MERCILON tabletti 150/20 mikrog
Vaikuttavat aineet ja niiden määrät
Jokainen tabletti sisältää 150 mikrogrammaa desogestreelia ja 20 mikrogrammaa etinyyliestradiolia.
Apuaine, jonka vaikutus tunnetaan: laktoosi < 80 mg
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Mercilon-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Mercilon-käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Annostus
Tabletteja otetaan yksi päivässä 21 perättäisen päivän ajan. Ennen uuden pakkauksen aloittamista pidetään tablettien ottamisessa 7 päivän tauko, jonka aikana tulee tyhjennysvuoto. Vuoto alkaa yleensä 2–3 päivän kuluttua viimeisen tabletin ottamisesta ja saattaa kestää seuraavan pakkauksen aloittamiseen saakka.
Pediatriset potilaat
Mercilon-valmisteen turvallisuutta ja tehoa alle 18-vuotiailla nuorilla ei ole tutkittu.
Antotapa
Suun kautta.
Miten Mercilon-tabletteja otetaan
Tabletit otetaan läpipainopakkaukseen merkityssä järjestyksessä joka päivä suunnilleen samaan aikaan, tarvittaessa pienen nestemäärän kera.
Mercilon-tablettien käytön aloittaminen
Ei edeltävää hormonaalista ehkäisyä [kuluneen kuukauden aikana]
Tablettien käyttö aloitetaan luonnollisen kuukautiskierron ensimmäisenä päivänä (ensimmäisenä vuotopäivänä). Tablettien käyttö voidaan aloittaa myös 2.–5. vuotopäivänä, mutta tällöin suositellaan lisäksi jonkin estemenetelmän käyttöä ensimmäisen kierron 7 ensimmäisen tablettipäivän ajan.
Vaihto Mercilon-valmisteeseen yhdistelmäehkäisyvalmisteesta (yhdistelmäehkäisytabletista, emätinrenkaasta tai ehkäisylaastarista)
Mercilon-tablettien käyttö aloitetaan mieluiten aiemman yhdistelmäehkäisyvalmisteen viimeisen vaikuttavaa ainetta sisältävän tabletin ottoa seuraavana päivänä, mutta viimeistään aiemman yhdistelmäehkäisyvalmisteen tavanomaista tablettitaukoa tai lumetablettijaksoa seuraavana päivänä. Jos on käytetty emätinrengasta tai ehkäisylaastaria, Mercilon-tablettien ottaminen tulee aloittaa mieluiten poistamispäivänä, mutta viimeistään silloin kun seuraava emätinrengas tai ehkäisylaastari olisi otettu käyttöön.
Mikäli nainen on käyttänyt aiempaa ehkäisymenetelmäänsä johdonmukaisesti ja oikein, ja on kohtuullisen varmaa, ettei hän ole raskaana, voi hän siirtyä käyttämään Mercilon-tabletteja myös syklin minä tahansa muuna päivänä.
Aiemman ehkäisymenetelmän hormoniton ajanjakso ei saa koskaan ylittää sen suositeltua pituutta.
Kaikkia ehkäisymenetelmiä (ehkäisylaastari, emätinrengas) ei ehkä ole markkinoilla kaikissa EU- maissa.
Vaihto Mercilon-valmisteeseen pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (minipilleri, injektio, implantaatti) tai progestiinia vapauttavasta kohdunsisäisestä ehkäisimestä (IUS)
Minipillereistä voidaan siirtyä käyttämään Mercilon-tabletteja koska tahansa, (implantaatista tai IUS:stä sen poistopäivänä ja injektiosta seuraavana suunniteltuna injektiopäivänä), mutta käyttäjää tulee kehottaa käyttämään lisäksi jotain estemenetelmää ensimmäisen kierron 7 ensimmäisen tablettipäivän ajan.
Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Tablettien käyttö voidaan aloittaa heti. Muita ehkäisymenetelmiä ei tällöin tarvita.
Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen Imetys, ks. kohta Raskaus ja imetys.
Tablettien käyttö aloitetaan 21–28 vuorokautta synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen. Jos tablettien käyttö aloitetaan myöhemmin, tulee ensimmäisen kierron 7 ensimmäisen tablettipäivän aikana käyttää lisäksi jotain estemenetelmää. Jos nainen on jo ollut yhdynnässä, raskaus on suljettava pois ennen yhdistelmäehkäisyvalmisteen käytön varsinaista aloittamista tai odotettava seuraavien kuukautisten alkamista.
Tablettien unohtaminen
Jos tabletin unohtamisesta on kulunut alle 12 tuntia, valmisteen ehkäisyteho ei ole heikentynyt. Unohtunut tabletti tulee ottaa heti muistettaessa ja seuraavat tabletit tavanomaiseen aikaan.
Jos tabletin unohtamisesta on kulunut yli 12 tuntia, valmisteen ehkäisyteho voi olla heikentynyt. Seuraavat kaksi perussääntöä pätevät tapauksissa, joissa tablettien ottaminen on unohtunut:
- Tablettien ottamista ei tule koskaan keskeyttää yli 7 päivän ajaksi
- Hypotalamus-aivolisäke-munasarja-akselin riittävä suppressio edellyttää tablettien ottamista yhtäjaksoisesti 7 päivän ajan.
Yllä olevan perusteella voidaan antaa seuraavat käytännön ohjeet:
Viikko 1
Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Lisäksi seuraavien 7 päivän ajan tulee käyttää jotain estemenetelmää, kuten kondomia. Jos nainen on ollut yhdynnässä tabletin unohtamista edeltävien 7 päivän aikana, raskauden mahdollisuus on otettava huomioon. Raskauden mahdollisuus on sitä suurempi mitä useampi tabletti on unohtunut ja mitä lähempänä säännöllistä tablettitaukoa unohtuneet tabletit ovat.
Viikko 2
Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Jos tabletteja on otettu säännöllisesti ohjeen mukaan 7 päivän ajan ennen ensimmäistä unohtunutta tablettia, lisäehkäisyä ei tarvita. Jos tabletteja ei ole otettu ohjeiden mukaan tai käyttäjä on unohtanut useampia tabletteja, häntä on neuvottava käyttämään lisäehkäisyä seuraavien 7 päivän ajan.
Viikko 3
Valmisteen ehkäisyteho on uhattuna, koska tablettitauko on lähellä. Ehkäisytehon heikkeneminen voidaan kuitenkin estää muuttamalla annostusta. Alla olevien ohjeiden mukaan toimimalla lisäehkäisyä ei tarvita, jos tabletteja on otettu säännöllisesti ohjeen mukaan 7 päivän ajan ennen ensimmäistä unohtunutta tablettia. Jos tabletteja ei ole otettu ohjeiden mukaan, käyttäjää on neuvottava toimimaan alla olevan ensimmäisen ohjeen mukaan ja käyttämään lisäksi jotain estemenetelmää seuraavien 7 päivän ajan.
- Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraava läpipainopakkaus aloitetaan heti, kun käytössä olevan pakkauksen tabletit loppuvat, niin että tablettien ottamisen väliin ei jää taukoa. Tyhjennysvuoto jää todennäköisesti tulematta ennen uuden pakkauksen loppumista, mutta tablettien käytön aikana voi esiintyä tiputtelu- tai läpäisyvuotoa.
- Tablettien ottaminen käytössä olleesta pakkauksesta voidaan myös lopettaa. Tällöin tulee pitää 7 päivän tablettitauko, mukaan lukien ne päivät, jolloin tabletit on unohdettu ottaa, ja sen jälkeen aloitetaan tablettien ottaminen uudesta läpipainopakkauksesta.
Jos nainen on unohtanut ottaa tabletteja eikä tyhjennysvuotoa tule ensimmäisen normaalin tablettitauon aikana, raskauden mahdollisuus on otettava huomioon.
Ohjeet ruuansulatuselimistön häiriöiden varalle
Jos esiintyy vakavia ruuansulatuselimistön häiriöitä, imeytyminen saattaa olla epätäydellistä ja lisäehkäisyä tarvitaan.
Jos oksentelua esiintyy 3–4 tunnin sisällä tabletin ottamisesta, sovelletaan tablettien unohtamista koskevia ohjeita (kohta Annostus ja antotapa). Jos nainen ei halua muuttaa tablettien normaalia käyttöaikatauluaan, hänen on otettava tarvittavat ylimääräiset tabletit toisesta läpipainopakkauksesta.
Kuukautisten alkamispäivän muuttaminen
Valmistetta ei ole tarkoitettu kuukautisten siirtämiseen. Jos näin kuitenkin poikkeustapauksessa halutaan tehdä, voidaan kuukautisia siirtää aloittamalla uusi Mercilon läpipainopakkaus heti edellisen loputtua ilman taukoa. Kuukautisia voidaan siirtää niin pitkälle kuin halutaan, kuitenkin enintään toisen pakkauksen loppumiseen saakka. Tänä aikana voi esiintyä läpäisy- tai tiputteluvuotoa. Mercilonin säännöllinen käyttö aloitetaan uudestaan tavanomaisen 7 päivän tablettitauon jälkeen.
Jos nainen haluaa muuttaa kuukautisten alkamispäivää nykyisestä joksikin toiseksi viikonpäiväksi, häntä voidaan neuvoa lyhentämään seuraavaa tablettitaukoa niin monella päivällä kuin hän haluaa. Mitä lyhyempi tauko sitä suurempi riski, että tyhjennysvuotoa ei tule ja että toisen pakkauksen käytön aikana esiintyy läpäisy- ja tiputteluvuotoa (kuten kuukautisia siirrettäessä).
Vasta-aiheet
Yhdistelmäehkäisyvalmisteita ei pidä käyttää seuraavien tilojen yhteydessä. Jos jokin näistä tiloista ilmenee ensimmäistä kertaa yhdistelmäehkäisyvalmisteen käytön aikana, valmisteen käyttö on lopetettava heti.
-
laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia - tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC-resistenssi, (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
valtimotromboembolia tai sen riski
- valtimotromboembolia - tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus - tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokystinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia.
- Nykyinen tai aiemmin ilmennyt haimatulehdus, jos siihen liittyy/liittyi vakava hypertriglyseridemia.
- Nykyinen tai aiemmin ilmennyt vaikea maksasairaus, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi.
- Nykyinen tai aiemmin ilmennyt hyvän- tai pahanlaatuinen maksakasvain.
- Todetut tai epäillyt maligniteetit, joihin sukupuolihormonit vaikuttavat (esim. sukupuolielinten tai rintojen maligniteetit).
- Kohdun limakalvon hyperplasia.
- Vaginaverenvuoto, jonka syytä ei ole selvitetty.
- Todettu tai epäilty raskaus.
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille. Mercilon on vasta-aiheinen käytettäessä samanaikaisesti ombitasviiri/paritapreviiri/ritonaviiri-yhdistelmää ja dasabuviiria sisältäviä lääkkeitä tai glekapreviiri/pibrentasviiri-yhdistelmää sisältäviä lääkkeitä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Varoitukset
Mercilon-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Mercilon-valmisteen käyttö keskeyttää.
1. Verenkiertohäiriöt
Laskimotromboembolian (VTE) riski
Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä, verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Mercilon-valmisteella. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Mercilon-valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
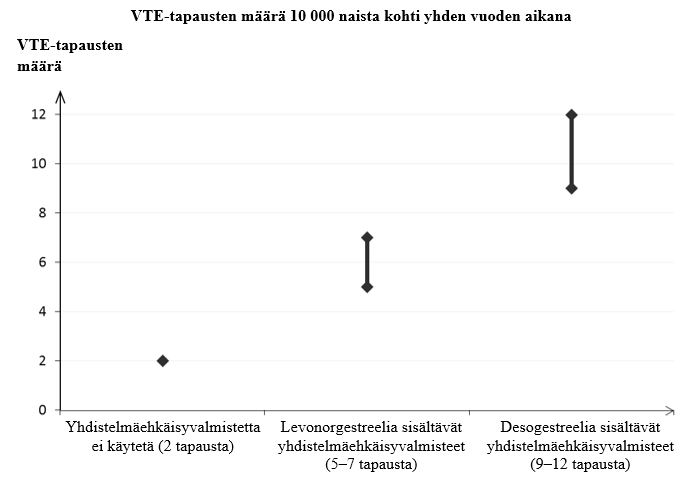
Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
Arviolta noin 9–12 naiselle1 10 000:sta, jotka käyttävät desogestreelia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana. Levonorgestreelia sisältävää yhdistelmäehkäisyvalmistetta käyttävillä naisilla vastaava luku on 62.
1Ilmaantuvuus arvioitiin kaikista epidemiologisista tutkimustuloksista vertaamalla eri valmisteiden suhteellisia riskejä levonorgestreelia sisältäviin yhdistelmäehkäisyvalmisteisiin.
2Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
Molemmissa tapauksissa VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Mercilon‑valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Mercilon‑valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkut näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Mercilon‑valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35‑vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, alle 50‑vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokystinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
- Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
2. Kasvaimet
- Epidemiologiset tutkimukset ovat osoittaneet, että pitkäaikainen yhdistelmäehkäisytablettien käyttö lisää kohdunkaulan syövän riskiä potilailla, joilla on ihmisen papilloomavirus (HPV) infektio. Kuitenkin on vielä epäselvää, missä määrin tähän havaintoon vaikuttavat sekoittavat tekijät (esim. erot sukupuolikumppanien määrissä tai estemenetelmien käytössä).
- Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytablettien tämänhetkisten käyttäjien suhteellinen rintasyöpäriski on hieman suurentunut (suhteellinen riskikerroin 1,24) ja että tämä suurentunut riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön loputtua. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, tällä hetkellä yhdistelmäehkäisytabletteja käyttävillä tai hiljattain niitä käyttäneillä havaittu rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän kokonaisriskiin. Nämä tutkimukset eivät anna näyttöä kausaliteetista. Havaittu riskin suureneminen voi johtua rintasyövän varhaisemmasta diagnoosista yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai molemmista. Lisäksi käyttäjillä diagnosoidut rintasyöpätapaukset ovat yleensä kliinisesti varhaisemmassa vaiheessa kuin ehkäisytabletteja käyttämättömillä diagnosoidut rintasyöpätapaukset.
- Yhdistelmäehkäisyvalmisteiden käyttäjillä on raportoitu harvoin hyvänlaatuisia ja vielä harvemmin pahanlaatuisia maksakasvaimia. Yksittäistapauksissa nämä kasvaimet ovat aiheuttaneet hengenvaarallisia vatsaontelon sisäisiä verenvuotoja. Erotusdiagnostisesti maksakasvaimen mahdollisuutta tulisi harkita, kun yhdistelmäehkäisyvalmisteiden käyttäjällä on voimakasta ylävatsakipua, suurentunut maksa tai merkkejä vatsaontelonsisäisestä verenvuodosta.
3. ALAT-arvon kohoaminen
- Kliinisissä tutkimuksissa, joissa käytettiin hepatiitti C -viruksen (HCV) hoitoon tarkoitettua yhdistelmää ombitasviiri/paritapreviiri/ritonaviiri ja dasabuviiria (ribaviriinin kanssa tai ilman), naisilla, jotka käyttivät etinyyliestradiolia sisältävää lääkitystä, kuten hormonaalisia yhdistelmäehkäisyvalmisteita, transaminaasiarvo (ALAT) kohosi merkittävästi useammin yli viisinkertaiseksi viitearvon ylärajasta (ULN). Myös glekapreviiri/pibrentasviiri-yhdistelmää saaneista potilaista naisilla, jotka käyttivät etinyyliestradiolia sisältävää lääkitystä, kuten hormonaalisia yhdistelmäehkäisyvalmisteita, todettiin ALAT-arvon kohoamista (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
4. Muut tilat
- Hypertriglyseridemia tai sen esiintyminen suvussa voi suurentaa haimatulehduksen riskiä yhdistelmäehkäisyvalmisteiden käyttäjillä.
- Eksogeeniset estrogeenit voivat aiheuttaa tai pahentaa perinnöllisen tai hankinnaisen angioedeeman oireita.
- Vähäistä verenpaineen kohoamista on raportoitu monilla yhdistelmäehkäisyvalmisteiden käyttäjillä, mutta kliinisesti merkittävä verenpaineen kohoaminen on harvinaista. Yhdistelmäehkäisyvalmisteen käytön ja kliinisen hypertension välistä yhteyttä ei ole vahvistettu. Jos verenpaine kuitenkin kohoaa kliinisesti merkittävästi yhdistelmäehkäisyvalmisteen käytön aikana, lääkärin tulisi keskeyttää valmisteen käyttö ja hoitaa hypertensiota. Valmisteen käyttöä voidaan jatkaa, jos verenpainelääkityksellä saadaan aikaan normotensio.
- Seuraavia sairaustiloja tai niiden pahenemista on raportoitu sekä raskauden että yhdistelmäehkäisyvalmisteen käytön yhteydessä, mutta niiden yhteydestä yhdistelmäehkäisyvalmisteen käyttöön ei ole vakuuttavaa näyttöä: kolestaasiin liittyvä keltaisuus ja/tai kutina, sappikivimuodostus, porfyria, SLE, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroosiin liittyvä kuulonalenema.
- Yhdistelmäehkäisyvalmisteen käytön keskeyttäminen saattaa olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksafunktioarvot ovat normalisoituneet. Yhdistelmäehkäisyvalmisteen käyttö on lopetettava, jos raskausaikana ensi kertaa ilmennyt tai aiempaan sukupuolihormonien käyttöön liittynyt kolestaattinen keltaisuus uusiutuu.
- Vaikka yhdistelmäehkäisyvalmisteet voivat vaikuttaa perifeeriseen insuliiniresistenssiin tai glukoosinsietoon, yhdistelmäehkäisyvalmisteita käyttävien naisten diabeteshoidon muuttamistarpeesta ei ole näyttöä. Yhdistelmäehkäisyvalmisteita käyttäviä diabeetikkoja tulee kuitenkin seurata huolellisesti.
- Crohnin tauti ja colitis ulcerosa on yhdistetty yhdistelmäehkäisyvalmisteen käyttöön.
- Maksaläiskiä voi joskus esiintyä, erityisesti jos niitä on esiintynyt raskausaikana. Maksaläiskiin taipuvaisten naisten tulisi välttää aurinkoa ja ultraviolettisäteilyaltistusta yhdistelmäehkäisyvalmisteiden käytön aikana.
- Yksi Mercilon-tabletti sisältää < 80 mg laktoosia. Potilaiden, joilla on harvinaisia perinnöllisiä ongelmia kuten galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasin puutos tai glukoosi-galaktoosin imeytymishäiriö ja jotka noudattavat laktoositonta ruokavaliota, tulee ottaa tämä määrä huomioon.
- Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Ehkäisymenetelmää valittaessa tulee kaikki yllämainittu ottaa huomioon
Lääkärintarkastus
Ennen Mercilon-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Mercilon-valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
Tehon heikkeneminen
Esim. tablettien unohtaminen (ks. kohta Annostus ja antotapa), ruuansulatuselimistön häiriöt (ks. kohta Annostus ja antotapa) tai samanaikainen lääkitys, joka laskee etinyyliestradiolin tai etonogestreelin, desogestreelin aktiivisen metaboliitin, pitoisuutta plasmassa (ks. kohta Yhteisvaikutukset) voivat heikentää Mercilon-valmisteen tehoa.
Mäkikuismaa (Hypericum perforatum) sisältäviä rohdosvalmisteita ei tulisi käyttää samanaikaisesti Mercilon-valmisteen kanssa, koska vaarana on vaikuttavien aineiden plasmapitoisuuksien laskeminen ja valmisteen ehkäisytehon huonontuminen (ks. kohta Yhteisvaikutukset ).
Syklikontrollin heikentyminen
Kaikki yhdistelmäehkäisyvalmisteet voivat aiheuttaa epäsäännöllisiä vuotoja (tiputtelu- tai läpäisyvuotoa) etenkin ensimmäisten käyttökuukausien aikana. Siksi epäsäännöllistä vuotoa kannattaa alkaa tutkia vasta noin kolme kiertoa kestävän sopeutumisvaiheen jälkeen.
Jos vuotohäiriöt jatkuvat tai niitä ilmaantuu kiertojen oltua aiemmin säännölliset, ei-hormonaaliset syyt on syytä ottaa huomioon. Asianmukaiset diagnostiset toimenpiteet (mahdollisesti kohdun kaavinta) ovat indisoituja maligniteetin tai raskauden poissulkemiseksi.
Joskus tablettitauon aikana ei tule tyhjennysvuotoa. Jos yhdistelmäehkäisyvalmistetta on käytetty kohdassa Annostus ja antotapa annettujen ohjeiden mukaan, nainen ei todennäköisesti ole raskaana. Jos valmistetta ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon ensimmäistä poisjääntiä, tai jos jo kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen yhdistelmäehkäisyvalmisteen käytön jatkamista.
Yhteisvaikutukset
Huom: Samanaikaisesti käytettävien lääkevalmisteiden valmisteyhteenvetoihin tulee tutustua mahdollisten yhteisvaikutusten selvittämiseksi.
Muiden lääkkeiden vaikutukset Mercilon-valmisteeseen
Yhteisvaikutuksia saattaa ilmetä mikrosomaalisia entsyymejä, erityisesti sytokromi P450-entsyymiä (CYP) indusoivien lääkkeiden tai kasvirohdosvalmisteiden kanssa, jotka voivat lisätä sukupuolihormonien puhdistumaa, mikä voi johtaa läpäisyvuotoihin ja/tai ehkäisytehon pettämiseen.
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymi-induktio ilmenee yleensä muutaman viikon kuluessa. Lääkehoidon lopettamisen jälkeen entsyymi-induktion vaikutus voi kestää noin neljän viikon ajan.
Lyhytaikainen hoito
Käytettäessä entsyymejä indusoivia lääkkeitä tai kasvirohdosvalmisteita naisen tulee väliaikaisesti käyttää Mercilon-valmisteen lisäksi jotakin estemenetelmää tai valita jokin muu ehkäisykeino. Estemenetelmää on käytettävä samanaikaisesti käytettävän lääkityksen ajan sekä lisäksi 28 päivää lääkityksen lopettamisen jälkeen.
Pitkäaikainen hoito
Käytettäessä pitkäkestoisesti maksan entsyymejä indusoivaa lääkitystä suositellaan muun luotettavan ei-hormonaalisen ja entsyymejä indusoimattoman ehkäisymenetelmän käyttöä.
Kirjallisuudessa on raportoitu seuraavia yhteisvaikutuksia:
Mercilon-valmisteen puhdistumaa lisäävät aineet (entsyymi-induktio), esim.:
fenytoiini, fenobarbitaali, primidoni, bosentaani, karbamatsepiini, rifampisiini, jotkut HIV-proteaasin estäjät (esim. ritonaviiri) ja ei-nukleosidirakenteiset käänteiskopioijaentsyymin estäjät (esim. efavirentsi, nevirapiini) sekä mahdollisesti myös okskarbatsepiini, topiramaatti, rifabutiini, felbamaatti, griseofulviini ja mäkikuismarohdosta sisältävät valmisteet.
Aineet, joilla on vaihtelevia vaikutuksia Mercilon-valmisteen puhdistumaan
Yhtäaikaisesti hormonaalisten ehkäisyvalmisteiden kanssa käytettynä monet HIV-proteaasin estäjiä (esim. nelfinaviiria) ja ei-nukleosidirakenteisia käänteiskopioijaentsyymin estäjiä (esim. nevirapiinia) sisältävät lääkeyhdistelmät ja/tai C-hepatiittiviruksen (HCV) hoitoon tarkoitetut yhdistelmät (esim. bosepreviiri, telapreviiri) voivat suurentaa tai pienentää progestiinien, mukaan lukien etonogestreelin, tai estrogeenin pitoisuutta plasmassa. Näiden muutosten kokonaisvaikutus voi joissakin tapauksissa olla kliinisesti merkittävä.
Tämän vuoksi samanaikaisen HIV/HCV-lääkityksen valmisteyhteenveto pitää tarkastaa potentiaalisten yhteisvaikutusten varalta ja niiden suhteen annettujen lisäohjeiden osalta. Naisen, joka käyttää proteaasin estäjää tai ei-nukleosidirakenteista käänteiskopioijaentsyymin estäjää, tulee lisäksi käyttää lisäehkäisynä jotain estemenetelmää, jos yhteisvaikutuksen mahdollisuutta epäillään.
Aineet, jotka vähentävät Mercilon-valmisteen puhdistumaa (entsyymi-inhibiittorit)
Entsyymi-inhibiittoreihin liittyvien mahdollisten interaktioiden kliininen merkitys on tuntematon.
Voimakkaiden CYP 3A4-entsyymi-inhibiittoreiden (esim. ketokonatsoli, itrakonatsoli, klaritromysiini) tai kohtalaisten CYP 3A4-entsyymi-inhibiittoreiden (esim. flukonatsoli, diltiatseemi, erytromysiini) yhtäaikainen käyttö voi nostaa estrogeenien tai progestiinien, mukaan lukien etonogestreelin, pitoisuutta plasmassa.
Etorikoksibin 60–120 mg päiväannoksen on havaittu nostavan etinyyliestradiolin plasmapitoisuutta 1,4–1,6-kertaiseksi käytettäessä samanaikaisesti yhdistelmäehkäisyvalmisteiden kanssa, jotka sisältävät 0,035 mg etinyyliestradiolia.
Mercilon-valmisteen vaikutus muihin lääkevalmisteisiin
Yhdistelmäehkäisytabletit saattavat muuttaa muiden lääkkeiden metaboliaa, jolloin niiden pitoisuus plasmassa ja kudoksessa voi joko nousta (esim. siklosporiini) tai laskea (esim. lamotrigiini).
Kliinisen tutkimustiedon perusteella etinyyliestradioli estää CYP1A2-substraattien puhdistumaa, joka johtaa heikkoon (mm. teofylliini) tai kohtalaiseen (mm. titsanidiini) nousuun näiden plasmapitoisuuksissa.
Farmakodynaamiset yhteisvaikutukset
Samanaikainen käyttö ombitasviiri/paritapreviiri/ritonaviiri-yhdistelmää ja dasabuviiria (ribaviriinin kanssa tai ilman) tai glekapreviiri/pibrentasviiri-yhdistelmää sisältävien lääkevalmisteiden kanssa saattaa lisätä ALAT-arvon kohoamisriskiä (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). Tästä syystä Mercilon-käyttäjien on vaihdettava muuhun ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään ehkäisyyn tai ei-hormonaalisiin menetelmiin) ennen tämän yhdistelmävalmisteen käytön aloittamista. Mercilon-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua tämän yhdistelmävalmisteen käytön lopettamisesta.
Laboratorioarvot
Steroidiehkäisyn käyttö voi vaikuttaa eräisiin laboratorioarvoihin, kuten maksan, kilpirauhasen, lisämunuaisen ja munuaisten toimintakokeiden biokemiallisiin parametreihin, (kantaja)proteiinien (esimerkiksi kortikosteroideja sitovan globuliinin ja lipidi/lipoproteiinifraktioiden) pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä normaalialueella.
Raskaus ja imetys
Raskaus
Mercilon-tabletteja ei ole tarkoitettu käytettäväksi raskauden aikana. Jos Mercilon-tabletteja käyttävä nainen tulee raskaaksi, tablettien käyttö on lopetettava. Useimpien epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski ei kuitenkaan ole suurentunut ennen raskautta yhdistelmäehkäisyvalmistetta käyttäneiden naisten lapsilla, kuten ei myöskään teratogeenisten vaikutusten riski silloin, kun yhdistelmäehkäisyvalmisteita on käytetty tahattomasti raskauden varhaisvaiheessa.
Kun Mercilon-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Yhdistelmäehkäisyvalmisteet voivat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi yhdistelmäehkäisyvalmisteita tulisi suosituksen mukaan yleensä käyttää vasta, kun lapsi on vieroitettu rintamaidosta. Pieniä määriä kontraseptiivisiä steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon, mutta tämän haitallisuudesta lapsen terveydelle ei ole näyttöä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Mercilon-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Tiettyjen haittavaikutusten kuvaus
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on raportoitu myös muita haittavaikutuksia. Näitä ovat esimerkiksi hypertensio, hormoniriippuvaiset kasvaimet (esim. maksakasvaimet, rintasyöpä), maksaläiskät. Näitä haittavaikutuksia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Kaikkien yhdistelmäehkäisyvalmisteiden käyttöön voi liittyä emätinverenvuodon muutoksia etenkin ensimmäisten käyttökuukausien aikana. Näitä voivat olla muutokset vuotofrekvenssissä (ei vuotoa, vuoto harvenee, tihenee tai on jatkuvaa), vuodon voimakkuudessa (vuoto vähenee tai lisääntyy) tai kestossa.
Mercilonin tai yleensä yhdistelmäehkäisyvalmisteiden käyttöön mahdollisesti liittyvät haittavaikutukset on esitetty alla olevassa taulukossa1. Haittavaikutukset on lueteltu elinjärjestelmän ja esiintymistiheyden mukaan luokiteltuina: yleinen (≥1/100), melko harvinainen (≥1/1000 ‑ <1/100), harvinainen (<1/1000) ja tuntematon (koska saatavilla oleva tieto ei riitä esiintyvyyden arviointiin.
Elinjärjestelmä | Yleinen | Melko harvinainen | Harvinainen | Tuntematon |
Immuunijärjestelmä | yliherkkyysreaktiot | perinnöllisen tai hankinnaisen angioedeeman oireiden paheneminen | ||
Aineenvaihdunta ja ravitsemus | nesteretentio | |||
Psyykkiset häiriöt | masennus, mielialanvaihtelut | libidon heikkeneminen | libidon voimistuminen | |
Hermosto | päänsärky | migreeni | ||
Silmät | piilolinssien huono sieto | |||
Verisuonisto | laskimotromboembolia, valtimotromboembolia | |||
Ruoansulatuselimistö | pahoinvointi, vatsakipu | oksentelu, ripuli | ||
Iho ja ihonalainen kudos | ihottuma, urtikaria | erythema nodosum, erythema multiforme | ||
Sukupuolielimet ja rinnat | rintojen kipu ja aristus | rintojen suureneminen | vuoto emättimestä ja rinnoista | |
Tutkimukset | painon nousu | painon lasku | ||
| 1Taulukossa on käytetty soveltuvinta haittavaikutusta kuvaavaa MeDRA-termiä. Synonyymejä ja oireeseen liittyviä tiloja ei ole lueteltu mutta ne tulee myös ottaa huomioon. | ||||
Yhteisvaikutukset
Läpäisyvuoto ja/tai ehkäisyn pettäminen saattavat johtua muiden lääkkeiden (entsyymi-indusorit) yhteisvaikutuksista hormonaalisten ehkäisyvalmisteiden kanssa (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen ei ole raportoitu aiheuttavan vakavia haittavaikutuksia. Mahdollisia yliannostusoireita ovat pahoinvointi, oksentelu ja nuorilla tytöillä vähäinen verenvuoto emättimestä. Antidoottia ei ole, ja jatkohoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet: ATC-koodi: G03AA09
Vaikutusmekanismi
Yhdistelmäehkäisyvalmisteiden ehkäisyteho perustuu monen eri tekijän yhteisvaikutukseen. Näistä tärkeimpiä ovat ovulaation estyminen ja kohdunkaulan liman koostumuksen muuttuminen. Raskauden ehkäisyn lisäksi yhdistelmäehkäisyvalmisteilla on useita myönteisiä vaikutuksia, joiden huomioon ottaminen negatiivisten vaikutusten (ks. Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) ohella voi olla hyödyllistä ehkäisymenetelmää valittaessa. Kuukautiskierto on säännöllisempi, kuukautisten yhteydessä on vähemmän kipuja ja vuoto on vähäisempää. Vuodon niukentuminen voi vähentää raudanpuutoksen esiintymistä. Tämän lisäksi suuriannoksisten yhdistelmäehkäisyvalmisteiden (50 mikrog etinyyliestradiolia) käytön yhteydessä on saatu näyttöä rintarauhasen fibrokystisten kasvainten, munasarjakystojen, sisäsynnytintulehduksen, kohdunulkoisen raskauden sekä kohdun limakalvosyövän- ja munasarjasyövän riskin pienenemisestä. Pieniannoksisten yhdistelmäehkäisyvalmisteiden osalta tämä on vielä vahvistamatta.
Pediatriset potilaat
Kliinisiä tietoja turvallisuudesta ja tehosta alle 18-vuotiailla nuorilla ei ole saatavilla.
Farmakokinetiikka
Desogestreeli
Imeytyminen
Oraalisen annoksen jälkeen desogestreeli imeytyy nopeasti ja täydellisesti ja muuttuu etonogestreeliksi. Huippupitoisuus seerumissa, n. 2 ng/ml, saavutetaan noin 1,5 tunnin kuluttua tabletin ottamisesta. Biologinen hyötyosuus on 62–81 %.
Jakautuminen
Etonogestreeli sitoutuu seerumin albumiiniin ja sukupuolihormoneja sitovaan globuliiniin (SHBG). Ainoastaan 2–4 % seerumin lääkepitoisuudesta on vapaina steroideina, 40–70 % on sitoutuneena SHBG:hen. Etinyyliestradiolin aiheuttama SHBG:n nousu vaikuttaa jakautumiseen proteiinisitoutumisessa. SHBG:hen sitoutunut osuus kasvaa ja albumiiniin sitoutunut osuus vähenee. Desogestreelin näennäinen jakautumistilavuus on 1,5 l/kg.
Biotransformaatio
Etonogestreeli metaboloituu täydellisesti tunnettuja steroidien metaboliareittejä noudattaen. Seerumin puhdistuma on noin 2 ml/min/kg. Interaktiota samanaikaisesti annostellun etinyyliestradiolin kanssa ei ole havaittu.
Eliminaatio
Etonogestreelin pitoisuus seerumissa pienenee kaksivaiheisesti. Loppuvaiheen puoliintumisaika on noin 30 h. Desogestreelista ja sen metaboliiteista 60 % erittyy virtsaan ja 40 % sappeen.
Vakaa tila
Etinyyliestradioli nostaa SHBG:n pitoisuuden 3-kertaiseksi, joka puolestaan vaikuttaa etonogestreelin farmakokinetiikkaan. Päivittäisessä käytössä lääkepitoisuus seerumissa nousee n. 2–3-kertaiseksi ja saavuttaa vakaan tilan syklin jälkipuoliskolla.
Etinyyliestradioli
Imeytyminen
Oraalisen annoksen jälkeen etinyyliestradioli imeytyy nopeasti ja täydellisesti. Huippupitoisuus seerumissa noin 45 pg/ml, saavutetaan 1–2 tunnissa. Absoluuttinen hyötyosuus on presysteemisen konjugaation ja alkureitin metabolian seurauksena noin 60 %.
Jakautuminen
Etinyyliestradioli sitoutuu enimmäkseen (n. 98,5 %:sti), mutta ei spesifisesti seerumin albumiiniin ja nostaa seerumin SHBG-pitoisuutta. Näennäinen jakautumistilavuus on noin 5 l/kg.
Biotransformaatio
Etinyyliestradiolin presysteeminen konjugaatio tapahtuu sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradioli metaboloituu pääasiassa aromaattisella hydroksylaatiolla, mutta aineenvaihduntatuotteina syntyy suuri määrä hydroksyloituja ja metyloituja metaboliitteja. Nämä ovat verenkierrossa vapaina tai konjugoituneena glukuronidiin tai sulfaattiin. Puhdistuma on noin 5 ml/min/kg.
In vitro, etinyyliestradioli on CYP2C19, CYP1A1 ja CYP1A2-entsyymien palautuva inhibiittori sekä CYP3A4/5, CYP2C8 ja CYP2J2-entsyymien mekanismiin perustuva inhibiittori.
Eliminaatio
Etinyyliestradiolin pitoisuus seerumissa pienenee kaksivaiheisesti ja loppuvaiheen puoliintumisaika on noin 24 h. Muuttumaton etinyyliestradioli ei erity, metaboliiteista 40 % erittyy virtsaan ja 60 % sappeen. Metaboliittien erittymisen puoliintumisaika on noin 1 vrk.
Vakaa tila
Vakaan tilan pitoisuus saavutetaan 3–4 päivässä, jolloin pitoisuus seerumissa on 30–40 % korkeampi kuin kerta-annoksen jälkeen.
Prekliiniset tiedot turvallisuudesta
Prekliinisissä tutkimuksissa ei ole tullut esille riskiä ihmisille, kun yhdistelmäehkäisyvalmisteita käytetään suositusten mukaisesti. Tämä perustuu tavanmukaisiin tutkimuksiin toistuvien annosten toksisuudesta, genotoksisuudesta, karsinogeenisyydestä ja yhdistelmäehkäisyvalmisteiden lisääntymistoksisuudesta. Sukupuolisteroidit voivat kuitenkin kiihdyttää eräiden hormoniriippuvaisten kudosten ja kasvainten kasvua.
Farmaseuttiset tiedot
Apuaineet
vedetön kolloidinen piidioksidi
laktoosimonohydraatti
perunatärkkelys
povidoni
steariinihappo
all-rac-alfa-tokoferoli.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 25 °C.
Herkkä valolle.
Herkkä kosteudelle.
Säilytä alkuperäispakkauksessa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
MERCILON tabletti
150/20 mikrog (L:kyllä) 3 x 21 fol (18,61 €), 6 x 21 fol (36,82 €)
PF-selosteen tieto
PVC / alumiiniläpipainoliuska, joka on pakattu alumiinilaminoituun pussiin. Jokainen läpipainopakkaus sisältää 21 tablettia. Pussit on pakattu painettuun pahvikoteloon yhdessä pakkausselosteen kanssa. Pakkauskoot ovat 1 x 21, 3 x 21, 6 x 21 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Tabletit ovat pyöreitä, kaksoiskuperia tabletteja, joiden halkaisija on 6 mm. Toisella puolella merkintä TR ja sen alapuolella 4, toisella Organon *.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
MERCILON tabletti
150/20 mikrog 3 x 21 fol, 6 x 21 fol
- Ei korvausta.
ATC-koodi
G03AA09
Valmisteyhteenvedon muuttamispäivämäärä
30.05.2022
Yhteystiedot
 Organon Finland Oy
Organon Finland Oy Puolikkotie 8, 5. krs
02230 Espoo
Suomi
029 170 3520
dpoc.finland@organon.com
