CERVARIX injektioneste, suspensio, esitäytetty ruisku
Vaikuttavat aineet ja niiden määrät
1 annos (0,5 ml) sisältää:
Ihmisen papilloomavirustyypin1 16 L1-proteiinia2,3,4 20 mikrogrammaa
Ihmisen papilloomavirustyypin1 18 L1-proteiinia2,3,4 20 mikrogrammaa
1Ihmisen papilloomavirus = HPV
2AS04-adjuvantti, joka sisältää
3-O-desasyyli-4’-monofosforyylilipidi A:ta (MPL)3 50 mikrogrammaa
3adsorboituna alumiinihydroksidiin, hydratoituun (Al(OH)3) tot. 0,5 milligrammaa Al3+
4L1-proteiini viruksen kaltaisina, ei infektioita aiheuttavina partikkeleina (virus-like particle, VLP), jotka on valmistettu rekombinantti-DNA-tekniikalla baculovirusekspressiosysteemissä, joka käyttää Trichoplusia ni:stä johdettuja Hi-5 Rix4446-soluja.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
Cervarix-rokote on tarkoitettu käytettäväksi 9 vuoden iästä alkaen ehkäisemään syöpää edeltäviä anogenitaalialueen (kohdunkaulan, vulvan, vaginan ja peräaukon) muutoksia ja kohdunkaulan syöpiä sekä peräaukon syöpiä, joiden aiheuttajina ovat tietyt syöpää aiheuttavat ihmisen papilloomavirus (HPV) tyypit. Lisää tärkeää informaatiota käyttöaihetta tukevista tiedoista, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka.
Cervarixia tulee käyttää mahdollisten virallisten suositusten mukaisesti.
Annostus ja antotapa
Annostus
Rokotusaikataulu riippuu rokotettavan iästä.
Ikä ensimmäistä rokotusta annettaessa | Immunisaatio ja aikataulu |
9−14 vuotiaat* | Kaksi erillistä 0,5 ml annosta. Toinen annos annetaan 5–13 kuukautta ensimmäisen annoksen jälkeen. |
15 vuotiaat ja sitä vanhemmat | Kolme erillistä 0,5 ml annosta kuukausina 0, 1, 6** |
* Jos toinen annos annetaan aikaisemmin kuin 5 kuukautta ensimmäisen annoksen jälkeen, kolmas annos tulee aina antaa.
** Jos rokotusaikatauluun tarvitaan joustovaraa, toinen annos voidaan antaa 1–2,5 kuukautta ensimmäisen annoksen jälkeen ja kolmas annos voidaan antaa 5–12 kuukautta ensimmäisen annoksen jälkeen.
Tehosteannoksen tarvetta ei ole osoitettu. (ks. kohta Farmakodynamiikka).
Rokotussarja suositellaan saatettavaksi loppuun Cervarixilla, jos ensimmäinen rokotus on annettu Cervarixilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat (alle 9-vuotiaat lapset)
Cervarixia ei suositella alle 9-vuotiaille lapsille, koska immunogeenisuudesta ja turvallisuudesta on rajoitetusti tietoa tässä ikäryhmässä.
Antotapa
Cervarix annetaan olka-hartialihakseen (ks. myös kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Cervarix-rokotetta ei saa missään tapauksessa antaa suonensisäisesti tai ihonsisäisesti. Tietoja Cervarixin antamisesta ihon alle ei ole saatavilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos Cervarix annetaan samanaikaisesti toisen injektoitavan rokotteen kanssa, on pistokset annettava eri pistoskohtiin (ks. kohta Yhteisvaikutukset).
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Harvinaisten rokotuksen antamista seuraavien anafylaktisten reaktioiden varalta tulee aina olla asianmukainen valmius hoitaa ja seurata potilasta, kuten kaikkia muitakin injisoitavia rokotteita annettaessa.
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Cervarix-rokotteen antamista on lykättävä, jos potilaalla on vaikea akuutti kuumetauti. Lievä infektio, kuten nuhakuume, ei ole immunisaation vasta-aihe.
Rokotetta ei saa missään tapauksessa antaa suonensisäisesti tai ihonsisäisesti. Tiedot Cervarixin antamisesta ihon alle puuttuvat.
Kuten muutkin lihaksensisäisesti annettavat rokotteet, Cervarix on annettava varoen henkilöille, joilla on trombosytopenia tai jokin hyytymishäiriö, sillä näillä henkilöillä lihaksensisäisestä annostuksesta voi seurata verenvuoto.
Kuten millä tahansa rokotteella suojaavaa vasta-ainetasoa ei ehkä saavuteta kaikilla rokotetuilla.
Cervarix suojaa vain HPV-alatyyppien 16 ja 18 aiheuttamilta taudeilta ja jossain määrin tiettyjen muiden syöpää aiheuttavien HPV-alatyyppien aiheuttamilta taudeilta (ks. kohta Farmakodynamiikka). Siksi sukupuoliteitse tarttuvilta taudeilta on edelleen suojauduttava asianmukaisesti.
Rokote on tarkoitettu vain ennaltaehkäisevään käyttöön. Cervarixilla ei ole vaikutusta aktiiviseen HPV-infektioon eikä olemassa olevaan kliiniseen tautiin. Rokotteella ei ole osoitettu olevan terapeuttista tehoa. Tästä syystä rokote ei ole tarkoitettu kohdunkaulan syövän hoitoon eikä kohdunkaulan intraepiteliaalisten neoplasioiden (CIN) hoitoon. Cervarix ei myöskään ole tarkoitettu muiden tunnettujen HPV:hen liittyvien muutosten eikä olemassa olevien, rokotteen alatyyppien tai niiden alatyyppien, joita ei ole rokotteessa, aiheuttamien HPV-infektioiden etenemisen estämiseen (ks. kohta Farmakodynamiikka ” Rokotteen teho HPV-16 ja HPV-18 -alatyyppejä vastaan naisilla, joilla oli HPV-16- tai HPV-18-tyypin aiheuttama infektio tutkimuksen alkaessa”).
Rokotus ei korvaa kohdunkaulan seulontatutkimuksia. Mikään rokote ei ole 100 % tehokas eikä Cervarix ei suojaa kaikilta HPV-alatyypeiltä eikä olemassa olevilta HPV-infektioilta. Tästä syystä kohdunkaulan seulontatutkimukset ovat edelleen ratkaisevan tärkeitä ja niiden osalta tulee noudattaa paikallisia suosituksia.
Suojan kestoa ei ole täysin selvitetty. Tehosteannoksen tai -annosten ajankohtaa ja tarvetta ei ole määritetty.
Saatavilla ei ole tietoja Cervarixin käytöstä immuunivasteeltaan heikentyneille henkilöille (esim. immunosuppressiivista hoitoa saaville potilaille), lukuun ottamatta HIV-tartunnan saaneita oireettomia potilaita, joiden immunogeenisuudesta on tietoa (ks. kohta Farmakodynamiikka). Kuten muillakaan rokotteilla, näillä henkilöillä ei ehkä saavuteta riittävää immuunivastetta.
Cervarixin vaihdettavuutta toisten HPV-rokotteiden kanssa ei ole tutkittu turvallisuuden, immunologisuuden tai tehon suhteen.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Kaikista kliinisistä tutkimuksista suljettiin pois henkilöt, jotka olivat saaneet immunoglobuliinia tai verivalmisteita kolmen kuukauden aikana ennen ensimmäistä rokotusta.
Käyttö muiden rokotteiden kanssa
Cervarix voidaan antaa samanaikaisesti kurkkumätä (d) -, jäykkäkouristus (T) - ja soluton hinkuyskä (ap) -tehosteyhdistelmärokotteen kanssa. Tehosteyhdistelmärokote voi myös sisältää inaktivoituja poliomyeliitti (IPV) -komponentteja (dTap ja dTap-IPV-rokotteet). Kummankaan rokotteen aikaansaamassa vasta-aineiden muodostuksessa ei havaittu kliinisesti merkittäviä vuorovaikutuksia.
Kun Cervarix rokotussarja annettiin kuukauden kuluttua dTap-IPV-yhdistelmärokotteen jälkeen, anti-HPV-16:n ja anti-HPV-18:n GMT-arvoissa oli havaittavissa suuntaus heikkenemiseen verrattuna tilanteisiin, joissa Cervarix annetaan yksin. Havainnon kliinistä merkitystä ei tiedetä.
Cervarix voidaan antaa samanaikaisesti myös meningokokki seroryhmien A, C, W-135, Y tetanustoksoidikonjugaattirokotteen (MenACWY-TT) kanssa; hepatiitti A (inaktivoitu) ja hepatiitti B (rDNA) yhdistelmärokotteen kanssa (Twinrix) tai hepatiitti B (rDNA) -rokotteen kanssa (Engerix-B). Cervarixin ja Twinrixin samanaikainen anto ei ole osoittanut mitään kliinisesti merkittävää vuorovaikutusta HPV ja hepatiitti A antigeenien vasta-ainemuodostuksessa. Anti-HBs:n vasta-aineen geometriset keskiarvopitoisuudet olivat merkittävästi matalammat, kun rokotteet annettiin samanaikaisesti. Havainnon kliininen merkitys on tuntematon, sillä suojan antavat vasta-ainetasot eivät muuttuneet. 98,3 % rokotetuista saavutti anti-HBs ≥ 10 mIU/ml vasta-ainetitterit, kun rokotteet annettiin samanaikaisesti. 100 % rokotetuista saavutti vastaavan arvon, kun Twinrixiä annettiin yksinään. Samanlaisia tuloksia havaittiin, kun Cervarix annettiin samanaikaisesti Engerix-B:n kanssa. Anti-HBs-arvot olivat ≥10 mIU/ml 97,9 %:lla koehenkilöistä verrattuna 100 %:iin, kun Engerix-B annettiin yksinään.
Jos Cervarix annetaan samanaikaisesti toisen injisoitavan rokotteen kanssa, rokotteet tulee aina antaa eri injektiokohtiin.
Käyttö hormonaalisten ehkäisyvalmisteiden kanssa
Kliinisissä tutkimuksissa noin 60 % Cervarixia saaneista naisista käytti hormonaalista ehkäisyvalmistetta. Hormonaalisten ehkäisyvalmisteiden vaikutuksista Cervarixin tehoon ei ole näyttöä.
Käyttö systeemisten immunosuppressiivisten lääkeaineiden kanssa
Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Raskaus ja imetys
Raskaus
Cervarixia ei ole erityisesti tutkittu raskaana olevilla naisilla. Raskaana olevista naisista sairaustietokannoista, epidemiologisista tutkimuksista ja kliinisten tutkimusten tahattomista altistustapauksista kerätyt tiedot eivät ole riittäviä johtopäästösten tekemiseen siitä vaikuttaako Cervarixilla rokottaminen raskauden epäsuotuisten lopputulosten riskiin mukaan lukien spontaanit keskenmenot.
Kliinisen tutkimusohjelman aikana on kuitenkin raportoitu kaikkiaan 10476 raskautta, joista 5387 ilmeni Cervarix-ryhmässä. Raskauden kulku oli molemmissa ryhmissä samanlainen. Esim. normaalien lapsien, epämuodostumien, ennenaikaisten synnytysten ja spontaanien aborttien määrässä ei ollut eroa.
Eläintutkimukset eivät viittaa suoriin tai epäsuoriin haittavaikutuksiin hedelmällisyyteen, raskauteen, alkion/sikiön kehitykseen, synnytykseen tai postnataalikehitykseen (ks kohta Prekliiniset tiedot turvallisuudesta).
Varotoimenpiteenä on parempi välttää Cervarixin käyttöä raskauden aikana. Raskaana olevia tai raskautta yrittäviä naisia neuvotaan lykkäämään tai keskeyttämään rokottautuminen kunnes raskaus on päättynyt.
Imetys
Kliinisissä tutkimuksissa ei ole selvitetty Cervarixin vaikutuksia imeväisiin antamalla rokotetta imettävälle äidille.
Cervarixia tulee käyttää imetyksen aikana vain tilanteissa, joissa mahdolliset hyödyt ovat suuremmat kuin mahdolliset riskit.
Hedelmällisyys
Tietoja vaikutuksesta hedelmällisyyteen ei ole saatavilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Cervarixin vaikutuksia ajokykyyn ja koneidenkäyttökykyyn ei ole tutkittu. Jotkut kohdassa Haittavaikutukset ”haittavaikutukset” mainitut vaikutukset voivat kuitenkin tilapäisesti vaikuttaa ajokykyyn tai koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuudesta
Kliinisissä tutkimuksissa Cervarixia on saanut 16142 naista ja kontrollia 13811 naista. Tutkimuksiin otettiin tyttöjä ja naisia, jotka olivat 10 - 72-vuotiaita (näistä 79,2 % oli 10 – 25-vuotiaita lähtötilanteessa). Henkilöitä seurattiin vakavien haittatapahtumien osalta koko tutkimuksen ajan. Ennalta laaditun suunnitelman mukaan osaa tutkittavista (Cervarix-ryhmä = 8130, kontrolli-ryhmä = 5786) seurattiin haittatapahtumien osalta 30 päivää jokaisen injektion jälkeen. Kahdessa kliinisessä tutkimuksessa, joihin otettiin 10–18-vuotiaita miehiä, 2617 miestä sai Cervarixia ja heitä seurattiin aktiivisella turvallisuusseurannalla.
Tavallisin haittavaikutus rokotuksen jälkeen oli injektiokohdan kipu, jota esiintyi 78 %:n frekvenssillä kaikkien annettujen annosten jälkeen. Valtaosa reaktioista oli lieviä tai keskivaikeita, eivätkä ne kestäneet kauan.
Haittavaikutustaulukko
Haittavaikutukset, joita tutkija piti mahdollisesti rokotukseen liittyvinä, on luokiteltu yleisyyden mukaan.
Esiintymistiheys raportoidaan seuraavasti:
Hyvin yleiset: (≥ 1/10)
Yleiset: (≥ 1/100 ja < 1/10)
Melko harvinaiset: (≥ 1/1000 ja < 1/100)
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Kliinisissä tutkimuksissa kerätty tieto | ||
Infektiot | Melko harvinainen | Ylähengitystieinfektiot |
Hermosto | Hyvin yleinen | Päänsärky |
Melko harvinainen | Huimaus | |
Ruoansulatuselimistö | Yleinen | Maha-suolikanavan oireet kuten pahoinvointi, oksentelu, ripuli ja vatsakipu |
Iho ja ihonalainen kudos | Yleinen | Kutina, ihottuma, urtikaria |
Luusto, lihakset ja sidekudos | Hyvin yleinen | Lihaskipu |
Yleinen | Nivelkipu | |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Kipua, punoitusta ja turvotusta pistoskohdassa, väsymys |
Yleinen | Kuume (≥38°C) | |
Melko harvinainen | Muut reaktiot injektiokohdassa kuten kovettuma, paikallinen tuntohäiriö | |
Markkinoille tulon jälkeen kerätty tieto | ||
Veri ja imukudos | Tuntematon * | Lymfadenopatia |
Immuunijärjestelmä | Tuntematon* | Allergiset reaktiot (anafylaktiset ja anafylaktoidiset reaktiot mukaan lukien), angioedeema. |
Hermosto | Tuntematon* | Pyörtyminen tai vasovagaalinen vaste injektiolle. Vasteeseen on joskus liittynyt toonis-kloonisia liikkeitä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
* Näitä tapahtumia on raportoitu spontaanisti, minkä vuoksi niiden frekvenssiä ei ole mahdollista arvioida luotettavasti
Kliinisissä tutkimuksissa turvallisuuslöydökset olivat samanlaisia aiemman tai ajankohtaisen HPV-infektion sairastaneilla kuin henkilöillä, jotka olivat negatiivisia kasvaimia aiheuttavalle HPV DNA:lle tai seronegatiivisia HPV-16- ja HPV-18-vasta-aineille.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Rokotteet, Papilloomavirusrokotteet. ATC-koodi J07BM02.
Vaikutusmekanismi
Cervarix ei itse aiheuta infektiota. Cervarix on rekombinanttirokote, joka sisältää adjuvanttia ja pitkälle puhdistettuja virustenkaltaisia partikkeleita (VLP). Partikkelit ovat peräisin onkogeenisten HPV-tyyppien 16 ja 18 L1-kapsidiproteiinista. Koska VLP-partikkelit eivät sisällä viruksen DNA:ta ne eivät voi infektoida soluja, lisääntyä eivätkä aiheuttaa sairautta. Eläintutkimukset ovat osoittaneet, että L1 VLP-rokotteiden teho perustuu niiden aikaansaamaan humoraaliseen immuunivasteeseen.
HPV-alatyypit 16 ja 18 aiheuttavat arviolta noin 70 % kohdunkaulan syövistä, 90 % peräaukon syövistä, 70 % HPV-tyyppeihin liittyvistä korkea-asteisista vulvan ja vaginan intraepiteliaalisista neoplasioista ja 78 % HPV-tyyppeihin liittyvistä korkea-asteisista peräaukon (AIN 2/3) intraepiteliaalisista neoplasioista. Muut syöpää aiheuttavat HPV-tyypit voivat myös aiheuttaa anogenitaali alueen syöpiä (noin 30 %). HPV-45, -31 ja -33 ovat kolme yleisintä HPV-tyyppiä, jotka eivät sisälly rokotteeseen, mutta joita tavataan levyepiteelikohdunkaulansyövässä (12,1 %) ja adenokarsinoomassa (8,5 %).
Kohdassa Käyttöaiheet mainittu termi ”syöpää edeltävä anogenitaalialueen muutos” tarkoittaa korkea-asteista kohdunkaulan intraepiteliaalista neoplasiaa (CIN 2/3), korkea-asteista vulvan intraepiteliaalista neoplasiaa (VIN2/3), korkea-asteista vaginan intraepiteliaalista neoplasiaa (VaIN2/3) ja korkea-asteista peräaukon intraepiteliaalista neoplasiaa (AIN 2/3).
Kliiniset tutkimukset
Kliininen teho 15 – 25-vuotiailla naisilla
Cervarixin teho on selvitetty kahdessa kontrolloidussa, kaksoissokkoutetussa, satunnaistetussa faasi II ja III kliinisessä tutkimuksessa. Tutkimuksiin osallistui 19778 iältään 15 - 25-vuotiasta naista.
Faasi II tutkimuksen (001/007) sisäänottokriteerit:
- onkogeenisten HPV-DNA löydösten piti olla negatiivisia (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 ja 68).
- seronegatiivisuus HPV-16 ja HPV-18 vasta-aineiden suhteen
- normaali sytologia
Ensisijainen tehoa mittaava päätetapahtuma oli HPV-16 ja/tai HPV-18 aiheuttama infektio. 12 kuukautta kestävä, jatkuva infektio oli toinen tehoa mittaava päätetapahtuma.
Faasi III tutkimuksessa (008) tutkittiin naisia ilman esiseulontaa. Naiset rokotettiin lähtötilanteen sytologiasta ja HPV- ja DNA-statuksesta riippumatta, eli HPV-infektion läsnäolo ei ollut poissulkukriteeri.
Ensisijainen tehoa mittaava päätetapahtuma oli CIN 2+, jonka taustalla oli HPV-16 ja/tai HPV-18 (HPV-16/18). Kohdunkaulan 2. ja 3. asteen intraepiteliaalinen neoplasia (CIN 2/3) ja kohdunkaulan adenokarsinooma in situ (AIS) olivat kliinisissä tutkimuksissa kohdunkaulansyövän sijaismuuttujina. Toissijainen päätetapahtuma oli 6 kuukautta ja 12 kuukautta kestävä, jatkuva infektio.
Vähintään 6 kuukautta kestävän jatkuvan infektion on myös osoitettu olevan asianmukainen kohdunkaulansyövän sijaismuuttuja 15–25-vuotiailla naisilla.
Ennaltaehkäisevä teho HPV-16 ja HPV-18-infektiota vastaan henkilöillä, jotka eivät olleet altistuneet onkogeenisille HPV-tyypeille.
Tutkimuksessa 001 naiset (N=1113) rokotettiin ja teho tutkittiin aina 27. kuukauteen asti. Jatkoseuranta oli tutkimuksessa 007 osalla rokotetuista (N=776) aina 6,4 vuoteen asti (noin 77 kuukauteen asti) ensimmäisestä annoksesta (seuranta-ajan keskiarvo oli 5,9 vuotta) Tutkimuksessa 001 oli viisi 12 kuukautta kestävää, jatkuvaa HPV-16/18-infektiota (4 HPV-16; 1 HPV-18) kontrolliryhmässä ja yksi HPV-16-tapahtuma rokoteryhmässä. Tutkimuksessa 007 Cervarixin teho 12 kuukautta kestävää, jatkuvaa HPV-16/18-infektiota vastaan oli 100 % (95 % CI: 80,5; 100). Kontrolliryhmässä oli kuusitoista pitkäaikaista HPV-16-infektiota ja viisi pitkäaikaista HPV-18-infektiota.
Tutkimuksessa HPV-023 tutkimuksen 001/007 brasilialaisen kohortin tutkittavia (N=437) seurattiin ensimmäisestä annoksesta. Seuranta-ajan keskiarvo oli 8,9 vuotta (keskihajonta 0,4 vuotta). HPV-023-tutkimuksen lopussa rokoteryhmässä ei ollut yhtään HPV-16/18:n aiheuttamaa infektiotapausta tai histopatologista leesiota. Kontrolliryhmässä oli neljä 6 kuukautta kestävää, jatkuvaa infektiota ja yksi 12 kuukautta kestävä, jatkuva infektio. Tutkimusta ei ollut suunniteltu siten, että voima riittää osoittamaan eroa rokote- ja kontrolliryhmien välillä näiden päätetapahtumien suhteen.
Ennaltaehkäisevä teho HPV-tyyppejä 16/18 vastaan naisilla, jotka eivät olleet altistuneet HPV-16 ja/tai HPV-18 tyypeille.
Tutkimuksessa HPV-008 ensisijaiset analyysit tehokkuudesta suoritettiin According to Protocol (ATP) ‑kohortissa (ATP-ryhmään kuuluivat naiset, jotka olivat saaneet 3 rokoteannosta ja jotka olivat DNA-negatiivisia ja seronegatiivisia kuukautena 0 ja DNA-negatiivisia kuukautena 6 analysoitavana olevalle HPV-tyypille). Tämä ryhmä koostui naisista, joilla oli normaali sytologia tai lieväasteinen sytologinen muutos tutkimuksen alkaessa. Ainoastaan korkea-asteinen sytologinen muutos (0,5 % koko populaatiosta) oli poissulkukriteeri. Tapauksia alettiin laskea ATP-ryhmässä päivänä 1 kolmannen rokoteannoksen jälkeen.
Kaiken kaikkiaan 74 % tutkimukseen osallistuneista naisista oli sekä HPV-16- että HPV-18-negatiivisia (toisin sanoen DNA-negatiivisia ja seronegatiivisia tutkimuksen alkaessa).
HPV-008-tutkimuksessa on tehty kaksi analyysia: tapahtumiin pohjautuva analyysi suoritettiin, kun ATP-kohortissa oli kertynyt vähintään 36 CIN 2+ -tapausta, jonka taustalla oli HPV-16/18, ja tutkimuksen loppuanalyysi.
Rokotteen teho ensisijaista tehoa mittaavaa päätetapahtumaa CIN 2+:a vastaan tutkimuksen lopussa esitetään taulukossa 1. Cervarixin tehoa HPV-16- ja HPV-18-taustaisia CIN 3+ muutoksia vastaan arvioitiin lisäanalyysissä.
Taulukko 1: Rokotteen teho korkea-asteisiin HPV-16/18 -taustaisiin kohdunkaulan muutoksiin (ATP-ryhmä)
HPV-16/18 päätetapahtuma | ATP-kohortti(1) | ||
Tutkimuksen loppuanalyysi(3) | |||
Cervarix (N = 7338) | Kontrolli (N = 7305) | % Teho (95 % CI) | |
n(2) | n | ||
CIN 2+ | 5 | 97 | 94,9 % (87,7;98,4) |
CIN 3+ | 2 | 24 | 91,7 % (66,6;99,1) |
N = tutkimusryhmään osallistuneiden henkilöiden lukumäärä n = tapausten määrä (1) ATP-ryhmään kuuluivat naiset, jotka olivat saaneet 3 rokoteannosta ja jotka olivat DNA-negatiivisia ja seronegatiivisia kuukautena 0 ja DNA-negatiivisia kuukautena 6 analysoitavana olevalle HPV-tyypille (HPV-16 tai HPV-18) (2) Pitää sisällään neljä CIN 2+ -tapausta ja kaksi CIN 3+ -tapausta, joissa toinen syöpää aiheuttava HPV-tyyppi todettiin muutoksessa samanaikaisesti HPV-16- tai HPV-18-alatyypin kanssa. Nämä tapaukset suljettiin pois HPV-tyyppejä erottelevasta jatkotutkimuksesta (ks. taulukon alla oleva teksti). (3) seuranta-aika oli keskimäärin 40 kuukautta 3. annoksen jälkeen | |||
Tapahtumiin pohjautuvassa analyysissa teho oli 92,9 % (96,1 % CI: 79,9;98,3) CIN 2+ vastaan ja 80 % (96,1 % CI: 0,3;98,1) CIN 3+ vastaan. Lisäksi osoitettiin tilastollisesti merkitsevä rokotteen teho CIN 2+ -tapauksia vastaan, joiden taustalla oli joko HPV-16 tai HPV-18 yksinään.
Jatkotutkimuksissa potilaiden, joilla oli useamman HPV-tyypin aiheuttama muutos, HPV-tyypit identifioitiin polymeraasiketjureaktiolla (PCR) muutoksesta otetun näytteen lisäksi vähintään yhdestä niistä kahdesta sytologisesta näytteestä, jotka otettiin ennen tutkimusta. Näin erotettiin HPV-tyyppi tai -tyypit, jotka todennäköisesti aiheuttivat muutoksen (HPV-tyyppimääritys). Tästä post hoc -analyysistä jätettiin pois (rokoteryhmästä ja kontrolliryhmästä) ne tapaukset, joiden ei katsottu olevan kausaalisessa yhteydessä tutkimuksen aikana saatuihin HPV-16 tai HPV-18 infektioihin.
HPV-tyyppejä erottelevassa post hoc -analyysissä todettiin rokoteryhmässä olleen yksi CIN 2+ -tapaus ja kontrolliryhmässä 92 tapausta (teho 98,9 % (95 % CI: 93,8;100)). Tutkimuksen loppuanalyysissa rokoteryhmässä ei ollut yhtään CIN 3+ -tapausta, kun kontrolliryhmässä oli 22 tapausta (teho 100 % (95 % CI: 81,8;100)).
Tapahtumiin pohjautuvassa analyysissa rokotteen teho HPV-16/18 -taustaisia CIN 1-muutoksia vastaan ATP-ryhmässä oli 94,1 % (96,1 % CI: 83,4;98,5). Rokotteen teho HPV 16/18 -taustaisia CIN 1+ -muutoksia vastaan ATP-ryhmässä oli 91,7 % (96,1 % CI: 82,4;96,7). Tutkimuksen loppuanalyysissa rokotteen teho HPV-16/18-taustaisia CIN 1-muutoksia vastaan ATP-kohortissa oli 92,8 % (95 % CI: 87,1;96,4).
Tutkimuksen loppuanalyysissä oli rokoteryhmässä 2 ja kontrolliryhmän ATP-kohortissa 7 VIN2+- tai VaIN2+-tapausta, jotka liittyivät HPV-alatyyppeihin 16 tai 18. Tutkimuksen tilastollinen voima ei riittänyt osoittamaan eroa rokote- ja kontrolliryhmien välillä näissä päätetapahtumissa.
Rokotteen teho ATP-ryhmässä tutkimuksen lopussa HPV-16/18-taustaisia virologisia päätetapahtumia (6 kuukautta ja 12 kuukautta kestävä, jatkuva infektio) vastaan esitetään taulukossa 2.
Taulukko 2. Rokotteen teho HPV 16/18 -taustaisia virologisia päätetapahtumia vastaan (ATP-ryhmä)
HPV-16/18 päätetapahtuma | ATP-kohortti(1) | ||
Tutkimuksen loppuanalyysi(2) | |||
Cervarix (N = 7338) | Kontrolli (N = 7305) | % Teho (95% CI) | |
n/N | n/N | ||
6 kuukautta kestävä, jatkuva infektio | 35/7182 | 588/7137 | 94,3% (92,0;96,1) |
12 kuukautta kestävä, jatkuva infektio | 26/7082 | 354/7038 | 92,9% (89,4;95,4) |
N = tutkimusryhmään osallistuneiden henkilöiden lukumäärä n = tapausten määrä (1) ATP-ryhmään kuuluivat naiset, jotka olivat saaneet 3 rokoteannosta ja jotka olivat DNA-negatiivisia ja seronegatiivisia kuukautena 0 ja DNA-negatiivisia kuukautena 6 analysoitavana olevalle HPV-tyypille (HPV-16 tai HPV-18) (2) seuranta-aika oli keskimäärin 40 kuukautta 3. annoksen jälkeen | |||
Tapahtumiin pohjautuvassa analyysissa tehotulokset olivat 94,3 % (96,1 % CI: 91,5;96,3) 6 kuukautta kestävää, jatkuvaa infektiota vastaan ja 91,4 % (96,1 % CI: 89,4;95,4) 12 kuukautta kestävää, jatkuvaa infektiota vastaan.
Rokotteen teho HPV-16 ja HPV-18 -alatyyppejä vastaan naisilla, joilla oli HPV-16- tai HPV-18-tyypin aiheuttama infektio tutkimuksen alkaessa.
Rokote ei suojannut niiden HPV-tyyppien aiheuttamilta infektioilta, joissa henkilö oli HPV-DNA positiivinen lähtötilanteessa. Jos henkilö lähtötilanteessa oli HPV-positiivinen yhdelle rokotteen sisältämälle HPV-tyypille, niin rokote suojasi toisen rokotteeseen sisältyvän HPV-tyypin aiheuttamilta taudeilta.
Rokotteen teho HPV-16 ja HPV-18 -alatyyppejä vastaan naisilla, joilla oli tai ei ollut HPV-16 tai HPV-18 -alatyyppien aiheuttamaa aikaisempaa infektiota tai tautia.
Ryhmä joka sai rokotteen (Total Vaccinated Cohort = TVC) koostui kaikista niistä henkilöistä, jotka saivat vähintään yhden rokoteannoksen, lähtötilanteen HPV-DNA statuksesta, sytologiasta ja serostatuksesta riippumatta. Tähän ryhmään kuuluivat myös naiset, joilla oli tai ei ollut aktiivista tai aikaisempaa HPV-infektiota. TVC-ryhmän tapausten laskenta alkoi päivänä 1 ensimmäisestä rokotteesta.
TVC-ryhmässä rokotteen tehon oletettiin olevan heikompi, sillä tässä ryhmässä oli myös naisia, joilla jo oli infektioita/muutoksia. Näihin Cervarixilla ei odotettu olevan tehoa. TVC-ryhmä voi suunnilleen vastata 15–25-vuotiaiden naisten yleisväestöä.
Taulukossa 3 esitetään TVC-ryhmässä havainnoitu rokotteen teho korkea-asteisia HPV-16/18-taustaisia kohdunkaulan muutoksia vastaan tutkimuksen lopussa.
Taulukko 3. Rokotteen teho korkea-asteisia HPV-16/18-taustaisia kohdunkaulan muutoksia vastaan TVC-ryhmässä
HPV-16/18 päätetapahtuma | TVC(1) | ||
Tutkimuksen loppuanalyysi(2) | |||
Cervarix (N = 8694) | Kontrolli (N = 8708) | % Teho (95% CI) | |
n | n | ||
CIN 2+ | 90 | 228 | 60,7% (49,6;69,5) |
CIN 3+ | 51 | 94 | 45,7% (22,9;62,2) |
N = tutkimusryhmään osallistuneiden henkilöiden lukumäärä n = tapausten määrä (1) TVC-ryhmä koostui kaikista niistä rokotetuista henkilöistä, jotka saivat vähintään yhden rokoteannoksen, lähtötilanteen HPV-DNA-statuksesta, sytologiasta ja serostatuksesta riippumatta. Tämä ryhmä pitää sisällään naiset, joilla oli infektioita/muutoksia lähtötilanteessa. (2) seuranta-aika oli keskimäärin 44 kuukautta 1. annoksen jälkeen | |||
Rokotteen teho HPV 16/18 -taustaisia virologisia päätetapahtumia (6 kuukautta ja 12 kuukautta kestävä, jatkuva infektio) vastaan TVC-ryhmässä tutkimuksen lopussa esitetään taulukossa 4.
Taulukko 4. Rokotteen teho HPV 16/18-taustaisia virologisia päätetapahtumia vastaan (TVC-ryhmä)
HPV-16/18 päätetapahtuma | TVC(1) | ||
Tutkimuksen loppuanalyysi(2) | |||
Cervarix | Kontrolli | % Teho (95% CI) | |
n/N | n/N | ||
6 kuukautta kestävä, jatkuva infektio | 504/8863 | 1227/8870 | 60,9% (56,6;64,8) |
12 kuukautta kestävä, jatkuva infektio | 335/8648 | 767/8671 | 57,5% (51,7;62,8) |
N = tutkimusryhmään osallistuneiden henkilöiden lukumäärä n = tapausten määrä (1) TVC-ryhmä koostui kaikista niistä rokotetuista henkilöistä, jotka saivat vähintään yhden rokoteannoksen, lähtötilanteen HPV-DNA-statuksesta, sytologiasta ja serostatuksesta riippumatta. (2) seuranta-aika oli keskimäärin 44 kuukautta 1. annoksen jälkeen | |||
Rokotteen kokonaisvaikutus HPV-tautitaakkaan
Tutkimuksessa HPV-008 korkea-asteisten kohdunkaulan muutosten insidenssiä rokoteryhmän ja lumelääkeryhmän välillä verrattiin riippumatta muutoksen taustalla olevasta HPV-DNA-tyypistä. TVC-ryhmässä ja ilman HPV-altistusta olleessa TVC-alaryhmässä rokotteen teho osoitettiin korkea-asteisia kohdunkaulan muutoksia vastaan tutkimuksen lopussa (taulukko 5). Ilman altistusta olevaan TVC-alaryhmään kuuluivat naiset, joilla oli normaali sytologia tutkimuksen alkaessa, ja jotka olivat HPV-DNA-negatiivisia 14 syöpää aiheuttavalle HPV-tyypille sekä seronegatiivisia HPV-16:lle ja HPV-18:lle.
Taulukko 5. Rokotteen teho korkea-asteisiin kohdunkaulan muutoksiin muutoksessa olevasta HPV-DNA-tyypistä riippumatta
Tutkimuksen loppuanalyysi(3) | |||||
Cervarix | Kontrolli | % Teho (95% CI) | |||
N | Tapaukset | N | Tapaukset | ||
CIN 2+ | |||||
Ilman HPV-altistusta oleva TVC-alaryhmä(1) | 5466 | 61 | 5452 | 172 | 64,9% (52,7;74,2) |
TVC-ryhmä(2) | 8694 | 287 | 8708 | 428 | 33,1% (22,2;42,6) |
CIN 3+ | |||||
Ilman HPV-altistusta oleva TVC-alaryhmä(1) | 5466 | 3 | 5452 | 44 | 93,2% (78,9;98,7) |
TVC-ryhmä(2) | 8694 | 86 | 8708 | 158 | 45,6% (28,8;58,7) |
N = tutkimusryhmään osallistuneiden henkilöiden lukumäärä (1) Ilman HPV-altistusta oleva TVC-alaryhmä koostui kaikista niistä rokotetuista henkilöistä, jotka saivat vähintään yhden annoksen rokotetta ja joilla lähtötilanteessa oli normaali sytologia ja jotka olivat HPV-DNA-negatiivisia 14 syöpää aiheuttavalle HPV-tyypille ja seronegatiivisia HPV-16:n ja HPV-18:n suhteen. (2) TVC-ryhmä koostui kaikista niistä rokotetuista henkilöistä, jotka saivat vähintään yhden rokoteannoksen, lähtötilanteen HPV-DNA-statuksesta, sytologiasta ja serostatuksesta riippumatta. (3) seuranta-aika oli keskimäärin 44 kuukautta 1. annoksen jälkeen | |||||
Tutkimuksen loppuanalyysissa Cervarix vähensi lopullisia kohdunkaulan hoitoja (mukaan lukien sähkösilmukkahoito (LEEP), veitsikonisaatio ja laserhoidot) 70,2 %:lla (95 % CI: 57,8;79,3) ilman HPV-altistusta olevassa TVC-alaryhmässä ja 33,2 % (95 % CI: 20,8;43,7) TVC-ryhmässä.
Ristisuojateho
HPV-008-tutkimuksessa on tutkittu Cervarixin ristisuojatehoa histopatalogisiin ja virologisiin päätetapahtumiin (jatkuva infektio) 12 syöpää aiheuttavalle HPV-tyypille, joita rokote ei sisällä. Tutkimuksessa ei pystytty määrittämään rokotteen tehoa yksittäisten HPV-tyyppien aiheuttamaa tautia vastaan. Useat rinnakkaiset infektiot CIN2+-leesioissa sekoittivat ensisijaisten päätetapahtumien analyyseja. Useat samanaikaiset infektiot häiritsevät virologisia päätetapahtumia vähemmän kuin histopatologisia päätetapahtumia.
HPV-31, HPV-33 ja HPV-45 -tyyppien kohdalla osoitettiin yhdenmukainen ristisuojateho 6 kuukautta kestäviin, jatkuviin infektioihin ja CIN 2+ -päätetapahtumissa kaikissa tutkimusryhmissä.
Tutkimuksen lopussa rokotteen teho 6 kuukautta kestävää jatkuvaa infektiota ja CIN 2+ -muutoksia vastaan, kun taustalla oli yksi tai useampi syöpää aiheuttava HPV-tyyppi, joita ei ole rokotteessa, esitetään taulukossa 6 (ATP-ryhmä).
Taulukko 6: Rokotteen teho rokotteeseen kuulumattomia syöpää aiheuttavia HPV-tyyppejä vastaan
ATP(1) | |||||||
HPV-tyyppi | 6 kuukautta kestävä, jatkuva infektio | CIN 2+ | |||||
Cervarix | Kontrolli | % Teho (95% CI) | Cervarix | Kontrolli | % Teho (95% CI) | ||
n | n | n | n | ||||
HPV-16-taustaiset tyypit (A9-kannat) | |||||||
HPV-31 | 58 | 247 | 76,8% (69,0;82,9) | 5 | 40 | 87,5% (68,3;96,1) | |
HPV-33 | 65 | 117 | 44,8% (24,6;59,9) | 13 | 41 | 68,3% (39,7;84,4) | |
HPV-35 | 67 | 56 | -19,8% (<0,0;17,2) | 3 | 8 | 62,5% (<0,0;93,6) | |
HPV-52 | 346 | 374 | 8,3% (<0,0;21,0) | 24 | 33 | 27,6% (<0,0;59,1) | |
HPV-58 | 144 | 122 | -18,3% (<0,0;7,7) | 15 | 21 | 28,5% (<0,0;65,7) | |
HPV-18-taustaiset tyypit (A7-kannat) | |||||||
HPV-39 | 175 | 184 | 4,8% (<0,0;23,1) | 4 | 16 | 74,9% (22,3;93,9) | |
HPV-45 | 24 | 90 | 73,6% (58,1;83,9) | 2 | 11 | 81,9% (17,0;98,1) | |
HPV-59 | 73 | 68 | -7,5% (<0,0;23,8) | 1 | 5 | 80,0% (<0,0;99,6) | |
HPV-68 | 165 | 169 | 2,6% (<0,0;21,9) | 11 | 15 | 26,8% (<0,0;69,6) | |
Muut tyypit | |||||||
HPV-51 | 349 | 416 | 16,6% (3,6;27,9) | 21 | 46 | 54,4% (22,0;74,2) | |
HPV-56 | 226 | 215 | -5,3% (<0,0;13,1) | 7 | 13 | 46,1% (<0,0;81,8) | |
HPV-66 | 211 | 215 | 2,3% (<0,0;19,6) | 7 | 16 | 56,4% (<0,0;84,8) | |
n= tapausten määrä (1) ATP-ryhmään kuuluivat naiset, jotka olivat saaneet 3 rokoteannosta ja jotka olivat DNA-negatiivisia kuukautena 0 ja kuukautena 6 analysoitavana olevalle HPV-tyypille. Rokotteen tehoon liittyvän luottamusvälin rajat selvitettiin. Kun arvo 0 sisältyy luottamusväliin, ja CI:n alaraja on <0, tehoa ei pidetä tilastollisesti merkitsevänä. Teho CIN 3:a vastaan osoitettiin vain, kun taustalla oli HPV-31 eikä näyttöä suojasta AIS:ia vastaan ollut millekään HPV-tyypille. | |||||||
Kliininen teho 26-vuotiailla ja vanhemmilla naisilla
Cervarixin tehoa arvioitiin kaksoissokkoutetussa, satunnaistetussa faasi III:n kliinisessä tutkimuksessa (HPV-015), johon osallistui yhteensä 5778 naista, jotka olivat iältään 26–72-vuotiaita (mediaani: 37,0 vuotta). Tutkimus suoritettiin Pohjois-Amerikassa, Latinalaisessa Amerikassa, Aasian ja Tyynenmeren alueella ja Euroopassa. Lopullinen analyysi suoritettiin tutkimuksen päätyttytä, seitsemän vuotta ensimmäisen rokotuksen jälkeen.
Ensisijainen päätetapahtuma oli virologisen ja histopatologisen päätetapahtuman yhdistelmä: HPV-16/18:aan liittyvä kuusi kuukautta kestävä jatkuva infektio ja/tai CIN1+. Ensisijaiset tehoanalyysit suoritettiin ATP-tehotutkimusalaryhmässä sekä TVC-ryhmässä, johon kuului 15 %:n osajoukko naisia, joilla oli ollut aiempi HPV:hen liittyvä infektio tai tauti (määritelmänä poikkeama kahdessa tai useammassa peräkkäisessä irtosolukokeessa, poikkeama kolposkopiassa tai koepalassa, tai kohdunkaulan hoitotoimenpide poikkeavan irtosolunäytteen tai kolposkopian jälkeen). Tämän osajoukon sisällyttäminen tutkimukseen mahdollisti profylaktisen tehon arvioinnin sellaisessa populaatiossa, jonka katsotaan kuvastavan todellista potilasjoukkoa, sillä kohdunkaulan seulontatutkimukset tyypillisesti kohdennetaan aikuisten naisten ikäryhmään.
Yhteenveto rokotteen tehosta tutkimuksen perusteella on tiivistetty alla olevaan taulukkoon.
Tutkimuksessa ei saatu näyttöä siitä, että vähintään kuusi kuukautta kestäneen jatkuvan infektion ehkäisy olisi merkittävä sijaismarkkeri kohdunkaulan syövän ehkäisyssä 26-vuotiailla ja sitä vanhemmilla naisilla.
Taulukko 7: Rokotteen teho HPV-015-tutkimuksen loppupäätelmissä
Päätetepahtuma | ATP(1) | TVC(2) | ||||
Cervarix | Kontrolli | % Teho (96,2% CI) | Cervarix | Kontrolli | % Teho (96,2% CI) | |
n/N | n/N | n/N | n/N | |||
HPV-16/18 | ||||||
6 kk kestävä jatkuva infektio ja/tai CIN1+ | 7/1852 | 71/1818 | 90,5% (78,6; 96,5) | 93/2768 | 209/2778 | 56,8% (43,8; 67,0) |
6 kk kestävä jatkuva infektio | 6/1815 | 67/1786 | 91,4% (79,4; 97,1) | 74/2762 | 180/2775 | 60% (46,4; 70,4) |
CIN2+ | 1/1852 | 6/1818 | 83,7% (<0,0; 99,7) | 33/2733 | 51/2735 | 35,8% (<0,0; 61,0) |
ASC-US+ | 3/1852 | 47/1818 | 93,8% (79,9; 98,9) | 38/2727 | 114/2732 | 67,3% (51,4; 78,5) |
6 kk kestävä jatkuva infektio ainoastaan lähtötilanteessa seropositiivisilla koehenkilöillä | 3/851 | 13/837 | 78% (15,0; 96,4) | 42/1211 | 65/1192 | 38,7% (6,3; 60,4) |
Ristisuojateho | ||||||
HPV-31 6 kk kestävä jatkuva infektio | 10/2073 | 29/2090 | 65,8% (24,9; 85,8) | 51/2762 | 71/2775 | 29% (<0,0; 52,5) |
HPV-45 6 kk kestävä jatkuva infektio | 9/2106 | 30/2088 | 70,7% (34,2; 88,4) | 22/2762 | 60/2775 | 63,9% (38,6; 79,6) |
HPV-31 ASC-US+ | 5/2117 | 23/2127 | 78,4% (39,1; 94,1) | 34/2727 | 55/2732 | 38,7% (2,0; 62,3) |
HPV-45 ASC-US+ | 5/2150 | 23/2125 | 78,7% (40,1; 94,1) | 13/2727 | 38/2732 | 66,1% (32,7; 84,1) |
N = tutkimusryhmään osallistuneiden koehenkilöiden lukumäärä n = tutkittavien, joilla raportoitiin vähintään yksi tapahtuma, lukumäärä tutkimusryhmässä CI = luottamusväli ASC-US = atyyppisiä soluja, joiden merkitys on epäselvä (epänormaali sytologia) (1) 3 rokoteannosta, DNA-negatiivisia ja seronegatiivisia aikapisteessä 0 kk ja DNA-negatiivisia 6 kuukauden kohdalla merkittävien HPV-tyyppien suhteen (HPV-16 ja/tai HPV-18) (2) vähintään yksi rokoteannos, riippumatta HPV-DNA- ja serostatuksesta aikapisteessä 0 kk. Sisältää 15 % tutkittavia, joilla oli aikaisemmin ollut HPV-tauti/infektio | ||||||
Teho ≥ASC-US (epänormaali sytologia) -muutoksia vastaan, kun taustalla oli syöpää aiheuttava tyyppi, jota ei ole rokotteessa, oli 37,2 % (96,2 % CI [21,3; 50,1]) (ATP).
Teho CIN1+-muutoksia vastaan oli 22,9% (96,2% CI [4,8; 37,7]) riippumatta siitä, mikä HPV-tyyppi muutoksesta löydettiin (TVC).
Tutkimuksessa ei saatu näyttöä suojasta HPV:n aiheuttamia tauteja vastaan 25-vuotiailla ja sitä vanhemmilla koehenkilöillä, jotka tutkimuksen alussa olivat DNA-positiivisia ja/tai joilla oli havaittu epänormaalia sytologiaa.
Immunogeenisuus
Immuunivaste Cervarixille perusrokotussarjan jälkeen
HPV-rokotteilla ei ole havaittu alinta vasta-ainetasoa, jotka olisi yhteydessä HPV-16/18-taustaisten 2. ja 3. asteen CIN muutosten tai pitkäaikaisen infektion ennaltaehkäisyyn.
Vasta-aineet HPV-tyyppejä 16 ja 18 vastaan mitattiin tyyppi-spesifisellä suoralla ELISA-menetelmällä (versio 2, MedImmune methodology, GSK:n modifioima), jonka on osoitettu korreloivan pseudoviruspartikkeliin perustuvaan neutralisaatiomenetelmään (PBNA).
Cervarixin kolmen annoksen aikaansaama immunogeenisuus on arvioitu 5465 naisella, joiden ikä oli 9–55 vuotta ja yli 800 miehellä, joiden ikä oli 10-18 vuotta.
Kliinisissä tutkimuksissa alun perin seronegatiivisistä henkilöistä yli 99 % oli muuttunut HPV-16 ja HPV-18 positiivisiksi yhden kuukauden kuluessa kolmannesta annoksesta. Rokotteen indusoimien IgG-tittereiden geometriset keskiarvot (Geometric Mean Titers, GMT) olivat selvästi yli luonnollisesta HPV-infektiosta parantuneiden naisten arvojen. Rokotusta edeltävästi seropositiiviset ja seronegatiiviset henkilöt saavuttivat samanlaiset titterit rokotuksen jälkeen.
Immuunivasteen säilyminen Cervarixille
Tutkimuksessa 001/007 immuunivastetta HPV-tyyppejä 16 ja 18 vastaan seurattiin 76 kuukauden ajan ensimmäisestä annoksesta naisilla, joiden ikä rokotushetkellä oli 15 − 25 vuotta. Tutkimuksessa 023 (joka oli tutkimuksen 001/007 osatutkimus) immuunivastetta seurattiin 113 kuukautta. Rokotetta saaneessa ryhmässä 92 koehenkilöltä saatiin immunogeenisuustietoja 107 – 113 kuukauden aikana ensimmäisestä rokoteannoksesta ja seuranta-ajan mediaani oli 8,9 vuotta. Näistä henkilöistä 100 % (95 % CI: 96,1;100) oli HPV-16 ja HPV-18 seropositiivisia ELISA-määrityksessä.
Rokotteen aikaansaamien IgG-tittereiden GMT-arvot sekä HPV-16 että HPV-18 tyyppiä vastaan olivat korkeimmillaan 7. kuukauden kohdalla. Tämän jälkeen arvot laskivat kunnes 18. kuukauden kohdalla saavutettiin taso, josta arvot eivät 107 – 113 kuukauden seuranta-aikana enää laskeneet. Seurannan lopussa sekä HPV-16 että HPV-18 GMT-arvot (ELISA) olivat vielä vähintään 10 kertaa korkeammat kuin GMT-arvot (ELISA) naisilla, jotka aikaisemmin ovat sairastaneet HPV-infektion mutta toipuneet siitä (luonnollinen infektio).
Tutkimuksessa 008 immunogeenisuus oli 48 kuukauden ajan samanlainen kuin tutkimuksessa 001. Neutraloivien vasta-aineiden kinetiikka oli samanlainen.
Toisessa kliinisessä tutkimuksessa (tutkimus 014), joka suoritettiin 15–55-vuotiailla naisilla, kaikilla rokotetuilla saavutettiin seropositiivisuus HPV-tyyppejä 16 ja 18 vastaan kolmannen annoksen jälkeen (7. kuukaudella). GMT-arvot olivat kuitenkin matalammat yli 25-vuotiailla naisilla. Jatkotutkimuksessa HPV-060 seurattiin 10 vuoden ajan 470 koehenkilöä (142 15–25-vuotiasta, 172 26–45-vuotiasta ja 156 46–55-vuotiasta), jotka olivat osallistuneet myös HPV-014 tutkimukseen ja saaneet kolmen annoksen perusrokotussarjan. Kymmenen vuoden kuluttua ensimmäisestä annoksesta 100 % koehenkilöistä 15–25-vuotiaiden ryhmässä, 99,2 % 26–45-vuotiaiden ryhmässä ja 96,3 % 46–55-vuotiaiden ryhmästä olivat edelleen seropositiivisia HPV-16:lle. Vastaavasti HPV-18:lle seropositiivisia oli 99,2 % (15–25-vuotiaat), 93,7 % (26–45-vuotiaat) ja 83,8 % (46–55-vuotiaat) koehenkilöistä. Kaikissa ikäryhmissä koehenkilöiden GMT-arvot pysyivät vähintään 5–32-kertaisina HPV-16:lle ja 3–14-kertaisina HPV-18:lle verrattuna luonnollisesta infektiosta parantuneiden naisten GMT-arvoihin (molempien antigeenien osalta).
Todisteet anamnestisesta vasteesta (immunologinen muisti)
Tutkimuksessa 024 (tutkimuksen 001/007 alatutkimus) Cervarixin altistusannos annettiin 65 koehenkilölle keskimäärin 6,8 vuoden kuluttua ensimmäisestä annoksesta. Viikon kuluttua altistusannoksen antamisesta havaittiin anamnestinen immunologinen vaste HPV-16:lle ja kuukauden kuluttua HPV-18:lle (ELISA). Kuukauden kuluttua altistusannoksesta GMT-arvot ylittivät ne arvot, joita havaitaan yhden kuukauden kuluttua 3 annoksen perusrokotussarjasta.
Tehotietojen soveltaminen nuorista aikuisista naisista kasvuikäisiin nuoriin
Yhdistetyssä analyysissä (HPV-029, -30 ja -48) 99,7 % 9-vuotiaista tytöistä saavutti serokonversion HPV-tyypille 16 ja 100 % HPV-tyypille 18 kolmannen annoksen jälkeen (7. kuukauden kohdalla). GMT-arvot olivat vähintään 1,4-kertaisia verrattuna arvoihin 10–14-vuotiailla ja 2,4-kertaisia verrattuna 15–25-vuotiaiden arvoihin.
Kahdessa kliinisessä tutkimuksessa (HPV-012 ja -013), jotka suoritettiin 10 – 14-vuotiailla tytöillä, kaikki rokotetut saavuttivat seropositiivisisuuden HPV-tyypeille 16 ja 18 kolmannen annoksen jälkeen (7. kuukauden kohdalla). GMT-arvot olivat vähintään kaksinkertaiset 15 – 25-vuotiaisiin naisiin verrattuna.
Kliinisissä tutkimuksissa (HPV-070 ja HPV-048), joissa 9−14-vuotiaat tytöt saivat rokotteen kahden annoksen aikataulun mukaan (kuukausina 0 ja 6 tai 0 ja 12) ja 15−25-vuotiaat nuoret naiset saivat Cervarixia normaalin kolmen annoksen aikataulun mukaan (kuukausina 0, 1 ja 6), kaikki tutkittavat olivat saavuttaneet serokonversion molempien HPV-tyyppien 16 ja 18 suhteen kuukauden kuluttua toisen annoksen saamisesta. 9−14-vuotiaiden tyttöjen immuunivaste kahden annoksen jälkeen oli samanarvoinen (non-inferior) kuin 15−25-vuotiaiden naisten vaste kolmen annoksen jälkeen.
Näihin immunogeenisuustietoihin perustuen voidaan päätellä, että Cervarix tehoaa 9–14-vuotiailla.
Immuunivasteen kesto 26-vuotiailla ja vanhemmilla naisilla
26-vuotiailla ja vanhemmilla naisilla tehdyssä faasi III:n tutkimuksessa (HPV-015) kaikki tutkittavat saavuttivat serokonversion kuukauden kuluttua kolmannen annoksen saannista. 84 kuukauden aikapisteessä, eli 78 kuukautta täyden rokotussarjan saamisen jälkeen, alkutilanteessa seronegatiivisista naisista 99,3 % säilyi seropositiivisina anti-HPV-16-vasta-aineille ja 95,9 % vastaavasti anti-HPV-18-vasta-aineille. Kaikki alkutilanteessa seropositiiviset naiset säilyivät seropositiivisina sekä anti-HPV-16- että anti-HPV-18-vasta-aineille. Vasta-ainetasot olivat korkeimmillaan kuukauden 7 kohdalla, laskivat sitten vähitellen kuukauteen 18 asti, minkä jälkeen stabiloituivat ja säilyivät tasaisina kuukauteen 84 saakka.
Immunogeenisuus 10-18-vuotiailla miehillä
Immunogeenisuutta miehillä arvioitiin kahdessa kliinisessä tutkimuksessa; HPV-011 (N=173) ja HPV-040 (N=556). Tutkimus osoitti vastaavanlaista immunogeenisuutta sekä miehillä että naisilla. HPV-011 tutkimuksessa kaikki tutkittavat saavuttivat serokonversion sekä HPV-16:lle että 18:lle, ja GMT –tasot olivat samanarvoiset kuin 15-25-vuotiailla naisilla HPV -012 tutkimuksessa.
Kliinisen tehon soveltaminen peräaukon muutoksiin ja syöpiin
Tutkimuksia Cervarixin tehosta peräaukon syöpää edeltäviin muutoksiin ei ole tehty. Tutkimukset 9-14-vuotiailla tytöillä (HPV-071 tutkimus) ja 18–45-vuotiailla naisilla (HPV-010 tutkimus) ovat kuitenkin yhdenmukaisesti osoittaneet, että immuunivaste on korkeampi Cervarixille, kuin vertailuvalmisteelle, jolle teho peräaukon syöpää edeltäviä muutoksia vastaan on osoitettu kiistattomasti ja suoja on osoitettu.
HIV-tartunnan saaneiden naisten immunogeenisuus
Cervarixin turvallisuutta ja immunogeenisuutta arvioitiin kahdessa kliinisessä tutkimuksessa:
- Etelä-Afrikassa suoritetussa HPV-020 tutkimuksessa 22 koehenkilöä, joilla ei ollut HIV-tartuntaa sekä 42 HIV-tartunnan saanutta koehenkilöä (WHO:n kliininen aste 1; ATP-immunogeenisuuskohortti) sai Cervarixia.
- Cervarixia ja nelivalenttista HPV-rokotetta vertaileva HPV-019 tutkimus suoritettiin 289 koehenkilöllä (ATP-kohortti = 157), joilla ei ollut HIV-tartuntaa, sekä 257 (ATP-kohortti = 166) HIV-tartunnan saaneella koehenkilölla. Tutkittavat olivat 15–25-vuotiaita naisia. Tutkimus toteutettiin Brasiliassa, Virossa, Intiassa ja Thaimaassa.
Molempiin tutkimuksiin osallistuvien HIV-tartunnan saaneiden koehenkilöiden oli oltava tutkimuksen alkaessa oireettomia riippumatta sairauden kliinisestä vaiheesta; viruskuorman oli oltava mittaamattomissa (viruskuorma < 400 kopiota/ml) vähintään kuuden kuukauden ajan jos henkilö sai antiretroviraalista lääkehoitoa (ART) (HPV-020) tai tehokasta antiretroviraalista yhdistelmälääkitystä (HAART) vähintään vuoden ajan (HPV-019); ei diagnosoitua aktiivista tuberkuloosia (TB) tai TB lääkehoitoa; HPV-019 tutkimuksessa CD4 solujen lukumäärän oli oltava > 350 solua/mm3.
Molemmissa tutkimuksissa kuukauden 7 kohdalla HIV-tartunnan saaneilla koehenkilöillä, jotka saivat Cervarixia, serokonversio oli ATP-kohortissa 100% molemmille antigeeneille. HPV-019 tutkimuksessa seropositiivisuus 24 kuukautta Cervarix-rokotuksen jälkeen oli 100% HPV-tyypin 16 vasta-aineille ja >96% HPV-tyypin 18 vasta-aineille pitoisuuksien geometrisen keskiarvon (GMC) ollessa yli 12 kertaa suurempi kuin vaste luonnolliseen HPV-infektioon. Molemmissa tutkimuksissa vasta-ainepitoisuuksien geometriset keskiarvot (GMC) HIV-tartunnan saaneilla koehenkilöillä olivat matalampia kuin henkilöillä, joilla ei ollut HIV-tartuntaa (ei-päällekkäiset 95 % luottamusvälit). HPV-019 tutkimuksessa Cervarixilla osoitettiin immuunivasteen paremmuus (neutraloivien vasta-aineiden GMT arvot) HPV-tyypin 16 ja 18 antigeeneja kohtaan HIV-tartunnan saaneilla koehenkilöillä 7 kuukauden kohdalla verrattuna nelivalenttiseen HPV-rokotteeseen. Näiden havaintojen kliinistä merkitystä ei tunneta. Kliinistä tutkimustietoa ei ole saatavilla suojan tehosta pitkäkestoista infektiota tai syövän esiasteina pidettäviä muutoksia vastaan HIV-tartunnan saaneilla naisilla.
Cervarixin reaktogeenisuus ja turvallisuusprofiili HIV-tartunnan saaneilla naisilla vastasi terveiden henkilöiden turvallisuusprofiilia (ks. kohta Haittavaikutukset).
Farmakokinetiikka
Ei sovelleta.
Prekliiniset tiedot turvallisuudesta
Non-kliinisten tietojen mukaan ihmiseen ei kohdistu erityisiä haittavaikutuksia. Päätelmät perustuvat tavanomaisiin farmakologisiin turvallisuustutkimuksiin, akuutin ja toistuvan annostuksen toksisuuskokeisiin sekä paikallisen siedettävyyden, fertiliteetin, alkio-sikiö-kehityksen ja postnataalivaiheen tutkimuksiin (imetyksen loppuun asti).
Serologiset tiedot viittaavat siihen, että anti-HPV-16- ja anti-HPV-18-vasta-aineet kulkeutuvat äidinmaitoon rotilla. Rokotuksen aikaansaamien vasta-aineiden kulkeutumisesta ihmisen äidinmaitoon ei ole tietoa.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi (NaCl)
Natriumdivetyfosfaattidihydraatti (NaH2PO4.2H2O)
Injektionesteisiin käytettävä vesi
Adjuvantit, katso kohta Vaikuttavat aineet ja niiden määrät
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
5 vuotta.
Cervarix tulee antaa niin pian kuin mahdollista sen jälkeen, kun rokote on otettu jääkaapista.
Säilyvyys on kuitenkin osoitettu jääkaapin ulkopuolella korkeintaan 3 vuorokautta 8 °C - 25 °C:ssa tai korkeintaan yhden vuorokauden 25 °C - 37 °C:ssa säilytettäessä. Rokote pitää hävittää, jos sitä ei käytetä tämän ajan kuluessa.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C:ssa).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CERVARIX injektioneste, suspensio, esitäytetty ruisku
10 x 0,5 ml (ilman neulaa) (-), 10 x 0,5 ml (-)
PF-selosteen tieto
Esitäytetty ruisku
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki. Pakkauskoot: 1 ja 10, neuloilla tai ilman neuloja.
Injektiopullo
0,5 ml suspensiota yhtä annosta varten injektiopullossa (tyypin I lasia), jossa korkki (butyylikumia). Pakkauskoot: 1, 10 ja 100.
Moniannospakkaus
1 ml suspensiota kahta annosta varten injektiopullossa (tyypin I lasia), jossa korkki (butyylikumia). Pakkauskoot: 1, 10 ja 100.
Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa sekä injektiopullon korkki ovat valmistettu synteettisestä kumista.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
Valmisteen kuvaus:
Samea, valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Esitäytetty ruisku
Säilytyksen aikana voi muodostua hienojakoinen valkoinen sakka ja kirkas väritön pintakerros. Tämä ei ole laadun huononemisen merkki.
Rokote on tarkistettava silmämääräisesti ennen ja jälkeen ravistamisen mahdollisten vierashiukkasten havaitsemiseksi ja/tai fysikaalisten muutosten varalta. Rokotetta ei saa käyttää, jos ulkonäössä havaitaan muutoksia.
Rokotetta on ravistettava hyvin ennen käyttöä.
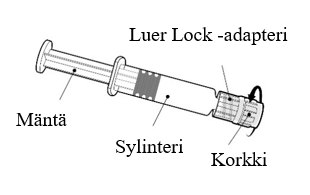
Esitäytetyn ruiskun käyttöohje
| Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
| Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun.
Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Injektiopullo
Säilytyksen aikana voi muodostua hienojakoinen valkoinen sakka ja kirkas väritön pintakerros. Tämä ei ole laadun huononemisen merkki.
Rokote on tarkistettava silmämääräisesti ennen ja jälkeen ravistamisen mahdollisten vierashiukkasten havaitsemiseksi ja/tai fysikaalisten muutosten varalta. Rokotetta ei saa käyttää, jos ulkonäössä havaitaan muutoksia.
Rokotetta on ravistettava hyvin ennen käyttöä.
Moniannospakkaus
Säilytyksen aikana voi muodostua hienojakoinen valkoinen sakka ja kirkas väritön pintakerros. Tämä ei ole laadun huononemisen merkki.
Rokote on tarkistettava silmämääräisesti ennen ja jälkeen ravistamisen mahdollisten vierashiukkasten havaitsemiseksi ja/tai fysikaalisten muutosten varalta. Rokotetta ei saa käyttää, jos ulkonäössä havaitaan muutoksia.
Rokotetta on ravistettava hyvin ennen käyttöä.
Moniannospakkausta käytettäessä, jokainen 0,5 ml annos vedetään steriiliin ruiskuun steriiliä neulaa käyttäen. Varovaisuutta on noudatettava, ettei sisältö kontaminoidu.
Hävitys
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
CERVARIX injektioneste, suspensio, esitäytetty ruisku
10 x 0,5 ml, 10 x 0,5 ml
- Ei korvausta.
ATC-koodi
J07BM02
Valmisteyhteenvedon muuttamispäivämäärä
26.04.2023
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi