TWINRIX PAEDIATRIC injektioneste, suspensio, esitäytetty ruisku
Vaikuttavat aineet ja niiden määrät
Yksi annos (0,5 ml) sisältää:
Hepatiitti A -virusta (inaktivoitua)1,2 360 ELISA-yksikköä
Hepatiitti B ‑pinta-antigeenia 3,4 10 mikrogrammaa
1 Tuotettu ihmisen diploidi (MRC-5) soluissa
2 Adsorboitu alumiinihydroksidiin (hydratoituun) 0,025 milligrammaa Al3+
3 Tuotettu hiivasoluissa (Saccharomyces cerevisiae)
rekombinantti DNA teknologian avulla
4 Adsorboitu alumiinifosfaattiin 0,2 milligrammaa Al3+
Rokote voi sisältää neomysiinijäämiä. Neomysiiniä käytetään valmistusprosessissa (ks. kohta Vasta-aiheet).
Täydellinen apuaineluettelo ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
Twinrix Paediatric on tarkoitettu käytettäväksi ei-immuuneilla 1−15-vuotiailla pikkulapsilla, lapsilla ja nuorilla, joilla tarvitaan suoja sekä hepatiitti A:ta että B:tä vastaan.
Annostus ja antotapa
Annostus
- Annostus
1−15-vuotiaiden pikkulasten, lasten ja nuorten annossuositus on 0,5 ml (360 ELISA-yksikköä HA/10 mikrog HBsAg).
- Perusrokotusohjelma
Standardi Twinrix Paediatric -perusrokotussarja sisältää kolme annosta; ensimmäinen annetaan valittuna päivänä, toinen kuukauden kuluttua ja kolmas 6 kuukauden kuluttua ensimmäisestä annoksesta. Rokotusaikataulusuosituksesta tulee pitää kiinni. Perusrokotussarja on annettava alusta loppuun samalla rokotteella.
- Tehosteannos
Haluttaessa antaa hepatiitti A- ja/tai B-tehosteannos voidaan käyttää monovalenttista tai yhdistelmärokotetta. Twinrix Paediatricin tehosteannoksen turvallisuutta ja immunogeenisuutta kolmen annoksen perusrokotussarjan jälkeen ei ole arvioitu.
Pitkäaikaistietoja vasta-aineiden säilymisestä on enimmillään 15 vuoden ajalta Twinrix Pediatric ‑rokotuksen jälkeen (kts. kohta Farmakodynamiikka).
Yhdistelmärokotteella annetun perusrokotussarjan jälkeen havaitut anti-HBs- ja anti-HAV-vasta-ainetitterit vastaavat monovalentin rokotteen antamisen jälkeen mitattuja tittereitä. Tehosterokotuksen yleiset ohjeet voidaan siten luoda monovalenteista rokotteista saatujen kokemusten perusteella seuraavasti.
Hepatiitti B
Hepatiitti B ‑rokotteen tehosteannoksen tarvetta terveillä henkilöillä, jotka ovat saaneet täyden perusrokotussarjan, ei ole selvitetty. Joissakin virallisissa rokotusohjelmissa on kuitenkin tällä hetkellä suositus hepatiitti B ‑rokotteen tehosteannoksesta, ja sitä tulee noudattaa.
Joissakin henkilö- ja potilasryhmissä, jotka altistuvat HB-virukselle (esim. hemodialyysi- tai immuunivajauspotilaat), on harkittava varotoimena suojaavan vasta-ainetason ≥ 10 IU/l varmistamista.
Hepatiitti A
Toistaiseksi ei varmasti tiedetä, tarvitsevatko hepatiitti A ‑rokotukseen reagoineet immunokompetentit henkilöt suojaksi tehosteannoksia, koska immunologinen muisti voi korvata mitattavissa olevien vasta-ainepitoisuuksien puuttumisen. Tehosterokotusohjeet perustuvat siihen olettamukseen, että suoja vaatii vasta-ainepitoisuuksia.
Twinrix Paediatric -rokote voidaan antaa henkilöille, joille halutaan antaa tehosteannos sekä hepatiitti A:ta että B:tä vastaan. Vaihtoehtoisesti, tehosteannos voidaan antaa jommallakummalla monovalentilla rokotteetta henkilöille, jotka ovat aikaisemmin saaneet Twinrix Paediatric -rokotuksia.
Antotapa
Twinrix Paediatric annetaan lihakseen, nuorille ja lapsille mieluiten olkavarteen (m. deltoideus) tai pikkulapsille reiden ulkosivuun.
Trombosytopeniaa sairastaville tai verenvuotohäiriöistä kärsiville potilaille pistos voidaan antaa poikkeuksellisesti ihon alle. Tällöin seurauksena saattaa kuitenkin olla suboptimaalinen immuunivaste rokotteelle (ks. Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille tai neomysiinille.
Yliherkkyys aiemmin annetulle hepatiitti A ja/tai hepatiitti B rokotteelle.
Twinrix Paediatric ‑rokotteen antamista kuten rokottamista yleensäkin tulee lykätä, jos potilaalla on akuutti vaikea kuumetauti.
Varoitukset ja käyttöön liittyvät varotoimet
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Rokotettavalla saattaa rokotettaessa olla itämisvaiheessa oleva hepatiitti A tai hepatiitti B ‑infektio. Ei tiedetä, estääkö Twinrix Paediatric hepatiitti A:n ja B:n tällaisissa tapauksissa.
Rokote ei suojaa muilta infektiotartunnoilta, esim. hepatiitti C:ltä tai hepatiitti E:ltä, ei myöskään muilta maksatulehduksia aiheuttavilta patogeeneiltä.
Twinrix Paediatric ‑rokotusta ei suositella altistuksenjälkeiseen profylaksiin (esim. neulanpistovammat).
Rokotetta ei ole tutkittu immuunivajauspotilailla. Hemodialyysipotilailla, immunosuppressiohoitoa saavilla potilailla tai potilailla, joilla vastustuskyky on heikentynyt, ei odotettua immuunivastetta ehkä saavuteta perusimmunisaatiolla. Tällöin rokotetta saatetaan tarvita lisäannoksia. Immuunivajauspotilailla riittävä vaste voi kuitenkin jäädä saavuttamatta.
Kuten kaikilla injisoitavilla rokotteilla, käsillä on aina oltava asianmukainen hoitovalmius ja seuranta harvinaisten anafylaktisten tapahtumien varalta.
Koska intradermaalinen tai gluteaalilihakseen annettu injektio voi antaa suboptimaalisen rokotusvasteen, näitä antotapoja tulee välttää. Jos potilaalla on trombosytopenia tai vuotohäiriö, Twinrix Paediatric voidaan kuitenkin poikkeuksellisesti antaa ihon alle, koska lihaksensisäinen anto saattaa näillä henkilöillä aiheuttaa verenvuotoa (ks. kohta Annostus ja antotapa).
Twinrix paediatric ‑rokotetta ei missään tapauksessa saa antaa suoneen.
Tämä rokote sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero tulisi kirjata selkeästi ylös.
Yhteisvaikutukset
Tietoja Twinrix Paediatric ‑rokotteen samanaikaisesta antamisesta spesifisen A-hepatiitti‑immunoglobuliinin tai B-hepatiitti‑immunoglobuliinin kanssa ei ole. Annettaessa monovalenttia hepatiitti A ja hepatiitti B ‑rokotetta samanaikaisesti spesifisten immunoglobuliinien kanssa, ei vaikutusta serokonversioon kuitenkaan havaittu, mutta vasta-ainetitterit voivat jäädä matalammiksi.
Twinrix Paediatric voidaan antaa samanaikaisesti ihmisen papilloomavirus (HPV)-rokotteen kanssa.
Twinrix Paediatricin ja Cervarixin (HPV-rokote) samanaikainen anto ei ole osoittanut mitään kliinisesti merkittävää vuorovaikutusta vasta-ainemuodostuksessa HPV- ja hepatiitti A-antigeeneille. Anti-HBs-vasta-aineen geometriset keskiarvotitterit olivat matalammat, kun rokotteet annettiin samanaikaisesti. Havainnon kliininen merkitys on tuntematon, sillä suojan antavat vasta-ainetasot eivät muuttuneet. 98,3 % rokotetuista saavutti anti-HBs-vasta-ainetitterit ≥ 10 mIU/ml, kun rokotteet annettiin samanaikaisesti. 100 % rokotetuista saavutti vastaavan arvon, kun Twinrixiä annettiin yksinään.
Twinrix Paediatric ‑rokotteen antamista samanaikaisesti muiden rokotteiden kanssa on tutkittu spesifisesti vain Cervarixilla, joten sitä ei tule antaa samanaikaisesti muiden kuin Cervarix-rokotteiden kanssa.
Raskaus ja imetys
Raskaus
Twinrix Paediatricin vaikutuksia alkion/sikiön kehitykseen ja kuolleisuuteen sekä peri- ja postnataalikehitykseen ja kuolleisuuteen on tutkittu rotilla. Tutkimuksessa ei tullut ilmi mitään suoria tai epäsuoria vahingollisia vaikutuksia hedelmällisyyteen, raskauteen, alkion/sikiön kehitykseen, synnytykseen eikä postnataalikehitykseen.
Twinrix Paediatricin vaikutuksia alkion/sikiön kehitykseen ja kuolleisuuteen sekä peri- ja postnataalikehitykseen ja kuolleisuuteen ei ole tutkittu kliinisissä tutkimuksissa.
Kokemus Twinrix Paediatricin käytöstä raskauden aikana perustuu rajalliseen määrään raskauksia. Kokemukset eivät viittaa rokotteen aiheuttamiin haittavaikutuksiin raskauden aikana. Myöskään sikiön/vastasyntyneen lapsen terveyteen ei ole havaittu kohdistuneen haittavaikutuksia. Vaikka rekombinantti DNA teknologian avulla valmistetun hepatiitti B viruksen pinta-antigeenin ei odoteta aiheuttavan haittaa sikiölle tai haittaavan raskauden kulkua, on suositeltavaa lykätä rokotus synnytyksen jälkeen. Rokotus voidaan antaa raskauden aikana, jos ilmenee välitön, pakottava syy suojata äiti hepatiitti B infektiota vastaan.
Imetys
Twinrix Paediatricin erittymisestä ihmisen äidinmaitoon ei ole tietoa, eikä Twinrix Paediatricin erittymistä eläinten äidinmaitoon ole tutkittu. Päätettäessä jatketaanko/lopetetaanko imettäminen, vai Twinrix Paediatric -rokotukset, on otettava huomioon rintaruokinnan hyödyt lapselle ja Twinrix Paediatric -rokotusten hyöty naiselle.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Twinrix Paediatric ei vaikuta lainkaan tai juurikaan ajokykyyn eikä koneiden käyttökykyyn.
Haittavaikutukset
Yhteenveto haittavaikutuksista
Alla esitetty turvallisuusprofiili perustuu noin 800 henkilöltä saatuihin tietoihin. Twinrix Paediatricilla yleisimmin raportoidut haittavaikutukset annosta kohti ovat kipu (28,5 %) ja punoitus (11,5 %).
Taulukko haittavaikutuksista
Yleisyys raportoidaan seuraavasti:
Hyvin yleiset: (≥ 1/10)
Yleiset: (≥ 1/100 ─ < 1/10)
Melko harvinaiset (≥ 1/1000 ─ < 1/100)
Harvinaiset: (≥ 1/10000 ─ < 1/1000)
Hyvin harvinaiset: (< 1/10000)
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Kliiniset lääketutkimukset | ||
Infektiot | melko harvinaiset | ylähengitystieinfektio* |
Veri ja imukudos | harvinaiset | lymfadenopatia |
Aineenvaihdunta ja ravitsemus | yleiset | ruokahaluttomuus |
Psyykkiset häiriöt | yleiset | ärtyneisyys |
Hermosto | yleiset harvinaiset | uneliaisuus, päänsärky heikentynyt tunto*, tuntoharha* huimaus |
Verisuonisto | harvinaiset | hypotensio* |
Ruoansulatuselimistö | yleiset melko harvinaiset | maha-suolikanavan oireet, pahoinvointi ripuli, oksentelu, vatsakipu |
Iho ja ihonalainen kudos | melko harvinaiset harvinaiset | ihottuma urtikaria, kutina* |
Luusto, lihakset ja sidekudos | melko harvinaiset harvinaiset | lihaskipu* nivelkipu* |
Yleisoireet ja antopaikassa todettavat haitat | hyvin yleiset yleiset harvinaiset | injektiokohdan kipu ja punoitus injektiokohdan turvotus, injektiokohdan reaktiot (kuten mustelma), väsymys, huonovointisuus, kuume (≥ 37,5ºC) influenssankaltainen tauti*, vilunväristykset* |
Markkinoille tulon jälkeiset tiedot | ||
Seuraavia haittavaikutuksia on raportoitu joko Twinrixillä tai GlaxoSmithKlinen monovalenttisilla hepatiitti A- tai B -rokotteilla. | ||
Infektiot | aivokalvontulehdus | |
Veri ja imukudos | trombosytopenia, trombosytopeeninen purppura | |
Immuunijärjestelmä | anafylaksia, allergiset reaktiot, anafylaktoidiset reaktiot mukaan lukien, seerumitaudin kaltainen tila | |
Hermosto | enkefaliitti, enkefalopatia, hermotulehdus, neuropatia, paralyysi, kouristukset | |
Verisuonisto | vaskuliitti | |
Iho ja ihonalainen kudos | angioneuroottinen edeema, lichen planus, erythema mulfiforme | |
Luusto, lihakset ja sidekudos | niveltulehdus, lihasheikkous | |
Yleisoireet ja antopaikassa todettavat haitat | injektiokohdan välitön kipu | |
Lisäksi seuraavia haittatapahtumia on raportoitu ajallisessa yhteydessä rokotukseen monovalenttien hepatiitti A- ja/tai hepatiitti B-rokotteiden laajan käytön aikana. | ||
Hermosto | MS-tauti, myeliitti, kasvohalvaus, polyneuriitti kuten Guillain−Barrén oireyhtymä (nouseva paralyysi), optikusneuriitti | |
Yleisoireet ja antopaikassa todettavat haitat | pistely ja polttava tunne | |
Tutkimukset | maksan toimintakokeiden epänormaalit arvot | |
* viittaa haittavaikutuksiin, joita on raportoitu kliinisissä tutkimuksissa aikuisille tarkoitetulla lääkemuodolla
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Markkinoille tulon jälkeen on raportoitu yliannostustapauksia. Yliannostuksen jälkeen raportoidut haittatapahtumat olivat samanlaiset kuin normaaliannostuksen jälkeen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Hepatiittirokote, ATC-koodi: J07BC20.
Twinrix Paediatric on yhdistelmärokote, joka on valmistettu yhdistämällä bulkkivalmisteina puhdistettua inaktivoitua hepatiitti A ‑virusta (HA) ja puhdistettua hepatiitti B ‑viruksen pinta-antigeenia (HBsAg), jotka on erikseen adsorboitu alumiinihydroksidiin (hydratoituun) ja alumiinifosfaattiin. HA-virus tuotetaan ihmisen MRC5-diploidisoluissa. HBsAg tuotetaan geenitekniikalla muunnelluissa hiivasoluviljelmässä selektiivisessä elatusaineessa.
Twinrix Paediatric saa aikaan immuniteetin HAV- ja HBV-infektiota vastaan aiheuttamalla spesifisen anti-HAV- ja anti-HBs-vasta-ainemuodostuksen.
Suoja hepatiitti A:ta ja B:tä vastaan kehittyy 2−4 viikossa. Kliinisissä tutkimuksissa spesifejä humoraalisia vasta-aineita hepatiitti A:ta vastaan havaittiin noin 89 %:lla koehenkilöistä kuukauden kuluttua ensimmäisen annoksen antamisesta ja 100 %:lla koehenkilöistä kuukauden kuluttua kolmannen annoksen antamisesta (eli 7. kuukausi). Spesifejä humoraalisia vasta-aineita hepatiitti B:tä vastaan havaittiin noin 67 %:lla koehenkilöistä ensimmäisen annoksen jälkeen ja 100 %:lla koehenkilöistä kolmannen annoksen jälkeen.
Kahdessa pitkäaikaisessa kliinisessä tutkimuksessa on todettu anti-HAV- ja anti-HBs-vasta-aineiden säilyminen 5 vuoteen saakka 1−11-vuotiailla lapsilla ja 15 vuoteen asti 12−15-vuotiailla lapsilla.
5 vuoden kuluttua Twinrix Paediatricin 0, 1 ja 6 kuukauden perusrokotussarjasta kaikilla seuratuilla 1−11-vuotiailla lapsilla anti-HAV-vasta-aineet olivat ≥ 15 mIU/ml. Anti-HBs-vasta-aineet olivat ≥ 10 mIU/ml 97 %:lla rokotetuista.
15 vuoden kuluttua Twinrix Paediatricin 0, 1 ja 6 kuukauden perusrokotussarjasta kaikilla seuratuilla 12−15-vuotiailla lapsilla anti-HAV-vasta-aineet olivat ≥ 15 mIU/ml. Anti-HBs-vasta-aineet olivat ≥ 10 mIU/ml 81,8 %:lla rokotetuista. Rajatulle määrälle henkilöitä (n=11), joiden anti-HBs-vasta-ainetasot laskivat < 10 mIU/ml, annettiin HBV tehosterokote. Heistä kymmenelle (90,9 %) kehittyi immunologinen muistivaste.
Farmakokinetiikka
Rokotteilta ei vaadita farmakokinetiikan arviointia.
Prekliiniset tiedot turvallisuudesta
Yleisten turvallisuutta koskevien tutkimusten perusteella ei ei-kliinisissä tiedoissa ilmene mitään erityistä vaaraa ihmiselle.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Injektionesteisiin käytettävä vesi
Adjuvantit, ks. kohta Vaikuttavat aineet ja niiden määrät.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Säilytys
Säilytä jääkaapissa (2°C − 8°C:ssä).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TWINRIX PAEDIATRIC injektioneste, suspensio, esitäytetty ruisku
0,5 ml (63,09 €)
PF-selosteen tieto
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki. Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa ovat valmistettu synteettisestä kumista.
Pakkauskoot 1, 10 ja 50 neuloilla tai ilman neuloja.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Samea, valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Varastoitaessa voi muodostua hienojakoinen valkoinen sedimentti ja kirkas, väritön pintakerros.
Rokote on saatettava käyttökuntoon ennen antoa. Käyttökuntoon saatettu rokote on ulkonäöltään tasainen, samea ja valkoinen.
Rokotteen käyttökuntoon saattaminen, jotta muodostuu tasainen, samea, valkoinen suspensio.
Rokote saatetaan käyttökuntoon vaiheittain noudattamalla seuraavia ohjeita.
- Pidä ruisku pystyasennossa käsi suljettuna.
- Ravista ruiskua kääntämällä se useita kertoja ylösalaisin ja takaisin oikein päin.
- Toista tätä liikettä voimakkaasti vähintään 15 sekunnin ajan.
-
Tarkista rokote uudestaan:
a) Rokote on valmis käytettäväksi, jos suspensio on tasainen, samea ja valkoinen – rokote ei ole kirkas.
b) Jos rokote ei vielä ole tasainen, samea, valkoinen suspensio – käännä ylösalaisin ja takaisin oikein päin vielä vähintään 15 sekunnin ajan – tarkista uudelleen.
Ennen rokottamista rokote tarkastetaan silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta. Jos jompaakumpaa havaitaan, rokotetta ei tule antaa.
Esitäytetyn ruiskun käyttöohje käyttökuntoon saattamisen jälkeen
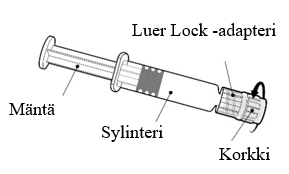
| Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
| Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys
Käyttämätön lääkevalmiste ja jäte on hävitettävä paikallisten vaatimusten mukaisesti
Korvattavuus
TWINRIX PAEDIATRIC injektioneste, suspensio, esitäytetty ruisku
0,5 ml
- Ei korvausta.
ATC-koodi
J07BC20
Valmisteyhteenvedon muuttamispäivämäärä
26.04.2023
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi