ENGERIX-B injektioneste, suspensio, esitäytetty ruisku 20 mikrog/ml
Vaikuttavat aineet ja niiden määrät
1 annos (1 ml):
Hepatiitti B -viruksen pinta-antigeeni1,2 20 mikrog
1 adsorboituna alumiinihydroksidiin (hydratoituun) yhteensä 0,5 millig Al3+
2 tuotetaan hiivasoluissa (Saccharomyces cerevisiae)
rekombinantti DNA teknologian avulla
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiopullo:
Injektioneste, suspensio
Esitäytetty ruisku:
Injektioneste, suspensio, esitäytetyssä ruiskussa.
Kliiniset tiedot
Käyttöaiheet
ENGERIX-B on tarkoitettu aktiiviseen immunisaatioon kaikkien tunnettujen hepatiitti B -viruksen (HBV) alatyyppien aiheuttamaa infektiota vastaan immunisoitumattomilla vähintään 16-vuotiailla henkilöillä. Rokotettavat väestöryhmät määritellään virallisten suositusten perusteella.
Voidaan olettaa, että immunisaatio ENGERIX-B-rokotteella estää myös (delta-tekijän aiheuttaman) hepatiitti D -infektion, koska hepatiitti D esiintyy ainoastaan hepatiitti B -infektion yhteydessä.
Annostus ja antotapa
Antotapa
Annostus
ENGERIX-B 20 mikrog/1 ml on tarkoitettu aikuisille ja vähintään 16-vuotiaille. ENGERIX-B 10 mikrog/0,5 ml on tarkoitettu 15-vuotiaille ja sitä nuoremmille lapsille.
ENGERIX-B 20 mikrog/1 ml voidaan myös antaa 11─15-vuotiaille henkilöille kahden annoksen rokotusohjelmaa noudattaen tilanteissa, joissa riski sairastua B-hepatiittiin rokotusohjelman aikana on matala. Samalla on varmistauduttava siitä, että rokotusohjelma voidaan toteuttaa kokonaisuudessaan (ks. alla ja kohta Farmakodynamiikka).
Perusrokotusohjelma
Vähintään 16-vuotiaat:
Perusrokotuksessa voidaan noudattaa kahta vaihtoehtoista rokotusohjelmaa:
Rokotusohjelma, jossa rokotukset annetaan 0, 1 ja 6 kuukauden kohdalla antaa optimaalisen suojan 7. kuukaudella ja johtaa korkeisiin vasta-ainepitoisuuksiin.
Nopea rokotusohjelma, jossa rokotukset annetaan 0, 1 ja 2 kuukauden kohdalla, antaa suojan nopeammin, ja hoitomyöntyvyyden arvellaan olevan parempi. Tässä rokotusohjelmassa neljäs annos annetaan 12 kuukauden kohdalla, mikä varmistaa pitkäaikaissuojan. Vasta-ainepitoisuudet ovat nimittäin kolmannen annoksen kohdalla matalammat kuin 0, 1 ja 6 kuukauden rokotusohjelmassa.
Vähintään 18-vuotiaat:
Poikkeusolosuhteissa, kun suoja on saatava aikaan vielä nopeammin aikuisilla, esim. silloin kun matkustetaan endeemisille alueille ja rokotussarja hepatiitti B:tä vastaan alkaa kuukautta ennen lähtöä, voidaan antaa kolmen lihakseen annettavan injektion sarja päivinä 0, 7 ja 21. Tätä ohjelmaa käytettäessä suositellaan neljättä annosta 12 kuukauden kuluttua ensimmäisestä annoksesta.
11 - 15-vuotiaat:
ENGERIX-B 20 mikrog/1 ml voidaan antaa 11 - 15-vuotiaille henkilöille 0 ja 6 kuukauden rokotusohjelmaa noudattaen. Tällä rokotusohjelmalla suoja hepatiitti B-infektiota vastaan kehittyy mahdollisesti vasta toisen annoksen jälkeen (ks kohta Farmakodynamiikka). Tätä rokotusohjelmaa tulee käyttää vain tilanteissa, joissa riski sairastua B-hepatiittiin rokotusohjelman aikana on matala. Samalla on varmistauduttava siitä, että rokotusohjelma voidaan toteuttaa kokonaisuudessaan. Ellei molempia ehtoja voida toteuttaa (esim. hemodialyysipotilaat, endeemiselle alueelle matkustavat, B-hepatiitin sairastuneiden lähikontaktit), rokotukset on annettava 10 mikrog kolmen annoksen aikataululla tai nopeutetulla 10 mikrog annostusaikataululla.
Vähintään 16-vuotiaat munuaisten vajaatoiminnasta kärsivät henkilöt, hemodialyysipotilaat mukaan lukien:
Perusrokotussarja munuaisten vajaatoiminnassa, hemodialyysipotilaat mukaan lukien, on neljä kaksoisannosta (2 x 20 mikrog) valittuna päivänä, 1 kuukauden kohdalla, 2 kuukauden kohdalla ja 6 kuukauden kohdalla ensimmäisestä annoksesta. Rokotusohjelmaa tulee muuttaa siten, että anti-HBs-vasta-ainepitoisuudet pysyvät varmasti ≥ 10 IU/l, joka on hyväksytty suojaava taso.
Todettu tai oletettu HBV altistus:
Mikäli henkilö on altistunut hiljattain hepatiitti B ‑virukselle (esim. saastuneen neulan pisto), ensimmäinen ENGERIX-B‑annos voidaan antaa samanaikaisesti HBIg-annoksen kanssa mutta eri injektiokohtaan (ks. kohta Yhteisvaikutukset). Immunisaatiossa tulisi noudattaa 0, 1, 2 – 12 kuukauden rokotusohjelmaa.
Rokotusohjelmia voidaan sovittaa paikallisten olosuhteiden mukaan.
Tehosteannos.
Tämänhetkinen tieto ei tue tehosteannoksen antamista henkilöille, joilla täydellinen perusrokotussarja on johtanut immuniteettiin. (Lancet 2000, 355:561).
Joillakin henkilöillä immuniteetti on puutteellinen (esim. kroonisesta munuaisten vajaatoiminnasta kärsivillä, hemodialyysipotilailla, HIV-positiivisilla) ja näille henkilöille tulee antaa tehosteannoksia. Näin varmistaudutaan siitä, että anti-HBs-vasta-ainepitoisuudet pysyvät ≥ 10 IU/l, joka on hyväksytty suojaava vasta-ainetaso. Vasta-ainetason tutkiminen 6-12 kuukauden välein rokottamisen jälkeen on näillä potilailla suositeltavaa.
Kansalliset suositukset tehosteannoksen osalta tulee huomioida.
Hepatiitti B -rokotteiden vaihdettavuus
Ks. kohta Yhteisvaikutukset.
Antotapa
ENGERIX-B annetaan sekä lapsille että aikuisille injektiona lihakseen hartialihaksen alueelle.
Poikkeustapauksissa rokote voidaan antaa subkutaanisena injektiona potilaille, joilla on trombosytopenia tai verenvuotohäiriö.
Vasta-aiheet
ENGERIX-B:tä ei pidä antaa henkilöille, joilla on tunnettu yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille, tai joilla on todettu yliherkkyyteen viittaavia merkkejä edellisen ENGERIX-B‑annoksen jälkeen.
ENGERIX-B‑rokotusta kuten muitakin rokotuksia on lykättävä, mikäli rokotettavalla on akuutti vaikea kuumesairaus. Lievät infektiot eivät kuitenkaan ole rokottamisen vasta-aiheita.
Varoitukset ja käyttöön liittyvät varotoimet
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Hepatiitti B:n pitkän itämisajan vuoksi rokotettavalla saattaa rokotushetkellä olla havaitsematon hepatiitti B ‑infektio. Tällaisissa tapauksissa rokote ei välttämättä estä hepatiitti B ‑infektiota.
Rokote ei estä muiden maksatauteja aiheuttavien patogeenien infektioita, kuten hepatiitti A:ta, hepatiitti C:tä ja hepatiitti E:tä.
Kuten kaikilla rokotteilla suojaava vasta-ainetasoa ei ehkä saavuteta kaikilla rokotetuilla.
Useiden tekijöiden on todettu heikentävän B-hepatiittirokotteiden immuunivastetta. Näitä tekijöitä ovat vanhempi ikä, miessukupuoli, lihavuus, tupakointi, antoreitti ja eräät taustalla olevat krooniset sairaudet. Serologisten testien suorittamista pitäisi harkita niillä henkilöillä, joilla saattaa olla riski, ettei suojaavaa vasta-ainetasoa saavuteta täydellisen Engerix-B-rokotesarjan jälkeen. Lisäannosten tarvetta pitäisi harkita henkilöillä, joille rokotusvastetta ei tule tai se jää puutteelliseksi.
Potilaita, joilla on krooninen maksasairaus tai HIV-infektio tai jotka ovat hepatiitti C:n kantajia, ei tule jättää rokottamatta B-hepatiittia vastaan. Rokotusta voidaan suositella, koska HBV-infektio voi olla vaikea näillä potilailla: lääkärin tuleekin harkita HBV-rokotusta tapauskohtaisesti. HIV-tartunnan saaneilla potilailla samoin kuin munuaisten vajaatoimintaa potevilla, hemodialyysipotilailla ja henkilöillä, joilla on immuunivajaus, perusimmunisaatiolla ei ehkä saavuteta riittäviä anti-HBs-vasta-ainepitoisuuksia, joten tällaisille potilaille voi olla tarpeen antaa lisäannos rokotetta.
ENGERIX-B rokotetta ei pidä antaa pakaraan eikä intradermaalisesti, koska tällöin tuloksena saattaa olla huonompi immuunivaste.
ENGERIX-B rokotetta ei saa missään tapauksessa antaa suoneen.
Injisoitavia rokotteita annettaessa käsillä on aina oltava tarvittava hoitovalmius mahdollisten rokotteen aiheuttamien harvinaisten anafylaktisten reaktioiden varalta.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero tulisi kirjata selkeästi ylös.
Yhteisvaikutukset
ENGERIX-B‑rokotteen ja standardin HBIg-annoksen samanaikainen anto ei johda pienempiin anti-HBs-vasta-ainepitoisuuksiin, mikäli valmisteet annetaan eri injektiokohtiin.
ENGERIX-B‑rokote voidaan antaa samanaikaisesti BCG-, hepatiitti A ‑, polio-, tuhkarokko‑, sikotauti-, vihurirokko-, kurkkumätä- ja jäykkäkouristusrokotteen kanssa.
ENGERIX-B voidaan antaa samanaikaisesti ihmisen papilloomavirusrokotteen (HPV) kanssa. ENGERIX-B:n ja Cervarixin (HPV-rokote) samanaikainen anto ei vaikuttanut kliinisesti merkittävästi HPV-antigeenien aikaansaamiin vasta-ainevasteisiin. Anti-HBs vasta-ainepitoisuudet (geometriset keskiarvot) jäivät matalammiksi samanaikaisen annon jälkeen. Näiden havaintojen kliinistä merkitystä ei tunneta, sillä riittävä serologinen vaste kuitenkin saavutettiin. Samanaikaisesti molemmat rokotteet saaneista henkilöistä 97,9 % saavutti anti-HBs pitoisuustason ≥ 10 mIU/ml. Osuus oli 100 %, kun ENGERIX-B annettiin yksinään.
Injektioina annettavat eri rokotetyypit tulee aina antaa eri pistokohtaan.
ENGERIX-B‑rokotetta voidaan käyttää sellaisen perusimmunisaation loppuunsaattamiseen, joka on aloitettu plasmaperäisellä tai jollakin toisella geenitekniikalla tuotetulla hepatiitti B ‑rokotteella, tai haluttaessa tehosteannoksena henkilöille, joilla perusimmunisaatio on toteutettu aikaisemmin plasmaperäisellä tai jollakin toisella geenitekniikalla tuotetulla hepatiitti B ‑rokotteella.
Raskaus ja imetys
Raskaus
HBsAg:n vaikutusta sikiönkehitykseen ei ole arvioitu.
Kuten muidenkaan inaktivoituja viruksia sisältävien rokotteiden sen ei kuitenkaan odoteta vahingoittavan sikiötä. ENGERIX-B‑rokotetta tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen ja mikäli mahdollinen hyöty on suurempi kuin sikiöön mahdollisesti kohdistuvat riskit.
Imetys
Imettävälle äidille annetun ENGERIX-B‑rokotteen vaikutuksia äidinmaitoa saavaan lapseen ei ole arvioitu kliinisissä tutkimuksissa, koska tietoja valmisteen erittymisestä äidinmaitoon ei ole käytettävissä.
Imettäminen ei ole vasta-aihe.
Hedelmällisyys
ENGERIX-B:tä ei ole arvioitu hedelmällisyystutkimuksissa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
ENGERIX-B-rokotteella ei ole vaikutusta tai on vähäinen vaikutus kykyyn ajaa autoa tai käyttää koneita.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Alla esitetty turvallisuusprofiili perustuu 23 tutkimuksesta saatuihin 5329 henkilön seurantatietoihin.
Nykyinen Engerix-B rokote ei sisällä tiomersaalia (orgaaninen elohopeayhdiste). Seuraavia haittavaikutuksia on raportoitu sekä tiomersaalia sisältävällä että tiomersaalittomalla rokotteella.
Yhdessä nykyisellä tiomersaalittomalla rokotteella tehdyssä kliinisessä tutkimuksessa, kivun, punoituksen, turvotuksen, väsymyksen, gastroenteriitin, päänsäryn, ja kuumeen ilmaantuvuus oli verrannollinen aikaisemmilla tiomersaalia sisältäneillä rokotteilla kliinisissä tutkimuksissa havaittuun ilmaantuvuuteen.
Haittavaikutustaulukko
Haittavaikutusten esiintymistiheys annosta kohti on määritelty seuraavasti:
Hyvin yleiset: ≥ 1/10
Yleiset: ≥1/100 − < 1/10
Melko harvinaiset: ≥1/1000 − < 1/100
Harvinaiset: ≥ 1/10000 − < 1/1000
Hyvin harvinaiset: < 1/10000
Elinjärjestelmä | Frekvenssi | Haittavaikutus |
Kliiniset tutkimukset | ||
Veri ja imukudos: | Harvinainen | Lymfadenopatia |
Aineenvaihdunta ja ravitsemus | Yleinen | Ruokahaluttomuus |
Psyykkiset häiriöt | Hyvin yleinen | Ärtyisyys |
Hermosto | Yleinen | Uneliaisuus, päänsärky |
| Melko harvinainen | Huimaus | |
| Harvinainen | Parestesia | |
Ruoansulatuselimistö | Yleinen | Maha-suolikanavan oireet (kuten pahoinvointi, oksentelu, ripuli, vatsakipu) |
Iho ja ihonalainen kudos | Harvinainen | Urtikaria, kutina, ihottuma |
Luusto, lihakset ja sidekudos | Melko harvinainen | Lihaskipu |
| Harvinainen | Nivelkipu | |
Yleisoireet ja antopaikassa todettavat haitat: | Hyvin yleinen | Injektiokohdan kipu ja punoitus, väsymys |
| Yleinen | Kuume (≥ 37,5 °C), yleinen sairauden tunne, injektiokohdan turvotus ja reaktiot (kuten kovettuma) | |
| Melko harvinainen | Influenssankaltainen sairaus | |
Markkinoille tulon jälkeiset tiedot | ||
Infektiot | Meningiitti | |
Veri ja imukudos | Trombosytopenia | |
Immuunijärjestelmä | Anafylaksia, allergiset reaktiot mukaan lukien anafylaktoidiset reaktiot ja seerumitaudin kaltainen tila | |
Hermosto | Enkefaliitti, enkefalopatia, kouristukset, paralyysi, neuriitti (mukaan lukien Guillain-Barrén oireyhtymä, optikusneuriitti ja MS-tauti), neuropatia ja alentunut tuntoherkkyys | |
Verisuonisto | Vaskuliitti, hypotensio | |
Iho ja ihonalainen kudos | Erythema multiforme, angioneuroottinen edeema, lichen planus | |
Luusto, lihakset ja sidekudos | Niveltulehdus, lihasheikkous | |
Vertailevassa tutkimuksessa 11−15-vuotiailla henkilöillä keräämällä raportoitujen paikallisten oireiden ja yleisoireiden ilmaantuvuus oli kahden annoksen ENGERIX-B 20 mikrog/1 ml rokotusohjelmassa kaiken kaikkiaan samanlainen kuin kolmen annoksen ENGERIX-B 10 mikrog/0,5 ml standardirokotusohjelmassa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta –tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Markkinoille tulon jälkeen on raportoitu yliannostustapauksia. Yliannostuksen aiheuttamat haittatapahtumat olivat samanlaiset kuin rokotteen normaaliannostuksessa raportoidut.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: hepatiitti B rokote, ATC koodi: J07BC01
Vaikutusmekanismi
ENGERIX-B aiheuttaa spesifisten humoraalisten vasta-aineiden muodostumista HBsAg:a vastaan (anti-HBs-vasta-aineet). Tason 10 IU/l saavuttava tai ylittävä anti-HBs-vasta-ainepitoisuus antaa suojan HBV-infektiota vastaan.
Farmakodynaamiset vaikutukset
Kenttätutkimuksissa on todettu 95─100 %:n suojavaikutus vastasyntyneillä, lapsilla ja aikuisilla, joilla oli riski saada hepatiitti B infektio.
- Terveet 16-vuotiaat ja sitä vanhemmat tutkitut
Alla oleva taulukko esittää kliinisissä lääketutkimuksissa saadut suojaavat vasta-ainetasot (toisin sanoen niiden henkilöiden prosenttiosuus, joilla anti-HBs-vasta-ainepitoisuudet olivat ≥ 10 IU/l), kun ENGERIX-B:tä annettiin (20 mikrog/1 ml) eri rokotusaikatauluja noudattaen (katso kohta Annostus ja antotapa)
Populaatio | Rokotusohjelma | Suojan antava vasta-ainetaso |
Terveet vähintään 16-vuotiaat henkilöt | 0, 1, 6 kuukautta | 7. kuukauden kohdalla ≥ 96 % |
| 0, 1, 2, 12 kuukautta | 1. kuukauden kohdalla: 15 % 3. kuukauden kohdalla: 89 % 13. kuukauden kohdalla: 95,8 % | |
Terveet vähintään 18-vuotiaat henkilöt | 0, 7, 21 päivää, 12 kuukautta | 28. päivä: 65, 2 % 2. kuukauden kohdalla 76 % 13. kuukauden kohdalla: 98,6 % |
Taulukossa esitetyt tulokset on saatu tiomersaalia sisältävillä rokotteilla. Tiomersaalittomalla koostumuksella on tehty kaksi lisätutkimusta terveillä lapsilla ja aikuisilla. Näissä tutkimuksissa suojaavat vasta-ainetasot olivat samanlaiset kuin tiomersaalia sisältävillä rokotteilla.
- Terveet 11−15-vuotiaat tutkitut
66 kuukautta perusrokotussarjan ensimmäisen annoksen jälkeen serologinen vaste tutkittiin sellaisilta 11−15-vuotiailta, jotka olivat saaneet rokotteen kahdella erilaisella, käyttöön hyväksytyllä annosvahvuudella ja rokotusaikataululla. Tehotulokset tälle lähtöryhmissä pysyneiden (ATP eli According-To-Protocol) kohortille esitetään seuraavassa taulukossa:
Kuukaudet ensimmäisestä annoksesta | |||||||
Rokotusaikataulu | 2 | 6 | 7 | 30 | 42 | 54 | 66 |
Suojaavat vasta-ainetasot | |||||||
ENGERIX-B 10 mikrog/0,5 ml (0, 1, 6 kuukautta) | 55,8 % | 87,6 % | 98,2 %* | 96,9 % | 92,5 % | 94,7 % | 91,4 % |
ENGERIX-B 20 mikrog/1 ml (0, 6 kuukautta) | 11,3 % | 26,4 % | 96,7 %* | 87,1 % | 83,7 % | 84,4 % | 79,5 % |
* 7. kuukauden kohdalla 97,3 % 11−15-vuotiaista henkilöistä, jotka olivat saaneet ENGERIX-B 10 mikrog/0,5 ml injektionestettä (0, 1, 6 kuukauden rokotusohjelmalla) ja 88,8 % 11−15-vuotiaista henkilöistä, jotka olivat saaneet ENGERIX-B 20 mikrog/1 ml injektionestettä (0, 6 kuukauden rokotusohjelmalla), kehittivät ≥ 100 mIU/ml anti-HBs-vasta-ainepitoisuudet. Pitoisuuksien (geometriset) keskiarvot (GMC) olivat vastaavasti 7238 mIU/ml ja 2739 mIU/ml.
Molempien rokotusryhmän kaikille henkilöille (N=74) annettiin heräteannos 72−78 kuukauden kuluttua perusrokotussarjasta. Kaikille henkilöille oli kuukaudessa kehittynyt anamnestinen vaste. Vasta-ainepitoisuudet kasvoivat 108-kertaisiksi niillä, jotka saivat 2 rokoteannosta ja 95- kertaisiksi niillä, jotka saivat 3 rokoteannosta kun pitoisuuksia verrattiin toisiinsa ennen heräteannoksen antoa ja sen jälkeen. Henkilöille oli siis kehittynyt rokotesuoja. Näiden tietojen perusteella immunologinen muisti oli kehittynyt kaikille perusrokotussarjan saaneille henkilöille, myös henkilöille, jotka olivat vailla suojaavaa vasta-ainetasoa 66. kuukauden kohdalla.
- Munuaisten vajaatoiminnasta kärsivät potilaat mukaan lukien hemodialyysipotilaat:
Suojaavat vasta-ainetasot tutkittiin 3. ja 7. kuukauden kohdalla perusrokotuksen ensimmäisestä annoksesta vähintään 16-vuotiailla munuaisten vajaatoiminnasta kärsivillä potilailla, mukaan lukien hemodialyysipotilaat. Tulokset on esitetty alla olevassa taulukossa.
Ikä (vuotta) | Rokotusohjelma | Suojaavat vasta-ainetasot |
vähintään 16-vuotiaat henkilöt | 0,1,2,6 kuukautta (2 x 20 mikrog) | 3. kuukauden kohdalla 55,4 % 7. kuukauden kohdalla 87,1 % |
- Tyypin II diabeteksestä kärsivät potilaat:
Suojaavat vasta-ainetasot tutkittiin yhden kuukauden kuluttua perusrokotuksen viimeisimmästä annoksesta vähintään 20-vuotiailla tyypin II diabeteksestä kärsivillä potilailla. Tulokset on esitetty alla olevassa taulukossa.
Ikä (vuotta) | Rokotusohjelma | Suojaavat vasta-ainetasot 7. kuukauden kohdalla |
20−39 | 0, 1, 6 kuukautta (20 mikrog) | 88,5 % |
40−49 | 81,2 % | |
50−59 | 83,2 % | |
≥ 60 | 58,2 % |
- Maksasolusyövän ilmaantuvuuden vähentäminen lapsilla:
Hepatiitti B -infektion ja maksasolusyövän esiintymisen välillä on osoitettu selvä yhteys. Hepatiitti B:n ehkäisy rokottamalla vähentää maksasolusyövän ilmaantuvuutta, kuten Taiwanissa on 6 ‑ 14-vuotiailla lapsilla todettu.
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Prekliiniset tiedot turvallisuudesta täyttävät WHO:n vaatimukset.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Dinatriumfosfaattidihydraatti
Natriumdivetyfosfaatti
Injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Säilytys
Säilytä jääkaapissa (2°C – 8oC).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilyvyystutkimukset osoittavat, että ENGERIX-B säilyy korkeintaan 37°C lämpötilassa 3 päivän ajan tai korkeintaan 25°C lämpötilassa 7 päivän ajan. Tämä tieto on tarkoitettu vain terveydenhuollon ammattilaisille siltä varalta, että rokote säilytetään tilapäisesti jääkaapin ulkopuolella.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ENGERIX-B injektioneste, suspensio, esitäytetty ruisku
20 mikrog/ml (L:ei) 1 ml (71,78 €)
PF-selosteen tieto
1 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki. Pakkauskoot 1 ja 10 neuloilla tai ilman neuloja.
1 ml suspensiota injektiopullossa (tyypin I lasia), jossa tulppa (butyylikumia). Pakkaukset 1, 10, 25 tai 100.
Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa sekä injektiopullon tulppa ovat valmistettu synteettisestä kumista.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Samea, valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Rokotteeseen saattaa säilytyksen aikana ilmaantua ohut valkoinen sakka, neste on kirkas ja väritön. Ravistamisen jälkeen rokote on hiukan sameaa.
Rokote tulee tarkastaa ennen antamista silmämääräisesti vierashiukkasten ja/tai poikkeavien fysikaalisten muutosten varalta. Rokotetta ei tule antaa, mikäli kumpaakaan edellä mainituista havaitaan.
Kerta-annospakkauksen koko sisältö on käytettävä kerralla ja annettava heti.
Esitäytetyn ruiskun käyttöohje
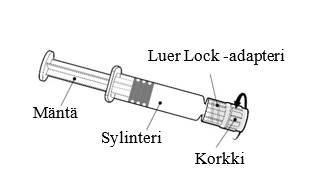 | Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
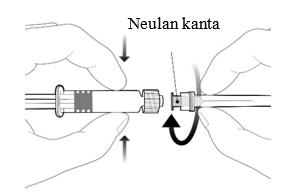 | Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ENGERIX-B injektioneste, suspensio, esitäytetty ruisku
20 mikrog/ml 1 ml
- Ei korvausta.
ATC-koodi
J07BC01
Valmisteyhteenvedon muuttamispäivämäärä
26.02.2024
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
