BOOSTRIX injektioneste, suspensio, esitäytetty ruisku
Vaikuttavat aineet ja niiden määrät
Yksi annos (0,5 ml):
Difteriatoksoidi1 vähintään 2 kansainvälistä yksikköä (IU) (2,5 Lf)
Tetanustoksoidi1 vähintään 20 kansainvälistä yksikköä (IU) (5 Lf)
Bordetella pertussis antigeenit
Pertussistoksoidi1 8 mikrogrammaa
Filamenttihemagglutiniini1 8 mikrogrammaa
Pertaktiini1 2,5 mikrogrammaa
1 adsorboituna alumiinihydroksidiin (hydratoituun) (Al(OH)3) 0,3 milligrammaa Al3+
ja alumiinifosfaattiin (AlPO4) 0,2 milligrammaa Al3+
Rokote saattaa sisältää jäämiä formaldehydistä, jota käytetään valmistusprosessin aikana (ks. kohta Vasta-aiheet).
Apuaineiden täydellinen luettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
Boostrix on tarkoitettu tehosterokotukseen kurkkumätää (difteriaa), jäykkäkouristusta (tetanusta) ja hinkuyskää (pertussista) vastaan 4 vuoden iästä alkaen (katso kohta Annostus ja antotapa).
Boostrix on tarkoitettu myös lapsen passiiviseen suojaamiseen hinkuyskää vastaan varhaisessa imeväisiässä, kun äiti on rokotettu raskauden aikana (ks. kohdat Annostus ja antotapa, Raskaus ja imetys ja Farmakodynamiikka).
Boostrixin annon tulee perustua virallisiin suosituksiin.
Annostus ja antotapa
Annostus
Yhtä 0,5 ml:n rokoteannosta suositellaan.
Boostrix voidaan antaa 4 vuoden iästä alkaen.
Boostrix tulee antaa niiden virallisten suositusten ja/tai paikallisten käytäntöjen mukaisesti, jotka koskevat matala-annoksisen difteriatoksoidi-tetanustoksoidi-pertussisantigeeni-yhdistelmärokotteen antamista.
Boostrixia voidaan antaa raskaana oleville naisille raskauden toisen tai kolmannen kolmanneksen aikana virallisten suositusten mukaan (ks. kohdat Käyttöaiheet, Raskaus ja imetys ja Farmakodynamiikka).
Boostrix voidaan antaa myös osana kurkkumätä-, jäykkäkouristus- ja hinkuyskärokotusohjelmaa nuorille ja aikuisille, joiden rokotushistoria on tuntematon tai jotka ovat puutteellisesti rokotettuja kurkkumätää, jäykkäkouristusta ja hinkuyskää vastaan. Aikuisilla saatuun tietoon perustuen kahta lisäannosta kurkkumätä- ja jäykkäkouristusrokotetta suositellaan rokotteen aikaansaaman kurkkumätä- ja jäykkäkouristusvasteen maksimoimiseksi. Lisäannokset annetaan yhden ja kuuden kuukauden kuluttua ensimmäisestä annoksesta (ks. kohta Farmakodynamiikka).
Boostrixia voi käyttää tetanukselle altistavan vamman hoidossa henkilöillä, jotka aikaisemmin ovat saaneet perusrokotussarjan tetanustoksoidirokotteella ja joilla difterian ja pertussiksen tehosteannos on indikoitu. Tetanus immunoglobuliinia tulee antaa samanaikaisesti virallisten suositusten mukaan.
Uusintarokotus difteriaa, tetanusta ja pertussista vastaan tulee antaa virallisten suositusten mukaisin väliajoin (yleensä 10 vuotta).
Lapset
Boostrixin turvallisuutta ja tehoa ei ole osoitettu alle 4-vuotiailla lapsilla.
Antotapa
Boostrix annetaan pistoksena syvälle lihakseen, mieluiten hartialihaksen alueelle (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai jollekin apuaineelle, jotka on lueteltu kohdassa Apuaineet tai formaldehydille.
Yliherkkyys aikaisemman difteria-, tetanus- tai pertussisrokotukselle.
Boostrix on vasta-aiheinen henkilöillä, joilla on 7 vrk:n kuluessa edellisen pertussiskomponentin sisältävän rokotteen antamisesta ilmennyt tuntemattomasta syystä johtunut enkefalopatia. Tällaisissa tapauksissa pertussisrokotus tulee keskeyttää ja rokotuksia tulee jatkaa difteria- ja tetanusrokotteilla.
Boostrixia ei tule antaa henkilöille, joilla on ollut ohimenevää trombosytopeniaa tai neurologisia komplikaatioita (kouristukset tai hypotonis-hyporesponsiiviset episodit, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) aiemman difteria- ja/tai tetanusrokotuksen jälkeen.
Boostrix-rokotteen antamista, kuten rokottamista yleensäkin, tulee lykätä, jos potilaalla on vaikea akuutti kuumetauti. Lievä infektio ei ole vasta-aihe.
Varoitukset ja käyttöön liittyvät varotoimet
Potilaalta otetaan ennen rokottamista anamneesi (selvitetään etenkin aiemmat rokotukset ja mahdolliset haittatapahtumat).
Mikäli jonkin alla mainituista tapahtumista tiedetään olleen ajallisesti yhteydessä pertussiskomponentin sisältävään rokotukseen, tulee pertussisrokotteen antamista harkita tarkkaan.
- Kahden vuorokauden kuluessa rokotuksesta ilman muuta ilmeistä syytä esiintyvä ≥ 40,0 °C:n kuume.
- Tajunnanmenetys tai sokinkaltainen tila (hypotonis-hyporesponsiivinen episodi) 2 vuorokauden kuluessa rokotuksesta.
- Jatkuva, tyyntymätön itku ≥ 3 tunnin ajan 2 vuorokauden kuluessa rokotuksesta.
- Kouristuksia, joihin voi liittyä kuumetta, 3 päivän kuluessa rokotuksesta.
Joissakin tilanteissa, esim. kun pertussista on liikkeellä, mahdolliset hyödyt ovat suuremmat kuin mahdolliset haitat.
Kuten millä tahansa rokotteella, lapsen rokottamista tai rokottamatta jättämistä on harkittava ja riski-hyötysuhde huolellisesti punnittava, jos rokotettavalla ilmaantuu vaikea neurologinen sairaus tai sen pahenemisvaihe.
Kuten yleensäkin kun rokotus annetaan pistoksena, potilasta on seurattava harvinaisten anafylaktisten reaktioiden varalta rokotuksen jälkeen ja asianmukaisesta hoitovalmiudesta huolehdittava.
Boostrix on annettava varovasti, jos potilaalla on trombosytopenia (ks. myös 4.3) tai vuotohäiriö, koska lihaksensisäinen anto saattaa tällöin aiheuttaa verenvuotoa. Näissä tilanteissa rokote voidaan antaa ihon alle, mikäli tämä on paikallisten suositusten mukaista. Molempia antoreittejä käytettäessä pistoskohtaa painetaan napakasti (hieromatta) vähintään kaksi minuuttia.
Boostrixia ei saa missään tapauksessa antaa suoneen.
Aiempi tai suvussa esiintynyt kouristelutaipumus sekä suvussa ilmenneet difteria-tetanus-pertussis-(DTP) rokotuksen jälkeiset haittatapahtumat eivät ole vasta-aiheita.
HIV-infektiota ei pidetä vasta-aiheena. Odotettua immunologista vastetta ei ehkä saada rokotettaessa immunosuppressiopotilaita.
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Kaikilla rokotetuilla ei ehkä saavuteta suojaavaa immuunivastetta. Boostrix ei tässä suhteessa poikkea muista rokotteista.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Käyttö muiden rokotteiden tai immunoglobuliinien kanssa
Boostrix voidaan antaa samanaikaisesti ihmisen papilloomavirusrokotteiden kanssa. Kummankaan rokotteen komponenttien aikaansaamien vasta-aineiden välillä ei havaittu kliinisesti merkittäviä vuorovaikutuksia.
Boostrix voidaan antaa samanaikaisesti meningokokki seroryhmien A, C, W-135 ja Y (MenACWY) konjugaattirokotteiden kanssa. Kliinisten tutkimusten mukaan samanaikainen anto ei vaikuta jäykkäkouristus-, kurkkumätä- ja meningokokkiantigeenien aikaansaamiin immuunivasteisiin 9-25 -vuotiailla. Hinkuyskäantigeenien kohdalla havaittiin matalampia geometrisia keskiarvopitoisuuksia (GMC), mutta tulokset eivät viittaa kliinisesti merkittävään vaikutukseen.
Boostrixia voidaan antaa samanaikaisesti inaktivoitujen kausi-influenssarokotteiden kanssa, jotka eivät sisällä adjuvanttia. Kun Boostrixia annettiin samanaikaisesti kolmivalenttisen inaktivoidun influenssarokotteen kanssa 19 – 64 -vuotiaille henkilöille, kliiniset tiedot osoittivat, että immuunivasteet jäykkäkouristus-, kurkkumätä-, hinkuyskätoksiini- (PT) ja influenssa-antigeenejä vastaan säilyivät muuttumattomina. Matalampia geometrisia keskiarvopitoisuuksia (GMC) havaittiin filamenttihemagglutiniinin (FHA) ja pertaktiinin (PRN) antigeeneista; nämä tiedot eivät kuitenkaan viittaa kliinisesti merkittävään vaikutukseen. Ennalta määritetyssä eksploratiivisessa kohortissa ei havaittu eroja, kun rokotteita annettiin joko samanaikaisesti tai erikseen 65-vuotiaille ja sitä vanhemmille henkilöille.
Boostrixia voidaan antaa samanaikaisesti herpes zoster -rokotteen kanssa, joka ei sisällä eläviä taudinaiheuttajia. Kliiniset tiedot 50-vuotiailta ja sitä vanhemmilta henkilöiltä osoittivat, että immuunivasteet jäykkäkouristus-, kurkkumätä-, PT-, FHA- ja herpes zoster -antigeeneja vastaan säilyivät muuttumattomina. Matalampia geometrisia keskiarvopitoisuuksia (GMC) havaittiin PRN-antigeenista; nämä tiedot eivät kuitenkaan viittaa kliinisesti merkittävään vaikutukseen.
Boostrixin samanaikaista antoa muiden rokotteiden tai immunoglobuliinien kanssa ei ole tutkittu. Samanaikainen anto muiden inaktivoitujen rokotteiden tai immunoglobuliinien kanssa ei todennäköisesti vaikuta kliinisesti merkittävästi immuunivasteeseen.
Jos Boostrixin anto samanaikaisesti muiden rokotteiden tai immunoglobuliinien kanssa katsotaan välttämättömäksi, valmisteet tulee antaa eri injektiokohtiin yleisesti hyväksyttyjen käytäntöjen ja suositusten mukaan.
Käyttö immunosuppressiivisten hoitojen kanssa
Immunosuppressiivista hoitoa saavilla riittävää vastetta ei ehkä saavuteta, kuten ei muidenkaan rokotusten yhteydessä.
Raskaus ja imetys
Raskaus
Boostrixia voidaan käyttää raskauden toisen tai kolmannen kolmanneksen aikana virallisten suositusten mukaan.
Katso kohdasta Farmakodynamiikka tietoa liittyen hinkuyskän ehkäisyyn imeväisillä, joiden äidit on rokotettu raskauden aikana.
Satunnaistetussa kontrolloidussa kliinisessä tutkimuksessa (342 raskauden lopputulosta) ja prospektiivisessa havainnoivassa tutkimuksessa (793 raskauden lopputulosta) Boostrixia annettiin raskaana oleville naisille raskauden viimeisen kolmanneksen aikana. Näissä tutkimuksissa saadun turvallisuustiedon perusteella ei ole havaittu rokotteeseen liittyviä, raskauteen tai sikiön/vastasyntyneen lapsen terveyteen kohdistuvia haittavaikutuksia.
Prospektiivisista kliinisistä tutkimuksista ei ole turvallisuustietoja Boostrixin eikä Boostrix Polion käytöstä raskauden ensimmäisen ja toisen kolmanneksen aikana.
Raskauden viimeisen tai toisen kolmanneksen aikana Boostrix- tai Boostrix Polio ‑rokotuksen saaneilla naisilla tehdyssä passiivisessa seurannassa kertyneen tiedon perusteella ei ole havaittu rokotteeseen liittyviä, raskauteen tai sikiön/vastasyntyneen terveyteen kohdistuvia haittavaikutuksia.
Kuten muidenkaan inaktivoitujen rokotteiden Boostrix-rokotuksen ei odoteta vaikuttavan haitallisesti sikiöön raskauden minkään kolmanneksen aikana.
Eläintutkimukset eivät ole osoittaneet suoria tai epäsuoria vahingollisia vaikutuksia raskauteen, alkion tai sikiön kehitykseen, synnytykseen eikä postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetys
Boostrixin vaikutuksia imetyksen aikana ei ole arvioitu. Imeväiseen ei odoteta kohdistuvan riskiä, sillä Boostrix sisältää toksoideja tai inaktivoituja antigeeneja. Terveydenhuollon henkilökunnan on huolellisesti punnittava hyötyjä haittoja vastaan annettaessa Boostrixia imettäville äideille.
Hedelmällisyys
Prospektiivisista kliinisistä tutkimuksista ei ole tietoja ihmisellä. Eläintutkimukset eivät viittaa suoriin tai epäsuoriin haitallisiin vaikutuksiin naaraiden hedelmällisyydessä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Rokotteen ei pitäisi vaikuttaa ajokykyyn eikä koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto haittavaikutuksista
Alla esitetty turvallisuustieto perustuu kliinisistä tutkimuksista saatuihin tietoihin, joissa Boostrixia annettiin 839 lapselle (4−8-vuotiaat) ja 1931 aikuiselle, nuorelle ja lapselle (10−76-vuotiaat) (Taulukko 1).
Yleisimmät tapahtumat Boostrix-rokotuksen jälkeen olivat kummassakin ryhmässä injektiokohdan paikallisreaktiot (kipu, punoitus ja turvotus). Näitä raportoitiin molemmassa tutkimuksessa 23,7−80,6 %:lla. Yleensä oireet ilmaantuivat 48 tunnin sisällä rokotuksesta. Kaikki oireet menivät ohi ilman seuraamuksia.
Haittavaikutustaulukko
Haittavaikutukset on esitetty seuraavien frekvenssien mukaan:
Hyvin yleinen: > 1/10
Yleinen: > 1/100 ja < 1/10
Melko harvinainen: > 1/1000 ja < 1/100
Harvinainen: > 1/10000 ja < 1/1000
Hyvin harvinainen: < 1/10000
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
- Kliiniset lääketutkimukset
Taulukko 1: Boostrix-rokotteen kliinisissä tutkimuksissa raportoidut haittavaikutukset
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset | |
4 – 8 vuotiaat lapset (N=839) | 10 - 76 vuotiaat tutkimushenkilöt (N = 1931) | ||
Infektiot | Melko harvinaiset | ylähengitystieinfektiot | ylähengitystieinfektiot, nielutulehdus |
Veri ja imukudos | Melko harvinaiset | lymfadenopatia | |
Aineenvaihdunta ja ravitsemus | Yleiset | ruokahaluttomuus | |
Psyykkiset häiriöt | Hyvin yleiset | ärtyneisyys | |
Hermosto | Hyvin yleiset | uneliaisuus | päänsärky |
Yleiset | päänsärky | huimaus | |
Melko harvinaiset | huomiokyvyn häiriöt | pyörtyminen | |
Silmät | Melko harvinaiset | konjunktiviitti | |
Hengityselimet, rintakehä ja välikarsina | Melko harvinaiset | yskä | |
Ruoansulatuselimistö | Yleiset | ripuli, oksentelu, GI-kanavan häiriöt | pahoinvointi, GI-kanavan häiriöt |
Melko harvinaiset | ripuli, oksentelu | ||
Iho ja ihonalainen kudos | Melko harvinaiset | ihottuma | voimakas hikoilu, kutina, ihottuma |
Luusto, lihakset ja sidekudos | Melko harvinaiset | nivelkipu, lihaskipu, niveljäykkyys, lihaksiin ja luustoon liittyvä jäykkyys | |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset | injektiokohdan reaktiot (kuten punoitus ja/tai turvotus), injektiokohdan kipu, väsymys | Injektiokohdan reaktiot (kuten punoitus ja/tai turvotus), huonovointisuus, väsymys, injektiokohdan kipu |
Yleiset | kuume ≥ 37,5 °C mukaan lukien kuume > 39,0 °C, pistetyn raajan laajalle levinnyt turpoaminen (joka joskus on ulottunut läheiseen niveleen) | kuume (≥ 37,5 °C), injektiokohdan reaktiot (kuten injektiokohdan kovettuma ja steriili märkäpesäke) | |
Melko harvinaiset | Muut injektiokohdan reaktiot (kuten kovettuma), kipu | kuume (> 39,0 °C), influenssankaltainen sairaus, kipu | |
Reaktogeenisuus toistuvan annon jälkeen
146 henkilöltä saadut tiedot viittaavat siihen, että paikallisessa reaktogeenisuudessa (kipu, punoitus, turvotus) saattaa esiintyä pientä nousua, kun rokote annetaan uudelleen 0, 1 ja 6 kuukauden rokotusohjelmalla aikuisille (> 40-vuotiaille).
Tiedot viittaavat siihen, että Boostrixin tehosteannos saattaa lisätä paikallista reaktogeenisuutta henkilöillä, jotka ovat saaneet DTP-rokotteen lapsuusiässä.
- Markkinoille tulon jälkeinen seuranta
Frekvenssiä ei ole mahdollista arvioida luotettavasti, koska tapahtumat raportoitiin spontaanisti.
Taulukko 2: Boostrix-rokotteen markkinoilletulon jälkeisen seurannan aikana raportoidut haittavaikutukset
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Immuunijärjestelmä | ei tiedossa | Allergiset reaktiot, mukaan lukien anafylaktiset ja anafylaktoidiset reaktiot. |
Hermosto | ei tiedossa | Hypotonis-hyporesponsiivinen episodi, kouristukset (joihin voi liittyä kuumetta) |
Iho ja ihonalainen kudos | ei tiedossa | Urtikaria, angioedeema |
Yleisoireet ja antopaikassa todettavat haitat | ei tiedossa | Voimattomuus |
Tetanustoksoidi-rokotteen annon jälkeen on erittäin harvoin raportoitu keskus- ja ääreishermostoon kohdistuvia haittavaikutuksia, nouseva paralyysi tai jopa respiratorinen paralyysi (esim. Guillain−Barrén oireyhtymä) mukaan lukien.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Markkinoille tulon jälkeisessä seurannassa on raportoitu yliannostustapauksia. Raportoidut haittavaikutukset olivat yliannostuksen jälkeen samanlaiset kuin normaaliannostuksessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Bakteerirokotteet yhdistelmävalmisteina, ATC-koodi J07AJ52
Immuunivaste
Seuraavat suojaavat serokonversionopeudet havaittiin noin yhden kuukauden kuluttua Boostrix-tehosteannoksen jälkeen (Taulukko 3):
Taulukko 3: Immuunivaste lapsilla, nuorilla ja aikuisilla
Antigeeni | Vaste(1) | Aikuiset ja nuoret 10 vuoden iästä lähtien ATP(2) N=1694 (% rokotetuista) | Lapset 4 vuoden iästä lähtien ATP(2) N=415 (% rokotetuista) |
Difteria | > 0,1 IU/ml | 97,2 % | 99,8 % |
Tetanus | > 0,1 IU/ml | 99,0 % | 100 % |
Pertussis |
|
|
|
| Pertussistoksoidi | ≥ 5 EL.U/ml | 97,8 % | 99,0 % |
| Filamenttihemagglutiniini | 99,9 % | 100,0 % | |
| Pertaktiini | 99,4 % | 99,8 % |
(1) Vaste: Tiettynä ajankohtana suojaavaksi vasta-ainetasoiksi katsottiin difteria- ja tetanusvasta-aineiden pitoisuudet ≥ 0,1 IU/ml, seropositiivisiksi katsottiin pertussis-vasta-aineiden pitoisuudet ≥ 5 EL.U/ml
(2) ATP: Tutkimussuunnitelman mukaan – pitää sisällään kaikki ne loppuanalyysiin soveltuvat henkilöt, jotka olivat saaneet Boostrix-tehosteannoksen kerta-annoksena ja joilta oli saatavissa immunogeenisuustietoja ainakin yhden antigeenin osalta tiettynä ajankohtana.
(N) Minimimäärä henkilöitä, joista oli saatavissa tietoja jokaisesta antigeenista.
Nuorilla ja aikuisilla vertailututkimukset ovat osoittaneet, että kuukauden kuluttua rokotuksesta difterian vasta-ainetitterit ovat samanlaisia kuin annettaessa aikuistyypin Td-rokotetta, joka sisältää samoja antigeenejä kuin Boostrix; tetanuksen vasta-ainetitterit olivat pienempiä kuin aikuistyypin Td-rokotteiden yhteydessä.
Kuten muutkin aikuistyypin Td-rokotteet, Boostrix saa lapsilla ja nuorilla aikaan korkeammat anti-D- ja anti-T-vasta-ainetitterit kuin aikuisilla.
Immuunivasteen säilyminen
Seuraavat suojaavat vasta-ainetasot/seropositiivisuudet on havaittu 3–3,5 ja 5-6 ja 10 vuoden kuluttua ensimmäisestä Boostrix-rokotuksesta henkilöillä, jotka rokotettiin tutkimussuunnitelman mukaan (ATP1) (Taulukko 4).
Taulukko 4: Immuunivasteen säilyminen lapsilla, nuorilla ja aikuisilla
Antigeeni | Vaste(2) | Aikuiset ja yli 10-vuotiaat nuoret (% rokotetuista) | |||||
Vasta-aineiden säilyminen 3−3.5 vuotta | Vasta-aineiden säilyminen 5 vuotta | Vasta-aineiden säilyminen 10 vuotta | |||||
Aikuiset(3) (N=309) | Nuoret(3) (N=261) | Aikuiset(3) (N=232) | Nuoret(3) (N=250) | Aikuiset(3) (N=158) | Nuoret(3) (N=74) | ||
Difteria | ≥ 0.1 IU/ml | 71,2 % | 91,6 % | 84,1 % | 86,8 % | 64,6 % | 82,4 % |
≥ 0.016 IU/ml(4) | 97,4 % | 100 % | 94,4 % | 99,2 % | 89,9 % | 98,6 % | |
Tetanus | ≥ 0.1 IU/ml | 94,8 % | 100 % | 96,2 % | 100 % | 95,0 % | 97,3 % |
Pertussis | |||||||
| Pertussistoksoidi | ≥ 5 EL.U/ml | 90,6 % | 81,6 % | 89,5 % | 76,8 % | 85,6 % | 61,3 % |
Filamenttihemagglutiniini | 100 % | 100 % | 100 % | 100 % | 99,4 % | 100 % | |
| Pertaktiini | 94,8 % | 99,2 % | 95,0 % | 98,1 % | 95,0 % | 96,0 % | |
(1)ATP: Tutkimussuunnitelman mukaan – pitää sisällään kaikki soveltuvat henkilöt, jotka olivat saaneet yhden Boostrix-tehosteannoksen ja joiden immunogeenisuustiedot olivat saatavilla ainakin yhden antigeenin osalta tiettynä ajankohtana.
(2)Vaste: Tiettynä ajankohtana suojaavaksi vasta-ainetasoiksi katsottiin difteria- ja tetanusvasta-aineiden pitoisuudet ≥ 0,1 IU/ml, seropositiivisiksi katsottiin pertussis-vasta-aineiden pitoisuudet ≥ 5 EL.U/ml
(3) Käsitteet ”aikuinen” ja ”nuori” viittaavat ikään, jolloin henkilöt saivat ensimmäisen Boostrix-annoksen.
(4)Niiden henkilöiden prosentuaalinen osuus, joilla vasta-aineiden pitoisuudet liittyivät suojaan tautia vastaan (≥ 0,1 IU/ml ELISA-menetelmällä tai ≥ 0,016 IU/ml in vitro Vero-solujen neutralisaatiomenetelmällä)
N= Minimimäärä henkilöitä, joista oli saatavilla tiedot jokaiselle antigeenille.
Seuraavat suojaavat vasta-ainetasot/seropositiivisuudet on havaittu 3–3,5 ja 5-6 vuoden kuluttua ensimmäisestä Boostrix-rokotuksesta henkilöillä, jotka rokotettiin tutkimussuunnitelman mukaan (ATP1):
Antigeeni | Vaste(2) | Yli 4-vuotiaat lapset (% rokotetuista) | |
Vasta-aineiden säilyminen 3−3.5 vuotta | Vasta-aineiden säilyminen 5−6 vuotta | ||
(N=118) | (N=68) | ||
Difteria | ≥ 0.1 IU/ml | 97,5 % | 94,2 % |
≥ 0.016 IU/ml(3) | 100 % | Määrittämätön | |
Tetanus | ≥ 0.1 IU/ml | 98,4 % | 98,5 % |
Pertussis | |||
| Pertussis toksoidi | ≥ 5 EL.U/ml | 58,7 % | 51, 5 % |
Filamenttihemagglutiniini | 100 % | 100 % | |
| Pertaktiini | 99,2 % | 100 % | |
(1)ATP: Tutkimussuunnitelman mukaan – pitää sisällään kaikki soveltuvat henkilöt, jotka olivat saaneet yhden Boostrix-tehosteannoksen ja joiden immunogeenisuustiedot olivat saatavilla ainakin yhden antigeenin osalta tiettynä ajankohtana.
(2)Vaste: Tiettynä ajankohtana suojaavaksi vasta-ainetasoiksi katsottiin difteria- ja tetanusvasta-aineiden pitoisuudet ≥ 0,1 IU/ml, seropositiivisiksi katsottiin pertussisvasta-aineiden pitoisuudet ≥ 5 EL.U/ml
(3)Niiden henkilöiden prosentuaalinen osuus, joilla vasta-aineiden pitoisuudet liittyivät suojaan tautia vastaan (≥ 0,1 IU/ml ELISA-menetelmällä tai ≥ 0,016 IU/ml in vitro Vero-solujen neutralisaatiomenetelmällä)
N= Minimimäärä henkilöitä, joista oli saatavilla tiedot jokaiselle antigeenille.
Suoja hinkuyskää vastaan
Boostrixin sisältämät pertussisantigeenit sisältyvät lasten soluttomaan pertussisyhdistelmärokotteeseen (Infanrix), jonka osalta perusrokotuksen tehokkuus on osoitettu samassa taloudessa elävien kesken tehdyssä tehokkuustutkimuksessa. Kaikkien kolmen pertussiskomponentin vasta-ainetitterit ovat Boostrix-rokotuksen jälkeen suuremmat kuin samassa perheessä asuvilla tehdyssä tehokkuustutkimuksessa havaitut. Näiden vertailujen perusteella Boostrix voi suojata pertussista vastaan, mutta tämän rokotteen antaman suojan aste ja kesto ovat määrittämättä.
Passiivinen suoja hinkuyskää vastaan imeväisillä (alle 3 kuukauden ikäisillä), joiden äidit on rokotettu raskauden aikana
Satunnaistetussa, lumekontrolloidussa, vaihtovuoroisessa tutkimuksessa osoitettiin, että napanuoraveren hinkuyskävasta-ainepitoisuudet olivat suuremmat Boostrix-rokotteen (dTpa-ryhmä; N=291) saaneiden äitien lapsilla kuin lumevalmistetta (kontrolliryhmä; N = 292) saaneiden äitien lapsilla, kun rokotukset annettiin raskausviikolla 27-36. Napanuoraveren hinkuyskän PT-, FHA- ja PRN-antigeeneja torjuvien vasta-aineiden pitoisuuksien geometriset keskiarvot olivat dTpa-ryhmässä 46,9, 366,1 ja 301,8 IU/ml ja 5,5, 22,7 ja 14,6 IU/ml kontrolliryhmässä. Tämä vastaa vasta-ainetittereita, jotka ovat 8, 16 ja 21 kertaa suuremmat rokotettujen äitien vauvojen napanuoraveressäkuin kontrolliryhmässä. Havainnoivissa vaikuttavuustutkimuksissa on todettu, että nämä vasta-ainetitterit voivat antaa passiivisen suojan hinkuyskää vastaan.
Immunogeenisuus imeväisillä ja taaperoilla, joiden äidit on rokotettu raskauden aikana
Kahdessa kliinisessä tutkimuksessa tutkittiin Infanrix hexan (kurkkumätä-, jäykkäkouristus-, hinkuyskä-, hepatiitti B, inaktivoitu poliomyeliitti ja tyypin B Haemophilus influenzae konjugaattirokote) immunogeenisuutta imeväisillä ja taaperoilla, jotka ovat syntyneet terveille äideille, jotka oli rokotettu Boostrixilla raskausviikkoina 27-36.
Infanrix hexaa annettiin yhdessä 13-valenttisen pneumokokkikonjugaattirokotteen kanssa imeväisille perusrokotuksena (n=268); ja samalle imeväiselle/taaperolle 11-18 kuukauden iässä tehosterokotuksena (n=229).
Perusrokotuksen ja tehosterokotuksen jälkeen tutkimusten immunologiset tiedot eivät osoittaneet, että äidin Boostrix-rokotus vaikuttaisi kliinisesti merkittävästi imeväisen/taaperon vasteeseen kurkkumätä-, jäykkäkouristus-, hepatiitti B-, tyypin B Haemophilus influenzae- tai pneumokokkiantigeeneja vastaan tai inaktivoitua poliovirusta vastaan.
Imeväisillä ja taaperoilla, joiden äidit ovat saivat Boostrix-rokotuksen raskauden aikana, havaittiin alhaisemmat vasta-ainekonsentraatiot hinkuyskän antigeeneja vastaan perusrokotuksen (PT, FHA ja PRN) ja tehosterokotuksen (PT, FHA) jälkeen. Hinkuyskävasta-ainepitoisuuksien nousun kertaluokka tehosterokotusta edeltävältä tasolta kuukausi tehosterokotuksen jälkeen mitattuun tasoon oli samaa luokkaa raskauden aikana Boostrix-rokotuksen tai plaseboa saaneiden äitien imeväisillä ja taaperoilla, mikä osoittaa immuunijärjestelmän tehokkaan vahvistumisen. Havainnon korrelaatiosta hinkuyskältä suojautumisen kanssa ei ole tietoa, joten havaintojen kliinistä merkitystä ei täysin tunneta. Tämänhetkiset, raskaudenaikaisen dTpa-immunisaation aloittamisen jälkeiset hinkuyskää koskevat epidemiologiset tiedot eivät kuitenkaan viittaa siihen, että tällä immunologisella interferenssillä olisi kliinistä merkitystä.
Suoja hinkuyskää vastaan imeväisillä, joiden äidit on rokotettu raskauden aikana
Boostrix tai Boostrix Polio rokotteen tehokkuus arvioitiin kolmessa havainnointitutkimuksessa Isossa-Britanniassa, Espanjassa ja Australiassa. Rokote annettiin osana raskausajan rokoteohjelmaa raskauden viimeisellä kolmanneksella, tarkoituksena suojata alle 3 kuukauden ikäiset imeväiset hinkuyskää vastaan.
Tutkimuksien yksityiskohtaiset tiedot ja tulokset on esitetty taulukossa 5.
Taulukko 5: Tehokkuus hinkuyskää vastaan alle 3 kuukauden ikäisillä imeväisillä, joiden äidit ovat saaneet Boostrix/Boostrix Polio rokotteen raskauden viimeisellä kolmanneksella.
Tutkimuspaikka | Rokote | Tutkimusmenetelmä | Rokotteen tehokkuus |
Iso-Britannia | Boostrix Polio | Retrospektiivinen, seulontamenetelmä | 88 % (95 % CI: 79; 93) |
Espanja | Boostrix | Prospektiivinen, tapaus-verrokkitutkimus | 90,9 % (95 % CI: 56,6; 98,1) |
Australia | Boostrix | Prospektiivinen, tapaus-verrokkitutkimus | 69 % (95 % CI: 13; 89) |
CI: luottamusväli
Jos raskaana oleva äiti rokotetaan kahden viikon sisällä ennen lapsen syntymää, rokotteen tehokkuus syntyvällä lapsella saattaa olla matalampi kuin taulukossa on ilmoitettu.
Immuunivaste Boostrix uusintarokotuksen jälkeen
Boostrixin immunogeenisuutta on arvioitu henkilöillä, joille Boostrix annettiin 10 vuoden kuluttua aikaisemmasta matala-annoksisesta difteria, tetanus ja pertussis (soluton)-rokotteen tehosteannoksesta. Yhden kuukauden kuluttua rokotuksesta > 99 % henkilöistä oli seropositiivisia pertussista vastaan. Suojaavat vasta-ainetasot mitattiin difterialle ja tetanukselle.
Immuunivaste henkilöillä, joilla aikaisemmat rokotukset puuttuvat tai joiden aikaisemmat rokotukset eivät ole tiedossa
Yhden Boostrix-annoksen antaminen 83 nuorelle, jotka olivat 11−18-vuotiaita ja jotka eivät aikaisemmin olleet saaneet mitään rokotusta hinkuyskää vastaan ja jotka eivät olleet saaneet kurkkumätä- ja jäykkäkouristusrokotusta viimeisen 5 vuoden aikana, sai aikaan suojaavat vasta-ainetasot (seroprotektio) kurkkumätää ja jäykkäkouristusta vastaan kaikilla rokotetuilla. Yhden annoksen jälkeen seropositiivisuusaste eri pertussisantigeeneille vaihteli 87 %:n ja 100 %:n välillä.
Yksi Boostrix-annos annettuna 139 aikuiselle sai aikaan seropositiivisuuden kaikille pertussis-antigeeneille 98,5 %:lla koehenkilöistä ja suojaavan vasta-ainetason kurkkumädälle 81,5 %:lla ja jäykkäkouristukselle 93,4 %:lla. Koehenkilöt olivat ≥ 40-vuotiaita ja he eivät olleet saaneet mitään rokotusta kurkkumätää eikä jäykkäkouristusta vastaan viimeisten 20 vuoden aikana. Kahden lisäannoksen jälkeen (0, 1 ja 6 kuukauden rokotusohjelmalla) seropositiivisuudet olivat 100 %:lla kaikille kolmelle pertussisantigeenille ja suojaavat vasta-ainetasot olivat kurkkumädälle 99,3 %:lla ja jäykkäkouristukselle 100 %:lla.
Immuunivaste ja turvallisuusprofiili potilailla, jotka saavat aktiivista hoitoa obstruktiivisiin hengitystiesairauksiin
Boostrixin turvallisuutta ja immunogeenisyyttä on arvioitu kuvailevassa meta-analyysitutkimuksessa, jossa yhdistettiin 222 koehenkilön tiedot, jotka olivat ≥ 18-vuotiaita ja jotka olivat saaneet Boostrix rokotteen ollessaan obstruktiivisen hengitystiesairauden, kuten astman tai keuhkoahtaumataudin (COPD) vuoksi aktiivisessa hoidossa. Kuukausi Boostrix-annoksen jälkeen immuunivasteen suojaavat vasta-ainetasot (≥ 0,1 IU/ml) olivat kurkkumätä- ja jäykkäkouristusantigeeneja vastaan 89,0 % ja 97,2 %, ja hinkuyskää vastaan tehostevasteen osalta 78,3 %, 96,1 % ja 92,2 % hinkuyskätoksiinia (PT), filamenttihemagglutiniinia (FHA) ja pertaktiinia (PRN) vastaan, vastaavasti. Tulokset ovat yhdenmukaisia koko aikuisväestöstä saatujen tulosten kanssa, ja niillä on samanlainen turvallisuusprofiili.
Farmakokinetiikka
Rokotteilta ei vaadita farmakokineettisten ominaisuuksien arviointia.
Prekliiniset tiedot turvallisuudesta
Lisääntymistoksisuus
Hedelmällisyys
Ei-kliiniset tiedot Boostrixilla eivät tuoneet ilmi mitään erityistä riskiä ihmisille. Päätelmät perustuvat tavanomaisiin naaraan hedelmällisyystutkimuksiin rotilla ja kaniineilla.
Raskaus
Ei-kliiniset tiedot Boostrixilla eivät tuoneet ilmi mitään erityistä riskiä ihmiselle. Päätelmät perustuvat tavanomaisiin alkio-sikiö-kehitysvaiheen tutkimuksiin rotilla ja kaneilla sekä synnytykseen ja postnataalivaiheen kohdistuviin toksisuustutkimuksiin rotilla (imetyksen loppuun asti).
Eläintoksisuus ja/tai farmakologia
Prekliinisten tietojen mukaan ihmiseen ei kohdistu erityisiä haittavaikutuksia tavanomaisten turvallisuutta ja toksisuutta koskevien tutkimusten perusteella.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Injektionesteisiin käytettävä vesi
Adjuvantit, ks. kohta Vaikuttavat aineet ja niiden määrät.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
4 vuotta
Säilytys
Säilytä jääkaapissa (2 °C−8 °C).
Säilyvyystutkimukset osoittavat, että Boostrix säilyy 7 päivän ajan korkeintaan 37 °C lämpötilassa. Tämän ajanjakson päättyessä Boostrix on käytettävä tai hävitettävä. Nämä tiedot on tarkoitettu vain terveydenhuollon ammattilaisten avuksi tilanteessa, jossa säilytyslämpötiloista poiketaan tilapäisesti.
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BOOSTRIX injektioneste, suspensio, esitäytetty ruisku
0,5 ml (34,15 €)
PF-selosteen tieto
0,5 ml suspensio esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki.
Pakkauskoot 1 ja 10, neuloilla tai ilman neuloja.
Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa ovat valmistettu synteettisestä kumista.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Boostrix on samea, valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Ennen käyttöä rokotteen on annettava lämmetä huoneenlämpöiseksi ja rokotetta on ravistettava hyvin, jotta saadaan homogeeninen, sameanvalkoinen suspensio. Ennen rokottamista rokote on tarkastettava silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta ennen antamista. Jos jompikumpi havaitaan, rokotetta ei saa antaa.
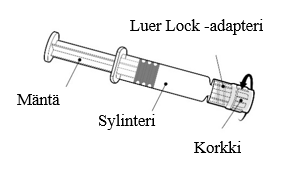
Esitäytetyn ruiskun käyttöohje
| Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
| Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys:
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BOOSTRIX injektioneste, suspensio, esitäytetty ruisku
0,5 ml
- Ei korvausta.
ATC-koodi
J07AJ52
Valmisteyhteenvedon muuttamispäivämäärä
27.06.2023
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi