PRIORIX injektiokuiva-aine ja liuotin, liuosta varten
Vaikuttavat aineet ja niiden määrät
Jokainen 0,5 ml annos valmiiksi saatettua rokotetta sisältää:
Elävää heikennettyä tuhkarokkovirusta1 (Schwarz-kantaa) vähintään 103.0 CCID503
Elävää heikennettyä sikotautivirusta1 (RIT 4385, tuotettu Jeryl Lynn-kannasta)
vähintään 103.7 CCID50 3
Elävää heikennettyä vihurirokkovirusta2 (Wistar RA 27/3-kantaa) vähintään 103.0 CCID50 3
1 Tuotettu kananalkionkudosviljelmissä
2 Tuotettu MRC-5 ihmisen diploidisoluviljelmissa
3 Cell Culture Infective Dose 50 %
Tämä rokote sisältää neomysiiniä jäämäaineena. Ks. kohta Vasta-aiheet
Apuaineet, joiden vaikutus tunnetaan
Rokote sisältää 9 mg sorbitolia.
Rokote sisältää 6,5 nanogrammaa para-aminobentsoehappoa per annos ja 334 mikrogrammaa fenyylialaniinia per annos (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin liuosta varten, esitäytetty ruisku
Kliiniset tiedot
Käyttöaiheet
Yli 9 kuukauden ikäisten lasten, nuorten ja aikuisten aktiivinen immunisaatio tuhkarokkoa, sikotautia ja vihurirokkoa vastaan.
Käyttö 9−12 kuukauden ikäisillä lapsilla, ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka.
Annostus ja antotapa
Annostus
Priorixia tulee käyttää virallisten suositusten mukaan.
12 kuukauden ikäiset tai sitä vanhemmat henkilöt
Annos on 0,5 ml. Toinen annos tulee antaa virallisten suositusten mukaan.
Priorix voidaan antaa henkilöille, jotka aikaisemmin ovat saaneet toista monovalenttista tai yhdistetettyä tuhkarokko-, sikotauti- ja vihurirokkorokotetta.
9−12-kuukauden ikäiset lapset
Ensimmäisenä ikävuotena lapset saattavat reagoida puutteellisesti rokotteen komponenteille. Jos epidemiologinen tilanne (epidemia tai matka endeemiselle alueelle) edellyttää rokottamista ensimmäisenä ikävuotena, toinen Priorix-annos tulee antaa toisena elinvuonna, mieluiten kolmen kuukauden sisällä ensimmäisestä annoksesta. Annosväli ei saa missään tapauksessa olla lyhyempi kuin neljä viikkoa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Alle 9 kuukauden ikäiset lapset
Priorixin turvallisuutta ja tehoa alle 9 kuukauden ikäisillä lapsilla ei ole osoitettu.
Antotapa
Priorix on tarkoitettu annettavaksi injektiona ihon alle, mutta se voidaan antaa myös injektiona lihakseen, hartialihaksen alueelle tai reiden etu-ulkosyrjään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Rokote on mieluiten annettava ihon alle potilailla, joilla on trombosytopenia tai koagulaatiohäiriö (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Ohjeet lääkevalmisteen saattamisesta käyttökuntoon, ks. kohta Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai jollekin kohdassa Apuaineet luetellulle apuaineelle tai neomysiinille. Neomysiinin aiheuttama kosketusihottuma ei ole vasta-aihe. Kananmunan proteiinin yliherkkyys: ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Samanaikainen tai äskettäin saatu immunosuppressiivinen hoito (myös suuriannoksinen kortikosteroidihoito). Priorix ei ole vasta-aiheinen henkilöillä, jotka saavat kortikosteroideja paikallisesti tai pieninä annoksina parenteraalisesti (esim. astman estohoito tai korvaushoito) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.).
Vaikea humoraalinen tai sellulaarinen (primaarinen tai hankittu) immuunikatotila, esim. SCID-oireyhtymä, agammaglobulinemia ja AIDS tai symptomaattinen HIV-tartunta tai ikäspesifinen CD4+ T-lymfosyytti % alle 12-kuukauden ikäisillä lapsilla: CD4+ <25 %; 12−35-kuukauden ikäisillä lapsilla: CD4+ < 20 %; 36−59-kuukauden ikäisillä lapsilla: CD4+ <15 % (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus. Lisäksi raskautta on vältettävä 1 kuukausi rokotuksen jälkeen (ks. kohta Raskaus ja imetys).
Priorix-rokotteen antamista, kuten muitakin rokotuksia, on lykättävä, jos rokotettavalla on akuutti vaikea kuumesairaus. Lievät infektiot, kuten nuhakuume, eivät kuitenkaan ole rokotuksen vasta-aiheita.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Kuten kaikkia injisoitavia rokotteita käytettäessä, asianmukainen hoitovalmius ja valvonta ovat tarpeen rokotteen aiheuttamien harvinaisten anafylaktisten tapahtumien varalta.
Alkoholin ja muiden desinfektioaineiden on annettava haihtua iholta ennen rokoteinjektion antamista, sillä ne voivat inaktivoida rokotteen sisältämät heikennetyt virukset.
Ensimmäisenä ikävuotena lapset eivät ehkä reagoi riittävän tehokkaasti rokotteen komponentteihin, koska heidän elimistössään saattaa olla vielä äidiltä saatuja vasta-aineita (Ks. kohta Annostus ja antotapa ja Farmakodynamiikka).
Priorixin annon yhteydessä on noudatettava varovaisuutta, jos rokotettavalla on keskushermoston häiriö, kuumekouristustaipumusta tai kouristuksia sukuanamneesissa, Kuumekouristustaipumusta omaavia henkilöitä on seurattava tarkoin.
Rokotteen tuhkarokko- ja sikotautikomponentit tuotetaan kananalkiosoluviljelmissä ja voivat siksi sisältää kananmunan proteiinijäämiä. Henkilöt, joille ravinnon sisältämä kananmuna on aikaisemmin aiheuttanut anafylaktisen, anafylaktoidisen tai muun välittömän reaktion (esim. yleistyneen urtikarian, suun ja kurkun turpoamisen, hengitysvaikeuden, hypotension tai shokin), muodostavat riskiryhmän, sillä heillä rokotuksen aiheuttama välittömien yliherkkyysreaktioiden esiintyminen saattaa olla suurentunut. Edellä mainitut reaktiot ovat kuitenkin osoittautuneet hyvin harvinaisiksi. Aikaisempi ravinnon kananmunan aiheuttama anafylatinen reaktio edellyttää rokotustilanteessa erityisen suurta varovaisuutta ja tällaisen reaktion asianmukainen hoitovalmius on oltava saatavilla siltä varalta, että vastaava reaktio esiintyisi.
Suoja tuhkarokkoa vastaan voi olla heikompi, jos rokotus tapahtuu 72 tunnin sisällä luonnollisesta tuhkarokkoaltistuksesta.
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Kuten muillakin rokotteilla, suojaavaa vasta-ainetasoa ei ehkä saavuteta kaikilla rokotetuilla.
PRIORIX-ROKOTETTA EI SAA MISSÄÄN OLOSUHTEISSA ANTAA SUONEEN.
Trombosytopenia
Trombosytopenian pahenemista tai uudelleen ilmaantumista on raportoitu henkilöillä, joille ensimmäinen tuhkarokko-, sikotauti- ja vihurirokkorokotus elävällä kannalla aiheutti trombosytopeniaa. MMR-rokotteeseen liittyvä trombosytopenia on harvinainen ja paranee yleensä itsestään. Potilailta, joilla on trombosytopenia tai joilla aikaisempi tuhkarokko-, sikotauti- tai vihurirokkorokotus on aiheuttanut trombosytopeniaa, tulee rokotta vain huolellisen riski-hyöty-suhdearvioinnin jälkeen. Huolellisuutta on noudatettava ja rokotus on näille potilaille annettava mieluiten ihon alle.
Immuunivajauspotilaat
Rokotusta voidaan harkita potilailla, joilla on tiettyjä immuunikatotiloja, jos hyödyt katsotaan suuremmiksi kuin riskit (esim. oireettomat HIV-kantajat, IgG alaryhmän puutostilat, synnynnäinen neutropenia, krooninen granulomatoottinen tauti ja komplementtipuutostaudit.
Immuunikatopotilaat, joilla tämä rokotus (ks. kohta Vasta-aiheet) ei ole vasta-aiheinen, eivät ehkä reagoi rokotukseen yhtä hyvin kuin immunokompetentit henkilöt. Jotkut näistä potilaista saattavat saada tuhkarokko-, sikotauti- tai vihurirokkotartunnan asianmukaisesta rokotuksesta huolimatta. Näitä potilaita on seurattava huolellisesti tuhkarokko-, sikotauti- ja vihurirokko-oireiden varalta. Priorix -rokotuksen ja immunosuppressiivisen hoidon välisen ajan pituuteen on kiinnitettävä huomiota rokotevasteen mahdollisen heikentymisriskin ja/tai tautien mahdollisen disseminoitumisriskin vuoksi (ks. kohta Vasta-aiheet).
Transmissio
Rokotettujen ei ole koskaan havaittu levittäneen tuhkarokko- ja sikotautivirusta tartunnalle alttiisiin kontakteihin. Vihurirokko- ja tuhkarokkovirusta erittyy nieluun 7−28 päivän ajan rokotuksen jälkeen ja runsaimmin noin 11 päivän kuluttua rokottamisesta. Näiden erittyneiden rokotevirusten ei ole kuitenkaan havaittu levinneen tartunnalle alttiisiin kontaktihenkilöihin. Vihurirokkorokotteen virusta on havaittu siirtyvän pikkulapsiin rintamaidon ja istukan kautta ilman mitään todisteita kliinisestä taudista.
Apuaineet, joiden vaikutus tunnetaan
Priorix sisältää para-aminobentsoehappoa. Se voi aiheuttaa allergisia reaktioita (mahdollisesti viivästyneitä) ja poikkeustapauksissa bronkospasmia.
Rokote sisältää 334 mikrogrammaa fenyylialaniinia per annos. Fenyylialaniini voi olla haitallista henkilöille, joilla on fenyyliketonuria (PKU).
Rokote sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Rokote sisältää kaliumia alle 1 mmol (39 mg) per annos eli sen voidaan sanoa olevan ”kaliumiton”.”
Yhteisvaikutukset
Kliiniset tutkimukset ovat osoittaneet, että Priorix voidaan antaa samanaikaisesti minkä tahansa seuraavan monovalenttisen tai yhdistelmärokotteen kanssa (mukaan lukien heksavalenttinen DTaP-HBV-IPV/Hib-rokote): kurkkumätä-, jäykkäkouristus- ja soluton hinkuyskärokote (DTaP), kurkkumätä-, jäykkäkouristus- ja soluton hinkuyskärokote (DTaP) kevennetyllä antigeenilla, Haemophilus influenzae tyyppi b rokote (Hib), inaktivoitu poliorokote (IPV), hepatiitti B -rokote (HBV), hepatiitti A -rokote (HAV), meningokokki seroryhmä B -rokote (MenB), konjugoitu meningokokki seroryhmä C -rokote (MenC), konjugoitu meningokokki seroryhmät A-, C-, W-135- ja Y-rokote (MenACWY), varicella-zoster-rokote (VZV), oraalinen poliorokote (OPV) ja konjugoitu pneumokokkirokote paikallisten ohjeiden mukaan.
Kun Bexsero-rokotetta annettiin samanaikaisesti tuhkarokko-, sikotauti-, vihurirokko- ja vesirokkoyhdistelmärokotteen (MMR-V) kanssa, kuumeen, injektiokohdan arkuuden, ruokailutottumusten muutosten ja ärtyisyyden riski lisääntyi. Siksi erillistä rokotusta Priorix-rokotteella voidaan harkita mikäli mahdollista.
Tiedot puuttuvat Priorixin ja muiden rokotteiden samanaikaisesta annosta.
Jos Priorix-rokotetta annetaan samanaikaisesti toisen injektoitavan rokotteen kanssa, rokotteet tulee aina antaa eri injektiokohtiin.
Ellei Priorix-rokotetta anneta samanaikaisesti muiden eläviä heikennettyjä viruksia sisältävien rokotteiden kanssa, rokotusvälin on oltava vähintään yksi kuukausi.
Mikäli tuberkuliinikoe aiotaan tehdä, se olisi tehtävä ennen rokotusta tai sen yhteydessä, sillä elävä tuhkarokko-, sikotauti- ja vihurirokkoyhdistelmärokote saattaa heikentää tilapäisesti tuberkuliinin aiheuttamaa ihoreaktiota. Tämä anergia saattaa kestää enimmillään 6 viikkoa rokotuksen jälkeen, eikä tuberkuliinikoetta pitäisi tehdä tänä aikana rokottamisen jälkeen väärien negatiivisten tulosten välttämiseksi.
Mikäli rokotettava on saanut ihmisen gammaglobuliineja tai verensiirron, rokottamista on lykättävä kolme kuukautta tai pidempään (aina 11 kuukauteen asti) riippuen annetusta ihmisen globuliiniannoksesta, sillä passiivisesti saadut tuhkarokko-, sikotauti- ja vihurirokkovasta-aineet saattavat estää rokotussuojan kehittymisen.
Raskaus ja imetys
Hedelmällisyys
Priorixilla ei ole tehty hedelmällisyystutkimuksia.
Raskaus
Raskaana olevia naisia ei saa rokottaa Priorixilla.
Priorixin käyttöä ei ole tutkittu raskaana olevilla naisilla.
Katsauksessa yli 3 500 naisesta, jotka eivät tienneet vielä olevansa raskaana altistuessaan alkuraskauden aikana vihurirokkovirusta sisältävälle rokotteelle, ei todettu tapauksia, joissa lapsella olisi ilmoitettu synnynnäinen vihurirokko-oireyhtymä. Myöhemmässä markkinoille tulon jälkeisessä seurannassa havaittiin rokotteessa käytettyyn vihurirokkoviruskantaan (Wistar RA 27/3) liittynyt synnynnäinen vihurirokko-oireyhtymä, kun raskaana oleva nainen oli tahattomasti rokotettu tuhkarokko/sikotauti/vihurirokko-rokotteella.
Sikiövaurioita ei ole todettu, kun tuhkarokko- tai sikotautirokotteita on annettu raskaana oleville naisille.
Raskautta on vältettävä 1 kuukausi rokotuksen jälkeen. Raskautta suunnittelevia naisia tulee neuvoa siirtämään raskautta myöhemmäksi.
Imetys
Priorixin käytöstä imetyksen aika on rajoitetusti tietoa. Tutkimukset ovat kuitenkin osoittaneet, että synnytyksen jälkeen imettävillä naisilla, joille on annettu elävää, heikennettyä vihurirokkorokotetta, virus saattaa erittyä äidinmaitoon ja siirtyä imeväiseen ilman todisteita mistään symptomaattisesta sairaudesta. Vain lapsen todettu tai epäilty immuunivajaus edellyttää riski-hyöty-suhteen arviointia, jos äiti halutaan rokottaa (ks. kohta Vasta-aiheet).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Priorix ei vaikuta ollenkaan tai vaikuttaa mitättömän vähän autolla-ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Haittavaikutusten yhteenveto
Alla oleva haittavaikutusprofiili perustuu Priorixin kliinisissä tutkimuksissa kaiken kaikkiaan noin 12000 koehenkilöltä saatuihin tietoihin.
Tuhkarokko-, sikotauti- ja vihurirokkoyhdistelmärokotteen käytön yhteydessä mahdollisesti esiintyvät haittavaikutukset ovat samoja kuin käytettäessä monovalenttisia rokotteita yksinään tai yhdessä.
Kontrolloiduissa kliinisissä tutkimuksissa seurattiin aktiivisesti oireita ja löydöksiä 42 vuorokauden ajan. Rokotettuja kehotettiin myös ilmoittamaan kaikista kliinisistä tapahtumista tutkimusjakson aikana.
Tavallisimmat haittavaikutukset Priorix-annon jälkeen olivat injektiokohdan punoitus ja kuume ≥ 38 °C (peräaukko) tai ≥ 37,5 °C (kainalo/suu).
Haittavaikutustaulukko
Haittavaikutusten frekvenssit raportoidaan seuraavasti:
Hyvin yleiset: > 1/10
Yleiset: > 1/100 ja < 1/10
Melko harvinaiset: > 1/1000 ja < 1/100
Harvinaiset: > 1/10000 ja < 1/1000
Kliiniset tutkimukset
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
| Infektiot | Yleiset | Ylähengitystieinfektio |
| Melko harvinaiset | Välikorvan tulehdus | |
| Veri ja imukudos | Melko harvinaiset | Lymfadenopatia |
| Immuunijärjestelmä | Harvinaiset | Allergiset reaktiot |
| Aineenvaihdunta ja ravitsemus | Melko harvinaiset | Ruokahaluttomuus |
| Psyykkiset häiriöt | Melko harvinaiset | Hermostuneisuus, epätavallinen itku, unettomuus |
| Hermosto | Harvinaiset | Kuumekouristukset |
| Silmät | Melko harvinaiset | Konjunktiviitti |
| Hengityselimet, rintakehä ja välikarsina | Melko harvinaiset | Keuhkoputkentulehdus, yskä |
| Ruoansulatuselimistö | Melko harvinaiset | Korvasylkirauhasen suureneminen, ripuli, oksentelu |
| Iho ja ihonalainen kudos | Yleiset | Ihottuma |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset | Injektiokohdan punoitus, kuume ≥ 38 °C (peräaukko) tai ≥ 37,5 °C (kainalo/suu) |
| Yleiset | Injektiokohdan kipu ja turvotus, kuume > 39,5 °C (peräaukko) tai > 39 °C (kainalo/suu) |
Yleensä haittavaikutusten frekvenssiluokitus oli sama ensimmäisen ja toisen rokoteannoksen jälkeen. Poikkeuksen muodostaa injektiokohdan kipu, joka oli ”yleinen” ensimmäisen rokoteannoksen jälkeen ja ”hyvin yleinen” toisen rokoteannoksen jälkeen.
Markkinoille tulon jälkeiset tiedot
Seuraavia haittavaikutuksia on identifioitu harvoin markkinoille tulon jälkeisessä seurannassa. Koska niitä on raportoitu vapaaehtoisesti potilasryhmästä, jonka kokoa ei tunneta, niiden todellista frekvenssiä ei voida luotettavasti arvioida.
| Elinjärjestelmä | Haittavaikutukset |
| Infektiot | Aivokalvontulehdus, tuhkarokonkaltainen oireyhtymä, sikotaudinkaltainen oireyhtymä (mukaan lukien kivestulehdus, lisäkivestulehdus ja sylkirauhasen tulehdus) |
| Veri ja imukudos | Trombosytopenia, trombosytopeeninen purppura |
| Immuunijärjestelmä | Anafylaktiset reaktiot |
| Hermosto | Aivotulehdus*, pikkuaivojen tulehdus, pikkuaivotulehduksenkaltainen oireyhtymä (mukaan lukien ohimenevä kävelyhäiriö ja ohimenevä ataksia), Guillain-Barrén oireyhtymä, selkäydintulehdus, perifeerinen neuriitti |
| Verisuonisto | Vaskuliitti |
| Iho ja ihonalainen kudos | Erytheema multiforme |
| Luusto, lihakset ja sidekudos | Nivelkipu, niveltulehdus |
*Aivotulehdusta on raportoitu harvemmin kuin kerran 10 milj. annoksen jälkeen. Rokotteen aiheuttama aivotulehduksen riski on paljon pienempi kuin luonnollisten tautien aiheuttaman aivotulehduksen riski (tuhkarokko 1/1000-2000; sikotauti 2−4/1000; vihurirokko noin 1/6000).
Intravaskulaarinen anto vahingossa voi aiheuttaa vaikeita reaktioita tai jopa sokin. Välittömät toimenpiteet riippuvat reaktion vaikeusasteesta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Tämä mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Markkinoille tulon jälkeen on raportoitu yliannostustapauksia (korkeintaan 2 kertaa suositeltu annos). Yliannostuksiin ei ole raportoitu haittavaikutuksia.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Virusrokote, ATC-koodi: J07B D52
Immuunivaste 12 kuukauden ikäisillä ja sitä vanhemmilla lapsilla
Kliinisissä tutkimuksissa Priorix on todettu erittäin immunogeeniseksi 12−24 kuukauden ikäisillä lapsilla.
Priorix-kerta-annoksen jälkeen tuhkarokkoviruksen vasta-aineita todettiin 98,1 %:lla, sikotautiviruksen vasta-aineita 94,4 %:lla ja vihurirokkoviruksen vasta-aineita 100 %:lla aiemmin seronegatiivisista henkilöistä.
Kahden vuoden kuluttua perusrokotuksesta serokonversiofrekvenssit olivat 93,4 % tuhkarokolle, 94,4 % sikotaudille ja 100 % vihurirokolle.
Vaikka Priorixin suojan antavasta tehosta ei ole tietoja, immunogeenisuuden katsotaan indikoivan suojaavaa tehoa. Eräissä kenttätutkimuksissa on kuitenkin havaittu, että tehokkuus sikotautia vastaan saattaa olla heikompi kuin serokonversiofrekvenssit sikotaudille.
Immuunivaste 9−10 kuukauden ikäisillä lapsilla
Erääseen kliiniseen tutkimukseen osallistui 300 tervettä lasta, jotka ensimmäisen rokoteannoksen saadessaan olivat 9−10 kuukauden ikäisiä. Näistä 147 henkilöä sai Priorixia ja Varilrixia samanaikaisesti. Serokonversiofrekvenssit olivat tuhkarokolle 92,6 %, sikotaudille 91,5 % ja vihurirokolle 100 %. Toisen annoksen jälkeen, joka annettiin 3 kuukauden kuluttua ensimmäisestä annoksesta, Serokonversiofrekvenssit olivat tuhkarokolle 100 %, sikotaudille 99,2 % ja vihurirokolle 100 %. Tästä syystä toinen Priorix-annos tulee antaa 3 kuukauden sisällä ensimmäisestä annoksesta optimaalisen immuunivasteen saavuttamiseksi.
Nuoret ja aikuiset
Priorixin turvallisuutta ja immunogeenisuutta ei ole erikseen tutkittu kliinisissä tutkimuksissa nuorilla ja aikuisilla.
Lihaksensisäinen anto
Rajoitettu määrä henkilöitä sai Priorixia lihakseen kliinisissä tutkimuksissa. Serokonversiofrekvenssit kolmelle komponentille olivat verrannollisia arvoihin, joita saavutetaan ihonalaisessa injektiossa.
Farmakokinetiikka
Rokotteilta ei vaadita farmakokineettisiä tutkimuksia.
Prekliiniset tiedot turvallisuudesta
Yleisten turvallisuustutkimusten perusteella non-kliinisissä tiedoissa ei ilmene mitään vaaraa ihmiselle.
Farmaseuttiset tiedot
Apuaineet
Injektiokuiva-aine:
Aminohapot (sisältää fenyylialaniinia)
Laktoosi (vedetön)
Mannitoli (E 421)
Sorbitoli (E 420)
Medium 199 (sisältää fenyylialaniinia, para-aminobentsoehappoa, natriumia ja kaliumia)
Liuotin: Injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Yhteensopivuustutkimusten puuttuessa tätä lääkevalmistetta ei saa sekoittaa toisten lääkevalmisteiden kanssa.
Kestoaika
2 vuotta.
Rokote tulee injisoida heti käyttökuntoon saattamisen jälkeen. Jos tämä ei ole mahdollista, tulee valmis rokote säilyttää 2 °C – 8 °C:ssä ja käyttää 8 tunnin sisällä käyttökuntoon saattamisesta.
Säilytys
Säilytä ja kuljeta kylmässä (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilytysohjeet käyttöön saattamisen jälkeen, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PRIORIX injektiokuiva-aine ja liuotin, liuosta varten
1 annos (26,11 €), 10 x 1 annos (-)
PF-selosteen tieto
Injektiokuiva-aine injektiopullossa (Tyyppi I lasia), jossa kumitulppa.
0,5 ml liuosta esitäytetyssä ruiskussa (Tyyppi I lasia), jossa uppokumitulpat, neuloilla tai ilman neuloja – pakkauskoot:
- kahdella erillisellä neulalla: pakkauskoot 1 tai 10.
- ilman neulaa: pakkauskoot 1 tai 10.
Kaikki pakkauskoot eivät välttämättä ole markkinoilla.
Valmisteen kuvaus:
Ennen käyttökuntoon saattamista, kuiva-aine on valkeahko tai hieman vaaleanpunainen jauhekakku, josta osa voi olla kellertävää tai hieman oranssia.
Liuotin on kirkas ja väritön liuos.
Käyttö- ja käsittelyohjeet
Liuotin ja käyttökuntoon saatettu rokote on tarkastettava silmämääräisesti ennen käyttökuntoon saattamista ja antamista mahdollisten vierasainehiukkasten ja/tai fysikaalisten ominaisuuksien muutosten havaitsemiseksi. Mikäli tällaisia muutoksia havaitaan, liuotinta tai käyttökuntoon saatettua rokotetta ei saa käyttää.
Rokote saatetaan käyttökuntoon lisäämällä liuotinta sisältävän esitäytetyn ruiskun koko sisältö injektiokuiva-ainetta sisältävään injektiopulloon.
Lue huolellisesti ohjeet sekä kuvat 1 ja 2 neulan kiinnittämisestä ruiskuun. Priorix-pakkauksessa oleva ruisku voi hieman poiketa (ilman kierreosaa) kuvassa olevasta ruiskusta. Tällöin neula on kiinnitettävä ilman kiertoliikettä.
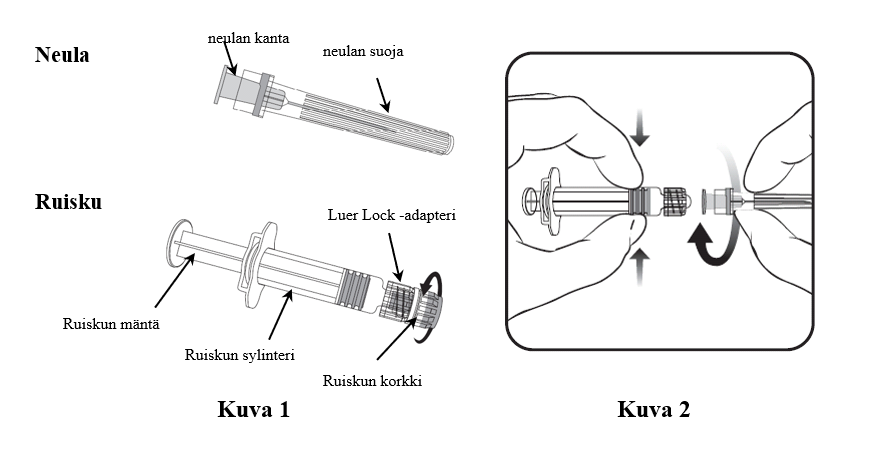
Pidä aina ruiskun sylinteristä kiinni, älä pidä kiinni ruiskun männästä tai Luer Lock -adapterista (LLA). Pidä neula samassa linjassa ruiskun kanssa (kuten kuvassa 2). Jos tätä ei tehdä, LLA saattaa vääntyä ja vuotaa.
Jos LLA irtoaa ruiskun kokoamisen aikana, tulee käyttää uutta rokotetta (uusi ruisku ja injektiopullo).
1. Poista ruiskun korkki kiertämällä sitä vastapäivään (kuten kuvassa 1).
Seuraa seuraavia ohjeita riippumatta siitä pyöriikö LLA vai ei:
2. Kiinnitä neula ruiskuun yhdistämällä kevyesti neulan kanta LLA:iin ja kääntämällä neljäsosakierroksen myötäpäivään kunnes neula tuntuu lukkiutuvan (kuten kuvassa 2).
3. Poista neulan suoja, joka voi tuntua jäykältä.
4. Lisää liuotin injektiokuiva-aineeseen. Seosta on ravistettava, kunnes injektiokuiva-aine on täysin liuennut liuottimeen.
Vähäisten pH-muutosten vuoksi käyttökuntoon saatetun rokotteen väri voi vaihdella kirkkaan persikanvärisestä fuksian vaaleanpunaiseen. Tämä ei vaikuta rokotteen tehoon.
5. Koko injektiopullon sisältö vedetään ruiskuun.
6. Käytä toista neulaa rokotteen antamiseen. Poista neula ruiskusta ja kiinnitä injektointiin käytettävä neula toistamalla yllä oleva kohta kaksi.
Kosketusta desinfektioaineisiin on vältettävä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
PRIORIX injektiokuiva-aine ja liuotin, liuosta varten
1 annos, 10 x 1 annos
- Ei korvausta.
ATC-koodi
J07BD52
Valmisteyhteenvedon muuttamispäivämäärä
04.12.2025
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
