TWINRIX ADULT injektioneste, suspensio, esitäytetty ruisku
Vaikuttavat aineet ja niiden määrät
Yksi annos (1 ml) sisältää:
Hepatiitti A ‑virusta (inaktivoitua)1,2 720 ELISA-yksikköä
Hepatiitti B -pinta-antigeenia3,4 20 mikrogrammaa
1Tuotettu ihmisen diploidi (MRC-5) soluissa
2Adsorboitu alumiinihydroksidiin (hydratoituun) 0,05 milligrammaa Al3+
3Tuotettu hiivasoluissa (Saccharomyces cerevisiae)
rekombinantti DNA teknologian avulla
4Adsorboitu alumiinifosfaattiin 0,4 milligrammaa Al3+
Rokote voi sisältää neomysiinijäämiä. Neomysiiniä käytetään valmistusprosessissa (ks. kohta Vasta-aiheet).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
Twinrix Adult on tarkoitettu käytettäväksi ei-immuuneilla aikuisilla ja 16 vuotta täyttäneillä nuorilla, joilla tarvitaan suoja sekä hepatiitti A:ta että B:tä vastaan.
Annostus ja antotapa
Annostus
- Annostus
Aikuisten ja 16 vuotta täyttäneiden nuorten annossuositus on 1 ml.
- Perusrokotusohjelma
Standardi Twinrix Adult -perusrokotussarja sisältää kolme annosta; ensimmäinen annetaan valittuna päivänä, toinen kuukauden kuluttua ja kolmas 6 kuukauden kuluttua ensimmäisestä annoksesta.
Poikkeustilanteissa aikuisilla silloin, kun matkallelähtö on odotettavissa kuukauden kuluessa tai myöhemmin rokotussarjan aloittamisesta, mutta aikaa ei ole riittävästi, jotta tavanomainen 0, 1 ja 6 kuukauden rokotusohjelma voitaisiin toteuttaa, voidaan antaa kolmen rokotuksen sarja lihakseen päivinä 0, 7 ja 21. Käytettäessä tätä aikataulua suositellaan neljännen annoksen antamista 12 kuukauden kuluttua ensimmäisestä annoksesta.
Rokotusaikataulusuosituksesta tulee pitää kiinni. Perusrokotussarja on annettava alusta loppuun samalla rokotteella.
- Tehosteannos
Pitkäaikaistietoja vasta-aineiden säilymisestä on enimmillään 20 vuoden ajalta Twinrix Adult ‑rokotuksen jälkeen (kts. kohta Farmakodynamiikka). Yhdistelmärokotteella annetun perusrokotussarjan jälkeen havaitut anti-HBs- ja anti-HAV-vasta-ainetitterit vastaavat monovalentin rokotteen antamisen jälkeen mitattuja tittereitä. Tehosterokotuksen yleiset ohjeet voidaan siten luoda monovalenteista rokotteista saatujen kokemusten perusteella.
Hepatiitti B
Hepatiitti B ‑rokotteen tehosteannoksen tarvetta terveillä henkilöillä, jotka ovat saaneet täyden perusrokotussarjan, ei ole selvitetty. Joissakin virallisissa rokotusohjelmissa on kuitenkin tällä hetkellä suositus hepatiitti B ‑rokotteen tehosteannoksesta, ja sitä tulee noudattaa.
Joissakin henkilö- ja potilasryhmissä, jotka altistuvat HB-virukselle (esim. hemodialyysi- tai immuunivajauspotilaat), on harkittava varotoimena suojaavan vasta-ainetason ≥ 10 IU/l varmistamista.
Hepatiitti A
Toistaiseksi ei varmasti tiedetä, tarvitsevatko hepatiitti A ‑rokotukseen reagoineet immunokompetentit henkilöt suojaksi tehosteannoksia, koska immunologinen muisti voi korvata mitattavissa olevien vasta-ainepitoisuuksien puuttumisen. Tehosterokotusohjeet perustuvat siihen olettamukseen, että suoja vaatii vasta-ainepitoisuuksia.
Twinrix Adult -rokote voidaan antaa henkilöille, joille halutaan antaa tehosteannos sekä hepatiitti A:ta että B:tä vastaan. Vaihtoehtoisesti, tehosteannos voidaan antaa jommallakummalla monovalentilla rokotteella henkilöille, jotka ovat aikaisemmin saaneet Twinrix Adult -rokotuksia.
Antotapa
Twinrix Adult annetaan lihakseen, mieluiten olkavarteen (m. deltoideus).
Trombosytopeniaa sairastaville tai verenvuotohäiriöistä kärsiville potilaille pistos voidaan antaa poikkeuksellisesti ihon alle. Tällöin seurauksena saattaa kuitenkin olla suboptimaalinen immuunivaste rokotteelle (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille tai neomysiinille.
Yliherkkyys aiemmin annetulle hepatiitti A- ja/tai hepatiitti B-rokotteelle.
Twinrix Adult ‑rokotteen antamista kuten rokottamista yleensäkin tulee lykätä, jos potilaalla on akuutti vaikea kuumetauti.
Varoitukset ja käyttöön liittyvät varotoimet
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Rokotettavalla saattaa rokotettaessa olla itämisvaiheessa oleva hepatiitti A tai hepatiitti B ‑infektio. Ei tiedetä, estääkö Twinrix Adult hepatiitti A:n ja B:n tällaisissa tapauksissa.
Rokote ei suojaa muilta infektiotartunnoilta, esim. hepatiitti C:ltä tai hepatiitti E:ltä, ei myöskään muilta maksatulehduksia aiheuttavilta patogeeneiltä.
Twinrix Adult ‑rokotusta ei suositella altistuksenjälkeiseen profylaksiin (esim. neulanpistovammat).
Rokotetta ei ole tutkittu immuunivajauspotilailla. Perusimmunisaatiolla ei ehkä saavuteta riittävää anti-HAV- ja anti-HBs-vasta-ainetitteriä hemodialyysipotilailla ja henkilöillä, joiden vastustuskyky on heikentynyt. Nämä potilaat saattavat tarvita lisäannoksia.
Lihavilla henkilöillä (BMI ≥ 30 kg/m2) immuunivasteen on hepatiitti A rokotteilla todettu alentuneen. Muutamissa tilanteissa immuunivasteen on hepatiitti B-rokotteilla todettu myös alentuneen. Riskitekijöitä ovat korkea ikä, miessukupuoli, lihavuus, tupakointi, antoreitti ja eräät taustalla olevat krooniset sairaudet. Serologisten testien suorittamista on harkittava henkilöillä, joilla suojaa antavaa vasta-ainetasoa ei ehkä saavuteta täydellisen Twinrix Adult -rokotesarjan jälkeen. Kuten muissakin tilanteissa, joissa vaste jää matalaksi tai jää tulematta, voidaan lisäannosten antamista harkita.
Kuten kaikilla injisoitavilla rokotteilla, käsillä on aina oltava asianmukainen hoitovalmius ja seuranta harvinaisten anafylaktisten tapahtumien varalta.
Koska intradermaalinen tai gluteaalilihakseen annettu injektio voi antaa suboptimaalisen rokotusvasteen, näitä antotapoja tulee välttää. Jos potilaalla on trombosytopenia tai vuotohäiriö, Twinrix Adult voidaan kuitenkin poikkeuksellisesti antaa ihon alle, koska lihaksensisäinen anto saattaa näillä henkilöillä aiheuttaa verenvuotoa (ks. kohta Annostus ja antotapa).
Twinrix Adult ‑rokotetta ei missään tapauksessa saa antaa suoneen.
Kuten muillakin rokotteilla suojaava immuunivaste voi jäädä saavuttamatta joillakin henkilöillä.
Tämä rokote sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero tulisi kirjata selkeästi ylös.
Yhteisvaikutukset
Tietoja Twinrix Adult ‑rokotteen samanaikaisesta antamisesta spesifisen A-hepatiitti‑immunoglobuliinin tai B-hepatiitti‑immunoglobuliinin kanssa ei ole. Annettaessa monovalenttia hepatiitti A ja hepatiitti B ‑rokotetta samanaikaisesti spesifisten immunoglobuliinien kanssa, ei vaikutusta serokonversioon kuitenkaan havaittu, mutta vasta-ainetitterit voivat jäädä matalammiksi.
Twinrix Adult ‑rokotteen antamista samanaikaisesti muiden rokotteiden kanssa ei ole spesifisesti tutkittu. Otaksuttavasti ei interaktioita havaita, jos käytetään eri ruiskuja ja eri injektiokohtaa.
Immunosuppressiohoitoa saavilla potilailla tai immuunivajauspotilailla riittävä vaste voi jäädä saavuttamatta.
Raskaus ja imetys
Raskaus
Twinrix Adultin vaikutuksia alkion/sikiön kehitykseen ja kuolleisuuteen sekä peri- ja postnataalikehitykseen ja kuolleisuuteen on tutkittu rotilla. Tutkimuksessa ei tullut ilmi mitään suoria tai epäsuoria vahingollisia vaikutuksia hedelmällisyyteen, raskauteen, alkion/sikiön kehitykseen, synnytykseen eikä postnataalikehitykseen.
Twinrix Adultin vaikutuksia alkion/sikiön kehitykseen ja kuolleisuuteen sekä peri- ja postnataali- kehitykseen ja kuolleisuuteen ei ole tutkittu kliinisissä tutkimuksissa.
Kokemus Twinrix Adultin käytöstä raskauden aikana perustuu rajalliseen määrään raskauksia. Kokemukset eivät viittaa rokotteen aiheuttamiin haittavaikutuksiin raskauden aikana. Myöskään sikiön/vastasyntyneen lapsen terveyteen ei ole havaittu kohdistuneen haittavaikutuksia. Vaikka rekombinantti DNA teknologian avulla valmistetun hepatiitti B viruksen pinta-antigeenin ei odoteta aiheuttavan haittaa sikiölle tai haittaavan raskauden kulkua, on suositeltavaa lykätä rokotus synnytyksen jälkeen. Rokotus voidaan antaa raskauden aikana, jos ilmenee välitön, pakottava syy suojata äiti hepatiitti B- infektiota vastaan.
Imetys
Twinrix Adultin erittymisestä ihmisen äidinmaitoon ei ole tietoa, eikä Twinrix Adultin erittymistä eläinten äidinmaitoon ole tutkittu. Päätettäessä jatketaanko/lopetetaanko imettäminen, vai Twinrix Adult -rokotukset, on otettava huomioon rintaruokinnan hyödyt lapselle ja Twinrix Adult -rokotusten hyöty naiselle.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Twinrix Adult ei vaikuta lainkaan tai juurikaan ajokykyyn eikä koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Alla esitetty turvallisuusprofiili perustuu yhdistettyihin tietoihin yli 6000 henkilöltä, jotka saivat joko standardirokotussarjan 0, 1 ja 6 kuukauden kohdalla (n = 5683) tai nopeutetun rokotussarjan 0, 7 ja 21 päivän kohdalla (n = 320) Twinrix Adultin 0,1 ja 6 kuukauden standardirokotusohjelmalla yleisimmin raportoidut haittavaikutukset annosta kohti ovat kipu (37,6 %) ja punoitus (17,0 %).
Niissä kahdessa kliinisessä tutkimuksessa, jossa Twinrix Adultia annettiin päivinä 0, 7 ja 21, kerättyjä yleisiä ja paikallisia oireita raportoitiin samalla yleisyydellä kuin alla olevassa luokituksessa on esitetty. Neljännen annoksen jälkeen, joka annettiin 12. kuukaudella, systeemisten ja paikallisten haittavaikutusten ilmaantuvuus oli verrattavissa siihen ilmaantuvuuteen, joka havaitaan 0, 7 ja 21 päivinä suoritettujen rokotusten jälkeen.
Vertailututkimuksissa todettiin, että Twinrix Adult ‑rokotuksen jälkeen kerättyjen haittatapahtumien yleisyys ei eroa monovalenttien rokotteiden antamisen jälkeen kerättyjen haittatapahtumien yleisyydestä.
Taulukko haittavaikutuksista
Yleisyys raportoidaan seuraavasti:
Hyvin yleiset: (≥ 1/10)
Yleiset: (≥1/100 ja < 1/10)
Melko harvinaiset (≥ 1/1000 ja < 1/100)
Harvinaiset: (≥ 1/10000 ja < 1/1000)
Hyvin harvinaiset: (< 1/10000)
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Kliiniset lääketutkimukset | ||
Infektiot | melko harvinaiset | ylähengitystieinfektio |
Veri ja imukudos | harvinaiset | lymfadenopatia |
Aineenvaihdunta ja ravitsemus | harvinaiset | ruokahaluttomuus |
Hermosto | hyvin yleiset melko harvinaiset harvinaiset | päänsärky huimaus heikentynyt tunto, tuntoharha |
Verisuonisto | harvinaiset | hypotensio |
Ruoansulatuselimistö | yleiset melko harvinaiset | maha-suolikanavan oireet, ripuli, pahoinvointi oksentelu, vatsakipu* |
Iho ja ihonalainen kudos | harvinaiset hyvin harvinaiset | ihottuma, kutina urtikaria |
Luusto, lihakset ja sidekudos | melko harvinaiset harvinaiset | lihaskipu nivelkipu |
Yleisoireet ja antopaikassa todettavat haitat | hyvin yleiset yleiset melko harvinaiset harvinaiset | injektiokohdan kipu ja punoitus, uupumus injektiokohdan turvotus, injektiokohdan reaktiot (kuten verenpurkauma, kutina ja mustelma), huonovointisuus kuume (≥ 37,5ºC) influenssankaltainen tauti, vilunväristykset |
Markkinoille tulon jälkeiset tiedot | ||
Seuraavia haittavaikutuksia on raportoitu joko Twinrixillä tai GlaxoSmithKlinen monovalenttisilla hepatiitti A tai B -rokotteilla. | ||
Infektiot | aivokalvontulehdus | |
Veri ja imukudos | trombosytopenia, trombosytopeeninen purppura | |
Immuunijärjestelmä | anafylaksia, allergiset reaktiot, anafylaktoidiset reaktiot mukaan lukien, seerumitaudin kaltainen tila | |
Hermosto | enkefaliitti, enkefalopatia, hermotulehdus, neuropatia, paralyysi, kouristukset | |
Verisuonisto | vaskuliitti | |
Iho ja ihonalainen kudos | angioneuroottinen edeema, lichen planus, erythema mulfiforme | |
Luusto, lihakset ja sidekudos | niveltulehdus, lihasheikkous | |
Yleisoireet ja antopaikassa todettavat haitat | injektiokohdan välitön kipu | |
Lisäksi seuraavia haittatapahtumia on raportoitu ajallisessa yhteydessä rokotukseen monovalenttien hepatiitti A- ja/tai hepatiitti B-rokotteiden laajan käytön aikana. | ||
Hermosto | MS-tauti, myeliitti, kasvohalvaus, polyneuriitti kuten Guillain−Barrén oireyhtymä (nouseva paralyysi), optikusneuriitti. | |
Yleisoireet ja antopaikassa todettavat haitat | pistely ja polttava tunne | |
Tutkimukset | maksan toimintakokeiden epänormaalit arvot | |
* viittaa haittavaikutuksiin, joita on raportoitu kliinisissä tutkimuksissa lapsille tarkoitetulla lääkemuodolla
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Markkinoille tulon jälkeen on raportoitu yliannostustapauksia. Yliannostuksen jälkeen raportoidut haittatapahtumat olivat samanlaiset kuin normaaliannostuksen jälkeen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Hepatiittirokote, ATC-koodi: J07BC20.
Twinrix Adult on yhdistelmärokote, joka on valmistettu yhdistämällä bulkkivalmisteina puhdistettua inaktivoitua hepatiitti A ‑virusta (HA) ja puhdistettua hepatiitti B ‑viruksen pinta-antigeenia (HBsAg), jotka on erikseen adsorboitu alumiinihydroksidiin (hydratoituun) ja alumiinifosfaattiin.
HA-virus tuotetaan ihmisen MRC5-diploidisoluissa. HBsAg tuotetaan geenitekniikalla muunnelluissa hiivasoluviljelmässä selektiivisessä elatusaineessa.
Twinrix Adult saa aikaan immuniteetin HAV- ja HBV-infektiota vastaan aiheuttamalla spesifisen anti-HAV- ja anti-HBs-vasta-ainemuodostuksen.
Suoja hepatiitti A:ta ja B:tä vastaan kehittyy 2 ‑ 4 viikossa. Kliinisissä tutkimuksissa spesifejä humoraalisia vasta-aineita hepatiitti A:ta vastaan havaittiin noin 94 %:lla aikuisista kuukauden kuluttua ensimmäisen annoksen antamisesta ja 100 %:lla aikuisista kuukauden kuluttua kolmannen annoksen antamisesta (eli 7. kuukausi). Spesifejä humoraalisia vasta-aineita hepatiitti B:tä vastaan havaittiin noin 70 %:lla aikuisista ensimmäisen annoksen jälkeen ja noin 99 %:lla aikuisista kolmannen annoksen jälkeen.
Perusrokotussarjaa 0, 7. ja 21. päivinä annettavilla rokotuksilla sekä 12. kuukaudella annettavalla neljännellä rokotuksella tulee käyttää vain poikkeustapauksissa aikuisilla. Kliinisessä lääketutkimuksessa, jossa Twinrix Adultia annettiin tämän rokotusaikataulun mukaisesti, suojan antavat anti-HBV-vasta-ainetasot havaittiin 1 viikon kuluttua kolmannesta annoksesta 82 %:lla rokotetuista ja 5 viikon kuluttua 85 %:lla rokotetuista (toisin sanoen 1 ja 2 kuukauden kuluttua ensimmäisestä annoksesta) Suoja hepatiitti B:tä vastaan nousi 95,1 %:iin kolmessa kuukaudessa ensimmäisestä annoksesta.
Anti- HAV-vasta-aineiden seropositiivisuus oli 1, 2 ja 3 kuukauden kuluttua ensimmäisestä annoksesta 100 %, 99,5 % ja 100 %. Yhden kuukauden kuluttua neljännestä annoksesta kaikilla koehenkilöillä oli kehittynyt suojaavat anti-HBs-vasta-ainetasot ja kaikki todettiin seropositiivisiksi anti-HAV-vasta-aineiden suhteen.
Eräässä kliinisessä tutkimuksessa suojaavia vasta-ainetasoja anti-HAV-vasta-aineita ja hepatiitti B:tä vastaan tutkittiin yli 40 vuotta täyttäneillä henkilöillä. Tutkittaville annettiin Twinrix Adultia 0, 1 ja 6 kuukauden rokotusohjelman mukaan ja suojaavia vasta-ainetasoja verrattiin arvoihin, joita saadaan kun hepatiitti A ja hepatiitti B rokotus annetaan monovalenttisella rokotteella eri käsivarsiin.
Twinrix Adultilla suojaavat vasta-ainetasot hepatiitti B vastaan olivat 7. kuukauden kohdalla 92 % ja 48 kuukauden kohdalla 56 %. Vastaavat arvot olivat 20 mikrog vahvuisella monovalenttisella rokotteella 80 % ja 43 % ja 10 mikrog vahvuisella monovalenttisella rokotteella 71 % ja 31 %. Anti-HBs vasta-aineiden pitoisuudet pienenivät iän ja body mass indexin noustessa. Arvot olivat myös matalammat miehillä. Anti-HAV-vasta-aineiden suojaavat pitoisuudet olivat 97 % Twinrix Adultin jälkeen 7. ja 48. kuukauden kohdalla verrattuna pitoisuuksiin 99 % ja 93 % GlaxoSmithKlinen monovalenttisen hepatiitti A rokotteen jälkeen. Toisen lisensioidun monovalenttisen hepatiitti A rokotteen jälkeen pitoisuudet olivat oli 99 % ja 97 %.
Koehenkilöt saivat lisäannoksen samaa rokotetta 48 kuukauden kuluttua perusrokotussarjan ensimmäisestä annoksesta. Suojaavia anti-HBV vasta-aineiden pitoisuuksia (≥ 10 mIU/ml) kehittyi kuukauden kuluttua tästä annoksesta 95 %:lle koehenkilöistä, jotka olivat saaneet Twinrix Adultia.
Iältään 17−43-vuotiailla aikuisilla tehtiin kaksi pitkäaikaista kliinistä tutkimusta. Ensimmäisessä tutkimuksessa 18 henkilöltä oli arvioitavissa olevia näytteitä 20 vuoden kuluttua Twinrix Adult -perusrokotussarjasta. Anti-HAV seropositiivisuus oli 100% ja 94%:lla rokotetuista oli suojaavat anti-HBs-vasta-ainetasot. Toisessa tutkimuksessa 25 henkilöltä oli arvioitavissa olevia näytteitä 20 vuoden kuluttua Twinrix Adult -perusrokotussarjasta. Tässä tutkimuksessa anti-HAV-seropositiivisuus oli 96% ja suojaavat anti-HBs-vasta-ainetasot vastaavasti 92 %.
Farmakokinetiikka
Rokotteilta ei vaadita farmakokinetiikan arviointia.
Prekliiniset tiedot turvallisuudesta
Yleisten turvallisuutta koskevien tutkimusten perusteella ei ei-kliinisissä tiedoissa ilmene mitään erityistä vaaraa ihmiselle.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Injektionesteisiin käytettävä vesi
Adjuvantit, ks. kohta Vaikuttavat aineet ja niiden määrät.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Säilytys
Säilytä jääkaapissa (2°C − 8°C:ssä).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TWINRIX ADULT injektioneste, suspensio, esitäytetty ruisku
1 ml (85,00 €), 10 x 1 ml (750,89 €)
PF-selosteen tieto
1 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki. Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa ovat valmistettu synteettisestä kumista.
Pakkauskoot 1, 10 ja 25 neuloilla tai ilman neuloja
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Samea, valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Varastoitaessa voi muodostua hienojakoinen valkoinen sedimentti ja kirkas, väritön pintakerros.
Rokote on saatettava käyttökuntoon ennen antoa. Käyttökuntoon saatettu rokote on ulkonäöltään tasainen, samea ja valkoinen.
Rokotteen käyttökuntoon saattaminen, jotta muodostuu tasainen, samea, valkoinen suspensio.
Rokote saatetaan käyttökuntoon vaiheittain noudattamalla seuraavia ohjeita.
- Pidä ruisku pystyasennossa käsi suljettuna.
- Ravista ruiskua kääntämällä se useita kertoja ylösalaisin ja takaisin oikein päin.
- Toista tätä liikettä voimakkaasti vähintään 15 sekunnin ajan.
-
Tarkista rokote uudestaan:
a) Rokote on valmis käytettäväksi, jos suspensio on tasainen, samea ja valkoinen – rokote ei ole kirkas.
b) Jos rokote ei vielä ole tasainen, samea, valkoinen suspensio – käännä ylösalaisin ja takaisin oikein päin vielä vähintään 15 sekunnin ajan – tarkista uudelleen.
Ennen rokottamista, rokote tarkastetaan silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta. Jos jompaakumpaa havaitaan, rokotetta ei tule antaa.
Esitäytetyn ruiskun käyttöohje käyttökuntoon saattamisen jälkeen
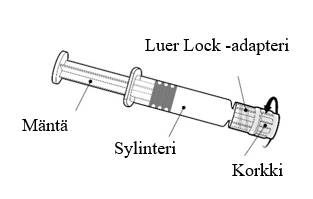
| Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
| Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys Käyttämätön lääkevalmiste ja jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TWINRIX ADULT injektioneste, suspensio, esitäytetty ruisku
1 ml, 10 x 1 ml
- Ei korvausta.
ATC-koodi
J07BC20
Valmisteyhteenvedon muuttamispäivämäärä
26.04.2023
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi