AZZALURE injektiokuiva-aine, liuosta varten 125 Speywood-yksikköä
Vaikuttavat aineet ja niiden määrät
Tyypin A botuliinitoksiini*
Yhdessä injektiopullossa on 125:tä Speywood-yksikköä** vastaava määrä.
* Tyypin A Clostridium botulinum -toksiinin hemagglutiniinikompleksi
**Azzaluren Speywood-yksiköt ovat valmistekohtaisia, eikä niitä voi soveltaa muihin botuliinitoksiinivalmisteisiin.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Azzalure on tarkoitettu
- otsaa maksimaalisesti rypistettäessä ilmaantuvien, kulmakarvojen välisten keskisyvien tai syvien pystysuorien uurteiden ja/tai
- silmänurkkiin maksimaalisesti hymyiltäessä ilmaantuvien keskisyvien tai syvien vaakasuorien uurteiden
ulkonäön tilapäiseen korjaamiseen alle 65-vuotiailla aikuisilla, kun uurteiden syvyydellä on voimakas psyykkinen vaikutus potilaaseen.
Annostus ja antotapa
Annostus
Eri lääkevalmisteiden botuliinitoksiiniyksiköissä on eroja. Azzaluren Speywood-yksiköt ovat valmistekohtaisia, eikä niitä voi soveltaa muihin botuliinitoksiinivalmisteisiin.
Pediatriset potilaat
Azzaluren turvallisuutta ja tehoa alle 18-vuotiailla ei ole osoitettu. Azzaluren käyttöä alle 18-vuotiaille potilaille ei suositella.
Antotapa
Azzalurea saavat antaa vain lääkärit, joilla on asianmukainen pätevyys ja kokemusta hoidon käytöstä sekä tarvittavat välineet.
Käyttöönvalmistettu Azzalure tulee käyttää vain yhden potilaan hoitoon vain yhdellä hoitokerralla.
Ohjeet valmisteen käyttövalmiiksi saattamiseksi, ks. kohta Käyttö- ja käsittelyohjeet.
Meikki poistetaan, ja ihoalue puhdistetaan antiseptisellä aineella.
Lihakseen annettavat injektiot tulee antaa sopivan paksuisella steriilillä neulalla.
Hoitojen antoväli riippuu yksittäisen potilaan reaktiosta arvion jälkeen.
Azzalure-hoitoa ei tule antaa useammin kuin 3 kuukauden välein.
Seuraavassa esitetään suositellut injektiokohdat kulmakarvojen välisiin uurteisiin ja silmänurkkien uurteisiin:
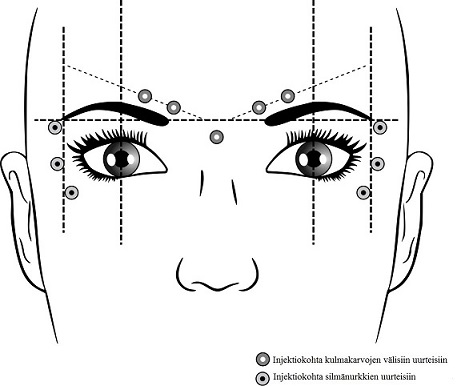
Kulmakarvojen väliset uurteet
Suositusannos on 50 Speywood-yksikköä Azzalurea jaettuna 5 injektiokohtaan. Kuhunkin kohtaan annetaan 10 Speywood-yksikköä lihakseen suorassa kulmassa ihoon nähden. Kumpaankin corrugatorlihakseen annetaan 2 injektiota ja nenä-otsakulman lähellä sijaitsevaan proceruslihakseen yksi injektio edellä olevan kuvan mukaisesti.
Kyseiset anatomiset kohdat on helpompi tunnistaa, jos ne etsitään ja palpoidaan potilaan rypistäessä otsaansa mahdollisimman paljon. Ennen injektion antamista peukalo tai etusormi painetaan lujasti silmäkuopan reunan alle, jotta silmäkuopan reunan alapuoliselta ekstravasaatiolta vältytään. Neula tulee pistää injektion aikana ylös ja mediaalisuuntaan. Ptoosiriskin minimoimiseksi on vältettävä injektioiden antamista levator palpebrae superioris ‑lihaksen lähelle etenkin, jos potilaan depressor supercilii ‑kompleksi on suuri. Corrugatorlihakseen annettavat injektiot tulee antaa kyseisen lihaksen keskiosaan, vähintään 1 cm silmäkuopan reunan yläpuolelle.
Kliinisissä tutkimuksissa optimaalinen vaikutus kulmakarvojen välisiin uurteisiin osoitettiin 4 kuukauden ajan injektion annosta. Joillakin potilailla vaste säilyi 5 kuukautta (ks. kohta Farmakodynamiikka).
Silmänurkkien uurteet
Suositusannos on 30 Speywood-yksikköä puolta kohden Azzalurea jaettuna 3 injektiokohtaan. Kuhunkin kohtaan annetaan 10 Speywood-yksikköä lihakseen. Injektion pitää olla lateraalisessa 20–30° kulmassa ihoon nähden ja hyvin pinnallinen. Kaikkien injektiokohtien pitää olla silmän kehälihaksen (orbicularis oculi) ulommassa osassa ja riittävän kaukana silmäkuopan reunasta (noin 1–2 cm), kuten ylläoleva kuva osoittaa.
Kyseiset anatomiset kohdat on helpompi tunnistaa, jos ne etsitään ja palpoidaan potilaan hymyillessä maksimaalisesti. Isoon ja pieneen poskipäälihakseen (zygomaticus major/minor) injisoimista tulee huolellisesti välttää, jotta suupielen riippuminen ja epäsymmetrinen hymy vältetään.
Yleistä tietoa
Jos hoito epäonnistuu tai sen teho heikkenee, kun hoitojaksot toistetaan, on käytettävä muita hoitomenetelmiä. Jos hoito epäonnistuu ensimmäisen hoitokerran jälkeen, on harkittava seuraavia lähestymistapoja:
- Selvitetään hoidon epäonnistumisen syyt (esim. injektion antaminen vääriin lihaksiin, epäasianmukainen injektiotekniikka ja toksiinia neutraloivien vasta-aineiden muodostus)
- A-tyypin botuliinitoksiinihoidon soveltuvuus potilaalle arvioidaan uudelleen
Toistettujen Azzalure-injektioiden tehoa ja turvallisuutta on tutkittu kulmakarvojen välisten uurteiden hoidossa 24 kuukauteen ja 8 toistettuun hoitojaksoon saakka ja silmänurkkien uurteiden hoidossa 12 kuukauteen ja 5 toistettuun hoitojaksoon saakka.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille;
- Ehdotetussa injektiokohdassa on infektio;
- Potilaalla on myasthenia gravis, Lambert-Eatonin myasteeninen oireyhtymä (LEMS) tai amyotrofinen lateraaliskleroosi (ALS).
Varoitukset ja käyttöön liittyvät varotoimet
On varmistettava huolellisesti, että Azzalurea ei injisoida verisuoneen.
Aiemmin todetut hermo-lihasliitoksen häiriöt
Azzaluren käytössä on noudatettava varovaisuutta, jos potilaalla on kliinistä näyttöä voimakkaista hermo-lihasliitoksen häiriöistä tai tällaisten häiriöiden riski. Nämä potilaat saattavat olla tavanomaista herkempiä Azzaluren kaltaisille aineille, mikä voi aiheuttaa liiallista lihasheikkoutta.
Azzalure-injektioiden käyttöä ei suositella, jos potilaalla on aiemmin esiintynyt dysfagiaa tai aspirointia.
Toksiinin vaikutuksen leviäminen paikallisesti tai muualle elimistöön
Botuliinitoksiinin käytön yhteydessä on ilmoitettu hyvin harvoin haittavaikutuksia, jotka voivat liittyä toksiinin vaikutusten leviämiseen antopaikasta muualle elimistöön. Hoitoannoksia saaneilla potilailla voi esiintyä korostuneen voimakasta lihasheikkoutta. Nielemis- ja hengitysvaikeudet ovat vakavia ja voivat johtaa kuolemaan.
Potilaille tai heidän hoitajilleen tulee kertoa, että potilaan on hakeuduttava välittömästi lääkärin hoitoon, jos hänelle kehittyy nielemis-, puhe- tai hengitysvaikeuksia.
Suositusten mukaista Azzalure-annosta tai -antotiheyttä ei saa ylittää.
On erittäin tärkeää, että potilaan kasvojen anatomia tutkitaan ennen Azzaluren antoa. Kasvojen epäsymmetria, ptoosi, silmäluomien ihon huomattava riippuminen, arvet ja aiempien kirurgisten toimenpiteiden aiheuttamat anatomiset muutokset tulee ottaa huomioon.
Varovaisuutta on noudatettava, jos suunnitellussa Azzalure-injektiokohdassa on tulehdusta tai kohdelihas on hyvin heikko tai atrofinen.
Kuten kaikkia lihakseen annettavia injektioita käytettäessä, Azzalure-hoitoa ei suositella potilaille, joiden verenvuotoaika on pidentynyt.
Kuivasilmäisyyttä on ilmoitettu potilailla, jotka ovat saaneet Azzalure-valmistetta kulmakarvojen välisten uurteiden ja silmänurkkien uurteiden hoitoon (ks. kohta Haittavaikutukset). Botuliinitoksiinivalmisteiden, myös Azzalure-valmisteen, käytön yhteydessä voi ilmetä kyynelnesteen erityksen vähentymistä, silmien räpyttelyn vähenemistä ja sarveiskalvon häiriöitä.
Vasta-aineenmuodostus
Tavanomaista tiheämmin tai suurempina annoksina annetut injektiot voivat suurentaa botuliinitoksiinivasta-aineiden kehittymisriskiä. Neutraloivien vasta-aineiden kehittyminen voi heikentää myöhempien hoitojen kliinistä tehokkuutta.
Botuliinitoksiiniyksiköt eivät ole sovellettavissa eri valmisteiden välillä. Speywood-yksikköinä suositellut annokset ovat erilaisia kuin muiden botuliinitoksiinivalmisteiden annokset.
On ehdottoman tärkeää, että Azzalurea käytetään vain yhden potilaan hoitoon ja vain yhdellä hoitokerralla. Yli jäävä käyttämätön valmiste tulee hävittää kohdassa Käyttö- ja käsittelyohjeet kuvatulla tavalla. Lääkkeen valmistelussa ja annossa ja yli jääneen käyttämättömän liuoksen inaktivoinnissa ja hävittämisessä tulee noudattaa erityisiä varotoimia (ks. kohta Käyttö- ja käsittelyohjeet).
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Azzaluren ja aminoglykosidien tai muiden hermo-lihasliitoksen toimintaan vaikuttavien aineiden (esim. kuraren kaltaisten aineiden) samanaikaisessa käytössä on noudatettava varovaisuutta, sillä A-tyypin botuliinitoksiinin vaikutus saattaa voimistua.
Yhteisvaikutustutkimuksia ei ole tehty. Mitään muita kliinisesti merkityksellisiä yhteisvaikutuksia ei ole ilmoitettu.
Raskaus ja imetys
Raskaus
Azzalurea ei tule käyttää raskauden aikana. Ei ole olemassa tarkkoja tietoja A-tyypin botuliinitoksiinin käytöstä raskaana oleville naisille. Eläintutkimuksissa on havaittu lisääntymistoksisuutta suuria annoksia käytettäessä (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta.
Imetys
Ei tiedetä, erittyykö Azzalure ihmisen rintamaitoon. Azzaluren käyttö imetyksen aikana ei ole suositeltavaa.
Hedelmällisyys
Azzaluren vaikutuksesta hedelmällisyyteen ei ole olemassa kliinistä tietoa. Eläinkokeissa ei ole saatu näyttöä Azzaluren suorasta vaikutuksesta hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Azzalurella on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn.
Valmisteen käyttöön liittyy paikallisen lihasheikkouden, näköhäiriöiden tai voimattomuuden riski. Nämä oireet voivat heikentää tilapäisesti ajokykyä ja koneiden käyttökykyä.
Haittavaikutukset
Noin 3 800 potilasta altistui Azzalurelle kliinisissä tutkimuksissa.
Lumekontrolloitujen kliinisten tutkimusten perusteella haittavaikutusten esiintymistiheys ensimmäisen Azzalure-injektion jälkeen oli 22,3 % kulmakarvojen välisiä uurteita hoidettaessa (16,6 % lumehoitoa saaneilla) ja 6,2 % silmänurkkien uurteita hoidettaessa (2,9 % lumehoitoa saaneilla). Useimmat näistä tapahtumista olivat vaikeusasteeltaan lieviä tai kohtalaisia ja korjautuvia.
Yleisimmin esiintyviä haittavaikutuksia olivat kulmakarvojen välisiä uurteita hoidettaessa päänsärky ja injektiokohdan reaktiot, ja silmänurkkien uurteita hoidettaessa päänsärky, injektiokohdan reaktiot ja silmäluomien turvotus. Yleensä hoitoon tai injektiotekniikkaan liittyvät reaktiot ilmenivät ensimmäisen viikon aikana injektiosta ja ne olivat ohimeneviä. Hoitoon/injektiotekniikkaan liittyvien reaktioiden esiintymistiheys pieneni, kun hoitojaksoja toistettiin. Haittavaikutukset voivat liittyä vaikuttavaan aineeseen, injektiotapaan tai niiden yhdistelmään.
Azzaluren turvallisuusprofiilia kulmakarvojen välisten ja silmänurkkien uurteiden samanaikaisessa hoidossa selvitettiin vaiheen III tutkimuksen avoimessa osassa. Haittavaikutusten luonne ja esiintymistiheys olivat verrattavissa siihen, mitä on havaittu hoidettaessa potilaita näissä käyttöaiheissa erikseen.
Haittavaikutusten esiintymistiheys on luokiteltu seuraavasti:
hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), hyvin harvinaiset (< 1/10 000), yleisyys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Kulmakarvojen väliset uurteet:
| Immuunijärjestelmä | Melko harvinaiset Yliherkkyys |
| Hermosto | Hyvin yleiset Yleiset Tilapäinen kasvojen pareesi (johtuu injektiokohdasta proksimaalisesti sijaitsevien kasvolihasten tilapäisestä pareesista, koskee lähinnä otsan pareesia) Melko harvinaiset |
| Silmät | Yleiset Melko harvinaiset Harvinaiset |
| Iho ja ihonalainen kudos | Melko harvinaiset Harvinaiset |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset Pistoskohdan reaktiot (esim. punoitus, turvotus, ärsytys, ihottuma, kutina, tuntoharha, kipu, epämukavuus, kirvely ja mustelmanmuodostus) |
Silmänurkan uurteet:
| Elinjärjestelmäluokka | Haittavaikutus |
| Hermosto | Yleiset Päänsärky Tilapäinen kasvojen pareesi (injektiokohdasta proksimaalisesti sijaitsevien kasvolihasten tilapäinen pareesi) |
| Silmät | Yleiset Melko harvinaiset |
| Yleisoireet ja antopaikassa todettavat haitat | Yleiset Pistoskohdan reaktiot (esim. mustelma, kutina ja turvotus) |
Haittavaikutuksia, jotka johtuvat toksiinin vaikutuksen leviämisestä kauas injektiopaikasta, on raportoitu hyvin vähän botuliinitoksiinin yhteydessä (merkittävä lihasheikkous, dysfagia, keuhkokuume ja ne voivat joissakin tapauksissa olla fataaleja) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Myyntiluvan saamisen jälkeinen kokemus
| Elinjärjestelmä | Haittavaikutus | Yleisyys |
| Immuunijärjestelmä | Yliherkkyys | Tuntematon |
| Hermosto | Hypestesia | Tuntematon |
| Luusto, lihakset ja sidekudos | Lihasatrofia | Tuntematon |
| Yleisoireet ja antopaikassa todettavat haitat | Voimattomuus, uupumus, influenssan kaltainen sairaus | Tuntematon |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Liialliset botuliinitoksiiniannokset voivat oletettavasti aiheuttaa hermo-lihasheikkoutta ja monia erilaisia oireita. Ventilaatiotuki voi olla tarpeen, jos liiallinen annos johtaa hengityslihasten halvautumiseen. Yliannostustapauksessa lääkärin tulee seurata potilaan tilaa liiallisen lihasheikkouden tai lihasten halvautumisen varalta. Tarvittaessa on annettava oireenmukaista hoitoa.
Yliannoksen oireet eivät välttämättä ilmene heti injektion jälkeen.
Sairaalahoitoa tulee harkita, jos potilaalla on A-tyypin botuliinitoksiinimyrkytyksen merkkejä (esim. lihasheikkoutta, ptoosia, diplopiaa ja nielemis- ja puhehäiriöitä tai hengityslihasten pareesia).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut perifeerisesti vaikuttavat lihasrelaksantit, ATC-koodi: M03AX01.
A-tyypin Clostridium botulinum -toksiinin ensisijainen farmakodynaaminen vaikutus johtuu hoidetun lihaksen kemiallisesta denervaatiosta, joka johtaa lihaksen toimintapotentiaalin mitattavaan pienenemiseen ja lihastoiminnan paikalliseen vähenemiseen tai lihaksen halvautumiseen.
A-tyypin botuliinitoksiini on lihasrelaksantti, joka tilapäisesti heikentää lihasten toimintaa. Injektion jälkeen A-tyypin botuliinitoksiini toimii estämällä hermovälittäjäaine asetyylikoliinin kuljetuksen läpi hermo-lihasliitoksen, joka sijaitsee hermonpäätteen ja lihassäikeen välillä. A-tyypin botuliinitoksiinin vaikutustapaan kuuluu neljä päävaihetta, joista kaikkien tulee toimia oikein, jotta vaikutus ilmenee. Vaikutus johtaa lihassupistuksen estymiseen kohdelihaksissa. Vaikutus jatkuu pitkäaikaisesti, kunnes hermo-lihasliitos on palautunut ja lihaksen toiminta palaa ennalleen.
Kliiniset tiedot
Azzalure-valmisteen kliinisen tutkimusohjelman aikana kliinisiin tutkimuksiin osallistui yli 4 500 potilasta, ja noin 3 800 potilasta altistui Azzalurelle.
Kulmakarvojen väliset uurteet
Kliinisissä tutkimuksissa 2 032 potilasta, joilla oli keskisyviä tai syviä pystysuoria uurteita kulmakarvojen välissä, sai hoitoa 50 Speywood-yksikön suuruisilla suositusannoksilla. 305 heistä sai hoitoa 50 yksikön annoksilla kahdessa vaiheen III kaksoissokkoutetussa, lumekontrolloidussa avaintutkimuksessa ja 1 200 sai hoitoa 50 yksikön annoksilla avoimessa, toistuvilla annoksilla tehdyssä vaiheen III pitkäaikaistutkimuksessa. Loput potilaat saivat hoitoa tukitutkimuksissa ja vaihtelevilla annoksilla toteutetuissa tutkimuksissa.
Vasteen alkamiseen kulunut mediaaniaika oli 2-3 vrk hoidosta, ja maksimaalinen vaikutus havaittiin päivään 30 mennessä. Azzalure-injektiot vähensivät merkitsevästi kulmakarvojen välisten pystysuorien uurteiden syvyyttä molemmissa vaiheen III lumekontrolloiduissa avaintutkimuksissa enintään 4 kk ajan. Toisessa näistä avaintutkimuksista vaikutus oli edelleen merkitsevä 5 kk kuluttua.
30 päivän kuluttua injektiosta tutkijoiden arvio osoitti, että 90 % potilaista (273/305) oli saavuttanut hoitovasteen (kulmakarvojen välissä ei lainkaan tai vain lieviä pystysuoria uurteita, kun otsaa rypistettiin maksimaalisesti), kun taas lumeryhmässä vastaava osuus oli 3 % (4/153). Viisi kuukautta injektion annon jälkeen 17 % (32/190) Azzalure-hoitoa saaneista potilaista reagoivat yhä hoitoon, kun taas kyseisessä tutkimuksessa vastaava luku plaseboa saaneilla potilailla oli 1 % (1/92). Kun potilaat arvioivat omaa tilannettaan maksimaalisen otsan rypistyksen yhteydessä, 82 % (251/305) Azzalure-hoitoa saaneista ja 6 % (9/153) lumehoitoa saaneista arvioi saavuttaneensa hoitovasteen. Eräässä vaiheen III avaintutkimuksessa tutkijat arvioivat, miten suurella osuudella potilaista tilanne oli lievittynyt kahden arviointiportaan verran otsan maksimaalisen rypistykseen yhteydessä; kyseinen osuus oli 77 % (79/103).
177 potilaan alaryhmällä oli levossa keskisyviä tai syviä pystysuoria uurteita kulmakarvojen välissä ennen hoitoa. Kun tutkijat arvioivat tätä potilasryhmää 30 päivän kuluttua hoidosta, he arvioivat 71 %:n (125/177) Azzalure-potilaista saavuttaneen vasteen; lumeryhmässä vastaava osuus oli 10 % (8/78).
Avoimessa, toistuvilla annoksilla tehdyssä pitkäaikaistutkimuksessa todettiin, että vasteen alkamiseen kuluva 3 päivän mediaaniaika pysyi samana, kun hoitojaksoja toistettiin. Kun tutkijat arvioivat potilaiden tilanteen otsan maksimaalisen rypistyksen yhteydessä päivänä 30, vasteprosentti pysyi samana eri hoitojaksojen yhteydessä (ja vaihteli 80 %:sta 91 %:iin 5 hoitojakson aikana). Myös toistuvien hoitojaksojen yhteydessä tutkittu vasteprosentti levossa oli samaa luokkaa kuin kerta-annostutkimuksissa (tutkijoiden arvioiden mukaan Azzalure-ryhmän vasteprosentti 30 päivän kuluttua hoidosta oli 56-74 %).
Silmänurkkien uurteet
Kliinisissä kaksoissokkotutkimuksissa hoidettiin suositellulla annoksella (30 Speywood-yksikköä puolta kohden) 308 potilasta, joilla oli maksimaalisesti hymyillessä keskisyviä tai syviä uurteita silmänurkissa. Näistä potilaista 252 hoidettiin vaiheen III kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa ja 56 potilasta vaiheen II kaksoissokkoutetussa annosvälitutkimuksessa.
Vaiheen III tutkimuksessa Azzalure-injektiot vähensivät lumehoitoon verrattuna merkitsevästi silmänurkkien uurteiden vaikeusastetta (p ≤ 0,001) 4, 8 ja 12 viikon kohdalla (tutkijoiden arvio maksimaalisesti hymyillessä). Kun tutkittavat arvioivat tyytyväisyyttä silmänurkkien uurteiden ulkonäköön, Azzaluren ja lumehoidon välillä oli merkitsevä ero (p ≤ 0,010) Azzaluren hyväksi 4, 8, 12 ja 16 viikon kohdalla.
Tehon ensisijainen päätetapahtuma 4 viikon kuluttua injektiosta: Tutkijoiden arvio osoitti, että 47,2 % (119/252) potilaista oli vastannut hoitoon (ei uurteita tai vähäisiä uurteita silmänurkissa maksimaalisesti hymyillessä), kun taas vastaava luku lumehoitoryhmässä oli 7,2 % (6/83).
Post hoc -analyysissä samassa aikapisteessä, 4 viikkoa injektion jälkeen, 75 % (189/252) Azzalure-hoitoa saaneista potilaista oli saavuttanut vähintään yhden asteen paranemisen maksimaalisesti hymyillessä, kun taas vastaava luku lumehoitoryhmässä oli vain 19 % (16/83).
Yhteensä 315 tutkittavaa osallistui vaiheen III tutkimuksen avoimeen jatkovaiheeseen, jossa he saattoivat saada hoitoa samanaikaisesti sekä silmänurkkien että kulmakarvojen välisiin uurteisiin.
Vaiheen III tutkimuksen kaksoissokko- ja avoimessa vaiheessa Azzalure-hoitoa saaneet potilaat saivat mediaanimäärän 3 hoitoa silmänurkkien uurteisiin. Mediaaniaika silmänurkkien uurteisiin saatujen injektioiden välillä riippui suurelta osin tutkimussuunnitelmasta ja vaihteli 85:sta 108:aan päivään. Tulokset osoittivat, että teho säilyy toistetuissa hoidoissa yli yhden vuoden ajan.
Potilaiden tyytyväisyystasot viikolla 4, 16 ja 52 osoittavat, että ensimmäisen Azzalure-hoidon jälkeen 165 tutkittavaa 252:sta (65,5 %) oli joko hyvin tyytyväisiä tai tyytyväisiä silmänurkkiensa uurteiden ulkonäköön.
Viikolla 16, 4 viikkoa sen jälkeen, kun Azzalure-ryhmään A-osassa satunnaistetut saivat Azzalure-hoitoa tai lumehoitoryhmään satunnaistetut saivat lumehoitoa, hyvin tyytyväisten tai tyytyväisten osuus oli 233/262 (89,0 %). Viikolla 52, kun tutkittavat olivat voineet saada enintään viisi hoitojaksoa Azzalure-hoitoa, joista viimeinen oli ollut viikolla 48, hyvin tyytyväisten/tyytyväisten tutkittavien osuus oli 255/288 (84,7 %).
Yhdenkään potilaan toksiinia neutraloivien vasta-aineiden testitulos ei ollut positiivinen sen jälkeen, kun he olivat saaneet toistetusti Azzalure-hoitoa yli yhden vuoden ajan.
Farmakokinetiikka
Kun suositusannoksia Azzalurea annetaan injektiona lihakseen, lääkettä ei oletettavasti esiinny ääreisveressä mitattavina pitoisuuksina. Näin ollen Azzaluren farmakokinetiikkaa ei ole tutkittu.
Prekliiniset tiedot turvallisuudesta
Rotalla ja kanilla tehdyissä lisääntymistutkimuksissa havaittiin vaikeaa emoon kohdistuvaa toksisuutta ja alkioiden kiinnittymisen heikkenemistä suuria annoksia käytettäessä. Alkio-/sikiötoksisuutta ei havaittu, kun kanille annettiin 60 kertaa ihmisen suositusannoksia (50 yks.) ja rotalle 100 kertaa ihmisen suositusannoksia vastaavia annoksia. Näillä lajeilla ei havaittu teratogeenisuutta. Uros- ja naarasrottien hedelmällisyys heikkeni, sillä suurten annosten aiheuttama lihasten halvautuminen vähensi parittelua.
Rotalla tehdyssä pitkäaikaistoksisuustutkimuksessa ei havaittu mitään systeemiseen toksisuuteen viittaavaa, kun eläimille annettiin 75 kertaa ihmisen suositusannoksia (50 yks.) vastaavia annoksia, jotka jaettiin puoliksi oikeaan ja vasempaan pakaralihakseen.
Akuuttia toksisuutta, pitkäaikaistoksisuutta ja pistoskohdan paikallista siedettävyyttä koskeneissa tutkimuksissa ei havaittu epätavallisia paikallisia tai systeemisiä haittavaikutuksia kliinisesti relevantteja annoksia käytettäessä.
Farmaseuttiset tiedot
Apuaineet
Ihmisen albumiini, 200 g/l, laktoosimonohydraatti.
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
2 vuotta.
Käyttövalmis liuos:
Valmisteen on osoitettu pysyvän kemiallisesti ja fysikaalisesti stabiilina 24 tunnin ajan 2 °C – 8 °C:ssa. Mikrobiologiselta kannalta valmiste tulee käyttää välittömästi, ellei valmistuksessa ole käytetty menetelmää, joka estää mikrobikontaminaation.
Jos liuosta ei käytetä välittömästi, sen säilytysaika ja käyttö ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Avaamattoman Azzalure-injektiopullon voi käyttää sen jälkeen, kun se on kerran altistunut korkeintaan 25 °C:n lämpötilalle enintään 72 tuntia, minkä jälkeen avaamaton injektiopullo on säilytettävä jääkaapissa (2 °C – 8 °C) kestoajan loppuun asti.
Ei saa jäätyä.
Käyttövalmiiksi sekoitetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
AZZALURE injektiokuiva-aine, liuosta varten
125 Speywood-yksikköä (L:kyllä) 2 x 125 U (255,53 €)
PF-selosteen tieto
125 Speywood-yksikköä kuiva-aineessa injektiopullossa (tyypin I lasia), jossa tulppa (halobutyylia) ja sinetti (alumiinia).
Pakkauskoot: 1 tai 2 injektiopulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kuiva-aine on valkoista.
Käyttö- ja käsittelyohjeet
Käyttö-, käsittely- ja hävittämisohjeita on noudatettava tarkoin.
Käyttöönvalmistuksessa on noudatettava hyviä käytäntöjä etenkin aseptiikan suhteen.
Azzalure on saatettava käyttövalmiiksi 9 mg/ml (0,9 %) NaCl-injektionesteellä.
Alla olevan laimennustaulukon mukainen määrä 9 mg/ml (0,9 %) natriumkloridi-injektionestettä vedetään ruiskuun, jotta saadaan käyttövalmis kirkas ja väritön liuos, jonka pitoisuus on seuraava:
Lisätyn liuottimen määrä | Saatava annos |
| 0,63 ml | 10 yksikköä (0,05 ml:aa kohti) |
| 1,25 ml | 10 yksikköä (0,1 ml:aa kohti) |
0,63 ml:n tai 1,25 ml:n tilavuus pystytään mittaamaan tarkasti ruiskuilla, joihin on merkitty mitta-asteikko, jonka mittavälit ovat 0,1 ml ja 0,01 ml.
KONTAMINOITUNEEN MATERIAALIN HÄVITTÄMISTÄ KOSKEVAT SUOSITUKSET
Käyttämätön, käyttövalmiiksi sekoitettu Azzalure (injektiopullossa tai ruiskussa) tulee inaktivoida 2 ml:lla laimeaa 0,55 % tai 1 % natriumhypokloriittiliuosta (Dakinin liuos) välittömästi käytön jälkeen ja ennen hävittämistä.
Käytettyjä injektiopulloja, ruiskuja ja materiaaleja ei pidä tyhjentää, vaan ne tulee asettaa asianmukaisiin astioihin ja hävittää paikallisten vaatimusten mukaisesti.
SUOSITUKSET BOTULIINITOKSIININ KÄSITTELYN YHTEYDESSÄ MAHDOLLISESTI TAPAHTUVIEN VAHINKOJEN VARALTA
- Kaikki kuiva-aineroiskeet on pyyhittävä runsaaseen natriumhypokloriittiliuokseen (valkaisuaineeseen) kastetulla imukykyisellä materiaalilla. Käyttövalmiin liuoksen roiskeet taas pyyhitään kuivalla, imukykyisellä materiaalilla.
- Kontaminoituneet pinnat tulee puhdistaa runsaaseen natriumhypokloriittiliuokseen (valkaisuaineeseen) kastetulla imukykyisellä materiaalilla, minkä jälkeen pinnat kuivataan.
- Jos injektiopullo rikkoutuu, toimitaan edellä kuvattuun tapaan. Lasinsirpaleet kerätään ja valmiste pyyhitään varovasti, ihon rikkoutumista välttäen.
- Jos valmistetta joutuu iholle, altistunut alue pestään natriumhypokloriittiliuoksella (valkaisuaine) ja huuhdellaan sitten runsaalla vedellä.
- Jos valmistetta joutuu silmiin, ne tulee huuhdella runsaalla vedellä tai silmähuuhteella.
- Jos valmistetta joutuu haavaan, viiltoon tai ihovaurioon, alue huuhdellaan runsaalla vedellä, minkä jälkeen ryhdytään asianmukaisiin hoitotoimiin injisoidun annoksen mukaisesti.
Näitä käyttö-, käsittely- ja hävittämisohjeita on noudatettava tarkoin.
Korvattavuus
AZZALURE injektiokuiva-aine, liuosta varten
125 Speywood-yksikköä 2 x 125 U
- Ei korvausta.
ATC-koodi
M03AX01
Valmisteyhteenvedon muuttamispäivämäärä
13.10.2025
Yhteystiedot
Seminariegatan 21
SE-752 28 Uppsala
Sverige
+46 18 444 0330
www.galdermanordic.com
nordic@galderma.com
