NUMETA G16E infuusioneste, emulsio
Vaikuttavat aineet ja niiden määrät
Tämä lääkevalmiste on pakattu kolmiosastoiseen pussiin. Kukin pussi sisältää steriiliä pyrogeenitonta glukoosiliuosta, elektrolyyttejä sisältävää pediatrista aminohappoliuosta ja lipidiemulsiota seuraavat määrät:
Pussin koko | Glukoosiliuos, 50 g/100 ml | Elektrolyyttejä sisältävä aminohappoliuos, 5,9 g/100 ml | Lipidiemulsio, 12,5 g/100 ml |
500 ml | 155 ml | 221 ml | 124 ml |
Jos potilaalle ei haluta antaa lipidejä, pussista voidaan avata vain elektrolyyttejä sisältävän aminohappoliuososaston ja glukoosiliuososaston välinen sauma ja jättää aminohappoliuos- ja lipidiemulsio-osaston välinen sauma ehjäksi. Pussin sisältö voidaan siis infusoida lipidien kanssa tai ilman niitä. Seuraava taulukko sisältää lääkevalmisteen koostumuksen, kun pussista on sekoitettu kahden osaston sisältö (aminohappo- ja glukoosiliuos, kaksi sekoitettua osastoa, 376 ml liuosta) tai kolmen osaston sisältö (aminohappo- ja glukoosiliuos sekä lipidiemulsio, kolme sekoitettua osastoa, 500 ml emulsiota).
Koostumus | ||
Vaikuttava aine | Kaksi osastoa sekoitettu (376 ml) | Kolme osastoa sekoitettu (500 ml) |
Aminohappoliuososasto | ||
Alaniini | 1,03 g | 1,03 g |
Arginiini | 1,08 g | 1,08 g |
Asparagiinihappo | 0,77 g | 0,77 g |
Kysteiini | 0,24 g | 0,24 g |
Glutamiinihappo | 1,29 g | 1,29 g |
Glysiini | 0,51 g | 0,51 g |
Histidiini | 0,49 g | 0,49 g |
Isoleusiini | 0,86 g | 0,86 g |
Leusiini | 1,29 g | 1,29 g |
Lysiinimonohydraatti (lysiininä) | 1,59 g (1,42 g) | 1,59 g (1,42 g) |
Metioniini | 0,31 g | 0,31 g |
Ornitiinihydrokloridi (ornitiinina) | 0,41 g (0,32 g) | 0,41 g (0,32 g) |
Fenyylialaniini | 0,54 g | 0,54 g |
Proliini | 0,39 g | 0,39 g |
Seriini | 0,51 g | 0,51 g |
Tauriini | 0,08 g | 0,08 g |
Treoniini | 0,48 g | 0,48 g |
Tryptofaani | 0,26 g | 0,26 g |
Tyrosiini | 0,10 g | 0,10 g |
Valiini | 0,98 g | 0,98 g |
Natriumkloridi | 0,30 g | 0,30 g |
Kaliumasetaatti | 1,12 g | 1,12 g |
Kalsiumklorididihydraatti | 0,46 g | 0,46 g |
Magnesiumasetaattitetrahydraatti | 0,33 g | 0,33 g |
Natriumglyserofosfaatti, hydratoitu | 0,98 g | 0,98 g |
Glukoosiliuososasto | ||
Glukoosimonohydraatti (vedettömänä glukoosina) | 85,25 g (77,50 g) | 85,25 g (77,50 g) |
Lipidiemulsio-osasto | ||
Puhdistettu oliiviöljy (n. 80 %) + puhdistettu soijaöljy (n. 20 %) | – | 15,5 g |
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Sekoitetun liuoksen/emulsion koostumus:
Koostumus | ||||
Kaksi osastoa sekoitettu | Kolme osastoa sekoitettu | |||
Tilavuusyksikköä kohden (ml) | 376 | 100 | 500 | 100 |
Typpi (g) | 2,0 | 0,52 | 2,0 | 0,39 |
Aminohapot (g) | 13,0 | 3,5 | 13,0 | 2,6 |
Glukoosi (g) | 77,5 | 20,6 | 77,5 | 15,5 |
Lipidit (g) | 0 | 0 | 15,5 | 3,1 |
Energia | ||||
Kokonaiskalorit (kcal) | 362 | 96 | 517 | 103 |
Proteiinittomat kalorit (kcal) | 310 | 82 | 465 | 93 |
Glukoosikalorit (kcal) | 310 | 82 | 310 | 62 |
Lipidikalorit (kcal)a | 0 | 0 | 155 | 31 |
Proteiinittomien kalorien kalori-typpisuhde (kcal/g typpi) | 158 | 158 | 237 | 237 |
Lipidikaloreiden osuus proteiinittomista kaloreista | Ei oleellinen | Ei oleellinen | 33 | 33 |
Lipidikaloreiden osuus kokonaiskaloreista | Ei oleellinen | Ei oleellinen | 30 | 30 |
Elektrolyytit | ||||
Natrium (mmol) | 11,6 | 3,1 | 12,0 | 2,4 |
Kalium (mmol) | 11,4 | 3,0 | 11,4 | 2,3 |
Magnesium (mmol) | 1,6 | 0,41 | 1,6 | 0,31 |
Kalsium (mmol) | 3,1 | 0,82 | 3,1 | 0,62 |
Fosfaattib (mmol) | 3,2 | 0,85 | 4,4 | 0,87 |
Asetaatti (mmol) | 14,5 | 3,9 | 14,5 | 2,9 |
Malaatti (mmol) | 4,3 | 1,1 | 4,3 | 0,86 |
Kloridi (mmol) | 13,8 | 3,7 | 13,8 | 2,8 |
pH (n.) | 5,5 | 5,5 | 5,5 | 5,5 |
Osmolaarisuus n. (mOsm/l) | 1585 | 1585 | 1230 | 1230 |
a Sisältää kananmunan fosfolipidien (injektionestettä varten) kalorit.
b Sisältää lipidiemulsion sisältämän kananmunan fosfolipidien (injektionestettä varten) fosfaatin.
Lääkemuoto
Infuusioneste, emulsio.
Ulkonäkö ennen sekoitusta:
- Aminohappo- ja glukoosiliuokset ovat kirkkaita, värittömiä tai hieman kellertäviä.
- Lipidiemulsio on homogeeninen ja maitomainen.
Kliiniset tiedot
Käyttöaiheet
Numeta G16E on tarkoitettu parenteraaliseen ravinnon antoon täysiaikaisille vastasyntyneille ja enintään 2-vuotiaille lapsille, kun ravinnon anto oraalisesti tai enteraalisesti on mahdotonta, riittämätöntä tai vasta-aiheista.
Annostus ja antotapa
Annostus
Annos valitaan potilaan energiankulutuksen, painon, iän ja sairaustilan mukaan. Annos riippuu myös potilaan kyvystä metaboloida Numeta G16E-valmisteen aineita sekä oraalisesti tai enteraalisesti annetusta lisäenergiasta tai lisäproteiinista. Elektrolyyttien ja makroravintoaineiden kokonaismäärä määräytyy sekoitettujen osastojen lukumäärän mukaan (ks. kohta Vaikuttavat aineet ja niiden määrät).
Päivittäistä enimmäisannosta ei pidä ylittää. Monikammiopussin valmiin koostumuksen vuoksi voi olla mahdollista, että potilaan kaikkia ravitsemustarpeita ei voida tyydyttää. Voi olla kliinisiä tilanteita, joissa potilaille pitää antaa eri määriä ravitsemusta kuin mitä valmiin pussin koostumuksessa on.
Suurin suositeltu infuusionopeus tunnissa ja saantitilavuus vuorokaudessa riippuvat koostumuksesta. Suurin vuorokausiannos määräytyy ensimmäiseksi saavutettavan raja-arvon mukaan. Suurin suositeltu infuusionopeus tunnissa ja saantitilavuus vuorokaudessa:
Kaksi osastoa sekoitettu (376 ml) | Kolme osastoa sekoitettu (500 ml) | |
| Suurin infuusionopeus (ml/kg/h) | 5,8 | 5,5 |
| Joka vastaa: | ||
| Aminohapot (g/kg/h) | 0,20a | 0,14 |
| Glukoosi (g/kg/h) | 1,2 | 0,85 |
| Lipidit (g/kg/h) | 0 | 0,17a |
| Enimmäismäärä (ml/kg/vuorokausi) | 72,3 | 96,2 |
| Joka vastaa: | ||
| Aminohapot (g/kg/vuorokausi) | 2,5a | 2,5a |
| Glukoosi (g/kg/vuorokausi) | 14,9 | 14,9 |
| Lipidit (g/kg/vuorokausi) | 0 | 3,0 |
a Rajoittava parametri ESPEN-ESPGHAN-ohjeiden mukaan.
Antotapa
Infuusionesteen, liuoksen/emulsion, sekoitus- ja käyttöohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Kun lääkettä käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, emulsio (pusseissa ja antovälineistössä) on suojattava valolta, kunnes emulsion antaminen on saatettu loppuun (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Kestoaika ja Käyttö- ja käsittelyohjeet).
1,2 mikrometrin suodattimen käyttöä suositellaan Numeta G16E-valmisteen annostelussa.
Suuren osmolaarisuuden vuoksi laimentamaton Numeta G16E voidaan antaa vain keskuslaskimoon. Jos Numeta G16E-valmistetta laimennetaan kuitenkin riittävästi injektionesteisiin käytettävällä vedellä, sen osmolaarisuus laskee ja se voidaan antaa ääreislaskimoon.
Alla olevalla kaavalla esitetään, miten laimennus vaikuttaa pussien osmolarisuuteen.
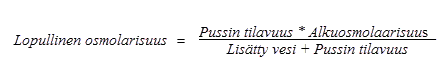
Alla olevassa taulukossa on esimerkkejä pussien osmolaarisuudesta injektionesteisiin käytettävän veden lisäämisen jälkeen, kun pussista on sekoitettu kahden tai kolmen osaston sisältö:
| Aminohappo- ja glukoosiliuos (kaksi osastoa sekoitettu) | Aminohappo- ja glukoosiliuos sekä lipidiemulsio (kolme osastoa sekoitettu) | |
| Pussin alkutilavuus (ml) | 376 | 500 |
| Pussin alkuosmolaarisuus (mOsm/l, n.) | 1585 | 1230 |
| Lisätyn veden tilavuus (ml) | 376 | 500 |
| Lopullinen tilavuus lisäysten jälkeen (ml) | 752 | 1000 |
| Osmolaarisuus lisäysten jälkeen (mOsm/l, n.) | 792,5 | 615 |
Infuusionopeutta suurennetaan vähitellen ensimmäisen tunnin aikana. Lopetettaessa infuusionopeutta lasketaan vähitellen viimeisen tunnin aikana. Antonopeutta määrättäessä on otettava huomioon annoksen suuruus, saantitilavuus vuorokaudessa ja infuusion kesto (ks. kohta Yliannostus).
Valmiiksi sekoitettua pussia ei saa kuitenkaan säilyttää tai pitää ripustettuna yli 24 tuntia, eikä siitä saa infusoida yli 24 tunnin ajan. Jaksottaiset infuusiot on määrättävä potilaan aineenvaihdunnan sietokyvyn mukaan.
Parenteraalisen ravinnon antoa voidaan jatkaa niin kauan kuin potilaan vointi sitä edellyttää.
Valmiste sisältää elektrolyyttejä, ja siihen voidaan lisätä elektrolyyttivalmisteita lääkärin harkinnan ja potilaan kliinisten tarpeiden mukaan (ks. kohta Käyttö- ja käsittelyohjeet).
Valmisteeseen voidaan lisätä vitamiineja ja hivenaineita lääkärin harkinnan ja potilaan kliinisten tarpeiden mukaan (ks. kohta Käyttö- ja käsittelyohjeet).
Vasta-aiheet
Laskimonsisäisen Numeta G16E-infuusionesteen annolla (pussista, josta on sekoitettu kahden osaston sisältö) on seuraavia yleisiä vasta-aiheita:
- yliherkkyys kananmunalle, soija- tai maapähkinäproteiinille, vaikuttaville aineille, kohdassa Apuaineet listatuille apuaineille tai pussin ainesosille.
- synnynnäinen epänormaali aminohappoaineenvaihdunta.
- natriumin, kaliumin, magnesiumin, kalsiumin ja/tai fosforin epänormaalin suuri pitoisuus plasmassa.
- kuten muiden kalsiumia sisältävien infuusioliuosten käytön yhteydessä, samanaikainen käyttö keftriaksonin kanssa vastasyntyneille vauvoille (≤ 28 päivän ikäiset), vaikka erillistä infuusioletkua käytettäisiin (fataalin keftriaksonin kalsiumsuolan saostumisen riski vastasyntyneen verenkierrossa). Katso kohdat Yhteisvaikutukset ja Yhteensopimattomuudet.
- vaikea hyperglykemia.
Lipidien lisääminen (laskimonsisäisen Numeta G16E-infuusionesteen anto pussista, josta on sekoitettu kolmen osaston sisältö) on vasta-aiheista myös seuraavissa kliinisissä tilanteissa:
- vaikea hyperlipidemia tai hypertriglyseridemialle tunnusomaiset vaikeat rasva-aineenvaihdunnan häiriöt.
Varoitukset ja käyttöön liittyvät varotoimet
Infuusio on lopetettava välittömästi, jos potilaalla esiintyy allergisten reaktioiden oireita (kuten kuumetta, hikoilua, vilunväreitä, päänsärkyä, ihottumaa tai hengenahdistusta).
Numeta G16E sisältää glukoosia, joka on peräisin maissitärkkelyksestä. Tämän vuoksi Numeta G16E-valmistetta on annettava varoen potilaille, jotka ovat allergisia maissille tai maissituotteille.
Fataaleja kalsium-keftriaksonisaostuma-reaktioita keuhkoissa ja munuaisissa alle 1 kuukauden ikäisillä täysiaikaisilla vastasyntyneillä on havaittu.
Keftriaksonia ei saa iästä riippumatta sekoittaa tai antaa samanaikaisesti laskimoon annettavien kalsiumia sisältävien liuosten kanssa, mukaan lukien Numeta G16E, edes erillistä infuusioletkua pitkin tai erillisiin infuusiokohtiin keftriaksonin kalsiumsuolan saostumien riskin takia.
Yli 28 päivän ikäisille potilaille voidaan kuitenkin antaa keftriaksonia kalsiumia sisältävien liuosten kanssa peräkkäin tai eri infuusiokohtiin tai jos infuusioletku huuhdotaan huolellisesti fysiologisella suolaliuoksella infuusioiden välissä saostumien välttämiseksi.
Keuhkoverenkierron veritulppia ja hengitysvaikeuksia johtuen keuhkoverenkierron saostumista on raportoitu potilailla, jotka saavat parenteraalista ravintoa. Jotkut tapaukset ovat olleet fataaleja. Liiallinen kalsiumin ja fosfaatin lisääminen suurentaa kalsiumfosfataattisaostumien muodostumisen riskiä (ks. kohta Yhteensopimattomuudet). Epäiltyjä saostumien muodostumisia verenkierrossa on myös raportoitu.
Liuoksen ja infuusiovälineistön tarkastamisen lisäksi myös katetri pitää tarkastaa ajoittain saostumien varalta.
Mikäli hengitysvaikeuksia esiintyy, infuusio pitää lopettaa ja tehdä lääketieteellinen arvio.
Pussiin ei saa lisätä muita aineita, ennen kuin niiden yhteensopivuus on varmistettu, koska saostuminen tai lipidiemulsion tasapainon häiriintyminen voi johtaa verisuonitukokseen (ks. kohdat Yhteensopimattomuudet ja Käyttö- ja käsittelyohjeet).
Laskimonsisäisten katetrien käyttö parenteraalisten valmisteiden antoon tai katetrien puutteellinen hoito voi aiheuttaa infektion ja sepsiksen. Sairauden immunosuppressiiviset vaikutukset tai lääkkeet voivat edistää infektion ja sepsiksen syntyä. Infektiot voidaan havaita varhaisessa vaiheessa kuumeen ja vilunväreiden, leukosytoosin, välineiden teknisten ongelmien ja hyperglykemian oireiden huolellisella tarkkailulla ja laboratoriotesteillä. Parenteraalista ravintoa tarvitsevat potilaat altistuvat usein infektioiden komplikaatioille aliravitsemuksesta ja/tai perussairaudesta johtuen. Septisten komplikaatioiden esiintymistä voidaan vähentää korostamalla aseptisen tekniikan merkitystä katetrin asetuksessa ja hoidossa sekä ravintovalmisteiden valmistelussa.
Rasvakuormitusoireyhtymää on raportoitu muiden parenteraalista ravitsemusta sisältävien tuotteiden käytön yhteydessä. Heikentynyt tai rajallinen kyky metaboloida Numeta G16E-valmisteen sisältämiä lipidejä tai yliannostus voi aiheuttaa rasvakuormituksen nimellä tunnetun oireyhtymän (ks. kohta Haittavaikutukset ja Yliannostus).
Ravinnon anto vaikeasti aliravituille potilaille voi johtaa refeeding-oireyhtymään, jossa kaliumia, fosforia ja magnesiumia siirtyy solun sisään potilaan siirtyessä anaboliseen tilaan. Seurauksena voivat olla myös tiamiinin puutos ja nesteen kertyminen elimistöön. Parenteraalinen ravinnon anto tulee aloittaa varovasti ja hitaasti, ja nesteiden, elektrolyyttien, hivenaineiden ja vitamiinien määrää on tarkkailtava huolellisesti.
Numeta G16E voidaan antaa ainoastaan keskuslaskimoon, paitsi jos sopiva laimennus suoritetaan (katso kohta Annostus ja antotapa). Jos valmisteeseen lisätään muita aineita, seoksen lopullinen osmolaarisuus on laskettava, ennen kuin valmiste annetaan ääreislaskimoon. Näin estetään laskimon ärsytys ja kudosvaurio ekstravasaatiotapauksissa. Numeta G16E-valmisteen anto ääreislaskimoon on aiheuttanut ekstravasaatiota, joka on johtanut pehmytkudosvaurioon ja ihokuolioon.
Pusseja ei saa kytkeä sarjaan, koska ensimmäiseen pussiin mahdollisesti jäänyt ilma voi aiheuttaa ilmaemboliavaaran.
Lipidejä, vitamiineja, lisäelektrolyyttejä tai hivenaineita annostellaan tarpeen mukaan.
VAROTOIMET
Älä lisää muita lääkkeitä tai muita aineita mihinkään pussin kolmesta osastosta tai sekoitettuun liuokseen/emulsioon, ennen kuin olet varmistanut niiden yhteensopivuuden ja sekoitetun valmisteen stabiiliuden (erityisesti lipidiemulsion stabiiliuden, ks. kohta Yhteensopimattomuudet ja Käyttö- ja käsittelyohjeet).
Laskimonsisäisen parenteraalisen ravinneliuoksen altistaminen valolle voi, erityisesti hivenaineiden ja/tai vitamiinien mukaan sekoittamisen jälkeen, vaikuttaa haitallisesti vastasyntyneiden hoitotulokseen peroksidien ja muiden hajoamistuotteiden muodostumisen takia. Kun Numeta G16E-valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, sitä on suojattava ympäristön valolta, kunnes valmisteen antaminen on saatettu loppuun (ks. kohdat Annostus ja antotapa, Kestoaika ja Käyttö- ja käsittelyohjeet).
Parenteraaliseen antoon tarkoitettujen ravintoliuosten valoaltistuminen sekoittamisen jälkeen voi vaikuttaa haitallisesti vastasyntyneisiin peroksidien ja muiden hajoamistuotteiden muodostumisen vuoksi. Numeta G16E-valmistetta on suojattava valolta sekoittamisesta aina valmisteen antoon asti (ks. kohta Käyttö- ja käsittelyohjeet).
Tarkkaile säännöllisesti potilaan neste- ja elektrolyyttitasapainoa, seerumin osmolaarisuutta, seerumin triglyseridejä, happo-emästasapainoa, verensokeria, maksan ja munuaisten toimintaa, verenkuvaa, myös trombosyyttien määrää, ja hyytymisarvoja, koko hoidon ajan.
Epästabiileissa tiloissa (esimerkiksi vakava posttraumaattinen tila, epätasapainossa oleva diabetes mellitus, akuutti verenkiertosokki, akuutti sydäninfarkti, vaikea metabolinen asidoosi, vaikea sepsis ja hyperosmolaarinen kooma) Numeta G16E-valmisteen antoa on tarkkailtava ja annostusta on säädettävä potilaan kliinisten tarpeiden mukaan.
Sydän ja verisuonet
Käytä valmistetta varoen potilailla, joilla on keuhkoödeema tai sydämen vajaatoiminta. Nestetasapainoa on tarkkailtava huolellisesti.
Munuaiset
Käytä valmistetta varoen potilailla, joilla on munuaisten vajaatoiminta. Neste- ja elektrolyyttitasapainoa mukaan lukien magnesiumia (katso kohta Hypermagnesemia) on tarkkailtava huolellisesti näillä potilailla.
Vaikeat neste- ja elektrolyyttitasapainohäiriöt, vaikea nesteylikuormitus sekä vaikeat aineenvaihduntahäiriöt on hoidettava ennen infuusion aloittamista (katso kohta Vasta-aiheet).
Maksa/maha-suolikanava
Käytä valmistetta varoen potilailla, joilla on vaikea maksan vajaatoiminta tai kolestaasi tai joiden maksan entsyymipitoisuus on kohonnut. Maksan toimintakokeiden tuloksia on tarkkailtava huolellisesti.
Umpirauhaset ja aineenvaihdunta
Potilaalla voi esiintyä aineenvaihduntahäiriöitä, jos ravintoaineiden saantia ei säädetä potilaan tarpeiden mukaan tai jos ravintosisällön jonkin osan metaboliakapasiteettia ei arvioida tarkasti. Jos potilaalle annetaan liian vähän tai liikaa ravintoaineita tai jos annettavan valmisteen koostumus ei sovellu nimenomaisen potilaan tarpeisiin, aineenvaihdunnallisia haittavaikutuksia voi esiintyä.
Seerumin triglyseridipitoisuuksia sekä elimistön kykyä metaboloida lipidejä on tarkkailtava säännöllisesti. Jos epäillään lipidiaineenvaihdunnan häiriötä, seerumin triglyseridipitoisuuksia on tarkkailtava tarvittaessa.
Hyperglykemiatapauksessa Numeta G16E-valmisteen infuusionopeutta on muutettava, ja/tai potilaalle on annettava insuliinia (ks. kohta Yliannostus).
Hematologia
Käytä valmistetta varoen potilailla, joilla on vaikeita veren hyytymishäiriöitä. Verenkuvaa ja hyytymisarvoja on tarkkailtava huolellisesti.
Hypermagnesemia
Numeta G16E-valmiste sisältää 0,3 mmol/kg/vrk magnesiumia, kun sitä annetaan enimmäisannos (ks. kohta Annostus ja antotapa). Tämä voi mahdollisesti aiheuttaa hypermagnesemian. Hypermagnesemian oireita ovat yleinen heikkous, hyporefleksia, pahoinvointi, oksentelu, hypokalsemia, hengitysvajaus, hypotensio ja rytmihäiriöt. Koska hypermagnesemian oireita ei ehkä havaita, suositellaan veren magnesiumpitoisuuden seurantaa lähtötilanteessa ja sen jälkeen sopivin väliajoin tavanomaisen kliinisen käytännön sekä yksittäisen potilaan tarpeiden mukaisesti. Tämä on erityisen tärkeää, jos potilaalla on suurentunut hypermagnesemian kehittymisen riski kuten potilaat, joilla on heikentynyt munuaisten toiminta, potilaat, jotka saavat muita hypermagnesemian kehittymisen riskiä lisääviä lääkevalmisteita, tai potilaat, jotka saavat magnesiumia muista lähteistä. Näitä potilaita ovat myös vastasyntyneet, joiden äiti on äskettäin saanut magnesiumia raskauden aikana.
Jos seerumin magnesiumpitoisuus on koholla (normaalin viitearvoalueen yläpuolella), Numeta G16E‑infuusio on lopetettava tai infuusionopeutta pienennettävä niin, että se on kliiniseen tilanteeseen sopiva ja turvallinen.
Yhteisvaikutukset
Numeta G16E-valmisteella ei ole tehty farmakodynaamisia yhteisvaikutustutkimuksia.
Numeta G16E-valmistetta ei saa antaa veren kanssa samanaikaisesti samalla infuusioletkulla, koska silloin on olemassa punasolujen sakkaantumisen vaara.
Kuten muidenkin kalsiumia sisältävien infuusioliuoksien kohdalla, Numeta G16E-valmisteen samanaikainen käyttö keftriaksonin kanssa on vasta-aiheista täysiaikaisille vastasyntyneille vauvoille (≤ 28 päivän ikäiset) vaikka erillisiä infuusioletkuja käytettäisiin (kuolemaan johtavan keftriaksonin kalsiumsuolan saostuminen riski vastasyntyneen verenkiertoon).
Keftriaksonia ei saa iästä riippumatta sekoittaa tai antaa samanaikaisesti laskimoon annettavien kalsiumia sisältävien liuosten kanssa, mukaan lukien Numeta G16E, edes erillistä infuusioletkua pitkin tai erillisiin infuusiokohtiin keftriaksonin kalsiumsuolan saostumien riskin takia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yli 28 päivän ikäisille potilaille voidaan kuitenkin antaa keftriaksonia kalsiumia sisältävien liuosten kanssa peräkkäin tai eri infuusiokohtiin tai jos infuusioletku huuhdotaan huolellisesti fysiologisella suolaliuoksella infuusioiden välissä saostumien välttämiseksi.
Oliivi- ja soijaöljy sisältävät luontaisesti K1-vitamiinia, joka voi kumota kumariinin (tai kumariinijohdosten, kuten varfariinin) antikoagulanttivaikutuksen.
Koska Numeta G16E sisältää kaliumia, erityistä varovaisuutta on noudatettava potilailla, joita hoidetaan samanaikaisesti kaliumia säästävillä diureeteilla (amiloridilla, spironolaktonilla, triamtereenilla) tai ACE-estäjillä angiotensiini II reseptorin estäjillä tai immunosupressantti takrolimuusilla tai siklosporiinilla, koska se voi aiheuttaa hyperkalemian vaaran.
Emulsion sisältämät lipidit voivat vääristää tiettyjen laboratoriotestien tuloksia (kuten bilirubiini, laktaattidehydrogenaasi, happisaturaatio, veren hemoglobiini), jos verikoe otetaan ennen lipidien eliminoitumista. Lipidit ovat yleensä eliminoituneet, kun potilaalle ei ole annettu lipidejä 5–6 tuntiin.
Katso myös kohta Yhteensopimattomuudet.
Raskaus ja imetys
Ei oleellinen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei merkityksellinen.
Haittavaikutukset
4.8.1 Kliinisessä tutkimuksessa ja markkinoille tulon jälkeen havaitut haittavaikutukset
Numeta-valmisteen turvallisuutta ja antoa arvioitiin yhdessä vaiheen III tutkimuksessa. Tutkimuksessa oli mukana sataviisikymmentäyhdeksän (159) lapsipotilasta, jotka saivat Numeta-valmistetta.
Kliinisistä tutkimuksista ja markkinoille tulon jälkeen saadut tiedot viittaavat Numeta-valmisteen käyttöön liittyvän seuraavia haittavaikutuksia:
| Kliinisessä tutkimuksessa ja markkinoille tulon jälkeen havaitut haittavaikutukset | ||
| Elinjärjestelmäluokitus (SOC) | Suositeltu MedDRA-termi | Yleisyysb |
| Aineenvaihdunta ja ravitsemus | Hypofosfatemiaa Hyperglykemiaa Hyperkalsemiaa Hypertriglyseridemiaa Hyperlipidemia Hyponatremiaa | Yleinen Yleinen Yleinen Yleinen Melko harvinainen Yleinen |
| Maksa ja sappi | Kolestaasi | Melko harvinainen |
| IHO JA IHONALAINEN KUDOS | Ihokuolioc | Tuntematon |
| Pehmytkudosvaurioc | Tuntematon | |
| YLEISOIREET JA ANTOPAIKASSA TODETTAVAT HAITAT | Ekstravasaatioc | Tuntematon |
a Verinäytteet otettiin infuusion aikana (ei paaston aikana).
b Yleisyys on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
c Näitä haittavaikutuksia on raportoitu vain Numeta G13E ja G16E-valmisteille, kun valmisteita on annettu ääreislaskimoon riittämättömällä laimennuksella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
4.8.2 Muut haittavaikutukset
Seuraavia haittavaikutuksia on raportoitu muihin parenteraalisiin ravitsemusvalmisteisiin liittyen:
- Rasvakuormitusoireyhtymä (fat overload syndrome): saattaa johtua virheellisestä antotavasta (yliannostus ja/tai suositeltua suurempi infuusionopeus, ks. kohta Yliannostus), oireyhtymän merkit ja oireet voivat kuitenkin ilmaantua, vaikka tuotteen antotapa on ohjeiden mukainen. Heikentynyt tai rajallinen kyky metaboloida Numeta G16E-valmisteen sisältämiä lipidejä yhdessä pitkittyneen plasmapuhdistuman voi aiheuttaa kanssa rasvakuormitukseksi kutsutun oireyhtymän (fat overload syndrome). Oireyhtymään liittyy potilaan voinnin äkillinen heikkeneminen ja sille luonteenomaisia löydöksiä ovat hyperlipidemia, kuume, rasvan kertyminen maksaan (hepatomegalia), heikentyvä maksan toiminta, anemia, leukopenia, trombosytopenia, veren hyytymishäiriöt, akuutti hengitysvaikeus, metabolinen asidoosi ja keskushermoston oireet (esimerkiksi kooma). Oireyhtymä tavallisesti häviää, kun lipidiemulsioinfuusio lopetetaan.
- Saostumia keuhkoverenkierrossa (keuhkoverenkierron veritulppa ja hengitysvaikeudet) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Virheellinen antotapa (yliannostus ja/tai suositeltua suurempi infuusionopeus) voi aiheuttaa oireita, kuten pahoinvointia, oksentelua, vilunväristyksiä, elektrolyyttitasapainohäiriöitä, hypervolemiaa tai asidoosia, joilla voi olla hengenvaarallisia seurauksia. Tällöin infuusio on lopetettava heti. Asianmukainen hoito on aloitettava tarpeen mukaan.
Liian suuri, puhdistuman ylittävä, glukoosin infuusionopeus saattaa aiheuttaa hyperglykemian, glukosurian ja hyperosmolaarisen oireyhtymän.
Yliannostus tai heikentynyt tai rajallinen kyky metaboloida lipidejä saattaa aiheuttaa rasvakuormitukseksi kutsutun oireyhtymän (fat overload syndrome), jonka seuraukset yleensä häviävät, kun lipidiemulsioinfuusio lopetetaan, ks. kohta Haittavaikutukset. Vastasyntyneillä ja vauvoilla. rasvakuormitusoireyhtymää on yhdistetty metaboliseen asidoosiin ja hengitysvaikeuksiin.
Yliannostustapauksissa ei ole erityistä vasta-ainetta. Ensihoidossa on tuettava yleisesti elintoimintoja, etenkin hengitystä ja verenkiertoa. Joissakin vaikeissa tapauksissa tarvitaan hemodialyysia, hemofiltraatiota tai hemodiafiltraatiota. Kirjallisuudessa on raportoitu vakavista rasvakuormitusoireyhtymätapauksista vaihtotransfuusiohoidon yhteydessä.
Tiivis biokemiallinen tarkkailu on välttämätöntä ja erityiset poikkeavuudet pitää hoitaa tapauskohtaisesti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Parenteraaliset ravintovalmisteet / yhdistelmävalmisteet
ATC-koodi: B05BA10
Numeta G16E-valmisteen sisältämä typpi (20 L-sarjan aminohappoa, joista 8 välttämätöntä aminohappoa) ja energia (glukoosi ja triglyseridit) ylläpitävät typpi/ energiatasapainoa. Typpi ja energia ovat välttämättömiä elimistön kaikkien solujen normaalille toiminnalle, ja niillä on tärkeä merkitys proteiinisynteesissä, kasvussa, haavan paranemisessa, immuunijärjestelmän ja lihasten toiminnassa sekä monissa muissa solun toiminnoissa.
Lääkevalmiste sisältää myös elektrolyyttejä.
Aminohappojakauma:
- välttämättömät aminohapot / aminohapot yhteensä: 47,5 %
- haaraketjuiset aminohapot / aminohapot yhteensä: 24,0 %
Numeta G16E-valmisteen sisältämä lipidiemulsio on puhdistetun oliiviöljyn ja puhdistetun soijaöljyn seos (suhde noin 80/20), jonka suhteellinen rasvahappojakauma on seuraava:
- 15 % tyydyttyneitä rasvahappoja (SFA)
- 65 % kertatyydyttymättömiä rasvahappoja (MUFA)
- 20 % monityydyttymättömiä rasvahappoja (PUFA)
Fosfolipidi-triglyseridisuhde on 0,06. Välttämättömien rasvahappojen (EFA) kohtalaisen osuuden ansiosta ne pystytään hyödyntämään paremmin. Tämä vahvistaa rasvahappojohdannaisten oikeaa statusta ja korjaa rasvahappovajausta.
Oliiviöljyssä on huomattava määrä alfatokoferolia, joka yhdessä kohtuullisen PUFA-saannin kanssa auttaa lisäämään E-vitamiinin määrää ja vähentämään lipidiperoksidaatiota.
Hiilihydraattilähde on glukoosi. Glukoosi on elimistön tärkein energianlähde.
Farmakokinetiikka
Infuusionesteen, emulsion, aineet (aminohapot, elektrolyytit, glukoosi, lipidit) jakaantuvat, hajoavat ja poistuvat elimistöstä samalla tavoin kuin ne tekisivät erikseen annettuina. Koska valmiste annetaan laskimoon, sen hyötyosuus on 100 %, ja aineet jakaantuvat elimistön kaikkiin soluihin ja metaboloituvat kaikissa soluissa.
Prekliiniset tiedot turvallisuudesta
Kolmiosastoisen pussin sisältämillä ainesosilla tehdyt prekliiniset tutkimukset eivät ole viitanneet muihin riskeihin, jo valmisteyhteenvedon muissa kohdissa mainittujen lisäksi.
Numeta G16E-valmisteella (kaksi tai kolme osastoa sekoitettu) ei ole tehty eläinkokeita.
Farmaseuttiset tiedot
Apuaineet
Apuaineet: | Aminohappo-osasto | Glukoosiosasto | Lipidiosasto |
L-omenahappoa | X | - | - |
Kloorivetyhappoa | - | X | - |
Fosfolipidit (muna) injektionestettä varten | - | - | X |
Glyseroli | - | - | X |
Natriumoleaatti | - | - | X |
Natriumhydroksidia | - | - | X |
Injektionesteisiin käytettävä vesi | X | X | X |
a pH:n säätöön | |||
Yhteensopimattomuudet
Mikäli yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, ks. kohta Käyttö- ja käsittelyohjeet.
Kuten mitä tahansa parenteraalista ravintovalmistetta annettaessa, kalsiumin ja fosfaatin suhde on huomioitava. Jos valmisteeseen lisätään liikaa kalsiumia ja fosfaattia, etenkin mineraalisuoloina, valmisteeseen voi saostua kalsiumfosfaattia.
Kuten muidenkin kalsiumia sisältävien infuusioliuoksien kohdalla, Numeta G16E-valmisteen samanaikainen käyttö keftriaksonin kanssa on vasta-aiheista täysiaikaisille vastasyntyneille vauvoille (≤ 28 päivän ikäiset) vaikka erillisiä infuusioletkuja käytettäisiin (kuolemaan johtavan keftriaksonin kalsiumsuolan saostuminen riski vastasyntyneen verenkiertoon, katso kohta Yhteisvaikutukset).
Keftriaksonia ei saa iästä riippumatta sekoittaa tai antaa samanaikaisesti laskimoon annettavien kalsiumia sisältävien liuosten kanssa, mukaan lukien Numeta G16E, edes erillistä infuusioletkua pitkin tai erillisiin infuusiokohtiin keftriaksonin kalsiumsuolan saostumien riskin takia.
Saostumisriskin vuoksi Numeta G16E-valmistetta ei saa antaa saman infuusiolinjan kautta ampisilliinin, fosfenytoiinin tai furosemidin kanssa.
Numeta G16E-valmistetta ei saa antaa veren kanssa samanaikaisesti samalla infuusioletkulla (ks. kohta Yhteisvaikutukset).
Numeta G16E sisältää kalsiumioneja, mikä aiheuttaa ylimääräisen hyytymän saostumisriskin sitraatti-antikoaguloidussa/säilötyssä veressä tai komponenteissa.
Kestoaika
18 kuukautta
Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, emulsio (pusseissa ja antovälineistössä) on suojattava valolta, kunnes emulsion antaminen on saatettu loppuun (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Käyttö- ja käsittelyohjeet).
Kestoaika sekoituksen jälkeen
Valmisteen käyttämistä suositellaan välittömästi, kun kahden tai kolmen osaston väliset saumat on avattu. Käyttövalmiiksi sekoitetun valmisteen on kuitenkin osoitettu olevan stabiili enintään 7 päivän ajan 2–8 °C:n lämpötilassa ja sen jälkeen enintään 48 tuntia 30 °C:n lämpötilassa.
Kestoaika lisäysten (elektrolyytit, hivenaineet, vitamiinit, vesi) jälkeen
Numeta G16E-formulaation, johon on tehty tiettyjä lisäyksiä, on osoitettu olevan stabiili enintään 7 päivän ajan 2–8 °C:n lämpötilassa ja sen jälkeen enintään 48 tuntia 30 °C:n lämpötilassa.
Mikrobiologiselta kannalta valmiste olisi käytettävä heti lisäysten jälkeen. Jos valmistetta ei käytetä heti, säilytysaika ja -olosuhteet ovat käyttäjän vastuulla. Säilytysaika ei tavallisesti saa ylittää 24 tuntia 2–8 ºC:ssa, ellei aktivointi/laimentaminen/lisäyksiä ole tehty valvotuissa ja validoiduissa aseptisissa olosuhteissa. Huomaa myös kohta Annostus ja antotapa ja kohta Käyttö- ja käsittelyohjeet.
Säilytys
Ei saa jäätyä.
Säilytettävä päällyspussissa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NUMETA G16E infuusioneste, emulsio
6 x 500 ml (934,33 €)
PF-selosteen tieto
Kolmiosastoisessa pussissa, joka ei sisällä PVC:tä, on seuraavat osat:
- monikerroksinen muovipussi
- täyttöportti lipidiemulsio-osastossa; se suljetaan täyttämisen jälkeen, jotta osastoon ei voi lisätä aineita
- kaksi porttia aminohappoliuos- ja glukoosiliuososastoissa
injektioportti, joka sulkee glukoosiliuososaston
- annosteluportti, joka sulkee aminohappoliuososaston
Kaikki osat ovat lateksittomia.
Jotta ilmaa ei pääse valmisteeseen, pussi on pakattu happitiiviiseen päällyspussiin, jossa on happea imevä tyyny ja happi-indikaattori.
Pakkauskoot:
500 ml:n pussit: 6 pussia laatikossa.
1 pussi, jossa 500 ml.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Ulkonäkö ennen sekoitusta:
- Aminohappo- ja glukoosiliuokset ovat kirkkaita, värittömiä tai hieman kellertäviä.
- Lipidiemulsio on homogeeninen ja maitomainen.
Käyttö- ja käsittelyohjeet
Kerta-antoon.
Älä käytä vaurioituneita pusseja.
Varmista, että pussi ja avautuvat saumat ovat ehjät.
Käytä valmistetta vain, jos aminohappo- ja glukoosiliuokset ovat kirkkaita, värittömiä tai hieman kellertäviä eikä niissä ole näkyviä hiukkasia, ja jos lipidiemulsio on homogeeninen ja maitomainen.
1,2 mikrometrin suodattimen käyttöä suositellaan Numeta G16E-valmisteen annostelussa.
Ennen kuin avaat päällyspussin, tarkista happi-indikaattorin väri.
- Vertaa väriä OK-symbolin vieressä näkyvään ja indikaattorin etiketin tulostetulla alueella olevaan vertailuväriin.
- Älä käytä valmistetta, jos happi-indikaattorin väri ei ole sama kuin OK-symbolin vieressä näkyvä vertailuväri.
Kuvassa 1 ja 2 kuvataan kuinka suojaava päällyspussi poistetaan. Hävitä päällyspussi, happi-indikaattori ja happea imevä tyyny.
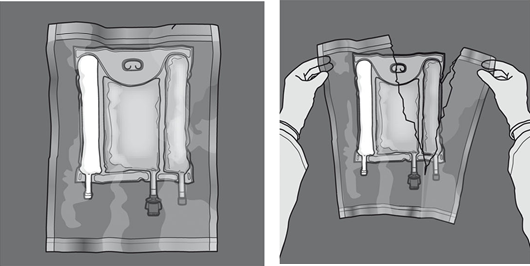
Kuva 1 Kuva 2
Sekoitetun emulsion valmisteleminen:
- Varmista, että valmiste on huoneenlämpöinen, ennen kuin avaat osastojen väliset saumat.
- Aseta pussi vaakasuoralle ja puhtaalle alustalle.
Kolmen osaston sisällön sekoittaminen (kolmen liuoksen sekoittaminen kaksi saumaa avaamalla)
Vaihe 1: Ala rullata pussia D-ripustinpäästä.
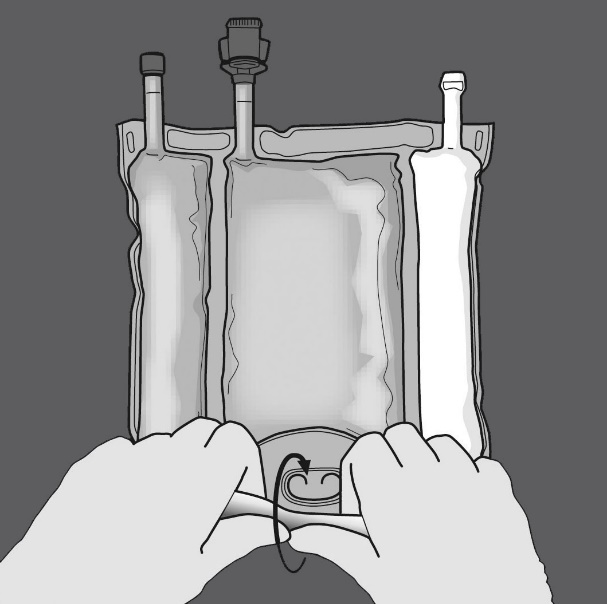
Vaihe 2: Avaa sauma painamalla.
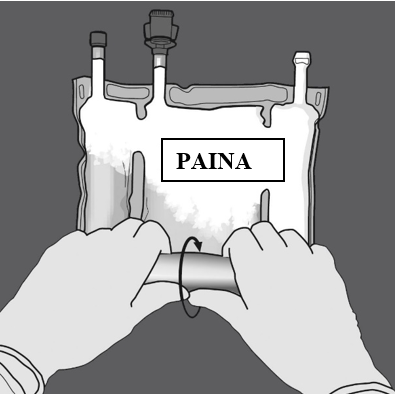
Vaihe 3: Muuta sitten suuntaa rullaamalla pussia kohti D-ripustinta.
Jatka rullaamista, kunnes sauma on täysin auki.
Etene samaan suuntaan toisen sauman avaamiseksi.
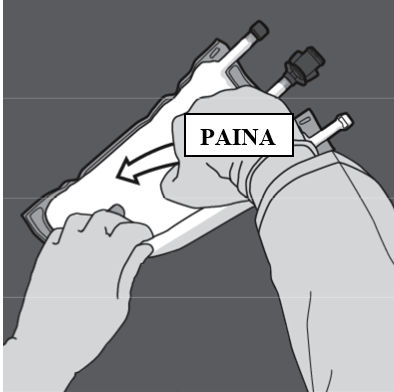
Vaihe 4: Sekoita pussin sisältö huolellisesti kääntämällä pussi ylösalaisin vähintään kolme kertaa. Sekoitettu liuos on maitomainen emulsio.
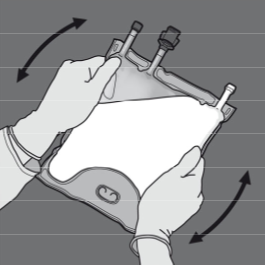
Vaihe 5: Irrota suojus annosteluportista ja kiinnitä siihen infuusioletkusto.
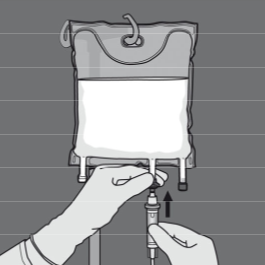
Kahden osaston sisällön sekoittaminen (kahden liuoksen sekoittaminen avaamalla aminohappo- ja glukoosikammioiden välinen sauma)
Vaihe 1: Jos haluat sekoittaa vain aminohappo- ja glukoosiliuokset, ala rullata pussia D-ripustinpäästä aminohappo- ja glukoosiliuososaston välisen sauman nurkasta ja avaa osastojen välinen sauma painamalla.
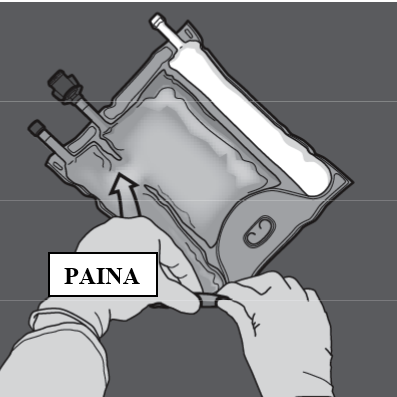
Vaihe 2: Aseta pussi niin, että lipidiemulsio-osasto on lähimpänä itseäsi. Rullaa pussia ja suojaa samalla lipidiemulsio-osastoa kämmenillä.
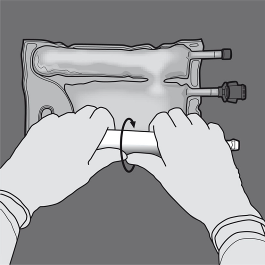
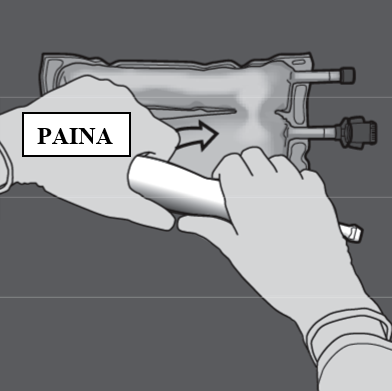
Vaihe 3: Rullaa ja paina pussia toisella kädellä porttien suuntaan.
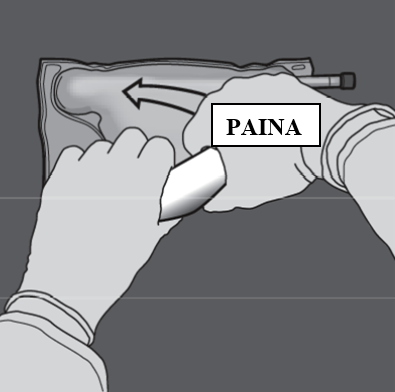
Vaihe 4: Vaihda sitten suuntaa ja rullaa pussia D-ripustimen suuntaan toisella kädellä painamalla, kunnes aminohappo- ja glukoosiliuososastojen välinen sauma on kokonaan auki.
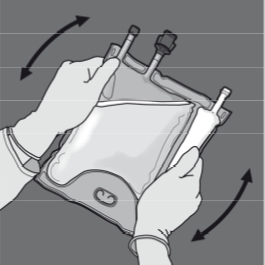
Vaihe 5: Sekoita pussin sisältö huolellisesti kääntämällä pussi ylösalaisin vähintään kolme kertaa. Sekoitettu liuos on kirkasta, väritöntä tai hieman kellertävää.
Vaihe 6: Irrota suojus annosteluportista ja kiinnitä siihen infuusioletkusto.
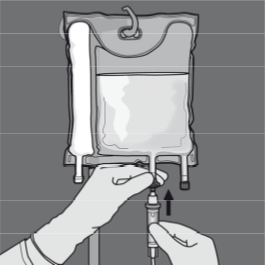
Lisäykset
Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, se on suojattava valolta, kunnes sen antaminen on saatettu loppuun. Numeta G16E-valmisteen altistaminen ympäristön valolle, erityisesti hivenaineiden ja/tai vitamiinien mukaan sekoittamisen jälkeen, tuottaa peroksideja ja muita hajoamistuotteita, joiden määrää voidaan vähentää suojaamalla valmiste valolta (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Kestoaika).
Yhteensopivien aineiden lisäykset voidaan tehdä injektioportin kautta käyttökuntoon saatettuun seokseen (kun osastojen väliset saumat on avattu ja kahden tai kolmen pussin sisältö on sekoitettu).
Vitamiineja voidaan lisätä myös glukoosia sisältävään osastoon ennen sekoittamista (ennen saumojen avaamista ja liuoksen ja emulsion sekoittamista).
Mahdolliset kaupallisten hivenainevalmisteiden (eli HA1-, HA2- ja HA4-valmisteiden), vitamiinivalmisteiden (eli V1- ja V2-kuiva-aineiden) ja elektrolyyttien lisäykset tietyissä määrissä on esitetty alla olevissa taulukossa 1–6.
- Yhteensopivuus HA4-, V1- ja V2-valmisteiden kanssa
Taulukko 1: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 500 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmisteessa | Enimmäislisäys | Sisältää enintään | Valmisteessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 12,0 | 25,6 | 37,6 | 12,0 | 25,6 | 37,6 |
| Kalium (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
| Magnesium (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
| Kalsium (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
| Fosfaatti* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
| Hivenaineet ja vitamiinit | - | 10 ml HA4-valmistetta + 1 injektiopullo V1-valmistetta + 30 ml V2-valmistetta | 10 ml HA4-valmistetta + 1 injektiopullo V1-valmistetta + 30 ml V2-valmistetta | - | 5 ml HA4-valmistetta + ½ injektio-pulloa V1-valmistetta + 5 ml V2-valmistetta | 5 ml HA4-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 350 ml | 350 ml |
* Orgaaninen fosfaatti
Taulukko 2: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 376 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmisteessa | Enimmäislisäys | Sisältää enintään | Valmisteessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Kalium (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnesium (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Kalsium (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfaatti* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Hivenaineet ja vitamiinit | - | 5 ml HA4-valmistetta + ½ injektiopulloa V1-valmistetta | 5 ml HA4-valmistetta + ½ injektiopulloa V1-valmistetta | - | 5 ml HA4-valmistetta + ½ injektiopulloa V1-valmistetta | 5 ml HA4-valmistetta + ½ injektiopulloa V1-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 450 ml | 450 ml |
* Orgaaninen fosfaatti
- Yhteensopivuus HA1-, V1- ja V2-valmisteiden kanssa
Taulukko 3: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 500 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmisteessa | Enimmäislisäys | Sisältää enintään | Valmisteessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Kalium (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnesium (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Kalsium (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosfaatti* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Hivenaineet ja vitamiinit | - | 5 ml HA1-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta | 5 ml HA1-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta | - | 5 ml HA1-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta | 5 ml HA1-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 350 ml | 350 ml |
* Orgaaninen fosfaatti
Taulukko 4: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 376 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmisteessa | Enimmäislisäys | Sisältää enintään | Valmisteessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Kalium (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnesium (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Kalsium (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfaatti* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Hivenaineet ja vitamiinit | - | 5 ml HA1-valmistetta + ½ injektiopulloa V1-valmistetta | 5 ml HA1-valmistetta + ½ injektiopulloa V1-valmistetta | - | 5 ml HA1-valmistetta + ½ injektio-pulloa V1-valmistetta | 5 ml HA1-valmistetta + ½ injektio-pulloa V1-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 450 ml | 450 ml |
* Orgaaninen fosfaatti
- Yhteensopivuus HA2-, V1- ja V2-valmisteiden kanssa
Taulukko 5: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 500 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmisteessa | Enimmäislisäys | Sisältää enintään | Valmisteessa | Enimmäis-lisäys | Sisältää enintään |
| Natrium (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Kalium (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnesium (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Kalsium (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosfaatti* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Hivenaineet ja vitamiinit | - | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta | - | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta + 5 ml V2-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 350 ml | 350 ml |
* Orgaaninen fosfaatti
Taulukko 6: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 376 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) | ||||||
| Laimentamaton seos | Laimennettu seos | |||||
| Lisäys | Valmisteessa | Enimmäislisäys | Sisältää enintään | Valmisteessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Kalium (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnesium (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Kalsium (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfaatti* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Hivenaineet ja vitamiinit | - | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta | - | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta | 5 ml HA2-valmistetta + ½ injektiopulloa V1-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 450 ml | 450 ml |
* Orgaaninen fosfaatti
Vitamiini- ja hivenainevalmisteiden koostumus on esitetty alla olevissa taulukoissa 7 ja 8.
Taulukko 7: Käytettyjen kaupallisten hivenainevalmisteiden koostumus
| Koostumus per 10 ml | HA1 | HA2 | HA4 |
| Rauta | - | 8,9 mikromol tai 0,5 mg | - |
| Sinkki | 38,2 mikromol tai 2,5 mg | 15,3 mikromol tai 1 mg | 15,3 mikromol tai 1 mg |
| Seleeni | 0,253 mikromol tai 0,02 mg | 0,6 mikromol tai 0,05 mg | 0,253 mikromol tai 0,02 mg |
| Kupari | 3,15 mikromol tai 0,2 mg | 4,7 mikromol tai 0,3 mg | 3,15 mikromol tai 0,2 mg |
| Jodi | 0,0788 mikromol tai 0,01 mg | 0,4 mikromol tai 0,05 mg | 0,079 mikromol tai 0,01 mg |
| Fluori | 30 mikromol tai 0,57 mg | 26,3 mikromol tai 0,5 mg | - |
| Molybdeeni | - | 0,5 mikromol tai 0,05 mg | - |
| Mangaani | 0,182 mikromol tai 0,01 mg | 1,8 mikromol tai 0,1 mg | 0,091 mikromol tai 0,005 mg |
| Kromi | - | 0,4 mikromol tai 0,02 mg | - |
| Koboltti | - | 2,5 mikromol tai 0,15 mg | - |
Taulukko 8: Käytettyjen kaupallisten vitamiinivalmisteiden koostumus
Injektiopullon koostumus | V1 | V2 |
| B1-vitamiini | 2,5 mg | - |
| B2-vitamiini | 3,6 mg | - |
| Nikotiiniamidi | 40 mg | - |
| B6-vitamiini | 4,0 mg | - |
| Pantoteenihappo | 15,0 mg | - |
| Biotiini | 60 mikrog | - |
| Foolihappo | 400 mikrog | - |
| B12-vitamiini | 5,0 mikrog | - |
| C-vitamiini | 100 mg | - |
| A-vitamiini | - | 2300 KY |
| D-vitamiini | - | 400 KY |
| E-vitamiini | - | 7 KY |
| K-vitamiini | - | 200 mikrog |
Lisää aineet seuraavasti:
- Huolehdi aseptisista olosuhteista.
- Valmistele pussin injektioportti.
- Lävistä injektioportti ja lisää muut aineet injektioneulalla tai lääkkeenlisäysvälikappaleella.
- Sekoita pussin sisältö ja lisäaineet.
Infuusion valmisteleminen:
- Huolehdi aseptisista olosuhteista.
- Ripusta pussi.
- Irrota annosteluportin muovisuojus.
- Työnnä infuusioletkuston piikkiliitin tiiviisti annosteluporttiin.
Infuusion antaminen:
- Aloita valmisteen antaminen potilaalle vasta, kun kahden tai kolmen osaston väliset saumat on avattu ja kahden tai kolmen osaston sisältö on sekoittunut.
- Varmista, että käyttövalmiissa infuusioemulsiossa (pussissa, josta on sekoitettu kolmen osaston sisältö) ei näy merkkejä faasien erottumisesta tai että käyttövalmiissa infuusioliuoksessa (pussissa, josta on sekoitettu kahden osaston sisältö) ei näy hiukkasia.
- Valmisteen käyttämistä suositellaan välittömästi, kun osastojen väliset saumat on avattu. Valmistetta ei saa säilyttää myöhempää infuusiota varten.
- Osittain käytettyä pussia ei saa käyttää uudelleen.
- Pusseja ei saa kytkeä sarjaan, koska ensimmäiseen pussiin mahdollisesti jäänyt ilma voi aiheuttaa ilmaemboliavaaran.
- Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NUMETA G16E infuusioneste, emulsio
6 x 500 ml
- Ei korvausta.
ATC-koodi
B05BA10
Valmisteyhteenvedon muuttamispäivämäärä
26.06.2024
Yhteystiedot
Karhumäentie 3
01530 Vantaa
09 862 1111
