BERINERT injektio/infuusiokuiva-aine ja liuotin, liuosta varten 500 IU, injektiokuiva-aine ja liuotin, liuosta varten 1500 IU
Vaikuttavat aineet ja niiden määrät
Vaikuttava aine: Ihmisen C1-esteraasi-inhibiittori (ihmisen plasmasta)
Yksi Berinert 500 IU‑injektiopullo sisältää 500 yksikköä (IU).
Yksi Berinert 1500 IU‑injektiopullo sisältää 1500 yksikköä (IU).
Ihmisen C1-esteraasi-inhibiittorien teho ilmaistaan WHO:n C1-esteraasi-inhibiittoreita koskevan voimassa olevan standardin mukaisesti kansainvälisinä yksikköinä (International Units, IU).
Berinert 500 IU sisältää 50 IU/ml ihmisen C1-esteraasi-inhibiittoria, kun se on saatettu käyttövalmiiksi sekoittamalla 10 ml:aan injektionesteisiin käytettävää vettä.
Berinert 1500 IU sisältää 500 IU/ml ihmisen C1-esteraasi-inhibiittoria, kun se on saatettu käyttövalmiiksi sekoittamalla 3 ml:aan injektionesteisiin käytettävää vettä.
Käyttövalmiiksi sekoitetun 500 IU liuoksen kokonaisproteiinisisältö on 6,5 mg/ml.
Käyttövalmiiksi sekoitetun 1500 IU liuoksen kokonaisproteiinisisältö on 65 mg/ml.
Apuaineet, joiden vaikutus tunnetaan:
Natriumia enintään 486 mg (noin 21 mmol) per 100 ml liuosta.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Berinert 500 IU:
Injektio/infuusiokuiva-aine ja liuotin, liuosta varten.
Berinert 1500 IU:
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Hereditaarinen angioedeema, tyyppi I ja II (HAE).
Akuuttien HAE-kohtausten hoito ja lääketieteellistä toimenpidettä edeltävä HAE-kohtausten ennaltaehkäisy.
Annostus ja antotapa
Hoito on aloitettava C1-esteraasi-inhibiittorien puutoksen hoitoon perehtyneen lääkärin valvonnassa.
Annostus
Aikuiset
Akuuttien HAE-kohtausten hoito:
20 IU:ta painokiloa kohden (20 IU/kg).
Lääketieteellistä toimenpidettä edeltävä HAE-kohtausten ennaltaehkäisy:
1000 IU:ta korkeintaan 6 tuntia ennen lääkintä-, hammas- tai kirurgista toimenpidettä.
Pediatriset potilaat
Akuuttien HAE-kohtausten hoito:
20 IU:ta painokiloa kohden (20 IU/kg).
Lääketieteellistä toimenpidettä edeltävä HAE-kohtausten ennaltaehkäisy:
15-30 IU:ta painokiloa kohden (15-30 IU/kg) korkeintaan 6 tuntia ennen lääkintä-, hammas- tai kirurgista toimenpidettä. Annoksen valinnassa on huomioitava kliiniset olosuhteet (esim. toimenpiteen laatu ja sairauden vakavuus).
Antotapa
Berinert sekoitetaan käyttövalmiiksi kohdassa Käyttö- ja käsittelyohjeet annettujen ohjeiden mukaisesti. Käyttövalmiiksi sekoitettu
- 500 IU liuos on väritön ja kirkas
- 1500 IU liuos on väritön ja kirkas tai hieman opalisoiva.
Liuos annetaan hitaana injektiona laskimoon. Berinert 500 IU voidaan myös antaa infuusiona (4 ml/minuutti).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jos potilaalla tiedetään olevan taipumusta allergioihin, hänelle on annettava estohoitona antihistamiineja ja kortikosteroideja.
Jos potilaalla ilmenee allergisia tai anafylaktistyyppisiä reaktioita, Berinert-valmisteen antaminen on lopetettava heti (esim. injektion/infuusion antaminen on keskeytettävä) ja asianmukainen hoito on aloitettava. Hoitotoimenpiteet riippuvat haittavaikutuksen tyypistä ja vaikeusasteesta. Sokin hoidossa on noudatettava voimassa olevia hoitosuosituksia.
Jos potilaalla on kurkunpään turvotusta, hänen vointiaan on seurattava erityisen tarkoin ja ensiavun on oltava heti saatavilla.
Berinert-valmisteen käyttöä muuhun kuin hyväksyttyyn käyttötarkoitukseen tai kapillaarivuoto-oireyhtymän (capillary leak syndrome, CLS) hoitoon ei suositella (ks. myös kohta Haittavaikutukset Haittavaikutukset).
Berinert 500 IU sisältää enintään 49 mg natriumia per injektiopullo, mikä vastaa 2,5 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Berinert 1500 IU sisältää alle 1 mmol natriumia (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Kotihoito ja itseannostelu
Tämän lääkevalmisteen käytöstä kotihoidossa ja itseannostelussa on rajallisesti tietoa. Kotihoidon mahdolliset riskit liittyvät itse lääkkeen antamiseen sekä haittavaikutusten, erityisesti yliherkkyysreaktioiden, hoitoon. Päätös kotihoidosta yksittäisen potilaan kohdalla kuuluu hoitavalle lääkärille, jonka täytyy varmistaa riittävän opastuksen tarjoaminen ja tarkistaa oikea käyttö säännöllisesti.
Virusturvallisuus
Vakiintuneita toimenpiteitä ihmisen verestä tai plasmasta valmistetuista lääkevalmisteista aiheutuvien infektioiden estämiseksi ovat verenluovuttajien valinta, erityisten infektiomerkkiaineiden seulominen luovutetusta verestä ja plasmapooleista sekä valmistuksenaikaiset tehokkaat toimenpiteet virusten inaktivoimiseksi/poistamiseksi. Tästä huolimatta taudinaiheuttajien siirtymisen mahdollisuutta ei voida täysin sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita. Tämä koskee myös tuntemattomia tai uusia viruksia ja muita taudinaiheuttajia.
Käytössä olevien toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten HI-virukseen, hepatiitti B- ja C-viruksiin sekä vaipattomiin viruksiin kuten hepatiitti A -virus ja parvovirus B19.
Ihmisen plasmasta valmistettuja valmisteita säännöllisesti/toistuvasti saavien potilaiden on tavallisesti harkittava asianmukaisten rokotusten (hepatiitti A:ta ja B:tä vastaan) ottamista.
Valmisteen nimi, eränumero ja potilaalle annettu lääkemäärä kehotetaan kirjaamaan Berinert-valmisteen jokaisen antokerran yhteydessä, jotta potilas ja valmiste-erä voidaan yhdistää.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Raskaus ja imetys
Raskaus
Käytössä olevat tiedot viittaavat siihen, etteivät riskit ole lisääntyneet, kun naiset ovat saaneet Berinert-hoitoa raskauden aikana. Berinert on ihmisen plasman fysiologinen aineosa. Reproduktiotoksisuutta ja kehitykseen kohdistuvaa toksisuutta ei siksi ole tutkittu eläimillä eikä ihmisellä odoteta esiintyvän haitallisia vaikutuksia hedelmällisyyteen, prenataaliseen ja postnataaliseen kehitykseen.
Berinert-valmistetta ei siksi pitäisi käyttää raskauden aikana, mikäli käyttö ei ole selvästi välttämätöntä.
Imetys
Ei tiedetä, erittyykö Berinert rintamaitoon, mutta erittyminen on epätodennäköistä koska sen molekyylipaino on suuri. On kuitenkin kyseenalaista, tulisiko hereditaarista angioedeemaa sairastavien naisten imettää. Imetyksen edut lapselle ja hoidon edut äidille on otettava huomioon, kun päätetään, onko imettäminen tai Berinert-hoito lopetettava.
Hedelmällisyys
Berinert on ihmisen plasman fysiologinen aineosa. Reproduktiotoksisuutta ja kehitykseen kohdistuvaa toksisuutta ei siksi ole tutkittu eläimillä eikä ihmisellä odoteta esiintyvän haitallisia vaikutuksia hedelmällisyyteen, prenataaliseen ja postnataaliseen kehitykseen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Berinertillä ei ole haitallista vaikutusta ajokykyyn tai koneiden käyttökykyyn.
Haittavaikutukset
Seuraavat haittavaikutustiedot perustuvat myyntiluvan saamisen jälkeiseen käyttökokemukseen sekä tieteelliseen kirjallisuuteen. Haittavaikutukset on esitetty seuraavien käyttöön vakiintuneiden esiintyvyyksien mukaisesti:
| Hyvin yleiset | ≥ 1/10 |
| Yleiset | ≥ 1/100, <1/10 |
| Melko harvinaiset | ≥ 1/1 000, < 1/100 |
| Harvinaiset | ≥ 1/10 000, < 1/1 000 |
| Hyvin harvinaiset | < 1/10 000 (mukaan lukien yksittäiset raportit) |
Haittavaikutukset ovat Berinert-hoidon yhteydessä harvinaisia.
| Elinjärjestelmä | Harvinaiset | Hyvin harvinaiset |
| Verisuonisto | Tromboosin kehittyminen* | |
| Yleisoireet ja antopaikassa todettavat haitat | Ruumiinlämmön nousu, injektiokohdan reaktiot | |
| Immuunijärjestelmä | Allergiset tai anafylaktistyyppiset reaktiot (esim. takykardia, hyper- tai hypotensio, punastelu, nokkosihottuma, hengenahdistus, päänsärky, huimaus, pahoinvointi) | Sokki |
* Suuria Berinert-annoksia on annettu tarkoituksena antaa potilaalle estohoitoa kapillaarivuoto-oireyhtymään tai hoitaa sitä ennen sydänleikkausta, jossa on käytetty kehonulkoista verenkiertoa tai tällaisen leikkauksen aikana tai jälkeen (käyttöaihetta ja annostusta ei ole hyväksytty), ja tämä on johtanut yksittäistapauksissa potilaan kuolemaan.
Turvallisuus tarttuvien taudinaiheuttajien suhteen, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta ‑tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta (ks. yhteystiedot alla).
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Yliannostustapauksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: proteiini-C1 estäjät
ATC-koodi: B06AC01
C1-esteraasi-inhibiittori on plasman glykoproteiini, jonka molekyylipaino on 105 kD, ja sen hiilihydraattiosa on 40 %. Sen pitoisuus ihmisen plamassa on noin 240 mg/l. C1-esteraasi-inhibiittoria esiintyy ihmisen plasman lisäksi myös istukassa, maksasoluissa, monosyyteissä ja trombosyyteissä.
C1-esteraasi-inhibiittorit kuuluvat ihmisen plasman seriini-proteaasi-inhibiittori-(serpiini)-järjestelmään samoin kuin muut proteiinit, kuten antitrombiini III, alfa2-antiplasmiini, alfa1-antitrypsiini ja muut proteiinit.
C1-esteraasi-inhibiittori estää fysiologisissa olosuhteissa komplementtijärjestelmän klassista aktivaatiotietä inaktivoimalla entsymaattisesti aktiivisia komponentteja C1s ja C1r. Aktiivinen entsyymi muodostaa kompleksin inhibiittorin kanssa suhteessa 1:1.
C1-esteraasi-inhibiittori on lisäksi yksi tärkeimmistä koagulaation kontaktiaktivaation estäjistä, koska se estää tekijää XIIa ja sen osia. Se on alfa2-makroglobuliinin lisäksi plasman kallikreiinin tärkein estäjä.
Berinert-valmisteen terapeuttinen vaikutus hereditaarisen angioedeeman hoitoon on seurausta puutteellisen C1-esteraasi-inhibiittorin aktiivisuuden substituutiosta.
Farmakokinetiikka
Valmiste annetaan laskimoon, joten sitä on heti plasmassa annettua annosta vastaavina pitoisuuksina.
Berinertin farmakokinetiikkaa on tutkittu kahdessa tutkimuksessa.
Berinert 1500 IU ja Berinert 500 IU‑valmisteiden suhteellista hyötyosuutta arvioitiin terveillä aikuisilla (n=15) tehdystä faasin I tutkimuksesta saatujen farmakokineettisten tietojen perusteella. Berinert-vahvuuksien hyötyosuudet olivat vertailukelpoiset. C1-INH:n antigeenipitoisuuksien Cmax-arvojen geometristen keskiarvojen suhde (90 %:n CI) oli1,02 (0,99, 1,04) ja AUC0-last-arvojen vastaava luku 1,02 (0,99, 1,05). Puoliintumisaika arvioitiin tutkimushenkilöiden osajoukosta tilamallista riippumattomilla farmakokineettisillä analyyseillä. Berinert 1500 IU‑valmisteen keskimääräinen puoliintumisaika oli 87,7 tuntia ja Berinert 500 IU‑valmisteen 91,4 tuntia.
Farmakokinetiikkaa on tutkittu hereditaarista angioedeemaa sairastavilla potilailla (34 potilasta oli yli 18 vuotta, 6 potilasta alle 18 vuotta). Näistä potilaista 15 sai estohoitoa (usein toistuviin/vaikeisiin HAE-kohtauksiin), ja 25 potilasta sai hoitoa harvemmin esiintyviin/lieviin HAE-kohtauksiin sekä tarvittaessa. Tiedot kerättiin kohtauksettomana ajanjaksona.
Saannon (ns. in-vivo recovery, IVR) mediaani oli 86,7 % (vaihteluväli: 54,0-254,1 %). Lasten saanto (IVR) oli hieman suurempi (98,2 %, vaihteluväli: 69,2-106,8 %) kuin aikuisten (82,5 %, vaihteluväli: 54,0-254,1 %). Jos potilaan kohtaukset olivat vaikea-asteisia, heidän saantonsa (IVR) oli suurempi (101,4 %) kuin silloin, kun potilaan kohtaukset olivat lieviä (75,8 %, vaihteluväli: 57,2-195,9 %).
Aktiivisuuden lisääntymisen mediaani oli 2,3 %/IU/painokilo (vaihteluväli: 1,4-6,9 %/IU/painokilo). Aikuisten ja lasten välillä ei havaittu merkitseviä eroja. Kun potilaan kohtaukset olivat vaikea-asteisia, heillä havaittiin hieman suurempi aktiivisuuden lisääntyminen kuin potilailla, joiden kohtaukset olivat lieviä (2,9, vaihteluväli: 1,4-6,9 vs 2,1, vaihteluväli: 1,5-5,1 %/IU/painokilo).
Ihmisen C1-esteraasi-inhibiittorin aktiivisuuden huippupitoisuus saavutettiin plasmassa 0,8 tunnin kuluessa Berinert-valmisteen antamisen jälkeen eikä potilasryhmien välillä esiintynyt merkitseviä eroja.
Puoliintumisajan mediaani oli 36,1 tuntia. Se oli lapsilla hieman lyhyempi kuin aikuisilla (32,9 vs 36,1 tuntia) samoin kuin potilailla, joiden kohtaukset olivat vaikea-asteisia, verrattuna potilaisiin, joiden kohtaukset olivat lieviä (30,9 vs 37,0).
Prekliiniset tiedot turvallisuudesta
Berinert sisältää vaikuttavana aineena ihmisen C1-esteraasi-inhibiittoria. Sitä saadaan ihmisen plasmasta ja se vaikuttaa samalla tavoin kuin plasman endogeeninen aineosa. Berinert- kerta-annos rotille ja hiirille ja toistuvaisannos rotille ei viitannut toksisuuteen.
Toistetuilla annoksilla tehtäviä prekliinisiä tutkimuksia karsinogeenisuuden ja reproduktiivisen toksisuuden selvittämiseksi ei ole tehty, koska niitä ei voi toteuttaa järkevästi tavanomaisilla eläinmalleilla heterologisten ihmisen proteiinien annon jälkeen kehittyvien vasta-aineiden vuoksi.
Ouchterlonyn koe in vitro ja marsun PCA-malli in vivo eivät viitanneet siihen, että Berinert-valmisteeseen ilmaantuisi uusia antigeenideterminantteja pastöroinnin jälkeen.
Kaneilla suoritettiin in vivo trombogeenisuustutkimuksia Berinert-annoksilla, jotka olivat enintään 800 IU/kg. Protromboottista riskiä ei havaittu, kun Berinert-valmistetta annettiin laskimoon enintään 800 IU/kg.
Kaneilla tehtyjen paikallisten siedettävyystutkimusten perusteella Berinert oli kliinisesti, paikallisesti ja histologisesti hyvin siedetty, kun sitä annettiin laskimoon, ihon alle, valtimoon ja lihakseen.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: glysiini, natriumkloridi, natriumsitraatti
Liuotin: injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden ja liuottimien kanssa samaan ruiskuun/injektioon-/infuusiolaitteeseen.
Kestoaika
36 kuukautta
Berinert 500 IU ‑valmisteen fysikaalis-kemiallisen säilyvyyden on osoitettu olevan 48 tuntia huoneenlämmössä (enintään 30 °C) käyttövalmiiksi saattamisen jälkeen. Berinert 1500 IU ‑valmisteen fysikaalis-kemiallisen säilyvyyden on osoitettu olevan 48 tuntia huoneenlämmössä (enintään 25 °C). Mikrobiologiselta kannalta katsottuna käyttövalmisliuos tulee käyttää heti valmistamisen jälkeen, koska se ei sisällä säilytysainetta. Jos valmistetta ei käytetä heti, sitä saa säilyttää enintään 8 tuntia huoneenlämpötilassa. Käyttövalmiiksi saatettu valmiste on säilytettävä injektiopullossa.
Säilytys
Säilytä alle 30 °C.
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BERINERT injektio/infuusiokuiva-aine ja liuotin, liuosta varten
500 IU (L:ei) 1 kpl (669,73 €)
BERINERT injektiokuiva-aine ja liuotin, liuosta varten
1500 IU (L:ei) 1 kpl (1891,56 €)
PF-selosteen tieto
Sisäpakkaukset:
Berinert 500 IU:
Kuiva-aine (500 IU) injektiopullossa (tyypin II lasia), jossa on suljin (bromobutyylikumia), vanhan kullan värinen sinetti (alumiinia) ja limetinvärinen irti napsautettava flip-off-suljin (muovia).
10 ml liuotinta injektiopullossa (tyypin I lasia), jossa on suljin (klorobutyyli- tai bromobutyylikumia), sininen sinetti (alumiinia) ja sininen irti napsautettava flip-off-suljin (muovia).
Berinert 1500 IU:
Kuiva-aine (1500 IU) injektiopullossa (tyypin I lasia), jossa on suljin (bromobutyylikumia), sininen sinetti (alumiinia) ja oranssi irti napsautettava flip-off-suljin (muovia).
3 ml liuotinta injektiopullossa (tyypin I lasia), jossa on suljin (klorobutyyli- tai bromobutyylikumia), sininen sinetti (alumiinia) ja oranssi irti napsautettava flip-off-suljin (muovia).
Pakkaukset:
Ulkopakkauksen sisältö:
yksi injektiopullo, joka sisältää kuiva-ainetta
yksi injektiopullo, joka sisältää liuotinta (Berinert 500: 10 ml, Berinert 1500: 3 ml)
yksi suodattimella varustettu siirtolaite 20/20
Annostelutarvikkeet (sisälaatikko):
yksi kertakäyttöinen ruisku (Berinert 500 IU: 10 ml, Berinert 1500 IU: 5 ml)
yksi laskimopunktiolaite
kaksi alkoholipyyhettä
yksi laastari
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen jauhe.
Kirkas, väritön liuotin.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Antotapa
Yleiset ohjeet
- Berinert 500 IU injektionesteen on oltava väritöntä ja kirkasta.
- Berinert 1500 IU injektionesteen on oltava väritöntä ja kirkasta tai hieman opaalinhohtoista.
- Kun käyttövalmiiksi sekoitettu valmiste on suodatettu/vedetty ruiskuun (ks. seuraavassa), valmiste on tarkistettava silmämääräisesti ennen antoa, ettei siinä ole havaittavissa hiukkasia eikä värinmuutoksia.
- Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa.
- Valmisteen käyttövalmiiksi sekoittaminen ja vetäminen ruiskuun on tehtävä aseptisissa olosuhteissa. Käytä valmisteen mukana toimitettua ruiskua.
Käyttövalmiiksi saattaminen
Anna liuottimen lämmetä huoneenlämpöiseksi. Varmista, että kuiva-aineen ja liuottimen sisältävien injektiopullojen irti napsautettavat flip-off-sulkimet on poistettu ja tulpat on käsitelty antiseptisella liuoksella. Tulpan on sen jälkeen annettava kuivua ennen Mix2Vial-pakkauksen avaamista.
| 1. Avaa Mix2Vial-pakkaus vetämällä suojakansi pois. Älä ota Mix2Vial-laitetta pois pakkauksesta! |
| 2. Aseta liuottimen sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial sekä pakkaus ja paina sinisen sovittimen piikki suoraan liuotinpullon tulpan läpi. |
| 3. Poista pakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain pakkauksen etkä Mix2Vial-laitetta. |
| 4. Aseta injektiopullo tasaiselle ja tukevalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial ylösalaisin, ja paina läpinäkyvän sovittimen piikki suoraan kuiva-aineinjektiopullon tulpan läpi. Liuotin siirtyy automaattisesti kuiva-aineen sisältävään injektiopulloon. |
| 5. Ota toisella kädellä kiinni Mix2Vial-laitteen kuiva-aineen sisältävän injektiopullon puolelta ja toisella kädellä liuottimen sisältävän injektiopullon puolelta ja kierrä laite varovasti kahteen osaan. Hävitä liuotinpullo ja siihen kiinnitetty sininen Mix2Vial-sovitin. |
| 6. Pyörittele kuiva-aineinjektiopulloa ja siihen kiinnitettyä läpinäkyvää sovitinta, kunnes kuiva-aine on liuennut täysin. Ei saa ravistaa. |
| 7. Vedä tyhjään, steriiliin ruiskuun ilmaa. Käytä valmisteen mukana toimitettua ruiskua. Kun kuiva-aineen sisältävä injektiopullo on oikeinpäin, kiinnitä ruisku Mix2Vial-sovittimen Luer Lock ‑liittimeen. Ruiskuta ilma kuiva-aineen sisältävään injektiopulloon. |
Valmisteen vetäminen ruiskuun ja anto
| 8. Kun ruiskun mäntä on alas painettuna, käännä laite ja injektiopullo ylösalaisin ja vedä liuos ruiskuun vetämällä mäntää hitaasti ulospäin. |
| 9. Kun liuos on nyt siirretty ruiskuun, ota tukeva ote ruiskun kammiosta (pitäen ruiskun mäntää samalla alaspäin) ja irrota ruiskusta läpinäkyvä Mix2Vial-sovitin.
|
Korvattavuus
BERINERT injektio/infuusiokuiva-aine ja liuotin, liuosta varten
500 IU 1 kpl
BERINERT injektiokuiva-aine ja liuotin, liuosta varten
1500 IU 1 kpl
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Berotralsaatti, C1-esteraasin estäjä, ikatibantti, konestaatti alfa ja lanadelumabi: Perinnöllisen angioedeemaan (HAE) hoito erityisin edellytyksin (338).
ATC-koodi
B06AC01
Valmisteyhteenvedon muuttamispäivämäärä
11.10.2021
Yhteystiedot
 CSL BEHRING AB
CSL BEHRING AB Box 712
182 17 Danderyd
Ruotsi
+46 (0) 8 544 966 70
www.cslbehring.fi
info@cslbehring.se

 1
1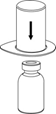 2
2 6
6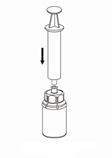 7
7