FLUENZ TETRA nenäsumute, suspensio
Vaikuttavat aineet ja niiden määrät
Seuraavien neljän kannan** reassortantti influenssavirus* (elävä heikennetty virus):
Kannan A/Victoria/4897/2022 (H1N1)pdm09 kaltainen virus (A/Norway/31694/2022, MEDI 369815) | 107,0±0,5 FFU*** |
Kannan A/Darwin/9/2021 (H3N2) kaltainen virus (A/Norway/16606/2021, MEDI 355293) | 107,0±0,5 FFU*** |
Kannan B/Austria/1359417/2021 kaltainen virus (B/Austria/1359417/2021, MEDI 355292) | 107,0±0,5 FFU*** |
| Kannan B/Phuket/3073/2013 kaltainen virus (B/Phuket/3073/2013, MEDI 306444) | 107,0±0,5 FFU*** |
| 0,2 ml:n annosta kohti |
* kasvatettu terveiden kanojen hedelmöitetyissä kananmunissa.
** tuotettu VERO-soluissa käänteisen geenitekniikan avulla. Tämä tuote sisältää muuntogeenisiä organismeja (GMO).
*** fluoresenssifokusyksiköt (fluorescent focus units, FFU).
Rokote on Maailman terveysjärjestön (WHO) suosituksen (pohjoinen pallonpuolisko) ja EU:n suosituksen mukainen kaudelle 2023/2024.
Rokote voi sisältää jäämiä seuraavista aineista: kananmunan proteiini (esim. ovalbumiini) ja gentamysiini. 0,2 ml annos sisältää ovalbumiinia enintään 0,024 mikrogrammaa (0,12 mikrogrammaa millilitraa kohti).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Nenäsumute, suspensio.
Kliiniset tiedot
Käyttöaiheet
Influenssan ehkäisy vähintään 24 kuukauden ja alle 18 vuoden ikäisille lapsille ja nuorille.
Fluenz Tetra -valmisteen käytön tulisi perustua virallisiin suosituksiin.
Annostus ja antotapa
Annostus
Vähintään 24 kuukauden ikäiset lapset ja nuoret:
0,2 ml (annettuna 0,1 ml kumpaankin sieraimeen).
Lapsille, jotka eivät aiemmin ole saaneet kausi-influenssarokotusta, annetaan toinen annos aikaisintaan neljän viikon kuluttua.
Fluenz Tetra -valmistetta ei pidä käyttää vauvojen ja alle 24 kuukauden ikäisten pikkulasten hoitoon tämän potilasryhmän sairaalahoidon tarpeen lisääntymisen ja hengityksen vinkumisen aiheuttamien turvallisuushuolien vuoksi (ks. kohta Haittavaikutukset).
Antotapa
Immunisointi on suoritettava antamalla rokote nenään.
Fluenz Tetra -valmistetta ei saa antaa pistoksena.
Fluenz Tetra annetaan jaettuna annoksena molempiin sieraimiin. Kun on annettu puolikas annos toiseen sieraimeen, annoksen toinen puolikas on annettava toiseen sieraimeen välittömästi tai pian sen jälkeen. Potilas voi hengittää normaalisti rokotteen antamisen aikana. Hänen ei tarvitse aktiivisesti hengittää sisään tai nuuhkaista.
Anto-ohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Vasta-aiheet
- Yliherkkyys vaikuttaville aineille, kohdassa Apuaineet mainituille apuaineille (esim. gelatiini) tai gentamysiinille (mahdollinen hivenjäämä).
- Vaikea allerginen reaktio (esim. anafylaksia) kananmunille tai kananmunan proteiineille (esim. ovalbumiini).
- Lapset ja nuoret, joilla on kliininen immuunipuutos sairauksista tai immunosuppressiohoidosta johtuen, joiksi luetaan esim. akuutit ja krooniset leukemiat, lymfooma, oireinen HIV-infektio, soluvälitteiset immuunipuutokset ja korkea annoksiset kortikosteroidihoidot. Fluenz Tetra -valmisteen käyttö ei ole vasta-aiheinen henkilöille, joilla on oireeton HIV-infektio, tai henkilöille, jotka saavat paikallisia/inhaloitavia kortikosteroideja, pieniannoksisia systeemisiä kortikosteroideja tai kortikosteroideja korvaushoitona, esim. lisämunuaisten vajaatoimintaan.
- Salisylaattihoitoa saavat alle 18-vuotiaat lapset ja nuoret, koska Reyen oireyhtymä liittyy salisylaatteihin ja villin tyypin influenssainfektioon.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Kuten useimpien rokotteiden käytön yhteydessä on asianmukaisen hoidon ja valvonnan oltava aina nopeasti saatavilla Fluenz Tetra -valmisteen annon jälkeisen anafylaktisen reaktion tai vakavan yliherkkyystapahtuman hoitamiseen.
Fluenz Tetra -valmistetta ei pidä antaa vaikeaa astmaa sairastaville tai vinkunaoireisille lapsille tai nuorille, sillä näitä henkilöitä ei ole tutkittu riittävästi kliinisissä tutkimuksissa.
Rokotettaville on kerrottava, että Fluenz Tetra on virusrokote, joka sisältää heikennettyä elävää virusta, ja että virus saattaa siirtyä immuunipuutteisiin henkilöihin. Rokotteen saajien tulisi mahdollisuuksien mukaan yrittää välttää läheistä kanssakäymistä vakavasti immuunipuutteisten henkilöiden kanssa (esim. eristyshoitoa vaativat luuydinsiirteen saajat) 1–2 viikon ajan rokotuksen jälkeen. Kliinisissä Fluenz-valmistetta koskeneissa tutkimuksissa rokoteviruksen erittymisen huippu esiintyi 2–3 vuorokauden kuluttua rokotuksesta. Olosuhteissa, joissa kanssakäymistä vakavasti immuunipuutteisten henkilöiden kanssa ei voida välttää, influenssarokoteviruksen siirtymisen mahdollista riskiä tulisi punnita villin tyypin influenssaviruksen saamisen ja levittämisen riskiin nähden.
Fluenz Tetra -valmistetta ei saa missään tapauksessa antaa pistoksena.
Fluenz Tetra -valmisteen nenänsisäisen annon turvallisuudesta ei ole tietoja lapsista, joilla on korjaamattomia kallon ja kasvojen alueen epämuodostumia.
Yhteisvaikutukset
Älä anna Fluenz Tetra -valmistetta salisylaattihoitoa saaville lapsille ja nuorille (ks. kohta Vasta-aiheet). Älä käytä salisylaatteja lapsille ja nuorille 4 viikon kuluessa rokotuksesta, ellei se ole lääketieteellisesti indikoitua, sillä Reyen oireyhtymää on raportoitu villin tyypin influenssainfektion aikana tapahtuneen salisylaattien käytön jälkeen.
Trivalenttisen Fluenz-valmisteen antoa samanaikaisesti eläviä heikennettyjä viruksia sisältävien rokotteiden, kuten tuhkarokon, sikotaudin, vihurirokon, vesirokon ja suun kautta annetun polioviruksen kanssa on tutkittu. Kliinisesti merkittävää muutosta immuunivasteessa tuhkarokolle, sikotaudille, vesirokolle, suun kautta annettavalle poliovirukselle tai Fluenz-valmisteelle ei todettu. Immuunivaste vihurirokkorokotteelle muuttui merkittävästi. Tällä muutoksella ei ehkä kuitenkaan ole kliinistä merkitystä vihurirokkorokotteen kahden annoksen immunisaatio-ohjelman vuoksi. Tällä trivalenttiin Fluenz-rokotteeseen liittyvällä havainnolla on merkitystä myös Fluenz Tetra -valmisteelle, koska Fluenz Tetra (influenssarokote, elävä heikennetty virus, nenään) on identtinen Fluenz-valmisteen kanssa lukuun ottamatta neljännen kannan (toisen B-kannan) lisäystä Fluenz Tetra -valmisteeseen.
Fluenz Tetra -valmisteen samanaikaista antoa inaktivoitujen rokotteiden kanssa ei ole tutkittu.
Fluenz Tetra -valmisteen samanaikaista käyttöä antiviraalisten aineiden kanssa, jotka vaikuttavat influenssa A- ja/tai B-viruksiin, ei ole arvioitu. Koska influenssan vastaisilla antiviraalisilla aineilla on taipumusta heikentää Fluenz Tetra -valmisteen tehoa, ei kuitenkaan ole suositeltavaa antaa rokotetta 48 tunnin kuluessa influenssan antiviraalisen hoidon päätyttyä. Influenssan vastaisten antiviraalisten aineiden antaminen kahden viikon kuluessa rokotuksesta voi vaikuttaa rokotteen aikaansaamaan vasteeseen.
Jos influenssan vastaisia antiviraalisia aineita ja Fluenz Tetra -valmistetta annetaan samanaikaisesti, uudelleenrokotusta tulee harkita kliiniseen arviointiin perustuen.
Raskaus ja imetys
Raskaus
Fluenz Tetra -valmisteen käytöstä raskaana oleville naisille on kohtalaisen laajat tiedot. Merkittävistä äitiin kohdistuvista haittavaikutuksista ei ollut todisteita 138:lla raskaana olevalla naisella, jotka olivat saaneet trivalentin Fluenz-rokotteen yhdysvaltalaisen sairausvakuutuksen korvaustietokannan mukaan.
AstraZenecan lääketurvatietokannan yli 300 tapausselostuksessa, joissa rokotetta oli annettu raskaana oleville naisille, ei esiintynyt epätavallisia raskauskomplikaatiomuotoja tai sikiölöydöksiä.
Fluenz Tetra -valmisteen käyttöä ei suositella raskauden aikana, vaikka eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia ja myyntiin tulon jälkeiset tiedot eivät viittaa vaaraan annettaessa rokotetta tahattomasti.
Imetys
Ei tiedetä, erittyykö Fluenz Tetra -valmiste ihmisen rintamaitoon. Koska jotkut virukset erittyvät ihmisen rintamaitoon, Fluenz Tetra -valmistetta ei pidä käyttää rintaruokinnan aikana.
Saatavilla oleva vähäinen näyttö viittaa siihen, että trivalenttinen Fluenz ei erity äidinmaitoon.
Hedelmällisyys
Tietoa Fluenz Tetra -valmisteen mahdollisista vaikutuksista miesten ja naisten hedelmällisyyteen ei ole.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Rokotteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Trivalenttiin Fluenz-rokotteeseen liittyvä turvallisuuskokemuksilla on merkitystä myös Fluenz Tetra -valmisteelle, koska Fluenz Tetra (influenssarokote, elävä heikennetty virus, nenään) on identtinen Fluenz-valmisteen kanssa lukuun ottamatta neljännen kannan (toisen-B kannan) lisäystä Fluenz Tetra -valmisteeseen.
Fluenz Tetra -valmisteen turvallisuutta koskevat tiedot perustuvat kliinisiin tutkimuksiin, joissa 2 231 2–17-vuotiasta lasta ja nuorta sai Fluenz Tetra -valmistetta, yli 29 000 2–17-vuotiasta lasta ja nuorta sai Fluenz-valmistetta sekä yli 84 000 2–17-vuotiailta lapsilta ja nuorilta myyntiluvan saamisen jälkeisissä Fluenz-valmisteen turvallisuustutkimuksissa kerättyihin tietoihin. Lisäkokemusta on saatu Fluenz-rokotteen markkinoille tulon jälkeisestä käytöstä.
Kliinisissä tutkimuksissa Fluenz Tetra -valmisteen turvallisuusprofiili oli samankaltainen kuin Fluenz-valmisteen turvallisuusprofiili. Kaikkein yleisin kliinisissä tutkimuksissa havaittu haittavaikutus oli nenän tukkoisuus/voimakas nuha.
Luettelo haittavaikutuksista
Haittavaikutusten esiintyvyydet raportoidaan seuraavasti:
Hyvin yleinen (≥ 1/10)
Yleinen (≥ 1/100, < 1/10)
Melko harvinainen (≥ 1/1 000, < 1/100)
Harvinainen (≥ 1/10 000, < 1/1 000)
Hyvin harvinainen (< 1/10 000)
Immuunijärjestelmä
Melko harvinainen: yliherkkyysreaktiot (mukaan lukien kasvojen turvotus, urtikaria ja hyvin harvinaiset anafylaktiset reaktiot)
Aineenvaihdunta ja ravitsemus
Hyvin yleinen: ruokahalun väheneminen
Hermosto
Yleinen: päänsärky
Hengityselimet, rintakehä ja välikarsina
Hyvin yleinen: nenän tukkoisuus/voimakas nuha
Melko harvinainen: nenäverenvuoto
Iho ja ihonalainen kudos
Melko harvinainen: ihottuma
Luusto, lihakset ja sidekudos
Yleinen: lihaskipu
Yleisoireet ja antopaikassa todettavat haitat
Hyvin yleinen: huonovointisuus
Yleinen: kuume
Pediatriset potilaat
Aktiivikontrolloidussa kliinisessä tutkimuksessa (MI-CP111) todettiin sairaalahoidon (mistä tahansa syystä) lisääntyminen 180 vuorokauden kuluessa viimeisestä rokoteannoksesta 6-11 kuukauden ikäisillä vauvoilla ja pikkulapsilla (6,1 % Fluenz vs. 2,6 % pistoksena annettava influenssarokote). Useimmat sairaalahoitoa vaatineet tapaukset johtuivat ruoansulatuskanavan ja hengitysteiden infektioista ja ilmenivät yli kuusi viikkoa rokottamisen jälkeen. Sairaalahoito ei lisääntynyt vähintään 12 kuukauden ikäisillä Fluenz-valmisteen saajilla. Samassa tutkimuksessa todettiin hengityksen vinkumisen lisääntyminen 42 vuorokauden ajalla 6-23 kuukauden ikäisillä vauvoilla ja pikkulapsilla (5,9 % Fluenz vs. 3,8 % pistoksena annettava influenssarokote). Hengityksen vinkuminen ei lisääntynyt vähintään 24 kuukauden ikäisillä Fluenz-valmisteen saajilla. Fluenz Tetra -valmistetta ei ole tarkoitettu käytettäväksi alle 24 kuukauden ikäisillä vauvoilla ja pikkulapsilla (ks. kohta Annostus ja antotapa).
Fluenz-valmisteen markkinoilletulon jälkeen on todettu hyvin harvinaisia raportteja Guillain–Barrén oireyhtymästä ja Leighin oireyhtymän (mitokondriaalinen enkefalomyopatia) oireiden pahenemisesta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Fluenz Tetra ‑valmisteen yliannostus on epätodennäköistä, koska valmiste on esitäytetyssä sumuttimessa. Fluenz Tetra ‑valmisteen suositeltua suuremman annoksen antamista on raportoitu harvoin ja haittavaikutusprofiili oli vastaavanlainen kuin suositellulla Fluenz Tetra ‑annoksella.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Influenssarokotteet, eläviä heikennettyjä viruksia sisältävä; ATC koodi: J07BB03
Vuodesta 1985 kaksi eri influenssa B-viruslinjaa (Victoria ja Yamagata) on kiertänyt maailmalla. Fluenz Tetra on tetravalentti rokote, joka sisältää antigeenejä neljälle influenssaviruskannalle, A/(H1N1)-kannalle, A/(H3N2)-kannalle ja kahdelle B-kannalle (kummastakin viruslinjasta). Fluenz Tetra on valmistettu samalla prosessilla kuin Fluenz. Fluenz Tetra -valmisteen sisältämät influenssaviruskannat ovat (a) kylmäadaptoituja (cold adapted (ca)); (b) lämpötilaherkkiä (temperature sensitive (ts)); ja (c) heikennettyjä (attenuated (att)). Tämän seurauksena ne replikoituvat nenänielussa ja saavat aikaan suojaavan immuniteetin.
Kliiniset tutkimukset
Fluenz-valmisteeseen liittyvä kliininen kokemus soveltuu myös Fluenz Tetra-valmisteeseen, koska molemmat rokotteet on valmistettu samaa prosessia käyttäen ja niillä on osittain samanlainen koostumus.
Tutkimukset lapsilla
Fluenz-valmisteen teho
Tiedot Fluenz-valmisteen tehosta lapsipotilailla on saatu 9 kontrolloidusta tutkimuksesta, jotka käsittävät yli 20 000 lasta ja nuorta, ja jotka on suoritettu 7 influenssakauden aikana. Neljään lumekontrolloituun tutkimukseen sisältyi toisen kauden uudelleenrokotus. Fluenz on kolmessa aktiivikontrolloidussa tutkimuksessa osoittautunut paremmaksi kuin pistoksena annettava influenssarokote. Katso yhteenveto tehotuloksista pediatrisilla potilailla taulukoista 1 ja 2.
Taulukko 1 Fluenz-valmisteen teho lumekontrolloiduissa lapsilla suoritetuissa tutkimuksissa
Tutkimuksen nro | Alue | Ikärajata | Tutkimukseen osallistujien lukumääräb | Influenssa-kausi | Teho | Teho |
D153-P502 | Eurooppa | 6–35 kk | 1 616 | 2000-2001 | 85,4 % | 85,9 % |
2001-2002 | 88,7 % | 85,8 % | ||||
D153-P504 | Afrikka, | 6–35 kk | 1 886 | 2001 | 73,5 % | 72,0 % |
2002 | 73,6 % | 46,6 % | ||||
D153-P513 | Aasia/ Oseania | 6–35 kk | 1 041 | 2002 | 62,2 % | 48,6 % |
D153-P522 | Eurooppa, Aasia/ Oseania, Latinalainen Amerikka | 11–24 kk | 1 150 | 2002-2003 | 78,4 % | 63,8 % |
D153-P501 | Aasia/ Oseania | 12–35 kk | 2 764 | 2000-2001 | 72,9 % | 70,1 % |
2001-2002 | 84,3 % | 64,2 % | ||||
AV006 | USA | 15–71 kk | 1 259 | 1996-1997 | 93,4 % | 93,4 % |
1997-1998 | 100 % | 87,1 % |
a kk=kuukautta.
b Tutkimukseen osallistuneiden määrä ensimmäisen vuoden tehoanalyysissä.
c Viljelyn avulla varmennettujen influenssasairauksien väheneminen lumerokotteeseen verrattuna.
d Kliinisen tutkimuksen D153-P504 tiedot perustuvat tutkimukseen osallistuneisiin henkilöihin, jotka saivat kaksi annosta tutkimusrokotetta. Aiemmin rokottamattomilla tutkimuksen osallistujilla, jotka saivat yhden annoksen 1. vuonna, teho oli 57,7 % (95 % CI: 44,7; 67,9) ja 56,3 % (95 % CI: 43,1; 66,7), mikä tukee kahden rokoteannoksen tarvetta aiemmin rokottamattomilla lapsilla.
e Tutkimuksen osallistujilla, jotka saivat 2 annosta 1. vuonna ja lumerokotetta 2. vuonna, teho 2. vuonna oli 56,2 % (95 % CI: 30,5; 72,7) ja 44,8 % (95 % CI: 18,2; 62,9) tutkimuksessa D153-P501, mikä tukee toisen kauden uudelleenrokotuksen tarvetta.
f Ensisijainen kiertävä kanta oli antigeenisesti poikkeava rokotteen H3N2-kannasta; teho yhteensopimatonta A/H3N2-kantaa vastaan oli 85,9 % (95 % CI: 75,3; 91,9).
Taulukko 2 Fluenz valmisteen suhteellinen teho pistettävään influenssarokotteeseen verrattuna lapsilla suoritetuissa aktiivikontrolloiduissa tutkimuksissa
Tutkimuksen nro | Alue | Ikärajata | Tutkimuk-seen osallistujien lukumäärä | Influenssa-kausi | Parantunut teho(95 % CI)b | Parantunut teho |
MI-CP111 | USA, Eurooppa, Aasia/ Oseania | 6–59 kk | 7 852 | 2004-2005 | 44,5 % | 54,9 % |
D153-P514 | Eurooppa | 6–71 kk | 2 085 | 2002-2003 | 52,7 % | 52,4 % |
D153-P515 | Eurooppa | 6–17 v. | 2 211 | 2002-2003 | 34,7 % | 31,9 % |
a kk=kuukautta. v.=vuotta. Ikäjakauma on tutkimussuunnitelman kuvauksen mukainen.
b Viljelyn avulla varmennettujen influenssasairauksien väheneminen pistettävään influenssarokotteeseen verrattuna.
c Fluenz-valmisteella todettiin 55,7 % (39,9; 67,6) vähemmän tapauksia kuin pistettävällä influenssarokotteella 3 686 vauvalla ja pikkulapsella, joiden ikä oli 6−23 kuukautta, ja 54,4 % (41,8; 64,5) vähemmän tapauksia 4 166 lapsella, joiden ikä oli 24-59 kuukautta.
d Fluenz-valmisteella todettiin 64,4 % (1,4; 88,8) vähemmän tapauksia kuin pistettävällä influenssarokotteella 476 vauvalla ja pikkulapsella, joiden ikä oli 6-23 kuukautta, ja 48,2 % (12,7; 70,0) vähemmän tapauksia 1 609 lapsella, joiden ikä oli 24-71 kuukautta.
Fluenz-valmisteen turvallisuus
Krooniset sairaudet
Vaikka turvallisuus lapsilla ja nuorilla, joilla on lievä tai keskivaikea astma, on varmistettu, tiedot turvallisuudesta ovat niukkoja lapsilla, joilla on muita keuhkosairauksia tai kroonisia kardiovaskulaarisia, metabolisia tai munuaissairauksia.
Tutkimuksessa (D153-P515), johon osallistui 6–17 vuotiaita keskivaikeaa tai vaikeaa astmaa sairastavia lapsia (trivalenttinen Fluenz: n = 1 114, trivalenttinen injektoitava influenssarokote: n = 1 115), ei esiintynyt merkittäviä eroja hoitoryhmien välillä astman pahenemistapauksissa, keskimääräisessa huippu-ulosvirtausmäärässä, astman oirepisteissä tai yöaikaisen heräämisen pisteissä. Hengityksen vinkumista esiintyi 15 päivän kuluessa rokotuksen jälkeen vähemmän Fluenz-rokotetta saaneilla kuin inaktivoitua rokotetta saaneilla (19,5 % vs. 23,8 %, P = 0,02).
Tutkimuksessa, johon osallistui 9–17 -vuotiaita keskivaikeaa tai vaikeaa astmaa sairastavia lapsia ja nuoria (trivalenttinen Fluenz: n = 24, lumelääke: n = 24), ensisijaisessa turvallisuuskriteerissä eli uloshengityksen sekuntikapasiteetin (FEV1) ennustetussa prosentuaalisessa muutoksessa ei ollut eroja hoitoryhmien välillä mitattuna ennen rokotusta ja sen jälkeen.
Tutkimuksissa, joihin osallistuneista aikuisista suurella osalla oli krooninen perussairaus, trivalenttisen Fluenz-valmisteen turvallisuusprofiili oli vertailukelpoinen niiden henkilöiden turvallisuusprofiiliin, joilla ei ollut näitä sairauksia.
Immuunipuutteiset
24 HIV-infektiota sairastavalla lapsella ja 25 HIV-negatiivisella lapsella, jotka olivat iältään 1–7 vuotta, sekä 243 HIV-infektiota sairastavalla lapsella ja nuorella, jotka olivat iältään 5–17 vuotta ja jotka saivat vakaata antiretroviraalista hoitoa, rokotteen viruksen vapautumisen tiheys ja kesto oli verrannollinen terveisiin yksilöihin nähden. HIV-viruskuormaan tai CD4-määriin kohdistuvia haitallisia vaikutuksia ei havaittu trivalentin Fluenz-rokotteen antamisen jälkeen. 20 keskivaikeasti tai vaikeasti immuunipuutteista lasta ja nuorta iältään 5–17 vuotta (jotka saivat solunsalpaajahoitoa ja/tai sädehoitoa tai jotka olivat äskettäin saaneet solunsalpaajahoitoa) satunnaistettiin 1:1 saamaan trivalenttia Fluenz-rokotetta tai lumelääkettä. Rokotteen viruksen vapautumisen tiheys ja kesto näillä immuunipuutteisilla lapsilla ja nuorilla oli verrannollinen terveiden lasten ja nuorten arvoihin. Fluenz ja Fluenz Tetra -valmisteen tehokkuutta immuunipuutteisten yksilöiden influenssan kaltaisen sairauden estämisessä ei ole arvioitu.
Fluenz Tetra -rokotteen immunogeenisuus
Satunnaistettu, kaksoissokkoutettu, aktiivikontrolloitu, yhdenvertaisuutta tutkiva monikeskustutkimus tehtiin Fluenz Tetra -valmisteen immunogeenisuuden arvioimiseksi verrattuna Fluenz-valmisteeseen (aktiivinen kontrolli) 2–17-vuotiaissa lapsissa ja nuorissa. Yhteensä 2 312 lasta ja nuorta satunnaistettiin keskuksissa suhteessa 3:1:1 saamaan joko Fluenz Tetra -valmistetta tai toista kahdesta Fluenz-vertailurokotteesta, joissa molemmissa oli yksi B-kanta, joka vastasi jompaakumpaa Fluenz Tetra -valmisteen kahdesta B-kannasta (B-kanta Yamagata- ja Victoria-viruslinjasta).
Immunogeenisuus arvioitiin vertaamalla kantaspesifisen seerumin hemagglutinaation inhibition (HAI) geometrisiä keskimääräisiä vasta-ainetittereitä (GMT) valmisteen antamisen jälkeen. Fluenz Tetra -valmiste oli immunologisesti yhdenvertainen näiden kahden Fluenz-valmisteen kanssa, koska rokotuksen jälkeen kunkin neljän kantaspesifisen HAI-vasta-aineen GMT-suhteiden 95 %:n luottamusvälin yläraja oli ≤1,5.
Tutkimukset aikuisilla
Useat lumelääkevertailua käyttäneet tutkimukset ovat osoittaneet, että Fluenz-valmisteella voi olla jonkin verran tehoa aikuisiin. Päätöstä tämän rokotteen kliinisistä eduista aikuisille ei kuitenkaan ole voitu tehdä, koska joidenkin tutkimusten tulokset verrattuina injektoitavia influenssarokotteita koskevien tutkimusten tuloksiin viittasivat siihen, ettei Fluenz-valmiste ole yhtä tehokas.
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta, lisääntymis- ja kehitystoksisuutta, paikallista siedettävyyttä ja neurovirulenssia koskevien suoritettujen konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Sakkaroosi
Dikaliumfosfaatti
Kaliumdivetyfosfaatti
Gelatiini (sika, tyyppi A)
Arginiinihydrokloridi
Mononatriumglutamaattimonohydraatti
Injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä rokotetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
18 viikkoa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Pidä nenäkappale ulkopakkauksessa. Herkkä valolle.
Ennen käyttöä rokote voidaan poistaa jääkaapista enintään 12 tunnin ajaksi enintään 25 °C:n lämpötilaan. Säilyvyystiedot osoittavat, että rokotteen komponentit säilyvät 12 tuntia, kun valmiste säilytetään 8–25 °C:n lämpötilassa, minkä jälkeen Fluenz Tetra on käytettävä välittömästi tai hävitettävä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FLUENZ TETRA nenäsumute, suspensio
10 x 0,2 ml (307,91 €)
PF-selosteen tieto
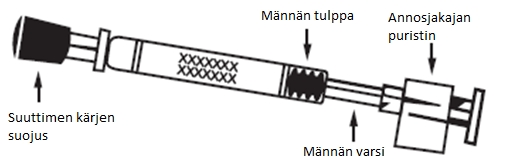
Fluenz Tetra toimitetaan 0,2 ml:n suspensiona kertakäyttöisessä annostelijassa (tyypin 1 lasia), jossa on suutin (polypropyleeniä ja polyetyleeninen siirtoventtiili), suuttimen kärjen suojuksen korkki (synteettistä kumia), männän varsi, männän tulppa (butyylikumia) ja annosjakajan puristin.
Pakkauskoko on 1 tai 10.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Fluenz Tetra on kaupan kausittain, syyskuusta noin helmikuulle.
Suspensio on väritön tai vaaleankeltainen, kirkas tai opalisoiva, ja sen pH on noin 7,2. Se saattaa sisältää pieniä valkoisia hiukkasia.
Käyttö- ja käsittelyohjeet
Antotapa
Fluenz Tetra ON TARKOITETTU AINOASTAAN NENÄÄN.
- EI SAA KÄYTTÄÄ NEULAN KANSSA. Ei saa antaa pistoksena.

- Älä käytä Fluenz Tetra ‑valmistetta viimeisen käyttöpäivämäärän jälkeen tai jos sumutin näyttää vahingoittuneelta, esimerkiksi jos mäntä on löysällä tai irti sumuttimesta tai jos näet merkkejä vuodosta.
- Tarkista rokotteen ulkonäkö ennen antoa. Suspension on oltava väritöntä tai vaaleankeltaista, kirkasta tai opalisoivaa. Se saattaa sisältää pieniä valkoisia hiukkasia.
- Fluenz Tetra annetaan jaettuna annoksena kumpaankin sieraimeen.
- Kun puoli annosta on annettu yhteen sieraimeen, anna annoksen toinen puoli toiseen sieraimeen välittömästi tai lyhyen ajan kuluessa.
- Potilas voi hengittää normaalisti rokotteen annon aikana – hänen ei tarvitse aktiivisesti hengittää sisään tai nuuhkaista.
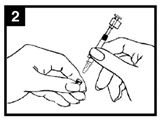
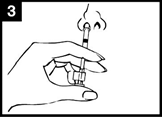
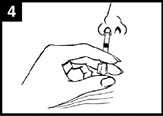
- Katso yksityiskohtaiset käyttöohjeet ja Fluenz Tetra -käyttökaaviosta (kuva 1).
Kuva 1 Fluenz Tetra -valmisteen antaminen
Tarkista viimeinen käyttöpäivämäärä |
Valmistele annostelija |
Annostelijan asemointi |
Paina mäntää |
Irrota annosjakajan puristin |
Annostele sieraimeen |
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten lääketieteellistä jätettä koskevien vaatimusten mukaisesti.
Korvattavuus
FLUENZ TETRA nenäsumute, suspensio
10 x 0,2 ml
- Ei korvausta.
ATC-koodi
J07BB03
Valmisteyhteenvedon muuttamispäivämäärä
28.07.2023
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi