EKLIRA GENUAIR inhalaatiojauhe 322 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi potilaan saama annos (suukappaleen kautta saatava annos) sisältää 375 mikrogrammaa aklidiniumbromidia, mikä vastaa 322 mikrogrammaa aklidiniumia. Tämä vastaa mitattuna annoksena 400 mikrogrammaa aklidiniumbromidia, mikä vastaa 343 mikrogrammaa aklidiniumia.
Apuaine, jonka vaikutus tunnetaan
Yksi potilaan saama annos sisältää noin 12 mg laktoosia (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe.
Kliiniset tiedot
Käyttöaiheet
Eklira Genuair -valmiste on tarkoitettu aikuispotilaiden keuhkoahtaumataudin (COPD) bronkodilatoivaan ylläpitohoitoon ja oireiden lievittämiseen (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Suositusannos on yksi inhalaatio eli 322 mikrogrammaa aklidiniumia kaksi kertaa vuorokaudessa.
Jos annoksen ottaminen unohtuu, seuraava annos tulee ottaa mahdollisimman nopeasti. Kuitenkin mikäli on lähes seuraavan annoksen ottamisen aika, unohtunut annos tulee jättää ottamatta.
Iäkkäät
Annoksen muuttaminen iäkkäitä potilaita hoidettaessa ei ole tarpeen (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen hoidettaessa potilaita, joilla on munuaisten vajaatoimintaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen hoidettaessa potilaita, joilla on maksan vajaatoimintaa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Eklira Genuair –valmistetta lapsille ja nuorille (alle 18-vuotiaille) keuhkoahtaumataudin hoitoon.
Antotapa
Inhaloitava.
Potilaat tulee ohjeistaa käyttämään tuotetta oikein, koska Genuar-inhalaattori saattaa toimia eri lailla kuin aikaisemmin potilaalla käytössä olleet inhalaattorit. On tärkeää ohjeistaa potilasta lukemaan jokaisen inhalaattorin mukana toimitettavassa pakkausselosteessa olevat käyttöohjeet huolellisesti.
Ks. kohdasta Käyttö- ja käsittelyohjeet käyttöohjeet.
Vasta-aiheet
Yliherkkyys aklidiniumbromidille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Paradoksaalinen bronkospasmi:
Eklira Genuair -valmisteen käyttö voi aiheuttaa paradoksaalisen bronkospasmin. Jos näin tapahtuu, Eklira Genuair -hoito on lopetettava ja harkittava muita hoitoja.
Sairauden paheneminen:
Aklidiniumbromidi on tarkoitettu bronkodilatoivaan ylläpitohoitoon ja sitä ei pidä käyttää akuuttien bronkospasmiepisodien hoitoon, ts. kohtauslääkkeenä. Jos keuhkoahtaumatauti pahenee aklidiniumbromidihoidon aikana niin, että potilas arvioi tarvitsevansa lisälääkitystä, potilaan tilanne ja hoito on arvioitava uudelleen.
Kardiovaskulaariset vaikutukset:
Sydämen rytmihäiriöitä (mukaan lukien eteisvärinää ja paroksysmaalista takykardiaa) havaittiin Eklira Genuair ‑valmisteen annon jälkeen (ks. kohta Haittavaikutukset). Siksi Eklira Genuair ‑valmistetta on käytettävä varoen potilaille, joilla on tai on aiemmin ollut sydämen rytmihäiriöitä tai joilla on sydämen rytmihäiriöiden riskitekijöitä.
Kliinisistä tutkimuksista saatua kokemusta potilaista, joilla on samanaikaisesti sydän- ja verisuonisairaus, on vain vähän (ks. kohta Farmakodynamiikka). Antikolinerginen vaikutusmekanismi voi vaikuttaa näihin sairauksiin.
Antikolinergiset vaikutukset:
Suun kuivuminen, jota on havaittu antikolinergisen hoidon yhteydessä, saattaa pitkään jatkuessaan aiheuttaa kariesta.
Antikolinergisen vaikutuksensa vuoksi aklidiniumbromidia on käytettävä varoen potilaille, joilla on oireista eturauhasen liikakasvua, virtsarakon kaulan ahtauma tai ahdaskulmaglaukooma (vaikka tuotteen suora kosketus silmiin on hyvin epätodennäköinen).
Apuaineet:
Tämä lääkevalmiste sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Aklidiniumbromidin samanaikaista käyttöä muiden antikolinergisten lääkkeiden kanssa ei ole tutkittu eikä siksi niiden samanaikaista käyttöä suositella.
Vaikka virallisia in vivo -yhteisvaikutustutkimuksia ei ole tehty, inhaloitavaa aklidiniumbromidijauhetta on käytetty samanaikaisesti muiden keuhkoahtaumataudin hoitoon käytettävien lääkkeiden kanssa ilman, että käyttöön on liittynyt kliinistä näyttöä yhteisvaikutuksista. Tällaisia lääkkeitä ovat mm. sympatomimeettiset bronkodilaattorit, metyyliksantiinit ja oraaliset ja inhaloitavat steroidit.
In vitro -tutkimukset ovat osoittaneet, että terapeuttisella annoksella aklidiniumbromidin tai aklidiniumbromidin metaboliittien ei odoteta aiheuttavan yhteisvaikutuksia lääkeaineiden kanssa, jotka ovat P-glykoproteiinin (P-gp) substraatteja, tai sytokromi P450:n (CYP450) entsyymien ja esteraasien kautta metaboloituvien lääkeaineiden kanssa (ks. kohta Farmakokinetiikka).
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja aklidiniumbromidin käytöstä raskaana oleville naisille.
Eläinkokeissa onhavaittu sikiötoksisuutta vain annostasoilla, jotka ovat ihmisen aklidiniumbromidin enimmäisaltistusmäärää paljon suurempia (ks. kohta Prekliiniset tiedot turvallisuudesta). Raskauden aikana aklidiniumbromidia tulee käyttää vain, jos odotettavan hyödyn arvioidaan ylittävän mahdolliset riskit.
Imetys
Ei tiedetä, erittyvätkö aklidiniumbromidi ja/tai sen metaboliitit ihmisen rintamaitoon. Eläinkokeissa maitoon on erittynyt pieniä määriä aklidiniumbromidia ja/tai sen metaboliitteja. Riskiä vastasyntyneille ja vauvoille ei voida sulkea pois. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko Eklira Genuair -hoito, ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Eläinkokeissa rotilla on havaittu pientä hedelmällisyyden heikkenemistä vain annostasoilla, jotka ovat ihmisen aklidiniumbromidin enimmäisaltistusmäärää paljon suurempia (ks. kohta Prekliiniset tiedot turvallisuudesta). On epätodennäköistä, että aklidiniumbromidi vaikuttaa ihmisen hedelmällisyyteen suositeltuina annoksina.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Aklidiniumbromidilla saattaa olla vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Aklidiniumbromidin annon jälkeisen päänsäryn, huimauksen tai näön hämärtymisen esiintyminen (ks. kohta Haittavaikutukset) saattaa vaikuttaa ajokykyyn tai koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitettuja Eklira Genuair -hoidon yhteydessä ilmenneitä haittavaikutuksia ovat päänsärky (6,6 %) ja nenänielun tulehdus (5,5 %).
Taulukoitu yhteenveto haittavaikutuksista
Alla lueteltujen haittavaikutusten esiintyvyys perustuu karkeaan haittavaikutusten määrään (ts. Eklira Genuair -valmisteesta johtuviksi katsottujen tapahtumien määrään), joka havaittiin Eklira Genuair 322 mikrogrammaa -valmisteen (636 potilasta) yhdistetyssä analyysissä, jossa analysoitiin yhtä 6 kuukauden ja kahta 3 kuukauden satunnaistettua, lumelääkekontrolloitua kliinistä tutkimusta, tai markkinoille tulon jälkeisten tutkimusten tuloksiin.
Lumelääkekontrolloidussa tutkimuksessa 1 791 potilaalla, joilla oli keskivaikea, vaikea tai hyvin vaikea keuhkoahtaumatauti ja jotka saivat Eklira Genuair -valmistetta enintään 36 kuukauden ajan, ei havaittu muita haittavaikutuksia.
Haittavaikutusten esiintyvyys on määritelty seuraavassa: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100 < 1/10); melko harvinainen (≥ 1/1 000 < 1/100); harvinainen (≥ 1/10 000 < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
| Elinryhmä | Haittavaikutus | Yleisyys |
| Infektiot | Sinuiitti | Yleinen |
| Nenänielun tulehdus | Yleinen | |
| Immuunijärjestelmä | Yliherkkyys | Harvinainen |
| Angioedeema | Tuntematon | |
| Anafylaktinen reaktio | Tuntematon | |
| Hermosto | Päänsärky | Yleinen |
| Huimaus | Melko harvinainen | |
| Silmät | Näön hämärtyminen | Melko harvinainen |
| Sydän | Sydämen rytmihäiriöt, mukaan lukien eteisvärinä ja paroksysmaalinen takykardia | Melko harvinainen |
| Sydämen tiheälyöntisyys | Melko harvinainen | |
| Sydämentykytykset | Melko harvinainen | |
| Hengityselimet, rintakehä ja välikarsina | Yskä | Yleinen |
| Käheys | Melko harvinainen | |
| Ruoansulatuselimistö | Ripuli | Yleinen |
| Pahoinvointi | Yleinen | |
| Suun kuivuminen | Melko harvinainen | |
| Suutulehdus | Melko harvinainen | |
| Iho ja ihonalainen kudos | Ihottuma | Melko harvinainen |
| Kutina | Melko harvinainen | |
| Munuaiset ja virtsatiet | Virtsaumpi | Melko harvinainen |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Suuret aklidiniumbromidiannokset saattavat aiheuttaa antikolinergisia merkkejä ja oireita.
Systeemisiä antikolinergisia haittavaikutuksia ei kuitenkaan esiintynyt, kun terveille tutkimushenkilöille annettiin enimmillään 6 000 mikrogramman inhalaatiokerta-annos aklidiniumbromidia. Kliinisesti merkitseviä haittavaikutuksia ei myöskään havaittu, kun terveille tutkimushenkilöille annettiin enimmillään 800 mikrogrammaa aklidiniumbromidia kaksi kertaa vuorokaudessa 7 päivän ajan.
Koska aklidiniumbromidin oraalinen hyötyosuus on pieni ja koska Genuair-inhalaattorissa on sisäänhengityksestä aktivoituva annostelumekanismi, on epätodennäköistä että lääkkeen tahaton nauttiminen suun kautta aiheuttaisi myrkytyksen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, antikolinergit, ATC-koodi: R03BB05
Vaikutusmekanismi
Aklidiniumbromidi on kompetitiivinen, selektiivinen muskariinireseptoriantagonisti (tunnetaan myös nimellä antikolinergi), jonka viipymä M3-reseptoreissa on pidempi kuin M2-reseptoreissa. M3-reseptorit välittävät hengitysteiden sileän lihaksen supistumista. Inhaloitu aklidiniumbromidi vaikuttaa keuhkoissa paikallisesti estäen hengitysteiden sileän lihaksen M3-reseptoreita ja saaden aikaan bronkodilataation. Prekliinisissä in vitro- ja in vivo -tutkimuksissa havaittiin, että aklidiniumbromidi estää nopeasti, annoksesta riippuen ja pitkävaikutteisesti asetyylikoliinin aiheuttamaa keuhkoputkien supistumista. Aklidiniumbromidi hajoaa plasmassa nopeasti, ja sen vuoksi systeemiset antikolinergiset haittavaikutukset ovat vähäiset.
Farmakodynaamiset vaikutukset
Tutkimukset valmisteen kliinisestä tehokkuudesta osoittivat, että Eklira Genuair paransi kliinisesti merkitsevästi keuhkojen toimintaa (mitattuna uloshengityksen sekuntikapasiteettina [FEV1]) 12 tuntia aamuannoksen ja ilta-annoksen jälkeen (nousu lähtötasosta 124‑133 ml). Vaikutus alkoi 30 minuutin kuluessa ensimmäisen annoksen antamisesta. Enimmäisbronkodilataatio ja keskimääräinen FEV1-arvon huippunousu verrattuna vakaan tilan perustasoon 227‑268 ml saavutettiin 1‑3 tunnin kuluessa annoksen antamisesta.
Sydämen elektrofysiologia
Aklidiniumbromidi (200 tai 800 mikrogrammaa) annettuna kerran vuorokaudessa 3 päivän ajan terveille tutkimushenkilöille ei vaikuttanut QT-aikaan perusteellisessa QT-tutkimuksessa (korjattu joko Fridericia- tai Bazett-menetelmällä tai yksilöllisesti).
Eklira Genuair -hoidolla ei myöskään havaittu olevan kliinisesti merkitsevää vaikutusta sydämen rytmiin 336 potilaalla (joista 164 sai Eklira Genuair 322 mikrogrammaa kaksi kertaa vuorokaudessa) 24 tunnin Holter-seurannassa 3 kuukauden hoidon jälkeen.
Kliininen teho ja turvallisuus
Eklira Genuair -valmisteen faasi III kliininen kehitysohjelma käsitti 269 potilasta, jotka saivat Eklira Genuair 322 mikrogrammaa kaksi kertaa vuorokaudessa 6 kuukautta satunnaistetussa, lumelääkekontrolloidussa tutkimuksessa, sekä 190 potilasta, jotka saivat Eklira Genuair 322 mikrogrammaa kaksi kertaa vuorokaudessa 3 kuukautta satunnaistetussa, lumelääkekontrolloidussa tutkimuksessa. Tehoa arvioitiin mittaamalla keuhkojen toimintaa sekä oireenmukaisten hoitotulosten, kuten hengenahdistuksen, terveyteen liittyvän elämänlaadun, lisälääkityksen ja pahenemisvaiheiden ilmaantumisen perusteella. Pitkän aikavälin turvallisuustutkimuksissa Eklira Genuair on yhdistetty bronkodilatoivaan vaikutukseen, kun hoito on kestänyt yli 1 vuoden.
Bronkodilataatio
6 kuukautta kestäneessä tutkimuksessa Eklira Genuair 322 mikrogrammaa kaksi kertaa vuorokaudessa saaneiden potilaiden keuhkojen toiminta parani kliinisesti merkitsevästi (FEV1-arvolla mitattuna). Enimmäisbronkodilataatiovaikutukset näkyivät heti ensimmäisenä päivänä ja säilyivät koko 6 kuukautta kestäneen hoitojakson ajan. 6 kuukauden hoidon jälkeen keskimääräinen paraneminen aamulla ennen annosta FEV1-arvolla mitattuna lumelääkkeeseen verrattuna oli 128 ml (95 % CI = 85‑170; p < 0,0001).
Eklira Genuair -valmisteesta tehtiin samanlaisia havaintoja 3 kuukautta kestäneessä tutkimuksessa.
Tautikohtainen terveydentila ja symptomaattiset edut
Eklira Genuair lievensi potilaiden hengenahdistusta kliinisesti merkitsevästi (Transition Dyspnoea -indeksin [TDI] perusteella arvioituna) ja paransi terveyteen liittyvää elämänlaatua (St. George’s Respiratory -kyselylomakkeella [SGRQ] arvioituna). Alla olevassa taulukossa näkyy oireiden lieventyminen 6 kuukauden Eklira Genuair -hoidon jälkeen.
Muuttuja | Hoito | Nousu | p-arvo | |
Eklira Genuair | Lumelääke | |||
TDI | ||||
MCIDa:n saaneiden | 56,9 | 45,5 | 1,68-kertainen c | 0,004 |
Keskimääräinen muutos lähtötasosta | 1,9 | 0,9 | 1,0 yksikkö | < 0,001 |
SGRQ | ||||
MCIDb:n saaneiden | 57,3 | 41,0 | 1,87-kertainen c | < 0,001 |
Keskimääräinen muutos lähtötasosta | ‑7,4 | ‑2,8 | ‑4,6 yksikköä | < 0,0001 |
a Kliinisesti merkitsevä vähimmäisero (MCID), joka on vähintään 1 yksikön muutos TDI:ssä.
b MCID, joka on vähintään ‑4 yksikön muutos SGRQ:ssa.
c Todennäköisyyssuhde, todennäköisyyden kasvu MCID:n saavuttamiseen lumelääkkeeseen verrattuna.
Potilaat, jotka saivat Eklira Genuair -valmistetta, tarvitsivat vähemmän lisälääkitystä kuin potilaat, joita hoidettiin lumelääkkeellä (0,95 henkäyksen väheneminen päivässä kuuden kuukauden aikana [p = 0,005]). Eklira Genuair lievensi myös keuhkoahtaumataudin oireita (hengenahdistusta, yskää ja limannousua) sekä yö- ja aamuyöoireita.
6 ja 3 kuukauden lumelääkekontrolloitujen tutkimusten yhdistetty analyysi osoitti tilastollisesti merkitsevän vähenemisen kohtalaisten ja vaikeiden pahenemisvaiheiden (jotka vaativat antibiootti- tai kortikosteroidihoitoa tai jotka johtivat sairaalahoitoon) ilmaantumisessa aklidiniumilla (322 mikrogrammaa kahdesti päivässä) hoidettaessa verrattuna lumelääkkeeseen (ilmaantuvuussuhteet potilasta kohti vuodessa: aklidinium 0,31 ja lumelääke 0,44; p = 0,0149).
Pitkän aikavälin, enintään 3 vuoden mittainen, turvallisuutta ja tehoa koskevat tutkimus
Aklidiniumbromidin vaikutusta merkittävien sydän- ja verisuonitapahtumien (MACE) ilmaantumiseen arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa, rinnakkaisryhmillä toteutetussa tutkimuksessa 3 630 aikuispotilaalla, jotka olivat 40–91-vuotiaita ja joilla oli keskivaikea, vaikea tai hyvin vaikea keuhkoahtaumatauti ja joita hoidettiin enintään 36 kuukautta. 58,7 % oli miehiä ja 90,7 % valkoihoisia, ja keskimääräinen FEV1 bronkodilaattorin käytön jälkeen oli 47,9 % ennustearvosta ja keskimääräinen CAT-testitulos (COPD Assessment Test) 20,7. Kaikilla potilailla oli aiemmin todettu sydän- ja verisuonisairaus tai aivoverisuonisairaus ja/tai merkittäviä kardiovaskulaarisia riskitekijöitä. 59,8 %:lla potilaista oli ilmennyt ainakin yksi keuhkoahtaumataudin pahenemisvaihe seulontakäyntiä edeltäneiden 12 kuukauden aikana. Tutkimukseen osallistuneista potilaista noin 48 %:lla oli aiemmin todettu ainakin yksi dokumentoitu sydän- ja verisuonitapahtuma: aivoverisuonisairaus (13,1 %), sepelvaltimotauti (35,4 %) tai ääreisverisuonien sairaus tai katkokävely (13,6 %).
Tutkimusasetelma oli tapahtumapohjainen ja tutkimus päättyi, kun oli todettu riittävästi MACE-tapahtumia turvallisuutta koskevaa primaarianalyysiä varten. Potilaat lopettivat hoidon, jos heillä ilmeni MACE-tapahtuma, ja siirtyivät hoidon jälkeiseen seurantavaiheeseen tutkimuksen aikana. 70,7 % potilaista jatkoi tutkimuksen loppuun tutkijalääkärin arvioinnin perusteella. Hoidon mediaaniaika oli Eklira Genuair ‑valmistetta saaneiden ryhmässä 1,1 vuotta ja lumelääkettä saaneiden ryhmässä 1 vuosi. Tutkimukseen osallistumisen mediaaniaika oli Eklira Genuair ‑valmistetta saaneiden ryhmässä noin 1,4 vuotta ja lumeryhmässä noin 1,3 vuotta.
Ensisijainen turvallisuutta koskeva päätetapahtuma oli aika ensimmäiseen MACE-tapahtuman ilmaantumiseen, jolloin MACE määriteltiin joksikin seuraavista vahvistetuista tapahtumista: sydän- ja verisuonitautikuolema, ei-fataali sydäninfarkti tai ei-fataali iskeeminen aivohalvaus. Niiden potilaiden osuus, joilla ilmeni ainakin yksi MACE-tapahtuma, oli aklidiniumryhmässä 3,85 % ja lumeryhmässä 4,23 %. Potilaan käyttämään taustahoitoon lisättynä Eklira Genuair ei suurentanut keuhkoahtaumatautipotilaiden MACE-riskiä lumelääkkeeseen verrattuna (riskitiheyksien suhde [HR] 0,89; 95 % CI = 0,64, 1,23). Luottamusvälin yläraja ei sisältänyt ennalta määriteltyä riskimarginaalia, joka oli 1,8.
Keskivaikeiden tai vaikeiden keuhkoahtaumataudin pahenemisvaiheiden määrä potilasta kohti vuodessa ensimmäisen hoitovuoden aikana arvioitiin tutkimuksen ensisijaisena tehoa koskevana päätetapahtumana. Eklira Genuair ‑valmistetta saaneilla potilailla tämä määrä pieneni tilastollisesti merkitsevästi 22 % verrattuna lumelääkkeeseen (määrien suhde [RR] 0,78; 95 % CI = 0,68–0,89; p < 0,001). Lisäksi Eklira Genuair ‑hoidon aikana ensimmäisenä vuonna todettujen keuhkoahtaumataudin pahenemisvaiheista johtuneiden sairaalahoitojen määrä pieneni tilastollisesti merkitsevästi 35 % verrattuna lumelääkkeeseen (RR 0,65; 95 % CI = 0,48–0,89; p = 0,006).
Eklira Genuair ‑ryhmässä todettiin tilastollisesti merkitsevä viive ajassa ensimmäiseen keskivaikeaan tai vaikeaan pahenemisvaiheeseen hoidon aikana verrattuna lumeryhmään. Aklidiniumbromidiryhmän potilailla pahenemisvaiheen riskin suhteellinen vähenemä oli 18 % (HR 0,82; 95 % CI [0,73, 0,92], p < 0,001).
Liikuntakestävyys
Kolmen viikon vaihtovuoroisessa, satunnaistetussa, lumelääkekontrolloidussa kliinisessä tutkimuksessa Eklira Genuair paransi tilastollisesti merkitsevästi kuntoliikuntakestävyyttä lumelääkkeeseen verrattuna. Parannus oli 58 sekuntia (95 % CI = 9–108; p = 0,021; hoitoa edeltävä arvo: 486 sekuntia). Eklira Genuair vähensi tilastollisesti merkitsevästi keuhkojen hyperinflaatiota levossa (toiminnallinen jäännöskapasiteetti [FRC]=0,197 L [95 % CI = 0,321, 0,072; p = 0,002]; jäännöstilavuus [RV] = 0,238 L [95 % CI = 0,396, 0,079; p = 0,004]) ja paransi myös sisäänhengityksen tilavuutta (0,078 L; 95 % CI = 0,01, 0,145; p = 0,025) ja vähensi hengenahdistusta liikunnan aikana Borg-asteikolla mitattuna (0,63 Borg-yksikköä; 95 %, CI = 1,11, 0,14; p = 0,012).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Eklira Genuair -valmisteen käytöstä keuhkoahtaumataudin hoidossa kaikissa pediatrisissa potilasryhmissä(ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Aklidiniumbromidi imeytyy keuhkoista nopeasti, ja huippupitoisuudet plasmassa saavutetaan terveiden tutkimushenkilöiden elimistössä 5 minuutin kuluessa inhalaatiosta ja keuhkoahtaumatautipotilaiden elimistössä yleensä ensimmäisen 15 minuutin aikana. Osuus inhaloidusta annoksesta, joka saavuttaa systeemisen verenkierron muuttumattomana aklidiniumbromidina, on hyvin pieni, alle 5 %.
Vakaan tilan huippupitoisuudet plasmassa, kun keuhkoahtaumatautipotilaat inhaloivat jauhetta 400 mikrogramman aklidiniumbromidiannoksen verran, olivat noin 224 pg/ml. Vakaan tilan tasot plasmassa saavutettiin 7 vuorokauden kuluessa, kun annoksia otettiin kaksi kertaa vuorokaudessa.
Jakautuminen
Genuair-inhalaattorin kautta inhaloidun aklidiniumbromidin kokonaiskulkeutuma keuhkoihin on keskimäärin 30 % mitatusta annoksesta.
Aklidiniumbromidin sitoutuminen plasman proteiineihin määritettynä in vitro tuotti tuloksen, joka todennäköisesti ilmaisi metaboliittien sitoutumista, sillä aklidiniumbromidi hydrolysoituu nopeasti plasmassa; karboksyylihappometaboliitti sitoutuu plasman proteiineihin 87-prosenttisesti ja alkoholimetaboliitti ja 15-prosenttisesti. Pääasiallinen aklidiniumbromidia sitova plasman proteiini on albumiini.
Biotransformaatio
Aklidiniumbromidi hydrolysoituu nopeasti ja kattavasti sen farmakologisesti inaktiivisiksi alkoholi- ja karboksyylihappojohdannaisiksi. Hydrolysoituminen tapahtuu sekä kemiallisesti (ei-entsymaattisesti) sekä entsymaattisesti esteraasien kautta. Butyryylikoliiniesteraasi on pääasiallinen esteraasi hydrolysoitumisessa. Happometaboliitin tasot plasmassa ovat noin 100-kertaisia alkoholimetaboliittien tasoihin sekä inhalaatiosta saatavaan muuttumattomaan aktiiviseen vaikuttavaan aineeseen verrattuna.
Inhaloidun aklidiniumbromidin pieni absoluuttinen hyötyosuus (< 5 %) johtuu siitä, että keuhkoihin kertynyt tai nielty aklidiniumbromidi hydrolysoituu perusteellisesti systeemisesti ja presysteemisesti.
CYP450-entsyymien kautta tapahtuvalla biotransformaatiolla on vähäinen osuus aklidiniumbromidin metabolisessa kokonaispuhdistumassa.
In vitro -tutkimukset ovat osoittaneet, että terapeuttisina annoksina aklidiniumbromidi tai sen metaboliitit eivät inhiboi tai indusoi mitään sytokromi P450:n (CYP450) entsyymejä eivätkä inhiboi esteraaseja (karboksyyliesteraasi, asetyylikoliiniesteraasi ja butyryylikoliiniesteraasi). In vitro ‑tutkimukset ovat osoittaneet, että aklidiniumbromidi ja sen metaboliitit eivät ole P‑glykoproteiinin substraatteja tai estäjiä.
Eliminaatio
Kun keuhkoahtaumatautipotilaat ottavat kaksi 400 mikrogramman inhalaatiota vuorokaudessa, aklidiniumbromidin terminaalinen eliminaation puoliintumisaika on noin 14 tuntia ja efektiivinen puoliintumisaika noin 10 tuntia.
Radioaktiivisesti merkitystä, terveille tutkimushenkilöille laskimoon annetusta 400 mikrogrammasta aklidiniumbromidia erittyi muuttumattomana virtsaan noin 1 %. Enintään 65 % annoksesta eliminoitui metaboliitteina virtsaan ja enintään 33 % metaboliitteina ulosteeseen.
Terveiden tutkimushenkilöiden ja keuhkoahtaumatautipotilaiden inhaloitua 200 tai 400 mikrog aklidiniumbromidia oli virtsaan erittyneen muuttumattoman aklidiniumbromidin määrä hyvin vähäinen, noin 0,1 % annetusta annoksesta. Tämä viittaa siihen, että munuaispuhdistumalla on vähäinen osuus aklidiniumbromidin plasman kokonaispuhdistumassa.
Lineaarisuus/ei-lineaarisuus
Aklidiniumbromidi osoitti kineettistä lineaarisuutta ja ajasta riippumatonta farmakokineettistä käyttäytymistä terapeuttisella alueella.
Erityisryhmät
Iäkkäät potilaat
Aklidiniumbromidin farmakokineettiset ominaisuudet potilaissa, joilla on keskivaikea tai vaikea keuhkoahtaumatauti, näyttävät olevan samanlaisia 40‑59-vuotiaissa ja yli 70-vuotiaissa potilaissa. Siksi annoksen muuttaminen ei ole tarpeen iäkkäille keuhkoahtaumatautipotilaille.
Maksan vajaatoiminta
Tutkimuksia ei ole tehty potilaille, joilla on maksan vajaatoiminta. Koska aklidiniumbromidi metaboloituu pääasiassa plasman kemiallisen ja entsymaattisen pilkkoutumisen kautta, on hyvin epätodennäköistä, että maksan vajaatoiminta muuttaisi sen systemaattista altistumista. Annoksen muuttaminen keuhkoahtaumatautipotilaille, joilla on maksan vajaatoimintaa, ei ole tarpeen.
Munuaisten vajaatoiminta
Verrattaessa tutkimushenkilöitä, joiden munuaistoiminta on normaalia, ja tutkimushenkilöitä, joiden munuaistoiminta on heikentynyt, ei ole havaittu merkitseviä farmakokineettisiä eroja. Siksi annoksen muuttaminen tai lisäseuranta ei ole tarpeen hoidettaessa keuhkoahtaumatautipotilaita, joilla on munuaisten vajaatoimintaa.
Rotu
Toistuvien inhalaatioiden jälkeen aklidiniumbromidin systeemisen altistuksen on havaittu olevan samankaltainen japanilaisilla ja valkoihoisilla potilailla.
Farmakokineettiset/farmakodynaamiset suhteet
Koska aklidiniumbromidi vaikuttaa paikallisesti keuhkoissa ja hajoaa nopeasti plasmassa, farmakokinetiikan ja farmakodynamiikan välillä ei ole suoraa suhdetta.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Prekliinisissä tutkimuksissa havaitut vaikutukset, jotka liittyvät kardiovaskulaarisiin parametreihin (nopeutunut sydämensyke koirilla), lisääntymistoksisuuteen (sikiötoksiset vaikutukset) ja hedelmällisyyteen (lievä lasku hedelmöittymisluvuissa ja keltarauhasten määrässä sekä munasolun kiinnittymistä edeltäviä ja sen jälkeisiä keskenmenoja) vain silloin, kun on käytetty altistusta, joka ylittää suurimman ihmisille käytettävän annostuksen niin huomattavasti, että asialla on kliinisen käytön kannalta vain vähäinen merkitys.
Prekliinisissä toksisuustutkimuksissa havaittu vähäinen toksisuus johtuu osittain aklidiniumbromidin nopeasta metaboloitumisesta plasmassa sekä pääasiallisten metaboliittien merkittävän farmakologisen vaikutuksen puutteesta. Turvamarginaalien NOAEL-taso (no observed adverse effect levels) ihmisen systeemiselle altistukselle 400 mikrog:n annoksella kaksi kertaa vuorokaudessa oli näissä tutkimuksissa 7−73-kertainen.
Farmaseuttiset tiedot
Apuaineet
Laktoosimonohydraatti.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Käytettävä 90 päivän kuluessa pussin avaamisesta.
Säilytys
Pidä inhalaattori pussissa, kunnes aloitat sen käytön.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EKLIRA GENUAIR inhalaatiojauhe
322 mikrog (L:kyllä) 60 annosta (40,21 €), 3 x 60 annosta (113,74 €)
PF-selosteen tieto
Inhalaattori on useista osista koostuva laite, joka on valmistettu polykarbonaatista, akryylinitriilibutadieenistyreenistä, polyasetaalista, polybutyleenitereftalaatista, polypropeenista, polystyreenistä ja ruostumattomasta teräksestä. Se on väriltään valkoinen ja siinä on kiinteä annoslaskuri ja vihreä annostelupainike. Suukappale on peitetty irrotettavalla vihreällä suojakorkilla. Inhalaattori toimitetaan muovilaminaatti pussissa pahvikoteloon pakattuna.
Kotelo, jossa yksi 30 annosta sisältävä inhalaattori.
Kotelo, jossa yksi 60 annosta sisältävä inhalaattori.
Kotelo, jossa kolme 60 annosta sisältävää inhalaattoria.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai melkein valkoinen jauhe valkoisessa inhalaattorissa, jossa on kiinteä annoslaskuri ja vihreä annostelupainike.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Käyttöohjeet
Aluksi
Lue nämä käyttöohjeet ennen kuin käytät lääkevalmistetta.
Tutustu Genuair-inhalaattorin osiin.
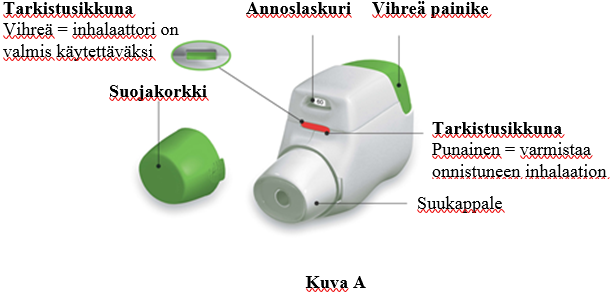
Ennen käyttöä:
a) Repäise suljettu pussi auki ennen ensimmäistä käyttökertaa ja ota inhalaattori pussista. Voit heittää pussin roskiin.
b) Älä paina vihreää painiketta ennen kuin olet valmis ottamaan annoksen.
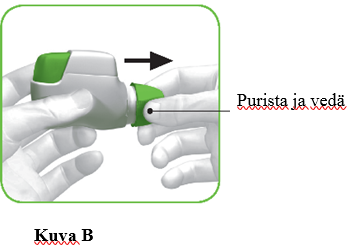
c) Poista suojakorkki puristamalla kevyesti sen kummallakin puolella näkyviä nuolia (kuva B).
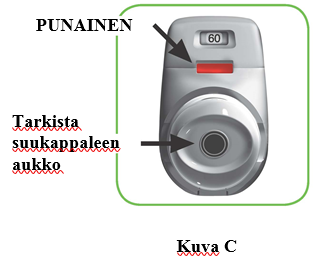
VAIHE 1: Valmistele annos
1.1 Tarkista suukappaleen aukko ja varmista, ettei mikään tuki suukappaletta (kuva C).
1.2 Tarkista tarkistusikkuna (sen pitäisi olla punainen, kuva C).
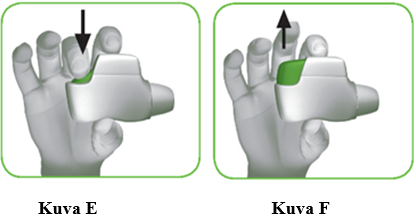
1.3 Pidä inhalaattori vaakatasossa siten, että suukappale on itseesi päin ja vihreä painike on ylhäällä (kuva D).

1.4 Paina vihreä painike kokonaan alas ladataksesi annoksen (kuva E).
Kun painat painikkeen kokonaan alas, tarkistusikkunan väri muuttuu punaisesta vihreäksi.
Varmista, että vihreä painike on ylhäällä. Äläkallista. |
1.5 Vapauta vihreä painike (kuva F).
Varmista, että vapautat painikkeen, jotta inhalaattori toimii oikein. |
Pysähdy ja tarkista:
1.6 Varmista, että tarkistusikkunan väri on nyt vihreä (kuva G).
Lääkevalmiste on valmiina inhalaatiota varten.
Siirry vaiheeseen 2: Lääkevalmisteen inhalointi.

Mitä tehdä, jos tarkistusikkunan väri on yhä punainen painikkeen painamisen jälkeen (kuva H).
Annos ei ole valmis. Palaa vaiheeseen 1 Valmistele annos ja toista vaiheet 1.1–1.6. |
VAIHE 2: Lääkevalmisteen inhalointi
Lue vaiheet 2.1–2.7 ennen käyttöä. Älä kallista. |
2.1 Pidä inhalaattori kaukana suusta ja hengitä keuhkot tyhjiksi. Älä koskaan uloshengitä inhalaattoriin (kuva I).
2.2 Pidä pää suorassa, aseta suukappale huulten väliin ja sulje huulet tiukasti suukappaleen ympärille (kuva J).
Älä pidä vihreää painiketta alas painettuna sisäänhengityksen aikana. |

2.3 Sisäänhengitä voimakkaasti ja syvään suun kautta. Jatka sisäänhengitystä niin kauan kuin mahdollista.
Naksahdus kertoo, että inhaloit oikein. Jatka sisäänhengitystä myös naksahduksen kuulemisen jälkeen niin kauan kuin mahdollista. Kaikki potilaat eivät kuule naksahdusta. Varmista tarkistusikkunasta, että olet inhaloinut oikein. |
2.4 Ota inhalaattori pois suusta.
2.5 Pidätä hengitystä niin kauan kuin mahdollista.
2.6 Hengitä hitaasti ulos poispäin inhalaattorista.
| Jotkut potilaat saattavat tuntea hiukkasmaisen tunteen suussaan tai hiukan makean tai kitkerän maun. Älä ota uutta annosta, vaikka et huomaisi mitään makua tai tuntisi hiukkasia sisäänhengityksen jälkeen. |
Pysähdy ja tarkista:
2.7 Varmista, että tarkistusikkunan väri on nyt punainen (kuva K). Tämä tarkoittaa, että olet inhaloinut lääkevalmisteen oikein.

Mitä tehdä, jos tarkistusikkunan väri on yhä vihreä inhalaation jälkeen (kuva L).
Tämä tarkoittaa, että et ole inhaloinut lääkevalmistetta oikein. Palaa vaiheeseen 2 Lääkevalmisteen inhalointi ja toista kohdat 2.1–2.7. Jos tarkistusikkuna ei vieläkään muutu punaiseksi, olet ehkä unohtanut vapauttaa vihreä painikkeen ennen inhalointia tai et ole hengittänyt sisään tarpeeksi voimakkaasti. Jos näin käy, yritä uudelleen. Varmista, että olet vapauttanut vihreän painikkeen, ja hengitä keuhkot tyhjiksi. Hengitä sitten sisään voimakkaasti ja syvään suukappaleen läpi. Ota yhteyttä lääkäriin, jos tarkistusikkunan väri on yhä vihreä usean yrityksen jälkeen. |
Laita suojakorkki takaisin suukappaleeseen jokaisen käyttökerran jälkeen (kuva M) estääksesi inhalaattorin altistumisen pölylle tai muille materiaaleille. Sinun on hävitettävä inhalaattori, jos hukkaat suojakorkin.

Lisätietoa
Mitä sinun on tehtävä, jos vahingossa valmistelet annoksen?
Säilytä inhalaattori niin, että suojakorkki on paikallaan, kunnes on aika ottaa seuraava lääkeannos. Poista sitten suojakorkki ja aloita kohdasta 1.6.
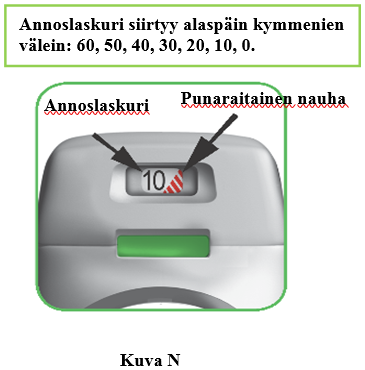
Kuinka annoslaskuri toimii?
- Annoslaskuri näyttää, kuinka monta annosta inhalaattorissa on jäljellä (kuva N).
- Ensimmäisellä käyttökerralla yksi inhalaattori sisältää vähintään 60 annosta tai vähintään 30 annosta pakkauskoon mukaan.
- Aina kun lataat annoksen painamalla vihreää painiketta, annoslaskuri siirtyy hieman seuraavaa numeroa kohti (50, 40, 30, 20, 10 tai 0).
Milloin tarvitset uuden inhalaattorin?
Ota uusi inhalaattori käyttöön:
- jos inhalaattori vaikuttaa vaurioituneelta tai jos hukkaat suojakorkin tai
- kun annoslaskuriin ilmestyy punainen nauha; tämä tarkoittaa, että lähestyt viimeistä annosta (kuva N), tai
- jos inhalaattori on tyhjä (kuva O).
Kuinka tiedät, että inhalaattori on tyhjä?
Kun vihreä painike ei enää palaa kokonaan yläasentoon ja se lukittuu keskiasentoon, olet ottanut viimeisen annoksen (kuva O). Vaikka vihreä painike on lukittu, voit kuitenkin ottaa viimeisen annoksen. Sen jälkeen inhalaattoria ei voi enää käyttää ja sinun on otettava käyttöön uusi inhalaattori.

Kuinka puhdistat inhalaattorin?
Älä KOSKAAN käytä vettä inhalaattorin puhdistamiseen, sillä se voi vahingoittaa lääkevalmistetta.
Jos haluat puhdistaa inhalaattorin, voit pyyhkiä suukappaleen ulkopuolelta kuivalla liinalla tai paperipyyhkeellä.
Korvattavuus
EKLIRA GENUAIR inhalaatiojauhe
322 mikrog 60 annosta, 3 x 60 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03BB05
Valmisteyhteenvedon muuttamispäivämäärä
20.02.2025
Yhteystiedot
Fuglevangsvej 11
1962 Frederiksberg
Denmark
(+45) 7070 1313
www.zentiva.com


