ZOLADEX implantaatti 3,6 mg
Vaikuttavat aineet ja niiden määrät
Gosereliiniasetaatti vastaten gosereliinia 3,6 mg.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Implantaatti.
Kliiniset tiedot
Käyttöaiheet
Eturauhassyövän hoito seuraavissa tilanteissa (katso myös kohta Farmakodynamiikka):
- Metastaattisen eturauhassyövän hoito (katso kohta Farmakodynamiikka)
- Vaihtoehtona kirurgiselle kastraatiolle paikallisesti edenneen eturauhassyövän hoidossa (katso kohta Farmakodynamiikka)
- Liitännäishoitona sädehoidon lisäksi potilailla, joilla on paikallinen korkean riskin eturauhassyöpä tai paikallisesti edennyt eturauhassyöpä (katso kohta Farmakodynamiikka)
- Neoadjuvanttihoitona ennen sädehoitoa potilailla, joilla on paikallinen korkean riskin eturauhassyöpä tai paikallisesti edennyt eturauhassyöpä (katso kohta Farmakodynamiikka)
- Liitännäishoitona radikaalin prostatektomian jälkeen potilaille, joilla on paikallisesti edennyt prostatasyöpä ja suuri sairauden etenemisen riski (katso kohta Farmakodynamiikka)
Rintasyöpä pre- ja perimenopausaalisilla naisilla, jotka soveltuvat hormonaaliterapiaan.
Endometrioosi: Preoperatiivisesti vaikean endometrioosin hoitoon yhtäjaksoisesti korkeintaan 6 kuukaudeksi ja myoomien koon pienentämiseksi korkeintaan 3 kuukaudeksi.
Kohdun limakalvon ohentaminen: Kohdun limakalvon ohentamiseen ennen endometriumin poistamista. Zoladex 3,6 mg annetaan kahtena implantaattina neljän viikon välein ja toimenpide tehdään kahden viikon kuluessa toisen implantaatin antamisesta.
Hedelmöityshoito, esimerkiksi koeputkihedelmöitys: aivolisäkkeen toiminnan lamaaminen ennen gonadotropiinihoitoa (tai ovulaation induktiota).
Suositus: Suositellaan käytettäväksi vain urologian, syöpätautien tai naistentautien erikoislääkäreiden valvomassa hoidossa.
Annostus ja antotapa
Annostus
Aikuiset
Yksi 3,6 mg implantaatti ihon alle vatsaontelon etuseinämään 28 päivän välein.
Endometrioosi
Endometrioosia tulee hoitaa ainoastaan kuuden kuukauden ajan, koska tällä hetkellä kliinistä tietoa pidemmistä hoitoajoista ei ole saatavilla. Toistuvia hoitoja ei tule antaa luun mineraalitiheyden pienenemisen riskin vuoksi. Potilailla, jotka saavat Zoladexia endometrioosin hoitoon on samanaikaisen hormonikorvaushoidon (päivittäinen estrogeeni- ja keltarauhashormonihoito) todettu vähentävän luun mineraalitiheyden pienenemistä sekä vasomotorisia oireita.
Kohdun limakalvon ohentaminen
Käyttö kohdun limakalvon ohentamiseen: neljän tai kahdeksan viikon hoito. Toinen implantaatti voi olla tarpeen naisille, joilla on suuri kohtu tai kun halutaan joustavaa kirurgista aikataulua.
Kohtumyoomat
Naisille, joilla on anemia kohtumyoomien seurauksena: Zoladex 3,6 mg implantaatti rautalääkityksen kanssa voidaan antaa kolmen kuukauden ajan ennen leikkausta.
Hedelmöityshoito
Zoladex 3,6 mg implantaatti annetaan aivolisäkkeen toiminnan lamaamiseksi samalle tasolle kuin aikaisessa follikkelivaiheessa, määritettynä seerumin estradiolipitoisuuden (noin 150 pmol/l) perusteella. Tämä kestää yleensä 7-21 päivää.
Kun lamaantuminen on aikaansaatu, superovulaatiohoito (kontrolloitu munasarjojen stimulaatio) gonadotropiinilla aloitetaan. Pitkävaikutteisella agonistilla aikaansaatu lamaantuminen on pysyvämpää, mikä voi joissain tapauksissa tarkoittaa gonadotropiinin lisääntynyttä tarvetta. Sopivassa follikkelien kehittymisvaiheessa gonadotropiinin anto lopetetaan ja ihmisen istukkagonadotropiinin (hCG) anto aloitetaan ovulaation käynnistämiseksi. Hoidon seuranta, oosyyttien kerääminen ja fertilisaatiotekniikat suoritetaan klinikan normaalikäytännön mukaisesti.
Munuaisten ja maksan vajaatoiminta
Annostelua ei tarvitse sovittaa erikseen potilaille, joilla on munuaisten tai maksan vajaatoiminta.
Iäkkäät potilaat
Annostelua ei tarvitse sovittaa erikseen iäkkäille potilaille.
Lapset
Ei ole tarkoitettu käytettäväksi lapsille.
Antotapa
Katso ohjeet Zoladexin oikeaan antoon käyttöohjekortista.
Varovaisuutta on noudatettava asetettaessa Zoladex-injektioruiskun neula vatsan etuseinämään sillä sen läheisyydessä ovat alempi vatsanseinämävaltimo ja sen haarautumat. On oltava erittäin varovainen annettaessa Zoladexia potilaille, joilla on alhainen kehon painoindeksi (BMI) ja/tai jotka saavat täysimääräistä veren hyytymisenestohoitoa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Tunnettu vakava yliherkkyys vaikuttavalle aineelle tai valmisteen muille aineosille.
Raskaus ja imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Zoladex 3,6 mg implantaattia ei ole tarkoitettu käytettäväksi lapsille, sillä sen turvallisuutta ja tehoa ei ole osoitettu tässä potilasryhmässä.
Zoladexin injektiokohdassa voi ilmetä reaktioita mukaan lukien kipua, mustelmia, verenvuotoa ja verisuonten vaurioitumista. Potilaita, joilla näitä ilmenee, on tarkkailtava vatsan verenvuodon oireiden tai löydösten havaitsemiseksi. Hyvin harvoissa tapauksissa virheellinen antotapa on johtanut verisuonivaurioon ja verenvuotosokkiin, joiden hoito on vaatinut verensiirtoa ja kirurgista toimenpidettä. On oltava erittäin tarkka annettaessa Zoladexia potilaille, joilla on alhainen BMI ja/tai, jotka saavat täysimääräistä veren hyytymisenestohoitoa (ks. kohta Annostus ja antotapa).
Potilaita, joilla on depressio tai korkea verenpaine tulee seurata tarkoin.
Depression (voi olla vakavaa) ilmenemisen riski kasvaa potilailla, joita hoidetaan GnRH-agonisteilla, kuten gosereliinillä. Potilaille on kerrottava tästä ja heitä on hoidettava asianmukaisesti, jos oireita ilmenee.
Androgeenideprivaatiohoito voi pidentää QT-aikaa
Potilailla, joilla on todettu QT-ajan pidentyminen tai sen riskitekijöitä, sekä potilailla, jotka saavat samanaikaisesti QT-aikaa mahdollisesti pidentäviä lääkkeitä (ks. kohta Yhteisvaikutukset), lääkärien pitäisi arvioida hyöty-haittasuhde ottaen huomioon kääntyvien kärkien takykardian mahdollisuus ennen kuin Zoladex-hoito aloitetaan.
Zoladexin käyttö saattaa antaa positiivisen tuloksen dopingtestissä.
Miehet
Zoladex 3,6 mg implantaatin käyttöä miehillä, joilla on virtsanjohtimen ahtauman tai selkäydinkompression vaara, tulee harkita tarkkaan, ja potilaita on seurattava tarkoin ensimmäisen hoitokuukauden aikana. Antiandrogeenin käyttöä hoidon alussa tulisi harkita aloitettaessa LHRH-analogihoitoa (esim. 300 mg syproteroniasetaattia päivittäin kolme päivää ennen Zoladex-hoidon aloitusta sekä kolme viikkoa sen jälkeen), sillä sen on raportoitu ehkäisevän hoidon alussa tapahtuvan seerumin testosteronin nousun aiheuttamia mahdollisia jälkivaikutuksia. Jos potilaalla on jo selkäydinkompressio tai virtsanjohtimen ahtauman aiheuttama munuaisten vajaatoiminta tai ne kehittyvät hoidon aikana, potilaan oireita on hoidettava spesifisesti.
LHRH-agonistin käyttö saattaa aiheuttaa luun mineraalitiheyden pienenemistä. On olemassa viitteitä, että bifosfonaatin käyttö LHRH-agonistihoidon kanssa saattaa vähentää luun mineraalitiheyden pienenemistä miehillä.
Erityistä varovaisuutta on noudatettava potilailla, joilla on muita osteoporoosin riskitekijöitä (esim. pitkäaikainen alkoholin väärinkäyttö, tupakointi, pitkäaikainen antikonvulsantti- tai kortikoidihoito tai osteoporoosin esiintyminen suvussa).
Heikentynyttä glukoosinsietoa on huomattu LHRH-agonistia saavilla miehillä. Tämä saattaa ilmentyä diabeteksena tai jo todetussa diabeteksessa sokeritasapainon menetyksenä. Veren glukoosin seurantaa tulisi siksi harkita.
Sydänkohtauksia ja sydämen vajaatoimintaa on havaittu eturauhassyövän hoidossa käytettyjen LHRH-agonistien farmakoepidemiologisessa tutkimuksessa. Riski näyttää kasvavan yhteiskäytössä antiandrogeenien kanssa.
Naiset
Rintasyöpä
Luun mineraalitiheyden pieneneminen.
LHRH-agonistin käyttö saattaa aiheuttaa luun mineraalitiheyden pienenemistä. Varhaisen rintasyövän kaksi vuotta kestäneen hoidon jälkeen luun mineraalitiheys pieneni keskimäärin 6,2 % reisiluun kaulan ja 11,5 % lannerangan alueella. Hoidon jälkeisessä yhden vuoden seurannassa mineraalitiheyden pienenemisen on osoitettu olevan osittain palautuvaa (palautuminen 3,4 %:iin reisiluun kaulan ja 6,4 %:iin lannerangan alueella lähtöarvoon verrattuna). Tämä perustuu kuitenkin hyvin rajoitettuun tietoon.
Nykyisin käytössä olevan tiedon mukaan luukadon paranemista ilmenee suurimmalla osalla naisista hoidon lopettamisen jälkeen.
Alustavan tiedon mukaan Zoladexin käyttö samanaikaisesti tamoksifeenin kanssa saattaa vähentää luun mineraalitiheyden pienenemistä rintasyöpäpotilailla.
Muut käyttöaiheet
Luun mineraalitiheyden pieneneminen.
On todennäköistä, että LHRH-agonistin käyttö aiheuttaa luun mineraalitiheyden pienenemistä keskimäärin 1 % kuukaudessa kuuden kuukauden hoitojakson aikana. Jokaiseen 10 %:n pienenemiseen luun mineraalitiheydessä liittyy noin 2-3 kertainen murtumariskin kasvu.
Nykyisin käytössä olevan tiedon mukaan luukadon paranemista ilmenee suurimmalla osalla naisista hoidon lopettamisen jälkeen.
Potilailla, jotka saavat Zoladexia endometrioosin hoitoon on samanaikaisen hormonikorvaushoidon todettu vähentävän luun mineraalitiheyden pienenemistä sekä vasomotorisia oireita.
Erityistä tietoa ei ole saatavilla potilaille, joilla osteoporoosi on jo todettu tai joilla on osteoporoosin riskitekijöitä (esim. pitkäaikainen alkoholin väärinkäyttö, tupakointi, pitkäaikainen hoito luun mineraalitiheyttä pienentävillä lääkkeillä kuten antikonvulsanteilla tai kortikoideilla tai osteoporoosin tai vajaaravitsemuksen kuten anorexia nervosan esiintyminen suvussa). Koska luun mineraalitiheyden pieneneminen on haitallisempaa näillä potilailla, Zoladex-hoitoa tulee harkita potilaskohtaisesti, ja se tulee aloittaa perusteellisen arvion jälkeen vain, jos hoidon antamat hyödyt ovat suurempia kuin siitä aiheutuvat riskit. Muita lisätoimenpiteitä on harkittava luun mineraalitiheyden pienenemisen ehkäisemiseksi.
Tyhjennysvuoto
Zoladex-hoidon alussa voi esiintyä emätinverenvuotoa, jonka kesto ja runsaus voivat vaihdella. Emätinverenvuotoa esiintyy yleensä ensimmäisen hoitokuukauden aikana. Emätinverenvuodon aiheuttaa todennäköisesti estrogeenihoidon keskeyttäminen ja se loppuu yleensä itsestään. Jos verenvuoto jatkuu, sen syyt on selvitettävä.
Zoladexin käyttö voi lisätä kohdun kaulakanavan vastusta, mikä on otettava huomioon kohdun kaulakanavaa laajennettaessa.
Kliinistä tietoa ei ole kuin 6 kuukauden hoitojaksoista Zoladex 3,6 mg implantaatin vaikutuksista hyvänlaatuisten gynekologisten sairauksien hoidossa.
Zoladex 3,6 mg implantaattia tulee käyttää osana hedelmöityshoitoa alaan erikoistuneen lääkärin valvonnassa.
Kuten muidenkin LHRH-agonistien käytön yhteydessä munasarjojen hyperstimulaatio -oireyhtymää (OHSS) on raportoitu, kun Zoladex 3,6 mg implantaattia on käytetty yhdessä gonadotropiinin kanssa. Stimulaatiokiertoa tulee seurata tarkoin, jotta OHSS:n kehittymiselle riskialttiit potilaat tunnistetaan. Jos OHSS-riski on todettu, istukkagonadotropiinin, (hCG) antamista ei tule aloittaa, mikäli mahdollista.
On suositeltavaa, että Zoladex 3,6 mg implantaattia käytetään varoen hedelmöityshoitopotilaille, joilla on polykystinen munasarjaoireyhtymä, sillä se voi lisätä kypsyvien munarakkuloiden määrää.
Hedelmällisessä iässä olevien naisten tulee käyttää ei-hormonaalisia ehkäisymenetelmiä Zoladex-hoidon aikana sekä Zoladex-hoidon päättymisen jälkeen aina kuukautisten palautumiseen asti.
Yhteisvaikutukset
Koska androgeenideprivaatiohoito voi pidentää QT-aikaa, Zoladexin samanaikaista käyttöä lääkkeiden kanssa, jotka pidentävät QT-aikaa tai voivat aiheuttaa kääntyvien kärkien takykardiaa, kuten luokan IA (esim. kinidiini, disopyramidi) tai luokan III (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkkeet, metadoni, moksifloksasiini, antipsykootit, jne., pitäisi tarkoin arvioida (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Zoladexia ei tule käyttää raskauden aikana, sillä LHRH-agonisteja samanaikaisesti käytettäessä on olemassa teoreettinen keskenmeno- tai sikiövaurioriski. Hedelmällisessä iässä olevat naiset tulee tutkia huolella ennen hoitoa raskauden poissulkemiseksi. Hoidon aikana tulee käyttää ei-hormonaalisia ehkäisymenetelmiä, kunnes kuukautiset ovat palautuneet (ks. myös kuukautisten palautumiseen liittyvä varoitus kohdassa Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus on poissuljettava ennen Zoladex 3,6 mg implantaatin käyttöä hedelmöityshoitoon. Kliinistä näyttöä ei ole siitä, että hedelmöityshoidossa käytettynä Zoladex aiheuttaisi mitään myöhemmin ilmenevää, munasolujen kehitykseen, raskauteen tai jälkeläiseen liittyvää poikkeavuutta.
Imetys
Zoladexin käyttöä imetyksen aikana ei suositella.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei ole viitteitä siitä, ettäZoladex 3,6 mg heikentäisi kykyä ajaa autoa tai käyttää koneita.
Haittavaikutukset
Alla oleva yleisyysluokitus perustuu kliinisissä tutkimuksissa ja markkinoille tulon jälkeisessä seurannassa havaittuihin sekä omaehtoisesti ilmoitettuihin haittavaikutuksiin. Yleisimmät havaitut haittavaikutukset ovat libidon muutokset, kuumat aallot, hikoilu ja potenssin heikkeneminen.
Haittavaikutusten yleisyys on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Taulukko: Zodalex 3,6 mg implantaatin haittavaikutukset MedDRA:n elinjärjestelmäluokituksen mukaan
Elinjärjestelmä | Yleisyys | Miehet | Naiset |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Hyvin harvinainen | Aivolisäkekasvain | Aivolisäkekasvain |
| Tuntematon | Ei oleellinen | Kohdun myoomien | |
Immuunijärjestelmä | Melko harvinainen | Lääkeyliherkkyysreaktiot | Lääkeyliherkkyysreaktiot |
| Harvinainen | Anafylaktinen reaktio | Anafylaktinen reaktio | |
Umpieritys | Hyvin harvinainen | Pituitaarinen verenvuoto | Pituitaarinen verenvuoto |
Aineenvaihdunta ja ravitsemus | Yleinen | Heikentynyt glukoosinsietoa | Ei oleellinen |
| Melko harvinainen | Ei oleellinen | Hyperkalsemia | |
Psyykkiset häiriöt | Hyvin yleinen | Libidon heikentyminenb | Libidon heikentyminenb |
| Yleinen | Mielialan vaihtelut, | Mielialan vaihtelut, | |
| Hyvin harvinainen | Psykoottiset häiriöt | Psykoottiset häiriöt | |
Hermosto | Yleinen | Parestesia | Parestesia |
| Selkäydinkompressio | Ei oleellinen | ||
| Ei oleellinen | Päänsärky | ||
| Sydän | Yleinen | Sydämen vajaatoimintaf, sydänkohtausf | Ei oleellinen |
| Tuntematon | QT-ajan pidentyminen (katso kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) | ||
Verisuonisto | Hyvin yleinen | Kuumat aallotb | Kuumat aallotb |
| Yleinen | Verenpaineen vaihtelutc | Verenpaineen vaihtelutc | |
| Iho ja ihonalainen kudos | Hyvin yleinen | Voimakas hikoilub | Voimakas hikoilub, aknei |
| Yleinen | Ihottumad | Ihottumad, hiusten lähtög | |
| Tuntematon | Hiusten lähtöh | ks. Yleinen | |
Luusto, lihakset ja sidekudos | Yleinen | Luukipue | Ei oleellinen |
| ks. Melko harvinainen | Nivelsärky | ||
| Melko harvinainen | Nivelsärky | ks. Yleinen | |
| Munuaiset ja virtsatiet | Melko harvinainen | Virtsanjohtimen ahtauma | Ei oleellinen |
| Sukupuolielimet ja rinnat | Hyvin yleinen | Erektiohäiriö | Ei oleellinen |
| Ei oleellinen | Emättimen kuivuus, rintojen kasvu | ||
| Yleinen | Gynekomastia | Ei oleellinen | |
| Melko harvinainen | Rintojen arkuus | Ei oleellinen | |
| Harvinainen | Ei oleellinen | Munasarjakysta, munasarjojen hyperstimulaatio-oireyhtymä | |
| Tuntematon | Ei oleellinen | Tyhjennysvuoto (ks. kohta Varoitukset ja | |
Yleisoireet ja antopaikassa | Hyvin yleinen | ks. Yleinen | Injektiokohdan reaktiot |
| Yleinen | Injektiokohdan reaktiot | ks. Hyvin yleinen | |
Tutkimukset | Yleinen | Luuntiheyden pieneneminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), painon nousu | Luuntiheyden pieneneminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), painon nousu |
a | Heikentynyttä glukoosinsietoa on havaittu miehillä, jotka saavat LHRH-agonisteja. Tämä saattaa ilmentyä diabeteksena tai jo todetussa diabeteksessa sokeritasapainon menetyksenä |
| b | Nämä oireet ovat farmakologisia vaikutuksia, jotka harvoin vaativat hoidon lopettamista. Voimakas hikoilu ja kuumat aallot voivat jatkua Zoladex-hoidon lopettamisen jälkeen |
| c | Nämä oireet voivat ilmetä hypo- tai hypertensiona ja niitä on satunnaisesti havaittu Zoladexia saavilla potilailla. Muutokset ovat yleensä ohimeneviä ja ne palautuvat joko hoidon jatkuessa tai Zoladexin käytön lopettamisen jälkeen. Nämä muutokset ovat harvoin vaatineet lääkinnällisiä toimenpiteitä, kuten Zoladex-hoidon lopettamista |
| d | Nämä oireet ovat yleensä lieviä ja ne palautuvat usein normaaliksi ilman hoidon lopettamista |
| e | Eturauhassyöpäpotilaat saattavat aluksi havaita ohimenevää lisääntynyttä luukipua, jota voidaan hoitaa oireenmukaisesti |
| f | Havaittu eturauhassyövän hoidossa käytettyjen LHRH-agonistien farmakoepidemiologisessa tutkimuksessa. Riski näyttää kasvavan yhteiskäytössä anti-androgeenien kanssa |
| g | Hiusten lähtöä on raportoitu naisilla, mukaan lukien nuoremmat potilaat, joiden hyvänlaatuista sairautta on hoidettu. Hiusten lähtö on usein vähäistä (lievää), mutta joskus runsasta (vaikeaa) |
| h | Erityisesti ihokarvojen lähtö, joka on odotettu vaikutus androgeenin määrän alenemisesta |
| i | Akne esiintyi useimmissa tapauksissa kuukauden sisällä Zoladex-hoidon aloittamisesta |
Markkinoille tulon jälkeinen seuranta
Verenkuvan muutoksia, maksan vajaatoimintaa, keuhkoemboliaa ja interstitiaalipneumoniaa on raportoitu harvoissa tapauksissa Zoladexin käytön yhteydessä.
Myös seuraavia haittavaikutuksia on raportoitu naispotilailla, jotka saavat Zoladexia hyvänlaatuisten gynekologisten sairauksien hoitoon:
Akne, ihokarvoituksessa ilmenevät muutokset, kuiva iho, painon nousu, seerumin kolesteroliarvojen nousu, munasarjojen hyperstimulaatio-oireyhtymä (jos valmistetta käytetään samanaikaisesti gonadotropiinien kanssa), emätintulehdus, emätinvuoto, hermostuneisuus, unihäiriöt, väsymys, perifeerinen edeema, lihaskivut, pohkeiden lihaskouristukset, pahoinvointi, oksentelu, ripuli, ummetus, vatsavaivat, äänen muutokset.
Rintasyöpäpotilaat saattavat aluksi havaita ohimenevää kasvainkipua, mutta niitä voidaan hoitaa oireenmukaisesti.
Joillekin rintasyöpäpotilaille, joilla on etäpesäkkeitä, on harvoin kehittynyt hyperkalsemia hoidon alussa. Jos potilaalla esiintyy hyperkalsemiaan viittaavia oireita (esim. janoa), hyperkalsemian olemassaolo on poissuljettava.
Joillakin harvoilla naispotilailla vaihdevuodet saattavat alkaa LHRH-analogihoidon aikana, eivätkä kuukautiset palaudu hoidon lopettamisen jälkeen. Sitä, onko tämä Zoladex-hoidon vaikutusta vai potilaan gynekologisen sairauden oire, ei tiedetä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea, Lääkkeiden haittavaikutusrekisteri, PL 55,
FI-00034 Fimea
Yliannostus
Yliannostuksesta ihmisillä ei ole paljon kokemusta. Tapauksissa, missä Zoladexia on annettu ennen suunniteltua annosteluajankohtaa tai joissa on annettu suunniteltua suurempi annos, ei ole havaittu kliinisesti merkittäviä haittavaikutuksia. Eläinkokeet viittaavat siihen, että suurten Zoladex-annosten yhteydessä ei esiinny muita kuin terapeuttisia vaikutuksia sukuhormonipitoisuuksiin ja sukuelimiin. Mahdollinen yliannostus tulee hoitaa oireenmukaisesti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Endokrinologiset lääkeaineet/Gonadotropiinia vapauttavan hormonin kaltaiset yhdisteet, ATC-koodi: L02AE03.
Zoladex (gosereliini) on synteettinen luonnollisen LHRH:n analogi. Pitkäaikaisessa käytössä Zoladex estää aivolisäkkeen LH-eritystä johtaen miehillä seerumin testosteronipitoisuuden ja naisilla seerumin estradiolipitoisuuden laskuun.
Aluksi Zoladex, kuten muutkin LHRH-agonistit, saattaa nostaa ohimenevästi seerumin testosteronipitoisuutta miehillä ja seerumin estradiolipitoisuutta naisilla. Zoladex-hoidon alkuvaiheessa joillain naisilla saattaa esiintyä kestoltaan ja voimakkuudeltaan vaihtelevaa verenvuotoa emättimestä. Tämä verenvuoto liittyy todennäköisesti estrogeenin vähenemiseen ja se todennäköisesti loppuu itsestään.
Miehillä testosteroniarvot ovat laskeneet kastraatiotasolle noin 21 vrk:ssa ensimmäisen implantaatin laiton jälkeen ja säilyvät kastraatiotasolla jatkuvassa hoidossa implantaattien ihon alle asettamisten välin ollessa 28 vrk. Tämä johtaa eturauhastuumorin regressioon ja symptomaattiseen paranemiseen valtaosalla potilaista.
Metastaattista eturauhassyöpää sairastavien potilaiden hoidossa Zoladexilla on saatu vertailevissa kliinisissä tutkimuksissa samanlaisia elinaikatuloksia kuin kirurgisilla kastraatioilla.
Vertailtaessa bikalutamidi 150 mg monoterapiaa kastraatioon (etupäässä Zoladexilla saavutettu) kahden satunnaistetun, kontrolloidun tutkimuksen yhdistetyssä analyysissä kokonaiselinajassa ei ollut merkittävää eroa paikallisesti edennyttä eturauhassyöpää sairastavien bikalutamidilla hoidettujen ja kastraatiolla hoidettujen potilaiden välillä [riskisuhde (HR) = 1,05; CI 0,81–1,36]. Tilastollisesti ei hoitojen samanarvoisuutta kuitenkaan voitu osoittaa.
Vertailevissa tutkimuksissa Zoladexin on osoitettu pidentävän tauditonta elinaikaa ja kokonaiselinaikaa, kun sitä käytetään liitännäishoitona sädehoidon lisäksi potilaille, joilla on paikallinen korkean riskin eturauhassyöpä (T1–T2 ja PSA vähintään 10 ng/ml tai Gleason-pistemäärä vähintään 7) tai paikallisesti edennyt (T3–T4) eturauhassyöpä. Liitännäishoidon optimaalista kestoa ei ole määritelty; vertailevassa tutkimuksessa on osoitettu, että kolmen vuoden Zoladex-liitännäishoito saa aikaan merkittävän pidennyksen elinaikaan verrattuna pelkkään sädehoitoon. Ennen sädehoitoa annetun Zoladex-neoadjuvanttihoidon on osoitettu pidentävän tauditonta elinaikaa potilailla, joilla on paikallinen korkean riskin eturauhassyöpä tai paikallisesti edennyt eturauhassyöpä.
Zoladex-liitännäishoito voi pidentää tauditonta elinaikaa prostatektomian jälkeen potilailla, joilla on todettu eturauhasen ulkopuolelle levinneitä kasvaimia. Elinajan pidennys ei kuitenkaan ole merkitsevä, jos potilailla ei ole leikkauksen aikaan havaittu löydöksiä imusolmukkeissa. Potilailla, joilla on patologisesti määritelty paikallisesti edennyt sairaus, pitäisi olla muita riskitekijöitä, kuten PSA-pitoisuus vähintään 10 ng/ml tai Gleason-pistemäärä vähintään 7, ennen kuin Zoladex-liitännäishoitoa tulisi harkita. Ennen radikaalia prostatektomiaa käytetyn Zoladex-neoadjuvanttihoidon aikaan saamista paremmista kliinisistä tuloksista ei ole näyttöä.
Naisilla seerumin estradioliarvot laskevat noin 21 vrk:ssa ensimmäisen implantaatin laiton jälkeen, ja kun hoitoa jatketaan implantaattien ihon alle asettamisten välin ollessa 28 vrk, pysyvät tasolla, joka vastaa postmenopaussia. Tätä suppressiota seuraa kohdun limakalvon oheneminen, follikkelin kehityksen estyminen munasarjoissa ja vaste hormoniriippuvaisessa rintasyövässä (ER-positiivisissa ja/tai PR-positiivisissa kasvaimissa), endometrioosissa ja kohdun myoomissa ja se saa aikaan amenorrean suurimmalle osalle potilaista.
LHRH-analogihoidon aikana joillakin naisilla saattaa alkaa luonnollinen menopaussi.
On kuitenkin harvinaista, että kuukautiset eivät käynnisty hoidon loputtua.
Farmakokinetiikka
Zoladexin biologinen hyötyosuus on lähes täydellinen. Implantaatin laitto ihon alle joka neljäs viikko varmistaa tehokkaan lääkepitoisuuden ilman kudosakkumulaatiota. Zoladex sitoutuu vähäisesti proteiiniin ja sen eliminaation puoliintumisaika seerumissa on 2-4 tuntia potilailla, joilla on normaali munuaisfunktio. Puoliintumisaika on pitempi munuaisten vajaatoimintaa sairastavilla. Valmisteella, joka implantoidaan ihon alle pitkävaikutteisessa muodossa kuukausittain, eliminaation puoliintumisajan pitenemisellä ei juuri ole vaikutusta. Tästä johtuen annoksen sovittaminen ei ole tarpeen munuaisten vajaatoimintaa sairastaville.
Maksasairautta sairastavien potilaiden farmakokinetiikassa ei ole merkitsevää muutosta.
Prekliiniset tiedot turvallisuudesta
Pitkäaikaisen, toistuvan Zoladexin annon yhteydessä on urosrotilla havaittu hyvänlaatuisten aivolisäkekasvainten esiintyvyyden lisääntyvän. Tämä havainto on tehty aikaisemminkin rotilla kirurgisen kastraation jälkeen, mutta ihmisellä ei vastaavaa ole voitu osoittaa.
Hiirillä pitkäaikaiset, toistuvat annokset, jotka ovat olleet moninkertaisia ihmisille käytettyihin nähden, ovat aiheuttaneet histologisia muutoksia ruoansulatuskanavassa manifestoituen haiman saarekkeen solujen hyperplasiana ja mahaportin alueen hyvänlaatuisena, proliferatiivisena tilana, jota jälkimmäistä on raportoitu hiirellä spontaanina muutoksena. Näiden löydösten kliininen merkitys on epäselvä.
Farmaseuttiset tiedot
Apuaineet
Laktidi/glykolidi-kopolymeeri (suuri- ja pienimolekyylipainoisten kopolymeerien seos).
Yhteensopimattomuudet
Ei tunneta.
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 25 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ZOLADEX implantaatti
3,6 mg (L:ei) 1 kpl (136,43 €)
PF-selosteen tieto
1 x 3,6 mg implantaatti käyttövalmiissa ruiskussa, umpinaisessa pussissa, jossa on mukana kuivatusaine.
Valmisteen kuvaus:
Steriili, valkeahko noin 1 cm pitkä ja 1,2 mm paksu sauva käyttövalmiissa ruiskussa.
Käyttö- ja käsittelyohjeet
Käytetään lääkärin ohjeiden mukaan.
Käytetään vain, jos foliopakkaus on vahingoittumaton. Käytetään heti, kun foliopakkaus on avattu.
Varovaisuutta on noudatettava injisoitaessa Zoladex-implantaatti vatsan etuseinämään sillä sen läheisyydessä ovat alempi vatsanseinämävaltimo ja sen haarautumat. On oltava erittäin varovainen annettaessa Zoladexia potilaille, joilla on alhainen BMI ja/tai jotka saavat täysimääräistä veren hyytymisenestohoitoa.
Zoladex-ruiskulla ei voi aspiroida. Jos sen hypoterminen neula lävistää suuren verisuonen, verta tulee näkymään välittömästi ruiskun kammiossa. Jos verisuoni on lävistetty, on neula vedettävä ulos välittömästi ja seurauksena oleva verenvuoto on heti kontrolloitava. Potilasta on tarkkailtava vatsan verenvuodon oireiden tai löydösten havaitsemiseksi. Kun on varmistettu, että potilas on hemodynaamisesti stabiili, voidaan Zoladex-implantaatti injisoida uudella ruiskulla toiseen paikkaan.
Ruiskun käyttöohjeet
1. Potilaan tulee asettua makuuasentoon ylävartalo hieman koholla. Desinfioi injektiokohta navan alapuolella
2. Tarkista ettei foliopakkaus tai ruisku ole vaurioitunut. Avaa foliopakkaus ja pidä ruiskua hieman yläviistoon valoa vasten tarkistaaksesi, että implantaatti näkyy (kuva 1).
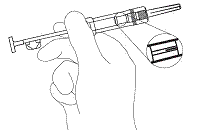
kuva 1
3. Tartu punaiseen varmistimeen ja poista se (kuva 2). Toisin kuin injektionesteitä käsiteltäessä, ilmakuplia ei ole tarpeen poistaa. Ilmakuplien poistoyritys voi siirtää implantaattia.
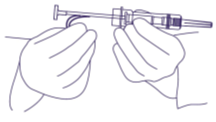
kuva 2
4. Poista neulan suojus. Pidä kiinni ruiskusta sormet suojahylsyn ympärillä, ota löyhästi kiinni ihosta noudattaen aseptista tekniikkaa ja pistä neula ihopoimuun pienessä kulmassa (30-45 astetta) ihoon nähden, eli lähes ihon suuntaisesti. Paina implantaatti vatsanahan ylimmäisen ihokudoksen alle navan alapuolella, kunnes suojahylsy koskettaa potilaan ihoa (kuva 3).
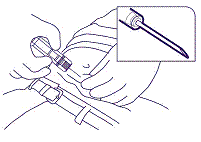
kuva 3
5. Älä työnnä neulaa lihakseen äläkä vatsakalvon läpi. Virheellinen ote ja asento on esitetty kuvassa 4.
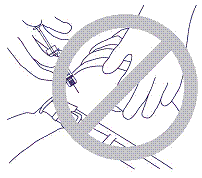
kuva 4
6. Injisoi implantaatti ja aktivoi suojahylsy painamalla mäntä kokonaan ruiskun sisään niin, että mäntä ei enää liiku pidemmälle. Saatat kuulla napsahduksen ja suojahylsy alkaa automaattisesti liukua peittämään neulaa. Jos mäntää ei ole painettu loppuun asti, suojahylsy ei aktivoidu.
7. Pidä neulaa kuten kuvassa 5 näytetään ja vedä neula ulos. Anna suojahylsyn liukua ja peittää neula kokonaan. Laita ruisku teräville esineille tarkoitettuun ongelmajäteastiaan.
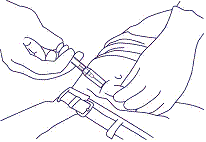
kuva 5
Korvattavuus
ZOLADEX implantaatti
3,6 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Rintasyöpä (115), Eturauhassyöpä (116).
- Peruskorvaus (40 %).
ATC-koodi
L02AE03
Valmisteyhteenvedon muuttamispäivämäärä
21.04.2023
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
