VISTABEL injektiokuiva-aine, liuosta varten 4 Allergan-yksikköä/0,1ml
Vaikuttavat aineet ja niiden määrät
Tyypin A botuliinitoksiini1 4 Allergan-yksikköä/0,1 ml käyttövalmiiksi saatettua liuosta.
1 peräisin Clostridium botulinum -bakteerista
Allergan-yksiköitä ei voi soveltaa muihin botuliinitoksiinivalmisteisiin.
50 yksikön injektiopullo.
100 yksikön injektiopullo.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Vistabel on tarkoitettu käytettäväksi tilapäisesti silottamaan
- kohtalaisia tai syviä pystysuoria ryppyjä, joita syntyy kulmakarvojen väliin otsaa voimakkaasti rypistettäessä (glabellaariuurteet), ja/tai
- kohtalaisia tai syviä leveimmän hymyn aiheuttamia silmäkulman sivun juonteita (naururypyt) ja/tai
- kohtalaisia tai syviä otsaryppyjä, joita syntyy kulmakarvoja voimakkaasti kohotettaessa
tapauksissa, joissa kasvoissa esiintyvien ryppyjen ja juonteiden vakavuudella on huomattava psykologinen vaikutus aikuispotilaaseen.
Annostus ja antotapa
Annostus
Ks. alla annetut käyttöaihekohtaiset suositukset.
Botuliinitoksiiniyksiköt ovat valmistekohtaisia ja annosten vastaavuus ei ole sama eri valmisteilla.
Allergan-yksikköinä mainitut suositusannokset ovat eri botuliinitoksiinivalmisteilla erilaiset.
Iäkkäät potilaat
Kliinistä kolmannen vaiheen tietoa Vistabel-valmisteesta on niukasti yli 65-vuotiaiden potilaiden osalta (ks. kohta Farmakodynamiikka).
Iäkkäiden hoitoon ei tarvita erityisiä annosmuutoksia.
Pediatriset potilaat
Vistabel-valmisteen turvallisuutta ja tehoa otsan voimakkaan rypistyksen seurauksena syntyvien glabellaariuurteiden, leveimmän hymyn aiheuttamien naururyppyjen tai kulmakarvojen voimakkaan kohotuksen seurauksena syntyvien otsaryppyjen hoidossa alle 18-vuotiailla ei ole osoitettu. Vistabel-valmisteen käyttöä ei suositella alle 18-vuotiailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antotapa
Vistabel-hoitoa saavat antaa vain lääkärit, joilla on tähän hoitoon ja tarvittavien välineiden käyttöön vaadittava pätevyys ja perehtyneisyys.
Käyttövalmiiksi saatettu Vistabel-liuos tulee käyttää vain yhdellä injektion/injektioiden antokerralla vain yhdelle potilaalle. Käyttämätön ylijäänyt valmiste tulee hävittää kohdassa Käyttö- ja käsittelyohjeet mainitulla tavalla. Liuoksen valmistuksessa ja annossa sekä käyttämättömän liuoksen tehottomaksi tekemisessä ja hävittämisessä on noudatettava erityistä varovaisuutta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Käyttö- ja käsittelyohjeet).
Suositeltava injektiomäärä yhteen lihaskohteeseen on 0,1 ml. Katso myös kohdan Käyttö- ja käsittelyohjeet laimennustaulukkoa.
Käyttöohjeet, injektiopullojen käsittely- ja hävittämisohjeet on esitetty kohdassa Käyttö- ja käsittelyohjeet.
Varo pistämästä Vistabel-liuosta verisuoneen, kun injektio annetaan otsan voimakkaan rypistyksen seurauksena syntyviin kulmakarvojen välisiin pystysuoriin uurteisiin (glabellaariuurteet), lateraalisiin leveimmän hymyn aiheuttamiin silmäkulman sivun juonteisiin (naururypyt) tai kulmakarvojen voimakkaan kohotuksen seurauksena syntyviin otsaryppyihin, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Hoitokertojen välin täytyy olla vähintään kolme kuukautta.
Anto-ohjeet otsan voimakkaan rypistyksen seurauksena syntyvien glabellaariuurteiden hoidossa:
Käyttövalmiiksi saatettu Vistabel-liuos (50 yksikköä/1,25 ml tai 100 yksikköä/2,5 ml) pistetään steriilillä 30 g:n neulalla. 0,1 ml (4 yksikköä) annetaan jokaiseen viiteen injektiokohtaan (ks. kuva 1): 2 injektiota kumpaankin corrugator-lihakseen ja 1 injektio procerus-lihakseen 20 yksikön kokonaisannoksena.
Ekstravasaation ehkäisemiseksi peukalo tai etusormi on asetettava lujasti silmäkuopan reunan alapuolelle ennen injektion antamista. Neulan on oltava ylä- ja keskisuunnassa injektion aikana. Silmäluomen ptoosin riskin takia ei pidä ylittää 4 yksikön enimmäisannosta injektiokohtaa kohden eikä injektioiden kokonaismäärää. Tämän lisäksi on vältettävä antamasta injektiota yläluomen kohottajalihaksen (m. levator palpebrae superioris) läheisyyteen, erityisesti potilailla, joilla on suuret kulmakarvojen alasvetäjälihaskompleksit (depressor supercilii). Corrugator-lihakseen annetaan injektiot sen keskiosaan, vähintään 1 cm:n etäisyydelle kulmakarvojen kaaren yläpuolelle.
Kuva 1:
Yleensä kulmakarvojen välisten otsan voimakkaan rypistyksen seurauksena syntyvien glabellaariuurteiden syvyys vähenee viikon kuluessa hoidosta. Vaikutuksen on osoitettu jatkuvan jopa 4 kuukautta injektion jälkeen.
Anto-ohjeet leveimmän hymyn aiheuttamien naururyppyjen hoidossa:
Käyttövalmiiksi saatettu Vistabel-liuos (50 yksikköä/1,25 ml tai 100 yksikköä/2,5 ml) pistetään steriilillä 30 g:n neulalla. 0,1 ml (4 yksikköä) annetaan jokaiseen kolmeen injektiokohtaan molemminpuolisesti (yhteensä 6 injektiokohtaa) lateraaliseen orbicularis oculi -lihakseen 0,6 millilitran ja 24 yksikön kokonaisannoksena (12 yksikköä puolta kohti).
Silmäluomen ptoosin riskin ehkäisemiseksi ei pidä ylittää 4 yksikön enimmäisannosta injektiokohtaa kohden eikä injektioiden kokonaismäärää. Tämän lisäksi injektiot tulee antaa temporaalisesti suhteessa silmäkuopan reunaan, jolloin säilytetään turvallinen etäisyys silmäluomea nostavaan lihakseen.
Silmäkulman naururyppyihin annettavat injektiot tulee antaa neulan kärjen viistoreuna suunnattuna ylös ja poispäin silmästä. Ensimmäinen injektio (A) tulee antaa noin 1,5-2,0 cm temporaalisesti suhteessa lateraaliseen silmäkulmaan ja aivan temporaalisesti suhteessa silmäkuopan reunaan. Jos naururypyt muodostavan alueen uurteet ulottuvat lateraalisen silmäkulman ylä- ja alapuolelle, käytä kuvassa 2 kuvattuja injektiokohtia. Vaihtoehtoisesti, jos naururypyt muodostavan alueen uurteet ovat etupäässä lateraalisen silmäkulman alapuolella, käytä kuvassa 3 kuvattuja injektiokohtia.
| Kuva 2: | Kuva 3: |
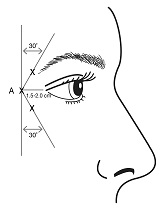 | 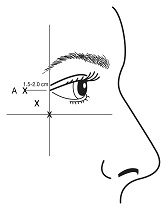 |
Samanaikaisten otsan voimakkaan rypistyksen seurauksena syntyvien glabellaariuurteiden ja leveimmän hymyn aiheuttamien naururyppyjen hoitoon pätee seuraava: 24 yksikköä naururyppyjen hoitoon ja 20 yksikköä glabellaariuurteiden hoitoon (ks. Anto-ohjeet glabellaariuurteiden hoidossa ja kuva 1) 1,1 millilitran ja 44 yksikön kokonaisannoksena.
Tutkijoiden arvioinnin mukaan leveimmän hymyn aiheuttamien naururyppyjen uurteiden syvyys pieneni viikon kuluessa hoidon saamisesta. Hoitovaikutus oli havaittavissa keskimäärin 4 kuukauden ajan injektiosta.
Anto-ohjeet kulmakarvojen voimakkaan kohotuksen seurauksena syntyvien otsaryppyjen hoidossa:
Käyttökuntoon saatettu Vistabel-liuos (50 yksikköä/1,25 ml tai 100 yksikköä/2,5 ml) pistetään steriilillä 30 G:n neulalla. Frontalis-lihaksen jokaiseen viiteen injektiokohtaan annetaan 0,1 ml (4 yksikköä) siten, että kokonaisannos on 20 yksikköä ja kokonaistilavuus on 0,5 ml (ks. kuva 4).
Kokonaisannos otsaryppyjen (20 yksikköä) ja glabellaariuurteiden (20 yksikköä) samanaikaiseen hoitoon on 40 yksikköä/1,0 ml.
Oikeiden injektiokohtien tunnistamiseksi frontalis-lihaksessa on arvioitava potilaan otsan koon ja frontalis-lihaksen aktiivisuuden jakautumisen välinen kokonaissuhde.
Seuraavat horisontaaliset hoitorivit on paikannettava kevyellä otsan palpoinnilla levossa sekä kulmakarvoja voimakkaasti kohotettaessa:
- frontalis-aktiivisuuden yläraja: noin 1 cm ylimmän otsarypyn yläpuolella
- alempi hoitorivi: frontalis-aktiivisuuden ylärajan ja kulmakarvan välisen etäisyyden keskivaiheilla, vähintään 2 cm kulmakarvan yläpuolella
- ylempi hoitorivi: frontalis-aktiivisuuden ylärajan ja alemman hoitorivin välisen etäisyyden keskivaiheilla.
Viisi injektiota on sijoitettava horisontaalisten hoitorivien risteyskohtaan seuraavien vertikaalisten anatomisten maamerkkien mukaisesti:
- alemmassa hoitorivissä kasvojen keskiviivan kohdalla ja 0,5–1,5 cm mediaalisesti suhteessa palpoituun temporaaliseen fuusiolinjaan (ohimoluun harjuun); toista sama toisen puolen osalta
- ylemmässä hoitorivissä alemman hoitorivin lateraalisten ja mediaalisten kohtien välisen etäisyyden keskivaiheilla; toista sama toisen puolen osalta.
Kuva 4:
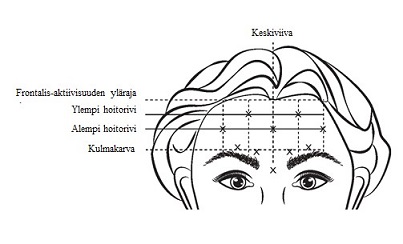
Kulmakarvojen voimakkaan kohotuksen seurauksena syntyvien otsaryppyjen syvyys pieneni viikon kuluessa hoidon saamisesta. Hoitovaikutus oli havaittavissa keskimäärin 4 kuukauden ajan injektiosta.
Glabellaariuurteiden ja naururyppyjen samanaikaisessa hoidossa kokonaisannos on 64 yksikköä. Se koostuu 20 yksiköstä otsaryppyjä varten, 20 yksiköstä glabellaariuurteita varten (ks. Anto-ohjeet glabellaariuurteiden hoidossa ja kuva 1) ja 24 yksiköstä naururyppyjä varten (ks. Anto-ohjeet leveimmän hymyn aiheuttamien naururyppyjen hoidossa sekä kuvat 2 ja 3).
Yleistä tietoa
Jos hoito epäonnistuu ensimmäisen hoitokerran jälkeen, toisin sanoen, jos kuukauden kuluessa injektion antamisesta ei ole tapahtunut merkittävää parantumista, on harkittava seuraavia toimenpiteitä:
- Epäonnistumisen syyn selvittäminen: esim. injektion kohteena olleiden lihasten virheellinen valinta, injektion antotekniikka, toksiinia neutraloivien vasta-aineiden muodostuminen, riittämätön annostus
- A-tyypin botuliinitoksiinin käytön hyödyn uudelleenarviointi.
Jos ensimmäisen hoitokerran jälkeen ei ilmene haittavaikutuksia, aloita toinen hoitokerta niin, että kahden hoitokerran väliin jää vähintään kolmen kuukauden väli.
Jos on annettu riittämätön annos otsan voimakkaan rypistyksen seurauksena syntyviä glabellaariuurteita hoidettaessa, aloita toinen hoitokerta sovittamalla annosta 40 tai 50 yksikön suuruiseksi kokonaisannokseksi ottaen huomioon edellisen hoitokerran epäonnistumisen syy.
Yli 12 kuukauden aikana annettujen toistuvien Vistabel-injektioiden tehoa ja turvallisuutta ei ole arvioitu.
Vasta-aiheet
Vistabel-valmistetta ei saa antaa potilaille, joilla on todettu:
- yliherkkyys A-tyypin botuliinitoksiinille tai jollekin valmisteen apuaineelle
- myasthenia gravis tai Eaton-Lambertin oireyhtymä
- infektio suunnitelluissa injektion antopaikoissa.
Varoitukset ja käyttöön liittyvät varotoimet
Tuotteen valmistelussa ja annossa on noudatettava erityisiä varotoimenpiteitä samoin kuin käyttämättömän ylijääneen liuoksen tehottomaksi tekemisessä ja hävittämisessä (ks. kohdat Annostus ja antotapa ja Käyttö- ja käsittelyohjeet).
Tämä lääkevalmiste sisältää natriumia alle 1 mmol (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Ennen Vistabel-injektion antoa on oltava selvillä kohteen anatomiasta ja mahdollisista anatomian muutoksista, jotka johtuvat aikaisemmista kirurgisista toimenpiteistä, ja injektiota vaurioitumiselle alttiille alueille tulee välttää.
Vistabel-valmisteen suositeltavaa annostusta ja antotiheyttä ei pidä ylittää.
Joissakin hyvin harvoissa tapauksissa voi botuliini-injektion jälkeen ilmetä anafylaktinen reaktio. Sen varalta tulee olla saatavilla adrenaliinia tai muita anafylaksian hoitoon tarvittavia välineitä.
Potilailla, joilla on havaitsematon neuromuskulaarisairaus, voi olla suurentunut vaara saada tavallisia A-tyypin botuliinitoksiinin annoksia käytettäessä kliinisesti merkittäviä haittavaikutuksia, kuten vaikeita nielemishäiriöitä ja hengityksen lamaantumista. Joissakin näistä tapauksista nielemishäiriöt ovat jatkuneet useita kuukausia ja vaatineet syöttöletkun käyttöä (ks. kohta Vasta-aiheet).
Vistabel-valmisteen käytössä on oltava varovainen myös, jos sitä käytetään potilaille, jotka sairastavat amyotrofista lateraaliskleroosia tai joilla on perifeerisiä neuromuskulaarisia sairauksia.
Botuliinitoksiini-injektion yhteydessä on hyvin harvoin raportoitu haittavaikutuksia, jotka ovat johtuneet toksiinin leviämisestä antopaikan ulkopuolelle (ks. kohta Haittavaikutukset). Hoitoannoksia saavilla potilailla voi ilmetä liiallista lihasheikkoutta. Nielemis- ja hengitysvaikeudet voivat olla vakavia ja kuolemaan johtavia. Vistabel-injektion antaminen potilaille, joilla on ollut nielemisvaikeuksia ja aspiraatiota, ei ole suositeltavaa.
Potilaita tai hänen hoitajiaan tulee neuvoa hakeutumaan välittömästi lääkärin hoitoon nielemis-, puhe- tai hengityshäiriöiden ilmetessä.
Liian tiheä tai liiallinen annostus voi aiheuttaa vasta-aineiden muodostumisen riskin. Neutraloivien vasta-aineiden muodostuminen voi tehdä A-tyypin botuliinitoksiinihoidon tehottomaksi myös muiden käyttöaiheiden osalta.
Kuten on odotettavissa kaikkien injektioiden kohdalla, injektion yhteydessä on esiintynyt paikallista kipua, tulehdusta, tuntohäiriöitä, hypestesiaa, arkuutta, turvotusta, punoitusta, paikallisia infektioita, verenvuotoa ja/tai mustelmia. Neulanpiston aiheuttama kipu ja/tai pelko ovat aiheuttaneet vasovagaalisia reaktioita, mukaan lukien ohimenevää verenpaineen alenemista ja pyörtymistä.
Vistabel-valmisteen käytössä on oltava varovainen, jos suunnitellussa injektiokohdassa (-kohdissa) on todettu tulehdus, tai kun kohteena oleva lihas on hyvin heikko tai surkastunut.
On varmistuttava huolella siitä, että Vistabel-valmistetta ei injektoida verisuoneen, kun injektio annetaan glabellaariuurteisiin, joita syntyy kulmakarvojen väliin otsaa voimakkaasti rypistettäessä, leveimmän hymyn aiheuttamiin naururyppyihin tai kulmakarvojen voimakkaan kohotuksen seurauksena syntyviin otsaryppyihin, ks. kohta Annostus ja antotapa.
Hoidon jälkeinen silmäluomen ptoosin riski on olemassa; ks. tätä riskiä pienentävät anto-ohjeet kohdasta Annostus ja antotapa.
Vistabel-valmisteen käyttö ei ole suositeltavaa alle 18-vuotiailla. Yli 65-vuotiailla suoritetuista faasin III Vistabel-tutkimuksista on saatu vain rajoitetusti kliinisiä tietoja.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Botuliinitoksiinin vaikutus voi teoriassa voimistua aminoglykosidiantibioottien tai spektinomysiinin tai muiden hermo-lihastransmissiota estävien lääkeaineiden (esim. hermo-lihasliitosta salpaavien lihasrelaksanttien) vaikutuksesta.
Botuliinitoksiinin eri serotyyppien samanaikaisen tai useiden kuukausien aikana tapahtuvan annon vaikutusta toisiinsa ei tunneta. Jos annetaan toista botuliinitoksiinia ennen kuin edellisen botuliinitoksiinin vaikutus on kadonnut, seurauksena voi olla liian voimakas neuromuskulaarinen heikkous.
Mahdollista yhteisvaikutusta muiden lääkeaineiden kanssa ei ole erityisesti tutkittu. Muita kliinisesti tärkeitä yhteisvaikutuksia ei ole raportoitu tämän käyttöaiheen osalta.
Raskaus ja imetys
Raskaus
A-tyypin botuliinitoksiinin käytöstä raskauden aikana ei ole riittävästi tietoa. Eläinkokeissa on havaittu lisääntymistoksisuutta (katso kohta Prekliiniset tiedot turvallisuudesta). Mahdollista ihmiseen kohdistuvaa riskiä ei tunneta. Vistabel-valmistetta ei suositella raskauden aikana, tai hedelmällisessä iässä olevilla naisilla, jotka eivät käytä ehkäisyä.
Imetys
Ei ole tiedossa, erittyykö Vistabel äidinmaitoon. Vistabelin käyttö imetyksen aikana ei ole suositeltavaa.
Hedelmällisyys
A-tyypin botuliinitoksiinin vaikutuksista fertiilissä iässä olevien naisten hedelmällisyyteen ei ole riittävästi tietoa. Uros- ja naarasrotilla on todettu hedelmällisyyden alenemista (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia vaikutuksista ajokykyyn ja koneidenkäyttökykyyn ei ole tehty. Vistabel voi kuitenkin aiheuttaa heikkoutta, lihasheikkoutta, heitehuimausta ja näköhäiriöitä, jotka voivat vaikuttaa autolla ajoon ja koneiden käyttöön.
Haittavaikutukset
a) Yleistä
Kontrolloiduissa, otsan voimakkaan rypistyksen seurauksena syntyviä glabellaariuurteita arvioivissa kliinisissä tutkimuksissa ilmoitettiin 23,5 %:lla potilaista (plasebo: 19,2 %) haittavaikutuksia, joiden tutkijat arvioivat liittyvän VISTABEL-hoitoon. Leveimmän hymyn aiheuttamia naururyppyjä arvioivien kontrolloitujen avaintutkimusten hoitosyklissä 1 näitä haittavaikutuksia ilmoitettiin 7,6 prosentilla potilaista (24 yksikköä naururyppyihin) ja 6,2 prosentilla potilaista (44 yksikköä: samanaikaisesti 24 yksikköä naururyppyihin ja 20 yksikköä glabellaariuurteisiin) verrattuna lumelääkkeeseen (4,5 %).
Kulmakarvojen voimakkaan kohotuksen seurauksena syntyviä otsaryppyjä arvioivien kliinisten tutkimusten hoitosyklissä 1 ilmoitettiin haittavaikutuksia, joiden tutkijat arvioivat liittyvän VISTABEL-hoitoon, 20,6 %:lla potilaista, joita hoidettiin 40 yksiköllä (20 yksikköä frontalis-lihakseen ja 20 yksikköä glabellaarikompleksiin), ja 14,3 %:lla potilaista, joita hoidettiin 64 yksiköllä (20 yksikköä frontalis-lihakseen, 20 yksikköä glabellaarikompleksiin ja 24 yksikköä silmäkulman sivun juonteisiin). Lumelääkettä käytettäessä haittavaikutuksia ilmoitettiin 8,9 %:lla potilaista.
Haittavaikutukset voivat liittyä hoitoon, injektiotekniikkaan tai molempiin. Yleensä haittavaikutukset ilmenevät injektion antoa seuraavina päivinä ja ovat ohimeneviä. Useimmat raportoidut haitat ovat olleet lieviä tai kohtalaisia.
Botuliinitoksiinin oletettava farmakologinen vaikutus on paikallinen lihasheikkous. Viereisten lihasten ja/tai kauempana injektiokohdasta sijaitsevien lihasten heikkoutta on kuitenkin raportoitu. Blefaroptoosi, joka saattaa liittyä injisointitekniikkaan, vastaa VISTABEL-valmisteen farmakologista vaikutusta. Kuten kaikki injektiot, valmisteinjektio voi aiheuttaa kipua/kirvelyä/pistelyä, turvotusta ja/tai mustelmia. Myös kuumetta ja flunssan oireita on ilmoitettu botuliinitoksiini-injektioiden jälkeen.
b) Haittavaikutukset - ilmaantuvuus
Haittavaikutukset on luokiteltu elinjärjestelmän ja yleisyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000).
Glabellaariuurteet
Seuraavista haittavaikutuksista ilmoitettiin kaksoissokkoutettujen, lumelääkekontrolloitujen kliinisten tutkimusten yhteydessä 20 yksikön VISTABEL-injektion saaneilla (vain glabellaariuurteiden hoito):
Elinjärjestelmä | Preferred Term ‑termi | Esiintyvyys |
Infektiot | Infektio | Melko harvinainen |
Psyykkiset häiriöt | Ahdistuneisuus | Melko harvinainen |
Hermosto | Päänsärky, parestesiat | Yleinen |
Heitehuimaus | Melko harvinainen | |
Silmät | Silmäluomen ptoosi | Yleinen |
Luomitulehdus, silmäkipu, näköhäiriö (myös näön hämärtyminen) | Melko harvinainen | |
Ruoansulatuselimistö | Pahoinvointi | Yleinen |
Suun kuivuminen | Melko harvinainen | |
Iho ja ihonalainen kudos | Eryteema, ihon kireys | Yleinen |
Turvotus (kasvojen, silmäluomien, silmänympärystän), valoherkkyys, kutina, kuiva iho | Melko harvinainen | |
Luusto, lihakset ja sidekudos | Paikallinen lihasheikkous | Yleinen |
Lihasten nykiminen, Mefiston merkki (kulmakarvojen lateraalinen kohoaminen) | Melko harvinainen | |
Yleisoireet ja antopaikassa todettavat haitat | Kasvokipu, injektiokohdan turvotus, mustelmat, injektiokohdan kipu, injektiokohdan ärsytys | Yleinen |
Flunssan kaltaiset oireet, heikkous, kuume | Melko harvinainen |
Naururypyt ilman glabellaariuurteita tai niiden kanssa
Seuraavista haittavaikutuksista ilmoitettiin kaksoissokkoutettujen, lumelääkekontrolloitujen kliinisten tutkimusten yhteydessä VISTABEL-injektion saaneilla (naururyppyjen hoito ilman glabellaariuurteita tai niiden kanssa):
Elinjärjestelmä | Preferred term -termi | Esiintyvyys |
Silmät | Silmäluomen turvotus | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan hematooma* | Yleinen |
Injektiokohdan verenvuoto* | Melko harvinainen | |
Injektiokohdan kipu* | Melko harvinainen | |
Injektiokohdan parestesiat* | Melko harvinainen |
*toimenpiteestä johtuvat haittavaikutukset
Otsarypyt ja glabellaariuurteet ilman naururyppyjä tai niiden kanssa
Seuraavista haittavaikutuksista ilmoitettiin kaksoissokkoutettujen, lumelääkekontrolloitujen kliinisten tutkimusten yhteydessä VISTABEL-injektion saaneilla (samanaikainen otsaryppyjen ja glabellaariuurteiden hoito ilman naururyppyjä tai niiden kanssa):
Elinjärjestelmä | Preferred term -termi | Esiintyvyys |
Hermosto | Päänsärky | Yleinen |
Silmät | Silmäluomen ptoosi1 | Yleinen |
Iho ja ihonalainen kudos | Ihon kireys | Yleinen |
Kulmakarvojen ptoosi2 | Yleinen | |
Luusto, lihakset ja sidekudos | Mefiston merkki (kulmakarvojen lateraalinen kohoaminen) | Yleinen |
Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan mustelma* | Yleinen |
Injektiokohdan hematooma* | Yleinen | |
Injektiokohdan kipu* | Melko harvinainen |
1Ajan mediaani silmäluomen ptoosin ilmenemiseen oli 9 vuorokautta hoidon jälkeen
2Ajan mediaani kulmakarvojen ptoosin ilmenemiseen oli 5 vuorokautta hoidon jälkeen
*toimenpiteestä johtuvat haittavaikutukset
Toistuvat annokset eivät muuttaneet turvallisuusprofiilia.
c) Myyntiintulon jälkeiset tiedot (ilmaantuvuus tuntematon)
Seuraavia haittavaikutuksia tai lääketieteellisesti relevantteja haittatapahtumia on raportoitu kulmakarvojen välisiä pystysuoria uurteita ja naururyppyjä hoidettaessa sekä muilla käyttöaiheilla joissakin harvoissa tapauksissa lääkkeen tultua myyntiin:
Elinjärjestelmä | Preferred Term ‑termi |
Immuunijärjestelmä | Anafylaksia, angioödeema, seerumitauti ja urtikaria |
Aineenvaihdunta ja ravitsemus | Anoreksia |
Hermosto | Brakiaalinen pleksopatia, dysfonia, dysartria, kasvohermohalvaus, hypestesia, lihasheikkous, myasthenia gravis, perifeerinen neuropatia, parestesiat, radikulopatia, pyörtyminen ja kasvohalvaus |
Silmät | Ahdaskulmaglaukooma (blefarospasmin hoitoon), silmäluomen ptoosi, avoluomi, karsastus, näön hämärtyminen, näköhäiriöt, kuivat silmät; silmäluomen turvotus |
Kuulo ja tasapainoelin | Huonokuuloisuus, tinnitus ja huimaus |
Hengityselimet, rintakehä ja välikarsina | Aspiraatiopneumonia, hengenahdistus, keuhkoputkien supistelu, hengityslama ja hengitysvajaus |
Ruoansulatuselimistö | Vatsakipu, ripuli, suun kuivuminen, nielemisvaikeudet, pahoinvointi ja oksentelu |
Iho ja ihonalainen kudos | Hiustenlähtö, kulmakarvojen ptoosi, psoriaasin kaltainen ihottuma, erythema multiforme, liikahikoilu, silmäripsien menetys, pruritus ja ihottuma |
Luusto, lihakset ja sidekudos | Lihasten surkastuminen ja lihaskipu, paikalliset lihasnykäykset/tahattoman lihassupistelut |
Yleisoireet ja antopaikassa todettavat haitat | Denervaatioatrofia, huonovointisuus ja kuume |
Antokohdasta kauas levinneeseen toksiiniin mahdollisesti liittyviä haittavaikutuksia on hyvin harvoin raportoitu botuliinitoksiiniin liittyen (esim. lihasheikkous, nielemishäiriö, ummetus tai aspiraatiokeuhkokuume, joka voi olla fataali) (katso osa 4.4).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Vistabelin yliannostus on suhteellinen käsite ja riippuu annoksesta, injektiokohdasta ja kyseessä olevan kudoksen ominaisuuksista. Epähuomiossa annetun A-tyypin botuliiniruiskeen ei ole havaittu aiheuttaneen systeemistä toksisuutta. Liian suuret annokset voivat tuottaa paikallisia tai kaukana antopaikasta olevia, yleistyneitä ja voimakkaita neuromuskulaarisen halvauksen oireita. A-tyypin botuliinin nielemistapauksia ei ole raportoitu.
Yliannostuksen merkit eivät näy heti injektion antamisen jälkeen. Jos injektio annetaan vahingossa tai valmistetta niellään, potilaan tulee olla lääkärin tarkkailussa useita päiviä yleisen heikkouden tai lihashalvauksen merkkien ja oireiden varalta.
Sairaalahoitoa on harkittava, jos potilaalla on A-tyypin botuliinimyrkytyksen oireita (yleinen heikkous, ptoosi, diplopia, nielemis- ja puhehäiriöitä tai hengityslihasten halvaus).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Lihasrelaksantit, perifeerisesti vaikuttavat lihasrelaksantit.
ATC-koodi: M03AX01.
A-tyypin botuliini (Clostridium botulinum -neurotoksiini) estää perifeerisen asetyylikoliinin vapautumisen presynaptisissa kolinergisissä hermopäätteissä halkaisemalla SNAP-25-proteiinin, joka on olennainen asetyylikoliinin menestykselliselle kiinnittymiselle ja vapautumiselle hermopäätteiden vesikkeleistä. Tämä johtaa lihaksen denervaatioon ja siten halvaantumiseen.
Injektion jälkeen toksiini sitoutuu nopeasti suurella affiniteetilla solupinnan spesifisiin reseptoreihin. Sitten toksiini siirtyy solukalvon läpi reseptorivälitteisen endosytoosin avulla. Lopulta toksiini vapautuu sytosoliin, mikä johtaa progressiiviseen asetyylikoliinin vapautumisen estymiseen. Kliiniset merkit ilmenevät 2–3 päivän kuluessa, ja suurin vaikutus näkyy 5−6 viikon kuluessa injektion antamisesta.
Toipuminen i.m.-injektiosta tapahtuu yleensä 12 viikon kuluessa, kun hermopäätteet toipuvat ja kytkeytyvät uudelleen päätelevyihin.
Kliiniset tiedot:
Glabellaariuurteet
537 potilasta, joilla oli kohtalaisia tai syviä otsan voimakkaan rypistyksen seurauksena syntyviä glabellaariuurteita, on otettu mukaan kliinisiin tutkimuksiin.
Vistabel-hoito vähensi huomattavasti glabellaariuurteiden syvyyttä jopa 4 kuukauden ajan. Tuloksen totesivat tutkija potilaan rypistäessä otsaansa maksimiin ja potilas, joka arvioi kokonaisuudessaan oman ulkonäkönsä muuttumista otsan voimakkaan rypistyksen seurauksena syntyvien glabellaariuurteiden osalta. Kliinisiin arviointeihin ei sisältynyt psykologisen vaikutuksen objektiivista arviointia. Tutkijat totesivat 30 päivää injektion jälkeen 80 %:lla (325/405) Vistabel-injektiolla hoidetuista potilaista hyvän hoitovasteen (ei yhtään tai vain lievää uurteiden syvyyttä, kun otsa rypistettiin maksimiin), kun vastaava luku oli 3 % (4/132) plaseboa saaneilla potilailla. Samaan aikaan 89 % (362/405) Vistabel-injektion saaneista potilaista oli sitä mieltä, että heidän uurteensa olivat madaltuneet kohtalaisesti tai kohtalaista paremmin, kun vastaava luku oli 7 % (9/132) plaseboa saaneilla potilailla.
Vistabel-hoito vähensi myös merkittävästi glabellaariuurteiden syvyyttä levossa. 537:stä tutkimuksen potilaasta 39 %:lla (210/537) oli kohtalaisia tai syviä glabellaariuurteita levossa (15 %:lla ei ollut uurteita lainkaan levossa). Vistabel-valmistetta saaneista tämän ryhmän potilaista pidettiin 74 % (119/161) hoitoon hyvin reagoivina (ei lainkaan tai vain matalia uurteita) kolmekymmentä päivää injektion jälkeen, kun vastaava luku oli 20 % (10/49) plaseboa saaneilla potilailla.
Yli 65-vuotiaiden Vistabel-valmistetta saaneiden potilaiden osalta kolmannen vaiheen kliinistä tutkimustietoa on vain vähän. Vain 6,0 % (32/537) koehenkilöistä oli yli 65-vuotiaita, ja hoidon teho oli vähäisempää tässä ikäryhmässä.
Naururypyt
Tutkimukseen otettiin mukaan 1362 potilasta, joilla oli kohtalaisia tai syviä leveimmän hymyn aiheuttamia naururyppyjä (N = 445, tutkimus 191622-098) tai joilla oli myös kohtalaisia tai syviä otsan voimakkaan rypistyksen seurauksena syntyneitä glabellaariuurteita (N = 917, tutkimus 191622-099).
Vistabel-hoito vähensi huomattavasti leveimmän hymyn aiheuttamien naururyppyjen syvyyttä lumelääkkeeseen verrattuna kaikkina ajankohtina (p < 0,001) jopa 5 kuukauden ajan. Tämä mitattiin niiden potilaiden osuutena, joiden leveimmän hymyn aiheuttamien naururyppyjen vakavuustason arvioksi annettiin ”ei vakava” tai ”lievä” molemmissa avaintutkimuksissa; päivään 150 asti (tutkimuksen loppu) tutkimuksessa 191622-098 ja päivään 120 asti (ensimmäisen hoitosyklin loppu) tutkimuksessa 191622-099. Sekä tutkijan että potilaan antamissa arvioissa leveimmän hymyn aiheuttamien naururyppyjen arvio ”ei vakava” tai ”lievä” saavutettiin potilailla, joiden lähtötason leveimmän hymyn aiheuttamat naururypyt olivat kohtalaisia verrattuina potilaisiin, joiden leveimmän hymyn aiheuttamat naururypyt olivat syviä.
Taulukossa 1 esitetään tulokset yhteenvedon muodossa päivältä 30, joka on ajankohta ensisijaiselle tehokkuuspäätetapahtumalle.
Tutkimukseen 191622-104 (jatkotutkimus tutkimukselle 191622-099) otettiin 101 potilasta, jotka oli aikaisemmin satunnaistettu saamaan lumelääkettä. Potilaiden saama ensimmäinen hoitoannos oli 44 yksikköä. Vistabel-valmisteella hoidetuilla, ensimmäisen aktiivisen hoidon saaneilla potilailla havaittiin tilastollisesti merkittävä hoitoetu verrattuna lumelääkkeeseen päivän 30 ensisijaisen tehokkuuspäätetapahtuman kohdalla. Hoitovaste oli samankaltainen kuin tutkimuksessa 191622-099 nähty ensimmäisen 44 yksikön kokonaisannoksen antama vaste. Kaikkiaan 123 potilasta sai 44 yksikköä Vistabelia 4 hoitosyklin aikana naururyppyjen ja glabellaariuurteiden yhdistelmähoitona.
Taulukko 1. Päivä 30: Leveimmän hymyn aiheuttamien naururyppyjen arvio tutkijan ja potilaan mukaan.
- Vastaajien arviot (prosenttiosuus potilaista, jotka saavuttivat naururyppyjen vakavuustason arvion ”ei vakava” tai ”lievä”)
Kliininen tutkimus | Annos | Vistabel
| Lumelääke
| Vistabel
| Lumelääke
|
Tutkijan arvio | Potilaan arvio | ||||
191622-098 | 24 yksikköä | 66,7 %* (148/222) | 6,7 % (15/223) | 58,1 %* (129/222) | 5,4 % (12/223) |
191622-099 | 24 yksikköä
| 54,9 %* (168/306) | 3,3 % (10/306) | 45,8 %* (140/306) | 3,3 % (10/306) |
| 44 yksikköä | 59,0 %* (180/305) | 3,3 % (10/306) | 48,5 %* (148/305) | 3,3 % (10/306) |
*p < 0,001 (Vistabel verrattuna lumelääkkeeseen)
Potilaiden antamassa arviossa nähtiin parannus Vistabel-valmisteella (24 yksikköä ja 44 yksikköä) hoidettujen potilaiden leveimmän hymyn aiheuttamissa naururypyissä lähtötasoon nähden verrattuna lumelääkkeeseen päivänä 30 ja kaikkina jokaista hoitosykliä seuraavina ajankohtina molemmissa avaintutkimuksissa (p < 0,001).
Vistabel-hoito (24 yksikköä) silotti myös merkittävästi levossa näkyvien naururyppyjen syvyyttä. 63 prosentilla (330/528) hoitoa saavista potilaista (528) oli myös levossa näkyviä naururyppyjä, joiden vakavuus vaihteli syvistä kohtalaisiin lähtötasolla. Vistabel-valmisteella hoidetuista potilaista 58 prosenttia pidettiin (192/330) hoitoon vastaavina (ei vakava tai lievä) 30 päivää injektion jälkeen verrattuna lumelääkkeellä hoidettuihin potilaisiin 11 % (39/352).
Facial Line Outcomes (FLO-11) ‑kyselyllä tehdyssä ikää ja viehättävyyttä koskevassa arvioinnissa nähtiin parannus Vistabel-valmistetta (24 yksikköä ja 44 yksikköä) saaneiden joukossa verrattuna lumelääkkeeseen ensisijaisen päätetapahtuman ajankohtana (päivä 30) (p < 0,001) ja kaikkina sitä seuraavina ajankohtina molemmissa avaintutkimuksissa.
Avaintutkimusten potilaista 3,9 % (53/1362) oli yli 65-vuotiaita. Tutkijan arvioinnin mukaan tämän ikäryhmän potilaiden Vistabel-valmisteella (24 yksikköä ja 44 yksikköä) saavuttama hoitovaste oli 36 % (päivä 30). Kun analyysit suoritettiin ikäryhmissä ≤ 50 vuotta ja > 50 vuotta, todettiin kummassakin ryhmässä tilastollisesti merkittävä parannus verrattuna lumelääkkeeseen. Tutkijan arvion mukaan Vistabel-valmisteella (24 yksikköä) saavutettu hoitovaste oli pienempi yli 50-vuotiaiden ikäryhmässä verrattuna ikäryhmään ≤ 50 vuotta (42,0 % ja 71,2 %, vastaavasti).
Leveimmän hymyn aiheuttamiin naururyppyihin annetun Vistabel-hoidon vaste (60 %) on kaiken kaikkiaan pienempi kuin otsan voimakkaan rypistyksen seurauksena syntyviin glabellaariuurteisiin annetun hoidon vaste (80 %)
916:lta (517 potilasta annoksella 24 yksikköä ja 399 potilasta annoksella 44 yksikköä) Vistabel-valmisteella hoidetulta potilaalta analysoitiin vasta-aineen muodostuminen näytteistä. Yhdelläkään potilaalla ei muodostunut neutraloivia vasta-aineita.
Otsarypyt
Tutkimukseen otettiin mukaan 822 potilasta, joilla oli kohtalaisia tai syviä voimakkaan lihassupistuksen aiheuttamia otsaryppyjä ja glabellaariuurteita, joko pelkästään (N = 254, tutkimus 191622-142) tai yhdessä kohtalaisten tai syvien leveimmän hymyn aiheuttamien naururyppyjen kanssa (N = 568, tutkimus 191622-143). Potilaat sisällytettiin mukaan kaikkien ensisijaisten ja toissijaisten tehokkuuspäätetapahtumien pääasialliseen tutkimusryhmään. Kliinisessä tutkimuksessa otsaryppyjä hoidettiin glabellaariuurteiden kanssa.
Sekä tutkijoiden että potilaiden arvioissa niiden potilaiden osuus, jotka saavuttivat Vistabel-injektioiden jälkeen otsaryppyjen häviämisen täysin tai lievät otsarypyt kulmakarvojen voimakkaan kohottamisen yhteydessä, oli suurempi kuin lumelääkkeellä hoidettujen potilaiden osuus päivänä 30, joka oli ensisijaisen tehokkuuspäätetapahtuman ajankohta (taulukko 2). Niiden potilaiden osuudet, jotka saavuttivat vähintään yhden asteen kohentumisen otsaryppyjen syvyydessä lähtötilanteeseen nähden levossa ja jotka saavuttivat kasvojen yläosan ryppyjen häviämisen täysin tai lievät kasvorypyt voimakkaan lihassupistuksen yhteydessä, on myös esitetty.
Taulukko 2: Päivä 30: Tutkijan ja potilaan arvio otsarypyistä ja kasvojen yläosan rypyistä voimakkaan lihassupistuksen yhteydessä ja levossa
Kliininen tutkimus | Päätetapahtuma | Vistabel
| Lumelääke
| Vistabel
| Lumelääke
| |
Tutkijan arvio | Potilaan arvio | |||||
Tutkimus 191622-142 40 yksikköä (20 yksikköä otsarypyt + 20 yksikköä glabellaariuurteet) | Otsarypyt voimakkaan lihassupistuksen yhteydessäa | 94,8 % | 1,7 % | 87,6 % | 0,0 % | |
p < 0,0005 | p < 0,0005 | |||||
Otsarypyt levossab | 86,2 % | 22,4 % | 89,7 % (174/194) | 10,2 % (6/59) | ||
p < 0,0001 | p < 0,0001 | |||||
Tutkimus 191622-143 40 yksikköä (20 yksikköä otsarypyt + 20 yksikköä glabellaariuurteet) | Otsarypyt voimakkaan lihassupistuksen yhteydessäa | 90,5 % | 2,7 % | 81,5 % | 3,6 % | |
p < 0,0005 | p < 0,0005 | |||||
Otsarypyt levossab | 84,1 % | 15,9 % | 83,6 % (184/220) | 17,4 % (19/109) | ||
p < 0,0001 | p < 0,0001 | |||||
Tutkimus 191622-143 64 yksikköä (20 yksikköä otsarypyt + 20 yksikköä glabellaariuurteet + 24 yksikköä naururypyt) | Otsarypyt voimakkaan lihassupistuksen yhteydessäa | 93,6 % | 2,7 % | 88,9 % | 3,6 % | |
p < 0,0005 | p < 0,0005 | |||||
Kasvojen yläosan rypyt voimakkaan lihassupistuksen yhteydessäc | 56,6 % | 0,9 % | ei saatavilla
| |||
p < 0,0001 | ||||||
a Niiden potilaiden osuus, jotka saavuttivat otsaryppyjen silenemisen kokonaan tai otsaryppyjen lievän syvyyden kulmakarvoja voimakkaasti kohotettaessa
b Niiden potilaiden osuus, joilla ilmeni levossa otsaryppyjen syvyydessä vähintään yhden asteen kohentuminen lähtötilanteesta
c Vasteen saaneiden osuus, kun vasteen määritelmänä on, että sama potilas saavuttaa otsaryppyjen, glabellaariuurteiden ja naururyppyjen silenemisen kokonaan tai lieväasteiset otsarypyt, glabellaariuurteet ja naururypyt kunkin kasvojen alueen voimakkaan lihassupistuksen yhteydessä
Vistabel-injektiot vähensivät kulmakarvoja voimakkaasti kohotettaessa syntyvien otsaryppyjen syvyyttä merkittävästi lumelääkkeeseen verrattuna 6 kuukauteen saakka (p < 0,05). Tämä mitattiin niiden potilaiden osuutena, joiden kulmakarvojen voimakkaan kohotuksen seurauksena syntyvien otsaryppyjen syvyyden arvioksi annettiin molemmissa avaintutkimuksissa ”silenneet täysin” tai ”lievä” päivään 150 asti tutkimuksessa 191622-142 (21,6 %:lla Vistabel-hoitoa saaneista, 0 %:lla lumelääkettä saaneista) ja päivään 180 asti tutkimuksessa 191622-143 (6,8 %:lla Vistabel-hoitoa saaneista, 0 %:lla lumelääkettä saaneista).
Kun kaikkia kolmea aluetta hoidettiin samanaikaisesti tutkimuksessa 191622-143 (Vistabel-hoitoa 64 yksikköä saanut ryhmä), Vistabel-injektiot vähensivät merkittävästi glabellaariuurteiden syvyyttä 6 kuukauteen saakka (5,5 %:lla Vistabel-hoitoa saaneista, 0 %:lla lumelääkettä saaneista), silmäkulman sivun juonteiden syvyyttä 6 kuukauteen saakka (3,4 %:lla Vistabel-hoitoa saaneista, 0 %:lla lumelääkettä saaneista) ja otsaryppyjen syvyyttä 6 kuukauteen saakka (9,4 %:lla Vistabel-hoitoa saaneista, 0 %:lla lumelääkettä saaneista).
Yhteensä 116 potilasta sai yhden vuoden aikana kolme hoitosykliä, joissa annettiin 40 yksikköä Vistabel-valmistetta (20 yksikköä otsaryppyihin ja 20 yksikköä glabellaariuurteisiin), ja 150 potilasta sai yhden vuoden aikana kolme hoitosykliä, joissa annettiin 64 yksikköä Vistabel-valmistetta (20 yksikköä otsaryppyihin, 20 yksikköä glabellaariuurteisiin ja 24 yksikköä naururyppyihin). Otsaryppyjen syvyyden vähentymisenä ilmenevän vasteen määrä oli samanlainen kaikkien hoitosyklien aikana.
FLO-11-kyselyssä havaittiin kohentumista potilaiden raportoimissa kokemuksissa siitä, miten häiritsevinä koettiin otsarypyt, varsinaista ikää vanhemmalta näyttäminen ja viehättävyys; kohentumista havaittiin merkitsevästi (p < 0,001) useammin 40 yksikköä Vistabel-hoitoa saaneilla (20 yksikköä otsaryppyihin, 20 yksikköä glabellaariuurteisiin) ja 64 yksikköä Vistabel-hoitoa saaneilla (20 yksikköä otsaryppyihin, 20 yksikköä glabellaariuurteisiin ja 24 yksikköä naururyppyihin) kuin lumelääkettä saaneilla tutkimuksen 191622-142 ja tutkimuksen 191622-143 ensisijaisen päätetapahtuman ajankohtana (päivä 30).
Facial Lines Satisfaction Questionnaire (FLSQ) -kyselyssä 78,1 % (150/192) potilaista tutkimuksessa 191622-142 ja 62,7 % (138/220) tutkimuksessa 191622-143 ilmoitti ulkonäköön liittyvien ja psyykkisten vaikutusten kohentuneen (perustuu kysymyksiin, jotka liittyvät itsensä vanhemmaksi tuntemiseen, negatiiviseen itsetuntoon, väsyneeltä näyttämiseen, tyytymättömyyden tuntemuksiin ja vihaiselta näyttämiseen), kun Vistabel-hoitoa annettiin 40 yksikköä (20 yksikköä otsaryppyihin, 20 yksikköä glabellaariuurteisiin). Lumelääkkeellä hoidetuilla potilailla osuus oli 19,0 % (11/58) tutkimuksessa 191622-142 ja 18,9 % (21/111) tutkimuksessa 191622-143 päivänä 30 (kummassakin tutkimuksessa p < 0,0001).
Samassa FLSQ-kyselyssä 90,2 % (174/193) potilaista tutkimuksessa 191622-142 ja 79,2 % (175/221, 40 yksikköä) tai 86,4 % (203/235, 64 yksikköä) tutkimuksessa 191622-143 ilmoitti olevansa ”erittäin tyytyväinen” / ”enimmäkseen tyytyväinen” 40 yksikön tai 64 yksikön Vistabel-hoitoon lumelääkkeellä hoidettuihin potilaisiin verrattuna (1,7 % [1/58] tutkimuksessa 191622-142 ja 3,6 % [4/110] tutkimuksessa 191622-143) ensisijaisen päätetapahtuman ajankohtana (päivä 60) (kummassakin tutkimuksessa p < 0,0001).
Avaintutkimusten potilaista 3,7 % (22/587) oli yli 65-vuotiaita. Tutkijan arvion mukaan tämän ikäryhmän potilaiden saavuttama hoitovaste oli 86,7 % (13/15) (päivä 30) Vistabel-valmisteella ja 28,6 % (2/7) lumelääkkeellä. Vasteen saaneiden määrät tässä Vistabel-hoitoa saaneessa alaryhmässä olivat samanlaiset kuin kokonaispopulaatiossa, mutta tilastollista merkitsevyyttä ei saavutettu ja vertailuja on vaikea tehdä lumelääkkeeseen verrattuna potilaiden pienestä lukumäärästä johtuen.
Farmakokinetiikka
a) Vaikuttavan aineen yleiset ominaisuudet:
Rotilla tehdyt jakautumistutkimukset osoittavat 125I-botuliinineurotoksiinin A kompleksin leviävän hitaasti gastrocnemius-lihakseen injektion antamisen jälkeen, mitä seuraa nopea systeeminen metabolia ja eliminaatio virtsan kautta. Radioaktiivisesti merkityn materiaalin puoliintumisaika oli noin 10 tuntia. Injektiokohdassa radioaktiivisuus sitoutui suuriin proteiinimolekyyleihin, kun taas plasmassa se sitoutui pieniin molekyyleihin, mikä viittaa substraatin nopeaan systeemiseen metaboliaan. Vuorokauden kuluessa annosta 60 % radioaktiivisuudesta erittyi virtsaan. Toksiini metaboloituu luultavasti proteaasien vaikutuksesta, ja molekyylikomponentit kierrättyvät normaalien metaboliareittien kautta.
Valmisteen erityisluonteen takia sillä ei ole tehty tavanomaisia vaikuttavan aineen imeytymis-, jakautumis-, biotransformaatio- ja eliminaatiotutkimuksia (ADME).
b) Ominaisuudet potilaissa:
Terapeuttisina annoksina annetun Vistabel-injektion systeemisen jakautumisen katsotaan olevan vähäistä. Yksisäikeiseen elektromyografiatekniikkaan perustuneet kliiniset tutkimukset ovat osoittaneet lisääntynyttä sähköfysiologista neuromuskulaarista aktiviteettia injektiokohdasta distaalisesti sijaitsevissa lihaksissa, ilman siihen liittyviä kliinisiä merkkejä tai oireita.
Prekliiniset tiedot turvallisuudesta
Lisääntymistutkimuksissa hiirillä, rotilla ja kaneilla todettiin embryotoksisuutta (viivästynyt luutuminen ja alentunut sikiön paino) suuria annoksia käytettäessä. Näillä lajeilla ei todettu viitteitä teratogeenisuudesta. Rotilla ilmeni haittavaikutuksia urosten hedelmällisyyteen sekä naaraiden estruskiertoon ja hedelmällisyyteen vain suuria annoksia käytettäessä.
Tutkimuksissa, jotka koskivat akuuttia toksisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, paikallista siedettävyyttä, mutageenisuutta, antigeenisuutta ja yhteensopivuutta veren kanssa, ei ilmennyt epätavallisia paikallisia tai systeemisiä haittavaikutuksia kliinisesti asianmukaisia annoksia käytettäessä.
Farmaseuttiset tiedot
Apuaineet
Ihmisen albumiini
Natriumkloridi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Liuottamisen jälkeen valmiste suositellaan käytettäväksi välittömästi. Kemiallisen ja fysikaalisen käytönaikaisen säilyvyyden on kuitenkin osoitettu olevan 24 tuntia 2 °C - 8 °C lämpötilassa.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C).
Käyttökuntoon saatetun liuoksen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VISTABEL injektiokuiva-aine, liuosta varten
4 Allergan-yksikköä/0,1ml (L:ei) 50 U (138,19 €)
PF-selosteen tieto
Jauhe injektiopullossa (tyypin I lasia), joka on suljettu (klorobutyyli)kumitulpalla ja alumiinitiivisteellä.
50 Allergan-yksikköä tyypin A botuliinitoksiinia/injektiopullo. Yhden tai kahden injektiopullon pakkaus;
100 Allergan-yksikköä tyypin A botuliinitoksiinia/injektiopullo. Yhden tai kahden injektiopullon pakkaus.
Kaikkia pakkauskokoja ei ole välttämättä myynnissä.
Valmisteen kuvaus:
Valkoinen jauhe.
Vistabel on ulkonäöltään ohut valkoinen sakka, jota voi olla vaikea nähdä injektiopullon pohjalla.
Käyttö- ja käsittelyohjeet
Käyttöliuoksen valmistuksessa on noudatettava huolellisuutta varsinkin aseptisuuden suhteen. VISTABEL on liuotettava steriiliin säilytysaineettomaan keittosuolaliuokseen (injektioihin tarkoitettuun 0,9 % natriumkloridiliuokseen). Alla olevan laimennustaulukon mukainen määrä steriiliä säilytysaineetonta keittosuolaliuosta (injektioihin tarkoitettua 0,9 % natriumkloridiliuosta) on vedettävä ruiskuun, jolloin saadaan käyttöliuos, jonka pitoisuus on 4 yksikköä/0,1 ml.
Injektiopullon koko | Lisätyn liuottimen määrä (steriiliä säilytysaineetonta keittosuolaliuosta [injektioihin tarkoitettua 0,9 % natriumkloridiliuosta]) | Saatava annos (yksikköjä 0,1 ml kohti) |
50 yksikön | 1,25 ml | 4,0 yksikköä |
100 yksikön | 2,5 ml | 4,0 yksikköä |
Kumikorkin keskiosa on puhdistettava spriillä.
Vistabel-valmisteen denaturaation välttämiseksi liuos valmistetaan ruiskuttamalla liuotin hitaasti injektiopulloon ja pyörittämällä injektiopulloa varovasti välttäen kuplien muodostumista. Injektiopullo on hävitettävä, jos alipaine ei vedä liuotinta injektiopulloon. Valmis liuos on tarkastettava silmämäärin ennen käyttöä. Liuosta saa käyttää vain, jos se on kirkas, väritön tai kellertävä, eikä sisällä hiukkasia.
Yksittäistä Vistabel-injektiopulloa saa ehdottomasti käyttää vain yhden ainoan potilaan hoitoon ja vain yhden hoitokerran aikana.
Injektiopullojen, ruiskujen ja käytettyjen materiaalien turvallinen hävittäminen:
Välittömästi käytön jälkeen ja ennen hävittämistä käyttämätön liuotettu injektiopullossa ja/tai ruiskussa oleva Vistabel-liuos on inaktivoitava 2 ml:lla laimennettua 0,5 % tai 1 % natriumhypokloriittiliuosta ja hävitettävä paikallisten määräysten mukaisesti.
Käytettyjä injektiopulloja, ruiskuja ja materiaaleja ei pidä tyhjentää, vaan ne on vietävä niille tarkoitettuihin säiliöihin ja hävitettävä ongelmajätteenä paikallisten määräysten mukaisesti.
Toimintasuositukset vaaratilanteissa botuliinitoksiinia käsiteltäessä.
Jos valmistetta käsiteltäessä tapahtuu onnettomuus, joko sen ollessa vakuumikuivatussa tai liuotetussa muodossaan, on ryhdyttävä seuraaviin toimenpiteisiin:
- Toksiini on hyvin herkkä lämmölle ja tietyille kemiallisille aineille.
- Roiskeet on pyyhittävä pois joko imukykyisellä kankaalla, joka on kostutettu natriumhypokloriittiliuoksella (kloorausliuoksella) vakuumikuivatun tuotteen ollessa kyseessä tai kuivalla imukykyisellä kankaalla valmiin liuoksen ollessa kyseessä.
- Pinnat, joille on joutunut toksiinia, on puhdistettava imukykyisellä kankaalla, joka on kyllästetty natriumhypokloriittiliuoksella (kloorausliuoksella), minkä jälkeen pinta kuivataan.
- Jos injektiopullo rikkoutuu, kerää varovasti lasinsirut ja toimi edellä annettujen ohjeiden mukaisesti välttäen ihon rikkoutumista.
- Pese mahdolliset roiskeet natriumhypokloriittiliuoksella ja huuhtele sitten perusteellisesti runsaalla vedellä.
- Jos valmistetta joutuu silmiin, huuhtele silmät perusteellisesti runsaalla vedellä tai silmähuuhteluliuoksella.
- Jos käyttäjä loukkaa itsensä (viilto- tai pistohaava) valmistetta käsitellessään, toimi edellä esitettyjen ohjeiden mukaan annosmäärä huomioon ottaen.
Tätä käyttö- ja käsittely- sekä hävittämisohjetta on noudatettava tarkasti.
Korvattavuus
VISTABEL injektiokuiva-aine, liuosta varten
4 Allergan-yksikköä/0,1ml 50 U
- Ei korvausta.
ATC-koodi
M03AX01
Valmisteyhteenvedon muuttamispäivämäärä
27.10.2022
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi
