SIMBRINZA silmätipat, suspensio 10 mg/ml+2 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi ml suspensiota sisältää 10 mg brintsolamidia ja 2 mg brimonidiinitartraattia, joka vastaa 1,3 mg:aa brimonidiinia.
Apuaine, jonka vaikutus tunnetaan
Yksi ml suspensiota sisältää 0,03 mg bentsalkoniumkloridia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Silmätipat, suspensio (silmätipat).
Kliiniset tiedot
Käyttöaiheet
Kohonneen silmänsisäisen paineen alentaminen aikuispotilailla, joilla on avokulmaglaukooma tai silmän hypertensio ja joilla monoterapia ei alenna silmänsisäistä painetta riittävästi (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Käyttö aikuisille, vanhukset mukaan lukien
Suositeltu annos on yksi tippa SIMBRINZA-silmätippoja kaksi kertaa vuorokaudessa hoidettavaan silmään.
Annoksen unohtuminen
Jos annos unohtuu, jatketaan hoitoa seuraavalla hoitosuunnitelman mukaisella annoksella.
Maksan ja/tai munuaisten vajaatoiminta
SIMBRINZA-silmätippoja ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla, joten varovaisuutta suositellaan tällaisten potilaiden hoidossa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
SIMBRINZA-silmätippoja ei ole tutkittu potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 30 ml/min), tai potilailla, joilla on hyperkloreeminen asidoosi. Koska SIMBRINZA-silmätippojen brintsolamidi ja sen metaboliitti erittyvät ensisijaisesti munuaisteitse, SIMBRINZA on vasta-aiheinen tällaisille potilaille (ks. kohta Vasta-aiheet).
Pediatriset potilaat
SIMBRINZA-silmätippojen turvallisuutta ja tehoa 2–17-vuotiaiden lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
SIMBRINZA-silmätippojen käyttö on turvallisuussyistä vasta-aiheista kohonneen silmänsisäisen paineen alentamiseen vastasyntyneille ja alle 2-vuotiaille lapsille, joilla on avokulmaglaukooma tai silmän hypertensio, eikä monoterapia alenna silmänsisäistä painetta riittävästi (ks. kohta Vasta-aiheet).
Antotapa
Silmän pinnalle.
Potilaita on opastettava ravistamaan pulloa hyvin ennen käyttöä.
Systeeminen imeytyminen vähenee käyttämällä nasolakrimaalista okkluusiota ja pitämällä silmät kiinni kahden minuutin ajan. Tämä voi vähentää systeemisiä haittavaikutuksia ja lisätä paikallista vaikutusta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tippapullon kärjen ja pullossa olevan nesteen kontaminoitumisen estämiseksi on lääkettä annosteltaessa varottava koskettamasta silmäluomia, silmäluomia ympäröiviä alueita ja muita pintoja lääkepullon tippakärjellä. Potilaita on kehotettava sulkemaan pullo tiiviisti käytön jälkeen.
SIMBRINZA-silmätippoja voidaan käyttää samanaikaisesti muiden paikallisten silmälääkevalmisteiden kanssa silmänsisäisen paineen alentamiseksi. Jos käytössä on useita paikallisesti silmään annosteltavia lääkevalmisteita, valmisteiden annon välillä on oltava vähintään 5 minuutin aikaväli.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Yliherkkyys sulfonamideille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Monoamiinioksidaasin (MAO:n) estäjähoitoa saavat potilaat (ks. kohta Yhteisvaikutukset)
Noradrenergiseen transmissioon vaikuttavia masennuslääkkeitä (esim. trisyklisiä antidepressantteja ja mianseriinia) saavat potilaat (ks. kohta Yhteisvaikutukset)
Potilaat, joilla on vaikea munuaisten vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Potilaat, joilla on hyperkloreeminen asidoosi
Vastasyntyneet ja alle 2-vuotiaat lapset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Varoitukset ja käyttöön liittyvät varotoimet
Tätä lääkevalmistetta ei saa antaa injektiona. Potilaita on opastettava, että SIMBRINZA-silmätippoja ei saa niellä.
Silmään kohdistuvat vaikutukset
SIMBRINZA-silmätippoja ei ole tutkittu ahdaskulmaglaukoomaa sairastavilla potilailla, eikä sen käyttöä suositella näille potilaille.
Brintsolamidin mahdollista vaikutusta sarveiskalvon endoteelin toimintaan ei ole tutkittu potilailla, joiden sarveiskalvot eivät ole normaalit (erityisesti potilailla, joiden endoteelisolumäärä on matala). Erityisesti piilolinssejä käyttäviä potilaita ei ole tutkittu, ja näiden potilaiden huolellista seurantaa suositellaan brintsolamidia käytettäessä, koska hiilihappoanhydraasin estäjät voivat vaikuttaa sarveiskalvon hydraatioon ja piilolinssien käyttö saattaa lisätä sarveiskalvon vahingoittumisen riskiä (ks. jäljempänä kohdasta ”Bentsalkoniumkloridi” lisää ohjeita piilolinssien käyttöön). Potilasta suositellaan seuraamaan tarkoin, jos potilaan sarveiskalvo on heikentynyt, esimerkiksi diabeteksen tai sarveiskalvodystrofian vuoksi.
Brimonidiinitartraatti voi aiheuttaa allergisia reaktioita silmissä. Jos allergisia reaktioita ilmenee, hoito on keskeytettävä. Brimonidiinitartraatin käytön yhteydessä on ilmoitettu ilmenneen viivästynyttä silmän yliherkkyysreaktioita, ja joihinkin näistä on ilmoitettu liittyvän silmänpaineen nousua.
SIMBRINZA-hoidon keskeyttämistä seuraavia mahdollisia vaikutuksia ei ole tutkittu. Vaikka SIMBRINZA-silmätippojen silmänsisäistä painetta alentavan vaikutuksen kestoa ei ole tutkittu, brintsolamidin silmänpainetta alentavan vaikutuksen uskotaan kestävän 5–7 vuorokautta. Brimonidiinin silmänsisäistä painetta alentava vaikutus voi kestää pidempään.
Systeemiset vaikutukset
SIMBRINZA sisältää brintsolamidia, joka on hiilihappoanhydraasin sulfonamidiestäjä, ja se imeytyy systeemisesti myös paikallisesti annosteltaessa. Sulfonamideille tyypillisiä haittavaikutuksia, kuten Stevens-Johnsonin oireyhtymää ja toksista epidermaalista nekrolyysiä, voi esiintyä myös paikallisessa käytössä. Lääkettä määrättäessä potilaille on kerrottava merkeistä ja oireista ja ihoreaktioita on seurattava tarkasti. Jos potilaalla ilmenee vakavia reaktioita tai yliherkkyyttä, SIMBRINZA-valmisteen käyttö on lopetettava heti.
Sydän
Verenpaineen pienoista laskua havaittiin joillakin potilailla SIMBRINZA-silmätippojen annostelun jälkeen. Varovaisuutta on syytä noudattaa, kun SIMBRINZA-silmätippoja käytetään samanaikaisesti eräiden lääkevalmisteiden, kuten verenpainelääkkeiden ja/tai sydänglykosidien, kanssa tai potilaille, joilla on vaikea tai epävakaa ja hallitsematon sydän- ja verisuonisairaus (ks. kohta Yhteisvaikutukset).
SIMBRINZA-silmätippoja on käytettävä varoen potilaille, joilla on masennus, aivoverisuonten tai sepelvaltimoiden vajaatoiminta, Raynaud’n oireyhtymä, ortostaattinen hypotensio tai verisuonten tukkotulehdus (thromboangiitis obliterans).
Happo-emästasapainon häiriöt
Happo-emästasapainon häiriöitä on ilmoitettu suun kautta otettavien hiilihappoanhydraasin estäjien käytön yhteydessä. SIMBRINZA sisältää brintsolamidia, joka on hiilihappoanhydraasin estäjä, ja se imeytyy systeemisesti myös paikallisesti annosteltaessa. Samanlaisia haittavaikutuksia kuin suun kautta otettavilla hiilihappoanhydraasin estäjillä (esim. happo-emästasapainon häiriöitä) voi ilmetä paikallisen annostelun yhteydessä (ks. kohta Yhteisvaikutukset).
SIMBRINZA-silmätippoja on käytettävä mahdollisen metabolisen asidoosin riskin vuoksi varoen potilaille, joilla on munuaisten vajaatoiminnan riski. SIMBRINZA on vasta-aiheinen potilailla, joilla on vaikea munuaisten vajaatoiminta (ks. kohta Vasta-aiheet).
Maksan vajaatoiminta
SIMBRINZA-silmätippoja ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla, joten tällaisten potilaiden hoidossa on noudatettava varovaisuutta (ks. kohta Annostus ja antotapa).
Henkinen vireystila
Suun kautta otettavat hiilihappoanhydraasin estäjät saattavat heikentää iäkkäiden potilaiden kykyä suoriutua riittävää vireystilaa ja/tai fyysistä koordinaatiokykyä edellyttävistä tehtävistä. SIMBRINZA imeytyy systeemisesti, minkä vuoksi tämä vaikutus voi ilmetä paikallisen annostelun yhteydessä (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn).
Pediatriset potilaat
SIMBRINZA-silmätippojen turvallisuutta ja tehoa 2–17-vuotiaiden lasten ja nuorten hoidossa ei ole varmistettu. Brimonidiinin yliannostuksen oireita (mukaan lukien tajuttomuus, hypotensio, hypotonia, bradykardia, hypotermia, syanoosi ja apnea) on ilmoitettu ilmenneen vastasyntyneillä ja lapsilla, jotka ovat saaneet brimonidiinisilmätippoja osana synnynnäisen glaukooman lääkehoitoa. SIMBRINZA-silmätippojen käyttö on tästä syystä vasta-aiheista alle 2-vuotiaiden lasten hoidossa (ks. kohta Vasta-aiheet).
Hoitoa ei suositella 2-vuotiaille ja sitä vanhemmille lapsille (erityisesti 2–7-vuotiaille ja/tai alle 20 kg painaville) mahdollisten keskushermostoon liittyvien haittavaikutusten vuoksi (ks. kohta Yliannostus).
Bentsalkoniumkloridi
SIMBRINZA sisältää bentsalkoniumkloridia, joka voi aiheuttaa silmä-ärsytystä ja jonka tiedetään värjäävän pehmeitä piilolinssejä. Kosketusta pehmeiden piilolinssien kanssa on vältettävä. Potilaita on neuvottava ottamaan piilolinssit pois ennen SIMBRINZA-silmätippojen annostelua ja odottamaan vähintään 15 minuuttia annostelun jälkeen ennen piilolinssien laittamista takaisin silmiin.
Bentsalkoniumkloridin on ilmoitettu aiheuttaneen silmä-ärsytystä ja silmän kuivuuden oireita, ja sillä voi olla vaikutusta kyynelkalvoon ja sarveiskalvon pintaan. Varovaisuutta on noudatettava hoidettaessa kuivasilmäisiä potilaita ja potilaita, joiden sarveiskalvo on vaurioitunut. Tarkka seuranta on aiheellista, jos valmistetta käytetään usein tai pitkään.
Yhteisvaikutukset
SIMBRINZA-valmisteella ei ole tehty erityisiä yhteisvaikutustutkimuksia.
SIMBRINZA-silmätippojen käyttö on vasta-aiheista monoamiinioksidaasin estäjiä tai noradrenergiseen transmissioon vaikuttavia masennuslääkkeitä (esim. trisyklisiä antidepressantteja ja mianseriinia) saavien potilaiden hoidossa (ks. kohta Vasta-aiheet). Trisykliset antidepressantit voivat heikentää SIMBRINZA-silmätippojen silmän hypotensiivistä vastetta.
Varovaisuutta on noudatettava, jos SIMBRINZA-silmätippoja käytetään keskushermostoa lamauttavien aineiden (esim. alkoholi, barbituraatit, opiaatit, sedatiivit tai anesteetit) kanssa, koska ne voivat lisätä tai tehostaa toistensa vaikutusta.
SIMBRINZA-silmätippojen annostelun jälkeen verenkierrossa ilmenevien katekolamiinien pitoisuuksista ei ole tutkimustietoa. On kuitenkin oltava varovainen, jos potilas saa lääkettä, joka voi vaikuttaa verenkierrossa esiintyvien amiinien, esim. klooripromatsiinin, metyylifenidaatin, reserpiinin sekä serotiniinin ja noradrenaliinin takaisinoton estäjien metaboliaan ja soluunottoon.
Alfa-adrenergiset agonistit (kuten brimonidiinitartraatti) voivat alentaa sykettä ja verenpainetta. Verenpaineen pienoista laskua havaittiin joillakin potilailla SIMBRINZA-silmätippojen annostelun jälkeen. Varovaisuutta on syytä noudattaa, kun SIMBRINZA-silmätippoja käytetään samanaikaisesti eräiden lääkevalmisteiden, kuten verenpainelääkkeiden ja/tai sydänglykosidien, kanssa.
On oltava varovainen, kun aletaan käyttää samanaikaisesti systeemistä lääkettä (tai sen annostusta muutetaan) (farmaseuttisesta lääkemuodosta riippumatta), jolla voi olla yhteisvaikutus α-adrenergisten agonistien kanssa tai joka voi vaikuttaa niiden aktiviteettiin. Näitä lääkkeitä ovat esim. adrenergisen reseptorin agonistit tai antagonistit, kuten isoprenaliini ja pratsosiini.
Brintsolamidi on hiilihappoanhydraasin estäjä ja imeytyy systeemisesti myös paikallisesti käytettynä. Happo-emästasapainon häiriöitä on ilmoitettu suun kautta otettavien hiilihappoanhydraasin estäjien käytön yhteydessä. Yhteisvaikutusten mahdollisuus on otettava huomioon SIMBRINZA-hoitoa saavilla potilailla.
Suun kautta otettavan hiilihappoanhydraasin estäjän ja paikallisen brintsolamidin samanaikainen käyttö saattaa voimistaa hiilihappoanhydraasin eston tunnettuja systeemisiä vaikutuksia. SIMBRINZA-silmätippojen ja suun kautta otettavien hiilihappoanhydraasin estäjien yhteiskäyttöä ei suositella.
Brintsolamidin metaboloitumisesta vastaavia sytokromi-P-450-isoentsyymejä ovat mm. CYP3A4 (pääasiallinen), CYP2A6, CYP2B6, CYP2C8 ja CYP2C9. CYP3A4:n estäjät, kuten ketokonatsoli, itrakonatsoli, klotrimatsoli, ritonaviiri ja troleandomysiini, estävät todennäköisesti CYP3A4-isoentsyymin välityksellä tapahtuvaa brintsolamidin metaboloitumista. Varovaisuutta on syytä noudattaa, mikäli potilaalle annetaan samanaikaisesti CYP3A4:n estäjiä. Brintsolamidin kumuloituminen on kuitenkin epätodennäköistä, koska eliminoituminen tapahtuu pääasiassa munuaisten kautta. Brintsolamidi ei ole sytokromi-P450-isoentsyymien estäjä.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja SIMBRINZA-silmätippojen käytöstä raskaana oleville naisille. Brintsolamidi ei ollut teratogeeninen systeemisesti (suun kautta) annettuna rotilla ja kaneilla. Suun kautta otettavalla brimonidiinilla tehdyissä eläinkokeissa ei todettu suoria haitallisia lisääntymistoksisia vaikutuksia. Eläinkokeissa brimonidiini läpäisi istukan ja pääsi jossakin määrin sikiön verenkiertoon (ks. kohta Prekliiniset tiedot turvallisuudesta). SIMBRINZA-silmätippojen käyttöä ei suositella raskauden aikana, eikä niitä saa antaa hedelmällisessä iässä oleville naisille, jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö paikallisesti annettu SIMBRINZA rintamaitoon. Saatavissa olevat eläimiä koskevat farmakodynaamiset/toksikologiset tiedot ovat osoittaneet, että brintsolamidia erittyy rintamaitoon hyvin pieninä määrinä suun kautta annostelun jälkeen. Suun kautta otettu brimonidiini erittyy äidinmaitoon. Rintaruokkivien naisten ei pidä käyttää SIMBRINZA-silmätippoja.
Hedelmällisyys
Ei-kliiniset tiedot eivät osoita brintsolamidilla tai brimodiinillä olevan vaikutuksia hedelmällisyyteen. SIMBRINZA-silmätippojen paikallisen silmään antamisen vaikutuksesta ihmisten hedelmällisyyteen ei ole tietoja.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
SIMBRINZA-silmätipoilla on kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
SIMBRINZA voi aiheuttaa huimausta, uupumusta ja/tai unisuutta, mikä voi haitata ajokykyä tai koneidenkäyttökykyä.
Ohimenevä näön sumeneminen tai muut näköhäiriöt saattavat vaikuttaa ajokykyyn ja koneidenkäyttökykyyn. Jos näkö hämärtyy tippoja silmään tiputettaessa, potilaan on odotettava näön kirkastumista, ennen kuin ajaa autoa tai käyttää koneita.
Suun kautta otettavat hiilihappoanhydraasin estäjät saattavat heikentää iäkkäiden potilaiden kykyä suorittaa tehtäviä, jotka edellyttävät henkistä valppautta ja/tai fyysistä koordinaatiota (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kliinisissä tutkimuksissa, joissa SIMBRINZA-silmätippoja annosteltiin kahdesti vuorokaudessa, yleisimmät haittavaikutukset olivat silmän verekkyys ja silmän allergiatyyppiset reaktiot, joita ilmeni noin 6–7 prosentilla potilaista, ja makuhäiriö (kitkerä tai poikkeava maku suussa tippojen tiputtamisen jälkeen), jota ilmeni noin 3 prosentilla potilaista.
Haittavaikutusten taulukoitu yhteenveto
Seuraavia haittavaikutuksia on ilmoitettu kliinisissä tutkimuksissa, joissa SIMBRINZA-silmätippoja annosteltiin kahdesti vuorokaudessa, sekä kliinisissä tutkimuksissa ja markkinoille tulon jälkeen yksittäisten ainesosien, brintsolamidin ja brimonidiinin, osalta. Haittavaikutusten esiintymistiheydet ovat seuraavan luokittelun mukaisia: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Elinjärjestelmäluokitus | Haittavaikutukset |
Infektiot | Melko harvinainen: nenänielun tulehdus2, nielutulehdus2, poskiontelontulehdus2. Tuntematon: nuha2. |
Veri ja imukudos | Melko harvinainen: pienentynyt punasolujen määrä2, suurentunut veren kloridipitoisuus2. |
Immuunijärjestelmä | Melko harvinainen: yliherkkyys3. |
Psyykkiset häiriöt | Melko harvinainen: apatia2, masennus2,3, masentuneisuus2, unettomuus1, heikentynyt seksuaalivietti2, painajaiset2, hermostuneisuus2. |
Hermosto | Yleinen: uneliaisuus1, huimaus3, makuhäiriö1. Melko harvinainen: päänsärky1, motorisen toiminnan häiriö2, muistinmenetys2, muistin heikkeneminen2, tuntoharhat2. Hyvin harvinainen: pyörtyminen3. Tuntematon: vapina2, alentunut tuntoaistimusherkkyys2, makuaistin puute2. |
Silmät | Yleinen: silmäallergia1, sarveiskalvotulehdus1, silmäkipu1, epämukava tunne silmässä1, näön sumentuminen1, poikkeava näkö3, silmän verekkyys1, sidekalvon kalpeneminen3. Melko harvinainen: sarveiskalvon kuluminen1, sarveiskalvon turvotus2, luomitulehdus1, hiukkasia (saostumia) sarveiskalvossa 1, sidekalvohäiriö (papillit) 1, valonarkuus1, fotopsia2, silmän turpoaminen2, silmäluomen turvotus1, sidekalvon turvotus1, silmän kuivuminen1, silmän vuotaminen1, heikentynyt näkö2, lisääntynyt kyynelvuoto1, siipikalvo2, silmäluomen punoitus1, Meibomin rauhasen tulehdus2, kahtena näkeminen2, häikäistyminen2, silmän alentunut tuntoaistimus2, kovakalvon pigmentaatio2, sidekalvonalainen rakkula2, epänormaali tunne silmässä1, silmien rasittuminen1. Hyvin harvinainen: uveiitti3, mioosi3. Tuntematon: näköhäiriöt2, madaroosi2. |
Kuulo ja tasapainoelin | Melko harvinainen: huimaus1, tinnitus2. |
Sydän | Melko harvinainen: kardiorespiratorinen vajaus2, angina pectoris2, rytmihäiriö3, sydämentykytys2,3, epäsäännöllinen syke2, bradykardia2,3, takykardia3. |
Verisuonisto | Melko harvinainen: hypotensio1. Hyvin harvinainen: hypertensio3. |
Hengityselimet, rintakehä ja välikarsina | Melko harvinainen: dyspnea2, keuhkoputken hyperaktiviteetti2, nielun ja kurkunpään kipu2, kurkun kuivuminen1, yskä2, nenän verenvuoto2, ylähengitysteiden tukkoisuus2, nenän tukkoisuus1, vetinen vuoto nenästä2, kurkun ärsytys2, nenän kuivuus1, takanielun limaisuus1, aivastelu2. Tuntematon: astma2. |
Ruoansulatuselimistö | Yleinen: suun kuivuminen1. Melko harvinainen: ruoansulatushäiriöt1, ruokatorvitulehdus2, epämiellyttävä tunne vatsassa1, ripuli2, oksentelu2, pahoinvointi2, tihentynyt suolen toiminta2, ilmavaivat2, alentunut tuntoaistimus suussa2, tuntoharha suussa1. |
Maksa ja sappi | Tuntematon: poikkeavat maksan toimintakokeiden tulokset2. |
Iho ja ihonalainen kudos | Melko harvinainen: kosketusihottuma1, nokkosihottuma2, ihottuma2, makulopapulaarinen ihottuma2, yleistynyt kutina2, alopesia2, ihon kireys2. Tuntematon: Stevens-Johnsonin oireyhtymä/toksinen epidermaalinen nekrolyysi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), kasvojen turvotus3, dermatiitti2,3, punoitus2,3. |
Luusto, lihakset ja sidekudos | Melko harvinainen: selkäkipu2, lihasspasmit2, lihaskipu2. Tuntematon: nivelkipu2, raajakipu2. |
Munuaiset ja virtsatiet | Melko harvinainen: munuaiskipu2. Tuntematon: tiheä virtsaamisen tarve2. |
Sukupuolielimet ja rinnat | Melko harvinainen: erektiohäiriö2. |
Yleisoireet ja antopaikassa todettavat haitat | Melko harvinainen: kipu2, epämukava tunne rinnassa2, poikkeava olo2, rauhaton olo2, ärtyneisyys2, lääkejäämät1. Tuntematon: rintakipu2, perifeerinen turvotus2,3. |
1 SIMBRINZA-silmätippojen yhteydessä havaittu haittavaikutus 2 Brintsolamidimonoterapian yhteydessä havaittu haittavaikutus 3 Brimonidiinimonoterapian yhteydessä havaittu haittavaikutus | |
Valikoitujen haittavaikutusten kuvaus
Makuhäiriö oli yleisin SIMBRINZA-silmätippojen käyttöön (3,4 %) liittyvä systeeminen haittavaikutus. Tämä johtuu todennäköisesti siitä, että silmätippoja pääsee kulkeutumaan nenänieluun kyynelkanavaa pitkin, ja tämä vaikutus johtuu pääosin SIMBRINZA-silmätippojen sisältämästä brintsolamidista. Tätä haittaa voidaan vähentää painamalla kevyesti kyynelkanavaa tai varovaisesti sulkemalla silmäluomet silmätippojen annon jälkeen (ks. kohta Annostus ja antotapa).
SIMBRINZA sisältää brintsolamidia, joka on systeemisesti imeytyvä sulfonamidiryhmään kuuluva hiilihappoanhydraasin estäjä. Ruoansulatuskanavaan ja hermostoon kohdistuvat vaikutukset, hematologiset vaikutukset sekä munuaisiin ja aineenvaihduntaan kohdistuvat vaikutukset liittyvät yleisesti systeemisiin hiilihappoanhydraasin estäjiin. Samantyyppisiä haittavaikutuksia, jotka liittyvät suun kautta otettaviin hiilihappoanhydraasin estäjiin, saattaa esiintyä myös paikallisesti käytettävillä hiilihappoanhydraasin estäjillä.
SIMBRINZA-silmätippojen sisältämään brimonidiiniin yleisesti liittyviä haittavaikutuksia ovat silmän allergiatyyppisten reaktioiden kehittyminen, uupumus ja/tai uneliaisuus sekä suun kuivuminen. Brimonidiinin käyttöön on liittynyt hyvin vähäistä verenpaineen laskua. Joillakin SIMBRINZA-silmätippoja saaneilla potilailla verenpaine nousi samalla tavoin kuin brimonidiinimonoterapian yhteydessä on havaittu.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
SIMBRINZA-silmätippojen mahdollisessa yliannostustapauksessa on annettava oireenmukaista tukihoitoa. Potilaan hengitystiet on pidettävä auki.
SIMBRINZA-silmätippojen sisältämän brintsolamidin vuoksi elektrolyyttitasapainon häiriöitä, asidoosia ja mahdollisesti hermostollisia vaikutuksia voi esiintyä. Seerumin elektrolyyttipitoisuuksia (erityisesti kalium) ja veren pH-arvoa on seurattava.
SIMBRINZA-silmätippojen brimonidiinin tahattomasta suun kautta ottamisesta aikuisilla on vain hyvin rajallisesti tietoa. Ainoa tähän mennessä ilmoitettu haittavaikutus on hypotensio. Raportoidussa tapauksessa hypotensiivistä episodia seurasi rebound-hypertensio.
Muiden suun kautta otettavien alfa-2-agonistien ylinnostuksen on raportoitu aiheuttaneen oireina verenpaineen laskua, heikkoutta, oksentelua, letargiaa, sedaatiota, bradykardiaa, arytmiaa, mioosia, apneaa, hypotoniaa, hypotermiaa, hengityslamaa ja kouristuksia.
Pediatriset potilaat
Pediatrisilla potilailla on ilmoitettu ilmenneen vakavia haittavaikutuksia SIMBRINZA-silmätippojen brimonidiiniainesosan tahattoman nielemisen seurauksena. Potilailla on esiintynytoireina keskushermostolamaa, tyypillisesti ohimenevää koomaa tai tajunnantason laskua, letargiaa, uneliaisuutta, hypotoniaa, bradykardiaa, hypotermiaa, kalpeutta, hengityslamaa ja apneaa, ja heidän tilansa on vaatinut tehohoitoa sairaalassa ja tarvittaessa intubaation. Kaikkien potilaiden on raportoitu toipuneen täysin, yleensä 6–24 tunnin kuluessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: silmälääkkeet, glaukoomalääkkeet ja mioosin aiheuttavat valmisteet, ATC-koodi: S01EC54
Vaikutusmekanismi
SIMBRINZA sisältää kahta vaikuttavaa ainetta, brintsolamidia ja brimonidiinitartraattia. Nämä kaksi ainesosaa alentavat silmänsisäistä painetta potilailla, joilla on avokulmaglaukooma ja silmän hypertensio; tämä vaikutus perustuu siihen, että se vähentää kammionesteen muodostumista processus ciliariksessa silmässä. Vaikka sekä brintsolamidi että brimonidiini alentavat silmänsisäistä painetta vähentämällä kammionesteen muodostumista, niiden vaikutusmekanismit ovat erilaiset.
Brintsolamidi vaikuttaa estämällä hiilihappoanhydraasi (CA-II) -entsyymin toimintaa värekarvaepiteelissä, mikä vähentää bikarbonaatti-ionien muodostumista ja johtaa värekarvaepiteelin poikki tapahtuvan natriumin ja nesteen siirron vähentymiseen ja siten myös kammionesteen muodostumisen vähentymiseen. Brimonidiini, joka on alfa-2-adrenerginen agonisti, estää adenylaattisyklaasientsyymin toimintaa ja vähentää kammionesteen cAMP-riippuvaista muodostumista. Lisäksi brimonidiinin annostelu lisää uveoskleraalista ulosvirtausta.
Farmakodynaamiset vaikutukset
Kliininen teho ja turvallisuus
Monoterapia
Kuuden kuukauden kontrolloidussa, eri tekijöiden vaikutusta tutkivassa kliinisessä tutkimuksessa, johon osallistui 560 avokulmaglaukoomaa (mukaan lukien pseudoeksfoliaatio tai pigmenttidispersio-oireyhtymä) ja/tai silmän hypertensiota sairastavaa potilasta, joiden sairaus oli tutkijan mielestä riittämättömästi hallinnassa monoterapiassa tai jotka saivat jo useita silmänsisäistä painetta alentavia lääkevalmisteita ja joiden keskimääräinen silmänpaineen vuorokautinen lähtöarvo oli 26 mmHg, kahdesti vuorokaudessa aamuisin annettu SIMBRINZA laski vuorokautista silmänpainetta keskimäärin noin 8 mmHg. SIMBRINZA-silmätippojen käyttö sai aikaan tilastollisesti merkitsevän keskimääräisen vuorokautisen silmänsisäisen paineen alenemisen verrattuna brintsolamidin annokseen 10 mg/ml tai brimonidiinin annokseen 2 mg/ml kahdesti vuorokaudessa annosteltuna, ja tämä vaikutus havaittiin kaikilla käynneillä koko tutkimuksen ajan (kuva 1).
Kuva 1 Keskimääräinena vuorokautinen (klo 9:00, +2 tuntia, +7 tuntia) silmänsisäisen paineen muutos lähtötilanteeseen nähden (mmHg) – eri tekijöiden vaikutusta tutkiva tutkimus
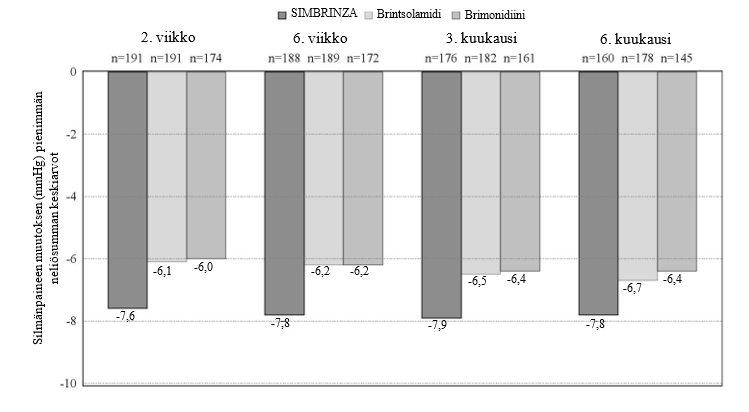
aPienimmän neliösumman keskiarvot johdettiin tilastollisesta mallista, joka huomioi tutkimuspaikan, klo 9:00 lähtötason silmänsisäisen paineen tiedot ja korreloidut silmänsisäisen paineen mittaukset potilaan osalta.
Kaikki hoitojen erot (SIMBRINZA vastaan yksittäiset ainesosat) olivat tilastollisesti merkitseviä, p = 0,0001 tai vähemmän.
Keskimääräinen silmänsisäisen paineen alentuminen kunakin ajankohtana jokaisella käynnillä oli suurempi SIMBRINZA-valmisteen (6–9 mmHg) tapauksessa kuin joko brintsolamidin (5–7 mmHg) tai brimonidiinin (4–7 mmHg) monoterapiassa. Keskimääräinen prosentuaalinen silmänpaineen alentuminen lähtötilanteesta SIMBRINZA-valmistetta käytettäessä vaihteli 23 prosentista 34 prosenttiin. Niiden potilaiden prosenttiosuus, joiden silmänsisäisen paineen arvo oli alle 18 mmHg, oli suurempi SIMBRINZA-ryhmässä kuin brintsolamidiryhmässä 11/12 arvioinnissa 6. kuukauteen saakka ja suurempi SIMBRINZA-ryhmässä kuin brimonidiiniryhmässä kaikissa 12 arvioinnissa 6. kuukauteen saakka. Ensisijaisella tehon arviointikäynnillä, joka tapahtui 3. kuukautena ajankohtana + 2 tuntia (aamun huipputehokkuutta vastaavaan aikaan), alle 18 mmHg:n silmänsisäisen paineen mittausarvon saaneiden potilaiden prosenttiosuus oli 68,8 % SIMBRINZA-ryhmässä, 42,3 % brintsolamidiryhmässä ja 44,0 % brimonidiiniryhmässä.
Kuuden kuukauden kontrolloidussa, vertailukelpoisuutta (non-inferiority) tutkivassa kliinisessä tutkimuksessa, johon osallistui 890 avokulmaglaukoomaa (mukaan lukien pseudoeksfoliaatio tai pigmenttidispersio-oireyhtymä) ja/tai silmän hypertensiota sairastavaa potilasta, joiden sairaus oli tutkijan mielestä riittämättömästi hallinnassa monoterapiassa tai jotka saivat jo useita silmänsisäistä painetta alentavia lääkevalmisteita ja joiden keskimääräinen silmänpaineen vuorokautinen lähtöarvo oli 26–27 mmHg, SIMBRINZA-silmätipat osoittautuivat vertailukelpoisiksi samanaikaisesti annosteltujen brintsolamidin (annos 10 mg/ml) + brimonidiinin (annos 2 mg/ml) kanssa kaikilla käynneillä koko tutkimuksen ajan, kun vertailukelpoisuus määritettiin sen mukaan, mikä oli keskimääräisen vuorokautisen silmänsisäisen paineen vähentyminen lähtötilanteeseen nähden (taulukko 1).
Taulukko 1 Keskimääräisen vuorokautisen silmänsisäisen paineen (mmHg) lähtötasoon nähden tapahtuneen muutoksen vertailu – vertailukelpoisuustutkimus (non-inferiority)
Käynti | SIMBRINZA, k.a.a | Brintsolamidi + brimonidiini, k.a.a | Ero, k.a.a (95 %:n luottamusväli) |
2. viikko | –8,4 (n = 394) | –8,4 (n = 384) | –0,0 (–0,4; 0,3) |
6. viikko | –8,5 (n = 384) | –8,4 (n = 377) | –0,1 (–0,4; 0,2) |
3. kuukausi | –8,5 (n = 384) | –8,3 (n = 373) | –0,1 (–0,5; 0,2) |
6. kuukausi | –8,1 (n = 346) | –8,2 (n = 330) | 0,1 (–0,3; 0,4) |
a Pienimmän neliösumman keskiarvot johdettiin tilastollisesta mallista, joka huomioi tutkimuspaikan, klo 9:00 lähtötason silmänsisäisen paineen tiedot ja korreloidut silmänsisäisen paineen mittaukset potilaan osalta. | |||
Keskimääräiset silmänsisäisen paineen alentumiset lähtötasoon nähden olivat kunakin ajankohtana ja kullakin käynnillä vastaavanlaiset (7–10 mmHg) sekä SIMBRINZA-silmätippoja käytettäessä että annosteltaessa yksittäiset ainesosat samanaikaisesti. Keskimääräinen prosentuaalinen silmänpaineen alentuminen lähtötilanteeseen nähden SIMBRINZA-valmistetta käytettäessä vaihteli 25 prosentista 37 prosenttiin. Niiden potilaiden prosenttiosuus, joiden silmänsisäinen paine oli alle 18 mmHg, oli samanlainen tutkimuspaikkojen kesken samana ajankohtana 6. kuukauteen saakka SIMBRINZA- ja brintsolamidi + brimonidiini -ryhmissä. Ensisijaisella tehon arviointikäynnillä, joka tehtiin 3. kuukautena ajankohtana + 2 tuntia (aamun huipputehokkuutta vastaavaan aikaan), alle 18 mmHg:n silmänsisäisen paineen mittausarvon saaneiden potilaiden prosenttiosuus oli 71,6 % molemmissa tutkimusryhmissä.
Lisähoito
Kliiniset tiedot SIMBRINZA-silmätippojen käytöstä lisähoitona prostaglandiinianalogihoidon (PGA) rinnalla osoittivat myös, että SIMBRINZA + PGA –hoidon teho silmänsisäisen paineen alentamisessa oli parempi kuin pelkän PGA-hoidon teho. Tutkimuksessa CQVJ499A2401 SIMBRINZA + PGA –hoidon (kun PGA oli travoprosti, latanoprosti tai bimatoprosti) teho silmänsisäisen paineen alentamisessa lähtötasoon verrattuna oli parempi kuin vehikkeli + PGA –hoidon teho 6 viikkoa kestäneen hoidon jälkeen. Lähtötasoon nähden mitatun mallivakioidun keskimääräisen vuorokautisen silmänsisäisen paineen muutoksen ero hoitoryhmien välillä oli ‑3,44 mmHg (95 % lv: ‑4,2; ‑2,7, p‑arvo < 0,001).
Kliiniset tiedot SIMBRINZA-silmätippojen käytöstä lisähoitona kiinteäannoksisten travoprosti‑timololimaleaattisilmätippojen (liuos) rinnalla osoittivat myös, että SIMBRINZA + travoprosti‑timololimaleaattisilmätippahoidon teho silmänsisäisen paineen alentamisessa oli parempi kuin pelkän travoprosti‑timololimaleaattisilmätippahoidon teho. Tutkimuksessa CQVJ499A2402 SIMBRINZA + travoprosti‑timololimaleaattisilmätippahoidon teho silmänsisäisen paineen alentamisessa lähtötasoon verrattuna oli parempi kuin vehikkeli + travoprosti-timololimaleaattisilmätippahoidon teho 6 viikkoa kestäneen hoidon jälkeen. Lähtötasoon nähden mitatun mallivakioidun keskimääräisen vuorokautisen silmänsisäisen paineen muutoksen ero hoitoryhmien välillä oli ‑2,15 mmHg (95 % lv: ‑2,8; ‑1,5; p‑arvo < 0,001).
Turvallisuusprofiili SIMBRINZA-silmätippoja lisähoitona käytettäessä oli samankaltainen kuin SIMBRINZA-silmätippoja monoterapiana käytettäessä.
Yli 6 viikkoa kestävän lisähoidon tehosta ja turvallisuudesta ei ole tietoja.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset SIMBRINZA-silmätippojen käytöstä glaukooman ja silmän hypertension hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Paikallisesti silmään annettu brintsolamidi imeytyy sarveiskalvon läpi. Se imeytyy myös systeemiseen verenkiertoon, jossa se sitoutuu voimakkaasti punasolujen hiilihappoanhydraasiin. Plasmapitoisuudet ovat erittäin alhaiset. Kokoverestä eliminoitumisen puoliintumisaika on pidentynyt (yli 100 päivää) ihmisillä hiilihappoanhydraasin punasoluihin sitoutumisen vuoksi.
Paikallisesti annettu brimonidiini imeytyy nopeasti silmään. Kaneilla suurimmat pitoisuudet silmässä saavutettiin useimmissa tapauksissa alle tunnissa. Suurimmat pitoisuudet ihmisen plasmassa olivat alle 1 ng/ml, ja ne saavutettiin alle 1 tunnin kuluessa. Plasmapitoisuudet laskevat noin 2–3 tunnin puoliintumisajalla. Pitkäaikaisessa annostelussa ei tapahdu kumuloitumista.
Paikalliseen silmään antamiseen perustuvassa kliinisessä tutkimuksessa, jossa vertailtiin kaksi tai kolme kertaa päivässä annettujen SIMBRINZA-silmätippojen sekä samalla annostustavalla yksittäin annosteltujen brintsolamidin ja brimonidiinin systeemistä farmakokinetiikkaa, vakaan tilan kokoveren brintsolamidin ja N-desetyylibrintsolamidin farmakokinetiikka olivat samanlaiset yhdistelmävalmisteen ja yksinään annetun brintsolamidin välillä. Samaten yhdistelmästä saadun brimonidiinin vakaan tilan farmakokinetiikka plasmassa oli samankaltainen kuin yksinään annetun brimonidiinin; ainoa poikkeus oli kahdesti päivässä SIMBRINZA-silmätippoja saaneiden hoitoryhmä, jonka osalta keskimääräinen AUC0–12 tuntia oli noin 25 % alempi kuin kahdesti päivässä annostellun pelkän brimonidiinin.
Jakautuminen
Kaneilla tehdyt tutkimukset osoittivat, että brintsolamidin suurimmat pitoisuudet silmässä paikallisen annostelun jälkeen ovat silmän etuosan kudoksissa, kuten sarveiskalvossa, sidekalvossa, kammionesteessä ja värikalvossa/sädekehässä. Sen pidättyminen silmän kudoksiin pidentyy karbonihappoanhydraasiin sitoutumisen vuoksi. Brintsolamidi sitoutuu kohtuullisesti (noin 60 %) ihmisen plasman proteiineihin.
Brimodiinillä on affiniteettiä pigmentillisiä silmän kudoksia ja erityisesti värikalvoa/sädekehää kohtaan sen tunnettujen melaniinin sitomiseen liittyvien ominaisuuksien vuoksi. Kliiniset ja ei-kliiniset turvallisuustiedot osoittavat kuitenkin, että se on hyvin siedettyä ja turvallista pitkäaikaisesti annosteltuna.
Biotransformaatio
Brintsolamidia metaboloivat maksan sytokromi-P450-isoentsyymit ja erityisesti CYP3A4, CYP2A6, CYP2B6, CYP2C8 ja CYP2C9. Pääasiallinen metaboliitti on N-desetyylibrintsolamidi, ja sen jälkeen tärkeimmät ovat N-desmetoksipropyyli- ja O-desmetyylimetaboliitit sekä N-propionihappoanalogi, joka muodostuu O-desmetyylibrintsolamidin N-propyylisivuketjun hapettumisen myötä. Brintsolamidi ja N-desetyylibrintsolamidi eivät estä sytokromi-P450-isoentsyymejä pitoisuuksilla, jotka ovat vähintään 100 kertaa suurimpien systeemisten tasojen yläpuolella.
Maksan aldehydioksidaasi metaboloi laajalti brimodiinia, ja sen päämetaboliitteina muodostuu 2-oksobrimodiinia, 3-oksibrimodiinia ja 2,3-dioksobrimodiinia. Imidatsoliinirenkaan oksidatiivinen pilkkoutumista 5-bromi-6-guanidinokinoksaliiniksi on myös havaittu.
Eliminaatio
Brintsolamidi eliminoituu pääasiassa muuttumattomana virtsaan. Ihmisillä virtsan brintsolamidi ja N-desetyylibrintsolamidi vastasivat noin 60 % ja 6 % annoksesta. Rotilla tehdyissä tutkimuksissa ilmeni tietynasteista sappieritystä (noin 30 %), pääasiassa metaboliitteina.
Brintsolamidi eliminoituu virtsaan pääasiassa metaboliitteina. Rotissa ja apinoilla virtsan metaboliitit vastasivat 60–75 % suun kautta tai laskimoon annostelluista annoksista.
Lineaarisuus/ei-lineaarisuus
Brintsolamidin farmakokinetiikka on luonnostaan ei-lineaarinen karbonihappoanhydraasin kokovereen ja erilaisiin kudoksiin tapahtuvan saturoituvan sitoutumisen vuoksi. Vakaan tilan altistus ei lisäänny annoksesta riippuvaisesti.
Sitä vastoin brimodiinillä on lineaarinen farmakokinetiikka kliinisesti terapeuttisella annosalueella.
Farmakokineettiset/farmakodynaamiset suhteet
SIMBRINZA on tarkoitettu vaikuttamaan paikallisesti silmässä. Ihmisen silmäaltistuksen arviointi tehokkailla annoksilla ei ole mahdollista. Ihmisiltä ei ole määritetty silmänsisäisen paineen farmakokineettistä/farmakodynaamista suhdetta.
Muut erityisryhmät
SIMBRINZA-silmätipoille ei ole tehty iän, rodun ja munuaisten tai maksan vajaatoiminnan vaikutuksia määrittäviä tutkimuksia. Tutkimuksessa, jossa verrattiin japanilaisia ja ei-japanilaisia, Brinzolamidin systeeminen farmakokinetiikka oli samankaltainen molemmissa ryhmissä. . Toisessa tutkimuksessa keskivaikeaa munuaisten vajaatoimintaa sairastavilla tutkimuspotilailla osoitettiin brintsolamidin ja N-desetyylibrintsolamidin systeemisen altistuksen lisäyksen olevan 11,6–2,8-kertainen terveisiin verrattuna. Tämä lääkeaineeseen liittyvän materiaalin vakaan tilan punasolupitoisuuksien lisäys ei laskenut punasolujen karbonihappoanhydraasin aktiivisuutta tasoille, joilla ilmenisi systeemisiä haittavaikutuksia. Yhdistelmävalmistetta ei kuitenkaan suositella potilaille, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 30 ml minuutissa).
Brimonidiinin Cmax, AUC ja eliminoitumisen puoliintumisaika ovat samankaltaiset vanhuksilla (yli 65-vuotiailla) ja nuorilla aikuisilla. Munuaisten ja maksan vajaatoiminnan vaikutuksia brimonidiinin systeemiseen farmakokinetiikkaan ei ole tutkittu. Kun otetaan huomioon vähäinen systeeminen brimonidiinialtistus paikallisen silmään annostelun jälkeen, on odotettavissa, että plasma-altistuksen muutokset eivät ole kliinisesti merkitseviä.
Pediatriset potilaat
Brintsolamidin ja brimonidiinin, yksinään tai yhdessä annosteltuina, systeemistä farmakokinetiikkaa ei ole tutkittu lapsilla.
Prekliiniset tiedot turvallisuudesta
Brintsolamidi
Farmakologista turvallisuutta, kerta-annoksen aiheuttamaa toksisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Haittoja on ei-kliinisissä lisääntymis- ja kehitystoksisuustutkimuksissa todettu vain silloin, kun on käytetty altistusta, joka ylittää suurimman ihmisille käytettävän annostuksen niin huomattavasti, että asialla on kliinisen käytön kannalta vain vähäinen merkitys. Enimmillään 6 mg/kg/vrk brintsolamidia (261 kertaa suositeltua kliinistä vuorokausiannosta 23 µg/kg/vrk suurempi annos) sikiölle toksisilla, suun kautta otettavilla annoksilla saaneilla kaneilla ei ilmennyt vaikutusta sikiön kehitykseen. Rotilla 18 mg/kg/vrk (783 kertaa suositeltua kliinistä vuorokausiannosta suurempi annos) aiheutti sikiön kallon luutumisen lievää heikkenemistä ja sikiön rintalastan kehityshäiriöitä, mutta tätä vaikutusta ei todettu, kun annos oli 6 mg/kg/vrk. Näihin tuloksiin liittyi metabolinen asidoosi, johon puolestaan liittyi emojen kehonpainon lisääntymisen vähentyminen sekä sikiön painon vähentyminen. Sikiöpainojen havaittiin laskevan annokseen liittyen kantavilla emoilla, jotka saivat 2–18 mg/kg/vrk. Jälkeläisille imetyksen aikana haitaton annostus (NAEL) oli 5 mg/kg/vrk.
Brimonidiini
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Bentsalkoniumkloridi
Propyleeniglykoli
Karbomeeri 974P
Boorihappo
Mannitoli
Natriumkloridi
Tyloksapoli
Suolahappo ja/tai natriumhydroksidi (pH:n säätämistä varten)
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
4 viikkoa avaamisesta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SIMBRINZA silmätipat, suspensio
10 mg/ml+2 mg/ml (L:ei) 3 x 5 ml (41,71 €)
PF-selosteen tieto
8 ml:n pyöreät, läpinäkymättömät, matalan tiheyden polyetyleenistä (LDPE) valmistetut pullot, joissa on LDPE-tippakärki ja valkoinen polypropeenikierrekorkki ja jotka sisältävät 5 millilitraa suspensiota.
Kartonkipakkaus, joka sisältää 1 tai 3 pulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai lähes valkoinen homogeeninen suspensio, pH noin 6,5.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia hävittämisen suhteen.
Korvattavuus
SIMBRINZA silmätipat, suspensio
10 mg/ml+2 mg/ml 3 x 5 ml
- Ylempi erityiskorvaus (100 %). Glaukooma (114).
- Peruskorvaus (40 %).
ATC-koodi
S01EC54
Valmisteyhteenvedon muuttamispäivämäärä
01.09.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
