OPSUMIT tabletti, kalvopäällysteinen 10 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää 10 mg masitentaania.
Apuaineet, joiden vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää noin 37 mg laktoosia (monohydraattina) ja noin 0,06 mg soijalesitiiniä (E322).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Aikuiset
Opsumit on tarkoitettu käytettäväksi monoterapiana tai yhdessä muiden lääkkeiden kanssa keuhkovaltimoiden verenpainetaudin (pulmonaaliarteriahypertensio, PAH) pitkäaikaishoitoon WHO:n toimintakykyluokkaan II–III kuuluville aikuispotilaille (ks. kohta Farmakodynamiikka).
Pediatriset potilaat
Opsumit on tarkoitettu käytettäväksi monoterapiana tai yhdessä muiden lääkkeiden kanssa keuhkovaltimoiden verenpainetaudin (pulmonaaliarteriahypertensio, PAH) pitkäaikaishoitoon WHO:n toimintakykyluokkaan II–III kuuluville pediatrisille potilaille, joiden ikä on alle 18 vuotta ja joiden paino on ≥ 40 kg (ks. kohta Farmakodynamiikka).
Ehto
Hoito tulee aloittaa vain pulmonaalihypertension hoitoon perehtyneen lääkärin määräyksestä ja toteuttaa hänen valvonnassaan.
Annostus ja antotapa
Hoito on aloitettava PAH:n hoitoon perehtyneen lääkärin määräyksestä ja valvonnassa.
Annostus
Aikuiset ja alle 18-vuotiaat, vähintään 40 kg:n painoiset pediatriset potilaat
Suositeltu annos on 10 mg kerran vuorokaudessa. Opsumit otetaan joka päivä suunnilleen samaan aikaan päivästä.
Jos Opsumit-annos jää väliin, potilasta kehotetaan ottamaan se mahdollisimman pian ja ottamaan tämän jälkeen seuraava annos säännöllisen aikataulun mukaisesti. Potilaalle on kerrottava, että kahta annosta ei saa ottaa yhtä aikaa, jos annos on jäänyt väliin.
10 mg:n kalvopäällysteisiä tabletteja suositellaan vain vähintään 40 kg:n painoisille pediatrisille potilaille. Alle 40 kg:n painoisille pediatrisille potilaille on saatavissa pienempi vahvuus 2,5 mg:n dispergoituvina tabletteina. Ks. Opsumit dispergoituvien tablettien valmisteyhteenveto.
Erityisryhmät
Iäkkäät
Annosmuutokset eivät ole tarpeen yli 65‑vuotiaille potilaille (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Farmakokineettisten tietojen perusteella annoksen muuttaminen ei ole tarpeen potilaille, joilla on lievä, keskivaikea tai vaikea maksan vajaatoiminta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Masitentaanin käytöstä ei kuitenkaan ole kliinistä kokemusta sellaisten PAH-potilaiden hoidossa, joilla on keskivaikea tai vaikea maksan vajaatoiminta. Opsumit-hoitoa ei saa aloittaa, jos potilaalla on vaikea maksan vajaatoiminta tai kliinisesti merkittävä maksan aminotransferaasipitoisuuksien nousu (yli 3 kertaa viitearvojen yläraja [> 3 x ULN]; ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Farmakokineettisten tietojen perusteella annosta ei tarvitse muuttaa munuaisten vajaatoimintapotilaille. Masitentaanin käytöstä ei ole kliinistä kokemusta sellaisten PAH-potilaiden hoidossa, joilla on vaikea munuaisten vajaatoiminta. Opsumitin käyttöä ei suositella dialyysihoitoa saaville potilaille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Masitentaanin annostusta ja tehoa alle 2 vuoden ikäisillä lapsilla ei ole varmistettu. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Antotapa
Kalvopäällysteisiä tabletteja ei saa murtaa ja ne niellään kokonaisena veden kera. Ne voidaan ottaa ruoan kanssa tai ilman ruokaa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle, soijalle tai kohdassa Apuaineet mainituille apuaineille.
- Raskaus (ks. kohta Raskaus ja imetys).
- Käyttö naisille, jotka voivat tulla raskaaksi ja jotka eivät käytä luotettavaa ehkäisyä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys).
- Imetys (ks. kohta Raskaus ja imetys).
- Vaikea maksan vajaatoiminta (johon saattaa liittyä myös kirroosi) (ks. kohta Annostus ja antotapa).
- Maksan aminotransferaasipitoisuuksien lähtötasoarvot (aspartaattiaminotransferaasi [ASAT] ja/tai alaniiniaminotransferaasi [ALAT] > 3 x viitearvon yläraja [ULN]) (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Masitentaanin hyöty-riskisuhdetta ei ole vahvistettu potilaille, joilla on WHO:n toimintakykyluokan I PAH.
Maksan toiminta
PAH:iin ja endoteliinireseptoriantagonisteihin on liittynyt maksan aminotransferaasiarvojen (ASAT ja ALAT) nousua. Opsumitia ei saa aloittaa potilaille, joilla on vaikea maksan vajaatoiminta tai joiden aminotransferaasiarvot ovat koholla (> 3 × ULN) (ks. kohdat Annostus ja antotapa ja Vasta-aiheet), eikä hoitoa suositella potilaille, joilla on keskivaikea maksan vajaatoiminta. Maksaentsyymikokeet on tehtävä ennen Opsumitin käytön aloittamista.
Potilaita on seurattava maksavaurion merkkien varalta, ja ALAT- sekä ASAT‑pitoisuuksien kuukausittainen seuranta on suositeltavaa. Jos ilmenee pitkittynyttä, selittämätöntä, kliinisesti merkittävää aminotransferaasiarvojen kohoamista tai jos arvojen kohoamiseen liittyy bilirubiiniarvon kohoaminen (> 2 × ULN) tai maksavaurion kliinisiä oireita (esim. keltaisuutta), Opsumitin käyttö on lopetettava.
Jos maksaentsyymiarvot normalisoituvat, Opsumitin käytön aloittamista uudelleen voidaan harkita, jos potilaalla ei ole ollut maksavaurion kliinisiä oireita. Hepatologin konsultointia suositellaan.
Hemoglobiinipitoisuus
Endoteliinireseptoriantagonistien, mukaan lukien masitentaanin, käyttöön on liittynyt hemoglobiinipitoisuuden laskua (ks. kohta Haittavaikutukset). Lumekontrolloiduissa tutkimuksissa masitentaaniin liittyvä hemoglobiinipitoisuuden lasku ei ollut progressiivista. Arvot vakiintuivat ensimmäisten 4–12 hoitoviikon kuluttua ja pysyivät vakaina pitkäaikaishoidon ajan. Masitentaanin ja muiden endoteliinireseptoriantagonistien käytön yhteydessä on raportoitu punasolusiirtoja vaatineita anemiatapauksia. Opsumitin käytön aloittamista ei suositella, jos potilaalla on vaikea anemia. On suositeltavaa, että hemoglobiinipitoisuus mitataan ennen hoidon aloittamista ja mittauksia toistetaan hoidon aikana kliinisen tarpeen mukaan.
Veno-okklusiivinen keuhkosairaus
Vasodilataattorien (pääasiassa prostasykliinien) käytön yhteydessä on raportoitu keuhkopöhöä potilailla, joilla on veno-okklusiivinen keuhkosairaus. Tästä syystä veno-okklusiivisen keuhkosairauden mahdollisuus on pidettävä mielessä, jos PAH-potilaalle tulee keuhkopöhön merkkejä masitentaanihoidon aikana.
Käyttö naisille, jotka voivat tulla raskaaksi
Jos nainen voi tulla raskaaksi, Opsumit-hoito on syytä aloittaa vain, jos raskaus on poissuljettu, potilaalle on annettu asianmukaista ehkäisyneuvontaa ja potilas käyttää luotettavaa ehkäisyä (ks. kohdat Vasta-aiheet ja Raskaus ja imetys). Naiset eivät saa tulla raskaaksi yhden kuukauden aikana Opsumit-hoidon lopettamisesta. Kuukausittaiset raskaustestit Opsumit-hoidon aikana ovat suositeltavia, jotta raskaus voitaisiin todeta varhain.
Voimakkaiden CYP3A4:n induktorien samanaikainen käyttö
Voimakkaiden CYP3A4:n induktorien samanaikainen käyttö voi heikentää masitentaanin tehoa. Masitentaanin ja voimakkaiden CYP3A4:n induktorien (esim. rifampisiinin, mäkikuisman, karbamatsepiinin tai fenytoiinin) samanaikaista käyttöä on vältettävä (ks. kohta Yhteisvaikutukset).
Voimakkaiden CYP3A4:n estäjien samanaikainen käyttö
Varovaisuutta on noudatettava, jos masitentaania käytetään samanaikaisesti voimakkaiden CYP3A4:n estäjien (esim. itrakonatsolin, ketokonatsolin, vorikonatsolin, klaritromysiinin, telitromysiinin, nefatsodonin, ritonaviirin tai sakinaviirin) kanssa (ks. kohta Yhteisvaikutukset).
Kohtalaisten sekä CYP3A4:n että CYP2C9:n estäjien tai CYP3A4:n ja CYP2C9:n estäjien yhdistelmän samanaikainen käyttö
Masitentaanin samanaikaisessa käytössä kohtalaisten sekä CYP3A4:n että CYP2C9:n estäjien (esim. flukonatsoli ja amiodaroni) kanssa pitää olla varovainen (ks. kohta Yhteisvaikutukset).
Masitentaanin samanaikaisessa käytössä sekä kohtalaisen CYP3A4:n estäjän (esim. siprofloksasiini, siklosporiini, diltiatseemi, erytromysiini, verapamiili) että kohtalaisen CYP2C9:n estäjän (esim. mikonatsoli, piperiini) kanssa pitää myös olla varovainen (ks. kohta Yhteisvaikutukset).
Munuaisten vajaatoiminta
Hypotension ja anemian riski saattaa suurentua masitentaanihoidon aikana potilailla, joilla on munuaisten vajaatoiminta. Tämän vuoksi on syytä harkita verenpaineen ja hemoglobiinipitoisuuden seurantaa. Masitentaanin käytöstä ei ole kliinistä kokemusta hoidettaessa PAH-potilaita, joilla on vaikea munuaisten vajaatoiminta. Varovaisuus on tarpeen näiden potilaiden hoidossa. Masitentaanin käytöstä dialyysihoitoa saaville potilaille ei ole kokemusta, joten Opsumitia ei suositella dialyysipotilaille (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Apuaineet, joiden vaikutus tunnetaan
Opsumit sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi‑intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi‑imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Opsumit sisältää soijalesitiiniä. Jos potilas on yliherkkä soijalle, Opsumitia ei pidä käyttää (ks. kohta Vasta-aiheet).
Muut apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
In vitro‑tutkimukset
Sytokromi P450 CYP3A4 on masitentaanin metaboliaan ja sen aktiivisen metaboliitin aprositentaanin muodostukseen osallistuva pääasiallinen entsyymi, ja CYP2C8-, CYP2C9- ja CYP2C19-entsyymit osallistuvat niihin vähän (ks. kohta Farmakokinetiikka). Masitentaani ja sen aktiivinen metaboliitti eivät estä eivätkä indusoi sytokromi P450 ‑entsyymejä kliinisesti merkittävästi.
Masitentaani ja sen aktiivinen metaboliitti eivät kliinisesti merkittävinä pitoisuuksinaan estä maksan ja munuaisten soluunoton kuljettajaproteiineja (mukaan lukien orgaanisten anionien kuljettajapolypeptidit OATP1B1 ja OATP1B3). Masitentaani ja sen aktiivinen metaboliitti eivät ole varsinaisia OATP1B1:n ja OATP1B3:n substraatteja, mutta ne kulkeutuvat maksaan passiivisen diffuusion avulla.
Masitentaani ja sen aktiivinen metaboliitti eivät kliinisesti merkittävinä pitoisuuksinaan estä maksan ja munuaisten ulosvirtauspumppuja (mukaan lukien monilääkeresistenssiproteiini [P‑gp, MDR‑1] ja monilääke- ja toksisten aineiden ekstruusioproteiinit [MATE1 ja MATE2‑K]). Masitentaani ei ole P‑gp/MDR‑1:n substraatti.
Masitentaanilla ja sen aktiivisella metaboliitilla ei ole kliinisesti merkittävinä pitoisuuksinaan yhteisvaikutuksia maksan sappisuolojen kuljetukseen vaikuttavien proteiinien eli sappisuolojen poistopumpun (BSEP) eikä natriumriippuvaisen taurokolaatin yhteiskuljettajapolypeptidin (NTCP) kanssa.
In vivo‑tutkimukset
Voimakkaat CYP3A4‑induktorit
Voimakkaan CYP3A4‑induktorin rifampisiinin samanaikainen käyttö (600 mg/vrk) pienensi vakaan tilan masitentaanialtistusta 79 %, mutta ei vaikuttanut altistukseen aktiiviselle metaboliitille. Masitentaanin tehon heikentyminen on otettava huomioon, jos voimakasta CYP3A4‑induktoria (kuten rifampisiinia) käytetään samanaikaisesti. Masitentaanin ja voimakkaiden CYP3A4‑induktorien samanaikaista käyttöä on vältettävä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ketokonatsoli
Voimakkaan CYP3A4:n estäjän ketokonatsolin käytön aikana (400 mg kerran vuorokaudessa) masitentaanialtistus kasvoi noin kaksinkertaiseksi. Fysiologiaan perustuvan farmakokineettisen mallinnuksen perusteella altistuksen ennustettiin suurenevan noin kolminkertaiseksi ketokonatsolin (200 mg kahdesti vuorokaudessa) käytön aikana. Tällaiseen mallinnukseen liittyvä epävarmuus on otettava huomioon. Altistus masitentaanin aktiiviselle metaboliitille pieneni 26 %. Varovaisuutta on noudatettava, kun masitentaania käytetään samanaikaisesti voimakkaiden CYP3A4:n estäjien kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Flukonatsoli
Kohtalaisen sekä CYP3A4:n että CYP2C9:n estäjän flukonatsolin (400 mg/vrk) käytön aikana masitentaanialtistus voi fysiologiaan perustuvan farmakokineettisen mallinnuksen perusteella kasvaa noin 3,8-kertaiseksi. Altistus masitentaanin aktiiviselle metaboliitille ei kuitenkaan muuttunut kliinisesti oleellisesti. Tällaiseen mallinnukseen liittyvät epävarmuudet pitää kuitenkin ottaa huomioon. Varovaisuutta on noudatettava käytettäessä masitentaania samanaikaisesti kohtalaisten sekä CYP3A4:n että CYP2C9:n estäjien (esim. flukonatsoli ja amiodaroni) kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varovaisuutta on noudatettava myös, kun masitentaania käytetään samanaikaisesti sekä kohtalaisen CYP3A4:n estäjän (esim. siprofloksasiini, siklosporiini, diltiatseemi, erytromysiini, verapamiili) että kohtalaisen CYP2C9:n estäjän (esim. mikonatsoli, piperiini) kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varfariini
Toistuvilla masitentaaniannoksilla (10 mg kerran vuorokaudessa) ei ollut vaikutusta S‑varfariinialtistukseen (CYP2C9:n substraatti) eikä R‑varfariinialtistukseen (CYP3A4:n substraatti) 25 mg:n varfariinikerta-annoksen jälkeen. Masitentaanilla ei ollut vaikutusta varfariinin INR‑arvoon kohdistuvaan farmakodynaamiseen vaikutukseen. Varfariinilla ei ollut vaikutusta masitentaanin ja sen aktiivisen metaboliitin farmakokinetiikkaan.
Sildenafiili
Vakaan tilan sildenafiilialtistus (20 mg kolmesti vuorokaudessa) kasvoi 15 % samanaikaisen masitentaanihoidon (10 mg kerran vuorokaudessa) aikana. Sildenafiili (CYP3A4:n substraatti) ei vaikuttanut masitentaanin farmakokinetiikkaan, mutta altistus masitentaanin aktiiviselle metaboliitille pieneni 15 %. Näiden muutosten ei katsota olevan kliinisesti merkittäviä. Masitentaanin ja sildenafiilin yhdistelmän teho ja turvallisuus osoitettiin PAH-potilailla lumekontrolloidussa tutkimuksessa.
Siklosporiini A
Sekä CYP3A4‑ että OATP‑toimintaa estävän siklosporiini A:n samanaikainen käyttö (100 mg kahdesti vuorokaudessa) ei muuttanut vakaan tilan altistusta masitentaanille eikä sen aktiiviselle metaboliitille kliinisesti merkittävästi.
Hormonaaliset ehkäisyvalmisteet
Masitentaani (10 mg kerran vuorokaudessa) ei vaikuttanut oraalisten ehkäisymenetelmien farmakokinetiikkaan (noretisteroni 1 mg ja etinyyliestradioli 35 mikrog).
Rintasyöpäresistenssiproteiinin (BCRP) substraatit
Masitentaani (10 mg kerran vuorokaudessa) ei vaikuttanut sellaisen lääkkeen farmakokinetiikkaan, joka on BCRP:n substraatti (riosiguaatti 1 mg; rosuvastatiini 10 mg).
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Käyttö naisille, jotka voivat tulla raskaaksi / Ehkäisy miehille ja naisille
Jos nainen voi tulla raskaaksi, Opsumit-hoito on syytä aloittaa vain, jos raskaus on poissuljettu, potilaalle on annettu ehkäisyneuvontaa ja potilas käyttää luotettavaa ehkäisyä (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). Naiset eivät saa tulla raskaaksi yhden kuukauden kuluessa Opsumit-hoidon lopettamisesta. Kuukausittaiset raskaustestit Opsumit-hoidon aikana ovat suositeltavia, jotta raskaus voitaisiin todeta varhain.
Raskaus
Ei ole olemassa tietoja masitentaanin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei vielä tunneta. Opsumit on vasta‑aiheista raskauden aikana ja sellaisille naisille, jotka voivat tulla raskaaksi ja jotka eivät käytä luotettavaa ehkäisyä (ks. kohta Vasta-aiheet).
Imetys
Ei tiedetä, erittyykö masitentaani ihmisen rintamaitoon. Rotalla masitentaani ja sen metaboliitit erittyvät maitoon imetyksen aikana (ks. kohta Prekliiniset tiedot turvallisuudesta). Imeväiseen kohdistuvia riskejä ei voida poissulkea. Opsumit on vasta-aiheista imetyksen aikana (ks. kohta Vasta-aiheet).
Miesten hedelmällisyys
Kivesten siementiehyiden atrofiaa havaittiin uroksilla masitentaanihoidon jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta). Endoteliinireseptoriantagonisteja käyttäneillä potilailla on havaittu siittiömäärän vähenemistä. Masitentaanista voi muiden endoteliinireseptoriantagonistien tavoin aiheutua haittavaikutuksia miesten spermatogeneesiin.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Masitentaanilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Vaikutuksia ajokykyyn ja koneidenkäyttökykyyn ei ole tutkittu. Potilaalla voi kuitenkin esiintyä haittavaikutuksia (kuten päänsärky, hypotensio), jotka voivat vaikuttaa ajokykyyn ja koneidenkäyttökykyyn (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
SERAPHIN-tutkimuksessa yleisimmin ilmoitetut haittavaikutukset olivat nenänielutulehdus (14 %), päänsärky (13,6 %) ja anemia (13,2 %, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Masitentaanin turvallisuutta on arvioitu lumekontrolloidussa pitkäaikaistutkimuksessa 742 aikuisella ja nuorella potilaalla, joilla oli oireinen PAH (SERAPHIN-tutkimus). Hoidon keston keskiarvo oli masitentaani 10 mg ‑ryhmässä 103,9 viikkoa ja lumeryhmässä 85,3 viikkoa. Tässä kliinisessä tutkimuksessa havaitut masitentaaniin liittyvät haittavaikutukset on taulukoitu alla. Taulukossa mainitaan myös valmisteen markkinoilletulon jälkeen havaitut haittavaikutukset.
Esiintymistiheydet on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
Infektiot | Hyvin yleinen | Nenänielutulehdus |
Hyvin yleinen | Keuhkoputkitulehdus | |
Yleinen | Nielutulehdus | |
Yleinen | Influenssa | |
Yleinen | Virtsatieinfektiot | |
Veri ja imukudos | Hyvin yleinen | Anemia, hemoglobiinipitoisuuden pieneneminen5 |
Yleinen | Leukopenia6 | |
Yleinen | Trombosytopenia7 | |
Immuunijärjestelmä | Melko harvinainen | Yliherkkyysreaktiot (esim. angioödeema, kutina, ihottuma)1 |
Hermosto | Hyvin yleinen | Päänsärky |
Verisuonisto | Yleinen | Hypotensio2, punastuminen |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Nenän tukkoisuus1 |
Maksa ja sappi | Yleinen | Aminotransferaasiarvojen suureneminen4 |
Sukupuolielimet ja rinnat | Yleinen | Lisääntynyt kohtuverenvuoto8 |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Turvotus, nesteretentio3 |
1 Tiedot perustuvat yhdistettyihin lumekontrolloituihin tutkimuksiin. 8 Sisältää seuraavat suositellut termit: runsaat kuukautiset, poikkeava kohtuverenvuoto, välivuodot, kohtu‑/emätinverenvuoto, tiheät kuukautiset ja epäsäännölliset kuukautiset. Esiintymistiheys perustuu naisten altistumiseen. | ||
Tiettyjen haittavaikutusten kuvaus
2 Endoteliinireseptoriantagonistien, mukaan lukien masitentaanin, käyttöön on liittynyt hypotensiota. Kaksoissokkoutetussa SERAPHIN-pitkäaikaistutkimuksessa PAH-potilailta hypotensiota raportoitiin 7,0 %:lla masitentaani 10 mg ‑ryhmästä ja 4,4 %:lla lumeryhmästä. Tämä vastasi 3,5:tä tapahtumaa 100:aa potilasvuotta kohti masitentaani 10 mg ‑ryhmässä ja 2,7:ää tapahtumaa 100:aa potilasvuotta kohti lumeryhmässä.
3 Endoteliinireseptoriantagonistien, mukaan lukien masitentaanin, käyttöön on liittynyt turvotusta/nesteretentiota. Kaksoissokkoutetussa SERAPHIN-pitkäaikaistutkimuksessa PAH-potilailla turvotushaittatapahtumien ilmaantuvuus oli masitentaani 10 mg ‑ryhmässä 21,9 % ja lumeryhmässä 20,5 %. Kaksoissokkotutkimuksessa idiopaattista keuhkofibroosia sairastavilla aikuisilla potilailla ääreisosien turvotusta koskevien haittatapahtumien ilmaantuvuus oli masitentaanihoitoryhmässä 11,8 % ja lumehoitoryhmässä 6,8 %. Kahdessa kaksoissokkoutetussa kliinisessä tutkimuksessa aikuisilla potilailla, joilla oli systeemiseen skleroosiin liittyviä haavaumia sormissa tai varpaissa, ääreisosien turvotusta koskevien haittatapahtumien ilmaantuvuus oli masitentaani 10 mg ‑ryhmissä 13,4 %:sta 16,1 %:iin sekä lumeryhmissä 6,2 %:sta 4,5 %:iin.
Poikkeavat laboratorioarvot
4 Maksan aminotransferaasipitoisuudet
Kaksoissokkoutetussa SERAPHIN-tutkimuksessa PAH-potilailla aminotransferaasipitoisuudet (ALAT/ASAT) kohosivat (> 3 × ULN) masitentaani 10 mg ‑ryhmässä 3,4 %:lla ja lumeryhmässä 4,5 %:lla. Masitentaani 10 mg ‑ryhmässä pitoisuudet kohosivat > 5 × ULN 2,5 %:lla potilaista ja lumeryhmässä 2 %:lla potilaista.
5 Hemoglobiini
Kaksoissokkoutetussa SERAPHIN-tutkimuksessa PAH-potilailla masitentaaniin (10 mg) liittyvä hemoglobiinipitoisuuden lasku oli keskimäärin 1 g/dl verrattuna lumeeseen. Hemoglobiinipitoisuuden raportoitiin laskeneen lähtötilanteesta alle arvon 10 g/dl 8,7 %:lla masitentaani 10 mg ‑ryhmässä ja 3,4 %:lla lumeryhmässä.
6 Valkosolut
Kaksoissokkoutetussa SERAPHIN-tutkimuksessa PAH-potilailla masitentaaniin (10 mg) liittyi leukosyyttien määrän keskiarvon lasku lähtötilanteesta (0,7 × 109/l). Lumeryhmässä ei tapahtunut muutoksia.
7 Verihiutaleet
Kaksoissokkoutetussa SERAPHIN-tutkimuksessa PAH-potilailla masitentaaniin (10 mg) liittyi verihiutaleiden määrän keskiarvon lasku (17 × 109/l). Lumeryhmässä keskiarvon alenema oli 11 × 109/l.
Pitkäaikainen turvallisuus
Kaksoissokkoutettuun SERAPHIN-pivotaalitutkimukseen osallistuneista 742 potilaasta 550 potilasta tuli mukaan pitkäkestoiseen avoimeen jatkotutkimukseen. (Avoimen jatkotutkimuksen kohortissa oli mukana 182 potilasta, jotka jatkoivat hoitoa 10 mg:n masitentaaniannoksella, ja 368 potilasta, jotka saivat lumelääkettä tai masitentaania 3 mg:n annoksella ja siirtyivät sen jälkeen saamaan masitentaania 10 mg:n annoksella.)
Pitkäaikaisseurannassa näiden 550 potilaan altistuksen kesto (mediaani) oli 3,3 vuotta ja pisimmillään 10,9 vuotta ja turvallisuusprofiili oli samanlainen kuin edellä kuvatun SERAPHIN-tutkimuksen kaksoissokkoutetun vaiheen aikana.
Pediatriset potilaat (ikä ≥ 2 vuodesta alle 18 vuoteen)
Masitentaanin turvallisuutta arvioitiin TOMORROW-tutkimuksessa, joka oli pediatrisilla PAH-potilailla tehty vaiheen 3 tutkimus. Yhteensä 72 potilasta, jotka olivat iältään ≥ 2 vuodesta alle 18 vuoteen, satunnaistettiin ja sai Opsumit-valmistetta. Keskimääräinen ikä tutkimukseen mukaan tullessa oli 10,5 vuotta (vaihteluväli 2,1 vuotta – 17,9 vuotta). Hoidon keston mediaani satunnaistetun tutkimuksen Opsumit-ryhmässä oli 168,4 viikkoa (vaihteluväli 12,9 viikkoa – 312,4 viikkoa).
Turvallisuusprofiili tässä pediatrisessa potilasjoukossa oli kaiken kaikkiaan yhdenmukainen aikuisten potilasjoukossa havaitun turvallisuusprofiilin kanssa. Pediatrisilla potilailla raportoitiin seuraavia haittavaikutuksia edellä haittavaikutustaulukossa mainittujen lisäksi: ylähengitysteiden infektio (31,9 %), nuha (8,3 %) ja maha-suolitulehdus (11,1 %).
Pediatriset potilaat (ikä ≥ 1 kuukaudesta alle 2 vuoteen)
Mukaan otettiin lisäksi 11 potilasta, jotka olivat iältään ≥ 1 kuukaudesta alle 2 vuoteen ja jotka saivat Opsumit-valmistetta ilman satunnaistamista. Näistä 9 potilasta tuli mukaan TOMORROW-tutkimuksen avoimesta ryhmästä ja 2 japanilaista potilasta PAH3001-tutkimuksesta. TOMORROW-tutkimuksesta tulleiden potilaiden iän vaihteluväli oli mukaantulon ajankohtana 1,2 vuodesta 1,9 vuoteen ja hoidon keston mediaani oli 37,1 viikkoa (vaihteluväli 7,0–72,9 viikkoa). PAH3001-tutkimuksesta tulleiden kahden potilaan iät olivat mukaantulon ajankohtana 21 kuukautta ja 22 kuukautta.
Turvallisuusprofiili tässä pediatristen potilaiden joukossa oli kaiken kaikkiaan yhdenmukainen turvallisuusprofiilin kanssa, joka havaittiin aikuisten potilasjoukossa sekä pediatristen potilaiden joukossa, jossa potilaiden ikä oli ≥ 2 vuodesta alle 18 vuoteen. Alle 2-vuotiaiden pediatristen potilaiden joukosta on kuitenkin saatavana hyvin vähän kliinisiä turvallisuustietoja vahvojen turvallisuutta koskevien päätelmien tekemiseksi.
Masitentaanin turvallisuutta alle 2 vuoden ikäisten lasten hoidossa ei ole varmistettu (ks. kohta Annostus ja antotapa).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista liitteessä V luetellun kansallisen ilmoitusjärjestelmän kautta.
Yliannostus
Masitentaania on annettu enintään 600 mg:n kerta-annoksia terveille aikuisille tutkimushenkilöille. Haittavaikutuksina havaittiin päänsärkyä, pahoinvointia ja oksentelua. Yliannostustapauksessa on aloitettava tavanomaiset tukitoimet tarpeen mukaan. Dialyysistä ei todennäköisesti ole hyötyä, sillä masitentaani sitoutuu vahvasti proteiineihin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: verenpainelääkkeet, keuhkoverenpainetaudin lääkkeet. ATC‑koodi: C02KX04
Vaikutusmekanismi
Endoteliini 1 (ET‑1) ja sen reseptorit (ETA ja ETB) välittävät useita vaikutuksia, kuten vasokonstriktiota, fibroosia, proliferaatiota, hypertrofiaa ja inflammaatiota. PAH:n kaltaisissa taudeissa ilmenee paikallisen ET‑järjestelmänvoimistussäätelyä, ja se edistää verisuonten hypertrofiaa ja elinvaurioiden syntyä.
Masitentaani on suun kautta otettuna aktiivinen, voimakas endoteelireseptorin antagonisti, joka vaikuttaa sekä ETA‑ että ETB‑reseptoreihin. Se sitoutuu noin 100 kertaa selektiivisemmin ETA‑ kuin ETB‑reseptoriin in vitro. Masitentaani kiinnittyy suurella affiniteetilla ja pitkäksi aikaa ihmisen keuhkovaltimoiden sileälihassolujen ET‑reseptoreihin. Tämä ehkäisee sellaisten toisiolähettijärjestelmien endoteliinivälitteistä aktivaatiota, jotka aiheuttavat vasokonstriktiota ja sileälihassolujen proliferaatiota.
Kliininen teho ja turvallisuus
Teho PAH-potilaiden hoidossa
Vaiheen 3 monikeskustutkimukseen (AC‑055‑302/SERAPHIN), joka oli kaksoissokkoutettu, lumekontrolloitu, rinnakkaisryhmissä toteutettu ja tapahtumien määrään perustuva, osallistui 742 potilasta, joilla oli oireinen PAH. Potilaat satunnaistettiin kolmeen hoitoryhmään (lume [N = 250], 3 mg masitentaania [N = 250] tai 10 mg masitentaania [N = 242] kerran vuorokaudessa), joissa arvioitiin sairastuvuuteen ja kuolleisuuteen kohdistuvaa pitkäaikaisvaikutusta.
Lähtötilanteessa valtaosa tutkimukseen osallistuneista potilaista (64 %) sai vakaana annoksena spesifistä hoitoa PAH:iin: joko peroraalisia fosfodiesteraasin estäjiä (61 %) ja/tai inhaloitavia/peroraalisia prostanoideja (6 %).
Ensisijainen päätetapahtuma oli ensimmäiseen sairastuvuus- tai kuolleisuustapahtumaan kulunut aika kaksoissokkoutetun hoidon päättymiseen asti. Määritelmä oli kuolema, eteisseptostomia, keuhkonsiirto, laskimoon (i.v.) tai ihon alle (s.c.) annettavan prostanoidihoidon aloittaminen tai muu PAH:n paheneminen. PAH:n muun pahenemisen määritelmään edellytettiin seuraavia kaikkia kolmea tekijää: 6 minuutin kävelymatkan (6MWD) tuloksen pitkäkestoinen huonontuminen (vähintään 15 % lähtötilanteesta), PAH:n oireiden paheneminen (WHO:n toimintakykyluokan heikentyminen tai sydämen oikean puolen vajaatoiminta) ja uuden PAH-hoidon tarve. Riippumaton arviointikomitea vahvisti kaikki tapahtumat hoidon suhteen sokkoutetusti.
Kaikkien potilaiden elossaoloa seurattiin tutkimuksen päättymiseen asti. Tutkimuksen katsottiin päättyneen, kun ennalta määritelty määrä ensisijaisia päätetapahtumia oli saavutettu. Hoidon päättymisen ja tutkimuksen päättymisen välisenä aikana potilaiden oli mahdollista saada avoimesti masitentaania (10 mg) tai muuta PAH-hoitoa. Kaksoissokkoutetun hoidon kokonaiskeston mediaani oli 115 viikkoa (enintään 188 viikkoa masitentaanihoitoa).
Kaikkien potilaiden iän keskiarvo oli 46 vuotta (ikähaarukka 12–85 vuotta, 20 alle 18‑vuotiasta potilasta, 706 18–74‑vuotiasta ja 16 vähintään 75‑vuotiasta). Valtaosa tutkittavista oli valkoihoisia (55 %) ja naisia (77 %). Noin 52 % kuului WHO:n toimintakykyluokkaan II, 46 % luokkaan III ja 2 % luokkaan IV.
Idiopaattinen ja perinnöllinen PAH olivat yleisimmät etiologiat tutkimuspopulaatiossa (57 %). Seuraavaksi yleisimpiä olivat sidekudostaudista johtuva PAH (31 %), korjattuun yksinkertaiseen synnynnäiseen sydänvikaan liittyvä PAH (8 %) ja muihin syihin liittyvä PAH (lääkevalmisteet ja toksiinit [3 %] ja HIV [1 %]).
Hoitotuloksen päätetapahtumat
Masitentaanihoito (10 mg) pienensi yhdistetyn sairastuvuus- ja kuolleisuuspäätetapahtuman riskiä 45 % (riskitiheyksien suhde [HR] 0,55; 97,5 %:n LV 0,39–0,76; logrank p < 0,0001) hoidon päättymiseen asti verrattuna lumeeseen [kuva 1 ja taulukko 1]. Hoitovaikutus saavutettiin varhain, ja se oli pitkäkestoinen.
Masitentaanin (10 mg) teho ensisijaisen päätetapahtuman suhteen oli johdonmukainen kaikissa alaryhmissä, jotka koskivat ikää, sukupuolta, etnistä taustaa, maantieteellistä aluetta, etiologiaa, monoterapiaa ja yhdistelmähoitoa toisen PAH-hoidon kanssa ja WHO:n toimintakykyluokkaa (I/II ja III/IV).
Kuva 1 Kaplan–Meier-estimaatit ensimmäisestä sairastuvuus-kuolleisuustapahtumasta SERAPHIN-tutkimuksessa
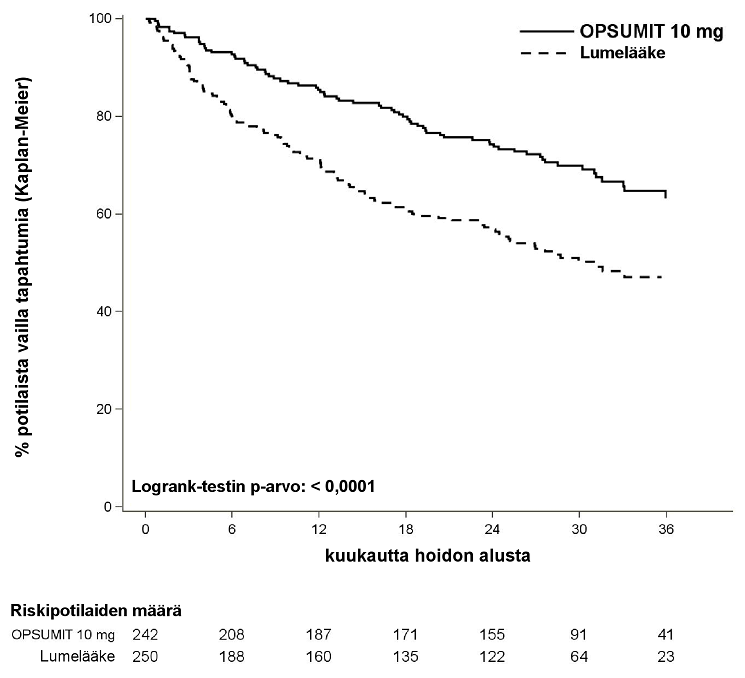
| Taulukko 1: Yhteenveto päätetapahtumista | ||||||
| Päätetapahtumat ja tilastot | Potilaat, joilla oli tapahtumia | Hoitovertailu: masitentaani 10 mg vs lume | ||||
Lume (N = 250) | Masitentaani 10 mg (N = 242) | Absoluuttisen riskin pieneneminen | Suhteellisen riskin pieneneminen (97,5 %:n LV) | HR a (97,5 %:n LV) | Log-rank p‑arvo | |
| Sairastuvuus-kuolleisuusb | 53 % | 37 % | 16 % | 45 % (24 %; 61 %) | 0,55 (0,39; 0,76) | < 0,0001 |
Kuolemac n (%) | 19 (7,6 %) | 14 (5,8 %) | 2 % | 36 % (-42 %; 71 %) | 0,64 (0,29; 1,42) | 0,20 |
PAH:n paheneminen n (%) | 93 (37,2 %) | 59 (24,4 %) | 13 % | 49 % (27 %; 65 %) | 0,51 (0,35; 0,73) | < 0,0001 |
i.v./s.c. prostanoidin aloitus n (%) | 6 (2,4 %) | 1 (0,4 %) | 2 % | |||
| a = perustuu Coxin suhteellisen riskin malliin | ||||||
| b = % potilaista, joilla tapahtuma 36 kk:n kohdalla = 100 × (1 - KM-estimaatti) | ||||||
| c = kokonaiskuolleisuus hoidon päättymiseen mennessä riippumatta aiemmasta pahenemisesta | ||||||
Kuolemantapausten (kaikki syyt) määrä tutkimuksen päättymiseen mennessä oli masitentaani 10 mg ‑ryhmässä 35 ja lumeryhmässä 44 (HR 0,77; 97,5 %:n LV 0,46–1,28).
Hoidon päättymiseen mennessä tapahtuvan PAH:iin liittyvän kuoleman tai sairaalahoidon riski pieneni 50 % (HR 0,50; 97,5 %:n LV 0,34–0,75; logrank p < 0,0001) masitentaanihoitoa (10 mg) saaneilla potilailla (50 tapahtumaa) verrattuna lumeeseen (84 tapahtumaa). 36 kuukauden kohdalla 44,6 % lumetta saaneista potilaista ja 29,4 % masitentaania (10 mg) saaneista (absoluuttisen riskin pienenemä = 15,2 %) oli joutunut sairaalahoitoon PAH:n takia tai kuollut PAH:iin liittyvästä syystä.
Oirepäätetapahtumat
Fyysinen suorituskyky oli toissijainen päätetapahtuma. Masitentaanihoidon (10 mg) yhteydessä lumehoidon suhteen korjattu 6MWD‑tulos oli suurentunut keskimäärin 22 metriä kuukauden 6 kohdalla (97,5 %:n LV 3–41; p = 0,0078). Toimintakykyluokittain arvioituna lumehoidon suhteen korjattu 6MWD‑tulos suureni lähtötilanteen ja kuukauden 6 välisenä aikana toimintakykyluokan III/IV potilailla keskimäärin 37 metriä (97,5 %:n LV 5–69) ja toimintakykyluokan I/II potilailla keskimäärin 12 metriä (97,5 %:n LV ‑8 – 33). Masitentaanihoidon yhteydessä kohentunut 6MWD‑tulos säilyi tutkimuksen keston ajan.
Masitentaanihoito (10 mg) oli parantanut kuukauden 6 kohdalla WHO:n toimintakykyluokan kohentumisen mahdollisuutta 74 % verrattuna lumeeseen (riskisuhde 1,74; 97,5 %:n LV 1,10–2,74; p = 0,0063).
Masitentaani 10 mg paransi SF‑36‑kyselylomakkeella arvioitua elämänlaatua.
Hemodynaamiset päätetapahtumat
Hemodynaamiset parametrit arvioitiin alaryhmässä (lume [N = 67], masitentaani 10 mg [N = 57]) 6 kuukauden hoidon jälkeen. Masitentaania (10 mg) saaneilla potilailla keuhkoverenkierron vastus pieneni 36,5 % (mediaani, 97,5 %:n LV 21,7–49,2 %) ja sydämen minuuttitilavuusindeksi suureni 0,58 l/min/m2 (97,5 %:n LV 0,28–0,93 l/min/m2) verrattuna lumeeseen.
PAH:n pitkäaikaistulokset
Pitkäaikaisseurannassa oli 242 potilasta, jotka saivat SERAPHIN-tutkimuksen kaksoissokkoutetussa vaiheessa hoitoa 10 mg:n masitentaaniannoksilla. Näistä 182 potilasta jatkoi masitentaanihoitoa avoimessa jatkotutkimuksessa (SERAPHIN OL) (DB/OL-kohortti), ja elossaolon Kaplan–Meierin estimaatit olivat 1, 2, 5, 7 ja 9 vuoden aikapisteissä vastaavasti 95 %, 89 %, 73 %, 63 % ja 53 %. Seuranta-ajan mediaani oli 5,9 vuotta.
Pediatriset potilaat
Teho pediatrisilla potilailla perustuu pääasiassa ekstrapolointiin, joka tehtiin aikuisilla todettua tehokasta annosaluetta vastaavan altistuksen pohjalta, kun huomioitiin sairauden samankaltaisuus lapsilla ja aikuisilla, sekä jäljempänä kuvatusta vaiheen 3 TOMORROW-tutkimuksesta tueksi saatuihin tehoa ja turvallisuutta koskeviin tietoihin.
Vaiheen 3 avoin, satunnaistettu monikeskustutkimus, jossa oli avoin yhden ryhmän jatkovaihe (TOMORROW), tehtiin masitentaanin farmakokinetiikan, tehon ja turvallisuuden arvioimiseksi oireista keuhkovaltimoiden verenpainetautia (PAH) sairastavilla pediatrisilla potilailla.
Ensisijainen päätetapahtuma oli farmakokineettisten ominaisuuksien selvittäminen (ks. kohta Farmakokinetiikka).
Keskeinen toissijainen yhdistetty päätetapahtuma oli satunnaistamisen ja tutkimuksen keskeisen jakson lopussa (end of the core period, EOCP) tehtävän käynnin välillä ilmenneeseen ensimmäiseen CEC-toimikunnan (Clinical Events Committee) vahvistamaan sairauden etenemiseen kulunut aika; sairauden etenemiseksi määriteltiin kuolema (mistä tahansa syystä), eteisseptostomia tai Pottsin suntti, keuhkonsiirtojonoon pääsy tai sairaalahoito PAH:n pahenemisen vuoksi tai PAH:n kliininen paheneminen. PAH:n kliiniseksi pahenemiseksi määriteltiin uuden PAH-spesifisen hoidon tai laskimoon annettavan diureettihoidon tai jatkuvan hapen käytön tarve tai aloittaminen JA vähintään yksi seuraavista: WHO:n toimintakykyluokan huononeminen tai pyörtymisten ilmaantuminen ensimmäistä kertaa tai paheneminen, vähintään kahden PAH-oireen ilmaantuminen ensimmäistä kertaa tai paheneminen tai suun kautta otettaviin diureetteihin reagoimattoman sydämen oikean puolen vajaatoiminnan merkkien ilmaantuminen ensimmäistä kertaa tai paheneminen.
Muita toissijaisia päätetapahtumia olivat ensimmäiseen CEC-toimikunnan vahvistamaan PAH:n vuoksi tapahtuneeseen sairaalahoitoon kulunut aika ja CEC-toimikunnan vahvistamaan PAH:sta aiheutuneeseen kuolemaan kulunut aika satunnaistamisen ja tutkimuksen keskeisen jakson lopun välillä, mistä tahansa syystä aiheutuneeseen kuolemaan kulunut aika satunnaistamisen ja tutkimuksen keskeisen jakson lopun välillä sekä muutos WHO:n toimintakykyluokassa ja B-tyypin natriureettista N-terminaalista propeptidiä (NT‑proBNP) koskevissa tuloksissa.
Pediatriset potilaat (ikä ≥ 2 vuodesta alle 18 vuoteen)
Yhteensä 148 potilasta, jotka olivat iältään ≥ 2 vuodesta < 18 vuoteen, satunnaistettiin suhteessa 1:1 saamaan joko masitentaania tai tavanomaista hoitoa. Tavanomainen hoito käsitti PAH:n epäspesifisen hoidon ja/tai enintään kaksi PAH-spesifistä lääkehoitoa (mukaan lukien toisen endoteliinireseptoriantagonistin), pois lukien masitentaanin ja laskimoon tai ihon alle annettavat prostanoidit. Keskimääräinen ikä oli 9,8 vuotta (vaihteluväli 2,1 vuotta – 17,9 vuotta), ja 35 potilasta (23,6 %) oli iältään ≥ 2 vuodesta < 6 vuoteen, 61 potilasta (41,2 %) oli iältään ≥ 6 vuodesta < 12 vuoteen ja 52 potilasta (35,1 %) oli iältään ≥ 12 vuodesta < 18 vuoteen. Valtaosa potilaista oli valkoihoisia (51,4 %) ja tyttöjä (59,5 %). Potilaiden WHO:n toimintakykyluokka oli I (25,0 %), II (56,1 %) tai III (18,9 %).
Yleisin etiologia tutkimuspotilasjoukossa oli idiopaattinen PAH (48,0 %) ja sen jälkeen postoperatiiviseen synnynnäiseen sydänvikaan liittyvä PAH (28,4 %), sivulöydöksenä todettuun synnynnäiseen sydänvikaan liittyvä PAH (17,6 %), periytyvä PAH (4,1 %) ja sidekudossairauteen liittyvä PAH (2,0 %). Sivulöydöksenä todettu synnynnäinen sydänvika käsitti tyypillisesti vain vähäiset sivulöydöksenä todetut viat, kuten oikean kammion kohonneen täyttöpaineen aiheuttavan trikuspidaaliläppävuodon, vasemman kammion kohonneen täyttöpaineen aiheuttavan trikuspidaaliläppävuodon, eteisväliseinän aukon, kammioväliseinän aukon ja avoimen valtimotiehyen, joista minkään ei katsota olevan PAH:n vaikeusastetta selittävä tekijä.
Hoidon keskimääräinen kesto satunnaistetussa tutkimuksessa oli masitentaanihoitoa saaneessa ryhmässä 183,4 viikkoa ja tavanomaista hoitoa saaneessa ryhmässä 130,6 viikkoa.
Masitentaanihoitoa saaneessa ryhmässä havaittiin vähemmän keskeistä toissijaista päätetapahtumaa eli CEC-toimikunnan vahvistamaa sairauden etenemistä koskevia tapahtumia (21 tapahtumaa / 73 potilasta, 29 %) verrattuna tavanomaista hoitoa saaneeseen ryhmään (24 tapahtumaa / 75 potilasta, 32 %), absoluuttisen riskin vähenemä 3 %. Riskitiheyksien suhde (HR) oli 0,828 (95 %:n LV 0,460; 1,492; kaksitahoinen ositettu p‑arvo = 0,567). Numeerinen muutos hyödyn suuntaan liittyi pääasiassa PAH:n kliiniseen pahenemiseen.
Muut toissijaiset tehon analyysit
Kummassakin ryhmässä havaittiin yhtä monta ensimmäiseen vahvistettuun PAH:n vuoksi tapahtuneeseen sairaalahoitoon liittyvää tapahtumaa (masitentaani 11 vs. tavanomainen hoito 11; korjattu riskitiheyksien suhde (HR) = 0,912, 95 %:n LV = [0,393; 2,118]). CEC-toimikunnan vahvistamaan PAH:sta aiheutuneeseen kuolemaan ja mistä tahansa syystä aiheutuneeseen kuolemaan kuluneen ajan osalta masitentaanihoitoa saaneessa ryhmässä havaittiin yhteensä 7 kuolemaa (joista CEC-toimikunnan arvion mukaan 6 johtui PAH:sta) verrattuna 6 kuolemaan (joista CEC-toimikunnan arvion mukaan 4 johtui PAH:sta) tavanomaista hoitoa saaneessa ryhmässä.
Numeerisesti suuremmalla osalla masitentaaniryhmän potilaista kuin tavanomaista hoitoa saaneen ryhmän potilaista raportoitiin WHO:n toimintakykyluokka I tai II viikon 12 aikapisteessä (masitentaaniryhmässä 88,7 % verrattuna 81,7 %:iin tavanomaista hoitoa saaneessa ryhmässä) ja viikon 24 aikapisteessä (masitentaaniryhmässä 90,0 % verrattuna 82,5 %:iin tavanomaista hoitoa saaneessa ryhmässä).
Masitentaanihoito oli yleensä pienentänyt NT-proBNP-pitoisuuksia (pmol/l) prosentuaalisesti lähtötasosta viikon 12 aikapisteessä tavanomaista hoitoa saaneeseen ryhmään verrattuna (geometristen keskiarvojen suhde: 0,72; 95 %:n LV: 0,49; 1,05), mutta tulokset eivät olleet tilastollisesti merkitseviä (kaksitahoinen p‑arvo 0,086). Ei-merkitsevyys oli vähemmän selkeää viikon 24 aikapisteessä (geometristen keskiarvojen suhde: 0,97; 95 %:n LV: 0,66; 1,43; kaksitahoinen p‑arvo 0,884).
Tehoa koskevat tulokset potilailla, jotka olivat iältään ≥ 2 vuodesta alle 18 vuoteen, olivat samankaltaisia kuin aikuisilla potilailla.
Pediatriset potilaat (ikä ≥ 1 kuukaudesta alle 2 vuoteen)
Mukaan otettiin lisäksi 11 potilasta, jotka olivat iältään ≥ 1 kuukaudesta alle 2 vuoteen ja jotka saivat masitentaania ilman satunnaistamista. Näistä 9 potilasta tuli mukaan TOMORROW-tutkimuksen avoimesta ryhmästä ja 2 japanilaista potilasta PAH3001-tutkimuksesta. PAH3001 oli vaiheen 3 avoin, yhden ryhmän monikeskustutkimus japanilaisilla pediatrisilla PAH-potilailla (ikä ≥ 3 kuukaudesta < 15 vuoteen), ja se tehtiin masitentaanin farmakokinetiikan ja tehon arvioimiseksi.
Lähtötilanteessa kuusi TOMORROW-tutkimuksesta mukaan tullutta potilasta sai parhaillaan hoitoa PDE5:n estäjällä. Potilaiden ikä mukaan tullessa oli 1,2 vuotta – 1,9 vuotta. Potilaiden WHO:n toimintakykyluokka oli joko II (4) tai I (5). Yleisin etiologia oli PAH:iin liittyvä synnynnäinen sydänvika (5 potilasta) ja sen jälkeen idiopaattinen PAH (4 potilasta). Alkuvaiheessa annettu vuorokausiannos oli 2,5 mg masitentaania, kunnes potilas täytti 2 vuotta. Kun seuranta-ajan mediaani oli 37,3 viikkoa, yhdelläkään potilaalla ei ollut todettu CEC-toimikunnan vahvistamaa sairauden etenemiseen liittyvää tapahtumaa, CEC‑toimikunnan vahvistamaa sairaalahoitoa PAH:n vuoksi, CEC-toimikunnan vahvistamaa PAH:sta aiheutunutta kuolemaa eikä mistä tahansa syystä tapahtunutta kuolemaa. NT‑proBNP-pitoisuudet olivat pienentyneet viikon 12 aikapisteessä 42,9 % (n = 6), viikon 24 aikapisteessä 53,2 % (n = 5) ja viikon 36 aikapisteessä 26,1 % (n = 6).
Lähtötilanteessa yksi PAH3001-tutkimuksesta mukaan tullut japanilainen potilas sai parhaillaan hoitoa PDE5:n estäjällä. Molemmat japanilaiset potilaat olivat poikia ja heidän ikänsä mukaan tullessa oli 21 kuukautta ja 22 kuukautta. Potilaiden Panama-toimintakykyluokka oli I ja II ja pääasiallinen etiologia oli leikkauksenjälkeinen PAH. Viikon 24 aikapisteessä NT‑proBNP-pitoisuuksien havaittiin pienentyneen lähtötilanteesta 3,894 pmol/l ja 16,402 pmol/l.
Altistuksen vastaavuutta aikuisten potilaiden altistuksen kanssa ei ole varmistettu tässä ikäryhmässä (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Farmakokinetiikka
Masitentaanin ja sen aktiivisen metaboliitin farmakokinetiikka on valtaosin dokumentoitu terveillä aikuisilla tutkittavilla. Masitentaanialtistus PAH-potilailla oli noin 1,2‑kertainen verrattuna terveisiin tutkittaviin. Altistus aktiiviselle metaboliitille, joka on noin 5 kertaa vähemmän potentti kuin masitentaani, oli noin 1,3 kertaa suurempi verrattuna terveisiin tutkittaviin. Taudin vaikeusaste ei vaikuttanut masitentaanin farmakokinetiikkaan PAH-potilailla.
Toistuvan annon jälkeen masitentaanin farmakokinetiikka on suhteessa annokseen enintään 30 mg:aan asti.
Imeytyminen
Masitentaanin huippupitoisuudet plasmassa saavutetaan kalvopäällystettyjä tabletteja ja dispergoituvia tabletteja käytettäessä noin 8–9 tunnin kuluttua lääkkeen annosta. Tämän jälkeen masitentaanin ja sen aktiivisen metaboliitin pitoisuus plasmassa pienenee hitaasti. Masitentaanin näennäinen eliminaation puoliintumisaika on noin 16 tuntia ja aktiivisen metaboliitin noin 48 tuntia.
Terveillä tutkittavilla ruoka ei vaikuta altistukseen masitentaanille eikä sen aktiiviselle metaboliitille, joten masitentaani voidaan ottaa ruoan kanssa tai ilman ruokaa.
Jakautuminen
Masitentaani ja sen aktiivinen metaboliitti aprositentaani sitoutuvat voimakkaasti plasman proteiineihin (> 99 %), pääasiassa albumiiniin ja vähäisemmässä määrin happamaan alfa‑1‑glykoproteiiniin. Masitentaani ja sen aktiivinen metaboliitti aprositentaani jakautuvat tehokkaasti kudoksiin näennäisen jakautumistilavuuden (Vss/F) perusteella (masitentaani noin 50 l ja aprositentaani noin 40 l).
Biotransformaatio
Masitentaanilla on neljä ensisijaista metaboliareittiä. Sulfamidin oksidatiivinen depropylaatio tuottaa farmakologisesti aktiivisen metaboliitin aprositentaanin. Reaktio on riippuvainen sytokromi P450 ‑järjestelmästä, pääosin CYP3A4‑isoentsyymistä (noin 99 %) ja vähäisemmässä määrin CYP2C8‑, CYP2C9‑ ja CYP2C19‑isoentsyymeistä. Aktiivinen metaboliitti kiertää ihmisen plasmassa ja saattaa osallistua farmakologiseen vaikutukseen. Muiden metaboliareittien tuotteilla ei ole farmakologista vaikutusta. Näissä reiteissä CYP2C9:n osuus on merkittävä ja CYP2C8:n, CYP2C19:n ja CYP3A4:n osuus on pieni.
Eliminaatio
Masitentaani eliminoituu vasta voimakkaan metaboloitumisen jälkeen. Suuri osa (noin 50 % annoksesta) erittyy virtsaan.
Vertailu kalvopäällysteisten tablettien ja dispergoituvien tablettien välillä
28 terveellä tutkittavalla tehdyssä tutkimuksessa varmistettiin 10 mg:n masitentaaniannoksen bioekvivalenssi kalvopäällystetyn tabletin ja neljän 2,5 mg:n dispergoituvan tabletin välillä.
Erityisryhmät
Iällä, sukupuolella tai etnisellä taustalla ei ole kliinisesti merkittävää vaikutusta masitentaanin ja sen aktiivisen metaboliitin farmakokinetiikkaan.
Munuaisten vajaatoiminta
Masitentaanialtistus kasvoi 1,3‑kertaiseksi ja altistus aktiiviselle metaboliitille 1,6‑kertaiseksi aikuisilla potilailla, joilla on vaikea munuaisten vajaatoiminta. Tämän nousun ei katsota olevan kliinisesti merkittävää (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta
Aikuisilla tutkittavilla altistus masitentaanille pieneni 21 % ja aktiiviselle metaboliitille 20 % lievän maksan vajaatoiminnan yhteydessä, altistus masitentaanille 34 % ja aktiiviselle metaboliitille 25 % keskivaikean maksan vajaatoiminnan yhteydessä ja masitentaanille 6 % ja aktiiviselle metaboliitille 25 % vaikean maksan vajaatoiminnan yhteydessä. Tämän laskun ei katsota olevan kliinisesti merkittävää (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat (ikä ≥ 1 kuukaudesta alle 18 vuoteen)
Masitentaanin ja sen aktiivisen metaboliitin aprositentaanin farmakokinetiikkaa selvitettiin 47 pediatrisella potilaalla, joiden ikä oli ≥ 2 vuotta, ja 11 potilaalla, joiden ikä oli ≥ 1 kuukaudesta alle 2 vuoteen.
Painoon perustuvat masitentaanihoito-ohjelmat johtivat pediatrisilla potilailla (ikä 2 vuodesta alle 18 vuoteen) havaittuihin/simuloituihin altistuksiin, jotka olivat verrannollisia 10 mg kerran päivässä saaneilla aikuisilla PAH-potilailla ja terveillä tutkittavilla havaittujen altistusten kanssa.
Ikäryhmässä ≥ 1 kuukaudesta alle 2 vuoteen ei saavutettu masitentaanialtistuksia, jotka olisivat verrattavissa altistuksiin 10 mg kerran päivässä saaneilla aikuisilla PAH-potilailla (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Koiralla masitentaani alensi verenpainetta ihmisen terapeuttisen altistuksen kaltaisilla altistuksilla. Sepelvaltimoiden intiman paksunemista havaittiin ihmisen altistukseen verrattuna 17‑kertaisen altistuksen yhteydessä 4–39 hoitoviikon kuluttua. Löydöksen ei katsota olevan merkittävä ihmisille lajispesifisen herkkyyden ja turvallisuusmarginaalin perusteella.
Maksan painon suurenemista ja hepatosellulaarista hypertrofiaa havaittiin hiirillä, rotilla ja koirilla masitentaanihoidon jälkeen. Muutokset olivat valtaosin korjautuvia, ja niiden katsottiin johtuvan maksan haitattomasta sopeutumisesta lisääntyneeseen metaboliatarpeeseen.
Masitentaani aiheutti kaikkina annoksina hyvin vähäistä tai lievää nenäontelon limakalvon hyperplasiaa ja limakalvonalaisia tulehduksellisia infiltraatteja karsinogeenisuustutkimuksessa hiirillä. Nenäontelolöydöksiä ei havaittu 3 kk:n pituisessa toksisuustutkimuksessa hiirillä eikä rotta- eikä koiratutkimuksissa.
Masitentaani ei ollut genotoksista tavanomaisissa in vitro- ja in vivo ‑kokeissa. Masitentaani ei ollut fototoksista in vivo kerta-annoksen jälkeen, kun altistus oli enintään 24‑kertainen ihmisen altistukseen verrattuna. Kahden vuoden pituisissa karsinogeenisuustutkimuksissa ei havaittu karsinogeenisuutta ihmisen altistukseen verrattuna 18‑kertaisen altistuksen yhteydessä rotilla eikä 116‑kertaisen altistuksen yhteydessä hiirillä.
Kivesten siementiehyiden laajentumista havaittiin pitkäaikaisissa toksisuustutkimuksissa urosrotilla (turvallisuusmarginaali 11,6) ja uroskoirilla (5,8). Ilmiö oli täysin korjautuva. Kahden hoitovuoden jälkeen kivesten siementiehyiden atrofiaa havaittiin rotilla, kun altistus oli 4‑kertainen ihmisen altistukseen verrattuna. Hypospermatogeneesiä todettiin elinikäisessä karsinogeenisuustutkimuksessa rotalla ja toistuvaisannosten toksisuustutkimuksissa koirilla. Altistusten mukaiset turvallisuusmarginaalit ovat 9,7 (rotilla) ja 23 (koirilla). Hedelmällisyyttä koskeva turvallisuusmarginaali oli urosrotilla 18 ja naarasrotilla 44. Hiirillä ei havaittu kiveslöydöksiä enintään kahden vuoden hoidon jälkeen.
Masitentaani oli teratogeenista kaneille ja rotille kaikilla tutkituilla annoksilla. Kummallakin lajilla havaittiin kardiovaskulaarisia poikkeavuuksia ja alaleukaluun kaaren fuusioitumiseen liittyviä poikkeavuuksia.
Masitentaanin anto naarasrotille tiineyden myöhäisvaiheen ja imetyksen aikana heikensi poikasten elossaoloa ja jälkeläisten lisääntymiskykyä, kun emon altistus oli 5‑kertainen verrattuna ihmisen altistukseen. Jälkeläiset altistuivat masitentaanille tiineyden loppuvaiheessa ja maidon välityksellä imeväiskauden aikana.
Valmisteen anto nuorille rotille syntymän jälkeen elinpäivinä 4–114 aiheutti painonnousun hidastumista, joka vaikutti sekundaarisesti kehitykseen (kivesten laskeutumisen lievä viive, korjautuva pitkien luiden kasvun hidastuminen, kiimakierron pidentyminen). Alkiokuolemien lievää lisääntymistä sekä ennen implantaatiota että sen jälkeen, poikasten keskimäärän pienentymistä ja kivesten ja lisäkivesten painon pienentymistä havaittiin, kun altistus oli 7‑kertainen verrattuna ihmisen altistukseen. Kivesten siementiehyiden atrofiaa ja vähäisiä vaikutuksia lisääntymismuuttujiin ja sperman morfologiaan havaittiin, kun altistus oli 3,8‑kertainen verrattuna ihmisen altistukseen.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Laktoosimonohydraatti
Mikrokiteinen selluloosa (E460i)
Natriumtärkkelysglykolaatti (tyyppi A)
Povidoni
Magnesiumstearaatti (E470b)
Polysorbaatti 80 (E433)
Kalvopäällyste
Poly(vinyylialkoholi) (E1203)
Titaanidioksidi (E171)
Talkki (E553b)
Soijalesitiini (E322)
Ksantaanikumi (E415)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Säilytys
Säilytä alle 30 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OPSUMIT tabletti, kalvopäällysteinen
10 mg (L:kyllä) 30 fol (2491,46 €)
PF-selosteen tieto
Valkoinen, läpinäkymätön PVC/PE/PVdC/Alumiini-läpipainopakkaus pahvipakkauksessa, jossa 15 tai 30 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
5,5 mm, pyöreä, kaksoiskupera, valkoinen tai luonnonvalkoinen kalvopäällysteinen tabletti, jossa on molemmilla puolilla kaiverrus ”10”.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
OPSUMIT tabletti, kalvopäällysteinen
10 mg 30 fol
- Peruskorvaus (40 %).
ATC-koodi
C02KX04
Valmisteyhteenvedon muuttamispäivämäärä
16.12.2025
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
