AGAMREE oraalisuspensio 40 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Yleinen
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi millilitra suspensiota sisältää 40 mg vamorolonia.
Apuaine, jonka vaikutus tunnetaan
Yksi millilitra suspensiota sisältää 1 mg natriumbentsoaattia (E 211).
Täydellinen apuaineluettelo, katso kohta Apuaineet.
Lääkemuoto
Oraalisuspensio.
Kliiniset tiedot
Käyttöaiheet
AGAMREE on tarkoitettu Duchennen lihasdystrofian (DMD) hoitoon vähintään 4-vuotiailla potilailla.
Ehto
Hoidon saa aloittaa vain erikoislääkäri, jolla on kokemusta Duchennen tai Beckerin lihasdystrofian hoidosta.
Annostus ja antotapa
AGAMREE-hoidon saavat aloittaa ainoastaan erikoislääkärit, joilla on kokemusta
Duchennen lihasdystrofian hoidosta.
Annostus
Suositeltu annos vamorolonia on 6 mg/kg kerran vuorokaudessa alle 40 kg painavilla potilailla.
Vähintään 40 kg painavilla potilailla vamorolonin suositeltu annos on 240 mg (vastaa 6 ml:aa) kerran vuorokaudessa.
Vuorokausiannos voidaan titrata pienemmäksi arvoon 4 mg/kg/vrk tai 2 mg/kg/vrk yksilöllisen sietokyvyn perusteella. Potilaille on annettava annosalueen suurinta siedettävää annosta.
Taulukko 1: Annostustaulukko
| 6 mg/kg/vrk | 4 mg/kg/vrk | 2 mg/kg/vrk | ||||
| Paino (kg) | Annos (mg) | Annos (ml) | Annos (mg) | Annos (ml) | Annos (mg) | Annos (ml) |
| 12–13 | 72 | 1,8 | 48 | 1,2 | 24 | 0,6 |
| 14–15 | 84 | 2,1 | 56 | 1,4 | 28 | 0,7 |
| 16–17 | 96 | 2,4 | 64 | 1,6 | 32 | 0,8 |
| 18–19 | 108 | 2,7 | 72 | 1,8 | 36 | 0,9 |
| 20–21 | 120 | 3 | 80 | 2 | 40 | 1 |
| 22–23 | 132 | 3,3 | 88 | 2,2 | 44 | 1,1 |
| 24–25 | 144 | 3,6 | 96 | 2,4 | 48 | 1,2 |
| 26–27 | 156 | 3,9 | 104 | 2,6 | 52 | 1,3 |
| 28–29 | 168 | 4,2 | 112 | 2,8 | 56 | 1,4 |
| 30–31 | 180 | 4,5 | 120 | 3 | 60 | 1,5 |
| 32–33 | 192 | 4,8 | 128 | 3,2 | 64 | 1,6 |
| 34–35 | 204 | 5,1 | 136 | 3,4 | 68 | 1,7 |
| 36–37 | 216 | 5,4 | 144 | 3,6 | 72 | 1,8 |
| 38–39 | 228 | 5,7 | 152 | 3,8 | 76 | 1,9 |
| 40 kg tai enemmän | 240 | 6 | 160 | 4 | 80 | 2 |
Vamoroloniannosta ei saa pienentää äkillisesti, jos hoitoa on annettu yli viikon ajan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Annosta on pienennettävä vähitellen viikkojen kuluessa pienentämällä sitä kerrallaan noin 20 prosentilla edelliseen annostasoon verrattuna. Jokaisen pienennysvaiheen kesto on mukautettava yksilöllisen sietokyvyn mukaan.
Erityisryhmät
Maksan vajaatoiminta
Annosta ei ole tarpeen muuttaa potilailla, joilla on lievä maksan vajaatoiminta (Child-Pugh-luokka A).
Vamorolonin suositeltu vuorokausiannos keskivaikeaa maksan vajaatoimintaa (Child-Pugh-luokka B) sairastaville potilaille on 2 mg/kg/vrk korkeintaan 40 kg painaville ja 80 mg potilaille, joiden paino on vähintään 40 kg (ks. kohta Farmakokinetiikka). Potilaita, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C), ei saa hoitaa vamorolonilla. Ks. kohta Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet.
Pediatriset potilaat
AGAMREE-valmisteen turvallisuutta ja tehoa alle 4 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Antotapa
AGAMREE on tarkoitettu otettavaksi suun kautta. AGAMREE on mieluiten otettava ruoan kanssa (ks. kohta Farmakokinetiikka).
Oraalisuspensio on sekoitettava uudelleen ravistamalla pulloa ennen antamista.
Vain lääkevalmisteen mukana toimitettua oraaliruiskua saa käyttää AGAMREE-annoksen mittaamiseen millilitroina. Kun tarvittava annos on vedetty oraaliruiskuun, se annetaan suoraan suuhun.
Käytön jälkeen oraaliruisku puretaan, huuhdellaan kylmän juoksevan vesijohtoveden alla, ja sen annetaan ilmakuivua. Sitä tulee säilyttää laatikossaan seuraavaan käyttöön saakka. Oraaliruiskua voidaan käyttää enintään 45 päivän ajan, minkä jälkeen se on hävitettävä ja otetaan käyttöön toinen pakkauksessa oleva oraaliruisku.
AGAMREE-oraalisuspension anto enteraalisen ruokintaletkun kautta
AGAMREE-oraalisuspensio voidaan antaa enteraalisen ruokintaletkun kautta (ks. kohta Käyttö- ja käsittelyohjeet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Vaikea maksan vajaatoiminta (Child-Pugh-luokka C).
Elävien tai elävien heikennettyjen rokotteiden käyttö hoitoa edeltävien kuuden viikon aikana ja hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Endokriinisen toiminnan muutokset
Vamoroloni aiheuttaa muutoksia endokriinisissä toiminnoissa, etenkin pitkäaikaisessa käytössä.
Lisäksi potilailla, joilla on muutoksia kilpirauhasen toiminnassa tai feokromosytooma, endokriinisten vaikutusten riski voi olla suurentunut.
Lisämunuaisen vajaatoiminnan riski
Vamoroloni aiheuttaa hypotalamus-aivolisäke-lisämunuaisakselin (HPA-akselin) annosriippuvaista ja korjautuvaa suppressiota, joka voi johtaa sekundaariseen lisämunuaisen vajaatoimintaan, joka voi jatkua kuukausia pitkäkestoisen hoidon lopettamisen jälkeen. Kroonisen lisämunuaisen vajaatoiminnan aste vaihtelee potilaiden keskuudessa, ja se riippuu annoksesta ja hoidon kestosta.
Akuutti lisämunuaisen vajaatoiminta (tunnetaan myös lisämunuaiskriisinä) voi ilmetä lisääntyneen stressin aikana tai jos vamoroloniannosta pienennetään tai se lopetetaan äkillisesti. Tämä tila voi olla hengenvaarallinen. Lisämunuaiskriisin oireita voivat olla voimakas väsymys, yllättävä voimattomuus, oksentelu, huimaus tai sekavuus. Riskiä lievennetään pienentämällä annosta vähitellen, kun annosta titrataan pienemmäksi tai hoito lopetetaan (ks. kohta Annostus ja antotapa).
Lisääntyneen stressin, kuten akuutin infektion, traumaattisten vammojen tai kirurgisen toimenpiteen, aikana potilaita on seurattava akuutin lisämunuaisen vajaatoiminnan oireiden varalta, ja tavanomaista AGAMREE-hoitoa on täydennettävä väliaikaisesti systeemisellä hydrokortisonilla lisämunuaiskriisin riskin ehkäisemiseksi. AGAMREE-annoksen suurentamisen vaikutuksista stressitilanteissa ei ole tietoja.
Potilasta on kehotettava pitämään mukanaan potilaskortti, jossa annetaan tärkeää turvallisuustietoa lisämunuaiskriisin varhaisen tunnistamisen ja hoidon tueksi.
Steroideihin liittyvä ”vieroitusoireyhtymä”, joka ei ilmeisesti liity lisämunuaiskuoren vajaatoimintaan, voi ilmetä myös glukokortikoidien äkillisen lopettamisen jälkeen. Oireyhtymän oireita ovat esimerkiksi ruokahaluttomuus, pahoinvointi, oksentelu, letargia, päänsärky, kuume, nivelkipu, hilseily, lihaskipu ja/tai painonlasku. Näiden vaikutusten katsotaan johtuvan ennemminkin glukokortikoidipitoisuuden äkillisestä muutoksesta kuin alhaisesta glukokortikoidipitoisuudesta.
Siirtyminen glukokortikoidihoidosta AGAMREE-hoitoon
Potilaat voivat vaihtaa suun kautta annettavasta glukokortikoidihoidosta (kuten prednisonista tai deflatsakortista) AGAMREE-hoitoon ilman hoidon keskeyttämistä tai aiemman glukokortikoidiannoksen pienentämistä. Aiemmin kroonisia glukokortikoideja käyttäneiden potilaiden on siirryttävä käyttämään AGAMREE-valmistetta annoksella 6 mg/kg/vrk lisämunuaiskriisin riskin minimoimiseksi.
Painonnousu
Vamoroloniin liittyy annoksesta riippuvainen ruokahalun lisääntyminen ja painonnousu, pääasiassa ensimmäisten hoitokuukausien aikana. Ikätasolle sopivia ruokavalio-ohjeita on annettava ennen AGAMREE-hoitoa ja sen aikana DMD-potilaiden ravitsemuksen hallintaa koskevien yleisten suositusten mukaisesti.
Käyttöä koskevat seikat potilailla, joiden kilpirauhasen toiminta on muuttunut
Glukokortikoidien metabolinen puhdistuma voi olla heikentynyt kilpirauhasen vajaatoimintaa sairastavilla potilailla ja kiihtynyt liikatoimintaa sairastavilla potilailla. Ei tiedetä, onko vaikutus samanlainen vamorolonin osalta, mutta muutokset potilaan kilpirauhasen tilassa voivat edellyttää annoksen muuttamista.
Silmiin kohdistuvat vaikutukset
Glukokortikoidit voivat aiheuttaa takakapselin alaista kaihia, glaukoomaa, joka voi vahingoittaa näköhermoja, ja ne voivat lisätä bakteerien, sienten tai virusten aiheuttamien sekundaaristen silmäinfektioiden riskiä.
AGAMREE-valmisteen käyttöön liittyvää silmään kohdistuvien vaikutusten riskiä ei tunneta.
Suurentunut infektioiden riski
Tulehdusvasteen ja immuunitoiminnan estäminen voi lisätä alttiutta infektioille ja niiden vakavuutta. Piilevien infektioiden aktivoituminen tai samanaikaisten infektioiden paheneminen voi olla mahdollista. Kliininen ilmentymä voi usein olla epätyypillinen, ja vakavat infektiot voivat peittyä, ja ne voivat edetä pitkälle, ennen kuin ne tunnistetaan.
Nämä infektiot voivat olla vaikeita ja joskus kuolemaan johtavia.
Vaikka vamorolonin kliinisissä tutkimuksissa ei havaittu infektioiden esiintyvyyden tai vaikeusasteen kasvua, rajallisen pitkäaikaisen kokemuksen perusteella ei voida sulkea pois lisääntynyttä infektioriskiä.
Infektioiden kehittymistä on seurattava. Pitkäkestoisen vamorolonihoidon aikana on sovellettava diagnosointi- ja hoitostrategioita potilaisiin, joilla on infektion oireita. Lisähoitoa hydrokortisonilla on harkittava vamorolonihoitoa saavilla potilailla, joilla on keskivaikeita tai vaikeita infektioita.
Diabetes
Pitkäaikainen kortikosteroidihoito voi lisätä diabetes mellituksen riskiä.
Vamorolonin kliinisissä tutkimuksissa ei ole havaittu kliinisesti merkittäviä muutoksia glukoosiaineenvaihdunnassa. Pitkäaikaiset tiedot ovat rajalliset. Veren glukoosipitoisuutta on seurattava säännöllisin väliajoin potilailla, joita hoidetaan pitkäaikaisesti vamorolonilla.
Rokottaminen
Vaste eläviin tai eläviin heikennettyihin rokotteisiin voi olla muuttunut potilailla, joita hoidetaan glukokortikoideilla.
AGAMREE-hoitoon liittyvää riskiä ei tunneta.
Eläviä heikennettyjä tai eläviä taudinaiheuttajia sisältävät rokotteet on annettava vähintään 6 viikkoa ennen AGAMREE- hoidon aloittamista.
Potilaille, joilla ei ole aiemmin ollut vesirokkoa tai jotka eivät ole saaneet rokotusta sitä vastaan, on annettava rokotukset varicella zoster -virusta vastaan ennen AGAMREE-hoitoa.
Tromboemboliset tapahtumat
Glukokortikoideilla tehdyt havainnoivat tutkimukset ovat osoittaneet, että tromboemboliariski (mukaan lukien laskimotromboembolia) on suurentunut etenkin suurien kumulatiivisten glukokortikoidiannosten yhteydessä.
AGAMREE-hoitoon liittyvää riskiä ei tunneta. AGAMREE-valmisteen käytössä on noudatettava varovaisuutta potilailla, joilla on tromboembolisia häiriöitä tai saattaa olla taipumusta niihin.
Anafylaksia
Harvinaisissa tapauksissa glukokortikoidihoitoa saaneilla potilailla on ilmennyt anafylaksiaa.
Vamorolonilla on rakenteellisia yhtäläisyyksiä glukokortikoidien kanssa, ja sitä on käytettävä varoen potilailla, joiden tiedetään olevan yliherkkiä glukokortikoideille.
Maksan vajaatoiminta
Vamorolonia ei ole tutkittu potilailla, joilla on vaikea maksavaurio (Child-Pugh-luokka C), eikä sitä saa antaa tällaisille potilaille (ks. kohta Vasta-aiheet).
Samanaikainen käyttö muiden lääkevalmisteiden kanssa
UGT:n substraatit
Lääkkeiden välisten sellaisten yhteisvaikutusten mahdollisuutta, johon liittyy UGT-entsyymejä, ei ole arvioitu täysimittaisesti, joten kaikkia UGT-entsyymien estäjiä on vältettävä samanaikaisena lääkityksenä, ja jos niille on lääketieteellinen tarve, niitä on käytettävä varoen.
Apuaineet
Natriumbentsoaatti
Yksi millilitra tätä lääkevalmistetta sisältää 1 mg natriumbentsoaattia, mikä vastaa 100 mg:aa/100 ml.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) 7,5 millilitraa kohden eli se on käytännössä natriumiton.
Yhteisvaikutukset
Farmakodynaamiset yhteisvaikutukset
Vamoroloni toimii mineralokortikoidireseptorissa antagonistina. Vamorolonin käyttö yhdessä mineralokortikoidireseptorin antagonistin kanssa voi lisätä hyperkalemian riskiä. Hyperkalemiatapauksia ei ole havaittu potilailla, jotka käyttävät vamorolonia yksinään tai yhdistettynä eplerenoniin tai spironolaktoniin. Kaliumpitoisuuden seuranta kuukauden kuluttua vamorolonin ja mineralokortikoidireseptorin antagonistin yhdistelmän käytön aloittamisesta on suositeltavaa. Jos hyperkalemiaa esiintyy, on harkittava mineralokortikoidireseptorin antagonistin annoksen pienentämistä.
Farmakokineettiset yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus vamoroloniin
Kun samanaikaisesti annettiin itrakonatsolia, joka on vahva CYP3A4:n estäjä, plasman pitoisuus-aikakäyrän alla oleva vamorolonin pinta-ala suureni 1,45-kertaiseksi terveillä koehenkilöillä. Kun vamorolonia annetaan vahvojen CYP3A4: n estäjien (esim. telitromysiini, klaritromysiini, vorikonatsoli, greippimehu) kanssa, suositeltu annos on 4 mg/kg/vrk.
Vahvat CYP3A4:n indusoijat tai vahvat PXR:n indusoijat (esim. karbamatsepiini, fenytoiini, rifampisiini, mäkikuisma) voivat vähentää vamorolonin pitoisuuksia plasmassa ja johtaa aineen tehottomuuteen, minkä vuoksi olisi harkittava vaihtoehtoisia hoitomuotoja, jotka eivät ole vahvoja CYP3A4-aktiivisuuden indusoijia. Samanaikainen hoito keskivahvalla PXR:n tai CYP3A4:n indusoijalla on tehtävä varoen, koska vamorolonin pitoisuus plasmassa voi pienentyä merkittävästi.
Raskaus ja imetys
Raskaus
Vamorolonin käytöstä raskaana oleville naisille ei ole olemassa tietoja. Vamorolonin lisääntymistoksisuutta selvittäneissä eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Glukokortikoidit on eläinkokeissa yhdistetty erityyppisiin epämuodostumiin (suulakihalkiot, luuston epämuodostumat).
AGAMREE-valmistetta ei pidä käyttää raskauden aikana, ellei naisen kliininen tila edellytä vamorolonihoitoa.
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä AGAMREE-hoidon aikana.
Imetys
Vamorolonin tai sen metaboliittien erittymisestä äidinmaitoon ei ole tietoja. Vastasyntyneisiin/vauvoihin kohdistuvaa riskiä ei voida sulkea pois. Imetys on lopetettava AGAMREE-hoidon ajaksi.
Hedelmällisyys
Kliinisiä tietoja vamorolonin vaikutuksista hedelmällisyyteen ei ole.
Pitkäaikainen vamorolonihoito esti urosten ja naaraiden hedelmällisyyttä koirilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
AGAMREE-valmisteella ei ole vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Vamorolonin yleisimmin ilmoitetut haittavaikutukset annoksella 6 mg/kg/vrk ovat Cushingin oireyhtymän oireet (28,6 %), oksentelu (14,3 %), painonnousu (10,7 %) ja ärtyisyys (10,7 %). Nämä reaktiot riippuvat annoksesta, niistä raportoidaan yleensä hoidon ensimmäisinä kuukausina, ja ne yleensä vähenevät tai vakiintuvat ajan mittaan jatkuvalla hoidolla.
Vamoroloni johtaa hypotalamus-aivolisäke-lisämunuaisakselin suppressioon, joka on yhteydessä annokseen ja hoidon kestoon. Akuutti lisämunuaisen vajaatoiminta (lisämunuaiskriisi) on vakava vaikutus, joka voi ilmetä lisääntyneen stressin aikana tai jos vamoroloniannosta pienennetään tai se lopetetaan äkillisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Haittavaikutukset on lueteltu MedDRA:n elinluokkajärjestelmän ja yleisyyden mukaisesti. Taulukko sisältää haittavaikutuksia potilailla, joita on hoidettu vamorolonilla annoksella 6 mg/kg/vrk (pooli 1) lumelääkekontrolloidussa tutkimuksessa. Haittavaikutusten yleisyys määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) (mukaan lukien yksittäiset tapaukset) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 2: Haittavaikutukset
| Elinluokka | Haittavaikutus (suositeltava termi) | Esiintyvyys |
| Umpieritys | Cushingin oireyhtymän oireet | Hyvin yleinen |
| Aineenvaihdunta ja ravitsemus | Painonnousu Lisääntynyt ruokahalu | Hyvin yleinen |
| Psyykkiset häiriöt | Ärtyisyys | Hyvin yleinen |
| Ruoansulatuselimistö | Oksentelu Vatsakipu Ylävatsakipu Ripuli | Hyvin yleinen Yleinen Yleinen Yleinen |
| Hermosto | Päänsärky | Yleinen |
Tiettyjen haittavaikutusten kuvaus
Cushingin oireyhtymän oireet
Cushingin oireyhtymän oireet (hyperkortisolismi) olivat yleisimmin ilmoitettu haittavaikutus (28,6 %) vamorolonin annoksella 6 mg/kg/vrk. Cushingin oireyhtymän oireita esiintyi harvemmin vamorolonia 2 mg/kg/vrk saaneiden ryhmässä (6,7 %). Kliinisessä tutkimuksessa Cushingin oireyhtymän oireita ilmoitettiin lievänä tai kohtalaisena ”kasvoissa näkyvänä painonnousuna” tai ”kasvojen pyöristymisenä”. Suurimmalla osalla potilaista, joilla oli Cushingin oireyhtymän oireita, niitä ilmeni ensimmäisten kuuden kuukauden aikana (28,6 prosentilla kuukausina 0–6 ja 3,6 prosentilla kuukausina 6–12 vamoroloniannoksella 6 mg/kg/vrk), eivätkä oireet johtaneet hoidon keskeyttämiseen.
Käyttäytymiseen liittyvät ongelmat
Käyttäytymiseen liittyvistä ongelmista ilmoitettiin kuuden ensimmäisen hoitokuukauden aikana useammin vamorolonia 6 mg/kg/vrk saaneilla potilailla (21,4 %) kuin vamorolonia 2 mg/kg/vrk saaneilla (16,7 %) tai lumelääkettä saaneilla (13,8 %), johtuen lisääntyneestä määrästä tapauksia, joita kuvailtiin lievänä ärtyisyytenä (10,7 prosentilla potilaista annoksella 6 mg/kg/vrk, mutta ei yhdelläkään potilaalla annoksella 2 mg/kg/päivä tai lumelääkkeellä). Suurin osa käyttäytymiseen liittyvistä ongelmista ilmeni hoidon kolmen ensimmäisen kuukauden aikana, ja ne hävisivät ilman hoidon keskeyttämistä. Käyttäytymiseen liittyvien ongelmien esiintymistiheys kuukausina 6–12 väheni kummallakin vamoroloniannoksella (10,7 prosenttia 6 mg/kg/vrk saaneiden ja 7,1 prosenttia 2 mg/kg/vrk saaneiden ryhmässä).
Painonnousu
Vamoroloniin liittyy ruokahalun lisääntymistä ja painonnousua. Suurin osa vamorolonia 6 mg/kg/vrk saaneiden ryhmässä raportoiduista painonnousutapauksista todettiin kuuden ensimmäisen hoitokuukauden aikana (17,9 prosenttia kuukausina 0–6 ja 0 prosenttia kuukausina 6–12). Painonnousu oli samanlaista vamorolonia 2 mg/kg/vrk saaneilla (3,3 %) ja lumelääkettä saaneilla (6,9 %). Ennen AGAMREE-hoitoa ja sen aikana on annettava ikään sopivia ruokavalio-ohjeita DMD-potilaiden ravitsemushoitoa koskevien yleisten suositusten mukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vieroitusoireet ja -merkit
Vamorolonin päivittäisen annoksen äkillinen pienentäminen tai lopettaminen yli viikon kestäneen pitkäaikaisen hoidon jälkeen voi johtaa lisämunuaiskriisiin (ks. kohta Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Vamorolonihoitoa saaneilla pediatrisilla DMD-potilailla haittavaikutukset olivat esiintyvyydeltään ja tyypiltään samanlaisia 4- vuotiailla ja sitä vanhemmilla potilailla.
Haittavaikutusten tyyppi ja esiintyvyys yli 7-vuotiailla potilailla oli yhdenmukainen 4–7-vuotiailla potilailla havaittujen vaikutusten kanssa. Saatavilla ei ole tietoa siitä, miten vamoroloni vaikuttaa puberteetin kehitykseen.
Käyttäytymiseen liittyviä ongelmia havaittiin enemmän alle 5-vuotiailla potilailla kuin ≥5-vuotiailla potilailla, jotka saivat vamorolonia 2–6 mg/kg/vrk.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Akuutin yliannostuksen hoito perustuu välittömään tukihoitoon ja oireenmukaiseen hoitoon. Mahahuuhtelua tai oksennuttamista voidaan harkita.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Glukokortikoidit, ATC-koodi: H02AB18
Vaikutusmekanismi
Vamoroloni on dissosiatiivinen kortikosteroidi, joka sitoutuu selektiivisesti glukokortikoidireseptoriin, mikä saa aikaan anti-inflammatorisia vaikutuksia estämällä NF-kB-välitteisten geenitranskriptien toimintaa, mutta vähentää muiden geenien transkriptionaalista aktivoitumista. Lisäksi vamoroloni estää mineralokortikoidireseptorin aktivoinnin aldosteronin avulla. Spesifisen rakenteensa vuoksi vamoroloni ei todennäköisesti ole 11ß-hydroksisteroididehydrogenaasin substraatti, joten siihen ei kohdistu paikallista kudosvahvistusta. Tarkkaa mekanismia, jolla vamoroloni saa aikaan terapeuttisen vaikutuksen DMD-potilailla, ei tunneta.
Farmakodynaamiset vaikutukset
Kliinisissä tutkimuksissa vamoroloni pienensi aamukortisolipitoisuutta annossidonnaisesti. Vamorolonin kliinisissä tutkimuksissa havaittiin annoksesta riippuvaista hemoglobiinin, hematokriittiarvojen, erytrosyyttien, leukosyyttien ja lymfosyyttien määrän lisääntymistä. Neutrofiilien keskimääräisessä määrässä tai kypsymättömien granulosyyttien määrässä ei havaittu merkittäviä muutoksia. HDL-kolesterolin ja triglyseridien arvot nousivat annossidonnaisesti. 30. kuukauteen asti kestäneellä hoidolla ei ollut merkittävää vaikutusta glukoosiaineenvaihduntaan.
Toisin kuin kortikosteroidit, vamoroloni ei vähentänyt luun aineenvaihduntaa, jota mitataan luun vaihtuvuuden merkkiaineilla, eikä pienentänyt merkitsevästi lannenikamaluun mineralisaatioparametrejä DXA-luuntiheysmittauksessa 48 viikon aikana kliinisissä tutkimuksissa. Luunmurtumien riskiä ei ole osoitettu vamorolonilla hoidetuilla DMD-potilailla.
Kliininen teho ja turvallisuus
AGAMREE-valmisteen tehoa DMD:n hoidossa arvioitiin tutkimuksessa 1, joka oli satunnaistettu, kaksoissokkoutettu, lumelääkkeellä ja vaikuttavalla aineella kontrolloitu monikeskus-, rinnakkaistutkimus, joka kesti 24 viikkoa, ja jota seurasi kaksoissokkoutettu jatkovaihe. Tutkimuspopulaatio koostui 121 miespuolisesta pediatrisesta potilaasta, jotka olivat tutkimukseen ilmoittautumisajankohtana 4 – < 7-vuotiaita ja jotka eivät olleet aiemmin saaneet kortikosteroideja, olivat avohoidossa ja joilla oli vahvistettu DMD-diagnoosi.
Tutkimuksessa 1 satunnaistettiin 121 potilasta saamaan jotakin seuraavista hoidoista: vamoroloni 6 mg/kg/vrk (n = 30), vamoroloni 2 mg/kg/vrk (n = 30), aktiivinen vertailuvalmiste prednisoni 0,75 mg/kg/vrk (n = 31) tai lumelääke (n = 30). 24 viikon jälkeen (ensisijainen tehon analyysi, jakso 1) potilaat, jotka olivat saaneet prednisonia tai lumelääkettä, jaettiin uudelleen alun perin määritetyn satunnaistamissuunnitelman mukaisesti joko saamaan vamorolonia 6 mg/kg/vrk tai 2 mg/kg/vrk seuraavien 20 lisähoitoviikon ajan (jakso 2).
Tutkimuksessa 1 tehoa arvioitiin arvioimalla muutosta lähtötilanteesta viikolle 24 seisaalle nousemisen ajan selinmakuulta (time to stand from supine; TTSTAND-testi) nopeutena annosta 6 mg/kg/vrk saaneilla potilailla verrattuna lumelääkettä saaneisiin. Ennalta määritetty hierarkkinen analyysi merkityksellisillä toissijaisilla päätetapahtumilla koostui TTSTAND-nopeuden muutoksesta lähtötasosta vamorolonia 2 mg/kg/vrk saaneilla potilailla verrattuna lumelääkettä saaneisiin, muutos kuuden minuutin kävelytestin (6MWT) etäisyydessä vamorolonia 6 mg/kg/vrk saaneilla potilailla, jota seurasi 2 mg/kg/vrk saaneiden potilaiden ja lumelääkettä saaneiden vertailu.
Vamorolonihoito annoksilla 6 mg/kg/vrk ja 2 mg/kg/vrk paransi tilastollisesti merkitsevästi TTSTAND-nopeuden muutosta ja muutosta kuuden minuutin kävelytestissä lähtötilanteen ja viikon 24 välillä verrattuna lumelääkkeeseen (ks. taulukko 2). Tutkimusta 1 ei ollut suunniteltu säilyttämään tyypin I kokonaisvirhetasoa kunkin vamorolonia saaneen ryhmän ja prednisoniryhmän vertailussa, joten näiden päätetapahtumien kokonaisarvio (global assessment) eri päätetapahtumien hoitoeroista on esitetty kuvassa 1 prosentuaalisina muutoksina lähtötilanteesta 95 prosentin luottamusvälein.
Taulukko 3: Analyysi lähtötilanteesta tapahtuneesta muutoksesta käytettäessä vamorolonia 6 mg/kg/vrk tai 2 mg/kg/vrk verrattuna lumelääkkeeseen viikolla 24 (tutkimus 1)
| TTSTAND-nopeus (nousua/s) / TTSTAND sekunteina (s/nousu) | Lumelääke | Vam 2 mg/kg/vrk | Vam 6 mg/kg/vrk | Pred 0,75 mg/kg/vrk |
Lähtötilanteessa keskimääräinen nousua/s Lähtötilanteessa keskimääräinen s/nousu | 0,20 5,555 | 0,18 6,07 | 0,19 5,97 | 0,22 4,92 |
Keskimääräinen muutos 24 viikon kuluttua Nousua/s Tuloksen paraneminen s/nousu | -0,012 -0,62 | 0,031 0,31 | 0,046 1,05 | 0,066 1,24 |
Ero lumelääkkeeseen verrattuna* Nousua/s s/nousu | - | 0,043 (0,007 ; 0,079) 0,927 (0,042 ; 1,895) | 0,059 (0,022 ; 0,095) 1,67 (0,684 ; 2,658) | ei annettu ei annettu |
| p-arvo | - | 0,020 | 0,002 | ei annettu |
| 6MWT-etäisyys (metriä) | Lumelääke | Vam 2 mg/kg/vrk | Vam 6 mg/kg/vrk | Pred 0,75 mg/kg/vrk |
| Lähtötason keskiarvo (m) | 354,5 | 316,1 | 312,5 | 343,3 |
| Keskimääräinen muutos 24 viikon kuluttua | -11,4 | +25,0 | +24,6 | +44,1 |
| Ero lumelääkkeeseen verrattuna* | - | 36,3 (8,3 ; 64,4) | 35,9 (8,0 ; 63,9) | ei annettu |
| p-arvo | - | 0,011 | 0,012 | ei annettu |
Keskimääräiset muutokset ja erot ovat mallipohjaisia pienimmän neliösumman keskiarvoja (LSM) ja keskimääräisiä eroja. Positiiviset luvut osoittavat paranemista lähtötasoon verrattuna. * Erot LSM:ssä esitettynä 95 %: n luottamusvälillä
Kuva 1 Vamorolonin ja prednisonin väliset vertailut motorista toimintaa koskevissa ajastetuissa testeissä, analysoitu prosentuaalisina muutoksina lähtötilanteeseen nähden (mITT-1-populaatio)
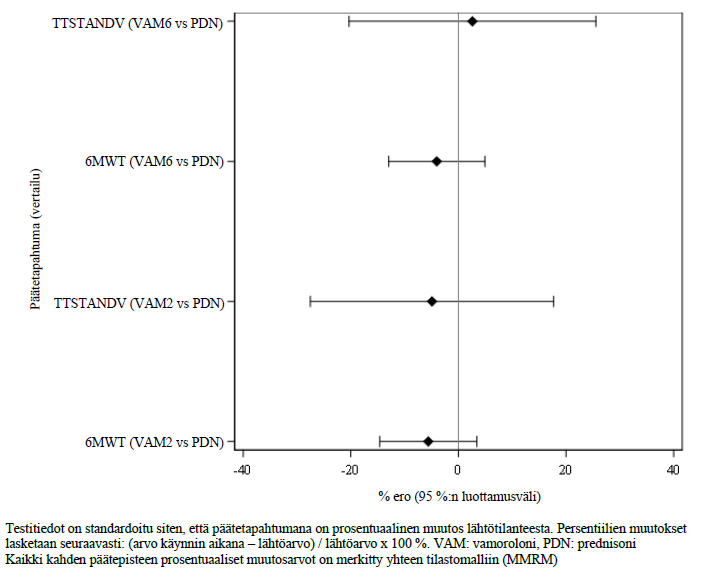
Vamorolonia 6 mg/kg/vrk saaneiden osalta kaikki 24 hoitoviikon kohdalla todetut mittaustulokset alaraajan toiminnan paranemisessa säilyivät suurelta osin 48 hoitoviikon ajan, kun taas annosta 2 mg/kg/vrk saaneilla tulokset olivat melko epäjohdonmukaisia ja olennaiset toiminnalliset tulosparametrit heikkenivät viikolla 48 (TTSTAND-nopeus ja 6MWT). Tämä johti kliinisesti merkitseviin eroihin verrattuna vamorolonia 6 mg/kg/vrk saaneeseen ryhmään, mutta NSAA-pisteet pienenivät vain vähän.
Potilailla, jotka vaihtoivat tutkimuksen 1 aikana jakson 1 prednisoniannoksesta 0,75 mg/kg/vrk vamoroloniannokseen 6 mg/kg/vrk jaksolla 2, havaittiin säilyttäneen näihin motoriseen toimintaan liittyvien päätetapahtumien hyödyt, kun taas niillä potilailla, jotka vaihtoivat vamoroloniannokseen 2 mg/kg/vrk, havaittiin hyötyjen heikkenemistä.
Lähtötilanteessa vamorolonia saaneiden ryhmien lapset olivat lyhyempiä (mediaani -0,74 SD ja -1,04 SD pituuden z-arvona annoksilla 2 mg/kg/vrk ja 6 mg/kg/vrk) kuin lumelääkettä (-0,54 SD) tai prednisonia (0,75 mg/kg/vrk) saaneet lapset (-0,56 SD). Pituuden persentiilin ja pituuden z-arvon muutos oli samanlainen vamorolonia tai lumelääkettä saaneilla lapsilla 24 viikon ajan, kun taas prednisonilla ne pienenenivät. Pituuden persentiilit ja z-arvot eivät pienentyneet, kun vamorolonia annettiin 48 hoitoviikon ajan tutkimuksessa 1. Siirtyminen 24 viikon jälkeen jakson 1 prednisonista jakson 2 vamoroloniin johti keski- ja mediaanipituuden z-arvon nousuun viikkoon 48 asti.
Farmakokinetiikka
Imeytyminen
Vamoroloni imeytyy hyvin ja jakautuu nopeasti kudoksiin. Kun lääke on annettu suun kautta ruoan kanssa, Tmax-arvon mediaani on noin 2 tuntia (vaihteluväli 0,5–5 tuntia).
Ruokailun vaikutus
Kun vamorolonia annettiin aterian yhteydessä, Cmax pieneni enintään 8 % ja Tmax viivästyi yhdellä tunnilla verrattuna lääkkeen ottamiseen paasto-olosuhteissa. AUC-arvolla mitattu systeeminen kokonaisabsorptio suureni enintään 14 prosenttia, kun vamoroloni otettiin ruokailun yhteydessä. Kiinalaisessa aikuispopulaatiossa AUCinf suureni 24 % ja Cmax 25 %, ja mediaani Tmax viivästyi 3 tuntia rasvaisen aterian yhteydessä. On epätodennäköistä, että tämä ruoan vaikutus muodostaa turvallisuutta koskevan huolenaiheen. Vaikka ruoka ei muutakaan merkittävästi vamorolonin yleistä biologista hyötyosuutta, jatkuva samanaikainen anto ruoan kanssa voi vähentää vaihtelua biologisessa hyötyosuudessa.
Jakautuminen
Vamorolonin jakautumisen näennäistilavuus DMD-potilaalla, jonka paino on 20 kg, on 28,5 l populaatiofarmakokineettisen analyysin perusteella. Sitoutuminen proteiineihin on 88,1 % in vitro. Veren ja plasman suhde on noin 0,87.
Biotransformaatio
Vamoroloni metaboloituu useissa vaiheen I ja vaiheen II väylissä, kuten glukuronidaation, hydroksylaation ja reduktion kautta. Tärkeimmät plasman ja virtsan metaboliitit muodostuvat suoran glukuronidaation sekä hydrauksen ja sitä seuraavan glukuronidaation kautta. Tiettyjen UGT- ja CYP-entsyymien osallistumista vamorolonin metaboliaan ei ole osoitettu vakuuttavasti.
Eliminaatio
Tärkein poistumisreitti on metaboloituminen ja sen jälkeinen metaboliittien erittyminen virtsaan ja ulosteeseen. Vamorolonin puhdistuma DMD-potilaalla, jonka paino on 20 kg, on 58 l/h populaatiofarmakokineettisen analyysin perusteella. Vamorolonin terminaalisen eliminaation puoliintumisaika DMD:tä sairastavilla lapsilla on noin kaksi tuntia.
Noin 30 prosenttia vamoroloniannoksesta erittyy ulosteeseen (15,4 prosenttia muuttumattomana) ja 57 prosenttia erittyy virtsaan metaboliitteina (< 1 prosentti muuttumattomana). Virtsan päämetaboliitit ovat glukuronidit.
Lineaarisuus/ei-lineaarisuus
Farmakokineettiset ominaisuudet ovat lineaarisia, ja vamorolonialtistus kasvaa suhteessa joko kerta-annoksiin tai useisiin annoksiin. Vamoroloni ei kerry elimistöön toistuvan annon yhteydessä.
Erityisryhmät
Maksan vajaatoiminta
Keskivaikean maksan vajaatoiminnan (Child-Pugh-luokka B) vaikutusta vamoroloniin tutkittiin ihmisillä. Vamorolonin Cmax- ja AUC0inf-arvot olivat keskimäärin 1,7- ja 2,6-kertaiset keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla, kun heitä verrattiin iän, painon ja sukupuolen mukaan vastaaviin terveisiin aikuisiin. AGAMREE-annosta on pienennettävä potilailla, joilla on keskivaikea maksan vajaatoiminta, annokseen 2 mg/kg/vrk enintään 40 kg painavilla potilailla ja 80 mg:aan potilailla, jotka painavat vähintään 40 kg.
Saatavilla olevien tietojen perusteella vamorolonille altistumisen lisääntyminen on suhteessa maksan vajaatoiminnan vaikeusasteeseen. Lievää maksan vajaatoimintaa (Child-Pugh-luokka A) sairastavien potilaiden altistuksen ei odoteta suurenevan merkitsevästi, joten annoksen muuttamista ei suositella.
Vamorolonista ei ole kokemusta potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh-luokka C), eikä vamorolonia saa antaa näille potilaille (ks. kohta Vasta-aiheet).
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavien potilaiden hoidosta ei ole kliinistä kokemusta. Vamoroloni ei erity muuttumattomana munuaisten kautta, ja altistumisen lisääntymistä munuaisten vajaatoiminnan vuoksi pidetään epätodennäköisenä.
Kuljettajaproteiinivälitteiset yhteisvaikutukset
Vamoroloni ei ole P-gp:n, BCRP:n, OATP1B1:n, OATP1B3:n, OCT2:n, OAT1:n, MATE1:n tai BSEP:n estäjä. Vamoroloni on osoittanut heikkoa OAT3- ja MATE2-K-kuljettajien estovaikutusta in vitro. Vamoroloni ei ole seuraavien substraatti: P-gp, BCRP, OATP1A2, OATP1B1, OATP1B3, OCT2, OAT1, OAT3, MATE1, MATE2-K tai BSEP.
Pediatriset potilaat
Vakaassa tilassa lasten (4–7-vuotiaiden) vamorolonin geometrinen Cmax-keskiarvo arvioitiin populaatiofarmakokineettisellä analyysillä arvoon 1 200 ng/ml (CV%=26,8) ja geometrinen AUC-keskiarvo arvoon 3 650 ng/ml.h, kun vamorolonia oli annettu 6 mg/kg vuorokaudessa.
Prekliiniset tiedot turvallisuudesta
Toistetun annoksen toksisuus
Toistuva vamorolonin anto johti triglyseridien ja kolesterolin sekä maksaentsyymien tilapäiseen lisääntymiseen hiirillä ja koirilla. Kummallakin lajilla havaittu fokaalinen maksatulehdus/nekroosi on voinut kehittyä toissijaisena hepatosellulaariselle hypertrofialle ja glykogeenia ja lipidikertymiä sisältävälle vakuolisaatiolle, mikä todennäköisesti heijastaa glukoneogeneesin stimulaatiota.
Pitkäaikainen vamoroloniannostus aiheutti myös lisämunuaiskuoren atrofiaa hiirillä ja koirilla. Sen syynä on tunnettu glukokortikoidiaineisiin liittyvä hypotalamus-aivolisäke-lisämunuaisakselin suppressio.
Lisäksi vamorolonin primaarinen tulehdusta ehkäisevä aktiivisuus aiheutti lievää tai kohtalaista lymfosyyttien poistumista kummankin lajin pernassa, kateenkorvassa ja imusolmukkeissa. Maksan ja lisämunuaisen haitalliset löydökset sekä hiirten ja koirien imukudoksen muutokset kehittyivät silloin, kun AUC- arvoon perustuvaan ihmisille suositeltuun enimmäisannokseen ei sovellettu turvallisuusmarginaalia.
Genotoksisuus ja karsinogeenisuus
Vamoroloni ei osoittanut genotoksista potentiaalia tavanomaisissa testeissä. Vamorolonista ei ole tehty karsinogeenisuustutkimuksia, mutta pre-neoplastisten leesioiden puuttuminen pitkäaikaisissa toksisuustutkimuksissa sekä kokemukset muista glukokortikoidiaineista eivät viittaa erityiseen karsinogeeniseen vaaraan.
Lisääntymis- ja kehitystoksisuus
Tavanomaisia lisääntymis- ja kehitystoksisuustutkimuksia ei ole tehty. Vamorolonilla hiirillä tehdyssä eksploratiivisessa alkion- ja sikiönkehitystutkimuksessa sikiöillä ja poikasilla todettiin suulakihalkioiden ilmaantuvuuden lisääntymistä altistuksilla, jotka vastasivat ihmisille suositellulla enimmäisannoksella saavutettavaa altistusta, mikä viittaa siihen, että vamorolonilla olisi olisi teratogenisia vaikutuksia. Vamoroloni ei vaikuttanut haitallisesti siittiöiden ja lisääntymiseen liittyvien kudosten kehitykseen hiirillä tehdyssä pitkäaikaistoksisuustutkimuksessa. Pitkäaikaisen annon seurauksena koirilla havaittiin epätäydellisesti palautuvaa spermatosyyttien/spermatidien rappeutumista kiveksissä, mikä johti oligospermiaan ja sukusolujätteeseen lisäkiveksissä. Lisäksi eturauhasen rauhasten määrä väheni ja se sisälsi vähemmän eritettä.
Naaraskoirilla pitkäaikainen toistuva annostus johti lisäksi osittain palautuvaan molemminpuoliseen keltarauhasen puutteeseen munasarjoissa. Urosten ja naaraiden hedelmällisyyden estyminen johtuu siitä, että pitkäaikaisen glukokortikoidihoidon tiedetään vaikuttavan hypotalamus-aivolisäke-gonadiakseliin ja se kehittyi ilman AUC-pohjaista ihmisille suositellun annoksen turvallisuusmarginaalia.
Juveniili toksisuus
Vamorolonin tärkeimmät kohde-elimet uros- ja naaraspuolisilla nuorilla hiirillä ovat osittain samat kuin aikuisilla hiirillä, kuten lisämunuaisen kuorikerroksen atrofia ja vamoroloniin liittyvä haitallinen hepatosellulaarinen rappeutuminen/nekroosi.
Yksinomaan nuorilla hiirillä havaitut vamoroloniin liittyvät vaikutukset liittyivät uros- ja naaraseläimillä haittaa aiheuttamattomaan koipiluun ja kehon pituuden lyhenemiseen, ja niiden katsottiin johtuvan kasvua hidastavasta vaikutuksesta. Lisäksi naaraspuolisilla eläimillä havaittiin alaleukaluun sylkirauhasten rauhasrakkulahypertrofiaa. Vaikka kasvun hidastuminen on hyvin tunnettu lasten glukokortikoidihoitoon liittyvä vaikutus, sylkirauhaslöydösten merkitystä lapsille ei tunneta. Nuorilla uros- ja naaraspuolisilla hiirillä yleisen toksisuuden haitattomalla vaikutustasolla (NOAEL) ei ole turvallisuusmarginaalia ihmisille suositellun enimmäisannoksen suhteen.
Farmaseuttiset tiedot
Apuaineet
Sitruunahappo(monohydraatti) (E330)
Dinatriumfosfaatti (E339)
Glyseroli (E422)
Appelsiiniaromi
Puhdistettu vesi
Natriumbentsoaatti (E211)
Sukraloosi (E955)
Ksantaanikumi (E415)
Kloorivetyhappo (pH:n säätöön)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Ennen avaamista
3 vuotta.
Pakkauksen avaamisesta
3 kuukautta.
Säilytä jääkaapissa (2 °C – 8 °C) pystyasennossa
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Säilytysolosuhteet lääkevalmisteen ensimmäisen avaamisen jälkeen, katso kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
AGAMREE oraalisuspensio
40 mg/ml (L:ei) 100 ml (1 pullosovitin, 2 oraaliruiskua) (6382,24 €)
PF-selosteen tieto
Meripihkanvärinen lasipullo, jossa on 100 ml oraalisuspensiota. Pullossa on polypropeenista valmistettu lapsiturvallinen korkki, jossa on pientiheyspolyeteenistä valmistettu tiiviste.
Yksi pakkaus sisältää yhden pullon, yhden painettavan pullosovittimen (pientiheyspolyeteenistä) ja kaksi samanlaista oraaliruiskua (pientiheyspolyeteenistä), joiden asteikko 0–8 ml on merkitty 0,1 ml:n välein.
Valmisteen kuvaus:
Valkoinen tai lähes valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Kutakin AGAMREE-valmisteen mukana toimitettua oraaliruiskua saa käyttää enintään 45 päivän ajan.
Käyttö enteraalisen ruokintaletkun kanssa:
AGAMREE voidaan antaa enteraalisen ruokintaletkun (12–24 fr) kautta ilman määrätyn annoksen muuttamista tai laimennusta. AGAMREE-valmistetta ei saa sekoittaa letkuravintovalmisteeseen tai muihin valmisteisiin. Enteraalinen ruokintaletku on huuhdeltava vähintään 20 millilitralla vettä ennen AGAMREE-valmisteen antoa ja annon jälkeen.
Korvattavuus
AGAMREE oraalisuspensio
40 mg/ml 100 ml
- Ei korvausta.
ATC-koodi
H02AB18
Valmisteyhteenvedon muuttamispäivämäärä
11.12.2025
Yhteystiedot
Marie-Curie Strasse 8
79539 Lörrach
Saksa
+49 (0)7621 1690 200
office@santhera.com
