OPFOLDA kapseli, kova 65 mg
Vaikuttavat aineet ja niiden määrät
Yksi kova kapseli sisältää 65 mg miglustaattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kapseli, kova
Kliiniset tiedot
Käyttöaiheet
Opfolda (miglustaatti) on sipaglukosidaasi alfan pitkäaikaisen entsyymikorvaushoidon entsyymitoimintaa vakauttava aine aikuisilla, joilla on myöhään alkanut Pompen tauti (happaman α-glukosidaasin [GAA] puutos).
Ehto
Hoito tulee antaa sellaisen lääkärin valvonnassa, jolla on kokemusta Pompen tautia tai muita perinnöllisiä metabolisia tai neuromuskulaarisia tauteja sairastavien potilaiden hoidosta.
Annostus ja antotapa
Hoitoa saa valvoa lääkäri, jolla on kokemusta Pompen tautia tai muita perinnöllisiä aineenvaihdunta- tai neuromuskulaarisairauksia sairastavien potilaiden hoidosta.
Miglustaatti 65 mg kovat kapselit on käytettävä yhdessä sipaglukosidaasi alfan kanssa. Sipaglukosidaasi alfan valmisteyhteenvetoon on tutustuttava ennen miglustaatin käyttöä.
Annostus
Vähintään 18-vuotiaat aikuiset ottavat suun kautta joka toinen viikko suositellun annoksen, joka perustuu painoon:
- ≥ 50 kg painaville potilaille suositeltu annos on 260 mg (neljä (4) 65 mg:n kapselia).
- ≥ 40 kg – < 50 kg painaville potilaille suositeltu annos on 195 mg (kolme (3) 65 mg:n kapselia).
Miglustaatti 65 mg kovat kapselit otetaan noin 1 tunti mutta enintään 3 tuntia ennen sipaglukosidaasi alfa -infuusion aloittamista.
Kuva 1. Annoksen aikajana
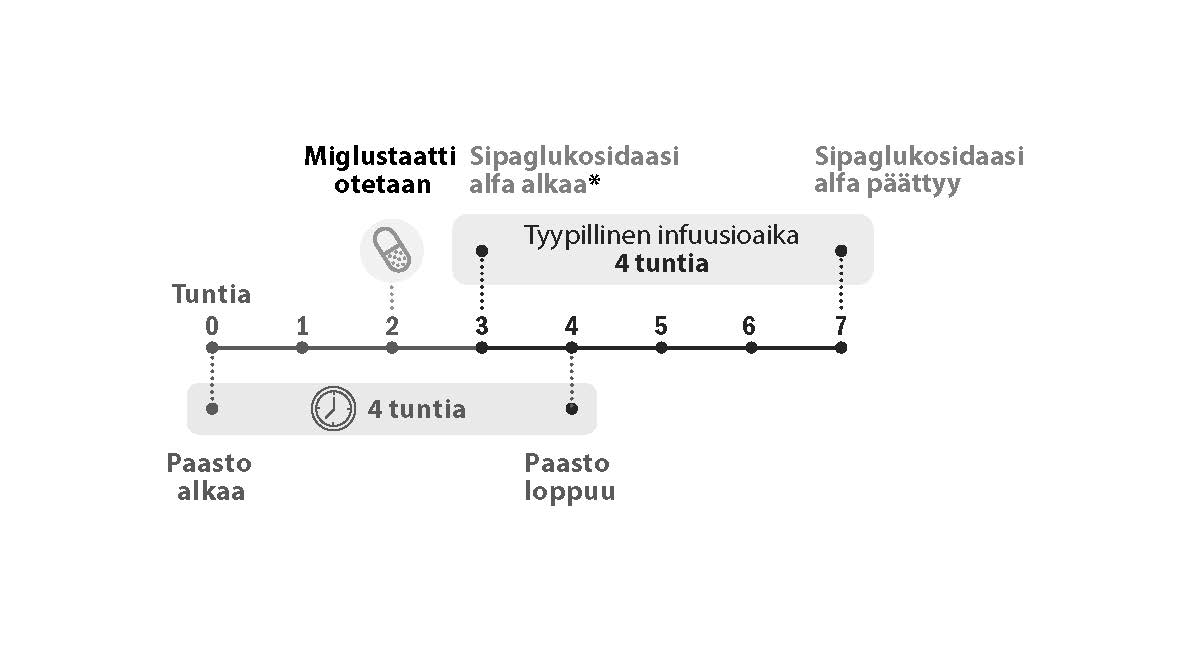
* Miglustaatti 65 mg kovat kapselit on otettava noin 1 tunti mutta enintään 3 tuntia ennen sipaglukosidaasi alfa -infuusion aloittamista.
Potilaan hoitovaste on arvioitava rutiininomaisesti kaikkien taudin kliinisten ilmentymien kattavan arvioinnin perusteella. Riittämättömän vasteen tai kohtuuttomien turvallisuusriskien tapauksessa on harkittava miglustaatti 65 mg kovien kapseleiden käytön keskeyttämistä yhdessä sipaglukosidaasi alfa -hoidon kanssa. Joko molempien lääkevalmisteiden käyttöä on jatkettava tai molempien lääkevalmisteiden käyttö on lopetettava.
Väliin jäänyt annos
Jos miglustaattiannos jää väliin, hoito on otettava mahdollisimman pian. Jos sitä ei oteta, älä aloita sipaglukosidaasi alfa -infuusiota. Sipaglukosidaasi alfa -infuusio voidaan aloittaa 1 tunnin kuluttua miglustaatin ottamisesta.
Erityisryhmät
Munuaisten ja maksan vajaatoiminta
Miglustaatin turvallisuutta ja tehoa yhdessä sipaglukosidaasi alfa -hoidon kanssa ei ole arvioitu keskivaikeaa tai vaikeaa munuaisten ja/tai maksan vajaatoimintaa sairastavilla potilailla. Kun hoito otetaan joka toinen viikko, plasman miglustaattialtistuksen suureneminen kohtalaisen tai vaikean munuaisten tai maksan vajaatoiminnan seurauksena ei todennäköisesti vaikuta merkittävästi sipaglukosidaasi alfa -altistukseen eikä sen odoteta vaikuttavan sipaglukosidaasi alfan tehoon ja turvallisuuteen kliinisesti merkittävällä tavalla. Annoksen muuttamista ei tarvita munuaisten tai maksan vajaatoimintaa sairastavilla potilailla.
Iäkkäät potilaat
Miglustaatin käytöstä yhdessä sipaglukosidaasi alfa -hoidon kanssa yli 65-vuotiaille potilaille on vain vähän kokemusta. Annoksen muuttaminen ei ole tarpeen iäkkäille potilaille.
Pediatriset potilaat
Miglustaatin turvallisuutta ja tehoa yhdessä sipaglukosidaasi alfa -hoidon kanssa alle 18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Miglustaatti otetaan suun kautta.
Miglustaatti kovassa kapselissa on sauma, joka estää kapselin kuoren avaamisen. Kapseli on nieltävä kokonaisena ja otettava tyhjään vatsaan.
Potilaan on paastottava 2 tuntia ennen 65 mg:n miglustaattiannosta (kovat kapselit) ja 2 tuntia sen jälkeen (ks. Kohta Farmakokinetiikka). Tämän 4 tunnin paaston aikana voidaan nauttia vettä, rasvatonta lehmänmaitoa sekä teetä tai kahvia ilman kermaa, sokeria tai makeutusaineita. Potilas voi jatkaa normaalia syömistä ja juomista 2 tuntia miglustaatin ottamisen jälkeen.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Sipaglukosidaasi alfan vasta-aihe.
Varoitukset ja käyttöön liittyvät varotoimet
Miglustaatin ja sipaglukosidaasi alfan yhdistelmähoidon yhteydessä voi esiintyä haittavaikutuksia (ks. kohta Haittavaikutukset).
Yhteisvaikutukset
Miglustaatin käyttöön liittyviä yhteisvaikutustutkimuksia ei ole tehty.
Yhteisvaikutus ruoan kanssa
Miglustaatilla tiedetään olevan suora vaikutus suoliston epiteelin merkittävien disakkaridaasien entsymaattiseen toimintaan. Tarkemmin sanottuna miglustaatti estää alfa-glykosidisia sidoksia sisältäviä disakkarideja, kuten sakkaraasia, maltaasia ja isomaltaasia. Mahdollisten yhteisvaikutusten voimakkuus voi välittömästi häiritä sakkaroosin, maltoosin ja isomaltoosin ruoansulatukseen liittyvää aktiivisuutta, mikä johtaa ruoansulatushäiriöön, veden osmoottiseen sisäänvirtaukseen, lisääntyneeseen käymiseen ja ärsyttävien metaboliittien tuotantoon. Potilaan on paastottava 2 tuntia ennen miglustaatin ottamista ja 2 tuntia sen ottamisen jälkeen.
Raskaus ja imetys
Ehkäisy naisilla
Naisten, jotka voivat tulla raskaaksi, on käytettävä luotettavia ehkäisymenetelmiä miglustaatin ja sipaglukosidaasi alfan yhdistelmähoidon aikana, sekä 4 viikon ajan hoidon lopettamisen jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta). Lääkevalmistetta ei suositella naisille, jotka voivat tulla raskaaksi ja jotka eivät käytä luotettavaa ehkäisyä.
Raskaus
Ei ole olemassa kliinisiä tietoja miglustaatin käytöstä yhdessä sipaglukosidaasi alfan kanssa raskaana oleville naisille. Miglustaatti läpäisee istukan. Eläinkokeet yhdistelmän käytöstä sipaglukosidaasi alfan kanssa sekä pelkän miglustaatin käytöstä ovat osoittaneet lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Miglustaatin ja sipaglukosidaasi alfa -hoidon yhdistelmän käyttöä ei suositella raskauden aikana.
Imetys
Ei tiedetä, erittyykö/erittyvätkö miglustaatti ja sipaglukosidaasi alfa ihmisen rintamaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Olemassa olevat farmakodynaamiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet miglustaatin ja sipaglukosidaasi alfan erittyvän rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko miglustaatin ja sipaglukosidaasi alfa -hoidon yhdistelmä ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ei ole olemassa kliinisiä tietoja miglustaatin ja sipaglukosidaasi alfa -hoidon yhdistelmän vaikutuksista hedelmällisyyteen.
Seitsemällä terveellä aikuisella miehellä, jotka saivat miglustaattia 100 mg suun kautta kahdesti päivässä 6 viikon ajan, ei havaittu vaikutuksia siittiöiden pitoisuuteen, liikkuvuuteen tai morfologiaan spermassa.
Urosrotilla ei havaittu mitään vaikutusta spermatogeneesiin, kun miglustaattia annettiin yhdessä sipaglukosidaasi alfan tai pelkän miglustaatin kanssa. Prekliiniset tiedot rotilla tehdyistä tutkimuksista, joissa käytettiin toista miglustaattia, ovat kuitenkin osoittaneet, että miglustaatti vaikuttaa haitallisesti sperman parametreihin (siittiöiden motiliteetti ja morfologia), mikä vähentää hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Naarasrotilla havaittiin ennen istutusta tapahtuvan alkioiden menehtymisen lisääntymistä käytettäessä miglustaattia yhdessä sipaglukosidaasi alfan kanssa ja pelkän miglustaatin kanssa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Miglustaatilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitettu haittavaikutus, joka liittyi vain 65 mg:n miglustaattiannokseen, oli ummetus (1,3 %).
Haittavaikutustaulukko
Haittavaikutusten arviointiin saatiin tietoja tutkittavien, joita hoidettiin miglustaatin ja sipaglukosidaasi alfa -hoidon yhdistelmällä kolmessa kliinisessä lääketutkimuksessa, yhdistetystä turvallisuusanalyysistä. Altistuksen keskimääräinen kokonaiskesto oli 28,0 kuukautta.
Taulukossa 1 on lueteltu haittavaikutukset MedDRA-elinjärjestelmäluokan perusteella jaoteltuina.
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1: Yhteenveto haittavaikutuksista miglustaattihoitoa saaneilla potilailla
Elinjärjestelmäluokka (SOC) | Esiintymistiheys | Haittavaikutus (suositeltu termi) |
Immuunijärjestelmä | Yleinen | Anafylaktinen reaktio7 |
| Melko harvinainen | Yliherkkyys |
Hermosto | Hyvin yleinen | Päänsärky |
Yleinen | Vapina, dysgeusia, parestesia | |
Melko harvinainen | Tasapainohäiriö, migreeni4 | |
Sydän | Yleinen | Takykardia6 |
Verisuonisto | Yleinen | Hypotensio |
| Melko harvinainen | Kalpeus |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus |
Melko harvinainen | Astma | |
Ruoansulatuselimistö | Yleinen | Ripuli, pahoinvointi, vatsakipu1, ilmavaivat, vatsan turpoaminen, oksentelu, ummetus† |
Melko harvinainen | Epämukava tunne vatsassa†, ruokatorven spasmi, suun kipu | |
Iho ja ihonalainen kudos | Yleinen | Urtikaria3, ihottuma2, kutina, hyperhidroosi |
Melko harvinainen | Ihon värimuutokset | |
Luusto, lihakset ja sidekudos | Yleinen | Lihaskouristukset, lihaskipu, nivelkipu, lihasheikkous |
Melko harvinainen | Kylkikipu, lihasväsymys, muskuloskeletaalinen jäykkyys | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Väsymys/uupumus, kuume, vilunväristykset, perifeerinen turvotus |
Melko harvinainen | Astenia, kasvokipu, jännittyneisyyden tunne†, ei-sydänperäinen rintakipu | |
Tutkimukset | Yleinen | Kohonnut verenpaine5 |
Melko harvinainen | Lymfosyyttien määrän väheneminen, verihiutaleiden määrän väheneminen† |
† Raportoitu vain miglustaatin käytön yhteydessä
1 Vatsakipu, ylävatsakipu ja alavatsakipu on ryhmitelty vatsakivun alle.
2 Ihottuma ja punoittava ihottuma on ryhmitelty ihottuman alle.
3 Urtikaria, urtikariaihottuma ja mekaaninen urtikaria on ryhmitelty urtikarian alle.
4 Migreeni ja auraoireinen migreeni on ryhmitelty migreenin alle.
5 Hypertensio ja kohonnut verenpaine on ryhmitelty kohonneen verenpaineen alle.
6 Takykardia ja sinustakykardia on ryhmitelty takykardian alle.
7 Anafylaksi, anafylaktinen reaktio ja anafylaktoidinen reaktio on ryhmitelty anafylaktisen reaktion alle.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Leukopeniaa, granulosytopeniaa, neutropeniaa, heitehuimausta ja parestesiaa on havaittu ihmisen immuunikatovirusta (HIV) sairastavilla potilailla, jotka saivat miglustaattia vähintään annoksella 800 mg/vrk.
Hoito
Yliannostuksen sattuessa on välittömästi annettava tukihoitoa. Täydellistä verenkuvaa on seurattava valkosolujen määrän vähentymisen varalta.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut ruoansulatuselimistön sairauksien ja aineenvaihduntasairauksien lääkkeet. ATC-koodi: A16AX06
Vaikutusmekanismi
Miglustaatti on sipaglukosidaasi alfan farmakokineettinen entsyymiä vakauttava aine.
Miglustaatti sitoutuu selektiivisesti sipaglukosidaasi alfan kanssa veressä infuusion aikana. Tämä vakauttaa sipaglukosidaasi alfan konformaatiota ja minimoi entsyymiaktiivisuuden menetyksen verenkierrossa olon aikana. Tämä selektiivinen sitoutuminen sipaglukosidaasi alfan ja miglustaatin välillä on ohimenevää. Disassosiaatio tapahtuu lysosomissa. Miglustaatilla ei yksinään ole vaikutusta glykogeenin vähenemiseen.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Opfolda-valmisteen käytöstä glykogeenin varastointisairauden tyypin II (Pompen tauti) hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Miglustaatin imeytymisnopeus (tmax) oli noin 2–3 tuntia. 260 mg:n kliinisellä annoksella plasman miglustaattipitoisuuden Cmax -arvo oli noin 3 000 ng/ml ja AUC-0-∞ -arvo noin 25 000 ng h/ml.
Ruoan vaikutus
Merkittävää ruoan tuottamaa vaikutusta havaittiin, ja se johti Cmax -pitoisuuden vähenemiseen 36 %:lla ja imeytymisen hidastumiseen noin 2 tunnilla (ks. kohta Annostus ja antotapa).
Metabolia
Miglustaatti ei metaboloidu suurelta osin, ja < 5 % radioleimatusta annoksesta palautuu glukuronideina.
Miglustaatti ei ole OAT1-, OAT3-, OATP1B1-, OATP1B3-, MATE1-, MATE2-K-, BCRP- tai BSEP-substraatti. Miglustaatti on heikko P-glykoproteiinin (P-gp) substraatti ja sisäänottokuljettajaproteiinien OCT1 (ilmentyy maksassa) ja OCT2 (ilmentyy munuaisissa) substraatti. Koska miglustaatti erittyy suurelta osin munuaisten kautta metaboloitumattomana, OCT1-estäjien ei odoteta johtavan kliinisesti merkitykselliseen yhteisvaikutukseen. Vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden tietojen perusteella OCT2-estäjillä ei odoteta olevan kliinisesti merkittävää vaikutusta miglustaatin erittymiseen ja altistumiseen munuaisten kautta. P-glykoproteiinin (P-gp) estäjien ei odoteta johtavan kliinisesti merkitykselliseen yhteisvaikutukseen miglustaatin kanssa suolistossa paastosuositusten ja miglustaatin nopean imeytymisen (tmax 2 tuntia) perusteella.
Miglustaatti ei ole sytokromi P450 -entsyymien tunnettu substraatti tai estäjä; näin ollen merkittävät yhteisvaikutukset ovat epätodennäköisiä lääkkeiden kanssa, jotka ovat sytokromi P450 -entsyymien substraatteja.
In vitro -kuljettaproteiinijatutkimuksen perusteella miglustaatti ei ole OAT1-, OAT3-, OCT1-, OCT2-, OATP1B1-, OATP1B3- tai BSEP-kuljettajaproteiinien estäjä. Kliinisesti merkittäviä yhteisvaikutuksia suolistossa P-gp- ja BCRP-substraattien kanssa ja maksassa porttilaskimossa OCT1:n, OATP1B1:n ja OATP1B3:n kanssa ei odoteta paastosuositusten ja miglustaatin nopean imeytymisen perusteella.
Eliminaatio
Miglustaatin terminaalinen eliminaation puoliintumisaika oli noin 6 tuntia. Oraalinen puhdistuma oli noin 10,5 l/h ja terminaalivaiheen jakautumistilavuus oli noin 90 l.
Lineaarisuus/ei-lineaarisuus
Miglustaatilla havaittiin olevan annokseen suhteessa oleva kinetiikka.
Erityisryhmät
Sukupuoli, iäkkäät ja rotu/etninen alkuperä
Yhdistetyn populaatiofarmakokineettisen analyysin perusteella sukupuolella, iällä (18–74 vuotta) ja rodulla/etnisellä alkuperällä ei ollut kliinisesti merkittävää vaikutusta miglustaatin ja sipaglukosidaasi alfan yhdistelmän altistukseen.
Maksan vajaatoiminta
Miglustaatin farmakokinetiikkaa yhdessä sipaglukosidaasi alfa -hoidon kanssa ei ole arvioitu maksan vajaatoimintaa sairastavilla potilailla.
Munuaisten vajaatoiminta
Miglustaatin AUC0–24 h -arvo lisääntyi 21 %:lla, 32 %:lla ja 41 %:lla potilailla, joilla on lievä (kreatiniinipuhdistuma [CLcr] 60–89 ml/minuutti, Cockcroft-Gault-yhtälöllä arvioituna), kohtalainen (CLcr 30–59 ml/minuutti) ja vaikea (CLcr 15–29 ml/minuutti) munuaisten vajaatoiminta, verrattuna potilaisiin, joiden munuaisten toiminta oli normaalia. Loppuvaiheen munuaissairauden vaikutusta miglustaatin farmakokinetiikkaan ei tunneta.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, kerta-annoksen ja toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja mutageenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Hiirten paksusuolen karsinoomia esiintyi ajoittain suun kautta annetun miglustaattihoidon jälkeen annoksilla 210, 420 ja 840/500 mg/kg/vrk kahden vuoden ajan annettuina. Nämä annokset vastaavat 8-, 16- ja 33/19-kertaista annosta suhteessa ihmisen annokseen 200 mg kolme kertaa vuorokaudessa. Näiden löydösten merkitystä miglustaattia käyttäville ihmisille ei tunneta Pompen taudin hoidossa käytettävillä merkittävästi pienemmillä tutkituilla annoksilla 195–260 mg joka toinen viikko.
Lisääntymis- ja kehitystoksikologia
Segmentin I tutkimuksessa urosrotilla miglustaatin ja sipaglukosidaasi alfa -hoidon yhdistelmällä tai pelkästään miglustaattilla ei ollut vaikutusta spermatogeneesiin eläinkokeissa.
Toisessa rotilla tehdyssä miglustaattivalmisteen tutkimuksessa miglustaatti, jota annettiin suun kautta johti siementiehyiden ja kivesten atrofiaan/rappeutumiseen altistumiskertoimella 2,0, joka on suurin suositeltu kehon pinta-alaan (mg/m2) perustuva ihmisannos (MRHD). Myös rotilla, jotka saivat miglustaattia, havaittiin spermatogeneesin heikentymistä sekä sperman morfologian ja motiliteetin muutoksia sekä hedelmällisyyden heikentymistä annoksilla, joiden altistus oli kerrannainen 0,6:lla suhteessa kehon pinta-alaan. Heikentynyt spermatogeneesi palautui rotilla 6 viikon kuluttua vaikuttavan aineen saannin loppumisesta.
Rotilla tehdyssä segmentin I hedelmällisyyttä ja varhaista alkion kehitystä koskevassa tutkimuksessa havaittiin ennen implantaatiota tapahtuvia keskenmenoja tutkimuksen naaraiden hedelmällisyyskomponentissa, sekä pelkkää miglustaattia saaneella ryhmällä että yhdistelmähoitoryhmällä. Tämän katsottiin liittyvän miglustaattiin. Yhdistelmähoidossa sipaglukosidaasi alfan ja miglustaatin MRHD:n marginaalit olivat 27-kertaiset ja miglustaatin 4-kertaiset plasman AUC-altistuksen perusteella.
Segmentin II alkion ja sikiön kehitystutkimuksessa ei havaittu sipaglukosidaasi alfasta tai miglustaatista suoraan johtuvia haittavaikutuksia tiineillä rotilla tai niiden jälkeläisillä.
Kaneilla tehdyssä alkion ja sikiön kehitystä koskevassa tutkimuksessa emovaikutuksia, mukaan lukien vähentynyttä ruuankulutusta ja painonnousua, havaittiin sekä pelkällä miglustaatilla että yhdistelmäryhmällä. Sipaglukosidaasi alfan ja miglustaatin yhdistelmä (mutta ei sipaglukosidaasi alfa ilman miglustaattia) johti kaneilla kardiovaskulaaristen epämuodostumien lisääntymiseen (atreettinen keuhkorunko, kammion väliseinän vajaatoiminta ja laajentunut aortan kaari) MRHD- kerta-annoksen perusteella 16-kertaisella sipaglukosidaasi alfalle altistuksella ja 3-kertaisella miglustaatille altistuksella ja tai kumulatiivisen annostuksen perusteella vastaavasti 112-kertaisesti ja 21-kertaisesti. Ei kuitenkaan voida poissulkea sitä mahdollisuutta, että kaneilla havaitut alkioon ja sikiöön kohdistuvat haittavaikutukset olisivat voineet ilmetä kerta-altistuksen jälkeen. Havaitsematonta haittavaikutusta (NOAEL) ei voitu määrittää yhdistelmäryhmälle, koska testattiin vain yksi yhdistelmäannos.
Segmentin III pre- ja postnataalisessa kehitystutkimuksessa rotilla ei havaittu haitallisia emon tai postnataalisen kehityksen vaikutuksia, jotka olisivat johtuneet suoraan sipaglukosidaasi alfasta tai miglustaatista. Yhdistelmähoitoryhmän rottien maidon arviointi osoitti miglustaatin ja sipaglukosidaasi alfan erittymistä rotanmaitoon. 2,5 tuntia annoksen jälkeen rotan maidon sipaglukosidaasi alfalle altistumisen suhde plasmaan oli 0,038.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Esigelatinoitu tärkkelys (maissi), Magnesiumstearaatti (E470b), Mikrokiteinen selluloosa (E460i), Sukraloosi (E955), Kolloidinen piidioksidi
Kapselin kuori
Gelatiini, Titaanidioksidi (E171), Musta rautaoksidi (E172)
Syömäkelpoinen painomuste
Musta rautaoksidi (E172), Kaliumhydroksidi (E525), Propyleeniglykoli (E1520), Sellakka (E904), Vahva ammoniakkiliuos (E527)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OPFOLDA kapseli, kova
65 mg (L:ei) 24 kpl (714,63 €)
PF-selosteen tieto
40 ml:n suurtiheyspolyeteenipullo (HDPE), jossa on 33 mm:n valkoinen lapsiturvallinen polypropeenikorkki ja etiketti. Pullon aukko on suljettu induktiotiivistetyllä foliovuorauksella.
4 ja 24 kapselin pullot.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Koon 2 kova kapseli (6,35 x 18,0 mm), jossa on harmaa läpinäkymätön kansiosa ja valkoinen läpinäkymätön runko-osa. Kapselin runkoon on painettu mustalla värillä teksti ”AT2221”. Kapseli sisältää valkoista tai luonnonvalkoista jauhetta.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
OPFOLDA kapseli, kova
65 mg 24 kpl
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Miglustaatti: Myöhään alkanutta Pompen tautia sairastavien aikuisten korvaushoito yhdistelmänä sipaglukosidaasi alfan kanssa erityisin edellytyksin (3104).
OPFOLDA kapseli, kova
65 mg 4 kpl
- Ei korvausta.
ATC-koodi
A16AX06
Valmisteyhteenvedon muuttamispäivämäärä
01.10.2024
Yhteystiedot
Block 1, Blanchardstown Corporate Park, Ballycoolen Road, Blanchardstown
D15 AKK1 Dublin
Ireland
Tel:+353(0)1588 6850
