HETRONIFLY infuusiokonsentraatti, liuosta varten 10 mg/ml
not_interestedSaatavuushäiriö
Ei saatavilla
HETRONIFLY infuusiokonsentraatti, liuosta varten
- 10 mg/ml10 ml15.11.2025 - 28.02.2026
Saatavilla
Vaihtokelpoisia tai muita samaa lääkeainetta sisältäviä valmisteita ei saatavilla.
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Serplulimabi on humanisoitu vasta-aine (IgG4-/kappa-isotyyppi stabiloivalla sekvenssimuunnoksella sarana-alueella), jota valmistetaan kiinanhamsterin munasarjasoluissa yhdistelmä-DNA-tekniikalla.
Apuaine, jonka vaikutus tunnetaan
Yksi 10 ml:n injektiopullo sisältää 0,98 mmol (22,5 mg) natriumia ja 2,0 mg polysorbaatti 80:tä (E433).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Yksi millilitra liuokseen tarkoitettua infuusiokonsentraattia sisältää 10 mg serplulimabia.
Yksi 10 ml:n injektiopullo konsentraattia sisältää 100 mg serplulimabia.
Lääkemuoto
Infuusiokonsentraatti liuosta varten (steriili konsentraatti).
Kliiniset tiedot
Käyttöaiheet
HETRONIFLY yhdessä karboplatiinin ja etoposidin kanssa on tarkoitettu ensilinjan hoidoksi levinnyttä pienisoluista keuhkosyöpää (ES‑SCLC) sairastaville aikuispotilaille.
Ehto
Hoito tulee aloittaa ja hoitoa tulee jatkaa syöpähoitoihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoidon saa aloittaa ja sitä saa valvoa vain sellainen lääkäri, jolla on kokemusta syövän hoidosta.
Annostus
Suositeltu annos on 4,5 mg/kg (kehon paino) serplulimabia joka 3. viikko, kunnes sairaus etenee tai ilmenee sietämätöntä toksisuutta.
Annoksen lykkääminen tai lääkityksen keskeyttäminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet)
HETRONIFLY-annoksen suurentamista tai pienentämistä ei suositella. Potilaan turvallisuuden takaaminen tai potilaan sietokyky voivat edellyttää tauon pitämistä lääkityksessä tai lääkityksen keskeyttämistä. Sietokykyyn liittyvistä syistä lääkityksessä voidaan pitää korkeintaan 12 viikon tauko (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Immuunivälitteisten haittavaikutusten suositeltava hoito on kuvattu taulukossa 1.
Taulukko 1. Suositellut hoitomuutokset
| Haittavaikutukset | Vaikeusaste | Hoitomuutos# |
| Immuunivälitteinen keuhkosairaus | Aste 2 | Pidä taukoa, kunnes haittavaikutukset parantuvat tai lievittyvät asteeseen 1. |
| Aste 3 tai 4 tai uusiutuva aste 2 | Keskeytä pysyvästi. | |
| Immuunivälitteinen paksusuolitulehdus | Aste 2 tai 3 | Pidä taukoa, kunnes haittavaikutukset parantuvat tai lievittyvät asteeseen 1. |
| Aste 4 tai uusiutuva aste 3 | Keskeytä pysyvästi. | |
| Immuunivälitteinen hepatiitti | Aste 2 ja ASAT tai ALAT > 3–5 kertaa ULN tai kokonaisbilirubiini > 1,5–3 kertaa ULN | Pidä taukoa, kunnes haittavaikutukset parantuvat tai lievittyvät asteeseen 1. |
| Aste 3 tai 4 ja ASAT tai ALAT > 5 kertaa ULN tai kokonaisbilirubiini > 3 kertaa ULN | Keskeytä pysyvästi. | |
| Immuunivälitteinen munuaistulehdus ja munuaisten vajaatoiminta | Asteen 2 kohonnut seerumin kreatiniiniarvo | Pidä taukoa, kunnes haittavaikutukset parantuvat tai lievittyvät asteeseen 1. |
| Asteen 3 tai 4 kohonnut seerumin kreatiniiniarvo | Keskeytä pysyvästi. | |
| Immuunivälitteiset umpierityssairaudet | Oireileva Asteen 2 tai 3 kilpirauhasen vajaatoiminta Asteen 2 tai 3 kilpirauhasen liikatoiminta Asteen 2 tai 3 hypofysiitti Asteen 2 lisämunuaisten vajaatoiminta Asteen 3 hyperglykemia tai tyypin 1 diabetes | Pidä taukoa, kunnes oireet loppuvat ja kortikosteroidihoito on saatu päätökseen. Hoitoa jatketaan hormonikorvaushoidon yhteydessä, jos oireita ei ilmene. |
Asteen 4 kilpirauhasen vajaatoiminta Asteen 4 kilpirauhasen liikatoiminta Asteen 4 hypofysiitti Asteen 3 tai 4 lisämunuaisten vajaatoiminta Asteen 4 hyperglykemia | Keskeytä pysyvästi. | |
| Immuunivälitteiset ihoreaktiot | Aste 3 | Pidä taukoa, kunnes haittavaikutukset parantuvat tai lievittyvät asteeseen 1. |
| Asteen 4 Stevens–Johnsonin oireyhtymä (SJS) tai toksinen epidermaalinen nekrolyysi (TEN) | Keskeytä pysyvästi. | |
| Muut immuunivälitteiset haittavaikutukset | Asteen 3 tai 4 kohonnut seerumin amylaasi- tai lipaasiarvo Asteen 2 tai 3 haimatulehdus Asteen 2 sydänlihastulehdus* Asteen 2 tai 3 muut ensimmäistä kertaa ilmenneet immuunivälitteiset haittavaikutukset Asteen 3 vähentynyt trombosyyttimäärä (trombosytopenia) tai valkosolumäärä | Pidä taukoa, kunnes haittavaikutukset parantuvat tai lievittyvät asteeseen 1. |
Asteen 4 haimatulehdus tai minkä tahansa asteinen uusiutuva haimatulehdus Asteen 3 tai 4 sydänlihastulehdus Asteen 3 tai 4 aivotulehdus Asteen 4 muut ensimmäistä kertaa ilmenneet immuunivälitteiset haittavaikutukset Asteen 4 tai uusiutuva asteen 3 vähentynyt trombosyyttimäärä (trombosytopenia) tai valkosolumäärä | Keskeytä pysyvästi. | |
| Infuusioon liittyvät reaktiot | Aste 2 | Laske infuusionopeus puoleen tai keskeytä infuusio. Hoitoa voidaan jatkaa, kun tapahtuma on ratkaistu. |
| Aste 3 tai 4 | Keskeytä pysyvästi. |
Huomautus: toksisuusasteet noudattavat National Cancer Instituten ”Common Terminology Criteria for Adverse Events” -kriteerien versiota 5.0 (NCI‑CTCAE v5.0).
#: serplulimabihoito on keskeytettävä pysyvästi, jos ilmenee mikä tahansa asteen 3 toistuva immuunivälitteinen haittavaikutus tai mikä tahansa asteen 4 immuunivälitteinen haittavaikutus, lukuun ottamatta umpierityssairauksia, joita hallitaan korvaushormoneilla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
†: ALAT: alaniiniaminotransferaasi, ASAT: aspartaattiaminotransferaasi, ULN: normaalin yläraja
*: Serplulimabihoidon uusimisen turvallisuudesta potilailla, joilla on ilmennyt immuunivälitteinen sydänlihastulehdus, ei ole varmuutta.
Erityisryhmät
Iäkkäät
Annoksen muuttaminen ei ole tarpeen iäkkäillä potilailla (≥ 65 vuotta) (ks. kohta Farmakodynamiikka ja kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen potilailla, joilla on lievä (CRCL = 60‑89 ml/min) tai keskivaikea (CRCL = 30‑59 ml/min) munuaisten vajaatoiminta. Vaikeaa (CRCL = 15‑29 ml/min) munuaisten vajaatoimintaa sairastavista potilaista ei ole saatu riittävästi tietoja, eikä annossuositusta voida antaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen potilailla, joilla on lievää (bilirubiini ≤ ULN ja ASAT > ULN tai bilirubiini > 1–1,5 × ULN ja mikä tahansa ASAT) maksan vajaatoimintaa. Tietoja ei ole riittävästi potilaista, joilla on keskivaikeaa (bilirubiini > 1,5–3 × ULN ja mikä tahansa ASAT) maksan vajaatoimintaa, eikä tietoja ole saatavilla vaikeasta (bilirubiini > 3 × ULN ja mikä tahansa ASAT) maksan vajaatoiminnasta (katso kohta Farmakokinetiikka). Annostelusuosituksia ei voida antaa potilaille, joilla on keskivaikea tai vaikea maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Serplulimabia ei ole tarkoitettu käytettäväksi pienisoluista keuhkosyöpää sairastavien lapsipotilaiden hoitoon.
Antotapa
HETRONIFLY on tarkoitettu laskimonsisäiseen käyttöön.
Infuusionopeudeksi on aluksi asetettava korkeintaan 100 ml tunnissa. Jos ensimmäistä infuusiota siedetään hyvin, kaikkia seuraavia infuusiokertoja voidaan lyhentää 30 minuuttiin (±10 minuuttia).
Annettaessa yhdessä kemoterapian kanssa HETRONIFLY on annettava ensin ja kemoterapia sen jälkeen samana päivänä. Käytä kuhunkin infuusioon eri infuusiopussia.
HETRONIFLYta ei saa antaa nopeana laskimonsisäisenä injektiona tai bolusinjektiona.
Tarvittava HETRONIFLY-kokonaisannos on laimennettava injektioon käytettävällä 9 mg/ml:n (0,9 %) natriumkloridiliuoksella (katso kohta Käyttö- ja käsittelyohjeet).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ja käsittelystä ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun on valmisteen nimi ja eränumero dokumentoitava selkeästi.
Immuunivälitteiset haittavaikutukset
Immuunivälitteisiä haittavaikutuksia – vaikeat ja kuolemaan johtaneet tapaukset mukaan lukien – on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Suurin osa immuunivälitteisistä, hoidon aikana ilmenneistä haittavaikutuksista voitiin parantaa ja niitä voitiin hallita pitämällä hoidosta taukoa ja antamalla kortikosteroideja ja/tai tukihoitoa (ks. kohta Annostus ja antotapa). Immuunivälitteisiä haittavaikutuksia on ilmennyt myös korkeintaan 3,6 kuukauden kuluttua viimeisen annoksen jälkeen. Useampaan kuin yhteen kehon järjestelmään samanaikaisesti vaikuttavat, immuunivälitteiset haittavaikutukset ovat mahdollisia.
Epäiltyjen immuunivälitteisten haittavaikutusten kohdalla etiologia on vahvistettava ja muut syyt suljettava pois riittävällä arvioinnilla. Hoidosta on pidettävä taukoa, ja kortikosteroideja annettava haittavaikutuksen vaikeusasteen mukaan. Useimpien asteen 2 ja joidenkin tiettyjen asteen 3 tai 4 immuunivälitteisten haittavaikutusten kohdalla lääkkeen antamisessa on pidettävä taukoa, kunnes vaikutukset paranevat tai lievittyvät asteeseen 1. Serplulimabihoito on keskeytettävä pysyvästi, jos ilmenee mikä tahansa asteen 4 tai tietty asteen 3 immuunivälitteinen haittavaikutus. Useimpien asteen 3 tai 4 ja joidenkin tiettyjen asteen 2 immuunivälitteisten haittavaikutusten (esim. immuunivälitteinen keuhkotulehdus, immuunivälitteinen sydänlihastulehdus) kohdalla kortikosteroidihoitoa (1‑2 mg/kg/päivä, prednisoni tai vastaava) tai muita kliinisten oireiden mukaisia hoitoja on annettava, kunnes haittavaikutukset paranevat tai lievittyvät asteeseen 1. Kun vaikutukset ovat lievittyneet asteeseen ≤ 1, on aloitettava kortikosteroidiannoksen asteittainen pienentäminen, jota on jatkettava vähintään yhden kuukauden ajan. Annoksen nopea pienentäminen voi johtaa haittavaikutuksen pahentumiseen tai toistumiseen. Kortikosteroiditonta immunosuppressiivista hoitoa (esim. infliksimabi) on myös käytettävä, jos haittavaikutukset pahenevat tai eivät lievity kortikosteroidihoidolla.
Immuunivälitteinen keuhkosairaus
Immuunivälitteistä keuhkotulehdusta – kuolemaan johtaneet tapaukset mukaan lukien – on raportoitu ilmenneen HETRONIFLYta saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava immuunivälitteisen keuhkotulehduksen merkkien ja oireiden – kuten röntgenmuutosten (esim. fokaaliset mattalasivarjostumat, paikoittaiset filtraatit), dyspnean ja hypoksian – varalta. Epäilty immuunivälitteinen keuhkotulehdus on vahvistettava röntgenkuvauksella, ja muut syyt on poissuljettava. Ks. hoitomuutos kohdasta Annostus ja antotapa.
Immuunivälitteinen paksusuolitulehdus
Immuunivälitteistä paksusuolitulehdusta – kuolemaan johtaneet tapaukset mukaan lukien – on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava immuunivälitteisen paksusuolitulehduksen merkkien ja oireiden – kuten vatsakivun, ripulin ja limaisen tai verisen ulosteen – varalta. Infektio ja muut sairausvälitteiset etiologiat on poissuljettava. Ks. hoitomuutos kohdasta Annostus ja antotapa. Maha-suolikanavan perforaation riski on otettava huomioon ja vahvistettava tarvittaessa röntgenkuvauksella ja/tai endoskopialla.
Immuunivälitteinen hepatiitti
Immuunivälitteistä hepatiittia – kuolemaan johtaneet tapaukset mukaan lukien – on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava maksan toiminnan muutosten ja immuunivälitteisen hepatiitin kliinisten merkkien ja oireiden – kuten kohonneiden transaminaasi- ja kokonaisbilirubiiniarvojen varalta säännöllisesti (joka kuukausi). Infektio ja sairauksiin liittyvät etiologiat on poissuljettava. Maksan toimintakokeita pitää seurata useammin, jos ilmenee immuunivälitteistä hepatiittia. Ks. hoitomuutos kohdasta Annostus ja antotapa.
Immuunivälitteinen munuaistulehdus ja munuaisten vajaatoiminta
Immuunivälitteistä munuaistulehdusta ja munuaisten vajaatoimintaa on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava munuaisten toiminnan muutosten ja immuunivälitteisen munuaistulehduksen ja munuaisten vajaatoiminnan kliinisten merkkien ja oireiden varalta säännöllisesti (joka kuukausi). Munuaisten toimintakokeita pitää seurata useammin, jos ilmenee immuunivälitteistä munuaistulehdusta. Useimmilla potilailla esiintyy oireetonta seerumin kreatiniiniarvon kohoamista. Sairauteen liittyvät etiologiat on poissuljettava. Ks. hoitomuutos kohdasta Annostus ja antotapa.
Immuunivälitteiset umpierityssairaudet
Kilpirauhassairaudet
Kilpirauhashäiriöitä – mukaan lukien kilpirauhasen liikatoimintaa, kilpirauhasen vajaatoimintaa ja kilpirauhastulehdusta – on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita tulee seurata kilpirauhastoiminnan muutosten ja kilpirauhashäiriöiden kliinisten merkkien ja oireiden varalta. Jos ilmenee asteen 2 tai 3 oireilevaa kilpirauhasen vajaatoimintaa, serplulimabilääkityksessä on pidettävä tauko, ja kilpirauhashormonikorvaushoito on aloitettava tarpeen vaatiessa. Jos ilmenee asteen 2 tai 3 oireilevaa kilpirauhasen liikatoimintaa, serplulimabilääkityksessä on pidettävä tauko ja tyreostaattilääkitys on aloitettava tarpeen vaatiessa. Jos epäillään kilpirauhasen akuuttia tulehdusta, serplulimabilääkityksessä on pidettävä tauko, ja hormonihoito on aloitettava. Hoitoa voidaan jatkaa, kun kilpirauhasen vajaa- tai liikatoiminnan oireet ovat hallinnassa, ja kilpirauhastoiminta on parantunut. Hengenvaarallisen kilpirauhasen liika- tai vajaatoiminnan tapauksessa serplulimabilääkitys on keskeytettävä pysyvästi. Kilpirauhastoimintaa on seurattava jatkuvasti asianmukaisen hormonikorvaushoidon varmistamiseksi (ks. kohta Annostus ja antotapa).
Aivolisäkehäiriöt
Hypofysiittiä on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava hypofysiitin merkkien ja oireiden varalta, ja muut syyt on suljettava pois. Jos ilmenee asteen 2 tai 3 oireilevaa hypofysiittiä, serplulimabilääkityksessä on pidettävä tauko, ja hormonikorvaushoito on aloitettava tarpeen vaatiessa. Jos epäillään akuuttia hypofysiittiä, kortikosteroidihoito on aloitettava. Hengenvaarallisen asteen 4 hypofysiitin tapauksessa serplulimabilääkitys on keskeytettävä pysyvästi (ks. kohta Annostus ja antotapa).
Lisämunuaisten vajaatoiminta
Lisämunuaisten vajaatoimintaa on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava merkkien ja oireiden varalta, ja muut syyt on suljettava pois. Jos ilmenee asteen 2 lisämunuaisten vajaatoimintaa, serplulimabilääkityksessä on pidettävä tauko, ja hormonikorvaushoito on aloitettava tarpeen vaatiessa. Hengenvaarallisen asteen 3 tai 4 lisämunuaisten vajaatoiminnan tapauksessa serplulimabilääkitys on keskeytettävä pysyvästi. Lisämunuaisten toimintaa ja hormonitasoja on seurattava jatkuvasti asianmukaisen hormonikorvaushoidon varmistamiseksi (ks. kohta Annostus ja antotapa).
Hyperglykemia
Hyperglykemiaa tai tyypin 1 diabetesta on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaiden verensokeritasoa on tarkkailtava, ja heitä on seurattava siihen liittyvien kliinisten merkkien ja oireiden varalta. Insuliinikorvaushoito on aloitettava tarpeen vaatiessa. Jos ilmenee tyypin 1 diabetesta huonolla verensokeritason hallinnalla, serplulimabihoidossa on pidettävä taukoa, ja insuliinikorvaushoitoa on annettava, kunnes oireet lievittyvät. Hengenvaarallisen asteen 4 tyypin 1 diabeteksen tapauksessa serplulimabilääkitys on keskeytettävä pysyvästi. Verensokeritasoja on seurattava jatkuvasti asianmukaisen insuliinikorvaushoidon varmistamiseksi (ks. kohta Annostus ja antotapa).
Immuunivälitteiset ihoreaktiot
Immuunivälitteisiä ihoreaktioita on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Jos ilmenee asteen 1 tai 2 ihottumaa, serplulimabihoitoa voidaan jatkaa ja oireenmukaista hoitoa tai paikallista kortikosteroidihoitoa voidaan antaa. Jos ilmenee asteen 3 ihottumaa, serplulimabihoidossa on pidettävä tauko, ja oireenmukaista hoitoa tai paikallista kortikosteroidihoitoa on annettava. Jos ilmenee asteen 4 ihottumaa, Stevens–Johnsonin oireyhtymä (SJS) tai toksinen epidermaalinen nekrolyysi (TEN), serplulimabihoito on keskeytettävä pysyvästi (ks. kohta Annostus ja antotapa).
Immuunivälitteinen haimatulehdus
Immuunivälitteistä haimatulehdusta – kohonneet seerumin amylaasi- ja lipaasitasot sekä kuolemaan johtaneet tapaukset – on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava seerumin lipaasi- ja amylaasitasojen muutosten (hoidon alussa, säännöllisesti hoidon aikana ja tarpeen mukaan kliinisen arvioinnin mukaisesti) ja haimatulehduksen kliinisten merkkien ja oireiden varalta. Jos ilmenee asteen 3 tai asteen 4 kohonnut seerumin amylaasi- tai lipaasitaso tai asteen 2 tai 3 haimatulehdus, serplulimabihoidossa on pidettävä tauko. Jos ilmenee asteen 4 haimatulehdus tai minkä tahansa asteinen uusiutuva haimatulehdus, serplulimabihoito on keskeytettävä pysyvästi (ks. kohta Annostus ja antotapa).
Immuunivälitteinen sydänlihastulehdus
Immuunivälitteistä sydänlihastulehdusta – kuolemaan johtaneet tapaukset mukaan lukien – on raportoitu ilmenneen serplulimabia saaneilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava sydänlihastulehduksen kliinisten merkkien ja oireiden varalta. Epäilty immuunivälitteinen sydänlihastulehdus on vahvistettava sydänlihasentsyymitutkimuksilla, ja muut syyt on poissuljettava. Jos ilmenee asteen 2 sydänlihastulehdusta, serplulimabihoidossa on pidettävä tauko, ja kortikosteroidihoitoa annettava. Serplulimabihoidon uudelleenaloittamisen turvallisuudesta potilailla, joilla on aiemmin ilmennyt immuunivälitteinen sydänlihastulehdus, ei ole varmuutta. On suositeltavaa järjestää monialainen keskustelu ennen serplulimabihoidon aloittamista uudelleen potilailla, joilla on aiemmin ilmennyt asteen 2 sydänlihastulehdus. Päätöksessä on huomioitava erilaiset kliiniset seikat, kuten sydämen toipumisaste, syövän vaste hoitoon, vaihtoehtoisten syöpähoitojen saatavuus sekä prognoosi. Jos ilmenee asteen 3 tai 4 sydänlihastulehdus, serplulimabilääkitys on keskeytettävä pysyvästi, ja kortikosteroidihoito on aloitettava. Kun sydänlihastulehdus on diagnosoitu, serplulimabihoidossa on pidettävä tauko tai se on keskeytettävä pysyvästi. Sydänlihasentsyymejä ja sydämen toimintaa on seurattava huolellisesti minkä tahansa asteisen sydänlihastulehduksen varalta (ks. kohta Annostus ja antotapa).
Immuunivälitteinen uveiitti
Jos uveiittia ja muita immuunivälitteisiä haittavaikutuksia – kuten Vogt‑Koyanagi‑Haradan oireyhtymää – ilmenee samanaikaisesti, systeemisiä kortikosteroideja on annettava pysyvän sokeutumisen välttämiseksi.
Muut immuunivälitteiset haittavaikutukset
Serplulimabin toimintamekanismin vuoksi muut immuunivälitteiset haittavaikutukset ovat mahdollisia. Muita kuolemaan johtaneita ja hengenvaarallisia immuunivälitteisiä haittavaikutuksia on havaittu serplulimabilla hoidetuilla potilailla kliinisissä tutkimuksissa eri annosten ja kasvaintyyppien kohdalla: trombosytopenia, äkillinen sepelvaltimo-oireyhtymä, sydäninfarkti ja immuunivälitteinen aivotulehdus (ks. kohta Haittavaikutukset).
Muiden epäiltyjen immuunivälitteisten haittavaikutusten kohdalla etiologia on vahvistettava ja muut syyt suljettava pois riittävällä arvioinnilla. Haittavaikutusten vaikeusasteesta riippuen serplulimabihoidossa on pidettävä taukoa ensimmäistä kertaa ilmenevien asteen 2 tai 3 immuunivälitteisten haittavaikutusten kohdalla. Serplulimabihoito on keskeytettävä pysyvästi, jos ilmenee toistuvia asteen 3 immuunivälitteisiä haittavaikutuksia (umpierityssairauksia lukuun ottamatta) tai asteen 4 immuunivälitteisiä haittavaikutuksia. Kortikosteroidihoito voidaan aloittaa, jos se on kliinisesti perusteltua (ks. kohta Annostus ja antotapa).
Infuusioon liittyvät reaktiot
Infuusioon liittyviä haittavaikutuksia on raportoitu ilmenneen serplulimabia saaneilla potilailla. Potilaita on seurattava infuusioon liittyvien vaikutusten kliinisten merkkien ja oireiden varalta. Hoidon antamista voidaan jatkaa potilailla, joilla on ilmennyt asteen 1 infuusioon liittyviä vaikutuksia, kunhan heitä seurataan huolellisesti. Infuusionopeutta on laskettava tai hoito keskeytettävä potilailla, joilla esiintyy asteen 2 infuusioon liittyviä vaikutuksia. Kuumelääkkeiden ja antihistamiinien käyttöä voidaan harkita. Serplulimabihoitoa voidaan jatkaa huolellisessa seurannassa, kun asteen 2 infuusioon liittyvät vaikutukset on saatu hallintaan. Jos ilmenee asteen ≥ 3 infuusioon liittyviä vaikutuksia, infuusio on pysäytettävä välittömästi, hoito keskeytettävä pysyvästi, ja asianmukaista hoitoa on annettava (ks. kohta Annostus ja antotapa).
Kliinisistä tutkimuksista poissuljetut potilaat
Potilaat, joilla oli jokin seuraavista tiloista, poissuljettiin kliinisistä tutkimuksista: aiempi aktiivinen tai aiempi dokumentoitu autoimmuunisairaus; potilaat, joilla oli aktiivinen tuberkuloosi, B- tai C-hepatiitti tai HIV-infektio; potilaat, jotka saivat heikennettyjä taudinaiheuttajia sisältävän rokotteen 28 päivän sisällä ennen serplulimabin antamista; potilaat, joilla oli aktiivinen infektio, joka vaati systeemistä infektiohoitoa, 14 päivän sisällä ennen ensimmäistä annosta; aiempi keuhkotulehdus tai interstitiaalinen keuhkosairaus; potilaat, joilla oli aktiivisia aivometastaaseja; aiempi merkittävä sydän- ja verisuonisairaus (esim. sydäninfarkti puolen vuoden sisällä); aiempi yliherkkyys toiselle monoklonaaliselle vasta-aineelle; systeemiset immunosuppressiiviset lääkevalmisteet kahden viikon sisällä ennen serplulimabin saamista.
Apuaineet, joiden vaikutus tunnetaan
Tämä lääkevalmiste sisältää 0,98 mmol (tai 22,5 mg) natriumia per 10 ml:n injektiopullo, joka vastaa 1,1 %:a WHO:n suosittelemasta natriumin 2 mg:n päivittäisestä enimmäissaannista aikuisille.
Tämä lääkevalmiste sisältää 2,0 mg polysorbaatti 80:tä (E433) per 10 ml:n injektiopullo. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ja käsittelystä ennen lääkkeen antoa.
Potilaskortti
Lääkemääräyksen antajan on keskusteltava serplulimabihoidon riskeistä potilaan kanssa. Potilas saa potilaskortin kunkin reseptin mukana.
Yhteisvaikutukset
Lääkkeiden välisiä yhteisvaikutuksia koskevia tutkimuksia ei ole suoritettu. Koska monoklonaaliset vasta-aineet eivät metaboloidu sytokromi P450 (CYP) -entsyymien tai muiden lääkkeitä metaboloivien entsyymien vaikutuksesta, yhdessä annettavien lääkevalmisteiden näille entsyymeille aiheuttaman inhibitio- tai induktiovaikutuksen ei odoteta vaikuttavan HETRONIFLYn farmakokinetiikkaan.
Systeemisten kortikosteroidien tai immuunisalpaajien käyttöä on vältettävä ennen serplulimabihoidon aloittamista, koska ne saattavat vaikuttaa lääkkeen farmakodynaamiseen toimintaan ja tehokkuuteen. Systeemisillä kortikosteroideilla tai muilla immuunisalpaajilla voidaan kuitenkin hoitaa immuunivälitteisiä haittavaikutuksia serplulimabihoidon aloittamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisymenetelmää hoidon aikana ja vähintään kuusi kuukautta viimeisen serplulimabiannoksen jälkeen.
Raskaus
Serplulimabin käytöstä raskaana olevilla naisilla ei ole tietoa. Eläinkokeet ovat osoittaneet, että PD‑1-reitin estäminen aiheuttaa alkio- ja sikiötoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Ihmisen IgG:n tiedetään läpäisevän istukan ja serplulimabi on IgG4, joten se saattaa siirtyä äidistä kehittyvään sikiöön. Serplulimabia ei suositella käytettäväksi raskauden aikana eikä sellaisilla naisilla, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö serplulimabi ihmisillä äidinmaitoon. Ihmisen IgG:iden tiedetään erittyvän rintamaitoon muutaman ensimmäisen päivän aikana syntymän jälkeen. Pitoisuus laskee nopeasti alhaiselle tasolle. Tästä syystä imetettävälle vauvalle koituvaa riskiä ei voida poissulkea tämän lyhyen ajanjakson aikana. Myöhemmin serplulimabia voidaan käyttää imetyksen aikana, jos sille on kliinistä tarvetta.
Hedelmällisyys
Hedelmällisyyttä arvioivia tutkimuksia ei ole suoritettu. Siksi serplulimabin vaikutuksesta miesten ja naisten hedelmällisyyteen ei ole tietoa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Serplulimabilla on vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn. Mahdollisten haittavaikutusten, kuten väsymyksen (ks. kohta Haittavaikutukset), vuoksi potilaita on kehotettava olemaan varovaisia ajamisen tai koneiden käyttämisen suhteen, kunnes he ovat varmoja siitä, ettei serplulimabi vaikuta heihin haitallisesti.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Serplulimabin ja kemoterapian turvallisuus perustuu 389 ES‑SCLC-potilaalta saatuihin tietoihin. Yleisimpiä haittavaikutuksia olivat neutropenia (82,8 %), leukopenia (74,0 %), anemia (72,8 %), trombosytopenia (56,0 %), kaljuus (54,2 %), pahoinvointi (36,2 %), hyperlipidemia (32,1 %), vähentynyt ruokahalu (28,3 %), hypoproteinemia (25,4 %) ja hyponatremia (25,4 %).
Yleisimpiä asteen ≥ 3 haittavaikutuksia olivat neutropenia (65,3 %), leukopenia (33,7 %), trombosytopenia (23,1 %), anemia (19,8 %), hyponatremia (10,0 %) ja lymfopenia (5,1 %).
Yleisimpiä vakavia haittavaikutuksia olivat trombosytopenia (9,3 %), neutropenia (7,7 %), leukopenia (6,7 %), keuhkokuume (3,3 %) ja hyperglykemia tai tyypin 1 diabetes (2,3 %).
Yleisimmät immuunivälitteiset haittavaikutukset olivat kilpirauhasen vajaatoiminta (13,1 %), kilpirauhasen liikatoiminta (10,8 %), immuunivälitteiset ihoreaktiot (7,5 %), poikkeava maksatoiminta (4,1 %), immuunivälitteinen keuhkosairaus (3,1 %), anemia (2,8 %), huonovointisuus (2,1 %), hyperglykemia tai tyypin 1 diabetes (1,8 %), immuunivälitteinen paksusuolitulehdus (1,8 %) ja alentunut trombosyyttimäärä (1,5 %).
Serplulimabin käyttö keskeytettiin haittavaikutusten vuoksi 5,4 %:lla potilaista.
Taulukkomuotoinen luettelo haittavaikutuksista
Kliinisessä tutkimuksessa ja markkinoille saattamisen jälkeen raportoidut haittavaikutukset on lueteltu elinjärjestelmän ja esiintymistiheyden mukaan (ks. taulukko 2). Ellei toisin ole mainittu, haittavaikutusten esiintymistiheydet perustuvat haittavaikutusten kokonaisesiintymistiheyksiin, jotka on tunnistettu ASTRUM‑005-tutkimuksessa. Tutkimuksessa 389 potilaalle annettiin serplulimabia ja kemoterapiaa, ja hoidon mediaanikesto oli 22 viikkoa. Ks. kohdasta Farmakodynamiikka tiedot kliinisen päätutkimuksen osallistujien pääominaisuuksista.
Esiintymistiheydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100 – < 1/10), melko harvinainen (≥ 1 / 1 000 – < 1/100), harvinainen (≥ 1 / 10 000 – < 1 / 1 000), hyvin harvinainen (< 1 / 10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Kunkin esiintymistiheysryhmän haittavaikutukset esitetään laskevassa järjestyksessä vaikeusasteen mukaan.
Taulukko 2. HETRONIFLY*-hoitoa saaneiden potilaiden haittavaikutukset ASTRUM‑005-tutkimuksessa
| Serplulimabi yhdessä karboplatiinin ja etoposidin kanssa | |
| Infektiot ja tartunnat | |
| Hyvin yleinen | keuhkokuume a |
| Yleinen | virtsatieinfektio b, hengitystieinfektio c |
| Melko harvinainen | septinen sokki, ihoinfektio, infektion aiheuttama enteriitti, huuli-infektio, herpeettinen meningoenkefaliitti |
| Veri ja imukudos | |
| Hyvin yleinen | neutropenia, leukopenia, anemia, trombosytopenia, lymfopenia |
| Yleinen | poikkeava tulos hyytymiskokeesta d, granulosytopenia |
| Melko harvinainen | imusolmuketulehdus |
| Immuunijärjestelmä | |
| Yleinen | infuusioon liittyvä reaktio e |
| Melko harvinainen | anafylaktinen reaktio |
| Umpieritys | |
| Hyvin yleinen | kilpirauhasen vajaatoiminta f, kilpirauhasen liikatoiminta, hyperglykemia tai tyypin 1 diabetes g |
| Yleinen | poikkeava tulos kilpirauhasen toimintakokeesta h, kilpirauhastulehdus i |
| Melko harvinainen | lisämunuaisten vajaatoiminta j, muu kilpirauhashäiriö k, lisämunuaiskuoren liikatoiminta l, hypofysiitti |
| Aineenvaihdunta ja ravitsemus | |
| Hyvin yleinen | hyperlipidemia, vähentynyt ruokahalu, hypoproteinemia, hyperurikemia, elektrolyyttitasapainon häiriö m |
| Yleinen | laihtuminen, hypoglykemia |
| Melko harvinainen | poikkeava lipoproteiiniarvo |
| Psyykkiset häiriöt | |
| Hyvin yleinen | unettomuus |
| Hermosto | |
| Yleinen | parestesia, päänsärky, heitehuimaus, perifeerinen neuropatian |
| Melko harvinainen | immuunivälitteinen aivotulehduso, huimaus, neurotoksisuus, motorisen toiminnan häiriöt |
| Silmät | |
| Melko harvinainen | sumea näkö |
| Sydän | |
| Hyvin yleinen | rytmihäiriö p |
| Yleinen | sinustakykardia, johtumishäiriötq, sinusbradykardia, sydämen vajaatoimintar, kohonnut aivojen natriureettisen N-terminaalisen propeptidin taso |
| Melko harvinainen | sydänlihassairauss, sydänlihasiskemia, perikardiumeffuusio, kohonnut sydänlihasnekroosin merkkiaineen taso, sydänlihastulehdus |
| Verisuonisto | |
| Yleinen | hypertensio, verisuonitulehdust |
| Hengityselimet, rintakehä ja välikarsina | |
| Hyvin yleinen | yskä |
| Yleinen | keuhkotulehdusu, dyspnea, rintakipu |
| Ruoansulatuselimistö | |
| Hyvin yleinen | pahoinvointi, ummetus, vatsakipu, ripuli, oksentelu |
| Yleinen | dysfagia, ilmavaivat, maha-suolikanavan häiriöv, suutulehdus, dyspepsia |
| Melko harvinainen | kuiva suu, suolitulehdusw, mahatulehdus, immuunivälitteinen haimatulehdus, ienverenvuoto |
| Maksa ja sappi | |
| Hyvin yleinen | kohonnut alaniiniaminotransferaasitaso, kohonnut aspartaattiaminotransferaasitaso, kohonnut gammaglutamyylitransferaasitaso |
| Yleinen | hyperbilirubinemia, maksavauriox |
| Iho ja ihonalaiskudos | |
| Hyvin yleinen | ihottumay, kaljuus |
| Yleinen | kutina, ihotulehdusz, liikahikoilu |
| Melko harvinainen | pigmentaatiohäiriö, psoriaasi, kuiva iho |
| Luusto, lihakset ja sidekudos | |
| Hyvin yleinen | tuki- ja liikuntaelimistön kipuaa |
| Yleinen | nivelsärky, raajan kipu, tuki- ja liikuntaelimistön vaivabb |
| Melko harvinainen | autoimmuunimyosiitti, niveltulehdus |
| Tuntematon | lihastulehduscc |
| Munuaiset ja virtsatiet | |
| Yleinen | kohonnut veren urea-arvo, proteiinia virtsassa, hematuria, munuaisvauriodd, kohonnut veren kreatiniiniarvo, glukosuria, valkosoluja virtsassa |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Hyvin yleinen | kuume, voimattomuus |
| Yleinen | uupumus, huonovointisuus, edeemaee |
| Melko harvinainen | vilunväristykset |
| Tutkimukset | |
| Hyvin yleinen | kohonnut veren alkalinen fosfataasiarvo |
| Yleinen | kohonnut veren myoglobiiniarvo, kohonnut veren kreatiinifosfokinaasiarvo, kohonnut troponiiniarvo |
* Taulukossa 2 esitetyt haittavaikutusten esiintymistiheydet eivät välttämättä johdu täysin HETRONIFLYsta, vaan niihin ovat saattaneet vaikuttaa taustalla olevat sairaudet tai muut yhdessä käytetyt lääkevalmisteet.
Seuraavat termit edustavat samankaltaisten, yhtä sairautta kuvaavien tapahtumien ryhmää yksittäisen tapahtuman sijaan:
- Kattaa keuhkokuumeen ja sienen aiheuttaman keuhkokuumeen.
- Kattaa virtsatieinfektion ja oireettoman bakteriurian.
- Kattaa ylähengitystieinfektion, faryngotonsilliitin ja nielurisatulehduksen.
- Kattaa pidentyneen aktivoidun partiaalisen tromboplastiiniajan, aktivoidun partiaalisen tromboplastiiniajan, lyhentyneen aktivoidun partiaalisen tromboplastiiniajan, alentuneen INR-arvon ja kohonneen protrombiinitason.
- Kattaa lääkeaineyliherkkyyden ja infuusioon liittyvät reaktiot.
- Kattaa kilpirauhasen vajaatoiminnan, kohonneen veren tyreotropiiniarvon, alentuneen vapaan tyroksiiniarvon, sentraalisen kilpirauhasen vajaatoiminnan ja alentuneen trijodityroniiniarvon.
- Kattaa hyperglykemian, tyypin 1 diabeteksen, diabeettisen ketoasidoosin, kohonneen veren ketoainearvon, heikentyneen glukoositoleranssin ja ketoasidoosin.
- Kattaa alentuneen veren tyreotropiiniarvon, kohonneen trijodityroniiniarvon, positiivisen kilpirauhasvasta-aineen, kohonneen tyreoglobuliiniarvon ja kohonneen tyroksiiniarvon.
- Kattaa kilpirauhashäiriön ja kilpirauhastulehduksen.
- Kattaa lisämunuaisten vajaatoiminnan ja alentuneen kortisolitason.
- Kattaa matalan T3-arvon oireyhtymän ja poikkeavan kilpirauhasen ultraäänilöydöksen.
- Kattaa kohonneen kortisolitason ja lisämunuaiskuoren liikatoiminnan.
- Kattaa hyponatremian, hypokalsemian, hypokalemian, hypomagnesemian, hypofosfatemian, hypokloremian, hyperfosfatemian, hyperkalemian, hypermagnesemian ja hyperkalsemian.
- Kattaa perifeerisen neuropatian, perifeerisen sensorimotorisen neuropatian ja immuunivälitteisen neuropatian‑ **.
- Kattaa immuunivälitteisen aivotulehduksen ja autoimmuunienkefaliitin.
- Kattaa supraventrikulaarinset lisälyönnit, supraventrikulaarisen takykardian, rytmihäiriön, kammiolisälyönnit, supraventrikulaarisen rytmihäiriön, eteisvärinän, eteistakykardian, bradyarytmian, varhaisen repolarisaation oireyhtymän, kammioperäisen rytmihäiriön, sydänsähkökäyrän pidentyneen QT-ajan, sydänsähkökäyrän repolarisaatiopoikkeavuuden ja sydänsähkökäyrän poikkeavan T-aallon.
- Kattaa ensimmäisen asteen eteis-kammiokatkoksen, oikean puolen haarakatkoksen, pidentyneen eteisen johtumisajan, vasemman puolen haarakatkoksen ja kammionsisäisen johtumishäiriön.
- Kattaa sydämen vajaatoiminnan, akuutin sydämen vajaatoiminnan ja vasemman kammion vajaatoiminnan.
- Kattaa sydänlihassairauden ja metabolisen sydänlihassairauden.
- Kattaa laskimotulehduksen ja pinnallisen laskimotulehduksen.
- Kattaa immuunivälitteisen keuhkosairauden, keuhkotulehduksen ja interstitiaalisen keuhkosairauden.
- Kattaa maha-suolikanavan verenvuodon, maha-suolikanavan häiriön ja alemman maha-suolikanavan verenvuodon.
- Kattaa suolitulehduksen ja immuunivälitteisen enterokoliitin **.
- Kattaa poikkeavan maksatoiminnan, lääkkeen aiheuttaman maksavaurion, maksavaurion, immuunivälitteisen hepatiitin, immuunivälitteisen maksahäiriön ** ja maksan vajaatoiminnan **.
- Kattaa ihottuman, makulopapulaarisen ihottuman, ekseeman, lääkeaineihottuman, punoituksen ja ihotoksisuuden.
z.Kattaa autoimmuunidermatiitin, ihotulehduksen, allergisen ihotulehduksen, rakkulaisen ihotulehduksen ja seborrooisen ihotulehduksen.
aa. Kattaa selkäkivun, lihaskivun, muskuloskeletaalisen rintakivun, selkärangan kivun ja niskakivun.
bb. Kattaa lihasheikkouden ja tuki- ja liikuntaelimistövaivat.
cc. Kattaa lihastulehduksen ** ja immuunivälitteisen lihastulehduksen **.
dd. Kattaa akuutin munuaisvaurion, munuaisten vajaatoiminnan, munuaisten toiminnan
häiriön ja munuaisvaurion.
ee. Kattaa kasvojen edeeman, perifeerisen edeeman, perifeerisen turvotuksen, turvotuksen ja
turvonneet kasvot.
** Markkinoille saattamisen jälkeinen tapahtuma
Valikoitujen haittavaikutusten kuvaus
Serplulimabi voi aiheuttaa immuunivälitteisiä haittavaikutuksia. Seuraavien immuunivälitteisten haittavaikutusten tiedot perustuvat 1172 potilaaseen, jotka saivat serplulimabia yksilääkehoitona (n = 263) tai yhdessä muiden lääkevalmisteiden kanssa (n = 909) kahdeksana eri annoksena (0,3; 1, 3, 10 mg/kg joka 2. viikko, 4,5 mg/kg joka 3. viikko, 200 mg joka 2. viikko, 300 mg joka 3. viikko tai 400 mg joka 4. viikko), kahdeksassa eri kliinisessä tutkimuksessa. Ohjeet näiden haittavaikutusten hallintaan on annettu kohdissa Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet.
Immuunivälitteinen keuhkosairaus
Immuunivälitteistä keuhkosairautta ilmeni 3,5 %:lla potilaista. Astetta 3 ilmeni 0,9 %:lla, astetta 4 ilmeni 0,1 %:lla ja astetta 5 ilmeni 0,3 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 3,25 kuukautta (vaihteluväli: 0,03‑34,53 kuukautta). Mediaanikesto oli 1,91 kuukautta (vaihteluväli: 0,26‑13,34 kuukautta). 1,6 % potilaista sai suuriannoksista kortikosteroidihoitoa. Immuunivälitteinen keuhkosairaus johti hoidon keskeytykseen 1,0 %:lla potilaista.
Immuunivälitteinen paksusuolitulehdus
Immuunivälitteistä paksusuolitulehdusta ilmeni 2,4 %:lla potilaista – astetta 3 ilmeni 0,6 %:lla ja astetta 5 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 3,01 kuukautta (vaihteluväli: 0,03‑20,11 kuukautta). Mediaanikesto oli 0,43 kuukautta (vaihteluväli: 0,03‑4,40 kuukautta). 0,5 % potilaista sai suuriannoksista kortikosteroidihoitoa. Immuunivälitteinen paksusuolitulehdus johti hoidon keskeytykseen 0,3 %:lla potilaista.
Immuunivälitteinen hepatiitti
Hepatiittia ilmeni 0,7 %:lla potilaista – astetta 3 ilmeni 0,3 %:lla, astetta 4 ilmeni 0,2 %:lla ja astetta 5 ilmeni 0,2 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 2,48 kuukautta (vaihteluväli: 0,43‑6,60 kuukautta). Mediaanikesto oli 0,95 kuukautta (vaihteluväli: 0,53‑1,51 kuukautta). 0,2 % potilaista sai suuriannoksista kortikosteroidihoitoa. Hepatiitti johti hoidon keskeytykseen 0,3 %:lla potilaista. Poikkeavaa maksatoimintaa ilmeni 4,5 %:lla potilaista. Astetta 3 ilmeni 1,0 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 1,51 kuukautta (vaihteluväli: 0,07‑29,73 kuukautta). Mediaanikesto oli 1,41 kuukautta (vaihteluväli: 0,26‑17,54 kuukautta). 0,3 % potilaista sai suuriannoksista kortikosteroidihoitoa. Poikkeava maksatoiminta johti hoidon keskeytykseen 0,3 %:lla potilaista.
Immuunivälitteinen munuaistulehdus ja munuaisten vajaatoiminta
Immuunivälitteistä munuaistulehdusta ja munuaisten vajaatoimintaa ilmeni 2,4 %:lla potilaista – astetta 3 ilmeni 0,3 %:lla ja astetta 4 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 2,78 kuukautta (vaihteluväli: 0,23‑17,28 kuukautta). Mediaanikesto oli 1,12 kuukautta (vaihteluväli: 0,13‑5,32 kuukautta). 0,2 % potilaista sai suuriannoksista kortikosteroidihoitoa. Immuunivälitteinen munuaistulehdus ja munuaisten vajaatoiminta johti hoidon keskeytykseen 0,2 %:lla potilaista.
Immuunivälitteiset umpierityssairaudet
Kilpirauhasen vajaatoiminta
Kilpirauhasen vajaatoimintaa ilmeni 11,2 %:lla potilaista. Astetta 3 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 3,84 kuukautta (vaihteluväli: 0,62‑34,10 kuukautta). Mediaanikesto oli 2,76 kuukautta (vaihteluväli: 0,53‑7,49 kuukautta). 5,9 % potilaista sai kilpirauhashormonikorvaushoitoa. Serplulimabihoitoa ei keskeytetty yhdelläkään potilaalla kilpirauhasen vajaatoiminnan vuoksi.
Kilpirauhasen liikatoiminta
Kilpirauhasen liikatoimintaa ilmeni 6,3 %:lla potilaista. Asteen ≥ 3 kilpirauhasen liikatoimintaa ei ilmennyt. Alkamiseen kulunut mediaaniaika oli 1,79 kuukautta (vaihteluväli: 0,69‑31,18 kuukautta). Mediaanikesto oli 1,41 kuukautta (vaihteluväli: 0,07‑4,21 kuukautta). Serplulimabihoitoa ei keskeytetty yhdelläkään potilaalla kilpirauhasen liikatoiminnan vuoksi.
Kilpirauhastulehdus
Kilpirauhastulehdusta ilmeni 0,7 %:lla potilaista. Asteen ≥ 3 kilpirauhastulehdusta ei ilmennyt. Alkamiseen kulunut mediaaniaika oli 5,65 kuukautta (vaihteluväli: 1,94‑13,50 kuukautta). Mediaanikesto oli 5,93 kuukautta (vaihteluväli: 0,56‑11,30 kuukautta). 0,2 % potilaista sai kilpirauhashormonikorvaushoitoa. Serplulimabihoitoa ei keskeytetty yhdelläkään potilaalla kilpirauhastulehduksen vuoksi.
Lisämunuaishäiriöt
Lisämunuaishäiriöitä ilmeni 0,3 %:lla potilaista. Kaikki tapauksista olivat astetta 2. Alkamiseen kulunut mediaaniaika oli 5,78 kuukautta (vaihteluväli: 5,75‑6,93 kuukautta). Serplulimabihoitoa ei keskeytetty yhdelläkään potilaalla lisämunuaishäiriöiden vuoksi.
Aivolisäkehäiriöt
Aivolisäkehäiriöitä ilmeni 0,9 %:lla potilaista. Astetta 3 ilmeni 0,2 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 6,97 kuukautta (vaihteluväli: 1,41‑20,53 kuukautta). Mediaanikesto oli 2,43 kuukautta. 0,3 % potilaista sai suuriannoksista kortikosteroidihoitoa. Aivolisäkehäiriöt johtivat hoidon keskeytykseen 0,2 %:lla potilaista.
Tyypin 1 diabetes / hyperglykemia
Tyypin 1 diabetesta / hyperglykemiaa ilmeni 1,0 %:lla potilaista – astetta 3 ilmeni 0,5 %:lla ja astetta 4 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 4,09 kuukautta (vaihteluväli: 0,69‑11,10 kuukautta). Mediaanikesto oli 2,96 kuukautta. 0,6 % potilaista sai insuliinikorvaushoitoa. Tyypin 1 diabetes / hyperglykemia johti hoidon keskeytykseen 0,1 %:lla potilaista.
Immuunivälitteiset ihoreaktiot
Immuunivälitteisiä ihoreaktioita ilmeni 8,7 %:lla potilaista. Astetta 3 ilmeni 0,8 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 2,10 kuukautta (vaihteluväli: 0,03‑30,52 kuukautta). Mediaanikesto oli 0,82 kuukautta (vaihteluväli: 0,07‑12,39 kuukautta). 1,4 % potilaista sai suuriannoksista kortikosteroidihoitoa. Immuunivälitteiset ihoreaktiot johtivat hoidon keskeytykseen 0,4 %:lla potilaista.
Immuunivälitteinen haimatulehdus
Immuunivälitteistä haimatulehdusta ilmeni 1,1 %:lla potilaista – astetta 3 ilmeni 0,3 %:lla, astetta 4 ilmeni 0,2 %:lla ja astetta 5 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 2,30 kuukautta (vaihteluväli: 0,23‑12,42 kuukautta). Mediaanikesto oli 0,76 kuukautta (vaihteluväli: 0,16‑10,12 kuukautta). 0,2 % potilaista sai suuriannoksista kortikosteroidihoitoa. Immuunivälitteinen haimatulehdus johti hoidon keskeytykseen 0,2 %:lla potilaista.
Immuunivälitteinen sydänlihastulehdus
Immuunivälitteistä sydänlihastulehdusta ilmeni 0,6 %:lla potilaista – astetta 3 ilmeni 0,2 %:lla ja astetta 5 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 1,87 kuukautta (vaihteluväli: 0,26‑25,36 kuukautta). Mediaanikesto oli 0,89 kuukautta (vaihteluväli: 0,72‑4,57 kuukautta). 0,3 % potilaista sai suuriannoksista kortikosteroidihoitoa. Immuunivälitteinen sydänlihastulehdus johti hoidon keskeytykseen 0,2 %:lla potilaista.
Immuunivälitteinen uveiitti
Immuunivälitteistä uveiittia ilmeni 0,1 %:lla potilaista, ja se oli astetta 1. Alkamiseen kulunut aika oli 6,90 kuukautta. Immuunivälitteisen uveiitin kesto oli 1,35 kuukautta. Tapahtuma saatiin ratkaistua.
Muut immuunivälitteiset haittavaikutukset
Muita serplulimabia saaneilla potilailla raportoituja kliinisesti merkittäviä immuunivälitteisiä haittavaikutuksia on lueteltu alla. Vaikeita tai kuolemaan johtaneita tapauksia on raportoitu joidenkin näiden haittavaikutusten kohdalla.
Veri ja imukudos: anemia, leukopenia, trombosytopenia, neutropenia.
Hermosto: heitehuimaus, immuunivälitteinen aivotulehdus, perifeerinen neuropatia.
Silmät: sumea näkö.
Sydän/verisuonet: äkillinen sepelvaltimo-oireyhtymä, sydäninfarkti, akuutti sydämen vajaatoiminta, sydäntoksisuus, kohonnut troponiiniarvo.
Hengitystiet, rintakehä ja välikarsina: dyspnea, keuhkoahtaumatauti, hengitysvajaus.
Ruoansulatuselimistö: suun haavauma, oksentelu, peräsuolitulehdus.
Yleisoireet ja antopaikassa todettavat haitat: voimattomuus, uupumus, kuume.
Muu: paniikkihäiriö, tinnitus, akuutti sappitietulehdus, sepsis, alentunut kortisoliarvo, kohonnut veren alkalinen fosfataasiarvo, elektrolyyttitasapainon häiriö.
Infuusioon liittyvät reaktiot
Infuusioon liittyviä reaktioita ilmeni 1,4 %:lla potilaista – astetta 3 ilmeni 0,2 %:lla ja astetta 4 ilmeni 0,1 %:lla potilaista. Alkamiseen kulunut mediaaniaika oli 1,02 kuukautta (vaihteluväli: 0,03‑9,86 kuukautta). Mediaanikesto oli 0,07 kuukautta (vaihteluväli: 0,03‑0,53 kuukautta). Serplulimabihoitoa ei keskeytetty yhdelläkään potilaalla infuusioon liittyvien reaktioiden vuoksi.
Poikkeavat laboratorioarvot
Niiden potilaiden osuudet, joilla ilmeni muutos lähtötasosta asteen ≥ 3 poikkeavaan laboratorioarvoon, olivat seuraavat: 0,6 %:lla trombosyyttimäärä laski, 0,4 %:lla neutrofiilimäärä laski, 0,3 %:lla veren kreatiinifosfokinaasiarvo kohosi, 0,2 %:lla valkosolumäärä laski, 0,1 %:lla veren laktaattidehydrogenaasiarvo kohosi ja 0,1 %:lla veren kolesteroliarvo kohosi.
Iäkkäät potilaat
Iäkkäiden (≥ 65 vuotta) ja nuorempien potilaiden yleisissä turvallisuustuloksissa ei raportoitu olleen eroja. ≥ 75-vuotiaiden potilaiden tiedot ovat liian rajallisia, jotta tästä populaatiosta voitaisiin tehdä päätelmiä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Jos potilas saa yliannoksen, häntä on tarkkailtava huolellisesti haittavaikutusten merkkien tai oireiden varalta, ja asianmukainen, oireenmukainen hoito on aloitettava välittömästi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: syöpälääkkeet, monoklonaaliset vasta-aineet ja vasta-ainekonjugoidut lääkkeet, PD-1/PD-L1 (ohjelmoitu solukuolemaproteiini 1/kuolemaligandi 1) estäjät
ATC-koodi: L01FF12.
Vaikutusmekanismi
Serplulimabi (HLX10) on humanisoitu monoklonaalinen IgG4-vasta-aine, joka sitoutuu ohjelmoitunut solukuolema 1 (PD‑1) -reseptoriin ja estää sen vuorovaikutuksen PD‑L1- ja PD‑L2-ligandien kanssa. PD‑1-reseptori on T‑solujen aktiivisuuden negatiivinen säätelijä, jonka on osoitettu hallitsevan T‑solujen immuunivasteita. PD‑1:n sitoutuminen PD‑L1- ja PD‑L2-ligandeihin, joita ilmenee antigeenia tarjoavissa soluissa ja joita saatetaan tuottaa kasvaimissa tai muissa kasvaimen mikroympäristön soluissa, johtaa T‑solujen proliferaation ja sytokiinin erittymisen estymiseen. Serplulimabi vahvistaa T‑soluvasteita, mukaan lukien antituumorivasteita, estämällä PD‑1:n sitoutumisen PD‑L1- ja PD‑L2-ligandeihin.
Tätä perifeeristen T-solujen PD‑1-reseptoreihin sitoutumista ja interleukiini 2:n (IL‑2) vapauttamiskykyä tutkittiin vaiheen 1 tutkimuksessa, johon osallistui 29 kiinalaista potilasta, joilla oli pitkälle edennyt kiinteä kasvain ja joihin injektoitiin yksi tai useampi (0,3 mg/kg, 1 mg/kg, 3 mg/kg, 10 mg/kg) serplulimabiannos. Tulokset osoittivat, että serplulimabi pystyi ylläpitämään vakaasti reseptoriin sitoutumisen saturaatiovaihetta ja säilytti toiminnallisen katkoksen, kun 0,3 mg/kg–10 mg/kg:n annos annettiin joka 2. viikko.
Kliininen teho ja turvallisuus
Serplulimabin ja kemoterapian (karboplatiini plus etoposidi) tehokkuutta ensilinjan hoitona levinneeseen pienisoluiseen keuhkosyöpään (ES‑SCLC:hen) arvioitiin vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, monialueisessa kliinisessä ASTRUM‑005-tutkimuksessa (NCT04063163). Ensisijainen tehokkuuden päätetapahtuma oli kokonaiselinaika (overall survival, OS). Toissijaiset tehokkuuden päätetapahtumat olivat etenemisvapaa elinaika (PFS), objektiivinen vaste (ORR) ja vasteen kesto (DOR), joita riippumaton radiologinen arviointikomitea (IRRC) ja tutkija arvioivat RECIST 1.1:n perusteella. Ensisijaisen päätetapahtuman analyysi suoritettiin 25. ja 33. kuukauden kohdalla kliinisen tutkimuksen aloittamisen jälkeen. Tutkimuksen hoito-ohjelmat avattiin ensisijaisen analyysin jälkeen.
Tutkimukseen osallistui vähintään 18-vuotiaita aikuispotilaita, jotka sairastivat ES‑SCLC:tä (Veterans Administration Lung Study Group [VALG] -asteikon mukaisesti), jotka eivät olleet saaneet systeemistä hoitoa ja joiden ECOG-suorituskykyluokka oli 0 tai 1. Potilaat poissuljettiin, jos heillä oli aktiivisia tai hoitamattomia keskushermostometastaaseja tai aktiivinen autoimmuunisairaus tai heille oli annettu systeemisiä immunosuppressiivisia lääkevalmisteita 14 päivän sisällä ennen ensimmäistä annosta.
Yhteensä 585 potilasta osallistui tutkimukseen ja satunnaistettiin (2:1) saamaan yhtä taulukossa 3 mainituista hoito-ohjelmista. Satunnaistaminen ositettiin PD‑L1-ilmentymistason (negatiivinen: Tumour Proportion Score [TPS] < 1 %; positiivinen: TPS ≥ 1 % tai ei arvioitavissa/saatavilla, mitattuna PD‑L1 IHC 22C3 pharmDx -sarjalla), aivometastaasien (kyllä vs ei) ja iän (≥ 65 vuotta vs. < 65 vuotta) mukaan.
Taulukko 3. Laskimonsisäiset hoito-ohjelmat
Hoito-ohjelma | Induktio (neljä 21‑päiväistä jaksoa) | Ylläpito (21‑päiväiset jaksot) |
A | Serplulimabi (4,5 mg/kg)a + karboplatiini (AUC = 5, korkeintaan 750 mg)b + etoposidi (100 mg/m2)b,c | Serplulimabi (4,5 mg/kg)a |
B | Lumelääke + karboplatiini (AUC = 5, korkeintaan 750 mg)b + etoposidi (100 mg/m2)b,c | Lumelääke |
a. Serplulimabia annettiin, kunnes sairaus eteni tai ilmeni sietämätöntä toksisuutta.
b. Karboplatiinia ja etoposidia annettiin, kunnes oli suoritettu neljä jaksoa, sairaus eteni tai ilmeni sietämätöntä toksisuutta, riippuen siitä, mikä tapahtui ensin.
c. Etoposidia annettiin kunkin jakson päivinä 1, 2 ja 3.
Lähtötason ominaisuudet olivat tasapainossa hoitohaarojen välillä. Osallistuneista potilaista 68,5 % oli aasialaisia (401 potilasta). 31,5 % potilaista oli ei-aasialaisia (184 potilasta), ja heistä kaikki olivat valkoisia. Mediaani-ikä oli 62 vuotta (vaihteluväli: 28‑83). 39,3 % potilaista oli ≥ 65-vuotiaita ja 1,9 % ≥ 75-vuotiaita. 82,2 % potilaista oli miehiä. Lähtötason ECOG-suorituskykyluokka oli 0 (17,6 %) tai 1 (82,4 %). 16,9 % potilaista oli PD‑L1-positiivisia (TPS ≥ 1 %). 13,3 %:lla potilaista oli aiemmin ollut aivometastaaseja.
Välianalyysin päivämäärärajan 22. lokakuuta 2021 kohdalla, kun 66 % ennalta määritellyistä OS-tapahtumista oli havaittu (määritelty noin 226, todellisia OS-tapahtumia 246), potilaiden eloonjäämisen mediaaniseuranta-aika oli 12,3 kuukautta. Välianalyysin OS-, PFS- ja ORR-tulosten yhteenveto on taulukossa 4.
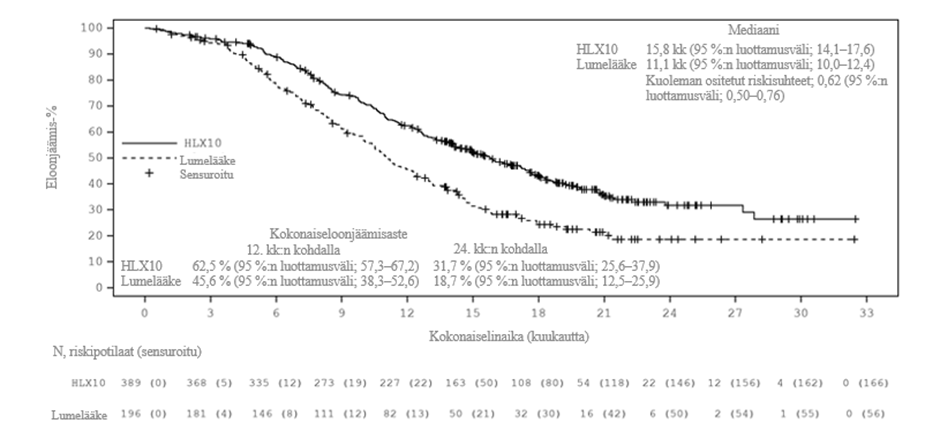
Taulukko 4. Ensisijaisen analyysin tehokkuustiedot (tietojen päivämääräraja: 22. lokakuuta 2021)
Haara A (serplulimabi + karboplatiini + etoposidi) | Haara B (lumelääke + karboplatiini + etoposidi) | ||
Potilaiden lukumäärä | 389 | 196 | |
Ensisijainen päätetapahtuma | |||
OS | Niiden potilaiden määrä, joilla ilmeni tapahtumia; n (%) | 146 (37,5 %) | 100 (51,0 %) |
Mediaani-OS (kuukautta) | 15,4 | 10,9 | |
Riskisuhde (95 %:n luottamusväli) | 0,63 (0,49‑0,82) | ||
p‑arvo | < 0,001 | ||
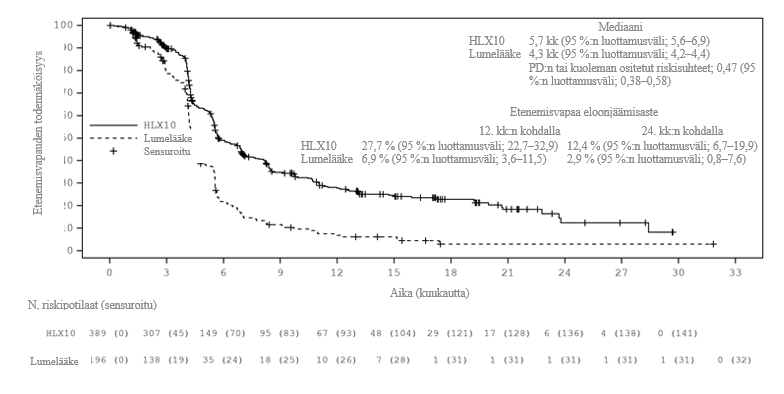
Toissijaiset päätetapahtumat | |||
PFS ‑IRRC RECIST 1.1:n mukaisesti | Mediaani-PFS (kuukautta) | 5,7 | 4,3 |
Riskisuhde (95 %:n luottamusväli) | 0,48 (0,38‑0,59) | ||
Vahvistettu ORR | (%) | 67,4 % | 58,7 % |
Mediaani DOR | Kuukaudet (95% CI) | 5,8 (5,2-7,5) | 4,1 (3,0-4,2) |
Päivitetty analyysi hoito-ohjelmien avaamisen jälkeen pidemmällä seurannan kestolla (mediaani: 19,7 kuukautta) suoritettiin päivämäärärajaan 13. kesäkuuta 2022 mennessä, kun 100 % ennalta määritellyistä OS-tapahtumista oli havaittu (määritelty noin 342, todellisia OS-tapahtumia 363). Mediaani-OS oli 15,8 kuukautta serplulimabiryhmässä ja 11,1 kuukautta lumelääkeryhmässä. Ositettu HR (95 %:n luottamusväli) oli 0,62 (0,50; 0,76). Mediaani-PFS oli IRRC-arvioinnin ja RECIST 1.1:n mukaan 5,7 kuukautta ja 4,3 kuukautta ositetun HR:n (95 %:n luottamusväli) ollessa 0,47 (0,38; 0,58). Loppuanalyysin tehokkuustulokset vastasivat ensisijaista analyysia. Loppuanalyysin Kaplan‑Meierin käyrät OS:lle ja PFS:lle on esitetty kuvissa 1 ja 2.
Kuva 1. Kaplan‑Meierin käyrä kokonaiselinajasta koko populaatiossa (ITT) (tietojen päivämääräraja: 13. kesäkuuta 2022)
Kuva 2. Kaplan‑Meierin käyrä etenemisvapaasta elinajasta (RECIST 1.1) IRRC-analyysin mukaan koko populaatiossa (ITT) (tietojen päivämääräraja: 13. kesäkuuta 2022)
Immunogeenisuus
Serplulimabin immunogeenisuutta arvioitiin 389 potilaalla, joita hoidettiin serplulimabilla annoksella 4,5 mg/kg Q3W ASTRUM-005-tutkimuksessa. Seitsemän potilasta (1,8 %) oli ADA-positiivisia jollakin käynneistä, joista kuusi potilasta (1,5 %) oli hoidon aikana ADA-positiivisia, mikä määritellään vähintään yhdeksi ADA-positiiviseksi tulokseksi lähtötason jälkeen.
Annoksen korotus- ja annoksen laajennustutkimuksessa HLX10-001 havaittiin ADA
13 potilaalla 66 potilaasta (19,7 %).
Kummassakaan keskeisessä tutkimuksessa ei havaittu neutraloivia vasta-aineita. Ei havaittu todisteita ADAvaikutuksesta farmakokinetiikkaan, tehokkuuteen tai turvallisuuteen. Kuitenkin tiedot ovat yhä rajalliset.
Iäkkäät potilaat
ASTRUM‑005-tutkimuksessa 153 (39,3 %) potilasta serplulimabiryhmän koko populaation 389 potilaasta oli ≥ 65-vuotiaita. Iäkkäiden ja nuorempien potilaiden yleisissä tehokkuustuloksissa ei havaittu eroja.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset serplulimabin käytöstä keuhkosyövän (pienisoluisen tai ei‑pienisoluisen keuhkosyövän) hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet lääkkeen käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Serplulimabin farmakokineettisiä ominaisuuksia on tutkittu populaatiofarmakokineettisessä analyysissa (popPK-analyysissa), jossa käsiteltiin 1 144:ää potilasta, jotka sairastivat keuhkosyöpää (mukaan lukien ES‑SCLC) tai muita kiinteitä syöpätyyppejä, kahdeksasta tutkimuksesta. Potilaat saivat serplulimabia laskimonsisäisesti yksilääkehoitona tai yhdistelmähoitona annoksen ollessa 0,3–10 mg/kg joka 2. viikko, 4,5 mg/kg joka 3. viikko, 200 mg joka 2. viikko, 300 mg joka 3. viikko tai 400 mg joka 4. viikko. Farmakokinetiikkaa kuvattiin kaksitilamallilla ja ajasta riippuvalla puhdistumalla (CL). Lähtötason CL:n ja keskeisen jakautumistilavuuden (Vc) yksilöiden välinen vaihtelevuus (variaatiokerroin, CV) oli 25,8 % ja 15,4 %. ASTRUM-005-tutkimuksessa havaittu keskimääräinen (CV) vakaan tilan minimipitoisuus oli 62,5 µg/ml (36,3 %).
Imeytyminen
Serplulimabia annetaan laskimonsisäisellä infuusiolla, ja se on siksi välittömästi ja täysin biologisesti hyödyntämiskelpoinen. Muita antoreittejä ei ole tutkittu.
Jakautuminen
popPK-analyysin perusteella serplulimabin jakautumistilavuus on noin 5,73 l.
Biotransformaatio
Serplulimabin aineenvaihduntareittiä ei ole määritelty. Serplulimabin odotetaan hajoavan pieniksi peptideiksi ja aminohapoiksi yleisten proteiinien hajoamisprosessien myötä.
Eliminaatio
popPK-analyysin perusteella serplulimabin puhdistuma (CL) ensimmäisen annoksen jälkeen on 0,225 l/päivä. Puhdistuma laskee ajan myötä enintään 30,5 % (CV 26,3 %), ja puolet enimmäisvaikutuksesta saavutetaan 106 päivässä. Puoliintumisaika vakaassa tilassa on tyypillisesti 24,3 päivää.
Lineaarisuus/ei‑lineaarisuus
Serplulimabin farmakokinetiikka oli lineaarista annosvälillä 0,3–10 mg/kg joka 2. viikko (mukaan lukien tasa-annokset 200 mg joka 2. viikko, 300 mg joka 3. viikko ja 400 mg joka 4. viikko) sekä yhden että useiden annosten jälkeen.
Erityispopulaatiot
Erityispopulaatioita koskevia tutkimuksia ei ole suoritettu. popPK-analyysissa ei ilmennyt ikään (23‑83 vuotta), rotuun (valkoisia n = 247 ja aasialaisia n = 895) tai ECOG-suorituskykytulokseen (0–1) liittyviä eroja serplulimabin systeemisessä kokonaispuhdistumassa. Serplulimabin puhdistuma kasvoi painon noustessa.
Munuaisten vajaatoiminta
Vaikutusta kreatiniiniin tai kreatiniinipuhdistumaan (CRCL) (Cockcroft‑Gault) ei havaittu serplulimabin puhdistumassa popPK-analyysissä, joka suoritettiin lievää (CRCL = 60‑89 ml/min, n = 448), keskivaikeaa (CRCL = 30‑59 ml/min, n=102) tai vaikeaa (CRCL = 15‑29 ml/min, n = 1) munuaisten vajaatoimintaa sairastavilla potilailla ja potilailla, joiden munuaistoiminta oli normaalia (CRCL ≥ 90 ml/min, n = 591). Vaikeaa munuaisten vajaatoimintaa sairastavista potilaista ei ole saatu riittävästi tietoja, jotta annostelusuosituksia voitaisiin antaa (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
popPK-analyysissa ei havaittu ALAT:n, ASAT:n tai kokonaisbilirubiiniarvon vaikutusta serplulimabin CL:ään potilailla, joilla oli lievä (bilirubiini ≤ ULN ja ASAT > ULN tai bilirubiini > 1–1,5 × ULN ja mikä tahansa ASAT, n = 176) tai keskivaikea (bilirubiini > 1,5–3 × ULN ja mikä tahansa ASAT, n=2) maksan vajaatoiminta tai normaali (bilirubiini ≤ ULN ja ASAT ≤ ULN, n = 956) maksatoiminta. Keskivaikeaa maksan vajaatoimintaa sairastavista potilaista ei ole saatu riittävästi tietoja, jotta annostelusuosituksia voitaisiin antaa. Serplulimabia ei ole tutkittu potilailla, joilla on vaikeaa (bilirubiini > 3 × ULN ja mikä tahansa ASAT) maksan vajaatoimintaa (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttama toksisuus
Toistuvan altistuksen aiheuttamaa toksisuutta koskevassa tutkimuksessa, jossa lääkettä annettiin jaavanmakakeille 31 viikon ajan, farmakologiaan liittyvää perivaskulaarista mononukleaarista soluinfiltraatiota esiintyi runsaasti aivokammion suonipunoksessa annoksen ollessa 100 mg/kg. Haittavaikutukseton annostaso (NOAEL) 31‑viikkoisessa toksisuustutkimuksessa oli 50 mg/kg/viikko, jonka tuottama altistus oli 36-kertainen (AUC0‑t:n mukaan laskettuna) verrattuna altistukseen ihmisillä annettaessa 3 mg/kg:n annos joka 2. viikko.
Lisääntymistoksisuus
Lisääntymistoksisuutta koskevia tutkimuksia ei ole suoritettu.
PD‑1/PD‑L1-reitin uskotaan olevan yhteydessä toleranssiin sikiötä kohtaan raskauden aikana. Hiiren raskausmalleissa PD‑L1-signaalien estämisen on osoitettu häiritsevän toleranssia sikiötä kohtaan ja johtavan useammin sikiön menetykseen.
Kahta monoklonaalista PD‑L1‑vasta-ainetta arvioitiin jaavanmakakeilla lisääntymis- ja kehitystoksisuuden osalta, ja niiden osoitettiin aiheuttavan ennenaikaisia synnytyksiä, sikiön menetyksiä ja vastasyntyneen ennenaikaisia kuolemia tiineille apinoille annettaessa.
Tästä syystä serplulimabin antamiseen raskauden aikana liittyy mahdollisesti suurempi keskenmenon tai kuolleena syntymisen riski. Lääkeaineen toimintamekanismin vuoksi sikiön altistuminen serplulimabille voi kasvattaa immuunivälitteisten häiriöiden kehittymisen, normaalin immuunivasteen muuttumisen tai PD‑1-poistogeenisillä hiirillä raportoitujen immuunivälitteisten häiriöiden riskiä.
Genotoksisuus ja karsinogeenisuus
Serplulimabin genotoksisuuden tai karsinogeenisuuden arvioimiseksi ei ole suoritettu tutkimuksia.
Farmaseuttiset tiedot
Apuaineet
Sitruunahappomonohydraatti (pH:n säätöä varten)
Natriumsitraatti (E331) (pH:n säätöä varten)
Natriumkloridi
Mannitoli (E421)
Polysorbaatti 80 (E433)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet. HETRONIFLYta ei saa infusoida samanaikaisesti samaan laskimonsisäiseen infuusioletkuun muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
3 vuotta.
Laimennettu liuos
Mikrobiologisista syistä valmiste on laimennuksen jälkeen käytettävä välittömästi. Laimennettu liuos ei saa jäätyä. Jos laimennettua liuosta ei käytetä välittömästi, säilytysajat ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla. Liuosta on säilytettävä 2 °C – 8 °C:ssa korkeintaan 24 tunnin ajan. Tämän 24 tunnin ajanjakson aikana liuosta saa pitää huoneenlämmössä (≤ 25 °C:ssa) korkeintaan kuusi tuntia. Jos liuosta on säilytetty jääkaapissa, injektiopullojen ja/tai infuusiopussien on annettava mukautua huoneenlämpöön ennen käyttöä.
Säilytys
Säilytä jääkaapissa (2°C ‑ 8°C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
HETRONIFLY infuusiokonsentraatti, liuosta varten
10 mg/ml (L:ei) 10 ml (1515,36 €)
PF-selosteen tieto
10 ml konsentraattia 10 ml:n tyypin I kirkkaasta lasista valmistetussa injektiopullossa, jossa on klorobutyylikumitulppa ja alumiini‑muovi-yhdistelmäkorkki, sisältäen 100 mg serplulimabia.
Yhden injektiopullon pakkaus.
Valmisteen kuvaus:
Väritön tai kellertävä, kirkas tai hieman opaalinhohtoinen liuos – pH 5,2‑5,8; osmolaliteetti noin 280‑340 mOsm/kg.
Käyttö- ja käsittelyohjeet
Valmistelu ja anto
- Aseptinen käsittely on varmistettava infuusion valmistelun aikana.
- Injektiopulloa ei saa ravistaa.
- Anna injektiopullon lämpötilan tasaantua huoneen lämpötilaan (korkeintaan 25°C:seen).
- Valmiste on ennen antamista tarkastettava silmämääräisesti hiukkasten ja värimuutosten varalta. Konsentraatti on väritön tai kellertävä, kirkas tai hieman opaalinhohtoinen liuos. Hävitä injektiopullo, jos hiukkasia näkyy.
- Vahvista valmisteannos ja laske HETRONIFLYn vaadittava määrä.
- Ota infuusiopussista steriilillä ruiskulla injektioon käytettävää 9 mg/ml:n (0,9 %) natriumkloridiliuosta määrä, joka vastaa infusoidun tuotteen määrää, ja hävitä.
- Vedä ruiskulla vaadittu määrä HETRONIFLYta injektiopullosta, ja injektoi se injektioon käytettävään 9 mg/ml:n (0,9 %) natriumkloridiliuokseen valmistaaksesi laimennetun liuoksen, jonka lopullinen pitoisuus on 1,0–8,0 mg/ml. Sekoita laimennettu liuos kevyesti käännellen.
- Anna infuusioliuos laskimoon käyttämällä steriiliä, pyrogeenitonta, proteiineja vähän sitovaa, letkunsisäistä tai erillistä 0,2–5,0 μm:n suodatinta.
- Aseta infuusionopeudeksi aluksi 100 ml tunnissa (suositus on 25 tippaa minuutissa). Infuusionopeutta voidaan muuttaa, jos infuusioon liittyviä vaikutuksia ilmenee (ks. kohta Annostus ja antotapa). Jos infuusioon liittyviä haittavaikutuksia ei ilmene ensimmäisessä infuusiossa, seuraavan antokerran kestoa voidaan lyhentää 30 minuuttiin (±10 minuuttia).
- Mikrobiologisista syistä valmiste on laimennuksen jälkeen käytettävä välittömästi. Laimennettu liuos ei saa jäätyä. Jos laimennettua liuosta ei käytetä välittömästi, sitä voidaan säilyttää 2°C – 8°C:ssa 24 tuntia. Tämän 24 tunnin ajanjakson aikana liuosta saa pitää huoneenlämmössä (≤ 25°C:ssa) korkeintaan kuusi tuntia. Jos liuosta on säilytetty jääkaapissa, injektiopullojen ja/tai infuusiopussien on annettava mukautua huoneenlämpöön ennen käyttöä (ks. kohta Kestoaika).
- Infuusion lopuksi infuusioletku huuhdellaan 9 mg/ml (0,9 %) natriumkloridiliuoksella sairaalan rutiinikäytännön mukaisesti.
- Muita lääkevalmisteita ei saa antaa saman infuusioletkun kautta.
- Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero on dokumentoitava selkeästi potilastietueeseen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
HETRONIFLY infuusiokonsentraatti, liuosta varten
10 mg/ml 10 ml
- Ei korvausta.
ATC-koodi
L01FF12
Valmisteyhteenvedon muuttamispäivämäärä
25.07.2025
Yhteystiedot
 ACCORD HEALTHCARE OY
ACCORD HEALTHCARE OY Oksasenkatu 10 A 6
00100 Helsinki
Suomi
010 231 4180
