RYJUNEA silmätipat, liuos 0,1 mg/ml
Vaikuttavat aineet ja niiden määrät
1 ml silmätippoja sisältää 0,1 mg atropiinisulfaattia.
Yksi tippa (noin 0,03 ml) sisältää noin 3 mikrog atropiinisulfaattia.
Apuaine, jonka vaikutus tunnetaan:
1 ml Ryjunea 0,1 mg/ml sisältää 0,1 mg bentsalkoniumkloridia
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Silmätipat, liuos (silmätipat)
Kliiniset tiedot
Käyttöaiheet
Ryjunea on tarkoitettu pediatristen potilaiden likitaittoisuuden etenemisen hidastamiseen. Hoito voidaan aloittaa 3–14-vuotiaille lapsille, kun likitaittoisuuden etenemisnopeus on vähintään -0,5 D vuoden aikana ja vaikeusaste on 0,5 D – -6,0 D.
Ehto
Hoidon saa aloittaa vain silmätautien erikoislääkäri tai silmätautioppiin perehtynyt terveydenhuollon ammattilainen.
Annostus ja antotapa
Ryjunea-hoidon saa aloittaa vain silmälääkäri tai silmätautioppiin perehtynyt terveydenhoidon ammattilainen.
Annostus
Ryjunea 0,1 mg/ml -silmätippojen suositeltu annos on yksi tippa kumpaankin silmään kerran päivässä.
Suositeltu antoaika on ennen nukkumaanmenoa.
Hoitoa on arvioitava säännöllisen kliinisen arvioinnin aikana. Harkitse hoidon vähentämistä ja lopettamista sen jälkeen, kun likitaittoisuus on vakiintunut (alle 0,5 D:n eteneminen 2 vuoden aikana) nuoruusiässä. Jatka seurantaa vuoden ajan hoidon lopettamisen jälkeen. Harkitse hoidon uudelleenaloittamista, jos likitaittoisuus etenee myöhemmin (vähintään 0,5 D vuoden aikana, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Väliin jäänyt annos
Jos yksi annos jää väliin, hoitoa tulee jatkaa normaaliin tapaan.
Pediatriset potilaat
Ryjunea-valmisteen turvallisuutta ja tehoa alle 3-vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Silmän pinnalle.
On suositeltavaa, että kyynelrauhaspussia puristetaan silmän sisänurkkaukseen (punktaalinen okkluusio) yhden minuutin ajan mahdollisen systeemisen imeytymisen vähentämiseksi. Tämä on tehtävä välittömästi tipan annostelun jälkeen.
Piilolinssit on poistettava ennen silmätippojen ottamista, ja ne voidaan asettaa uudelleen viidentoista minuutin kuluttua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos käytetään useampaa kuin yhtä paikallisesti käytettävää silmälääkettä, lääkevalmisteet on annettava vähintään viidentoista minuutin välein. Silmävoiteita tulee käyttää viimeiseksi.
Steriiliyden ylläpitämiseksi säiliön kosketusta silmään tai silmäluomeen on vältettävä.
Vasta-aiheet
Yliherkkyys atropiinisulfaatille tai kohdassa Apuaineet mainituille apuaineille.
Tunnettu yliherkkyys muille antikolinergeille, kuten ipratropiumille ja tiotropiumille.
Potilaat, joilla on ensisijainen glaukooma tai ahdaskulmaglaukooma.
Varoitukset ja käyttöön liittyvät varotoimet
Valonarkuus ja mukautumishäiriö
Atropiinisulfaatin käytön jälkeen voidaan odottaa mukauttavaa toimintahäiriötä ja lisääntynyttä herkkyyttä kirkkaalle valolle mydriaasin vuoksi. Vaikutus voi kestää enintään 14 päivää. Fotokromaattisia linssejä voidaan käyttää tarvittaessa valonarkuuden aiheuttaman epämukavuuden vähentämiseksi.
Likitaittoisuuden eteneminen uudelleen keskeyttämisen jälkeen
Atropiinisulfaattisilmätippojen keskeyttäminen voi johtaa likitaittoisuuden etenemiseen uudelleen. Seurantaa jatketaan vuoden ajan hoidon lopettamisen jälkeen. Hoidon uudelleen aloittamista on harkittava likitaittoisuuden etenemisen tapauksessa (vähintään 0,5 D vuodessa, ks. kohta Annostus ja antotapa).
Synekiat
Atropiinisulfaatti voi lisätä iiriksen ja linssin kiinnittymisen riskiä.
Kaihi
Kaihin tyypistä ja samentuneisuudesta riippuen näöntarkkuutta ja refraktiota ei välttämättä ole mahdollista arvioida tarkasti.
Heikkonäköisyys ja karsastus
Atropiinisulfaatti voi aiheuttaa näön hämärtymistä, joka voi pahentaa näitä sairauksia.
Lapsuuden etenevä syndrominen likitaittoisuus
Ennen atropiinihoidon aloittamista on tärkeää rajata pois lapsuuden etenevä syndrominen likitaittoisuus, kuten glaukooma, retinitis pigmentosa, synnynnäinen hemeralopia ja myeliinitupellisten hermosyiden aiheuttama oireyhtymä. Nämä sairaudet eivät kehity samalla tapaa kuin tyypillinen etenevä likitaittoisuus eikä niitä pidä hoitaa atropiinilla.
Potilaat, joilla on sydänsairaus
Atropiinisulfaattia on käytettävä ja annosteltava erityisen varovasti, jos potilaalla on takykardia, sydämen vajaatoiminta, sepelvaltimostenoosi ja verenpainetauti. Äskettäisen sydänkohtauksen saaneilla potilailla saattaa esiintyä takykardisia rytmihäiriöitä, jotka voivat johtaa kammiovärinään asti atropiinisulfaattia annettaessa.
Hypertermian riski
Koska hikoilun estyminen voi vaikuttaa lämpötilan säätelykykyyn, atroopiinisulfaattia on käytettävä hypertermian riskin takia varoen korkeassa ympäristön lämpötilassa ja potilaille, joilla on kuumetta.
Spastinen halvaus
Spastisesta halvauksesta kärsivillä lapsilla on raportoitu kohonnutta atropiiniherkkyyttä. Näin ollen atropiinisulfaattia on käytettävä erityisen varoen potilailla, joilla on spastinen halvaus.
Downin oireyhtymä
Downin oireyhtymää sairastavilla lapsilla on raportoitu kohonnutta atropiiniherkkyyttä. Näin ollen atropiinisulfaattia on käytettävä erityisen varovasti näille potilaille.
Apuaineet
Tämä lääkevalmiste sisältää 0,1 mg bentsalkoniumkloridia kussakin ml:ssa. Bentsalkoniumkloridin on raportoitu aiheuttavan silmien ärsytystä, kuivasilmäisyyden oireita ja voi vaikuttaa kyynelkalvoon ja sarveiskalvon pintaan. Tätä lääkevalmistetta on käytettävä varoen kuivasilmäisillä potilailla ja potilailla, joilla sarveiskalvo on voinut vaarantua. Näitä potilaita on seurattava pitkäaikaisen käytön yhteydessä.
Piilolinssit on poistettava ennen antoa, ja ne voidaan asettaa uudelleen 15 minuuttia annostelun jälkeen. Bentsalkoniumkloridin tiedetään absorboituvan pehmeisiin piilolinsseihin ja se voi muuttaa piilolinssien väriä.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Sympatomimeettiset aineet
Systeemisten lääkkeiden yhteisvaikutusten mahdollisuutta pidetään vähäisenä käytettäessä silmätippoja, joissa on atropiinisulfaattia. Sitä on kuitenkin käytettävä varoen, kun sitä käytetään yhdessä sympatomimeettien kanssa, kuten dobutamiini, dopamiini, noradrenaliini, adrenaliini tai isoprenaliini, koska mydriaasi voi tehostua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antikolinergit
Jos oftalminen atropiinisulfaatti imeytyy merkittävästi systeemisesti, muiden antikolinergien tai antikolinergisten lääkevalmisteiden kuten antihistamiinien, fenotiatsiinien, trisyklisten ja tetrasyklisten masennuslääkkeiden, amantadiinin, kinidiinin, disopyramidin ja metoklopramidin samanaikainen käyttö voi aiheuttaa voimistuneita antikolinergisiä vaikutuksia.
Karbakoli, fysostigmiini tai pilokarpiini:
Samanaikainen käyttö atropiinisulfaatin kanssa voi häiritä karbakolin, fysostigmiinin tai pilokarpiinin antiglaukoomavaikutusta (ks. myös kohta Vasta-aiheet). Samanaikainen käyttö voi myös estää atropiinisulfaatin mydriaasivaikutusta.
Lihasheikkouslääkevalmisteet, kuten pyridostigmiini ja neostigmiini, kaliumsitraatti, kaliumlisät:
Jos oftalminen atropiinisulfaatti imeytyy merkittävästi systeemisesti, samanaikainen käyttö saattaa lisätä toksisuuden ja/tai haittavaikutusten, kuten ummetuksen, pahoinvoinnin ja oksentelun, mahdollisuutta, koska maha-suolikanavan motiliteetti hidastuu antikolinergisesti.
Keskushermostoon vaikuttavaa masennusta tuottavat lääkevalmisteet:
Jos systeeminen atropiinisulfaatti imeytyy merkittävästi, keskushermostoon vaikuttavien lääkeaineiden, kuten pahoinvointilääkkeiden, fentiatsiinien tai barbituraattien, samanaikainen käyttö voi aiheuttaa opistotonusta, kouristuksia, koomaa ja ekstrapyramidaalisia oireita.
Raskaus ja imetys
Raskaus
Tämän lääkevalmisteen turvallisuutta raskauden aikana ei ole varmistettu. Eläimillä tehdyistä tutkimuksista saadut tiedot eivät riitä lisääntymistoksisuuden selvittämiseen. Kohtalaisen laajat tiedot raskaana olevista naisista eivät viittaa siihen, että atropiinisulfaatilla olisi epämuodostumia aiheuttavaa tai fetaalista/neonataalista toksisuutta.
Atropiinisulfaatti läpäisee istukan nopeasti. Koska atropiinisulfaatti saattaa imeytyä systeemisesti silmään annon jälkeen, Ryjunea-valmistetta tulee käyttää vain, jos se on ehdottoman välttämätöntä, erityisesti kolmen viimeisen raskauskuukauden aikana.
Imetys
Atropiinisulfaatin vaikutuksista vastasyntyneeseen/imeväiseen ei ole riittävästi tietoa.
Atropiinisulfaatti erittyy ihmisen rintamaitoon. On päätettävä, lopetetaanko imetys vai pidättäydytäänkö Ryjunea-hoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Eläimillä tehdyissä tutkimuksissa ei ole havaittu kliinisesti merkittäviä vaikutuksia urosten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta). Eläimillä ei ole tehty tutkimuksia naaraiden hedelmällisyyteen kohdistuvien vaikutusten arvioimiseksi.
Atropiinia sisältävien silmätippojen vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoja.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ryujunea-silmätippojen käytöllä on kohtalainen vaikutus pyöräilykykyyn, ajokykyyn ja koneidenkäyttökykyyn. Ryjunea-silmätippojen käyttö voi aiheuttaa tilapäistä näön hämärtymistä tai muita näköhäiriöitä (ks. kohta Haittavaikutukset). Potilaita on neuvottava olemaan ajamatta polkupyörällä tai autolla tai käyttämättä koneita, kunnes heidän näkönsä on kirkastunut. Tämä vaikutus voi kestää enintään 14 päivää hoidon lopettamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset ovat valonarkuus (23,4 %), silmien ärsytys (9,9 %) ja näön sumeneminen (7,8 %).
Taulukkomuotoinen luettelo haittavaikutuksista
Haittavaikutukset, jotka ilmoitettiin vaiheen III kliinisessä tutkimuksessa, jossa 282 iältään 3–18-vuotiasta potilasta altistettiin Ryjunea-valmisteelle 0,1 mg/ml, on lueteltu jäljempänä elinjärjestelmäluokan ja esiintymistiheyden mukaan. Noin 0,4 % Ryjunea-valmistetta käyttäneistä potilaista keskeytti jonkin haittatapahtuman vuoksi 24 kuukautta kestäneessä tutkimuksessa.
Esiintymistiheydet ovat seuraavat: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000) hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1. Ryjunea-valmistetta 0,1 mg/ml koskevissa kliinisissä tutkimuksissa havaitut haittavaikutukset.
| Elinjärjestelmäluokka | Hyvin yleinen ≥1/10 | Yleinen ≥1/100, <1/10 | Melko harvinainen ≥1/1 000, <1/100 |
| Hermosto | Päänsärky | ||
| Silmät | Valonherkkyys | Näön hämärtyminen, silmien ärsytys, silmäkipu, vierasesineiden tunne silmissä, mydriaasi | Mukautumishäiriö, konjunktivaaliset papillat, punktaattikeratiitti |
Valittujen haittavaikutusten kuvaus
Valonarkuus
Atropiinisulfaatti aiheuttaa valonarkuutta pupillien laajentumisen ja siliaarilihaksen halvaantumisen vuoksi, jolloin liiallinen valo pääsee silmään ja heikentää sen kykyä sopeutua kirkkaaseen valoon. Valonarkuus oli kliinisissä tutkimuksissa yleisimmin raportoitu haittavaikutus, jonka vaikeusaste oli tyypillisesti lievä tai kohtalainen. Valonarkuuden kesto vaihteli välillä 1–392 vuorokautta (keskimäärin 259 vuorokautta) ja sitä ilmeni yleensä jaksoittaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Näön hämärtyminen
Lievä tai kohtalainen näön hämärtyminen liittyy atropiinisulfaattiin (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Vaikutus ajokykyyn ja koneidenkäyttökykyyn). Noin 69 %:lla potilaista se häviää itsestään hoidon aikana (keston vaihteluväli 2–734 vuorokautta, keskimääräinen kesto 135 vuorokautta).
Silmien ärsytys
Atropiinisulfaattiin liittyviä silmä-ärsytyksen merkkejä ja oireita ovat myös silmien kutina ja epämukavuus silmässä. Nämä ovat enimmäkseen lieviä tai kohtalaisia oireita, joita ilmeni jaksoittaisesti. Näiden reaktioiden kesto vaihteli välillä 1–758 vuorokautta kliinisessä tutkimuksessa ja ne olivat samanlaisia vehikkeli- ja atropiinisulfaattiryhmissä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostus on hyvin epätodennäköinen silmätipan annostelun jälkeen.
Oireet
Yliannostuksen mahdollisia oireita voivat olla ihon punoitus ja kuivuus, laajentuneet pupillit, joissa on valonarkuus, suun ja kielen kuivuminen, johon liittyy polttava tunne, nielemisvaikeudet, takykardia, nopea hengitys, hyperpyreksia, pahoinvointi, oksentelu, hypertensio, ihottuma ja jännitys. Keskushermoston (CNS) stimulaation oireita ovat levottomuus, sekavuus, hallusinaatiot, vainoharhaiset ja psykoottiset reaktiot, koordinaation puute, houreet ja ajoittain kouristukset. Vaikeassa yliannostuksessa voi esiintyä uneliaisuutta, tokkuraisuutta ja keskushermostoon vaikuttavaa masennusta, kooma, verenkierto- ja hengitysvajaus sekä kuolema.
Hoito
Jos atropiinisulfaattia yliannostellaan, hoidon on oltava oireenmukaista ja potilasta tukevaa. Silmiin annetun yliannostuksen tapauksessa silmiä voidaan huuhdella vedellä tai natriumkloridi 9 mg/ml (0,9 %) -injektioliuoksella. Hengitystiet on pidettävä avoinna. Diatsepaamia voidaan antaa jännityksen ja kouristusten hallitsemiseksi, mutta keskushermostoon vaikuttavan masennuksen riskiä on harkittava.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Mydriaasilääkkeet ja sykloplegaatit, Antikolinergiset, ATC-koodi: S01FA01
Vaikutusmekanismi
Atropiini toimii kilpailevana ja palautuvana antagonistina kaikissa muskariinisissa asetyylikoliinireseptoreissa. Mekanismia, jonka kautta atropiini hidastaa likitaittoisuuden etenemistä, ei ymmärretä täysin, mutta sen ajatellaan sisältävän skleraalisen uudismuodostuksen/vahvistumisen stimulaatiota, joka vähentää aksiaalista pituutta ja lasiaiskammion syvyyttä. Julkaistu kirjallisuus antaa näyttöä siitä, että atropiinin vaikutusmekanismi myopiassa ja mydriaattisissa/sykloplegisissa käyttöaiheissa ei ole identtinen.
Farmakodynaamiset vaikutukset
Atropiinisulfaatti aiheuttaa mydriaasia estämällä iiriksen pyöreän sulkijalihaksen supistumista, jolloin säteittäinen laajenninlihas supistuu ja pupilli laajenee. Se myös estää siliaarilihaksen kolinergisen stimulaation, mikä johtaa sykloplegiaan halvauttamalla mukautumisesta vastuussa olevaa lihasta.
Kliininen teho ja turvallisuus
Ryjunea 0,1 mg/ml:n tehoa, turvallisuutta ja siedettävyyttä on arvioitu keskeisessä vaiheen III tutkimuksessa.
48 kuukauden kaksoissokkoutetussa vehikkelikontrolloidussa vaiheen III kliinisessä tutkimuksessa (STAR-tutkimus), johon osallistui 852 3–14-vuotiasta lasta, joiden likitaittoisuus oli -0,50 D – -6,0 D ja jotka satunnaistettiin saamaan Ryjunea 0,1 mg/ml:aa, 0,3 mg/ml:aa tai lumelääkettä (vehikkeli). Kuukauden 36 kohdalla potilaat, jotka oli alun perin satunnaistettu saamaan Ryjunea 0,1 mg/ml:aa tai 0,3 mg/ml:aa, saivat satunnaisesti uudelleen kaksoissokkoutetusti joko Ryjunea 0,1 mg/ml tai 0,3 mg/ml -valmistetta tai he saivat vehikkeliä. Tutkittavat, jotka alun perin satunnaistettiin vehikkeliryhmään, saivat Ryjunea 0,3 mg/ml:aa. Hoitomyöntyvyys oli yli 97 % kaikissa hoitoryhmissä.
Koko analyysijoukko (Full Analysis Set, FAS) sisälsi 847 tutkittavaa, jotka saivat vähintään yhden annoksen tutkimuslääkettä. Satunnaistaminen ryhmiteltiin iän mukaan (3 – <6 vuotta [3,1 %], 6 – <9 [21,8 %], 9 – <12 [39,1 %] ja 12–14 [36 %]) sekä lähtötason sfäärisen ekvivalentin (SE) mukaan (‑0,50 D – - -3,0 D [61,9 %]), >-3,0 D – -6,0 D (31,8 %) sykloplegisella autorefraktiometrilla mitattuna.
Demografiset ominaisuudet olivat samanlaisia kaikissa hoitoryhmissä. Kaiken kaikkiaan lähtötason keski-ikä oli 10,3, ± 2,44 vuotta, vaihteluväli oli 3–14 vuotta. Kaikissa ryhmissä miespuolisia (55,7 %) oli enemmän kuin naispuolisia (44,3 %). Suurin osa osallistujista oli valkoisia (68,5 %); aasialaisten osallistujien osuus FAS:sta oli 17,5 %. Muut lähtötason ominaisuudet olivat samanlaisia kaikissa hoitoryhmissä. Keskimääräinen osallistujien lähtötason sfäärinen ekvivalentti (SE) oli ‑2,69 ± 1,309 D, ja se oli samanlainen hoitoryhmien välillä. Tutkimukseen mukaan otetuilla tutkittavilla ei ollut mitään degeneratiiviselle likitaittoisuudelle altistavia sairauksia (esim. Marfanin oireyhtymä, Sticklerin oireyhtymä) eikä sairauksia, jotka voivat vaikuttaa näkökykyyn tai kehitykseen (esim. diabetes, kromosomipoikkeavuus). Tutkimuksesta suljettiin pois henkilöt, joilla oli heikkonäköisyyttä, karsastusta tai primaarinen avokulma- tai ahdaskulmaglaukooma.
Teho
Ensisijainen päätetapahtuma oli likitaittoisuuden keskimääräisen vuosittaisen etenemisnopeuden (APR) ero 24 kuukauteen asti hoitojen ja kantaja-aineryhmien välillä FAS:ssa. Ryjunea 0,1 mg/ml -ryhmässä osoitettiin tilastollisesti merkitsevä 0,132 D:n ero (95 %:n luottamusväli: 0,061, 0,204) vehikkeliin verrattuna.
Suurempi hoitovaikutus havaittiin potilailla, joiden etenemisnopeus oli vähintään 0,5 D vuodessa. Tässä ennalta määrätyssä alaryhmässä havaittiin keskimääräinen APR-ero 0,207 D (95 %:n luottamusväli: 0,112, 0,302) Ryjunea 0,1 mg/ml:lla vehikkeliin verrattuna 24 kuukauden kohdalla, ja keskimääräinen APR-ero 0,154 D (95 %:n luottamusväli: 0,073, 0,236) 36 kuukauden kohdalla. Lähtötason sfäärisen ekvivalentin (SE) keskimääräisen muutoksen eron havaittiin olevan 0,388 D (95 %:n luottamusväli: 0,190, 0,585) Ryjunea 0,1 mg/ml:lla vehikkeliin verrattuna 24 kuukauden kohdalla, ja lähtötason sfäärisen ekvivalentin (SE) keskimääräisen muutoksen eron havaittiin olevan 0,425 D (95 %:n luottamusväli: 0,170, 0,681) Ryjunea 0,1 mg/ml:lla vehikkeliin verrattuna 36 kuukauden kohdalla. Kuvassa 1 esitetään keskimääräinen muutos lähtötasoon SE:ssä 36 kuukaudessa hoito- ja vehikkeliryhmien välillä potilailla, joiden etenemisnopeus oli vähintään 0,5 D vuodessa.
Vaikutuksen suuruus oli suurempi nuoremmilla potilailla.
Taulukko 2: STAR-tutkimus: Sfäärisen ekvivalentin (D) muutos lähtötasosta kuukauteen 36 asti potilailla, joilla etenemisnopeus oli vähintään 0,5 D vuodessa
Vehikkeli (n=93) | Ryjunea 0.1 mg/ml (n=95) | |
| Lähtötasosta kuukauteen 24 | -0,862 (-1,00, -0,72) | -0,474 (-0,61, -0,33) |
| Ero vehikkeliin | 0,388 (0,190, 0,585) | |
| Lähtötasosta kuukauteen 36 | -1,091 (-1,27, -0,91) | -0,665 (-0,85, -0,49) |
| Ero vehikkeliin | 0,425 (0,170, 0,681) |
Kuva 1: STAR-tutkimus: Sfäärisen ekvivalentin (D) keskimääräinen muutos lähtötasosta kuukauteen 36 asti potilailla, joilla etenemisnopeus oli vähintään 0,5 D vuodessa.
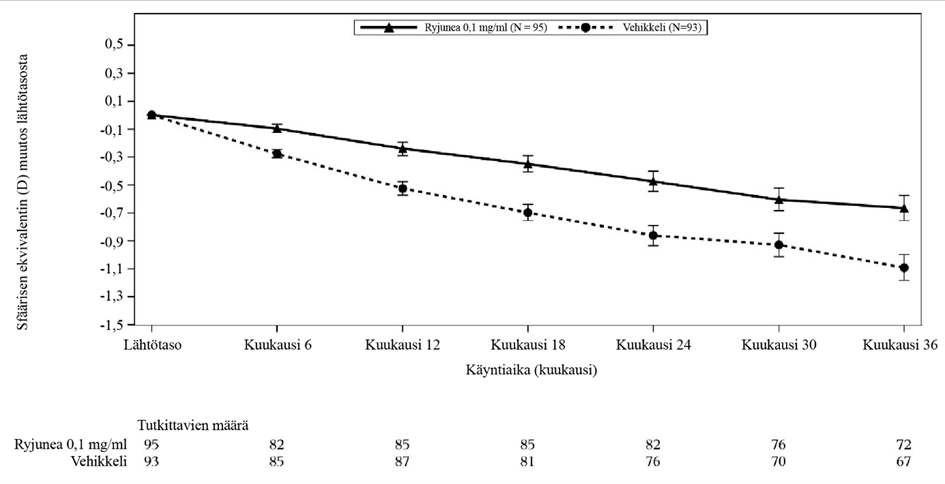
44 tutkittavan alajoukossa hoitoryhmää kohti ei ollut tilastollisesti merkitsevää paranemista aksiaalisessa pituudessa Ryjunea 0,1 mg/ml -valmisteella vehikkeliin verrattuna kuukauden 24 kohdalla.
Farmakokinetiikka
Ryjunea-valmisteesta ei ole tehty farmakokineettistä tutkimusta pediatrisilla potilailla. Farmakokineettisiä tietoja on saatavilla vain aikuisista, jotka saivat suuremman annoksen atropiinisulfaattia.
Imeytyminen
Terveillä tutkittavilla tehdyssä tutkimuksessa, jossa silmään annettuna paikallisesti, 30 µl atropiinisulfaatti-oftalminen liuos, 10 mg/ml, on ilmoitettu l-hyossyamiinin systeemisen hyötyosuuden keskiarvon (-keskihajonta) olevan noin 64 ± 29 % (vaihteluväli 19–95 %) verrattuna atropiinisulfaatin suonensisäiseen antamiseen. Plasman maksimipitoisuuden (Tmax) keskiarvo-aika (± keskihajonta) oli noin 28 ± 27 minuuttia (vaihteluväli 3–60 minuuttia), ja l-hyoskyamiinin plasmahuippupitoisuuden (Cmax) keskiarvo (± keskihajonta) oli 288 ± 73 pg/ml.
Erillisessä silmäleikkauspotilaiden tutkimuksessa, jossa silmään annettiin paikallisesti 40 µl atropiinisulfaattiliuosta pitoisuudella 10 mg/ml, keskimääräinen l-hyoskyamiinin plasman Cmax-arvo oli 860 ± 402 pg/ml.
Jakautuminen
Atropiini jakautuu laajalti kehoon ja läpäisee veren aivoesteen. Enintään 50 % annoksesta sitoutuu proteiineihin.
Biotransformaatio
Atropiini metaboloituu maksassa hapettumalla ja konjugoitumalla, jolloin saadaan inaktiivisia metaboliitteja.
Eliminaatio
Eliminaation puoliintumisaika on noin 2–5 tuntia. Noin 50 % annoksesta erittyy 4 tunnin kuluessa ja 90 % 24 tunnin aikana virtsaan, noin 30–50 % muuttumattomana lääkkeenä.
Prekliiniset tiedot turvallisuudesta
Silmäluomen vähäistä fokaalista hyperkeratoosia havaittiin ruumiinavauksessa kolmella neljästä kanista, joille annettiin atropiinia 0,1 mg/ml silmätippoja kolme kertaa päivässä.
Kirjallisuudessa olevien tietojen perusteella atropiinisulfaatin mutageenisistä tai tuumorigeenisistä vaikutuksista ei ole näyttöä.
Suun kautta annettu atropiinisulfaatti vähensi urosrottien hedelmällisyyttä altistuksilla, joiden katsottiin olevan riittävästi ihmisen enimmäisaltistuksen yläpuolella, mikä viittaa siihen, että sillä ei ole juurikaan merkitystä kliiniselle käytölle.
Farmaseuttiset tiedot
Apuaineet
Bentsalkoniumkloridi
Sitruunahappo (E330)
Natriumsitraatti (E331)
Natriumkloridi
Natriumhydroksidi (E524) / kloorivetyhappo (E507) (pH:n säätämiseen)
Deuteriumoksidi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Avaamattomana: 2 vuotta.
Ensimmäisen avaamisen jälkeen: 4 viikkoa.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
RYJUNEA silmätipat, liuos
0,1 mg/ml (L:ei) 2,5 ml (74,59 €)
PF-selosteen tieto
Valkoiset matalatiheyksiset polyetyleeni (LDPE) 5 ml:n pullot, joissa on valkoiset LDPE-kärjet ja punaise korkeatiheyksiset polyetyleeni (HDPE) ruuvikorkit, joissa on suojaava peukaloinnin osoittava rengas.
Yksi moniannospullo sisältää 2,5 ml Ryjunea 0,1 mg/ml.
Pakkauskoot: 1 tai 3 moniannospulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkas ja väritön neste, jonka pH on 5,4 ja osmolaliteetti 280 mOsm/kg.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
RYJUNEA silmätipat, liuos
0,1 mg/ml 2,5 ml
- Ei korvausta.
ATC-koodi
S01FA01
Valmisteyhteenvedon muuttamispäivämäärä
02.06.2025
Yhteystiedot
Kelloportinkatu 1
33100 Tampere
03 284 8111
www.santen.fi
