EZETIMIB/ATORVASTATIN KRKA tabletti, kalvopäällysteinen 10/10 mg, 10/20 mg, 10/40 mg, 10/80 mg
not_interestedSaatavuushäiriö
Ei saatavilla
EZETIMIB/ATORVASTATIN KRKA tabletti, kalvopäällysteinen
- 10/10 mg90 fol30.12.2025 - 05.03.2026
Saatavilla
Saman valmisteen muut pakkaukset ja/tai vaihtokelpoiset valmisteet
EZETIMIB/ATORVASTATIN KRKA tabletti, kalvopäällysteinen
- 10/10 mg30 fol
Muut samaa lääkeainetta sisältävät valmisteet
EZETIMIB/ATORVASTATIN KRKA tabletti, kalvopäällysteinen
- 10/20 mg30 fol, 90 fol
- 10/40 mg30 fol, 90 fol
- 10/80 mg30 fol, 90 fol
Vaikuttavat aineet ja niiden määrät
10 mg/10 mg: Yksi kalvopäällysteinen tabletti sisältää 10 mg etsetimibiä ja atorvastatiinikalsiumtrihydraattia vastaten 10 mg atorvastatiinia.
10 mg/20 mg: Yksi kalvopäällysteinen tabletti sisältää 10 mg etsetimibiä ja atorvastatiinikalsiumtrihydraattia vastaten 20 mg atorvastatiinia.
10 mg/40 mg: Yksi kalvopäällysteinen tabletti sisältää 10 mg etsetimibiä ja atorvastatiinikalsiumtrihydraattia vastaten 40 mg atorvastatiinia.
10 mg/80 mg: Yksi kalvopäällysteinen tabletti sisältää 10 mg etsetimibiä ja atorvastatiinikalsiumtrihydraattia vastaten 80 mg atorvastatiinia.
Apuaine(et), joiden vaikutus tunnetaan
Yksi 10 mg/10 mg kalvopäällysteinen tabletti sisältää 25 mg laktoosia (monohydraattina).
Yksi 10 mg/20 mg kalvopäällysteinen tabletti sisältää 51 mg laktoosia (monohydraattina).
Yksi 10 mg/40 mg kalvopäällysteinen tabletti sisältää 102 mg laktoosia (monohydraattina).
Yksi 10 mg/80 mg kalvopäällysteinen tabletti sisältää 203 mg laktoosia (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti (tabletti)
Kliiniset tiedot
Käyttöaiheet
Sydän- ja verisuonitapahtumien ehkäisy
Ezetimib/Atorvastatin Krka on tarkoitettu pienentämään sydän- ja verisuonitapahtumien riskiä (ks. kohta Farmakodynamiikka) potilailla, joilla on sepelvaltimotauti ja aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymä. Ezetimib/Atorvastatin Krka -valmistetta voidaan käyttää sekä potilailla, joita on aiemmin hoidettu statiinilla, että potilailla, joita ei ole aiemmin hoidettu statiinilla.
Hyperkolesterolemia
Ezetimib/Atorvastatin Krka on tarkoitettu ruokavalion lisähoidoksi aikuisten primaarisen (heterotsygoottisen familiaalisen ja ei-familiaalisen) hyperkolesterolemian tai sekamuotoisen hyperlipidemian hoitoon, kun yhdistelmävalmisteen käyttö on tarkoituksenmukaista:
- potilaille, joille pelkällä statiinilla ei ole saavutettu riittävää hoitovastetta
- potilaille, joita hoidetaan jo statiinilla ja etsetimibillä
Homotsygoottinen familiaalinen hyperkolesterolemia
Ezetimib/Atorvastatin Krka on tarkoitettu ruokavalion lisähoidoksi aikuisten homotsygoottisen familiaalisen hyperkolesterolemian (HoFH) hoitoon. Potilaat voivat saada lisäksi myös muuta hoitoa (esim. LDL-afereesi).
Annostus ja antotapa
Annostus
Hyperkolesterolemia ja/tai sepelvaltimotauti (ja aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma)
Potilaan tulee noudattaa tavanomaista kolesterolia alentavaa ruokavaliota, jota on jatkettava Ezetimib/Atorvastatin Krka -hoidon aikana.
Ezetimib/Atorvastatin Krka -valmisteesta on saatavana annosvalikoima annoksesta 10 mg/10 mg/vuorokausi annokseen 10 mg/80 mg/vuorokausi. Tavanomainen annos on 10 mg/10 mg kerran vuorokaudessa. Hoitoa aloitettaessa ja annosta muutettaessa on huomioitava potilaan LDL‑kolesteroliarvot, sepelvaltimotaudin riskistatus ja hoitovaste nykyiseen kolesterolia alentavaan hoitoon.
Ezetimib/Atorvastatin Krka -annos on määritettävä yksilöllisesti perustuen eri Ezetimib/Atorvastatin Krka -vahvuuksien tunnettuun tehoon (katso kohta Farmakodynamiikka, taulukko 4) sekä nykyisen kolesterolia alentavan hoidon vasteeseen. Annosta ei tule muuttaa useammin kuin neljän viikon välein.
Homotsygoottinen familiaalinen hyperkolesterolemia
Homotsygoottisessa familiaalisessa hyperkolesterolemiassa Ezetimib/Atorvastatin Krka -annos on 10 mg/10 mg−10 mg/80 mg vuorokaudessa. Näillä potilailla Ezetimib/Atorvastatin Krka -hoitoa voidaan käyttää muiden rasva-arvoja alentavien hoitojen (esim. LDL-afereesin) lisänä tai jos muita hoitoja ei ole käytettävissä.
Samanaikainen anto muiden lääkkeiden kanssa
Ezetimib/Atorvastatin Krka tulisi annostella vähintään 2 tuntia ennen sappihappoa sitovien aineiden ottamista tai vähintään 4 tuntia sen jälkeen.
Ezetimib/Atorvastatin Krka -annos ei saa olla yli 10 mg/20 mg/vuorokausi silloin, kun potilas saa samanaikaisesti hepatiitti C:n viruslääkkeitä elbasviiria/gratsopreviiria (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Iäkkäät
Annostusta ei tarvitse muuttaa iäkkäitä potilaita hoidettaessa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ezetimib/Atorvastatin Krka -valmisteen turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu (ks. kohta Farmakokinetiikka). Tietoja ei ole saatavilla.
Maksan vajaatoiminta
Ezetimib/Atorvastatin Krka -valmisteen käytössä on noudatettava varovaisuutta potilaille, joilla on maksan vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Ezetimib/Atorvastatin Krka on vasta-aiheinen potilaille, joilla on aktiivinen maksasairaus (ks. kohta Vasta-aiheet).
Munuaisten vajaatoiminta
Annostusta ei tarvitse muuttaa munuaisten vajaatoimintaa sairastavia potilaita hoidettaessa (ks. kohta Farmakokinetiikka).
Antotapa
Ezetimib/Atorvastatin Krka -valmiste otetaan suun kautta. Ezetimib/Atorvastatin Krka -tabletti voidaan annostella kerta-annoksena mihin aikaan päivästä tahansa, joko aterian yhteydessä tai tyhjään vatsaan. Tabletissa ei ole jakouurretta, joten tabletti tulee niellä kokonaisena eikä sitä saa jakaa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Ezetimib/Atorvastatin Krka -hoito on vasta-aiheista raskauden ja imetyksen aikana sekä naisille, jotka voivat tulla raskaaksi, ja jotka eivät käytä luotettavaa ehkäisyä (ks. kohta Raskaus ja imetys).
Ezetimib/Atorvastatin Krka on vasta-aiheinen potilaille, joilla on aktiivinen maksasairaus, tai tuntemattomasta syystä pitkäaikaisesti yli 3-kertaisiksi normaaliarvojen ylärajaan (upper limit of normal, ULN) nähden suurentuneet seerumin transaminaasiarvot.
Ezetimib/Atorvastatin Krka on vasta-aiheinen potilaille, jota hoidetaan hepatiitti C:n viruslääkkeillä glekapreviirillä/pibrentasviirillä.
Varoitukset ja käyttöön liittyvät varotoimet
Myopatia/rabdomyolyysi
Markkinoilletulon jälkeen etsetimibillä on raportoitu myopatia- ja rabdomyolyysitapauksia. Useimmat potilaat, joille kehittyi rabdomyolyysi, olivat käyttäneet samanaikaisesti statiinia ja etsetimibiä. Rabdomyolyysia on kuitenkin raportoitu hyvin harvoin, kun etsetimibiä on käytetty yksinään tai kun etsetimibiä on annettu yhdessä muiden lääkkeiden kanssa, joihin tiedetään liittyvän rabdomyolyysivaaraa.
Ezetimib/Atorvastatin Krka sisältää atorvastatiinia. Kuten muutkin HMG-CoA-reduktaasin estäjät, atorvastatiini saattaa joissakin harvinaisissa tapauksissa vaikuttaa luustolihaksiin ja aiheuttaa lihaskipua, lihastulehduksen ja lihassairauden, jotka saattavat edetä rabdomyolyysiksi. Rabdomyolyysi on mahdollisesti hengenvaarallinen tila, jolle on tunnusomaista huomattavasti suurentunut kreatiinikinaasi (CK) -arvo (yli 10 kertaa normaaliarvojen ylärajaa suurempi), myoglobinemia ja myoglobinuria, jotka voivat johtaa munuaisten vajaatoimintaan.
Ennen hoitoa
Varovaisuutta on noudatettava määrättäessä Ezetimib/Atorvastatin Krka -valmistetta potilaille, joilla on todettu rabdomyolyysille altistavia tekijöitä. Potilaan kreatiinikinaasiarvo on mitattava ennen hoidon aloittamista seuraavissa tapauksissa:
- munuaisten vajaatoiminta
- kilpirauhasen vajaatoiminta
- potilaalla tai suvussa on ollut perinnöllisiä lihassairauksia
- aiempi lihastoksisuus statiinin tai fibraatin käytön yhteydessä
- potilaalla on ollut maksasairaus ja/tai hän käyttää runsaasti alkoholia
- jos potilas on iäkäs (yli 70-vuotias), mittauksen tarpeellisuutta on arvioitava sen mukaan, onko hänellä muita rabdomyolyysille altistavia tekijöitä
- tilanteet, joissa pitoisuudet plasmassa voivat suurentua, kuten yhteisvaikutukset (ks. kohta Yhteisvaikutukset) ja erityispotilasryhmät, mukaan lukien geneettiset alaryhmät (ks. kohta Farmakokinetiikka).
Näissä tapauksissa hoidon riskit on punnittava hoidosta mahdollisesti saatavaan hyötyyn nähden ja potilaan kliininen seuranta on suositeltavaa.
Hoitoa ei tule aloittaa, jos CK-arvot ovat lähtötilanteessa merkitsevästi suurentuneet (> 5 x normaaliarvojen yläraja).
Kreatiinikinaasin (CK) määritys
Määritystuloksen oikean tulkinnan varmistamiseksi, CK-pitoisuutta ei tule määrittää liikunnan jälkeen eikä muiden CK-pitoisuuden suurenemista aiheuttavien syiden vaikuttaessa tulokseen. Jos CK‑pitoisuus on lähtötilanteessa huomattavasti suurentunut (> 5 x normaaliarvojen yläraja), pitoisuus on mitattava uudestaan 5–7 vuorokauden kuluessa tulosten varmistamiseksi.
Hoidon aikana
- Potilaita on pyydettävä ilmoittamaan viipymättä, jos heillä ilmenee lihaskipua, -kouristuksia tai -heikkoutta erityisesti, jos niihin liittyy huonovointisuutta tai kuumetta tai jos lihasoireet ja - merkit jatkuvat Ezetimib/Atorvastatin Krka -valmisteen lopettamisen jälkeen.
- Jos tällaisia oireita ilmenee Ezetimib/Atorvastatin Krka -hoidon aikana, potilaan CK-arvo on mitattava. Jos arvo on merkitsevästi suurentunut (yli 5 kertaa normaaliarvojen ylärajaa suuremmaksi), hoito on lopetettava.
- Jos lihasoireet ovat voimakkaita ja aiheuttavat päivittäistä haittaa, on hoidon lopettamista harkittava, vaikka CK-arvo olisi enintään 5 kertaa normaaliarvojen ylärajoja suurempi.
- Jos oireet häviävät ja CK-arvo palautuu normaaliksi, voidaan harkita Ezetimib/Atorvastatin Krka -hoidon aloittamista uudelleen tai toisen statiinia sisältävän valmisteen aloittamista pienimmällä annoksella ja tarkassa seurannassa.
- Ezetimib/Atorvastatin Krka -hoito on lopetettava, jos CK-arvo suurenee kliinisesti merkittävästi (yli 10 kertaa normaaliarvojen ylärajaa suuremmaksi) tai jos potilaalla todetaan tai epäillään olevan rabdomyolyysi.
- Joidenkin statiinihoitojen aikana tai niiden jälkeen on raportoitu hyvin harvoin esiintyvää immuunivälitteistä nekrotisoivaa myopatiaa (immune-mediated necrotising myopathy, IMNM). IMNM:lle ominaisia kliinisiä merkkejä ovat jatkuva proksimaalinen lihasheikkous ja kohonneet seerumin kreatiinikinaasiarvot, jotka jatkuvat statiinihoidon keskeyttämisestä huolimatta.
Koska Ezetimib/Atorvastatin Krka -valmiste sisältää atorvastatiinia, rabdomyolyysin riski suurenee, kun Ezetimib/Atorvastatin Krka -valmistetta käytetään samanaikaisesti sellaisen lääkityksen kanssa, joka saattaa suurentaa atorvastatiinipitoisuutta plasmassa. Tällaisia lääkeaineita ovat voimakkaat CYP3A4:n tai kuljettajaproteiinien estäjät (esim. siklosporiini, telitromysiini, klaritromysiini, delavirdiini, stiripentoli, ketokonatsoli, vorikonatsoli, itrakonatsoli, posakonatsoli ja HIV-proteaasin estäjät mukaan lukien ritonaviiri, lopinaviiri, atatsanaviiri, indinaviiri, darunaviiri, tipranaviiri/ritonaviiri jne.). Myopatian riski voi myös suurentua, jos valmistetta käytetään samanaikaisesti gemfibrotsiilin ja muiden fibriinihappojohdannaisten, hepatiitti C:n (HCV) hoidossa käytettävien viruslääkkeiden (bosepreviiri, telapreviiri, elbasviiri/gratsopreviiri), erytromysiinin tai niasiinin kanssa. Jos mahdollista, näiden lääkitysten sijaan on harkittava sellaisten lääkeaineiden käyttöä, joilla ei ole yhteisvaikutuksia (ks. kohta Haittavaikutukset).
Jos näitä lääkkeitä on tarpeen antaa samanaikaisesti Ezetimib/Atorvastatin Krka -valmisteen kanssa, samanaikaisen hoidon hyödyt ja riskit on punnittava huolellisesti. Jos potilas käyttää plasman atorvastatiinipitoisuutta suurentavia lääkeaineita, suositellaan Ezetimib/Atorvastatin Krka -valmisteen pienempää enimmäisannosta. Lisäksi käytettäessä voimakkaita CYP3A4:n estäjiä, on harkittava Ezetimib/Atorvastatin Krka -valmisteen pienempää enimmäisannosta ja potilaiden asianmukaista kliinistä seurantaa suositellaan (ks. kohta Yhteisvaikutukset).
Atorvastatiinia ei saa antaa samanaikaisesti systeemisen fusidiinihapon kanssa tai 7 päivän sisällä fusidiinihappohoidon lopettamisesta. Potilailla, joilla systeemisen fusidiinihapon käyttöä pidetään välttämättömänä, statiinihoito on keskeytettävä koko fusidiinihappohoidon ajaksi. Rabdomyolyysitapauksia (osa kuolemaan johtaneita) on raportoitu potilailla, jotka ovat saaneet fusidiinihappoa ja statiineja samanaikaisesti (ks. kohta Yhteisvaikutukset). Potilasta on kehotettava ottamaan yhteyttä lääkäriin välittömästi, mikäli ilmenee lihasheikkouden oireita, lihaskipua tai -arkuutta.
Statiinihoito voidaan aloittaa uudelleen 7 päivän kuluttua viimeisestä fusidiinihappoannoksesta.
Poikkeuksellisissa tapauksissa, joissa pidempiaikainen systeeminen fusidiinihappohoito on välttämätön, esim. vaikeiden infektioiden hoidossa, Ezetimib/Atorvastatin Krka -valmisteen ja fusidiinihapon yhteiskäytön tarvetta on harkittava tapauskohtaisesti ja tarkassa lääkärin valvonnassa.
Daptomysiini
Myopatiaa ja/tai rabdomyolyysia on raportoitu, kun HMG-CoA-reduktaasin estäjiä (esim. atorvastatiinia ja etsetimibi/atorvastatiini-yhdistelmää) ja daptomysiinia on käytetty samanaikaisesti. On noudatettava varovaisuutta määrättäessä HMG-CoA-reduktaasin estäjiä samanaikaisesti daptomysiinin kanssa, koska kumpikin aine yksinään käytettynä voi aiheuttaa myopatiaa ja/tai rabdomyolyysia. Ezetimib/Atorvastatin Krka -valmisteen käytön keskeyttämistä väliaikaisesti on harkittava daptomysiinia käyttävillä potilailla, ellei samanaikaisen käytön hyöty ole riskiä suurempi. Tutustu daptomysiinin tuotetietoihin saadaksesi lisätietoa tästä mahdollisesta yhteisvaikutuksesta HMG-CoA-reduktaasin estäjien (esim. atorvastatiinin ja etsetimibi/atorvastatiini-yhdistelmän) kanssa ja lisäohjeistusta seurantaan liittyen (ks. kohta Yhteisvaikutukset).
Myasthenia gravis/silmämyastenia
Joissakin tapauksissa statiinien on ilmoitettu indusoivan ensimmäisen kerran tai pahentavan jo olemassa olevaa myasthenia gravista tai silmämyasteniaa (ks. kohta Haittavaikutukset). Ezetimib/Atorvastatin Krka -hoito on keskeytettävä, jos oireet pahenevat. Uusiutumistapauksista on ilmoitettu, kun käyttöön otettiin eri statiini tai sama statiini uudelleen.
Maksaentsyymit
Kontrolloiduissa tutkimuksissa, joissa etsetimibiä on annettu yhdessä atorvastatiinin kanssa, on havaittu transaminaasiarvojen kohoamista peräkkäisissä mittauksissa (≥ 3 x normaaliarvojen yläraja) (ks. kohta Haittavaikutukset).
Maksan toimintakokeet on tehtävä ennen hoidon aloittamista ja sen jälkeen säännöllisesti. Jos potilaalle kehittyy maksavaurioihin viittaavia merkkejä tai oireita, hänelle on tehtävä maksan toimintakokeet. Jos potilaan maksan transaminaasiarvot ovat suurentuneet, maksa-arvoja on tarkkailtava, kunnes ne palautuvat normaaleiksi. Jos normaaliarvojen ylärajaan nähden yli 3-kertaisiksi suurentuneet transaminaasiarvot eivät palaudu, suositellaan Ezetimib/Atorvastatin Krka -annoksen pienentämistä tai hoidon lopettamista.
Ezetimib/Atorvastatin Krka -valmisteen käytössä on noudatettava varovaisuutta potilaille, jotka käyttävät runsaasti alkoholia ja/tai joilla on aiemmin todettu maksasairaus.
Maksan vajaatoiminta
Ezetimib/Atorvastatin Krka -hoitoa ei suositella potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta, koska suurentuneiden etsetimibipitoisuuksien vaikutuksia näihin potilaisiin ei tunneta (ks. kohta Farmakokinetiikka).
Fibraatit
Etsetimibin tehoa ja turvallisuutta yhdessä fibraattien kanssa ei ole vahvistettu. Tästä syystä Ezetimib/Atorvastatin Krka -valmisteen ja fibraattien yhteiskäyttöä ei suositella (ks. kohta Yhteisvaikutukset).
Siklosporiini
Aloitettaessa Ezetimib/Atorvastatin Krka -hoito siklosporiinia saavalle potilaalle on syytä noudattaa varovaisuutta. Jos potilas käyttää Ezetimib/Atorvastatin Krka -valmistetta ja siklosporiinia, on siklosporiinipitoisuuksia seurattava (ks. kohta Yhteisvaikutukset).
Antikoagulantit
Jos varfariinihoitoon, johonkin muuhun kumariiniantikoagulanttihoitoon tai fluindionihoitoon lisätään Ezetimib/Atorvastatin Krka, INR-arvoa (International Normalised Ratio) tulisi seurata asianmukaisesti (ks. kohta Yhteisvaikutukset).
Aivohalvauksen ehkäisy alentamalla kolesterolitasoja voimakkaasti (Stroke Prevention by Aggressive Reduction in Cholesterol Levels, SPARCL)
Aivohalvauksen eri alatyyppien post hoc -analyysissä havaittiin, että potilailla, joilla oli äskettäin ollut aivohalvaus tai TIA-kohtaus, mutta joilla ei ollut sepelvaltimotautia, hemorragisten aivohalvausten määrä oli suurempi 80 mg atorvastatiinia saaneilla potilailla verrattuna lumelääkettä saaneisiin. Riski oli erityisen suuri potilailla, joilla oli ollut aiempi hemorraginen aivohalvaus tai lakuunainfarkti tutkimuksen alkaessa. Jos potilaalla on aiemmin ollut hemorraginen aivohalvaus tai lakuunainfarkti, atorvastatiini 80 mg -hoidon riskihyötysuhde on epäselvä. Tällöin hemorragisen aivohalvauksen riski on arvioitava huolellisesti ennen hoidon aloittamista (ks. kohta Farmakodynamiikka).
Interstitiaalinen keuhkosairaus
Poikkeuksellisia tapauksia interstitiaalista keuhkosairautta on raportoitu ilmenneen joidenkin statiinien käytön yhteydessä, erityisesti pitkäaikaisen hoidon yhteydessä (ks. kohta Haittavaikutukset). Ilmeneviin oireisiin saattavat kuulua hengenahdistus, kuiva yskä ja yleiskunnon heikkeneminen (väsymys, painon lasku ja kuume). Jos epäillään, että potilaalle on kehittynyt interstitiaalinen keuhkosairaus, statiinihoito tulee lopettaa.
Diabetes mellitus
Jotkut tiedot viittaavat siihen, että statiinit luokkana nostavat verensokeria, ja joillakin sellaisilla potilailla, joilla diabeteksen puhkeamisen riski on suuri, ne saattavat aiheuttaa hyperglykemiaa, johon tarvitaan tavanomaista diabeteksen hoitoa. Statiinien vaskulaaririskiä vähentävät vaikutukset ovat kuitenkin tätä riskiä suuremmat, eikä statiinihoitoa tule tästä syystä lopettaa. Riskipotilaita (paastoverensokeriarvo 5,6–6,9 mmol/l, painoindeksi (BMI) > 30 kg/m2 , kohonneet triglyseridiarvot, kohonnut verenpaine) on seurattava sekä kliinisesti että laboratoritutkimuksin kansallisten hoitosuositusten mukaan.
Apuaineet
Ezetimib/Atorvastatin Krka sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per tabletti, eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Useat mekanismit saattavat myötävaikuttaa mahdollisten yhteisvaikutusten syntymiseen HMG-CoA-reduktaasin estäjien kanssa. Tiettyjen entsyymien (esim. CYP3A4) ja/tai kuljettajaproteiinien (esim. OATP1B) toimintaa estävät lääkkeet ja rohdosvalmisteet saattavat nostaa atorvastatiinin pitoisuuksia plasmassa ja lisätä myopatian/rabdomyolyysin riskiä.
Tutustu kaikkien samanaikaisesti käytettävien lääkkeiden tuotetietoihin mahdollisten atorvastatiiniin liittyvien yhteisvaikutusten ja/tai entsyymien ja kuljettajaproteiinien toimintaa mahdollisesti koskevien muutosten sekä annosta ja hoito-ohjelmaa koskevien muutosten varalta.
Farmakodynaamiset yhteisvaikutukset
Atorvastatiini metaboloituu sytokromi P450 3A4:n (CYP3A4) vaikutuksesta ja on maksan kuljettajaproteiinien, orgaanisten anionien kuljettajapolypeptidi 1B1:n (OATP1B1) ja 1B3:n (OATP1B3), substraatti. Atorvastatiinin metaboliitit ovat OATP1B1:n substraatteja. Atorvastatiini on tunnistettu myös monilääkeresistenssiproteiini 1:n (MDR1) ja rintasyövälle resistentin proteiinin (BCRP) substraatiksi, mikä saattaa rajoittaa atorvastatiinin imeytymistä suolistosta ja puhdistumaa sapen kautta (ks. kohta Farmakokinetiikka). CYP3A4:n tai kuljettajaproteiinien estäjien samanaikainen anto voi suurentaa atorvastatiinipitoisuutta plasmassa ja lisätä myopatian riskiä. Riski voi suurentua myös, kun Ezetimib/Atorvastatin Krka -valmistetta käytetään samanaikaisesti muiden mahdollisesti myopatiaa aiheuttavien lääkeaineiden, kuten fibriinihappojohdannaisten (fibraattien) ja etsetimibin, kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset yhteisvaikutukset
Ezetimib/Atorvastatin Krka
Kliinisesti merkitseviä farmakokineettisiä yhteisvaikutuksia ei havaittu, kun etsetimibiä annettiin yhdessä atorvastatiinin kanssa.
Muiden lääkkeiden vaikutus Ezetimib/Atorvastatin Krka -valmisteeseen
Etsetimibi
Antasidit
Antasidien samanaikainen käyttö hidasti etsetimibin imeytymisnopeutta, mutta ei vaikuttanut etsetimibin hyötyosuuteen. Hidastuneen imeytymisen ei katsota olevan kliinisesti merkittävä.
Kolestyramiini
Kolestyramiinin samanaikainen käyttö laski etsetimibin kokonaispitoisuuden (etsetimibi + etsetimibiglukuronidi) AUC:n keskiarvoa noin 55 %. Tämä yhteisvaikutus saattaa heikentää LDL-kolesterolin laskua tehostavaa vaikutusta, jonka Ezetimib/Atorvastatin Krka -valmisteen lisääminen kolestyramiinihoitoon saa aikaan (ks. kohta Annostus ja antotapa).
Siklosporiini
Kahdeksalle munuaisensiirtopotilaalle, joiden kreatiniinipuhdistuma oli > 50 ml/min ja jotka saivat stabiilia siklosporiiniannosta, tehdyssä tutkimuksessa 10 mg:n kerta-annos etsetimibiä nosti etsetimibin kokonaispitoisuuden AUC:n keskiarvon 3,4-kertaiseksi (vaihteluväli 2,3–7,9-kertainen) verrattuna toisessa tutkimuksessa pelkästään etsetimibiä saaneilla terveillä vapaaehtoisilla (n = 17) todettuihin pitoisuuksiin. Toisessa tutkimuksessa munuaisensiirtopotilaalla, jolla oli vaikea munuaisten vajaatoiminta, ja joka sai siklosporiinia ja useita muita lääkkeitä, todettiin 12 kertaa suurempi altistuminen etsetimibin kokonaispitoisuudelle verrattuna kontrolliryhmään, joka sai pelkästään etsetimibiä. Kaksijaksoisessa, vaihtovuoroisessa tutkimuksessa, johon osallistui 12 tervettä henkilöä, 20 mg etsetimibiä vuorokaudessa kahdeksan vuorokauden ajan yhdessä seitsemäntenä päivänä annetun siklosporiinin (100 mg kerta-annoksena) kanssa nosti siklosporiinin AUC-arvoa keskimäärin 15 % (vaihteluväli 10 %:n lasku – 51 %:n nousu), verrattuna yksinään annettuun 100 mg:n kerta-annokseen siklosporiinia. Samanaikaisesti annetun etsetimibin vaikutuksesta siklosporiinialtistumiseen potilailla, joille on tehty munuaisensiirto, ei ole tehty kontrolloitua tutkimusta. Aloitettaessa Ezetimib/Atorvastatin Krka -hoito siklosporiinia saavalle potilaalle on syytä noudattaa varovaisuutta. Jos potilas käyttää Ezetimib/Atorvastatin Krka -valmistetta ja siklosporiinia, on siklosporiinipitoisuuksia seurattava (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Fibraatit
Fenofibraatin tai gemfibrotsiilin samanaikainen käyttö nosti etsetimibin kokonaispitoisuuksia (noin 1,5- ja 1,7-kertaiseksi). Vaikka näitä nousuja ei pidetä kliinisesti merkittävinä, Ezetimib/Atorvastatin Krka -valmisteen samanaikaista käyttöä fibraattien kanssa ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Atorvastatiini
CYP3A4:n estäjät
Voimakkaiden CYP3A4:n estäjien on osoitettu johtavan merkitsevästi suurentuneisiin atorvastatiinipitoisuuksiin (ks. taulukko 1 ja yksityiskohtaiset tiedot alla). Voimakkaiden CYP3A4:n estäjien (esim. siklosporiini, telitromysiini, klaritromysiini, delavirdiini, stiripentoli, ketokonatsoli, vorikonatsoli, itrakonatsoli, posakonatsoli, jotkin HCV:n hoidossa käytettävät viruslääkkeet (esim. elbasviiri/gratsopreviiri) ja eräät HIV-proteaasin estäjät (mukaan lukien ritonaviiri, lopinaviiri, atatsanaviiri, indinaviiri, darunaviiri, jne.) samanaikaista antoa on mahdollisuuksien mukaan vältettävä. Jos näiden lääkkeiden ja Ezetimib/Atorvastatin Krka -valmisteen samanaikaista antoa ei voida välttää, on harkittava Ezetimib/Atorvastatin Krka -valmisteen aloitusannoksen ja enimmäisannoksen pienentämistä ja potilaan asianmukaista kliinistä seurantaa suositellaan (ks. taulukko 1).
Kohtalaiset CYP3A4:n estäjät (esim. erytromysiini, diltiatseemi, verapamiili ja flukonatsoli) voivat suurentaa atorvastatiinipitoisuutta plasmassa (ks. taulukko 1). Kun erytromysiiniä käytettiin samanaikaisesti statiinien kanssa, todettiin lisääntynyttä myopatian riskiä. Yhteisvaikutustutkimuksia amiodaronin tai verapamiilin vaikutuksista atorvastatiiniin ei ole tehty. Sekä amiodaronin että verapamiilin tiedetään estävän CYP3A4:n aktiivisuutta ja niiden samanaikainen anto Ezetimib/Atorvastatin Krka -valmisteen kanssa voi johtaa suurentuneeseen atorvastatiinialtistukseen. Siksi on harkittava Ezetimib/Atorvastatin Krka -valmisteen enimmäisannoksen pienentämistä ja potilaan asianmukaista kliinistä seurantaa suositellaan, kun Ezetimib/Atorvastatin Krka -valmistetta käytetään samanaikaisesti kohtalaisten CYP3A4:n estäjien kanssa. Asianmukaista kliinistä seurantaa suositellaan estäjähoidon aloittamisen tai annoksen muuttamisen jälkeen.
Rintasyöpäresistenssiproteiinin (BCRP) estäjät
BCRP:n estäjien (esim. elbasviiri ja gratsopreviiri) samanaikainen käyttö saattaa nostaa plasman atorvastatiinipitoisuutta ja lisätä myopatiariskiä, joten atorvastatiinin annoksen muuttamista on harkittava riippuen määrätystä annoksesta. Elbasviirin ja gratsopreviirin samanaikainen käyttö atorvastatiinin kanssa suurentaa atorvastatiinin pitoisuutta plasmassa 1,9-kertaiseksi (ks. taulukko 1). Tästä syystä Ezetimib/Atorvastatin Krka -annos ei saa ylittää 10 mg/20 mg vuorokaudessa potilailla, jotka saavat samanaikaisesti elbasviiria tai gratsopreviiria sisältäviä lääkkeitä (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Sytokromi P450 3A4 indusoijat
Sytokromi P450 3A4:n indusoijien (esim. efavirentsi, rifampisiini, mäkikuisma) ja atorvastatiinin samanaikainen anto voi pienentää atorvastatiinipitoisuuksia plasmassa vaihtelevasti. Rifampisiinilla on kaksinainen yhteisvaikutusmekanismi (se toisaalta indusoi sytokromi P450 3A4:ää, toisaalta estää hepatosyyttien OATP1B1-sisäänkuljettajaproteiinia). Tästä syystä on suositeltavaa antaa Ezetimib/Atorvastatin Krka -valmiste ja rifampisiini samanaikaisesti, sillä kun atorvastatiini on annettu viivästyneesti rifampisiinin jälkeen, plasman atorvastatiinipitoisuus on pienentynyt merkittävästi. Rifampisiinin vaikutusta atorvastatiinipitoisuuksiin hepatosyyteissä ei kuitenkaan tunneta, ja jos samanaikainen käyttö on välttämätöntä, lääkityksen tehoa tulisi seurata huolellisesti.
Kuljettajien estäjät
Kuljettajaproteiinien estäjät (esim. siklosporiini) voivat suurentaa systeemistä atorvastatiinialtistusta (ks. taulukko 1). Maksan kuljettajaproteiinien estämisen vaikutusta atorvastatiinialtistukseen hepatosyyteissä ei tunneta. Jos samanaikaista antoa ei voida välttää, Ezetimib/Atorvastatin Krka -annoksen pienentämistä ja potilaan kliinistä seurantaa tehon havaitsemiseksi suositellaan (ks. taulukko 1).
Gemfibrotsiili/fibriinihappojohdannaiset
Pelkkien fibraattien käyttöön on toisinaan liittynyt lihastapahtumia, mukaan lukien rabdomyolyysia. Näiden tapahtumien riski voi suurentua, jos fibriinihappojohdannaisia ja atorvastatiinia käytetään samanaikaisesti.
Etsetimibi
Pelkän etsetimibin käyttöön on liittynyt lihastapahtumia, mukaan lukien rabdomyolyysia. Tästä syystä tällaisten tapahtumien riski voi suurentua, kun etsetimibiä ja atorvastatiinia käytetään samanaikaisesti. Näille potilaille suositellaan asianmukaista kliinistä seurantaa.
Kolestipoli
Kun atorvastatiinin kanssa annettiin samanaikaisesti kolestipolia, atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa olivat pienempiä (arviolta noin 25 %). Lipidivaikutukset olivat kuitenkin suuremmat, kun atorvastatiinia ja kolestipolia annettiin samanaikaisesti kuin annettaessa jompaakumpaa lääkevalmistetta yksinään.
Fusidiinihappo
Myopatian, mukaan lukien rabdomyolyysin, riski voi lisääntyä systeemisen fusidiinihapon ja statiinien yhteiskäytön aikana. Yhteisvaikutuksen mekanismi (farmakodynaaminen, farmakokineettinen vai molemmat) on vielä tuntematon. Rabdomyolyysitapauksia (osa kuolemaan johtaneita) on raportoitu potilailla, jotka ovat saaneet tätä yhdistelmää.
Jos systeeminen fusidiinihappohoito on välttämätöntä, atorvastatiinihoito on keskeytettävä koko fusidiinihappohoidon ajaksi. Katso myös kohta Varoitukset ja käyttöön liittyvät varotoimet.
Kolkisiini
Vaikka atorvastatiinin ja kolkisiinin yhteisvaikutustutkimuksia ei ole tehty, myopatiatapauksia on raportoitu, kun atorvastatiinia on annettu yhdessä kolkisiinin kanssa. Siksi on noudatettava varovaisuutta määrättäessä atorvastatiinia yhdessä kolkisiinin kanssa.
Daptomysiini
Myopatian ja/tai rabdomyolyysin riski voi lisääntyä käytettäessä HMG-CoA-reduktaasin estäjiä ja daptomysiinia samanaikaisesti. Daptomysiiniä käyttävillä potilailla on harkittava Ezetimib/Atorvastatin Krka -hoidon tilapäistä keskeyttämistä, elleivät samanaikaisen käytön hyödyt ole riskejä suuremmat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Bosepreviiri
Atorvastatiinialtistus lisääntyi, kun sitä annettiin yhdessä bosepreviirin kanssa. Kun samanaikainen käyttö Ezetimib/Atorvastatin Krka -valmisteen kanssa on tarpeen, on harkittava aloitusta pienimmällä mahdollisella Ezetimib/Atorvastatin Krka -annoksella ja nostaa annosta titraamalla kunnes saavutetaan haluttu kliininen teho. Samalla tulee seurata turvallisuutta, eikä vuorokausiannos saa ylittää 10 mg/20 mg:aa. Potilailla, jotka käyttävät jo Ezetimib/Atorvastatin Krka -valmistetta, Ezetimib/Atorvastatin Krka -valmisteen vuorokausiannos ei saa ylittää 10 mg/20 mg:aa samanaikaisen bosepreviirihoidon aikana.
Ezetimib/Atorvastatin Krka -valmisteen vaikutus muiden lääkkeiden farmakokinetiikkaan
Etsetimibi
Prekliinisissä tutkimuksissa on osoitettu, ettei etsetimibi indusoi lääkeaineita metaboloivia sytokromi P450 (CYP) -entsyymejä. Etsetimibillä ei ole havaittu kliinisesti merkitseviä farmakokineettisiä yhteisvaikutuksia sellaisten lääkkeiden kanssa, joiden tiedetään metaboloituvan sytokromi P450‑entsyymien 1A2, 2D6, 2C8, 2C9 ja 3A4 tai N-asetyylitransferaasin välityksellä.
Antikoagulantit
Kahdelletoista terveelle aikuiselle miehelle tehdyssä tutkimuksessa etsetimibin (10 mg kerran vuorokaudessa) samanaikainen antaminen ei vaikuttanut merkitsevästi varfariinin hyötyosuuteen tai protrombiiniaikaan. Lääkkeen markkinoilletulon jälkeen on kuitenkin raportoitu tapauksia INR-arvon noususta potilailla, joiden varfariini- tai fluindionihoitoon oli lisätty etsetimibi. Jos varfariinihoitoon tai johonkin muuhun kumariiniantikoagulanttihoitoon tai fluindionihoitoon lisätään Ezetimib/Atorvastatin Krka -valmiste, INR-arvoa tulisi seurata asianmukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Atorvastatiini
Digoksiini
Toistuvasti otetut samanaikaiset digoksiini- ja 10 mg atorvastatiiniannokset suurensivat vakaan tilan digoksiinipitoisuuksia hieman. Digoksiinilla hoidettuja potilaita on seurattava asianmukaisesti.
Suun kautta otettavat ehkäisyvalmisteet
Suun kautta otettavan ehkäisyvalmisteen ja atorvastatiinin samanaikainen käyttö suurensi noretisteroni- ja etinyyliestradiolipitoisuuksia plasmassa.
Varfariini
Kliinisessä tutkimuksessa, jossa potilaat saivat jatkuvaa varfariinilääkitystä, 80 mg:n atorvastatiiniannos kerran vuorokaudessa samaan aikaan varfariinin kanssa aiheutti protrombiiniajan pienen, noin 1,7 sekunnin, lyhentymisen hoidon 4 ensimmäisen päivän aikana. Arvot palautuivat normaalitasolle 15 päivän kuluessa atorvastatiinihoidon aloittamisesta. Vaikka veren hyytymiseen liittyviä, kliinisesti merkitseviä yhteisvaikutuksia on ilmoitettu vain hyvin harvinaisissa tapauksissa, protrombiiniaika on määritettävä kumariiniantikoagulanttilääkitystä saavalle potilaalle ennen Ezetimib/Atorvastatin Krka -hoidon aloittamista ja riittävän usein hoidon alkuaikana, jotta voidaan varmistua, ettei protrombiiniajassa tapahdu merkitseviä muutoksia. Kun stabiili protrombiiniaika on saavutettu, voidaan protrombiiniajan määrityksissä siirtyä samanlaisiin määritysväleihin kuin kumariiniantikoagulanttilääkitystä saaville potilaille yleensä suositellaan. Jos Ezetimib/Atorvastatin Krka -annostusta muutetaan tai hoito lopetetaan, on sama käytäntö toistettava. Atorvastatiinihoitoon ei ole liittynyt verenvuotoa tai muutoksia protrombiiniajassa sellaisilla potilailla, jotka eivät saa antikoagulanttilääkitystä.
Taulukko 1: Samanaikaisesti annettujen lääkkeiden vaikutus atorvastatiinin farmakokinetiikkaan
| Samanaikaisesti annettu lääke ja lääkeannos | Atorvastatiini | Ezetimib/Atorvastatin Krka | |
| Annos (mg) | AUC-muutos& | Kliininen suositus# | |
| Tipranaviiri 500 mg x 2/vrk / ritonaviiri 200 mg x 2, 8 vrk ajan (päivät 14–21) | 40 mg päivänä 1, 10 mg päivänä 20 | ↑ 9,4-kertainen | Jos samanaikainen anto Ezetimib/Atorvastatin Krka -valmisteen kanssa on välttämätöntä, Ezetimib/Atorvastatin Krka -vuorokausiannos ei saa ylittää 10 mg/10 mg. Näille potilaille suositellaan kliinistä seurantaa. |
| Siklosporiini 5,2 mg/kg/vrk, vakaa annos | 10 mg x 1/vrk, 28 vrk ajan | ↑ 8,7-kertainen | |
| Lopinaviiri 400 mg x 2/vrk / ritonaviiri 100 mg x 2/vrk, 14 vrk ajan | 20 mg x 1/vrk, 4 vrk ajan | ↑ 5,9-kertainen | Jos samanaikainen anto Ezetimib/Atorvastatin Krka -valmisteen kanssa on välttämätöntä, suositellaan pienempää Ezetimib/Atorvastatin Krka -ylläpitoannosta. Jos Ezetimib/Atorvastatin Krka annos on suurempi kuin 10 mg/20 mg, potilaille suositellaan kliinistä seurantaa. |
| Klaritromysiini 500 mg x 2/vrk, 9 vrk ajan | 80 mg x 1/vrk, 8 vrk ajan | ↑ 4,4-kertainen | |
Sakinaviiri 400 x 2/vrk / ritonaviiri (300 mg x 2/vrk päivästä 5–7 alkaen, lisätty 400 mg:aan x 2/vrk päivänä 8), päivinä 5–18, 30 minuuttia atorvastatiinin annon jälkeen | 40 mg x 1/vrk, 4 vrk ajan | ↑ 3,9-kertainen | Jos samanaikainen anto Ezetimib/Atorvastatin Krka -valmisteen kanssa on välttämätöntä, suositellaan pienempää Ezetimib/Atorvastatin Krka -ylläpitoannosta. Jos Ezetimib/Atorvastatin Krka annos on suurempi kuin 10 mg/40 mg, potilaille suositellaan kliinistä seurantaa. |
| Darunaviiri 300 mg x 2/vrk / ritonaviiri 100 mg x 2/vrk, 9 vrk ajan | 10 mg x 1/vrk, 4 vrk ajan | ↑ 3,3-kertainen | |
| Itrakonatsoli 200 mg x 1/vrk, 4 vrk ajan | 40 mg kerta-annos | ↑ 3,3-kertainen | |
Fosamprenaviiri 700 mg x 2/vrk / ritonaviiri 100 mg x 2/vrk, 14 vrk ajan | 10 mg x 1/vrk, 4 vrk ajan | ↑ 2,5-kertainen | |
| Fosamprenaviiri 1 400 mg x 2/vrk, 14 vrk ajan | 10 mg x 1/vrk, 4 vrk ajan | ↑ 2,3-kertainen | |
| Nelfinaviiri 1 250 mg x 2/vrk, 14 vrk ajan | 10 mg x 1/vrk, 28 vrk ajan | ↑ 1,7-kertainen^ | Ei erityistä suositusta. |
| Greippimehu, 240 ml x 1/vrk* | 40 mg kerta-annos | ↑ 37 % | Ezetimib/Atorvastatin Krka -valmisteen ja suurien greippimehumäärien samanaikaista nauttimista ei suositella. |
| Diltiatseeemi 240 mg x 1/vrk, 28 vrk ajan | 40 mg kerta-annos | ↑ 51 % | Diltiatseemihoidon aloittamisen tai annostusmuutosten jälkeen suositellaan potilaan asianmukaista kliinistä seurantaa. |
| Erytromysiini 500 mg x 4/vrk, 7 vrk ajan | 10 mg kerta-annos | ↑ 33 %^ | Näille potilaille suositellaan pienempää enimmäisannosta ja kliinistä seurantaa. |
| Amlodipiini 10 mg, kerta-annos | 80 mg kerta-annos | ↑ 18 % | Ei erityistä suositusta. |
Simetidiini 300 mg x 4/vrk, 2 viikon ajan | 10 mg x 1/vrk, 4 viikon ajan | ↓ alle 1 %^ | Ei erityistä suositusta. |
| Magnesiumia ja aluminiumhydroksidia sisältävä antasidisuspensio, 30 ml x 4/vrk, 2 viikon ajan | 10 mg x 1/vrk, 4 viikon ajan | ↓ 35 %^ | Ei erityistä suositusta. |
| Efavirentsi 600 mg x 1/vrk, 14 vrk ajan | 10 mg 3 vrk ajan | ↓ 41 % | Ei erityistä suositusta. |
| Rifampisiini 600 mg x 1/vrk, 7 vrk ajan (samanaikaisesti) | 40 mg kerta-annos | ↑ 30 % | Jos samanaikaista käyttöä ei voida välttää, Ezetimib/Atorvastatin Krka -valmisteen samanaikaista antoa rifampisiinin kanssa ja potilaan kliinistä seurantaa suositellaan. |
| Rifampisiini 600 mg x 1/vrk, 5 vrk ajan (erikseen annettuna) | 40 mg kerta-annos | ↓ 80 % | |
| Gemfibrotsiili 600 mg x 2/vrk, 7 vrk ajan | 40 mg kerta-annos | ↑ 35 % | Ei suositella. |
| Fenofibraatti 160 mg x 1/vrk, 7 vrk ajan | 40 mg kerta-annos | ↑ 3 % | Ei suositella. |
| Bosepreviiri 800 mg x 3/vrk, 7 vrk ajan | 40 mg kerta-annos | ↑ 2,3-kertainen | Näille potilaille suositellaan pienempää aloitusannosta ja kliinistä seurantaa. Ezetimib/Atorvastatin Krka -valmisteen vuorokausiannos ei saa ylittää 10 mg/20 mg:aa samanaikaisen bosepreviirihoidon aikana. |
| Elbasviiri 50 mg x 1/vrk / gratsopreviiri 200 mg x 1/vrk, 13 vrk ajan | 10 mg kerta-annos | ↑ 1,94-kertainen | Ezetimib/Atorvastatin Krka -valmisteen vuorokausiannos ei saa ylittää 10 mg/20 mg:aa samanaikaisen elbasviiria tai gratsopreviiria sisältävän hoidon aikana. |
| Glekapreviiri 400 mg x 1/vrk / pibrentasviiri 120 mg x 1/vrk, 7 vrk ajan | 10 mg x 1/vrk, 7 vrk ajan | ↑ 8,3-kertainen | Ei saa antaa samanaikaisesti glekapreviiriä tai pibrentasviiriä sisältävän hoidon kanssa (ks. kohta Vasta-aiheet). |
& X-kertaisena muutoksena annetut tiedot kuvaavat yksinkertaista hoitojen suhdetta: samaan aikaan annettu lääke ja atorvastatiini vs. pelkkä atorvastatiini (esim. 1-kertainen = ei muutosta). Prosentuaalisena muutoksena ilmoitetut tiedot kuvaavat prosentuaalista eroa pelkkään atorvastatiiniin verrattuna (esim. 0 % = ei muutosta).
# Kliininen merkitys, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset.
* Sisältää yhden tai useamman komponentin, jotka estävät CYP3A4:ää ja voivat suurentaa sellaisen lääkevalmisteen pitoisuuksia plasmassa, jotka metaboloituvat CYP3A4:n vaikutuksesta. Yhden 240 ml suuruisen greippimehulasillisen nauttiminen pienensi myös aktiivisen ortohydroksimetaboliitin AUC-arvoa 20,4 %. Suuret greippimehumäärät (yli 1,2 l/vrk 5 päivän ajan) suurensivat atorvastatiinin AUC-arvon 2,5‑kertaiseksi ja aktiivisten HMG-CoA-reduktaasin estäjien (atorvastatiinin ja sen metaboliittien) AUC-arvon 1,3-kertaiseksi.
^ Atorvastatiiniekvivalentin kokonaisaktiivisuus.
Suureneminen on merkitty “↑”, pieneneminen merkitty “↓”.
Taulukko 2. Atorvastatiinin vaikutus samanaikaisesti annettujen lääkkeiden farmakokinetiikkaan
| Atorvastatiini ja lääkeannos | Samanaikaisesti annettu lääke | Ezetimib/Atorvastatin Krka | |
| Lääke/Annos (mg) | AUC-muutos& | Kliininen suositus | |
80 mg x 1/vrk, 10 vrk ajan | Digoksiini 0,25 mg x 1/vrk, 20 vrk ajan | ↑ 15 % | Digoksiinia saavia potilaita on seurattava asianmukaisesti. |
40 mg x 1/vrk, 22 vrk ajan | Suun kautta otettava ehkäisyvalmiste x 1/vrk, 2 kk ajan - noretisteroni 1 mg - etinyyliestradioli 35 mikrog | ↑ 28 % ↑ 19 % | Ei erityistä suositusta. |
80 mg x 1/vrk, 15 vrk ajan | *Fenatsoni 600 mg kerta-annos | ↑ 3 % | Ei erityistä suositusta. |
10 mg x 1/vrk, 4 vrk ajan | Fosamprenaviiri 1 400 mg x 2/vrk, 14 vrk ajan | ↓ 27% | Ei erityistä suositusta. |
& Prosentuaalisena muutoksena ilmoitetut tiedot kuvaavat prosentuaalista eroa pelkkään atorvastatiiniin verrattuna (esim. 0 % = ei muutosta).
* Toistuvasti samanaikaisesti otetut atorvastatiini- ja fenatsoniannokset vaikuttivat tuskin ollenkaan tai niillä ei ollut mitattavissa olevaa vaikutusta fenatsonipuhdistumaan.
Suureneminen on merkitty “↑”, pieneneminen merkitty “↓”.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana (katso kohta Vasta-aiheet).
Raskaus
Ateroskleroosin kehittyminen on pitkäaikainen prosessi. Lipidihoidon keskeyttämisen raskauden ajaksi ei pitäisi normaalisti vaikuttaa juuri lainkaan primaariseen hyperkolesterolemiaan liittyvään pitkän aikavälin riskiin.
Ezetimib/Atorvastatin Krka
Ezetimib/Atorvastatin Krka -valmisteen käyttö on vasta-aiheista raskauden aikana (ks. kohta Vasta-aiheet). Ezetimib/Atorvastatin Krka -valmisteen raskaudenaikaisesta käytöstä ei ole kliinistä tietoa. Ezetimib/Atorvastatin Krka -valmistetta ei tule käyttää naisille, jotka ovat raskaana, suunnittelevat raskautta tai arvelevat olevansa raskaana. Ezetimib/Atorvastatin Krka -hoito on keskeytettävä raskauden ajaksi tai kunnes on varmistettu, ettei potilas ole raskaana (ks. kohta Vasta-aiheet).
Etsetimibin ja atorvastatiinin samanaikainen annostelu tiineille rotille osoitti, että testiartikkeleihin liittyvä luuston variaatio "vähentynyt rintakehän luutuminen" lisääntyi suurta etsetimibi/atorvastatiini-annosta saaneessa ryhmässä. Tämä voi liittyä havaittuun sikiön painon laskuun. Tiineillä kaniineilla todettiin vähäisessä määrin luuston epämuodostumia (yhteensulautuneita rinta- ja häntänikamia sekä epäsymmetristä rintalastavariaatiota).
Atorvastatiini
Turvallisuutta raskaana oleville naisille ei ole osoitettu. Kontrolloituja kliinisiä tutkimuksia atorvastatiinin käytöstä raskaana oleville naisille ei ole tehty. Harvinaisia ilmoituksia synnynnäisistä epämuodostumista on vastaanotettu, kun sikiö oli altistunut HMG-CoA-reduktaasin estäjille kohdussa. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Äidin atorvastatiinihoito saattaa pienentää sikiön mevalonaattitasoja. Mevalonaatti on kolesterolin biosynteesin esiaste.
Etsetimibi
Etsetimibin raskaudenaikaisesta käytöstä ei ole kliinistä tietoa. Etsetimibillä yksinään tehdyt eläinkokeet eivät ole tuoneet esiin suoria eivätkä epäsuoria haitallisia vaikutuksia raskauteen, alkion- ja sikiönkehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetys
Ezetimib/Atorvastatin Krka -valmisteen käyttö on vasta-aiheista imetyksen aikana. Vakavien haittavaikutusten riskin vuoksi Ezetimib/Atorvastatin Krka -valmistetta käyttävien naisten ei tule imettää. Rotilla tehdyt tutkimukset osoittivat, että etsetimibi erittyy imettävien rottien maitoon. Rotilla atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa ovat samaa luokkaa kuin niiden pitoisuudet maidossa. Ei tiedetä, erittyvätkö Ezetimib/Atorvastatin Krka -valmisteen vaikuttavat aineet ihmisillä äidinmaitoon (ks kohta Vasta-aiheet).
Hedelmällisyys
Ezetimib/Atorvastatin Krka -valmisteella ei ole tehty hedelmällisyystutkimuksia.
Atorvastatiini
Eläinkokeissa atorvastatiinilla ei todettu vaikutuksia miehen tai naisen hedelmällisyyteen.
Etsetimibi
Etsetimibillä ei ole vaikutusta uros- tai naarasrottien hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ezetimib/Atorvastatin Krka -valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Ajoneuvoa ajettaessa tai koneita käytettäessä on kuitenkin huomioitava, että heitehuimausta on ilmoitettu esiintyneen.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Etsetimibi/atorvastatiini-yhdistelmän (tai etsetimibi/atorvastatiini-yhdistelmää vastaavan etsetimibin ja atorvastatiinin samanaikaisen käytön) turvallisuutta on arvioitu yli 2 400 potilaalla 7 kliinisessä tutkimuksessa.
HaittavaikutustaulukkoEtsetimibi/atorvastatiini-yhdistelmän (tai etsetimibi/atorvastatiini-yhdistelmää vastaavan etsetimibin ja atorvastatiinin samanaikaisen käytön), etsetimibin tai atorvastatiinin kliinisissä tutkimuksissa havaitut tai etsetimibi/atorvastatiini-yhdistelmän, etsetimibin tai atorvastatiinin markkinoille tulon jälkeisessä käytössä havaitut haittavaikutukset on lueteltu taulukossa 3. Nämä haittavaikutukset on esitetty elinjärjestelmän ja yleisyyden mukaan.
Haittavaikutusten esiintyvyystiheydet on luokiteltu seuraavasti:
hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 3. Haittavaikutukset
Elinjärjestelmä Yleisyys | Haittavaikutus |
| Infektiot | |
| Melko harvinainen | influenssa |
| Tuntematon | nasofaryngiitti |
| Veri ja imukudos | |
| Tuntematon | trombosytopenia |
| Immuunijärjestelmä | |
| Tuntematon | yliherkkyys mukaan lukien anafylaksi, angioedeema, ihottuma ja urtikaria |
| Aineenvaihdunta ja ravitsemus | |
| Tuntematon | heikentynyt ruokahalu, anoreksia, hyperglykemia, hypoglykemia |
| Psyykkiset häiriöt | |
| Melko harvinainen | masennus, unettomuus, unihäiriö |
| Tuntematon | painajaisunet |
| Hermosto | |
| Melko harvinainen | huimaus, makuhäiriö, päänsärky, parestesia |
| Tuntematon | hypestesia (tuntoaistin heikkeneminen), muistinmenetys, perifeerinen neuropatia, myasthenia gravis |
| Silmät | |
| Tuntematon | näön sumeneminen, näköhäiriöt, silmämyastenia |
| Kuulo ja tasapainoelin | |
| Tuntematon | tinnitus, kuulon menetys |
| Sydän | |
| Melko harvinainen | sinusbradykardia |
| Verisuonisto | |
| Melko harvinainen | kuumat allot |
| Tuntematon | hypertensio |
| Hengityselimet, rintakehä ja välikarsina | |
| Melko harvinainen | dyspnea |
| Tuntematon | yskä, nielun ja kurkunpään kipu, nenäverenvuoto |
| Ruoansulatuselimistö | |
| Yleinen | ripuli |
| Melko harvinainen | vatsan alueen epämukavuus, vatsan turvotus, vatsakipu, ylä- ja alavatsakipu, ummetus, dyspepsia, ilmavaivat, tiheät suolen liikkeet, gastriitti, pahoinvointi, vatsan epämukavuus |
| Tuntematon | pankreatiitti, gastroesofageaalinen refluksitauti, röyhtäily, oksentelu, suun kuivuminen |
| Maksa ja sappi | |
| Tuntematon | hepatiitti, kolelitiaasi, kolekystiitti, kolestaasi, fataali ja ei-fataali maksan vajaatoiminta |
| Iho ja ihonalainen kudos | |
| Melko harvinainen | akne, urtikaria |
| Tuntematon | alopesia, ihottuma, kutina, erythema multiforme, angioneuroottinen edeema, rakkulaiset ihottumat mukaan lukien erythema multiforme, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi |
| Luusto, lihakset ja sidekudos | |
| Yleinen | myalgia |
| Melko harvinainen | nivelkipu, selkäkipu, lihasten väsyminen, lihaskouristukset, lihasheikkous, raajakipu |
| Tuntematon | myopatia/rabdomyolyysi, lihasrepeämä, jännesairaus (jonka komplikaationa joskus jänteen repeämä), niskakipu, nivelten turpoaminen, myosiitti, lupuksen kaltainen oireyhtymä, immuunivälitteinen nekrotisoiva myopatia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Sukupuolielimet ja rinnat | |
| Tuntematon | gynekomastia |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Melko harvinainen | astenia, uupumus, huonovointisuus, edeema |
| Tuntematon | rintakipu, kipu, ääreisturvotus, kuume |
| Tutkimukset | |
| Melko harvinainen | kohonneet ALAT- ja/tai ASAT-arvot, kohonnut alkalinen fosfataasi, kohonnut veren kreatiinifosfokinaasipitoisuus (CK), kohonnut gammaglutamyylitransferaasiarvo, kohonneet maksaentsyymiarvot, normaalista poikkeavat maksan toimintakokeiden tulokset, painonnousu |
| Tuntematon | positiivinen tulos virtsan valkosolutestissä |
Laboratorioarvot
Kontrolloiduissa kliinisissä tutkimuksissa kliinisesti tärkeää seerumin transaminaasiarvojen nousua (ALAT ja/tai ASAT ≥ 3 x normaaliarvojen yläraja [ULN], peräkkäisissä mittauksissa) esiintyi 0,6 % potilailla, jotka saivat etsetimibi/atorvastatiini-yhdistelmää. Nämä muutokset olivat yleensä oireettomia eikä niihin liittynyt kolestaasia, ja arvot palautuivat lähtötasolle hoitoa jatkettaessa tai hoidon lopettamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Seuraavia haittavaikutuksia on raportoitu ilmenneen joidenkin statiinien käytön yhteydessä:
- seksuaaliset toimintahäiriöt
- poikkeuksellisissa tapauksissa interstitiaalinen keuhkosairaus, erityisesti pitkäaikaisen hoidon yhteydessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- diabetes mellitus: Esiintyvyys riippuu riskitekijöistä (paastoverensokeri ≥ 5,6 mmol/l, BMI > 30 kg/m2 , kohonnut triglyseridipitoisuus, aiempi kohonnut verenpaine).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ezetimib/Atorvastatin Krka
Yliannostustapauksissa on annettava oireenmukaista ja elintoimintoja tukevaa hoitoa. Potilaalle on tehtävä maksan toimintakokeet ja seurattava hänen seerumin kreatiinikinaasiarvojaan (CK).
Etsetimibi
Etsetimibiä siedettiin yleensä hyvin, kun sitä annettiin kliinisissä tutkimuksissa 15 terveelle koehenkilölle 50 mg/vrk enintään 14 vuorokauden ajan tai 18:lle primaarista hyperlipidemiaa sairastavalle potilaalle 40 mg/vrk enintään 56 vuorokauden ajan. Muutamia yliannostustapauksia on raportoitu, ja useimpiin niistä ei ole liittynyt haittavaikutuksia. Raportoidut haittavaikutukset eivät olleet vakavia. Eläinkokeissa ei havaittu toksisia vaikutuksia, kun etsetimibiä annettiin oraalisina kerta-annoksina rotille ja hiirille 5 000 mg/kg ja koirille 3 000 mg/kg.
Atorvastatiini
Atorvastatiini sitoutuu voimakkaasti plasman proteiineihin eikä hemodialyysin siksi odoteta merkitsevästi suurentavan atorvastatiinin puhdistumaa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Lipidejä muuntavat lääkeaineet, lipidejä muuntavien lääkeaineiden yhdistelmävalmisteet, ATC-koodi: C10BA05.
Etsetimibi/atorvastatiini on veren lipidejä vähentäviä valmiste, ja se estää selektiivisesti kolesterolin ja vastaavien kasvisterolien imeytymistä suolistosta sekä kolesterolin endogeenistä synteesiä.
Vaikutusmekanismi
Etsetimibi/atorvastatiini
Plasman kolesteroli on peräisin suolistosta imeytyneestä kolesterolista ja kolesterolin endogeenisestä synteesistä. Etsetimibi/atorvastatiini sisältää etsetimibiä ja atorvastatiinia, kahta lipidejä alentavaa yhdistettä, joilla on toisiaan täydentävät vaikutusmekanismit. Etsetimibi/atorvastatiini laskee koholla olevia kokonaiskolesteroli-, LDL-kolesteroli-, Apo B- ja triglyseridipitoisuuksia sekä non-HDL-kolesterolitasoja ja lisää HDL-kolesterolin pitoisuutta kahdella tavalla: estämällä sekä kolesterolin imeytymistä että sen synteesiä.
Etsetimibi
Etsetimibi estää kolesterolin imeytymistä suolistosta. Etsetimibi on tehokas suun kautta annettuna, ja sen vaikutusmekanismi poikkeaa muiden kolesterolia alentavien lääkeaineryhmien (esim. statiinien, sappihappoja sitovien aineiden [resiinien], fibriinihappojohdannaisten ja kasvistanolien) vaikutusmekanismeista. Etsetimibin vaikutuskohde molekyylitasolla on sterolien kuljettaja, Niemann‑Pick C1-Like 1(NPC1L1) -proteiini, joka vastaa kolesterolin ja fytosterolien imeytymisestä suolistossa.
Etsetimibi asettuu ohutsuolen sukareunukseen (”brush border”), missä se estää kolesterolin imeytymistä ja vähentää siten suolistossa olevan kolesterolin siirtymistä maksaan; statiinit vähentävät kolesterolin synteesiä maksassa ja yhdessä nämä erilliset vaikutusmekanismit täydentävät toistensa kolesterolia alentavaa vaikutusta. Kaksi viikkoa kestäneessä kliinisessä tutkimuksessa, jossa oli mukana 18 hyperkolesterolemiapotilasta, etsetimibi vähensi kolesterolin imeytymistä suolistosta 54 % plaseboon verrattuna.
Etsetimibin kolesterolin imeytymistä estävän vaikutuksen selektiivisyyttä on tutkittu prekliinisissä tutkimuksissa. Etsetimibi esti 14C-kolesterolin imeytymistä ilman että se vaikutti triglyseridien, rasvahappojen, sappihappojen, progesteronin, etinyyliestradiolin tai rasvaliukoisten A‑ ja D-vitamiinien imeytymiseen.
Atorvastatiini
Atorvastatiini on selektiivinen, kilpaileva HMG-CoA-reduktaasin estäjä. HMG-CoA-reduktaasi on entsyymi, joka vastaa 3-hydroksi-3-metyyliglutaryylikoentsyymi A:n konversiosta mevalonaatiksi (sterolien, mm. kolesterolin, esiaste), ja säätelee konversion nopeutta. Triglyseridit ja kolesteroli liittyvät maksassa VLDL:ään (very low density lipoprotein) ja vapautuvat edelleen plasmaan perifeerisiin kudoksiin vietäviksi. Low density -lipoproteiini (LDL) muodostuu VLDL:stä ja hajoaa pääasiassa reseptoreissa, joilla on suuri affiniteetti LDL:ään (LDL-reseptori).
Atorvastatiini pienentää plasman kolesteroli- ja lipoproteiinipitoisuuksia estämällä HMG‑CoA‑reduktaasia ja siten kolesterolin biosynteesiä maksassa. Atorvastatiini lisää maksan LDL‑reseptoreiden määrää solujen pinnalla, mikä lisää LDL:n soluunottoa ja hajoamista.
Atorvastatiini vähentää LDL:n tuotantoa ja LDL-partikkeleiden lukumäärää. Atorvastatiini lisää LDL‑reseptoriaktiivisuutta voimakkaasti ja pitkäkestoisesti, ja lisäksi se parantaa kiertävien LDL‑partikkeleiden laatua. Atorvastatiini pienentää LDL-kolesterolipitoisuutta tehokkaasti homotsygoottisessa familiaalisessa hyperkolesterolemiassa sellaisessa potilasryhmässä, jossa ei tavallisesti saada vastetta lipidejä alentavalla lääkityksellä.
Annosvastetutkimuksessa atorvastatiinin on todettu pienentävän kokonaiskolesterolipitoisuutta (30−46 %), LDL-kolesterolipitoisuutta (41−61 %), apolipoproteiini B -pitoisuutta (34−50 %) ja triglyseridipitoisuutta (14−33 %) sekä suurentavan vaihtelevassa määrin HDL-kolesteroli- ja apolipoproteiini A‑I ‑pitoisuuksia. Nämä tulokset ovat yhteneväiset tulosten kanssa, jotka on saatu heterotsygoottisessa familiaalisessa hyperkolesterolemiassa, ei-familiaalisessa hyperkolesterolemiassa ja sekamuotoisessa hyperlipidemiassa (myös insuliinista riippumatonta aikuistyypin diabetesta sairastavilla).
Kliininen teho ja turvallisuus
Kontrolloiduissa kliinisissä tutkimuksissa etsetimibi/atorvastatiini vähensi merkittävästi hyperkolesterolemiaa sairastavien potilaiden kokonaiskolesteroli-, LDL-kolesteroli-, Apo B- ja triglyseridipitoisuutta ja lisäsi HDL-kolesterolin pitoisuutta.
Primaarinen hyperkolesterolemiaPlasebokontrolloidussa tutkimuksessa 628 hyperlipidemiapotilasta satunnaistettiin saamaan lumelääkettä, etsetimibiä (10 mg), atorvastatiinia (10 mg, 20 mg, 40 mg tai 80 mg) tai etsetimibiä ja atorvastatiinia yhdessä niin että annos vastasi etsetimibi/atorvastatiini-yhdistelmää (10 mg/10 mg, 10 mg/20 mg, 10 mg/40 mg ja 10 mg/80 mg) enintään 12 viikon ajan.
Kaikkia etsetimibi/atorvastatiini-annoksia saavia potilaita verrattiin kaikkia atorvastatiiniannoksia saaneisiin potilaisiin. Etsetimibi/atorvastatiini alensi kokonaiskolesteroli- (kokonais-C), LDL-kolesteroli- (LDL-C), Apo B- ja triglyseridiarvoja (TG) sekä non-HDL-kolesterolia (non-HDL-C) ja lisäsi HDL-kolesterolin (HDL-C) pitoisuutta merkittävästi enemmän kuin atorvastatiini yksinään (ks. taulukko 4.).
Taulukko 4. Etsetimibi/atorvastatiini-yhdistelmän vaste potilailla, joilla on primaarinen hyperlipidemia (keskimääräinena %-muutos verrattuna hoitamattomaan lähtötasoonb viikolla 12)
Hoito (vuorokausiannos) | N | Kokonais-C | LDL-C | Apo B | TGa | HDL-C | Non- HDL-C |
Yhdistetyt tiedot (kaikki etsetimibi/atorvastatiini -annokset)c | 255 | -41 | -56 | -45 | -33 | +7 | -52 |
Yhdistetyt tiedot (kaikki atorvastatiiniannokset)c | 248 | -32 | -44 | -36 | -24 | +4 | -41 |
Etsetimibi 10 mg | 65 | -14 | -20 | -15 | -5 | +4 | -18 |
Plasebo | 60 | +4 | +4 | +3 | -6 | +4 | +4 |
Etsetimibi/atorvastatiini annoksittain 10 mg/10 mg | 65 | -38 | -53 | -43 | -31 | +9 | -49 |
10 mg/20 mg | 62 | -39 | -54 | -44 | -30 | +9 | -50 |
10 mg/40 mg | 65 | -42 | -56 | -45 | -34 | +5 | -52 |
10 mg/80 mg | 63 | -46 | -61 | -50 | -40 | +7 | -58 |
Atorvastatiini annoksittain | |||||||
10 mg | 60 | -26 | -37 | -28 | -21 | +6 | -34 |
20 mg | 60 | -30 | -42 | -34 | -23 | +4 | -39 |
40 mg | 66 | -32 | -45 | -37 | -24 | +4 | -41 |
80 mg | 62 | -40 | -54 | -46 | -31 | +3 | -51 |
a Triglyseridiarvojen prosentuaalinen mediaanimuutos lähtötilanteesta.
b Lähtötilanne – ilman lipidejä alentavaa lääkettä.
c Etsetimibi/atorvastatiini yhdistettynä (10 mg/10 mg – 10 mg/80 mg) vähensi merkitsevästi kokonais-C-, LDL-C-, Apo B-, TG- ja non-HDL-C-pitoisuutta ja suurensi merkitsevästi HDL-C:tä verrattuna kaikkiin yhdistettyihin atorvastatiiniannoksiin (10 mg – 80 mg).
Kontrolloidussa ”Titration of Atorvastatin vs Ezetimibe Add-On to Atorvastatin in Patients with Hypercholesterolaemia” (TEMPO) -tutkimuksessa 184 potilasta, joiden LDL-kolesterolipitoisuus oli ≥ 2,6 mmol/l ja ≤ 4,1 mmol/l, ja joilla oli kohtalaisen suuri sepelvaltimotaudin riski, saivat 20 mg atorvastatiinia vähintään 4 viikon ajan ennen satunnaistamista. Potilaat, joiden LDL‑kolesterolipitoisuus ei ollut < 2,6 mmol/l, satunnaistettiin saamaan joko etsetimibiä ja atorvastatiinia (vastaten etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/20 mg) tai 40 mg atorvastatiinia 6 viikon ajan.
Etsetimibi/atorvastatiini 10 mg/20 mg oli merkitsevästi tehokkaampi alentamaan entisestään kokonaiskolesteroli- (-20 % vs. -7 %), LDL-kolesteroli- (-31 % vs. -11 %), Apo B- (‑21 % vs. -8 %) ja non-HDL-kolesteroliarvoja (-27 % vs. -10 %) kuin atorvastatiiniannoksen kaksinkertaistaminen 40 mg:aan. HDL-kolesteroli ja triglyseridi-tulokset näiden kahden hoitoryhmän välillä eivät eronneet merkitsevästi. Lisäksi merkitsevästi useammalla etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/20 mg saaneella potilaalla (84 %) LDL-kolesterolipitoisuus oli < 2,6 mmol/l verrattuna 40 mg:aa atorvastatiinia saaneisiin potilaisiin (49 %.).
Kontrolloidussa ”The Ezetimibe Plus Atorvastatin vs Atorvastatin Titration in Achieving Lower LDL‑C Targets in Hypercholesterolaemic Patients” (EZ-PATH) -tutkimuksessa 556 suuren kardiovaskulaarisen riskin potilasta, joiden LDL-kolesterolipitoisuus oli ≥ 1,8 mmol/l ja ≤ 4,1 mmol/l, saivat 40 mg atorvastatiinia vähintään 4 viikon ajan ennen satunnaistamista. Potilaat, joiden LDL‑kolesterolipitoisuus ei ollut < 1,8 mmol/l, satunnaistettiin saamaan joko etsetimibiä ja atorvastatiinia (vastaten etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/40 mg) tai 80 mg atorvastatiinia 6 viikon ajan.
Etsetimibi/atorvastatiini 10 mg/40 mg oli merkitsevästi tehokkaampi alentamaan entisestään kokonaiskolesteroli- (-17 % vs. ‑7 %), LDL-kolesteroli- (-27 % vs. -11 %), Apo B- (-18 % vs. -8 %), triglyseridi- (-12 % vs. -6 %) ja non-HDL-kolesteroliarvoja (-23 % vs. -9 %) kuin atorvastatiiniannoksen kaksinkertaistaminen 80 mg:aan. HDL-kolesterolitulokset näiden kahden hoitoryhmän välillä eivät eronneet merkitsevästi. Lisäksi merkitsevästi useammalla etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/40 mg saaneella potilaalla (74 %) LDL‑kolesterolipitoisuus oli < 1,8 mmol/l verrattuna 80 mg:n atorvastatiinia saaneisiin potilaisiin (32 %).
Kahdeksan viikon plasebokontrolloituun tutkimukseen osallistui 308 hyperkolesterolemiapotilasta, jotka saivat atorvastatiinihoitoa eivätkä olleet saavuttaneet NCEP‑suosituksen (National Cholesterol Education Program) mukaista LDL-kolesterolin tavoitearvoa (LDL-kolesteroli-tavoite perustuu lähtötilanteen LDL-kolesterolitasoon ja sepelvaltimotaudin riskitilaan). Näille potilaille annettiin satunnaistetusti joko 10 mg etsetimibiä tai plaseboa jo käytössä olevan atorvastatiinihoidon lisäksi.
Niistä atorvastatiinia saaneista potilaista, joiden LDL-kolesteroli ei ollut tavoitetasolla tutkimuksen alkaessa (~83 %), merkitsevästi useampi etsetimibi-ryhmään (67 %) kuin plaseboryhmään (19 %) satunnaistetuista potilaista saavutti LDL-kolesterolin tavoitetason. Atorvastatiinihoitoon lisätty etsetimibi vähensi merkitsevästi LDL-kolesterolipitoisuutta plaseboon verrattuna (etsetimibi 25 % ja plasebo 4 %). Atorvastatiinihoitoon lisätty etsetimibi vähensi myös merkitsevästi kokonaiskolesteroli-, Apo B- ja triglyseridipitoisuuksia plaseboon verrattuna.
Kontrolloidussa, 12 viikkoa kestäneessä 2-vaiheisessa tutkimuksessa 1 539 suuren sydän- ja verisuonitautiriskin potilasta, joiden LDL-kolesterolipitoisuus oli välillä 2,6–4,1 mmol/l, ja jotka saivat atorvastatiinia 10 mg vuorokaudessa, satunnaistettiin saamaan 20 mg atorvastatiinia, 10 mg rosuvastatiinia tai etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/10 mg. Kuuden viikon hoidon jälkeen (vaihe I) potilaat, jotka saivat 20 mg atorvastatiinia, ja jotka eivät saavuttaneet LDL‑kolesterolitasoa < 2,6 mmol/l, vaihdettiin saamaan joko 40 mg:n atorvastatiiniin tai etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/20 mg 6 viikon ajaksi (vaihe II). Vastaavasti potilaat, jotka saivat 10 mg rosuvastatiinia vaiheen I aikana ja jotka eivät saavuttaneet LDL‑kolesterolitasoa < 2,6 mmol/l, vaihdettiin saamaan joko 20 mg rosuvastatiinia tai etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/20 mg. LDL‑kolesterolipitoisuuden pieneneminen sekä etsetimibi/atorvastatiini-ryhmän ja muiden tutkittujen hoitoryhmien väliset vertailut on esitetty taulukossa 5.
Taulukko 5. Etsetimibi/atorvastatiini-yhdistelmän* vaste suuren riskin potilailla, joiden LDL‑kolesterolipitoisuus oli 2,6–4,1 mmol/l, kun atorvastatiinia annettiin lähtötilanteessa 10 mg vuorokaudessa
Hoito | N | %-muutos lähtötilanteesta† | |||||||
Kokonais-C | LDL-C | Apo B | TG‡ | HDL-C | Non-HDL-C | ||||
Vaihe I Vaihto atorvastatiinista | |||||||||
10 mg | |||||||||
Etsetimibi/atorvastatiini 10 mg/10 mg | 120 | -13,5 | -22,2 | -11,3 | -6,0 | +0,6 | -18,3 | ||
Atorvastatiini | 480 | -6,4§ | -9,5§ | -6,0¶ | -3,9 | -1,1 | -8,1§ | ||
20 mg | |||||||||
Rosuvastatiini | 939 | -7,7§ | -13,0§ | -6,9# | -1,1 | +1,1 | -10,6§ | ||
10 mg | |||||||||
Vaihe II Vaihto atorvastatiinista | |||||||||
20 mg | |||||||||
Etsetimibi/atorvastatiini 10 mg/20 mg | 124 | -10,7 | -17,4 | -9,8 | -5,9 | +0,7 | -15,1 | ||
Atorvastatiini | 124 | -3,8Þ | -6,9Þ | -5,4 | -3,1 | +1,7 | -5,8Þ | ||
40 mg | |||||||||
Vaihto 10 mg rosuvastatiinista | |||||||||
Etsetimibi/atorvastatiini 10 mg/20 mg | 231 | -11,8 | -17,1 | -11,9 | -10,2 | +0,1 | -16,2 | ||
Rosuvastatiini | 205 | -4,5Þ | -7,5Þ | -4,1Þ | -3,2ß | +0,8 | -6,4Þ | ||
20 mg | |||||||||
* Annosteltu etsetimibiä ja atorvastatiinia yhdessä niin että se vastasi etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/10 mg tai 10 mg/20 mg.
† M-estimaatit (perustuvat Huberin menetelmään; 95 %:n luottamusväli ja p-arvo saatiin sovittamalla robusti regressiomalli, jossa oli hoidon ehdot ja lähtöarvot).
‡ TG:n (triglyseridiarvojen) geometriset keskimääräiset prosentuaaliset muutokset lähtötilanteesta laskettiin mallipohjaisten pienimmän neliösumman (least square, LS) keskiarvojen eksponentioinnin avulla tehdyn takaisinmuunnoksen perusteella ja ilmaistiin (geometrinen keskiarvo – 1) kerrottuna 100:lla.
§ p < 0,001 vs. etsetimibi/atorvastatiini 10 mg/10 mg
¶ p < 0,01 vs. etsetimibi/atorvastatiini 10 mg/10 mg
# p < 0,05 vs etsetimibi/atorvastatiini 10 mg/10 mg
Þ p < 0,001 vs. etsetimibi/atorvastatiini 10 mg/20 mg
ß p < 0,05 vs. etsetimibi/atorvastatiini 10 mg/20 mg
Taulukko 5 ei sisällä tietoja, joissa etsetimibi/atorvastatiini 10 mg/10 mg tai 10 mg/20 mg -annoksien vaikutuksia olisi verrattu 40 mg atorvastatiinia tai 20 mg rosuvastatiinia suurempiin annoksiin.
Plasebokontrolloidussa ”Myocardial Ischaemia Reduction with Aggressive Cholesterol-Lowering” (MIRACL) -tutkimuksessa tutkittiin potilaita, joilla oli akuutti sepelvaltimo-oireyhtymä (non‑Q‑aaltoinfarkti tai epästabiili angina). Potilaat satunnaistettiin saamaan atorvastatiinia 80 mg/vrk (n = 1 538) tai lumelääkettä (n = 1 548). Hoito aloitettiin akuuttivaiheessa sairaalaan sisäänottamisen jälkeen, ja se kesti 16 viikkoa. Atorvastatiinihoito (80 mg/vrk) pienensi yhdistetyn ensisijaisen päätetapahtuman riskiä (mistä tahansa syystä johtuva kuolema, kuolemaan johtamaton sydäninfarkti, elvytetty sydämenpysähdys tai angina pectoris, jossa näyttöä sairaalahoitoa vaativasta sydänlihaksen iskemiasta) 16 %:lla (p = 0,048). Tämä johtui pääasiassa siitä, että riski joutua uudelleen sairaalahoitoon väheni 26 % (p = 0,018) kun angina pectorikseen liittyi näyttöä sydänlihaksen iskemiasta.
Ezetimib/Atorvastatin Krka sisältää atorvastatiinia. 10 mg atorvastatiiniannoksen vaikutusta kuolemaan johtavaan ja kuolemaan johtamattomaan sepelvaltimotautiin arvioitiin plasebokontrolloidussa tutkimuksessa ”Anglo-Scandinavian Cardiac Outcomes Trial Lipid Lowering Arm” (ASCOT-LLA). Tutkimukseen osallistui 10 305 iältään 40–80-vuotiasta kohonnutta verenpainetta sairastavaa potilasta. Potilaiden kokonaiskolesteroliarvot olivat ≤ 6,5 mmol/l, ja kaikilla potilailla oli vähintään kolme sydän- ja verisuonisairauksien riskitekijää. Potilaiden seuranta-ajan mediaani oli 3,3 vuotta. 10 mg annos atorvastatiinia vähensi merkittävästi (p < 0,001) suhteellista riskiä seuraaville tekijöille: kuolemaan johtava sepelvaltimotauti ja ei-kuolemaan johtava sydäninfarkti 36 % (absoluuttinen riskin väheneminen = 1,1 %); sydän- ja verisuonitapahtumien ja revaskularisaatiotoimenpiteiden kokonaismäärä 20 % (absoluuttinen riskin väheneminen = 1,9 %); ja sepelvaltimotapahtumien kokonaismäärä 29 % (absoluuttinen riskin väheneminen = 1,4 %).
Plasebokontrolloidussa ”Collaborative Atorvastatin Diabetes Study” (CARDS) -tutkimuksessa, 10 mg:atorvastatiinin vaikutusta sydän- ja verisuonitautien päätetapahtumiin arvioitiin 2 838:lla 40-75-vuotiaalla potilaalla, joilla oli tyypin 2 diabetes, yksi tai useampi kardiovaskulaarinen riskitekijä, LDL-kolesteroli ≤ 4,1 mmol/l ja triglyseridiarvo ≤ 6,8 mmol/l. Potilaiden seuranta-ajan mediaani oli 3,9 vuotta. 10 mg atorvastatiiniannos vähensi merkittävästi (p < 0,05) seuraavia tekijöitä: suurten sydän- ja verisuonitapahtumien määrä 37 % (absoluuttinen riskin väheneminen = 3,2 %); aivohalvauksen riski 48 % (absoluuttinen riskin väheneminen = 1,3 %); ja sydäninfarktin riski 42 % (absoluuttinen riskin väheneminen = 1,9 %).
Sydän- ja verisuonitapahtumien ehkäisy
Etsetimibi/simvastatiini-yhdistelmää tutkittiin satunnaistetussa, kaksoissokkoutetussa, aktiivikontrolloidussa monikeskustutkimuksessa, johon osallistui 18 144 potilasta, jotka otettiin mukaan tutkimukseen 10 päivän kuluessa sairaalaanotosta äkillisen sepelvaltimo-oireyhtymän (joko akuutin sydäninfarktin tai epästabiilin angina pectoriksen) vuoksi. Kaikki potilaat satunnaistettiin suhteessa 1:1 saamaan joko etsetimibi/simvastatiini-yhdistelmää 10 mg/40 mg (n = 9 067) tai simvastatiinia 40 mg (n = 9 077). Seuranta-ajan mediaani oli 6,0 vuotta.
Potilaat olivat iältään keskimäärin 63,6 vuotta; 76 % oli miehiä, 84 % oli valkoihoisia ja 27 %:lla oli diabetes. Keskimääräinen LDL-kolesteroliarvo tutkimuksen mukaanottokriteerin täyttymishetkellä oli 2,1 mmol/l (80 mg/dl) potilailla, jotka käyttivät rasva-arvoja alentavaa lääkitystä (n = 6 390), ja 2,6 mmol/l (101 mg/dl) potilailla, jotka eivät käyttäneet rasva-arvoja alentavaa lääkitystä (n = 11 594). 34 % potilaista sai statiinihoitoa ennen sairaalaanottoa tutkimuksen mukaanottokriteerinä olleen akuutin sepelvaltimo-oireyhtymän vuoksi. Yhden vuoden kohdalla hoitoa jatkaneiden potilaiden keskimääräinen LDL-kolesteroliarvo oli 1,4 mmol/l (53,2 mg/dl) etsetimibi/simvastatiini-yhdistelmää saaneiden ryhmässä ja 1,8 mmol/l (69,9 mg/dl) pelkkää simvastatiinia saaneiden ryhmässä.
Ensisijainen päätetapahtuma oli yhdistelmä, joka muodostui kardiovaskulaarikuolemasta, merkittävästä sepelvaltimotapahtumasta (määriteltiin kuolemaan johtamattomaksi sydäninfarktiksi, dokumentoiduksi sairaalahoitoa vaativaksi epästabiiliksi anginaksi, joka vaati sairaalahoitoa, tai miksi tahansa sepelvaltimon revaskularisaatiotoimenpiteeksi, joka tehtiin vähintään 30 päivää hoitoryhmään satunnaistamisen jälkeen) ja kuolemaan johtamattomasta aivohalvauksesta. Tutkimus osoitti, että etsetimibi/simvastatiini-yhdistelmähoito tuotti lisähyötyä ensisijaisen yhdistelmäpäätetapahtuman eli kardiovaskulaarikuoleman, merkittävän sepelvaltimotapahtuman ja kuolemaan johtamattoman aivohalvauksen vähentämisen suhteen verrattuna pelkkään simvastatiiniin (riskin suhteellinen vähenemä 6,4 %; p = 0,016). Ensisijainen päätetapahtuma todettiin 2 572:lla 9 067 potilaasta (7 vuoden Kaplan-Meier-luku [KM] 32,72 %) etsetimibi/simvastatiini-yhdistelmää saaneiden ryhmässä ja 2 742:lla 9 077 potilaasta (7 vuoden KM-luku oli 34,67 %) pelkkää simvastatiinia saaneiden ryhmässä (ks. kuva 1 ja taulukko 6). Tämän lisähyödyn odotetaan olevan samanlainen, kun etsetimibiä annetaan samanaikaisesti atorvastatiinin kanssa. Kokonaiskuolleisuus säilyi muuttumattomana tässä korkean riskin ryhmässä.
Kokonaishyöty oli nähtävissä aivohalvausten suhteen; kuitenkin todettiin pieni ei-merkitsevä hemorragisten aivohalvausten määrän suureneminen etsetimibi/simvastatiini-yhdistelmää saaneiden ryhmässä verrattuna pelkkää simvastatiinia saaneiden ryhmään. Hemorragisen aivohalvauksen riskiä ei ole arvioitu pitkällä aikavälillä, kun etsetimibiä annetaan yhtäaikaisesti tehokkaampien statiinien kanssa.
Etsetimibi/simvastatiini-yhdistelmähoidon vaikutus oli yleensä yhdenmukainen kokonaistulosten kanssa useissa alaryhmissä, jotka perustuivat mm. sukupuoleen, ikään, etnisyyteen, aiemmin todettuun diabetekseen, lähtötilanteen rasva-arvoihin, aiempaan statiinihoitoon, aiemmin sairastettuun aivohalvaukseen ja hypertensioon.
Kuva 1. Etsetimibi/simvastatiini-yhdistelmän vaikutus ensisijaiseen yhdistelmäpäätetapahtumaan, joka oli kardiovaskulaarikuolema, merkittävä sepelvaltimotapahtuma tai kuolemaan johtamaton aivohalvaus
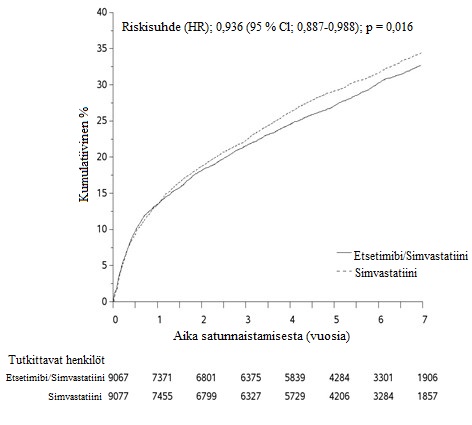
Taulukko 6. Merkittävät sydän- ja verisuonitapahtumat hoitoryhmittäin IMPROVE-IT-tutkimuksen kaikkien satunnaistettujen potilaiden osalta
Tulos | Etsetimibi/simvastatiini 10/40 mg* (N = 9 067) | Simvastatiini 40 mg† (N = 9 077) | Riskisuhde (HR) (95 % CI) | p-arvo | ||
n | K-M % ‡ | n | K-M %‡ | |||
Ensisijainen tehon yhdistelmäpäätetapahtuma | ||||||
(kardiovaskulaarikuolema, merkittävät sepelvaltimotapahtumat ja kuolemaan johtamaton aivohalvaus) | 2 572 | 32,72 % | 2 742 | 34,67 % | 0,936 (0,887; 0,988) | 0,016 |
Ensisijaisen yhdistelmäpäätetapahtuman osatekijät ja valikoidut tehon päätetapahtumat (mainittujen tapahtumien ensimmäiset ilmenemiset milloin tahansa) | ||||||
Kardiovaskulaarikuolema | 537 | 6,89 % | 538 | 6,84 % | 1,000 (0,887; 1,127) | 0,997 |
Merkittävä sepelvaltimotapahtuma: | ||||||
Kuolemaan johtamaton sydäninfarkti | 945 | 12,77 % | 1083 | 14,41 % | 0,871 (0,798; 0,950) | 0,002 |
Sairaalahoitoa vaativa epästabiili angina | 156 | 2,06 % | 148 | 1,92 % | 1,059 (0,846; 1,326) | 0,618 |
Sepelvaltimon revaskularisaatio 30 päivän jälkeen | 1 690 | 21,84 % | 1 793 | 23,36 % | 0,947 (0,886; 1,012) | 0,107 |
Kuolemaan johtamaton aivohalvaus | 245 | 3,49 % | 305 | 4,24 % | 0,802 (0,678; 0,949) | 0,010 |
* 6 %:lla potilaista annos suurennettiin etsetimibi/simvastatiini-annokseen 10/80 mg.
† 27 %:lla potilaista annos suurennettiin 80 mg:aan simvastatiinia.
‡ Kaplan-Meier-estimaatti 7 vuoden kohdalla.
Homotsygoottinen familiaalinen hyperkolesterolemia (HoFH)
12 viikon satunnaistettuun kaksoissokkotutkimukseen otettiin mukaan potilaita, joilla oli kliinisesti ja/tai genotyypin perusteella diagnosoitu HoFH. Tiedot analysoitiin potilaiden alaryhmästä (n = 36), jotka saivat lähtötilanteessa 40 mg atorvastatiinia. Atorvastatiiniannoksen nostaminen 40 mg:sta 80 mg:aan (n = 12) laski LDL‑kolesterolipitoisuutta 2 % verrattuna 40 mg atorvastatiiniannokseen lähtötilanteessa. Kun etsetimibiä ja atorvastatiinia annosteltiin yhdessä niin että annos vastasi etsetimibi/atorvastatiini-yhdistelmää (10 mg/40 mg ja 10 mg/80 mg yhdistettynä, n = 24), LDL‑kolesteroli laski 19 %:lla verrattuna 40 mg atorvastatiiniannokseen lähtötilanteessa. Potilailla, jotka saivat samanaikaisesti etsetimibiä ja atorvastatiinia annoksella, joka vastasi etsetimibi/atorvastatiini-yhdistelmää (10 mg/80 mg, n = 12), LDL-kolesterolipitoisuus pieneni 25 % verrattuna 40 mg atorvastatiiniannokseen lähtötilanteessa.
Kun 12 viikkoa kestänyt tutkimus oli päättynyt, tutkimukseen soveltuvat potilaat (n = 35), jotka saivat lähtötilanteessa 40 mg atorvastatiinia, määrättiin saamaan etsetimibiä ja atorvastatiinia annoksella, joka vastasi etsetimibi/atorvastatiini-yhdistelmää annoksella 10 mg/40 mg vielä 24 kuukauden ajan. Vähintään 4 viikon hoidon jälkeen atorvastatiiniannos voitiin kaksinkertaistaa enimmäisannokseen 80 mg. 24 kuukauden kuluttua etsetimibi/atorvastatiini (10 mg/40 mg ja 10 mg/80 mg yhdistettynä) sai aikaan LDL-kolesterolipitoisuuden laskun, joka oli yhdenmukainen 12 viikkoa kestäneen tutkimuksen kanssa.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset etsetimibi/atorvastatiini-yhdistelmän käytöstä hyperkolesterolemian ja sekamuotoisen hyperlipidemian hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Etsetimibi/atorvastatiini
Etsetimibi/atorvastatiini on osoitettu olevan biologisesti samanarvoinen etsetimibi- ja atorvastatiinitablettien vastaavien annosten samanaikaisen käytön kanssa.
Imeytyminen
Etsetimibi/atorvastatiini
Runsasrasvaisen aterian vaikutukset etsetimibin ja atorvastatiinin farmakokinetiikkaan, kun niitä annetaan etsetimibi/atorvastatiini-tabletteina, ovat verrattavissa yksittäisten tablettien vaikutuksiin.
Etsetimibi
Etsetimibi imeytyy nopeasti suun kautta annettaessa ja konjugoituu merkittävässä määrin farmakologisesti aktiiviseksi fenoliglukuronidiksi (etsetimibiglukuronidiksi). Etsetimibiglukuronidin keskimääräinen maksimipitoisuus plasmassa (Cmax) saavutetaan 1–2 tunnissa ja etsetimibin maksimipitoisuus 4–12 tunnissa. Etsetimibin absoluuttista hyötyosuutta ei voida määrittää, sillä valmiste on lähes täysin liukenematon vesipitoisiin injektionesteisiin.
Samanaikaisesti nautittu (rasvapitoinen tai rasvaton) ruoka ei vaikuta suun kautta otetun etsetimibin hyötyosuuteen käytettäessä 10 mg:n etsetimibi -tabletteja.
Atorvastatiini
Suun kautta annettu atorvastatiini imeytyy nopeasti. Enimmäispitoisuudet plasmassa (Cmax) saavutetaan 1–2 tunnin kuluessa. Imeytyneen atorvastatiinin määrä suurenee suhteessa atorvastatiiniannokseen. Kalvopäällysteisen atorvastatiinitabletin biologinen hyötyosuus on 95–99 % oraaliliuokseen verrattuna. Atorvastatiinin absoluuttinen biologinen hyötyosuus on noin 12 %, ja HMG-CoA-reduktaasin estoaktiivisuuden systeeminen hyötyosuus on noin 30 %. Pienen systeemisen hyötyosuuden katsotaan johtuvan ruoansulatuskanavan limakalvolla tapahtuvasta presysteemisestä puhdistumasta ja/tai maksan ensikierron metaboliasta.
Jakautuminen
Etsetimibi
Etsetimibi sitoutuu 99,7 %:sti ja etsetimibiglukuronidi 88–92 %:sti ihmisen plasman proteiineihin.
Atorvastatiini
Atorvastatiinin keskimääräinen jakautumistilavuus on noin 381 litraa. Atorvastatiinista ≥ 98 % sitoutuu plasman proteiineihin.
Biotransformaatio
Etsetimibi
Etsetimibi metaboloituu pääasiassa ohutsuolessa ja maksassa glukuronidikonjugaation (II vaiheen reaktio) kautta ja erittyy sen jälkeen sappeen. Kaikilla tutkituilla lajeilla on todettu hyvin vähäistä oksidatiivista metaboliaa (I vaiheen reaktio). Etsetimibi ja etsetimibiglukuronidi ovat tärkeimmät plasmassa tavatut lääkeaineesta peräisin olevat yhdisteet, ja etsetimibin osuus on 10–20 % ja etsetimibiglukuronidin osuus 80–90 % koko lääkeaineen pitoisuudesta plasmassa. Sekä etsetimibi että etsetimibiglukuronidi eliminoituvat hitaasti plasmasta, ja viitteitä merkittävästä enterohepaattisesta kiertokulusta on havaittu. Etsetimibin ja etsetimibiglukuronidin puoliintumisaika on noin 22 tuntia.
Atorvastatiini
Atorvastatiini metaboloituu sytokromi P450 3A4:n vaikutuksesta orto- ja parahydroksyloiduiksi johdannaisiksi ja erilaisiksi beetaoksidaatioyhdisteiksi. Muista metaboliareiteistä riippumatta nämä yhdisteet metaboloituvat edelleen glukuronidoitumalla. Orto- ja parahydroksyloitujen metaboliittien estovaikutus HMG-CoA-reduktaasiin in vitro on yhtä suuri kuin atorvastatiinilla. Noin 70 % kiertävästä HMG-CoA-reduktaasin estovaikutuksesta johtuu aktiivisista metaboliiteista.
Eliminaatio
Etsetimibi
Koehenkilöille suun kautta annetun 14C-etsetimibiannoksen (20 mg) jälkeen etsetimibin kokonaispitoisuus vastasi noin 93 % plasman kokonaisradioaktiivisuudesta. Ulosteeseen erittyi noin 78 % ja virtsaan noin 11 % radioaktiivisesti merkitystä annoksesta 10 päivän keräysjakson aikana. 48 tunnin kuluttua plasmassa ei ollut havaittavaa radioaktiivisuutta.
Atorvastatiini
Atorvastatiini erittyy pääasiassa sappeen hepaattisen ja/tai ekstrahepaattisen metabolian jälkeen. Tämä lääkevalmiste ei kuitenkaan näytä läpikäyvän merkittävää enterohepaattista uudelleenkiertoa. Ihmisellä atorvastatiinin keskimääräinen eliminaation puoliintumisaika plasmasta on noin 14 tuntia. Aktiivisten metaboliittien ansiosta HMG-CoA-reduktaasin estovaikutuksen puoliintumisaika on noin 20−30 tuntia.
Atorvastatiini on maksan kuljettajien, orgaanisten anionien kuljettajapolypeptidi 1B1:n (OATP1B1) ja 1B3:n (OATP1B3), substraatti. Atorvastatiinin metaboliitit ovat OATP1B1:n substraatteja. Atorvastatiini on tunnistettu myös uloskuljetusproteiinien monilääkeresistenssiproteiini 1:n (MDR1) ja rintasyövälle resistentin proteiinin (BCRP) substraatiksi, mikä saattaa rajoittaa atorvastatiinin imeytymistä suolistosta ja puhdistumaa sapen kautta.
Pediatriset potilaat
Etsetimibi
Etsetimibin farmakokinetiikka on samanlainen 6 vuotta täyttäneillä lapsilla ja aikuisilla. Alle 6‑vuotiaiden lasten ikäryhmästä ei ole farmakokineettisiä tutkimustuloksia. Kliiniset kokemukset lasten ja nuorten hoidosta kattavat HoFH-, HeFH- ja sitosterolemiapotilaat.
Atorvastatiini
8 viikkoa kestäneessä, avoimessa tutkimuksessa oli mukana 6–17-vuotiaita pediatrisia potilaita, joiden puberteettikehityksen aste oli Tannerin luokituksen mukaan I (n = 15) tai II (n = 24). Potilailla oli heterotsygoottinen familiaalinen hyperkolesterolemia ja LDL-kolesterolipitoisuus lähtötilanteessa ≥ 4 mmol/l. Tannerin luokituksen I mukaiset potilaat saivat joko 5 mg tai 10 mg atorvastatiinia kerran vuorokaudessa pureskeltavana tablettina kun taas Tannerin luokituksen II mukaiset potilaat saivat joko 10 mg tai 20 mg atorvastatiinia kerran vuorokaudessa kalvopäällysteisenä tablettina. Atorvastatiinin populaatiofarmakokineettisessä mallissa paino oli ainoa merkitsevä kovariaatti. Suun kautta annetun atorvastatiinin näennäinen puhdistuma allometrisesti painoon suhteutettuna vaikutti pediatrisilla potilailla samanlaiselta kuin aikuisilla. LDL-kolesteroli- ja kokonaiskolesterolipitoisuuksien havaittiin pienenevän yhdenmukaisesti kaikilla atorvastatiini- ja o‑hydroksiatorvastatiinialtistuksilla.
Iäkkäät
Etsetimibi
Etsetimibin kokonaispitoisuus plasmassa on iäkkäiden (≥ 65-vuotiaat) elimistössä noin kaksi kertaa suurempi kuin nuorten (18–45-vuotiaat). LDL-kolesteroliarvon lasku ja turvallisuusprofiili ovat vertailukelpoiset etsetimibiä saaneilla iäkkäillä ja nuorilla koehenkilöillä.
Atorvastatiini
Atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa ovat suuremmat terveillä iäkkäillä henkilöillä kuin nuorilla aikuisilla, kun taas lipidivaikutukset olivat heillä verrattavissa vaikutuksiin nuoremmassa potilasryhmässä.
Maksan vajaatoiminta
Etsetimibi
Etsetimibin 10 mg:n kerta-annoksen jälkeen etsetimibin kokonaispitoisuuden AUC (keskiarvo) oli lievää maksan vajaatoimintaa (Child-Pughin asteikolla 5 tai 6) sairastavilla potilailla noin 1,7‑kertainen terveisiin koehenkilöihin verrattuna. Kohtalaista maksan vajaatoimintaa (Child-Pughin asteikolla 7–9) sairastaville potilaille tehdyssä 14 päivän moniannostutkimuksessa (10 mg/vrk) etsetimibin kokonaispitoisuuden AUC (keskiarvo) oli ensimmäisenä ja neljäntenätoista tutkimuspäivänä noin 4-kertainen terveiden koehenkilöiden vastaavaan arvoon verrattuna. Annostusta ei tarvitse muuttaa lievää maksan vajaatoimintaa sairastavia potilaita hoidettaessa. Koska ei tiedetä, kuinka suurentunut etsetimibipitoisuus vaikuttaa kohtalaista tai vaikeaa (Child‑Pughin asteikolla > 9) maksan vajaatoimintaa sairastaviin potilaisiin, etsetimibiä ei suositella näille potilaille (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Atorvastatiini
Atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa suurenevat huomattavasti (Cmax noin 16-kertaiseksi ja AUC noin 11-kertaiseksi) potilailla, joilla on krooninen alkoholiperäinen maksasairaus (Child-Pugh-luokka B).
Munuaisten vajaatoiminta
Etsetimibi
Kun etsetimibiä annettiin 10 mg:n kerta-annoksena vaikeaa munuaisten vajaatoimintaa sairastaville potilaille (n = 8; kreatiniinipuhdistuman keskiarvo ≤ 30 ml/min/1,73 m2 ), etsetimibin kokonaispitoisuuden AUC (keskiarvo) oli noin 1,5-kertainen terveisiin koehenkilöihin (n = 9) verrattuna.
Lisäksi yhdessä tämän tutkimuksen potilaassa (munuaisensiirtopotilas, joka sai useita lääkkeitä, mm. siklosporiinia) etsetimibin kokonaispitoisuus nousi 12-kertaiseksi.
Atorvastatiini
Munuaissairaus ei vaikuta atorvastatiinin ja sen aktiivisten metaboliittien pitoisuuksiin plasmassa eikä niiden lipidivaikutuksiin.
Sukupuoli
Etsetimibi
Etsetimibin kokonaispitoisuus plasmassa on naisilla jonkin verran suurempi (noin 20 %) kuin miehillä. LDL-kolesteroliarvon lasku ja turvallisuusprofiili ovat etsetimibi-hoitoa saaneilla miehillä ja naisilla vertailukelpoiset.
Atorvastatiini
Naisten elimistössä atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa eroavat miesten elimistössä mitatuista pitoisuuksista: naisilla Cmax on noin 20 % suurempi ja AUC noin 10 % pienempi kuin miehillä. Näillä eroilla ei ollut kliinistä merkitystä, eivätkä ne aiheuttaneet kliinisesti merkittäviä eroja lipidivaikutuksissa miesten ja naisten välillä.
SLCO1B1-polymorfismi
Atorvastatiini
OATP1B1-sisäänkuljettajaproteiini osallistuu kaikkien HMG-CoA-reduktaasinestäjien, myös atorvastatiinin, hepaattiseen soluunottoon. Potilailla, joilla on SLCO1B1-polymorfismi, on suurentunut atorvastatiinialtistuksen riski, mikä voi johtaa suurentuneeseen rabdomyolyysin riskiin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Polymorfismi OATP1B1:tä koodaavassa geenissä (SLCO1B1 c.521CC) liittyy 2,4‑kertaiseen atorvastatiinialtistukseen (AUC) verrattuna henkilöihin, joilla ei ole tätä genotyypin muunnosta (c.521TT). Geneettisistä syistä heikentynyt atorvastatiinin soluunotto maksassa on myös mahdollista näillä potilailla. Mahdollisia tehoon liittyviä seurauksia ei tiedetä.
Prekliiniset tiedot turvallisuudesta
Etsetimibi/atorvastatiini
Yhteiskäyttötutkimuksissa rotille ja koirille annettiin etsetimibiä ja atorvastatiinia kolmen kuukauden ajan. Havaitut toksiset vaikutukset olivat pääasiassa tyypillisesti statiineihin liittyviä. Statiinin kaltaiset histopatologiset löydökset rajoittuivat maksaan. Jotkut toksisista vaikutuksista olivat voimakkaampia kuin pelkkää statiinihoitoa käytettäessä. Tämä epäillään johtuvan samanaikaisen annon jälkeisistä farmakokineettisistä ja/tai farmakodynaamisista yhteisvaikutuksista.
Etsetimibin ja atorvastatiinin samanaikainen anto tiineille rotille osoitti, että suuren annoksen (1 000/108,6 mg/kg) etsetimibi/atorvastatiini-ryhmässä ilmeni testiartikkeliin liittyvää luuston variaation (rintalastan luutumisen väheneminen) lisääntymistä. Tämä voi liittyä havaittuun sikiön painon laskuun. Tiineillä kaniineilla todettiin vähäisessä määrin luuston epämuodostumia (yhteensulautuneita rinta- ja häntänikamia sekä epäsymmetrinen rintalastavariaatio).
In vivo ja in vitro -analyysisarjoissa etsetimibillä yksinään tai yhdessä statiinien kanssa annettuna ei havaittu geenitoksisia vaikutuksia.
Etsetimibi
Etsetimibin pitkäaikaistoksisuutta selvittävissä eläinkokeissa ei havaittu toksisia vaikutuksia missään kohde-elimissä. Koirilla, jotka saivat etsetimibiä (≥ 0,03 mg/kg/vrk) neljän viikon ajan, sappirakon sapen kolesterolipitoisuus nousi 2,5–3,5-kertaiseksi. Vuoden kestäneessä tutkimuksessa, jossa koirat saivat etsetimibiä enintään 300 mg/kg/vrk, ei kuitenkaan havaittu normaalia runsaampaa sappikivien muodostumista eikä muita hepatobiliaarisia vaikutuksia. Näiden löydösten merkitystä ihmiselle ei tunneta. Etsetimibin terapeuttiseen käyttöön liittyvää sappikivien muodostumisen riskiä ei voida sulkea pois.
Etsetimibin pitkäaikaisten karsinogeenisuustutkimusten tulokset olivat negatiivisia.
Etsetimibi ei vaikuttanut uros- eikä naarasrottien fertiliteettiin, sen ei havaittu aiheuttavan epämuodostumia rotille eikä kaniineille eikä se vaikuttanut prenataaliseen eikä postnataaliseen kehitykseen. Etsetimibi läpäisi tiineiden rottien ja kaniinien istukan, kun sitä annettiin toistuvina annoksina 1 000 mg/kg/vrk.
Atorvastatiini
Neljässä in vitro -tutkimuksessa ja yhdessä in vivo -tutkimuksessa atorvastatiinilla ei osoitettu mutageenisiä eikä klastogeenisiä ominaisuuksia. Atorvastatiini ei ollut karsinogeeninen rotille, mutta hiirille annetut suuret annokset (jotka johtivat 6–11-kertaiseen altistukseen verrattuna ihmisellä todettuun altistukseen AUC0–24h, kun käytetään suurinta suositeltua annosta) aiheuttivat hepatosellulaarisia adenoomia uroksille ja hepatosellulaarisia karsinoomia naaraille.
Eläimillä tehdyt tutkimukset osoittivat, että HMG-CoA-reduktaasin estäjät saattavat vaikuttaa alkioiden tai sikiöiden kehitykseen. Rotilla, kaneilla ja koirilla atorvastatiini ei vaikuttanut niiden hedelmällisyyteen eikä se ollut teratogeeninen, mutta emolle toksisilla annoksilla todettiin sikiötoksisuutta rotilla ja kaneilla. Rotan jälkeläisten kehitys oli viivästynyttä ja syntymän jälkeinen eloonjääminen pieneni, kun emot altistuivat suurille atorvastatiiniannoksille. Rotilla on todettu, että atorvastatiini läpäisee istukan. Rotilla atorvastatiinin pitoisuudet plasmassa ovat samaa luokkaa kuin sen pitoisuudet maidossa. Ei tiedetä, erittyvätkö atorvastatiini tai sen metaboliitit ihmisen rintamaitoon.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Kalsiumkarbonaatti
Hydroksipropyyliselluloosa
Mikrokiteinen selluloosa
Laktoosimonohydraatti
Kroskarmelloosinatrium
Polysorbaatti 80
Kolloidinen vedetön piidioksidi
Magnesiumstearaatti
Natriumlauryylisulfaatti
Povidoni
Mannitoli
Natriumstearyylifumaraatti
Keltainen rautaoksidi (E172)
Kalvopäällyste
Hypromelloosi
Makrogoli (E1521)
Titaanidioksidi (E171)
Talkki (E553b)
Keltainen rautaoksidi (E172) - vain 10 mg/10 mg, 10 mg/20 mg
Punainen rautaoksidi (E172) - vain 10 mg/20 mg, 10 mg/40 mg, 10 mg/80 mg
Musta rautaoksidi (E172) - vain 10 mg/80 mg
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EZETIMIB/ATORVASTATIN KRKA tabletti, kalvopäällysteinen
10/10 mg (L:kyllä) 30 fol (10,22 €), 90 fol (20,44 €)
10/20 mg (L:kyllä) 30 fol (11,04 €), 90 fol (22,08 €)
10/40 mg (L:kyllä) 30 fol (11,85 €), 90 fol (23,70 €)
10/80 mg (L:kyllä) 30 fol (13,50 €), 90 fol (26,98 €)
PF-selosteen tieto
OPA/Al/PVC//Al -läpipainopakkaukset sisältävät 10, 20, 30, 60, 90 tai 100 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
10 mg/10 mg: haalean keltaisia, soikeita, kaksoiskuperia kalvopäällysteisiä tabletteja, joiden toisella puolella on merkintä ”A1”. Tabletin koko: noin 13 mm x 6 mm.
10 mg/20 mg: haalean oransseja, kaksoiskuperia, kapselinmuotoisia kalvopäällysteisiä tabletteja, joiden toisella puolella on merkintä ”A2”. Tabletin koko: noin 14 mm x 6 mm.
10 mg/40 mg: haalean vaaleanpunaisia, soikeita, kaksoiskuperia kalvopäällysteisiä tabletteja, joiden toisella puolella on merkintä ”A4”. Tabletin koko: noin 17 mm x 8 mm.
10 mg/80 mg: haalean violetteja, soikeita, kaksoiskuperia kalvopäällysteisiä tabletteja, joiden toisella puolella on merkintä ”A8”. Tabletin koko: noin 19 mm x 9 mm.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia hävittämisen suhteen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
EZETIMIB/ATORVASTATIN KRKA tabletti, kalvopäällysteinen
10/10 mg 30 fol, 90 fol
10/20 mg 30 fol, 90 fol
10/40 mg 30 fol, 90 fol
10/80 mg 30 fol, 90 fol
- Alempi erityiskorvaus (65 %). Krooninen sepelvaltimotauti ja krooniseen sepelvaltimotautiin liittyvä rasva-aineenvaihdunnan häiriö (206), Periytyvät rasva-aineenvaihdunnan vaikea-asteiset häiriöt (familiaalinen hyperkolesterolemia ja tyyppi III dyslipoproteinemia) (211).
- Peruskorvaus (40 %).
ATC-koodi
C10BA05
Valmisteyhteenvedon muuttamispäivämäärä
11.11.2025
Yhteystiedot
Tekniikantie 14
02150 Espoo
Suomi
020-7545330
www.krka.biz
info.fi@krka.biz
