ZONISAMIDE DESITIN oral suspension 20 mg/ml
Kvalitativ och kvantitativ sammansättning
1 ml oral suspension innehåller 20 mg zonisamid.
Hjälpämnen med känd effekt:
2 mg/ml natriummetylparahydroxibensoat (E219) och 0,5 mg/ml natriumpropylparahydroxibensoat (E217)
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per 10 ml spruta.
Innehåller spår av fruktos, glukos, sackaros och svaveldioxid [E220].
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Oral suspension
Kliniska uppgifter
Terapeutiska indikationer
Zonisamide Desitin är avsett för:
- monoterapi i behandlingen av partiella anfall, med eller utan sekundär generalisering hos vuxna med nydiagnostiserad epilepsi (se avsnitt Farmakodynamiska egenskaper);
- tilläggsbehandling i behandlingen av partiella anfall, med eller utan sekundär generalisering hos vuxna, ungdomar och barn i åldern 6 år och äldre.
Dosering och administreringssätt
Dosering
Vuxna
Upptrappning och underhållsdosering
Zonisamide Desitin kan tas som monoterapi eller läggas till redan inledd behandling hos vuxna. Dosen ska titreras på basis av klinisk effekt. Rekommenderade upptrappnings- och underhållsdoser anges i tabell 1. Vissa patienter, i synnerhet de som inte tar CYP3A4‑inducerande medel, kan dock svara på lägre doser.
Utsättande
När behandling med Zonisamide Desitin ska avbrytas ska detta ske gradvis (se avsnitt Varningar och försiktighet). I kliniska studier hos vuxna patienter har dosreduceringar på 100 mg per vecka använts med samtidig justering av läkemedelsdoser av andra antiepileptika (vid behov).
Tabell 1 Vuxna – Rekommenderad dosupptrappning och underhållsregim
| Behandlingsregim | Titreringsfas | Vanlig underhållsdos | ||
| Monoterapi– nydiagnostiserade vuxna patienter | Vecka 1 + 2 | Vecka 3 + 4 | Vecka 5 + 6 | 300 mg/dag (15 ml) en gång dagligen. Om högre dos krävs: öka i tvåveckorsintervaller i steg om 100 mg (5 ml) upp till maximalt 500 mg. (25 ml). |
| 100 mg (5 ml) en gång dagligen | 200 mg (10 ml) en gång dagligen | 300 mg (15 ml) en gång dagligen | ||
Tilläggsbehandling – med CYP3A4-inducerande medel (se avsnitt Interaktioner) | Vecka 1 | Vecka 2 | Vecka 3 till 5 | 300 till 500 mg per dag (en gång per dag eller två delade doser) = 15 – 25 ml/dag eller 2 x 7,5 – 2 x 12,5 ml/dag |
50 mg/dag (i två delade doser) = 2 x 1,25 ml/dag | 100 mg/dag (i två delade doser) = 2 x 2,5 ml/dag | Öka i veckointervaller i steg om 100 mg (5 ml) | ||
| - utan CYP3A4-inducerande medel, eller vid nedsatt njur- eller leverfunktion | Vecka 1 + 2 | Vecka 3 + 4 | Vecka 5 till 10 | 300 till 500 mg per dag (en gång per dag eller två delade doser) = 15 – 25 ml/dag eller 2 x 7,5 – 2 x 12,5 ml/dag. Vissa patienter kan svara på lägre doser. |
50 mg/dag (i två delade doser) = 2 x 1,25 ml/dag | 100 mg/dag (i två delade doser) = 2 x 2,5 ml/dag | Öka i tvåveckorsintervaller i steg upp till 100 mg (5 ml) | ||
Allmänna doseringsrekommendationer för Zonisamide Desitin i särskilda patientpopulationer
Pediatrisk population (i åldern 6 år och äldre)
Upptrappning och underhållsdosering
Zonisamide Desitin måste läggas till i den befintliga behandlingen för pediatriska patienter i åldern 6 år och äldre. Dosen ska titreras på basis av klinisk effekt. Rekommenderade upptrappnings- och underhållsdoser anges i tabell 2. Vissa patienter, i synnerhet de som inte tar CYP3A4-inducerande medel, kan dock svara på lägre doser.
Läkare ska uppmärksamma pediatriska patienter och deras föräldrar/vårdare på rutan Patientvarning (i bipacksedeln) om förebyggande av värmeslag (se avsnitt Varningar och försiktighet: Pediatrisk population).
Tabell 2 Pediatrisk population (i åldern 6 år och äldre) – rekommenderad regim för dosupptrappning och underhållsdosering
| Behandlingsregim | Titreringsfas | Vanlig underhållsdos | ||
| Tilläggsbehandling | Vecka 1 | Vecka 2 till 8 | Patienter som väger 20 till 55 kga | Patienter som väger > 55 kg |
- med CYP3A4- inducerande medel (se avsnitt Interaktioner) | 1 mg/kg/dag (en gång dagligen) = 0,05 ml/kg/dag | Öka med veckointervall i steg om 1 mg/kg = 0,05 ml/kg | 6 till 8 mg/kg/dag (en gång dagligen) = 0,3 – 0,4 ml/kg/dag | 300‑500 mg/dag (en gång dagligen) = 15 – 25 ml/dag |
| Vecka 1 + 2 | Vecka ≥ 3 | |||
| – utan CYP3A4-inducerande medel | 1 mg/kg/dag (en gång dagligen) = 0,05 ml/kg/dag | Öka med tvåveckorsintervall i steg om 1 mg/kg = 0,05 ml/kg | 6 till 8 mg/kg/dag (en gång dagligen) = 0,3 – 0,4 ml/kg/dag | 300‑500 mg/dag (en gång dagligen) = 15 – 25 ml/dag |
Observera:
a. För att säkerställa att en terapeutisk dos upprätthålls ska barnets vikt kontrolleras och dosen ska granskas i takt med att vikten förändras upp till en vikt på 55 kg. Dosregimen är 6‑8 mg/kg/dag upp till en dos på högst 500 mg/dag.
Tabell 3 Dosrekommendation för barn från 6 år och uppåt med en kroppsvikt mellan 20 och 55 kg
| Kroppsvikt | Startdos | Underhållsdos |
| 20 kg | 20 mg/dag = 1 ml/dag | 120 – 160 mg/dag = 6 – 8 ml/dag |
| 25 kg | 25 mg/dag = 1,25 ml/dag | 150 – 200 mg/dag = 7,5 – 10 ml/dag |
| 30 kg | 30 mg/dag = 1,5 ml/dag | 180 – 240 mg/dag = 9 – 12 ml/dag |
| 35 kg | 35 mg/dag = 1,75 ml/dag | 210 – 280 mg/dag = 10,5 – 14 ml/dag |
| 40 kg | 40 mg/dag = 2 ml/dag | 240 – 320 mg/dag = 12 – 16 ml/dag |
| 45 kg | 45 mg/dag = 2,25 ml/dag | 270 – 360 mg/dag = 13,5 – 18 ml/dag |
| 50 kg | 50 mg/dag = 2,5 ml/dag | 300 – 400 mg/dag = 15 – 20 ml/dag |
| 55 kg | 55 mg/dag = 2,75 ml/dag | 330 – 440 mg/dag = 16,5 – 22 ml/dag |
Säkerhet och effekt för Zonisamide Desitin för barn under 6 år eller barn som väger under 20 kg har ännu inte fastställts.
Det finns begränsade data från kliniska studier för patienter som väger under 20 kg. Därför ska barn i åldern 6 år och äldre men som väger under 20 kg behandlas med försiktighet.
Utsättande
När behandling med Zonisamide Desitin ska avbrytas ska detta ske gradvis (se avsnitt Varningar och försiktighet). I kliniska studier med pediatriska patienter har nedtrappning genomförts genom veckovisa dossänkningar i steg om cirka 2 mg/kg (dvs. i enlighet med schemat i tabell 4).
Tabell 4 Pediatrisk population (i åldern 6 år och äldre) – rekommenderat nedtrappningsschema
| Vikt | Sänkning med veckointervall i steg om: |
| 20‑28 kg | 25 till 50 mg/dag* = 1,25 – 2,5 ml/dag |
| 29‑41 kg | 50 till 75 mg/dag* = 2,5 – 3,75 ml/dag |
| 42‑55 kg | 100 mg/dag* = 5 ml/dag |
| > 55 kg | 100 mg/dag* = 5 ml/dag |
Observera:
* Alla doser ges en gång dagligen.
Äldre
Försiktighet bör iakttas vid inledande av behandling av äldre patienter eftersom informationen om användning av Zonisamide Desitin till dessa patienter är begränsad. Ordinerande läkare ska även beakta Zonisamide Desitins säkerhetsprofil (se avsnitt Biverkningar).
Patienter med nedsatt njurfunktion
Försiktighet måste iakttas vid behandling av patienter med nedsatt njurfunktion, då det finns begränsad information om användning till dessa patienter och det kan krävas en långsammare titrering av Zonisamide Desitin. Eftersom zonisamid och dess metaboliter utsöndras via njurarna ska behandlingen avbrytas hos patienter som utvecklar akut njursvikt eller när en kliniskt signifikant ihållande ökning av serumkreatinin observeras.
Hos försökspersoner med nedsatt njurfunktion, var njurclearance vid enkeldoser av zonisamid positivt korrelerade till kreatininclearance. AUC i plasma för zonisamid ökade med 35 % hos försökspersoner med kreatininclearance < 20 ml/min.
Patienter med nedsatt leverfunktion
Användning till patienter med nedsatt leverfunktion har inte studerats. Användning till patienter med svår leverfunktionsnedsättning rekommenderas därför inte. Försiktighet måste iakttas vid behandling av patienter med lindrig till måttlig leverfunktionsnedsättning, och det kan krävas en långsammare titrering av Zonisamide Desitin.
Administreringssätt
Zonisamide Desitin är avsedd för oral användning.
Innan du tar Zonisamide Desitin måste flaskan skakas kraftigt (i minst 30 sekunder) och dosen beredas omedelbart efteråt (för att undvika sedimentering). Den orala dosen kan sväljas direkt från oralsprutan eller spädas ut i ett glas vatten eller apelsinjuice. Kolsyrade drycker som mineralvatten ska inte tas tillsammans med suspensionen.
En graderad 10 ml oralspruta med tillhörande adapter och bruksanvisning i bipacksedeln medföljer Zonisamide Desitin.
Zonisamide Desitin kan också administreras via en sond, som måste sköljas tre gånger omedelbart efter administrering med minst 5 ml vatten i varje sköljning. Om denna administreringsmetod används ska suspensionen beredas enligt beskrivningen ovan för oral användning omedelbart före administrering.
Effekten av födointag
Zonisamide Desitin kan tas med eller utan föda (se avsnitt Farmakokinetiska egenskaper). Zonisamide Desitin kan blandas med yoghurt för att maskera dess smak.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller mot sulfonamider.
Varningar och försiktighet
Oförklarliga hudutslag
Svåra hudutslag, inklusive fall av Stevens-Johnsons syndrom, förekommer i samband med behandling med Zonisamide Desitin.
Utsättande av Zonisamide Desitin måste övervägas för patienter som utvecklar annars oförklarliga hudutslag. Alla patienter hos vilka hudutslag uppstår när de tar Zonisamide Desitin måste noggrant övervakas. Särskild försiktighet måste iakttas med avseende på patienter som samtidigt behandlas med andra antiepileptiska medel som också kan orsaka hudutslag.
Utsättningsanfall
I enlighet med aktuell klinisk praxis måste utsättande av Zonisamide Desitin till patienter med epilepsi utföras med gradvis reducering av dosen för att minska risken för anfall under utsättandeperioden.
Uppgifter saknas avseende utsättande av andra samtidigt administrerade antiepileptika, när kontroll över anfallen har uppnåtts med Zonisamide Desitin som tilläggsmedicinering, för att uppnå monoterapi. Utsättande av de övriga antiepileptiska läkemedlen måste därför ske med försiktighet.
Reaktioner på sulfonamider
Zonisamide Desitin är ett benzisoxazolderivat som innehåller en sulfonamidgrupp. Bland allvarliga, immunrelaterade biverkningar som förknippas med läkemedel som innehåller en sulfonamidgrupp märks hudutslag, allergiska reaktioner och svårare hematologiska störningar såsom aplastisk anemi, som i mycket sällsynta fall kan vara fatala.
Fall av agranulocytos, trombocytopeni, leukopeni, aplastisk anemi, pancytopeni och leukocytos har rapporterats. Det finns inte tillräckligt med information för att ett eventuellt samband mellan dos och behandlingstid och dessa biverkningar skall kunna fastställas.
Akut myopi och sekundärt trångvinkelglaukom
Ett syndrom med akut myopi i samband med sekundärt trångvinkelglaukom har rapporterats hos vuxna och pediatriska patienter som får zonisamid. Symtomen består av akut minskad synskärpa och/eller ögonsmärta. Oftalmologiska fynd kan omfatta myopi, grund främre ögonkammare, okulär hyperemi (rodnad) och ökat intraokulärt tryck. Detta syndrom kan förknippas med supraciliär utgjutning som resulterar i att lins och iris förskjuts framåt med sekundärt trångvinkelglaukom som följd. Symtomen kan uppträda inom timmar eller veckor efter påbörjad behandling. Behandling omfattar utsättande av zonisamid, så snart som möjligt enligt den behandlande läkarens bedömning, och lämpliga åtgärder för att minska intraokulärt tryck. Förhöjt intraokulärt tryck av någon orsak, om det lämnas obehandlat, kan leda till allvarliga följdtillstånd inklusive permanent synförlust. Försiktighet ska iakttas vid behandling med zonisamid till patienter med tidigare ögonsjukdomar.
Suicidtankar och självmordsbeteende
Suicidtankar och självmordsbeteende har rapporterats hos patienter som behandlas med antiepileptika för flera indikationer. En metaanalys av randomiserade placebokontrollerade studier med antiepileptika har också visat en liten ökad risk för suicidtankar och självmordsbeteende. Mekanismen för denna risk är inte känd och tillgängliga data utesluter inte en eventuell ökad risk för Zonisamide Desitin.
Därför ska patienter övervakas för tecken på suicidtankar och självmordsbeteende och lämplig behandling bör övervägas. Patienter (och deras vårdgivare) bör rådas till att uppsöka medicinsk rådgivning om tecken på suicidtankar och självmordsbeteende uppstår.
Njursten
Vissa patienter, särskilt sådana med benägenhet för njursten, kan ha ökad risk för bildning av njursten och tillhörande tecken och symtom såsom njurkolik, njursmärta eller flanksmärta. Njursten kan leda till kroniska njurskador. I riskfaktorerna för njursten ingår tidigare stenbildning, eller njursten och hyperkalciuri i familjehistoriken. Ingen av dessa riskfaktorer kan på ett pålitligt sätt förutsäga stenbildning under behandling med zonisamid. Dessutom kan risken vara större för patienter som tar andra läkemedel förknippade med njursten. Ökat vätskeintag och urinavgång kan bidra till att reducera risken för stenbildning i synnerhet hos patienter med predisponerande riskfaktorer.
Metabolisk acidos
Det finns ett samband mellan hyperkloremisk, metabolisk acidos utan anjongap (dvs. minskat serumbikarbonat under det normala referensintervallet utan kronisk respiratorisk alkalos) och behandling med Zonisamide Desitin. Denna metaboliska acidos orsakas av bikarbonatförlust via njurarna på grund av zonisamids hämmande effekt på karbanhydras. En sådan elektrolytisk obalans har setts vid användning av Zonisamide Desitin i placebokontrollerade kliniska prövningar och efter godkännandet för försäljning. I allmänhet inträffar zonisamid‑inducerad metabolisk acidos tidigt i behandlingen, även om fall kan inträffa när som helst under behandlingen. Vanligtvis minskar bikarbonatet med små till måttliga mängder (genomsnittlig minskning omkring 3,5 mEq/l vid dagliga doser på 300 mg hos vuxna); i sällsynta fall kan patienter drabbas av allvarligare minskningar. Sjukdomar eller behandlingar som predisponerar för acidos (t ex njursjukdomar, svåra respiratoriska sjukdomar, status epilepticus, diarré, kirurgi, ketogen diet eller behandling med vissa läkemedel) kan förstärka den bikarbonatsänkande effekten av zonisamid.
Risken för zonisamidinducerad metabolisk acidos verkar vara vanligare och allvarligare hos yngre patienter. Lämplig utvärdering och övervakning av serumbikarbonatnivåer bör utföras hos patienter som tar zonisamid och som har underliggande sjukdomstillstånd som kan komma att öka risken för acidos, hos patienter med ökad risk för oönskade konsekvenser av metabolisk acidos och hos patienter med symtom som tyder på metabolisk acidos. Om metabolisk acidos utvecklas och kvarstår bör man överväga att reducera dosen eller avbryta Zonisamide Desitin-behandlingen (genom nedtrappning eller minskad terapeutisk dos) eftersom osteopeni kan utvecklas.
Om beslut fattas att låta patienten fortsätta med Zonisamide Desitin trots kvarstående acidos bör alkalibehandling övervägas.
Metabolisk acidos kan potentiellt leda till hyperammonemi, vilket har rapporterats med eller utan encefalopati under zonisamidbehandling. Risken för hyperammonemi kan vara förhöjd för patienter som samtidigt tar andra läkemedel som kan orsaka hyperammonemi (till exempel valproat) eller som har en underliggande ureacykelrubbning eller nedsatt mitokondrisk aktivitet i levern. För patienter som utvecklar oförklarlig letargi eller förändrad mental status under behandling med zonisamid rekommenderas att de genomgår undersökning avseende hyperammonemisk encefalopati och mätning av ammoniaknivåer.
Zonisamide Desitin ska användas med försiktighet till vuxna patienter som samtidigt behandlas med karbanhydrashämmare såsom topiramat eller acetazolamid. Eventuell farmakodynamisk interaktion kan inte uteslutas eftersom adekvata uppgifter saknas (se även avsnitt Varningar och försiktighet Pediatrisk population och avsnitt Interaktioner).
Värmeslag
Fall av minskad svettning och förhöjd kroppstemperatur har rapporterats huvudsakligen hos barn (se den fullständiga varningen i avsnitt Varningar och försiktighet Pediatrisk population). Försiktighet måste iakttas för vuxna när Zonisamide Desitin förskrivs tillsammans med andra läkemedel som gör patienterna mer mottagliga för värmerelaterade besvär. Sådana läkemedel inkluderar karbanhydrashämmare och läkemedel med antikolinerg verkan (se även avsnitt Varningar och försiktighet Pediatrisk population).
Pankreatit
För patienter som behandlas med Zonisamide Desitin och som utvecklar kliniska tecken och symtom på pankreatit rekommenderas övervakning av pankreaslipas och amylas. Vid tydlig pankreatit och i brist på annan uppenbar orsak rekommenderas att utsättande av Zonisamide Desitin övervägs och lämplig behandling inleds.
Rabdomyolys
För patienter, som tar Zonisamide Desitin och som utvecklar svår muskelsmärta och/eller -svaghet med eller utan feber, rekommenderas utvärdering av markörer för muskelskada inklusive kreatinkinas- och aldolashalter i serum. Om halterna är förhöjda och i brist på annan uppenbar orsak såsom trauma eller grand mal-anfall, rekommenderas att utsättande av Zonisamide Desitin övervägs och lämplig behandling inleds.
Fertila kvinnor
Fertila kvinnor ska använda effektiv preventivmetod under behandlingen med Zonisamide Desitin och under en månad efter avslutad behandling (se avsnitt Fertilitet, graviditet och amning). Zonisamide Desitin ska inte användas av fertila kvinnor som inte använder effektivt preventivmedel såvida det inte är absolut nödvändigt, och endast om de potentiella fördelarna kan anses väga upp risken för fostret. Fertila kvinnor som behandlas med zonisamid skall erhålla medicinska råd av specialist. Kvinnan ska informeras fullt ut om och förstå de möjliga effekterna av Zonisamide Desitin på fostret, och dessa risker ska diskuteras med patienten i förhållande till fördelarna innan behandlingen inleds. Innan behandling med Zonisamide Desitin inleds hos en fertil kvinna ska graviditetstest övervägas.
Kvinnor som planerar att bli gravida ska rådas av specialister för att ompröva behandlingen med Zonisamide Desitin och överväga andra behandlingsalternativ före befruktning och innan preventivmedel sätts ut. Fertila kvinnor ska rådas att omedelbart kontakta läkare om de blir gravida eller tror att de kan vara gravida och tar Zonisamide Desitin. Läkare som behandlar patienter med Zonisamide Desitin ska säkerställa att patienterna är fullständigt informerade om behovet av att lämplig effektiv preventivmetod tillämpas och ska kliniskt bedöma huruvida orala preventivmedel, eller doserna för komponenterna i orala preventivmedel, är tillräckliga baserat på den enskilda patientens kliniska situation.
Kroppsvikt
Zonisamide Desitin kan orsaka viktminskning. Kosttillskott eller ökat födointag kan tas i beaktande om patienten går ned i vikt eller är underviktig under behandlingen. Om betydande, ej önskvärd viktminskning inträffar skall utsättande av Zonisamide Desitin övervägas. Viktminskning är potentiellt allvarligare hos barn (se avsnitt Varningar och försiktighet Pediatrisk population).
Pediatrisk population
Varningarna och försiktighetsåtgärderna som nämns ovan gäller även adolescenta och pediatriska patienter. Varningarna och försiktighetsåtgärderna som nämns nedan är mer relevanta för pediatriska och adolescenta patienter.
Värmeslag och dehydrering
Förebyggande av överhettning och uttorkning hos barn
Zonisamide Desitin kan göra att barn svettas mindre och blir överhettade och om barnet inte behandlas kan detta leda till hjärnskador och dödsfall. Barn är mest utsatta, särskilt i varmt väder.
När ett barn tar Zonisamide Desitin:
- Barnet måste hållas svalt, särskilt i varmt väder
- Barnet måste undvika kraftig ansträngning, särskilt i varmt väder
- Barnet måste dricka mycket kallt vatten
- Barnet får inte ta något av dessa läkemedel: karbanhydrashämmare (som topiramat och acetazolamid) och antikolinerga medel (som klomipramin, hydroxyzin, difenhydramin, haloperidol, imipramin och oxybutynin).
OM NÅGOT AV FÖLJANDE INTRÄFFAR BEHÖVER BARNET AKUT LÄKARVÅRD:
Huden känns mycket varm med liten eller ingen svettning, eller barnet blir förvirrat eller får muskelkramper, eller barnets hjärtslag eller andning blir mycket snabba.
- Ta barnet till en sval, skuggig plats
- Håll barnets hud sval med hjälp av vatten
- Ge barnet kallt vatten att dricka
Fall av minskad svettning och förhöjd kroppstemperatur har rapporterats huvudsakligen hos barn. Värmeslag som krävde sjukhusbehandling har diagnostiserats i några fall. Värmeslag som krävde sjukhusvård och ledde till dödsfall har rapporterats. De flesta inträffade under perioder med varmt väder. Läkare bör tala med patienter och deras vårdare om det potentiella allvaret med värmeslag, i vilka situationer det kan uppkomma samt vilka åtgärder som bör vidtas vid tecken och symtom. Patienter eller deras vårdare måste instrueras att upprätthålla hydrering och undvika exponering för alltför höga temperaturer och påfrestande fysisk ansträngning, beroende på patientens tillstånd. Ordinerande läkare bör uppmärksamma pediatriska patienter och deras föräldrar/vårdare på de råd i bipacksedeln om förebyggande av värmeslag och överhettning hos barn som tillhandahålls. Om tecken eller symtom på dehydrering, oligohydros eller förhöjd kroppstemperatur uppstår bör man överväga utsättning av Zonisamide Desitin.
Zonisamide Desitin ska inte användas som samtidig medicinering till pediatriska patienter med andra läkemedel som gör patienterna mer mottagliga för värmerelaterade besvär. Sådana läkemedel inkluderar karbanhydrashämmare och läkemedel med antikolinerg verkan.
Kroppsvikt
Viktminskning som leder till ett försämrat allmäntillstånd och underlåtenhet att ta antiepileptika har relaterats till ett fall med dödlig utgång (se avsnitt Biverkningar). Zonisamide Desitin rekommenderas inte till pediatriska patienter som är underviktiga (definition i enlighet med WHO:s åldersjusterade BMI-kategorier) eller har nedsatt aptit.
Incidensen av viktminskning är konsekvent genom alla åldersgrupper (se avsnitt Biverkningar); med tanke på det potentiella allvaret med viktnedgång hos barn bör dock vikten övervakas i denna grupp. Kosttillskott eller ökat matintag bör övervägas om patienten inte lyckas öka i vikt i enlighet med tillväxttabeller, i annat fall bör Zonisamide Desitin sättas ut.
Det finns begränsade data från kliniska studier för patienter som väger under 20 kg. Därför ska barn i åldern 6 år och äldre med en kroppsvikt på under 20 kg behandlas med försiktighet. Effekten på lång sikt av viktnedgång i den pediatriska populationen när det gäller tillväxt och utveckling är okänd.
Metabolisk acidos
Risken för zonisamidinducerad metabolisk acidos förefaller vara mer frekvent och allvarlig hos pediatriska och adolescenta patienter. Lämplig utvärdering och övervakning av bikarbonatnivåerna i serum bör utföras i denna grupp (se den fullständiga varningen i avsnitt Varningar och försiktighet – Metabolisk acidos; se avsnitt Biverkningar för incidens av låg bikarbonatnivå). Effekten på lång sikt av låga bikarbonatnivåer på tillväxt och utveckling är okänd.
Zonisamide Desitin ska inte användas till barn som samtidigt behandlas med andra karbanhydrashämmare såsom topiramat eller acetazolamid (se avsnitt Interaktioner).
Njursten
Njurstenar har uppkommit hos pediatriska patienter (se den fullständiga varningen i avsnitt Varningar och försiktighet Njurstenar). Vissa patienter, särskilt sådana med benägenhet för njursten, kan ha ökad risk för bildning av njursten och tillhörande tecken och symtom såsom njurkolik, njursmärta eller flanksmärta. Njursten kan leda till kroniska njurskador. I riskfaktorerna för njursten ingår tidigare stenbildning, eller njursten och hyperkalciuri i familjehistoriken. Ingen av dessa riskfaktorer kan på ett pålitligt sätt förutsäga stenbildning under behandling med zonisamid.
Ökat vätskeintag och urinavgång kan bidra till att reducera risken för stenbildning i synnerhet hos patienter med predisponerande riskfaktorer. Renalt ultraljud bör utföras enligt läkarens bedömning. Om njurstenar upptäcks ska Zonisamide Desitin sättas ut.
Leverdysfunktion
Förhöjda nivåer av hepatobiliära parametrar som alaninaminotransferas (ALAT), aspartataminotransferas (ASAT), gammaglutamyltransferas (GGT) och bilirubin har uppkommit hos pediatriska och adolescenta patienter, utan något konsekvent mönster i observationerna av värden ovanför den övre normalgränsen. Icke desto mindre, om leverpåverkan misstänks, bör leverfunktionen utvärderas och utsättning av Zonisamide Desitin övervägas.
Kognition
Kognitiv nedsättning hos patienter med epilepsi har associerats med den underliggande patologin och/eller administreringen av antiepileptika. I en placebokontrollerad zonisamidstudie som utfördes på pediatriska och adolescenta patienter var andelen patienter med nedsatt kognition numeriskt större i zonisamidgruppen jämfört med placebogruppen.
Information om hjälpämnen
Läkemedlet innehåller natriummetylparahydroxibenzoat och natriumpropylparahydroxibensoat som kan orsaka allergiska reaktioner (eventuellt fördröjda).
Läkemedlet innehåller svaveldioxid (E220) som i sällsynta fall kan orsaka allvarliga överkänslighetsreaktioner och bronkospasm.
Läkemedlet innehåller glukos och sackaros. Patienter med sällsynta ärftliga problem med fruktosintolerans, glukos-galaktosmalabsorption eller sukras-isomaltasbrist bör inte ta detta läkemedel. Glukos och sackaros kan vara skadligt för tänderna.
Läkemedlet innehåller fruktos. Den additiva effekten av samtidigt administrerade produkter som innehåller fruktos (eller sorbitol) och av fruktos (eller sorbitol) i kosten bör beaktas.
Fruktos kan vara skadligt för tänderna.
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per doseringsspruta (10 ml), det vill säga är i princip "natriumfritt".
Interaktioner
Zonisamide Desitins inverkan på cytokrom P450-enzymer
In vitro-studier med användning av levermikrosomer från människa visar ingen eller ringa (< 25 %) inhibition av cytokrom P450-isozymer 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 och 3A4 vid zonisamidnivåer som är ca två eller fler gånger så stora som kliniskt relevanta, obundna serumkoncentrationer. Således förväntas inte Zonisamide Desitin påverka farmakokinetiken hos andra läkemedel via cytokrom P450‑medierade mekanismer vilket har visats in vivo för karbamazepin, fenytoin, etinylestradiol och desipramin.
Zonisamide Desitins potential att påverka andra läkemedel
Antiepileptika
Upprepad dosering med Zonisamide Desitin orsakade inga kliniskt relevanta, farmakokinetiska effekter på karbamazepin, lamotrigin, fenytoin och natriumvalproat hos patienter med epilepsi.
P-piller
Vid kliniska studier med friska försökspersoner påverkades inte serumhalterna av etinylestradiol eller noretisteron i ett kombinerat p-piller efter upprepad dosering med Zonisamide Desitin.
Karbanhydrashämmare
Zonisamide Desitin ska användas med försiktighet till vuxna patienter som samtidigt behandlas med karbanhydrashämmare såsom topiramat och acetazolamid, eftersom det inte finns tillräckliga uppgifter för att utesluta eventuell farmakodynamisk interaktion (se avsnitt Varningar och försiktighet).
Zonisamide Desitin ska inte användas till barn som samtidigt behandlas med andra karbanhydrashämmare såsom topiramat eller acetazolamid (se avsnitt Varningar och försiktighet).
P-gp-substrat
En in vitro-studie visar att zonisamid är en svag hämmare av P-gp (MDR1) med IC50 om 267 μmol/l och teoretiskt har zonisamid potential att påverka farmakokinetiken hos substanser som är P-gp-substrat. Försiktighet bör iakttas vid inledande eller utsättande av zonisamidbehandling eller ändring av zonisamiddosen till patienter vilka även behandlas med läkemedel som är P-gp-substrat (t.ex. digoxin, kinidin).
Potentiella läkemedelsinteraktioner som påverkar Zonisamide Desitin
Samtidig administrering av lamotrigin hade ingen märkbar effekt på zonisamids farmakokinetik vid kliniska studier. Användning av Zonisamide Desitin samtidigt med andra läkemedel som kan ge upphov till urolithiasis kan öka risken för njursten. Samtidig administrering av sådana läkemedel skall därför undvikas.
Zonisamid metaboliseras delvis genom CYP3A4 (reduktiv klyvning) och även genom N-acetyl-transferaser och konjugering med glukuronsyra. Ämnen som kan inducera eller hämma dessa enzymer kan därför inverka på zonisamids farmakokinetik:
- Enzyminducering: Exponeringen för zonisamid är lägre hos patienter med epilepsi som behandlas med CYP3A4‑inducerande medel såsom fenytoin, karbamazepin och fenobarbiton. Det är osannolikt att detta har klinisk betydelse när Zonisamide Desitin läggs till en befintlig behandling. Förändringar i zonisamidkoncentrationen kan emellertid inträffa om ett samtidigt administrerat CYP3A4‑inducerande antiepileptikum eller annat läkemedel utsätts, dosjusteras eller introduceras. En dosjustering av Zonisamide Desitin kan eventuellt vara nödvändig. Rifampicin är en kraftig CYP3A4-inducerare. Om samtidig administrering med rifampicin är nödvändig ska patienten noggrant övervakas och dosen Zonisamide Desitin och andra CYP3A4-substrat justeras efter behov.
CYP3A4-inhibitering: Enligt kliniska uppgifter tycks inte kända, specifika och icke-specifika CYP3A4-hämmare ha någon kliniskt relevant effekt på zonisamids farmakokinetiska exponeringsparametrar. Steady-state-tillförsel av antingen ketokonazol (400 mg/dag) eller cimetidin (1200 mg/dag) hade inga kliniskt relevanta effekter på farmakokinetiken hos zonisamid efter engångsdos till friska försökspersoner. Det bör därför inte vara nödvändigt att justera Zonisamide Desitindosen när medlet administreras tillsammans med kända CYP3A4-hämmare.
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Fertilitet, graviditet och amning
Fertila kvinnor
Fertila kvinnor ska använda effektiv preventivmetod under behandlingen med Zonisamide Desitin och under en månad efter avslutad behandling.
Zonisamide Desitin ska inte användas av fertila kvinnor som inte använder effektivt preventivmedel såvida det inte är absolut nödvändigt, och endast om de potentiella fördelarna kan anses väga upp risken för fostret. Fertila kvinnor som behandlas med zonisamid skall erhålla medicinska råd av specialist. Kvinnan ska informeras fullt ut om och förstå de möjliga effekterna av Zonisamide Desitin på fostret, och dessa risker ska diskuteras med patienten i förhållande till fördelarna innan behandlingen inleds. Graviditetstest på kvinnor i fertil ålder ska övervägas innan behandling med zonisamid påbörjas. Kvinnor som planerar att bli gravida ska rådas av specialister för att ompröva behandlingen med zonisamid och överväga andra behandlingsalternativ före befruktning och innan preventivmedel sätts ut.
På samma sätt som gäller för alla antiepileptika ska man undvika att zonisamid avbryts plötsligt, eftersom detta kan leda till anfall med allvarliga följder för både modern och fostret. Risken för missbildning ökar med 2 till 3 gånger hos barn till kvinnor som behandlats med antiepileptikum. De vanligaste rapporterade missbildningarna är läppspalt, kardiovaskulära missbildningar och neuralrörsdefekter. Behandling med flera antiepileptika kan vara förenad med högre risk för medfödda missbildningar än vid monoterapi.
Graviditet
Det finns begränsad mängd data från användningen av Zonisamide Desitin hos gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter). Hos människa är risken för större medfödda missbildningar och utvecklingsneurologiska störningar okänd.
Data från registerstudie tyder på en ökning i proportionen av spädbarn som föds med låg födelsevikt (low birth weight, LBW), för tidigt födda eller små för tiden (small for gestational age, SGA). Dessa ökningar är från ca 5 % till 8 % för LBW, från ca 8 % till 10 % för tidigt födda och ca 7 % till 12 % för SGA, allt jämfört med mödrar som behandlats med lamotrigin som monoterapi.
Zonisamide Desitin ska inte användas under graviditet såvida det inte är absolut nödvändigt, och endast om de potentiella fördelarna kan anses väga upp risken för fostret. Om Zonisamide Desitin ordineras under graviditet ska patienter till fullo informeras om den potentiella faran för fostret och användning av minimal effektiv dos tillråds tillsammans med noggrann övervakning.
Amning
Zonisamid utsöndras i bröstmjölk och koncentrationen i bröstmjölk liknar den i moderns plasma. Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med Zonisamide Desitin. Eftersom zonisamid finns kvar i kroppen en längre tid får amning inte återupptas förrän en månad efter att behandlingen med Zonisamide Desitin har avslutats.
Fertilitet
Det finns inga kliniska data om effekterna av zonisamid på fertilitet hos människa. Studier på djur har visat förändringar i fertilitetsparametrar (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Inga studier har utförts avseende effekten på förmågan att framföra fordon och använda maskiner. Zonisamide Desitin kan emellertid orsaka sömnighet eller koncentrationssvårigheter hos vissa patienter, särskilt vid början av behandlingen och efter ökning av dosen. Patienter ska därför rådas att iaktta försiktighet under aktiviteter som kräver särskild uppmärksamhet såsom bilkörning och användning av maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Vid kliniska prövningar har zonisamid administrerats till över 1 200 patienter av vilka fler än 400 behandlades med zonisamid i minst ett år. Ytterligare erfarenhet av behandling med zonisamid har erhållits vid användning i Japan sedan 1989 och i USA sedan år 2000.
Det bör observeras att Zonisamide Desitin är ett benzisoxazolderivat som innehåller en sulfonamidgrupp. Bland allvarliga, immunrelaterade biverkningar som förknippas med läkemedel som innehåller en sulfonamidgrupp märks hudutslag, allergiska reaktioner och svårare hematologiska störningar såsom aplastisk anemi, som i mycket sällsynta fall kan vara fatala (se avsnitt Varningar och försiktighet).
De vanligaste biverkningarna vid kontrollerade studier av tilläggsbehandling var sömnighet, yrsel och anorexi. De vanligaste biverkningarna i en randomiserad, kontrollerad monoterapistudie som jämförde zonisamid med karbamazepin med förlängd frisättning var sänkt bikarbonat, minskad aptit och viktnedgång. Förekomsten av påtagligt onormalt låg serumbikarbonatnivå (en sänkning till under 17 mEq/l och med över 5 mEq/l) var 3,8 %. Förekomsten av tydlig viktminskning med 20 % eller mer var 0,7 %
Lista i tabellform med biverkningar
Biverkningar som har förknippats med Zonisamide Desitin och som har observerats vid kliniska studier och kontroll efter marknadsföring anges i nedanstående tabell. Biverkningarnas frekvens anges på följande sätt:
Mycket vanliga ≥ 1/10
Vanliga ≥ 1/100 to < 1/10
Mindre vanliga ≥ 1/1,000 to < 1/100
Sällsynta ≥ 1/10,000 to < 1/1,000
Mycket sällsynta < 1/10,000
Ingen känd frekvens Kan inte beräknas från tillgängliga data
Tabell 5 Biverkningar som förknippas med zonisamid och som har observerats vid tilläggsbehandling vid kliniska studier och kontroll efter marknadsföring
Klassificering av organsystem (MedDRA- terminologi) | Mycket vanliga | Vanliga | Mindre vanliga | Mycket sällsynta |
| Infektioner och infestationer | Pneumoni Urinvägsinfektion | |||
| Blodet och lymfsystemet | Ekkymos | Agranulocytos Aplastisk anemi Leukocytos Leukopeni Lymfadenopati Pancytopeni Trombocytopeni | ||
| Immunsystemet | Överkänslighet | Läkemedelsframkallat överkänslighetssyndrom Läkemedelsutslag med eosinofili och systemiska symtom | ||
| Metabolism och nutrition | Anorexi | Hypokalemi | Metabolisk acidos Renal tubulär acidos | |
| Psykiska störningar | Rastlöshet Irritabilitet Förvirring Depression | Affektiv labilitet Ångest Sömnlöshet Psykos | Vrede Aggression Självmordstankar Självmordsförsök | Hallucination |
| Centrala och perifera nervsystemet | Ataxi Yrsel Minnesförlust Sömnighet | Bradyfreni Koncentrationssvårigheter Nystagmus Parestesi Talsvårigheter Tremor | Konvulsion | Amnesi Koma Grand mal-anfall Myastenisyndrom Malignt neuroleptiskt syndrom Status epilepticus |
| Ögon | Dubbelseende | Trångvinkelglaukom Ögonsmärta Myopi Dimsyn Minskad synskärpa | ||
| Andningsvägar, bröstkorg och mediastinum | Dyspné Aspirationspneumoni Andningsbesvär Allergisk pneumoni | |||
| Magtarmkanalen | Buksmärtor Förstoppning Diarré Dyspepsi Illamående | Kräkningar | Pankreatit | |
| Lever och gallvägar | Kolecystit Kolelitiasis | Hepatocellulär skada | ||
| Hud och subkutan vävnad | Hudutslag Klåda Alopeci | Anhidros Erythema multiforme Stevens-Johnsons syndrom Toxisk epidermal nekrolys | ||
| Muskuloskeletala systemet och bindväv | Rabdomyolys | |||
| Njurar och urinvägar | Njursten | Urinsten | Hydronefros Njursvikt Onormal urin | |
| Allmänna symtom och/eller symtom vid administreringsstället | Trötthet Influensaliknande sjukdom Pyrexi Perifert ödem | |||
| Undersökningar | Minskat bikarbonat | Viktminskning | Förhöjt kreatinkinas i blod Förhöjt kreatinin i blod Förhöjd blodurea Onormala leverfunktionsprov | |
| Skador, förgiftningar och behandlingskomplikationer | Värmeslag |
Dessutom har det förekommit enskilda fall av plötslig, oförklarlig död bland epilepsipatienter (SUDEP) som behandlas med zonisamid.
Tabell 6 Biverkningar i en randomiserad, kontrollerad monoterapistudie som jämfört zonisamid med karbamazepin med förlängd frisättning
Klassificering av organsystem (MedDRA-terminologi) | Mycket vanliga | Vanliga | Mindre vanliga |
| Infektioner och infestationer | Urinvägsinfektion Pneumoni | ||
| Blodet och lymfsystemet | Leukopeni Trombocytopeni | ||
| Metabolism och nutrition | Minskad aptit | Hypokalemi | |
| Psykiska störningar | AgitationDepression Sömnlöshet Humörsvängningar Ångest | Förvirring Akut psykos Aggressivitet Självmordstankar Hallucination | |
| Centrala och perifera nervsystemet | Ataxi Yrsel Minnesförlust Sömnighet Bradyfreni Koncentrationssvårigheter Parestesi | Nystagmus Talsvårigheter Tremor Konvulsion | |
| Ögon | Dubbelseende | ||
| Andningsvägar, bröstkorg och mediastinum | Andningsbesvär | ||
| Magtarmkanalen | Förstoppning Diarré Dyspepsi Illamående Kräkningar | Buksmärtor | |
| Lever och gallvägar | Akut kolecystit | ||
| Hud och subkutan vävnad | Hudutslag | Klåda Ekkymos | |
| Allmänna symtom och/eller symtom vid administreringsstället | Trötthet Pyrexi Irritabilitet | ||
| Undersökningar | Minskat bikarbonat | Viktminskning Förhöjt blodkreatininfosfokinas Förhöjt alaninaminotransferas Förhöjt aspartataminotransferas | Avvikande fynd vid urinanalys |
Ytterligare information om särskilda populationer:
Äldre
En samlad analys av säkerhetsuppgifter om 95 äldre patienter har visat en relativt högre rapporteringsfrekvens för perifert ödem och klåda jämfört med den vuxna populationen.
Granskning av uppgifter efter marknadsföring antyder att patienter över 65 år rapporterar en högre frekvens än den allmänna populationen av följande händelser: Stevens-Johnsons syndrom (SJS) och läkemedelsframkallat överkänslighetssyndrom (DIHS).
Pediatrisk population
Biverkningsprofilen för zonisamid hos pediatriska patienter i åldern 6 till 17 år i placebokontrollerade kliniska studier var förenlig med profilen för vuxna. Bland 465 patienter i den pediatriska säkerhetsdatabasen (inklusive ytterligare 67 patienter från förlängningsfasen av den kontrollerade kliniska prövningen) skedde 7 dödsfall (1,5 %; 14,6/1 000 personår): 2 fall av status epilepticus, av vilka ett var förenat med svår viktnedgång (10 % inom 3 månader) hos en underviktig patient och därpå följande underlåtenhet att ta läkemedel; 1 fall med huvudskada/hematom, och 4 dödsfall bland patienter med befintliga neurologiska funktionsnedsättningar av olika skäl (2 fall av penumoniinducerad sepsis/organsvikt, 1 SUDEP och 1 huvudskada). Totalt 70,4 % av de pediatriska patienterna som fick zonisamid i den kontrollerade studien eller i dess öppna förlängning hade minst ett bikarbonatvärde som uppstått under behandlingen som låg under 22 mmol/l. Varaktigheten för låga bikarbonatvärden var dessutom lång (median 188 dagar). En samlad analys av säkerhetsdata om 420 pediatriska patienter (183 patienter i åldern 6 till 11 år, och 237 patienter i åldern 12 till 16 år, med en genomsnittlig exponeringstid på cirka 12 månader) har visat en relativt högre rapporteringsfrekvens av pneumoni, dehydrering, minskad svettning, avvikande resultat i leverfunktionstester, otitis media, faryngit, sinuit och övre luftvägsinfektion, hosta, näsblod och rinit, buksmärta, kräkningar, utslag och eksem samt feber jämfört med den vuxna populationen (särskilt för patienter som var yngre än 12 år) och, med en låg incidens, amnesi, förhöjt kreatinin, lymfadenopati och trombocytopeni. Incidensen av en viktminskning på 10 % eller mer var 10,7 % (se avsnitt Varningar och försiktighet). I vissa fall med viktminskning skedde en försenad övergång till nästa Tannerstadium liksom en försenad skelettmognad.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Fall av oavsiktlig och avsiktlig överdosering hos vuxna patienter och barn har rapporterats. I vissa fall var överdoseringen asymtomatisk, särskilt när kräkning eller ventrikelsköljning skedde snabbt. I andra fall åtföljdes överdoseringen av symtom såsom sömnighet, illamående, gastrit, nystagmus, myokloni, koma, bradykardi, nedsatt njurfunktion, hypotension och andningsdepression. En mycket hög plasmahalt om 100,1 μg/ml zonisamid uppmättes ca 31 timmar efter att en patient tog en överdos zonisamid och klonazepam. Patienten förlorade medvetandet och hade andningsdepression men återfick medvetandet fem dagar senare utan sviter.
Behandling
Det finns inga specifika antidoter mot överdosering av Zonisamide Desitin. Efter misstänkt, nyligen inträffad överdosering kan tömning av magen genom sköljning eller inducering av kräkning vara indicerad, förutsatt att vanliga åtgärder för att skydda luftvägarna vidtas. Allmän, stödjande vård är indicerad inklusive täta kontroller av vitala tecken och noggrann övervakning. Zonisamid har lång halveringstid och läkemedlets effekter kan därför vara långvariga. Hemodialys har inte studerats formellt för behandling av överdosering men har sänkt zonisamidhalten i plasma hos en patient med nedsatt njurfunktion och kan övervägas som behandling av överdosering om detta är kliniskt indicerat.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antiepileptika, övriga antiepileptika
ATC-kod: N03AX15
Zonisamid är ett benzisoxazolderivat. Det är ett antiepileptikum med svag karbanhydrasaktivitet in vitro. Läkemedlet är inte kemiskt besläktat med andra antiepileptika.
Verkningsmekanism
Zonisamids verkningsmekanism är inte helt klarlagd men det tycks verka på spänningskänsliga natrium- och kalciumkanaler och därigenom störa synkroniserad neuronaktivitet, minska anfallens spridning och avbryta efterföljande epileptisk aktivitet. Zonisamid har också en begränsande effekt på GABA-medierad neuroninhibitering.
Farmakodynamisk effekt
Zonisamids antikonvulsiva verkan har bedömts i många olika modeller, hos flera arter med inducerade eller medfödda anfall, och läkemedlet tycks verka som ett antiepileptikum med bred effekt i dessa modeller. Zonisamid förhindrar kramper vid maximal elchock, begränsar anfallens spridning inklusive spridning av anfall från cortex till subkortikala strukturer och dämpar aktiviteten i epileptogena foci. I motsats till fenytoin och karbamazepin verkar zonisamid företrädesvis på anfall med ursprung i cortex.
Klinisk effekt och säkerhet
Monoterapi vid partiella anfall, med eller utan sekundär generalisering
Effekten av zonisamid som monoterapi har fastställts i en dubbelblind, non inferiority-studie i parallellgrupper i jämförelse med karbamazepin med förlängd frisättning hos 583 vuxna patienter med nydiagnostiserade partiella anfall med eller utan sekundära generaliserade tonisk‑kloniska anfall. Försökspersonerna randomiserades till behandling med karbamazepin eller zonisamid i upp till 24 månader beroende på respons. Försökspersonerna titrerades till en måldos på 600 mg karbamazepin eller 300 mg zonisamid. Försökspersoner som upplevde anfall titrerades till nästa måldos dvs 800 mg karbamazepin eller 400 mg zonisamid. Försökspersoner som upplevde ytterligare anfall titrerades till den högsta måldosen på 1200 mg karbamazepin eller 500 mg zonisamid. Försökspersoner utan anfall under 26 veckor på en måldosnivå fortsatte med denna dos under ytterligare 26 veckor. De viktigaste resultaten i denna studie presenteras i denna tabell:
Tabell 7 Effektresultaten i monoterapistudie
Zonisamid | Karbamazepin | |||
n (ITT-population) Sex månader utan anfall | 281 | 300 | Diff | CI95 % |
PP-population* | 79,4 % | 83,7 % | -4,5 % | -12,2 % ; 3,1 % |
ITT-population | 69,4 % | 74,7 % | -6,1 % | -13,6 % ; 1,4 % |
≤ 4 anfall under 3 månader | 71,7 % | 75,7 % | -4,0 % | -11,7 % ; 3,7 % |
baslinjeperiod | ||||
> 4 anfall under 3 månader | 52,9 % | 68,9 % | -15,9 % | -37,5 % ; 5,6 % |
baslinjeperiod | ||||
Tolv månader utan anfall | ||||
PP-population | 67,6 % | 74,7 % | -7,9 % | - 17,2 % ; 1,5 % |
ITT-population | 55,9 % | 62,3 % | -7,7 % | - 16,1 % ; 0,7 % |
≤ 4 anfall under 3 månader | 57,4 % | 64,7 % | -7,2 % | -15,7 % ; 1,3 % |
baslinjeperiod | ||||
> 4 anfall under 3 månader | 44,1 % | 48,9 % | -4,8 % | -26,9 % ; 17,4 % |
baslinjeperiod | ||||
Anfallsundertyp (6 månader utan anfall-PP-population) | ||||
Alla partiella | 76,4 % | 86,0 % | -9,6 % | -19,2 % ; 0,0 % |
Enkla partiella | 72,3 % | 75,0 % | -2,7 % | -20,0 % ; 14,7 % |
Komplexa partiella | 76,9 % | 93,0 % | -16,1 % | -26,3 % ; -5,9 % |
Alla generaliserade tonisk-kloniska | 78,9 % | 81,6 % | -2,8 % | -11,5 % ; 6,0 % |
Sekundära tonisk-kloniska | 77,4 % | 80,0 % | -2,6 % | -12,4 % ; 7,1 % |
Generaliserade tonisk-kloniska | 85,7 % | 92,0 % | -6,3 % | -23,1 % ; 10,5 % |
PP = Per protokoll-population; ITT = intent-to-treat-population
*Primärt effektmått
Tilläggsbehandling i behandlingen av partiella anfall med eller utan sekundär generalisering hos vuxna
Hos vuxna har effekten visats med zonisamid i 4 dubbelblinda, placebokontrollerade studier med upp till 24 veckors behandlingstid med dosering antingen en eller två gånger dagligen. Dessa studier visar att medianminskningen av frekvensen partiella anfall är relaterad till dosen zonisamid och att varaktig effekt uppnås vid doser om 300‑500 mg per dag.
Pediatrisk population
Tilläggsbehandling i behandlingen av partiella anfall, med eller utan sekundär generalisering, hos adolescenta och pediatriska patienter (i åldern 6 år och äldre)
Hos pediatriska patienter (i åldern 6 år och äldre) har effekt påvisats med zonisamid i en dubbelblind, placebokontrollerad studie, vilken innefattade 207 patienter och hade en behandlingslängd på upp till 24 veckor. En reduktion på 50 % eller mer från baslinjen när det gällde anfallsfrekvens under den 12 veckor långa perioden med stabil dos sågs hos 50 % av patienterna som behandlades med zonisamid och 31 % av patienterna som fick placebo.
Särskilda säkerhetsproblem som man stötte på i de pediatriska studierna var nedsatt aptit och viktminskning, sänkta bikarbonatnivåer, ökad risk för njurstenar och dehydrering. Alla dessa effekter och särskilt viktnedgång kan ha skadliga effekter på tillväxt och utveckling, och kan leda till en allmänt försämrad hälsa. På det hela taget är data om effekter på tillväxt och utveckling på lång sikt begränsade.
Farmakokinetiska egenskaper
Absorption
Efter oral administrering absorberas zonisamid nästan fullständigt och maximala serum- eller plasmahalter uppnås i allmänhet inom 2 till 5 timmar. Första passagemetabolismen anses vara försumbar. Den absoluta biotillgängligheten beräknas vara ca 100 %. Oral biotillgänglighet påverkas inte av föda, men maximala plasma- och serumkoncentrationer kan fördröjas.
Zonisamids AUC- och Cmax-värden steg nästan linjärt efter en engångsdos inom intervallet 100‑800 mg och upprepade doser inom intervallet 100‑400 mg en gång dagligen. Ökningen vid steady-state var något större än väntat på basis av dos, sannolikt på grund av den mättnadsbara bindningen av zonisamid till röda blodkroppar. Steady-state uppnåddes inom 13 dagar. En något större ackumulering än väntat inträffar i jämförelse med engångsdosering.
Distribution
Zonisamid är till 40‑50 % bundet till plasmaproteiner hos människa och studier in vitro visar att detta inte påverkas av närvaro av olika antiepileptika (dvs. fenytoin, fenobarbiton, karbamazepin och natriumvalproat). Den skenbara distributionsvolymen är ca 1,1‑1,7 l/kg hos vuxna vilket visar att zonisamid i stor utsträckning distribueras till vävnader. Erytrocyt/plasma-förhållanden ligger på omkring 15 vid låga koncentrationer och på omkring 3 vid högre koncentrationer.
Metabolism
Zonisamid metaboliseras via CYP3A4 huvudsakligen genom reduktiv klyvning av modersubstansens benzisoxazolring för att bilda 2‑sulfamoylacetylfenol (SMAP) samt även genom N-acetylering. Modersubstansen och SMAP kan dessutom glukuronideras. Metaboliterna som inte kunde spåras i plasma saknar antikonvulsativ aktivitet. Det finns inga belägg för att zonisamid inducerar sin egen metabolism.
Eliminering
Efter oral administrering är skenbar clearance av zonisamid ca 0,70 l/h vid steady-state och den terminala halveringstiden är ca 60 timmar i frånvaro av CYP3A4-inducerare. Halveringstiden var oberoende av dos och påverkades inte av upprepad administrering. Variationen i serum- och plasmahalter under ett doseringsintervall är låg (< 30 %). Den huvudsakliga utsöndringsvägen för zonisamidmetaboliter och oförändrat läkemedel är via urinen. Renal clearance av oförändrat zonisamid är relativt låg (ca 3,5 ml/min) och ca 15‑30 % av dosen elimineras oförändrad.
Linjäritet/-icke-linjäritet
Zonisamidexponering ökar med tiden tills steady-state uppnås efter cirka 8 veckor. Vid jämförelse av samma dosnivå föreföll det som om patienter med högre total kroppsvikt hade lägre serumkoncentrationer i steady-state, men denna effekt verkar vara relativt blygsam. Ålder (≥ 12 år) och kön, efter justering för kroppsviktseffekter, hade ingen uppenbar effekt på zonisamidexponeringen hos epilepsipatienter under steady-state-dosering. Det finns inget behov av dosjustering med något antiepileptikum inklusive CYP3A4-inducerare.
Farmakokinetiskt/farmakodynamiskt förhållande
Zonisamid sänker medelanfallsfrekvensen under en 28‑dagarsperiod och sänkningen är proportionell (log-linjär) till medelkoncentrationen av zonisamid.
Speciella patientgrupper
Patienter med nedsatt njurfunktion: Renalt clearance efter engångsdoser zonisamid var positivt korrelerade med kreatininclearance. Zonisamids plasma-AUC ökade med 35 % hos patienter med kreatininclearance < 20 ml/min (se även avsnitt Dosering och administreringssätt).
Patienter med nedsatt leverfunktion: Zonisamids farmakokinetik hos patienter med nedsatt leverfunktion har inte studerats tillräckligt.
Äldre patienter: Inga kliniskt signifikanta skillnader i farmakokinetiken observerades mellan unga (ålder 21‑40 år) och äldre patienter (65‑75 år).
Barn och ungdomar (5‑18 år): Begränsade uppgifter indikerar att farmakokinetiken hos barn och ungdomar, som vid steady-state tillfördes 1, 7 eller 12 mg/kg dagligen i uppdelade doser, liknar den som observeras hos vuxna efter justering enligt kroppsvikt.
Bioekvivalens
För Zonisamide Desitin oral suspension utfördes en bioekvivalensstudie mot referensprodukten Zonegran på 23 friska frivilliga under fastande förhållanden. Eftersom doslinjäritet ges kan resultaten översättas till andra dosstyrkor. Baserat på de farmakokinetiska parametrarna för zonisamid i plasma efter oral applicering visades bioekvivalens mot referensprodukten (tabell 8).
Plasmakoncentrationens tidsförlopp för båda de testade produkterna var nästan kongruent (figur 1). När det gäller den maximala plasmakoncentrationen (Cmax) och arean under kurvan (AUC) var Zonisamide Desitin bioekvivalent jämfört med referensprodukten. För Cmax var medelkvoten 98,6 % med 90 % konfidensintervall 94,5 % till 102,8 %. Medelkvoten för AUC(0-72) var 98,7 % med 90 % konfidensintervall på 96,1 % till 101,4 %.
Tabell 8 Medelvärden för de farmakokinetiska parametrarna för zonisamid efter orala engångsdoser på 100 mg Zonisamide Desitin jämfört med referensprodukten
| Zonisamide Desitin 100 mg | Referensprodukt 100 mg | ||
| Cmax | ng/mL | 1003,17 | 995,11 |
| tmax | hr | 2,00 | 3,25 |
| AUC(0-72) | hr ∙ ng/mL | 38964,95 | 39070,99 |
Förklaring: geometriskt medelvärde för Cmax och AUC(0-72), median för t max
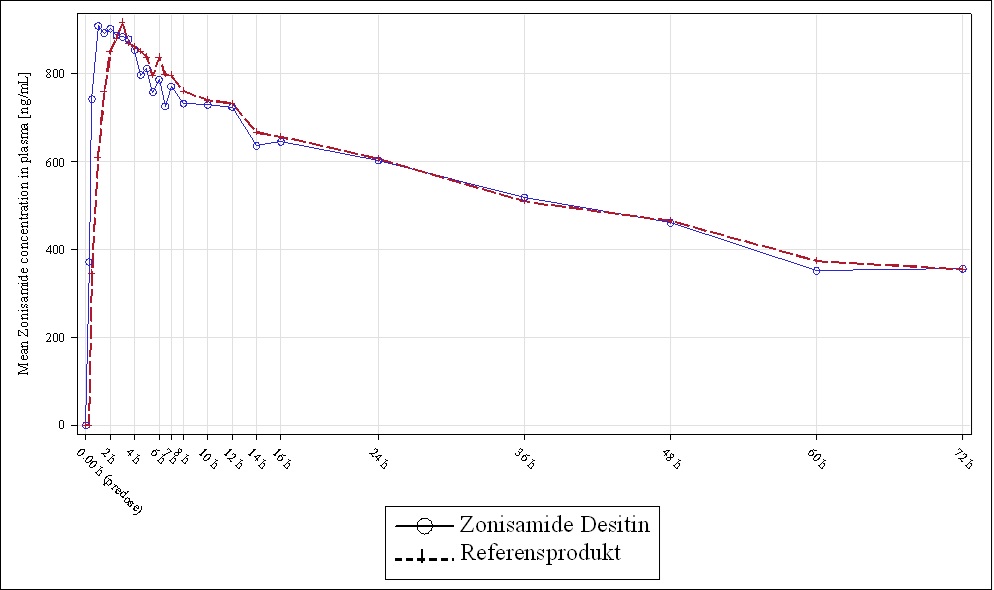
Figur 1: Tidsförlopp för det geometriska medelvärdet av plasmakoncentrationerna av zonisamid efter engångsdoser på 100 mg oral Zonisamide Desitin jämfört med referensprodukten
Prekliniska säkerhetsuppgifter
Förändringar som inte setts i kliniska studier, men som har observerats hos hund vid exponeringsnivåer liknande de vid klinisk användning, var leverförändringar (förstoring, mörkt brun missfärgning, mild hepatocytförstoring med koncentriska lamellkroppar i cytoplasman och cytoplasmisk vakuolisering) som är förknippade med ökad metabolism.
Zonisamid har inte visat sig vara genotoxiskt och har ingen karcinogen potential.
Zonisamid gav upphov till utvecklingsabnormiteter hos mus, råtta och hund och var embryoletalt hos apa vid tillförsel under organogenesperioden vid doser/exponering av moderdjuren nära eller lägre än behandlingsnivåerna för människa.
I en studie av allmäntoxicitet med upprepade orala doser till råttungar, vid exponeringsnivåer som liknar de som observeras hos pediatriska patienter vid den högsta rekommenderade dosen, sågs viktminskning samt förändringar av njurhistopatologi, parametrar för klinisk patologi och beteende. Förändringar av njurhistopatologi och parametrar för klinisk patologi ansågs bero på zonisamids hämning av karbanhydras. Effekterna vid denna dosnivå var reversibla under återhämtningsperioden. Vid en högre dos (2‑till 3‑faldig systemisk exponering jämfört med terapeutisk exponering) var effekterna på njurhistopatologin svårare och endast delvis reversibla. De flesta biverkningarna som sågs hos råttungarna liknade de som sågs i studierna av allmäntoxicitet av zonisamid på vuxna råttor, men hyalindroppar i njurtubuli och transitionell hyperplasi sågs endast i studien på ungar. Vid denna högre dos uppvisade råttungar en nedgång i parametrarna för tillväxt, inlärning och utveckling. Dessa effekter ansågs sannolikt vara relaterade till den minskade kroppsvikten och de överdrivna farmakologiska effekterna av zonisamid vid den högsta tolererade dosen.
Hos råttor observerades ett minskat antal gulkroppar och implantationsställen vid exponeringsnivåer som motsvarade den högsta terapeutiska dosen för människa. Oregelbundna brunstcykler och ett minskat antal levande foster observerades vid exponeringsnivåer som var tre gånger högre.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Fosforsyra 85 %
Xantangummi
Natriumdivätefosfatdihydrat
Dikaliumfosfat
Dokusatnatrium
Sukralos
Natriummetylparahydroxibensoat (E219)
Natriumpropylparahydroxibensoat (E217)
Jordgubbsarom (innehåller spår av natrium)
Sötmamodulerande arom (innehåller spår av fruktos, glukos, sackaros, E220 och natrium)
Maskeringsarom (innehåller spår av natrium)
Destillerat vatten
Inkompatibiliteter
Ej relevant
Hållbarhet
3 år
Efter första öppning: 3 månader
Särskilda förvaringsanvisningar
Detta läkemedel kräver inga särskilda lagringsförhållanden.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ZONISAMIDE DESITIN oraalisuspensio
20 mg/ml (L:ei) 250 ml (10 ml ruisku ja adapteri) (208,41 €)
PF-selosteen tieto
1 bärnstensfärgad glasflaska (typ III) med 250 ml suspension och en vit barnsäker förslutning (polypropen) i en låda som även innehåller en 10 ml oralspruta, graderad var 0,25 ml (polyeten, polypropen) och en polyetenadapter för oralsprutan.
2 bärnstensfärgade glasflaskor (typ III) med 250 ml suspension vardera och vita barnsäkra förslutningar (polypropen) i en låda som även innehåller en 10 ml oralspruta, graderad var 0,25 ml (polyeten, polypropen) och en polyetenadapter för oralsprutan.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit suspension med jordgubbssmak.
Särskilda anvisningar för destruktion och övrig hantering
Oanvänt läkemedel eller avfall ska kasseras i enlighet med lokala föreskrifter.
Ersättning
ZONISAMIDE DESITIN oraalisuspensio
20 mg/ml 250 ml
- Ei korvausta.
Atc-kod
N03AX15
Datum för översyn av produktresumén
23.10.2024
Yhteystiedot
Unioninkatu 32 B
00100 Helsinki
Suomi
www.desitin.fi
info@desitin.fi
