FLUARIX injektionsvätska, suspension i förfylld spruta 15 mikrog HA/0,5 ml
Kvalitativ och kvantitativ sammansättning
Influensavirus (inaktiverat, spjälkat) av följande stammar*:
A/Victoria/4897/2022 (H1N1)pdm09-liknande stam (A/Victoria/4897/2022, IVR-238) 15 mikrogram HA**
A/Croatia/10136RV/2023 (H3N2)-liknande stam (A/Croatia/10136RV/2023, X-425A) 15 mikrogram HA**
B/Austria/1359417/2021-liknande stam (B/Austria/1359417/2021, BVR-26) 15 mikrogram HA**
per 0,5 ml dos
* producerat i befruktade hönsägg från friska höns
** hemagglutinin
Detta vaccin överensstämmer med Världshälsoorganisationens (WHO) rekommendation (norra halvklotet) och EUs rekommendation för säsongen 2025/2026.
Fluarix kan innehålla restmängder av ovalbumin, hydrokortison, gentamicinsulfat, formaldehyd och natriumdeoxikolat, vilka används under tillverkningen (se avsnitt Kontraindikationer).
Hjälpämne med känd effekt
Vaccinet innehåller inte mer än 0,415 mg polysorbat 80 per dos (se avsnitt Varningar och försiktighet).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, suspension i förfylld spruta.
Kliniska uppgifter
Terapeutiska indikationer
Fluarix är avsett för aktiv immunisering av vuxna och barn från 6 månaders ålder för att förebygga influensasjukdom orsakad av de två subtyper av influensa A-virus och den stam av influensa B-virus som ingår i vaccinet (se avsnitt Farmakodynamiska egenskaper).
Användningen av Fluarix ska baseras på officiella rekommendationer.
Dosering och administreringssätt
Dosering
Vuxna
En dos à 0,5 ml.
Pediatrisk population
Barn från 6 månaders till 17 års ålder: En dos à 0,5 ml.
Barn i åldern 6 månader till under 9 år som inte har vaccinerats tidigare ska ges en andra dos à 0,5 ml efter ett intervall på minst 4 veckor.
Säkerhet och effekt för Fluarix för barn i åldern under 6 månader har inte fastställts.
Administreringssätt
Fluarix ska administreras som en intramuskulär injektion, företrädesvis i deltoidmuskeln eller i den anterolaterala delen av låret (beroende på muskelmassa).
Försiktighetsåtgärder före hantering eller administrering av vaccinet
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller något ämne som kan förekomma i restmängder t.ex. ovalbumin, hydrokortison, gentamicinsulfat, formaldehyd och natriumdeoxikolat.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Före immunisering
Det är god klinisk praxis att gå igenom sjukdomshistorien (särskilt med tanke på tidigare vaccinationer och eventuella biverkningar) och göra en läkarundersökning före vaccination.
Som för alla injicerbara vacciner bör adekvat medicinsk utrustning och övervakning alltid finnas lätt tillgänglig om en anafylaktisk reaktion skulle inträffa efter administrering av vaccinet.
Synkope (svimning) kan uppträda efter, eller till och med före, all vaccination, särskilt hos ungdomar som en psykogen reaktion på nålsticket. Detta kan åtföljas av flera neurologiska tecken, såsom övergående synstörningar, parestesier och rörelser av tonisk-klonisk typ i extremiteterna under återhämtning. Det är viktigt att rutiner finns på plats för att undvika skador vid svimning.
Som för andra vacciner ska vaccination med Fluarix skjutas upp hos personer med akut svår febersjukdom. En mindre infektion, såsom en förkylning, bör dock inte leda till att vaccinationen skjuts upp.
Fluarix är avsett att skydda mot de virusstammar från vilka vaccinet framställs samt närbesläktade stammar. Fluarix kanske inte är effektivt mot alla influensavirusstammar som kan förekomma.
I likhet med alla vacciner kan det hända att Fluarix inte framkallar ett skyddande immunsvar hos alla som vaccineras.
Försiktighet
Fluarix ska inte administreras intravaskulärt.
I likhet med andra vacciner som administreras intramuskulärt ska Fluarix ges med försiktighet till personer med trombocytopeni eller någon koagulationsrubbning eftersom blödning kan förekomma efter intramuskulär administrering hos dessa personer.
Systemiska immunsuppressiva läkemedel och immunbrist
Det kan förväntas att Fluarix kanske inte framkallar ett adekvat immunsvar hos patienter som får immunsuppressiv behandling eller hos patienter med immunbrist.
Inverkan på serologiska tester
Falskt positivt svar på serologiska ELISA-tester för hiv‑1, hepatit C och i synnerhet HTLV‑1 kan förekomma efter influensavaccination. Dessa övergående falska positiva resultat kan bero på det IgM-svar som vaccinet framkallar. En definitiv diagnos på infektion med hiv‑1, hepatit C eller HTLV‑1 kräver därför ett positivt resultat på ett bekräftande virusspecifikt test (t.ex. Western blot eller immunoblot eller PCR).
Hjälpämnen
Detta vaccin innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Detta vaccin innehåller mindre än 1 mmol kalium (39 mg) per dos, d.v.s. är näst intill ”kaliumfritt”.
Detta vaccin innehåller inte mer än 0,415 mg polysorbat 80 per dos. Polysorbater kan orsaka allergiska reaktioner.
Interaktioner
Samtidig administrering av vacciner har utvärderats i studier utförda med Fluarix Tetra (kvadrivalent influensavaccin).
Om Fluarix ska ges samtidigt med ett annat injicerbart vaccin, ska vaccinerna alltid ges på olika injektionsställen.
Data som visar att Fluarix kan administreras samtidigt med andra vacciner finns tillgängliga för följande vacciner: pneumokockpolysackaridvaccin (hos individer från 50 års ålder), adjuvanterat herpes zostervaccin (Shingrix) och mRNA-vaccin mot coronavirussjukdom 2019 (covid-19) (se avsnitt Farmakodynamiska egenskaper).
Frekvensen av smärta vid injektionsstället som har rapporterats hos personer som samtidigt vaccinerats med Fluarix och 23-valent pneumokockpolysackaridvaccin (PPV23) är ungefär densamma som den som observerats vid vaccination med enbart PPV23 och högre jämfört med den som observerats vid vaccination med enbart Fluarix Tetra.
Incidensen av trötthet, huvudvärk, myalgi, artralgi, gastrointestinala symtom (däribland illamående, kräkningar, diarré och/eller buksmärtor) och frossa som har rapporterats hos personer som samtidigt vaccinerats med Fluarix Tetra och Shingrix är högre jämfört med den som observerats vid vaccination med enbart Fluarix Tetra.
Incidensen av biverkningar som har rapporterats på förfrågan hos personer som samtidigt vaccinerats med Fluarix Tetra och mRNA-vaccin mot covid‑19 är ungefär densamma som den som observerats vid vaccination med enbart mRNA-vaccin mot covid-19 och högre jämfört med den som observerats vid vaccination med enbart Fluarix Tetra.
Fertilitet, graviditet och amning
Graviditet
Inaktiverade influensavacciner, såsom Fluarix, kan användas i alla stadier av graviditeten. Större mängder säkerhetsdata finns tillgängliga för användning av vaccin under den andra eller tredje trimestern, jämfört med den första trimestern.
Säkerheten vid administrering av Fluarix till gravida kvinnor har inte utvärderats i kliniska studier.
Tillgängliga data för Fluarix efter marknadsintroduktionen tyder inte på någon ökad risk för negativa graviditetsutfall.
Djurstudier med Fluarix tyder inte på direkta eller indirekta reproduktionstoxikologiska eller utvecklingstoxikologiska effekter eller (se avsnitt Prekliniska säkerhetsuppgifter).
Säkerhetsdata från användning över hela världen och från systematisk litteraturgranskning för inaktiverade vacciner mot säsongsinfluensa administrerade vid graviditet tyder inte på några ökade risker för att oönskade effekter på foster eller moder skulle bero på vaccinet.
Amning
Det är okänt om Fluarix utsöndras i bröstmjölk.
Inga negativa effekter förväntas på ammade nyfödda/spädbarn. Fluarix kan användas under amning.
Fertilitet
Djurstudier tyder inte på direkta eller indirekta skadliga effekter på fertiliteten hos honor.
Effekter på förmågan att framföra fordon och använda maskiner
Det har inte gjorts några studier om Fluarix påverkar förmågan att framföra fordon eller använda maskiner. Vissa av de biverkningar som nämns under ”Biverkningar” (t.ex. trötthet eller yrsel) kan tillfälligt ha mindre påverkan på förmågan att framföra fordon och använda maskiner.
Biverkningar
Säkerhetsprofilen för aktuellt godkänt Fluarix har härletts från tidigare godkänt Fluarix.
Sammanfattning av säkerhetsprofilen
Hos vuxna uppstår de flesta vanliga biverkningarna inom 2 dagar efter vaccinationen. Dessa är oftast lindriga till måttliga och varar i 3 dagar.
Hos barn och ungdomar i åldern 6 månader till 17 år uppstår de flesta vanliga biverkningarna på vaccinationsdagen. Dessa är oftast lindriga till måttliga och varar i 2 dagar.
I samtliga åldersgrupper var smärta vid injektionsstället (21,5 % till 52,7 %) den vanligaste rapporterade lokala biverkningen efter vaccination.
Hos vuxna 18 år och äldre var trötthet (12,2 % till 31,4 %), huvudvärk (9,0 % till 21,9 %) och myalgi (12,2 % till 14,3 %) de vanligaste rapporterade allmänna biverkningarna efter vaccination.
Hos barn och ungdomar mellan 6 och < 18 år var trötthet (10,5 % till 16,7 %), myalgi (10,7 % till 24,6 %) och huvudvärk (9,3 % till 14,4 %) de vanligaste rapporterade allmänna biverkningarna efter vaccination.
Hos barn mellan 3 och < 6 år var dåsighet (7,3 % till 14,8 %), aptitförlust (5,5 % till 8,7 % och irritabilitet/kinkighet (8,1 % till 15,4 %) de vanligaste rapporterade allmänna biverkningarna efter vaccination.
Hos barn mellan 6 och < 36 månader var irritabilitet/kinkighet (19 % till 30,1 %), dåsighet (13,5 % till 19,8 %) och aptitförlust (7,5 % till 18 %) de vanligaste rapporterade allmänna biverkningarna efter vaccination.
Tabell över biverkningar
De rapporterade biverkningarna listas enligt följande frekvenskategorier:
Mycket vanliga (≥ 1/10)
Vanliga (≥ 1/100, < 1/10)
Mindre vanliga (≥ 1/1 000, < 1/100)
Sällsynta (≥ 1/10 000, < 1/1 000)
Mycket sällsynta (< 1/10 000)
Data från kliniska studier
I kontrollerade kliniska studier har Fluarix givits till fler än 24 500 vuxna 18 år och äldre och fler än 8 600 barn och ungdomar mellan 6 månader och 18 år.
Följande biverkningar per dos har rapporterats:
Organsystem | Biverkning | Frekvens | |||
6 till < 36 månader | 3 till < 6 år | 6 till < 18 år | ≥ 18 år | ||
Metabolism och nutrition | Minskad aptit | Mycket vanliga | Mycket vanliga | N/A | N/R |
Psykiatriska tillstånd | Irritabilitet | Mycket vanliga | Mycket vanliga | N/A | N/R |
Centrala och perifera nervsystemet | Huvudvärk | N/A | N/A | Mycket vanliga | Mycket vanliga |
Dåsighet | Mycket vanliga | Mycket vanliga | N/A | N/R | |
Yrsel | N/R | N/R | N/R | Mindre vanliga | |
Magtarmkanalen | Magtarmsymtom (t.ex. illamående, kräkningar, diarré och/eller buksmärta) | Vanliga | Vanliga | Vanliga | Vanliga |
Hud och subkutan vävnad | Svettning | N/R | N/R | N/R | Vanliga |
Muskuloskeletala systemet och bindväv | Myalgi | N/A | N/A | Mycket vanliga | Mycket vanliga |
Artralgi | N/A | N/A | Vanliga | Vanliga | |
Allmänna symtom och/eller symtom vid administreringsstället | Trötthet | N/A | N/A | Mycket vanliga | Mycket vanliga |
Frossa | N/A | N/A | Vanliga | Vanliga | |
Feber | Vanliga | Vanliga | Vanliga | Mindre vanliga | |
Smärta vid injektionsstället | Mycket vanliga | Mycket vanliga | Mycket vanliga | Mycket vanliga | |
Rodnad vid injektionsstället | Mycket vanliga | Mycket vanliga | Mycket vanliga | Vanliga | |
Svullnad vid injektionsstället | Mycket vanliga | Mycket vanliga | Mycket vanliga | Vanliga | |
Förhårdnad vid injektionsstället | N/R | N/R | N/R | Vanliga | |
N/A = Ej efterfrågad i denna åldersgrupp
N/R = Ej rapporterad
Data efter marknadsintroduktionen
Organsystem | Frekvens | Biverkningar |
Blodet och lymfsystemet | Sällsynta | Övergående lymfadenopati |
Immunsystemet | Sällsynta | Allergiska reaktioner (inklusive anafylaktiska reaktioner). |
Centrala och perifera nervsystemet | Sällsynta | Neurit, akut disseminerad encefalomyelit och Guillain-Barrés syndrom* |
Hud och subkutan vävnad | Sällsynta | Urtikaria, klåda, erytem, hudutslag, angioödem |
Allmänna symtom och/eller symtom vid administreringsstället | Sällsynta | Influensaliknande sjukdom, allmän sjukdomskänsla |
*Spontana rapporter om Guillain-Barrés syndrom har inkommit efter vaccination med Fluarix. Något orsakssamband mellan vaccinationen och Guillain-Barrés syndrom har dock inte fastställts.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Otillräckliga data finns tillgängliga.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Influensavaccin, ATC-kod: J07BB02
Verkningsmekanism
Fluarix ger aktiv immunisering mot de tre influensavirusstammar som ingår i vaccinet.
Fluarix inducerar humorala antikroppar mot hemagglutininerna. Dessa antikroppar neutraliserar influensavirus.
Specifika nivåer av titern av hemagglutinationshämmande (HAI) antikroppar efter vaccination med inaktiverade influensavirusvacciner har inte korrelerats med skydd mot influensasjukdom men HAI-antikroppstitrar har använts som ett mått på vaccinaktivitet. I några challenge-prövningar på människa har HAI-antikroppstitrar på ≥ 1:40 varit förenade med skydd mot influensasjukdom hos upp till 50 % av deltagarna.
Årlig revaccination rekommenderas eftersom immuniteten avtar under året efter vaccination och eftersom cirkulerande stammar av influensavirus kan ändras från år till år.
Farmakodynamisk effekt
Immunologiska data och Fluarix vaccineffekt har utvärderats i studier som utförts med antingen Fluarix eller med Fluarix Tetra.
Vaccineffekt
Effekt hos barn i åldern 6 till 35 månader
Effekten av Fluarix Tetra utvärderades i den kliniska studien D-QIV-004, en randomiserad, observatörsblindad studie med ett icke-influensavaccin som kontroll, som utfördes under influensasäsongerna 2011–2014. Friska studiedeltagare i åldern 6 till och med 35 månader randomiserades (1:1) till att få Fluarix Tetra (N = 6 006) eller ett icke-influensavaccin som kontroll (N = 6 012). De som tidigare vaccinerats mot influensa gavs 1 dos och övriga gavs 2 doser med cirka 28 dagars mellanrum.
Effekten av Fluarix Tetra bedömdes vad avser förebyggande av omvänt transkriptaspolymeraskedjereaktion-(RT-PCR)-bekräftad influensa A- och/eller B-sjukdom (måttlig till svår och av samtliga svårighetsgrader) orsakad av någon säsongsinfluensastam. Från 2 veckor efter vaccination till slutet av influensasäsongen (cirka 6 månader senare) insamlades svabbprover från näsan efter en influensaliknande händelse och testades för influensa A och/eller B med RT-PCR. Alla RT-PCR-positiva prover testades ytterligare för viabilitet i cellodling samt för att bestämma om virusstammarna matchade dem i vaccinet.
Fluarix Tetra uppfyllde de fördefinierade kriterierna för de primära och sekundära mål för vaccineffekt som redovisas i tabell 1.
Tabell 1: Fluarix Tetra: Attackfrekvenser och vaccineffekt hos barn i åldern 6‑35 månader (ATP-(enligt protokoll)-kohort för effekt – tid till händelse)
| Fluarix Tetra | Aktivt jämförelsevaccin1 | Vaccineffekt | ||||
| N2=5 707 | N2=5 697 | |||||
| n3 | Attackfrekvens (n/N) (%) | n3 | Attackfrekvens n/N (%) | % | KI: | |
| Influensa av någon svårighetsgrad6 | ||||||
| RT-PCR-bekräftad | 344 | 6,03 | 662 | 11,62 | 49,8 | 41,8; 56,84 |
| Odlingsbekräftad | 303 | 5,31 | 602 | 10,57 | 51,2 | 44,1; 57,65 |
| Odlingsbekräftade vaccinmatchande stammar | 88 | 1,54 | 216 | 3,79 | 60,1 | 49,1; 69,05 |
| Måttlig till svår influensa7 | ||||||
| RT-PCR-bekräftad | 90 | 1,58 | 242 | 4,25 | 63,2 | 51,8; 72,34 |
| Odlingsbekräftad | 79 | 1,38 | 216 | 3,79 | 63,8 | 53,4; 72,25 |
| Odlingsbekräftade vaccinmatchande stammar | 20 | 0,35 | 88 | 1,54 | 77,6 | 64,3; 86,65 |
| RT-PCR-bekräftad nedre luftvägssjukdom | 28 | 0,49 | 61 | 1,07 | 54,0 | 28,9; 71,05 |
| RT-PCR-bekräftad akut otitis media | 12 | 0,21 | 28 | 0,49 | 56,6 | 16,7; 78,85 |
KI: Konfidensintervall
1Barn fick ett för åldern lämpligt icke-influensavaccin som kontroll.
2Antalet deltagare som ingick i ATP-kohorten för effekt – tid till händelse. Denna kohort inkluderade deltagare som uppfyllde alla lämplighetskriterier, som följdes för effekt och som följde studieprotokollet fram till episoden.
3Antal deltagare som rapporterade minst ett fall under rapportperioden.
4Två-sidigt 97,5 % konfidensintervall.
5Två-sidigt 95 % konfidensintervall.
6Influensasjukdom av någon svårighetsgrad definierades som en episod med influensaliknande sjukdom (ILI, dvs. feber ≥38 °C med något av följande: hosta, rinnsnuva, nästäppa eller andningssvårigheter) eller en följd av influensavirusinfektion [akut mediaotit (AOM) eller nedre luftvägssjukdom (NLI)].
7Måttlig till svår influensa var en undergrupp av influensasjukdom med något av följande: feber >39 °C, läkardiagnostiserad AOM, läkardiagnostiserad nedre luftvägsinfektion, läkardiagnostiserad allvarliga extra-pulmonella komplikationer, inläggning på intensivvårdsavdelning eller behov av syrgastillskott i mer än 8 timmar.
Exploratoriska analyser utfördes på den totala vaccinerade kohorten, som inkluderade 12 018 deltagare (N = 6 006 för Fluarix Tetra, N = 6 012 för kontroll). Fluarix Tetra var effektivt i förebyggandet av måttlig till svår influensa orsakad av var och en av de 4 stammarna (tabell 2), även vid signifikant bristande antigen överensstämmelse med 2 av vaccinstammarna (A/H3N2 och B/Victoria).
Tabell 2: Fluarix Tetra: Attackfrekvenser och vaccineffekt för RT-PCR-bekräftad måttlig till svår sjukdom orsakad av influensa A-subtyp eller influensa B-linje hos barn i åldern 6‑35 månader (total vaccinerad kohort)
| Fluarix Tetra | Aktivt jämförelsevaccin1 | Vaccineffekt | ||||
| N2=6 006 | N2=6 012 | |||||
| Stam | n3 | Attackfrekvens (n/N) (%) | n3 | Attackfrekvens (n/N) (%) | % | 95 % KI |
| A | ||||||
| H1N14 | 13 | 0,22 | 46 | 0,77 | 72,1 | 49,9; 85,5 |
| H3N25 | 53 | 0,88 | 112 | 1,86 | 52,7 | 34,8; 66,1 |
| B | ||||||
| Victoria6 | 3 | 0,05 | 15 | 0,25 | 80,1 | 39,7; 95,4 |
| Yamagata7 | 22 | 0,37 | 73 | 1,21 | 70,1 | 52,7; 81,9 |
KI: Konfidensintervall
1Spädbarn fick ett för åldern lämpligt icke-influensavaccin som kontroll.
2Antalet deltagare som ingick i den totala vaccinerade kohorten.
3Antal deltagare som rapporterade minst ett fall under rapportperioden.
4 ‑7Andelen antigenmatchande stammar var 84,8 %, 2,6 %, 14,3 % och 66,6 %, för A/H1N1, A/H3N2, B/Victoria respektive B/Yamagata..
Vad gäller RT-PCR-bekräftade fall av någon svårighetsgrad minskade Fluarix Tetra risken för besök hos allmänläkare med 47 % (relativ risk (RR): 0,53 [95 % KI: 0,46; 0,61], dvs. 310 mot 583 besök) och på akutmottagning med 79 % (RR: 0,21 [95 % KI: 0,09; 0,47], dvs. 7 mot 33 besök). Användningen av antibiotika minskade med 50 % (RR: 0,50 [95 % KI: 0,42; 0,60], dvs. 172 mot 341 deltagare).
Effekt hos vuxna från 18 års ålder
Effekten av Fluarix utvärderades i den kliniska studien Fluarix-US-006, en randomiserad dubbelblind, placebokontrollerad studie. Studien utvärderade effekten hos 7 652 deltagare (N = 5 103 för Fluarix och N = 2 549 för placebo) i förebyggandet av odlingsbekräftade fall av influensa A och/eller B orsakade av antigenmatchade stammar.
Deltagarna övervakades för influensaliknande sjukdom som bekräftades med odling (resultaten redovisas i tabell 3), Influensaliknande sjukdom definierades som minst ett allmänt symtom (feber ≥ 37,8 °C och/eller myalgi) och minst ett luftvägssymtom (hosta och/eller halsont).
Tabell 3: Attackfrekvens och vaccineffekt mot sjukdom förenad med belägg för influensa A- eller B-infektion hos vuxna i åldern 18 till 64 år (total vaccinerad kohort)
| Fluarix | Placebo | Vaccineffekt | ||||
| N1=5 103 | N1=2 549 | |||||
| n2 | Attackfrekvens n/N (%) | n2 | Attackfrekvens n/N (%) | % | 95 % KI | |
| Antigenmatchad, odlingsbekräftad influensa3 | 49 | 1,0 | 74 | 2,9 | 66,9 | 51,9; 77,4 |
| All odlingsbekräftad influensa (matchad, omatchad och icke-typad)4 | 63 | 1,2 | 82 | 3,2 | 61,6 | 46,0; 72,8 |
KI: Konfidensintervall
1totalt antal deltagare
2antal fall
3Det fanns inga vaccinmatchade odlingsbekräftade fall av influensastammarna A/New Caledonia/20/1999 (H1N1) eller B/Malaysia/2506/2004 med Fluarix eller placebo.
4Av de ytterligare 22 fallen var 18 omatchade och 4 var inte typade; 15 av de 22 fallen var A (H3N2) (11 fall med Fluarix och 4 fall med placebo).
Immunogenicitetsdata
Fluarix Tetras immunogenicitet utvärderades i termer av det geometriska medelvärdet (GMT) för HAI-antikroppstiter och HAI-konversionsfrekvens (fyrfaldig ökning av reciprok titer eller förändring från icke påvisbar [<10] till en reciprok titer på ≥ 40) 28 dagar (barn) eller 21 dagar (vuxna) efter den sista dosen.
Immunogenicitet hos barn i åldern 6 till 35 månader
I studie D-QIV-004 utfördes utvärderingen i en delkohort med 1 332 barn (753 i Fluarix Tetra-gruppen och 579 i kontrollgruppen). Resultaten redovisas i tabell 4.
Tabell 4: GMT och serokonversionfrekvenser hos barn (6‑35 månader (enligt protokoll-kohorten) efter vaccination
| Fluarix Tetra | Kontroll3 | |||
| N1=750‑753 | N2=742‑746 | N1=578‑579 | N2=566‑568 | |
GMT4 (95 % KI) | Serokonversionsfrekvens2 (95 % KI) | GMT4 (95 % KI) | Serokonversionsfrekvens4 (95 % KI) | |
| A/H1N1 | 165,3 (148,6; 183,8) | 80,2 % (77,2; 83,0) | 12,6 (11,1; 14,3) | 3,5 % (2,2; 5,4) |
| A/H3N2 | 132,1 (119,1; 146,5) | 68,8 % (65,3; 72,1) | 14,7 (12,9; 16,7) | 4,2 % (2,7; 6,2) |
| B (Victoria) | 92,6 (82,3; 104,1) | 69,3 % (65,8; 72,6) | 9,2 (8,4; 10,1) | 0,9 % (0,3; 2,0) |
| B (Yamagata) | 121,4 (110,1; 133,8) | 81,2 % (78,2; 84,0) | 7,6 (7,0; 8,3) | 2,3 % (1,2; 3,9) |
KI: Konfidensintervall
1Antal deltagare med tillgängligt resultat efter vaccination (för GMT).
2Antal deltagare med tillgängligt resultat både före och efter vaccination (för serokonversionsfrekvens).
3icke-influensakontrollvaccin
4resultat från immunogenicitets-kohorten
Huruvida 2 doser som primärvaccination i studien D QIV-004 framkallat immunologiskt minne utvärderades i D-QIV-009. Det immunologiska svaret mätt 7 dagar efter revaccination med en dos Fluarix Tetra ett år efter primärvaccination visade att immunologiskt minne inducerats för samtliga fyra stammar hos barn i åldern 6 till 35 månader.
Immunogenicitet hos barn i åldern 3 till under 18 år
I en dubbelblind fas III-studie (D-QIV-003) randomiserades barn till att få 1 eller 2 doser (beroende på tidigare influensavaccination) av antingen Fluarix (N = 818) eller Fluarix Tetra (N = 791). Immunsvaren framkallade av Fluarix och Fluarix Tetra redovisas i tabell 5.
Tabell 5: GMT och serokonversionfrekvenser hos barn (3‑< 18 år (enligt protokoll-kohorten) efter vaccination
| Fluarix3 | Fluarix Tetra | |||
| n 1/818 | N2=818 | N1=791 | N2=790 | |
GMT (95 % KI) | Serokonversionsfrekvens (95 % KI) | GMT (95 % KI) | Serokonversionsfrekvens (95 % KI) | |
| A/H1N1 | 433,2 (401,0; 468,0) | 89,9 % (87,6; 91,8) | 386,2 (357,3; 417,4) | 91,4 % (89,2; 93,3) |
| A/H3N2 | 227,3 (213,3; 242,3) | 70,7 % (67,4; 73,8) | 228,8 (215,0; 243,4) | 72,3 % (69,0; 75,4) |
| B (Victoria) | 245,6 (229,2; 263,2) | 68,5 % (65,2; 71,6) | 244,2 (227,5; 262,1) | 70,0 % (66,7; 73,2) |
| B (Yamagata) | 224,7 (207,9; 242,9) | 37,0 % (33,7; 40,5) | 569,6 (533,6; 608,1) | 72,5 % (69,3; 75,6) |
KI: Konfidensintervall
1Antal deltagare med tillgängligt resultat efter vaccination (för GMT).
2Antal deltagare med tillgängligt resultat både före och efter vaccination (för serokonversionsfrekvens).
3B-(Yamagata)-stammen ingick inte i Fluarix
Immunogenicitet hos vuxna från 18 års ålder
I en randomiserad, delvis blindad fas III-studie (D-QIV-008) immunicerades cirka 600 deltagare med 1 dos Fluarix och cirka 1 800 deltagare med 1 dos Fluarix Tetra. Immunsvaren framkallade av Fluarix och Fluarix Tetra redovisas i tabell 6.
Tabell 6: GMT och serokonversionfrekvenser hos vuxna från 18 års ålder (enligt protokoll-kohorten) efter vaccination
| Fluarix3 | Fluarix Tetra | |||
| N1=608 | N2=605 | N1=1 809 | N2=1 801 | |
GMT (95 % KI) | Serokonversionsfrekvens (95 % KI) | GMT (95 % KI) | Serokonversionsfrekvens (95 % KI) | |
| A/H1N1 | 218,4 (194,2; 245,6) | 77,2 % (73,6; 80,5) | 201,1 (188,1; 215,1) | 77,5 % (75,5; 79,4) |
| A/H3N2 | 298,2 (268,4; 331,3) | 65,8 % (61,9; 69,6) | 314,7 (296,8; 333,6) | 71,5 % (69,3; 73,5) |
| B (Victoria) | 393,8 (362,7; 427,6) | 55,4 % (51,3; 59,4) | 404,6 (386,6; 423,4) | 58,1 % (55,8; 60,4) |
| B (Yamagata) | 386,6 (351,5; 425,3) | 45,6 % (41,6; 49,7) | 601,8 (573,3; 631,6) | 61,7 % (59,5; 64,0) |
KI: Konfidensintervall
1Antal deltagare med tillgängligt resultat efter vaccination (för GMT).
2Antal deltagare med tillgängligt resultat både före och efter vaccination (för serokonversionsfrekvens).
3B-(Yamagata)-stammen ingick inte i Fluarix
Samtidig administrering
Samtidig administrering med pneumokockvacciner:
I den kliniska studien D-QIV-010 på 356 vuxna i åldern ≥ 50 år med risk för komplikationer till influensa och pneumokocksjukdomar, fick deltagarna Fluarix Tetra och ett 23-valent pneumokockpolysackaridvaccin (PPV23) antingen samtidigt eller icke-samtidigt. Immunsvaret var inte sämre i någon av de två behandlingsgrupperna vad avser samtliga fyra stammar i Fluarix Tetra och de sex pneumokockserotyper (1, 3, 4, 7F, 14 och 19A) i PPV23 som utvärderade i den förspecificerade analysen.
Baserat på publicerade data har immunologisk non-inferioritet visats för samtliga tre stammar i Fluarix och samtliga serotyper i det 13-valenta konjugerade pneumokockvaccinet (PCV13) hos vuxna i åldern 50‑59 år, och för 2 av 3 Fluarix-stammar och 12 av 13 PCV13-serotyper hos vuxna i åldern > 65 år. Ett sämre immunsvar för vissa pneumokockserotyper observerades när PCV13 gavs samtidigt med Fluarix jämfört med icke-samtidig administrering. Den kliniska betydelsen av denna observation är emellertid okänd.
Samtidig administrering med adjuvanterat herpes zostervaccin (Shingrix)
I den kliniska fas III-studien Zoster-004 randomiserades 828 vuxna i åldern ≥ 50 år till 2 doser Shingrix med 2 månaders mellanrum, administrerade samtidigt med den första dosen (N = 413) eller icke-samtidigt (N = 415) med en dos Fluarix Tetra. Immunologisk non-inferioritet mellan samtidig och icke-samtidig administrering visades för alla fyra stammar i Fluarix Tetra i termer av GMT för HAI-antikropp.
Samtidig administrering med mRNA-vaccin mot covid-19
I den kliniska studien Zoster-091 fick 988 vuxna i åldern ≥ 18 år Fluarix Tetra och en boosterdos av monovalent mRNA-1273-vaccin mot covid-19 (50 mikrogram) (ursprunglig SARS-CoV-2-stam) antingen samtidigt (N = 498) eller icke-samtidigt med två veckors mellanrum (N = 490). Immunologisk non-inferioritet mellan samtidig och icke-samtidig administrering påvisades för alla fyra stammar i Fluarix Tetra i termer av GMT för HAI-antikropp och för boosterdosen av mRNA-1273-vaccinet mot covid-19 i termer av GMC för anti‑S-protein-antikropp.
Farmakokinetiska egenskaper
Utvärdering av farmakokinetiska egenskaper krävs inte för vacciner.
Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi visade inte några särskilda risker för människa.
En reproduktions- och utvecklingsstudie med Fluarix visade inte några vaccinrelaterade effekter på honors fertilitet och dräktighet eller på embryofetal utveckling eller avkommors utveckling.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Natriumklorid
Dinatriumvätefosfatdodekahydrat
Kaliumdivätefosfat
Kaliumklorid
Magnesiumkloridhexahydrat
a-tokoferylvätesuccinat
Polysorbat 80
Oktoxinol 10
Vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
1 år
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C‑8°C).
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Stabilitetsdata tyder på att Fluarix är stabilt i 72 timmar vid förvaring i temperaturer upp till 25 °C. Vaccinet ska kasseras om det inte har använts inom denna tidsperiod. Denna information är endast avsedd som vägledning för hälso- och sjukvårdspersonal i händelse av tillfälliga temperaturavvikelser.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
FLUARIX injektioneste, suspensio, esitäytetty ruisku
15 mikrog HA/0,5 ml (L:ei) 10 x 1 annos (92,30 €)
PF-selosteen tieto
0,5 ml injektionsvätska, suspension i en förfylld spruta (typ I-glas) med kolvpropp (butylgummi) och ett gummiskyddslock.
Den förfyllda sprutans skyddslock och gummikolvpropp är av syntetiskt gummi.
Förpackningsstorlekar om 1 eller 10 doser med eller utan nål.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Suspensionen är färglös till lätt opaliserande.
Särskilda anvisningar för destruktion och övrig hantering
Vacciner ska inspekteras visuellt avseende eventuella främmande partiklar och/eller och fysiska aspekter före administrering. Vaccinet ska skakas väl före användning så att en färglös och svagt opaliserande vätska erhålls. Kassera om innehållet har ett annorlunda utseende.
Allt innehåll i sprutan ska injiceras.
Instruktioner för den förfyllda sprutan
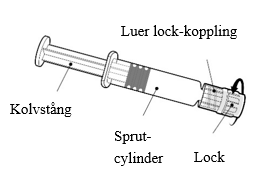 | Håll alltid i sprutcylindern, inte i kolvstången. Skruva av locket på sprutan genom att vrida det motsols. |
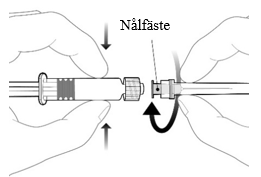 | Fäst nålen på sprutan genom att ansluta den till luerlock-kopplingen och vrid den ett kvarts varv medsols tills du känner att den låser sig. Dra inte ut kolvstången ur sprutcylindern, om detta sker ska vaccinet inte administreras. |
Destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
FLUARIX injektioneste, suspensio, esitäytetty ruisku
15 mikrog HA/0,5 ml 10 x 1 annos
- Ei korvausta.
Atc-kod
J07BB02
Datum för översyn av produktresumén
10.04.2025
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
