NIMBEX injektio/infuusioneste, liuos 2 mg/ml
not_interestedSaatavuushäiriö
Ei saatavilla
NIMBEX injektio/infuusioneste, liuos
- 2 mg/ml5 x 10 ml25.06.2024 - 20.08.2024
Saatavilla
Saman valmisteen muut pakkaukset ja/tai vaihtokelpoiset valmisteet
NIMBEX injektio/infuusioneste, liuos
- 2 mg/ml5 x 5 ml
CISATRACURIUM ACCORDPHARMA injektio-/infuusioneste, liuos
- 2 mg/ml5 x 5 ml
Vaikuttavat aineet ja niiden määrät
1 ml sisältää 2,68 mg sisatrakuuribesilaattia vastaten 2 mg sisatrakuuria.
Yksi 2,5 ml:n ampulli sisältää 5 mg sisatrakuuria.
Yksi 5 ml:n ampulli sisältää 10 mg sisatrakuuria.
Yksi 10 ml:n ampulli sisältää 20 mg sisatrakuuria.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektio-/infuusioneste, liuos
Kliiniset tiedot
Käyttöaiheet
Nimbex-injektioneste on tarkoitettu käytettäväksi aikuisille ja yli kuukauden ikäisille lapsille kirurgisissa ja muissa toimenpiteissä. Nimbex-injektioneste on myös tarkoitettu käytettäväksi aikuisille, jotka tarvitsevat tehohoitoa. Sitä käytetään yleisanestesian yhteydessä tai tehohoidossa sedaation lisänä, relaksoimaan luustolihaksistoa ja mahdollistamaan intubaatio ja mekaaninen hengitys.
Annostus ja antotapa
Nimbexiä tulee antaa vain anestesiologin tai sellaisen lääkärin toimesta tai valvonnassa, jolla on kokemusta hermo-lihasliitosta salpaavien lääkeaineiden käytöstä ja vaikutuksesta. Hengitysputken asettamista sekä keuhkotuuletuksen ylläpitämistä ja asianmukaista valtimoveren happeuttamista varten tarvittavat laitteistot on oltava saatavilla.
Huom: Nimbexiä ei tule sekoittaa samaan ruiskuun tai antaa samanaikaisesti saman neulan kautta propofoliemulsion tai emäksisten liuosten, kuten tiopentaalin, kanssa. (ks. kohta Yhteensopimattomuudet.).
Nimbex ei sisällä antimikrobisia säilytysaineita ja yksi ampulli on tarkoitettu käytettäväksi yhdelle potilaalle.
Monitorointi
Kuten muidenkin hermolihasliitosta salpaavien aineiden käytön yhteydessä, myös Nimbexin käytön aikana suositellaan hermolihasliitoksen toiminnan monitorointia annostuksen yksilöllistämiseksi.
Käyttö iv-boluksena
Aikuiset:
Trakeaalinen intubaatio. Suositeltu Nimbex-intubaatioannos aikuisille on 0,15 mg/kg. Tämä annos aikaansaa hyvät tai erinomaiset olosuhteet trakeaalista intubaatiota varten 120 sekunnissa injektion antamisesta propofolianestesiassa.
Suuremmat annokset lyhentävät hermolihasliitoksen salpautumisen saavuttamiseen kuluvaa aikaa.
Taulukko 1 on yhteenveto keskeisestä farmakodynamiikasta, kun Nimbexiä annettiin annoksina 0,1–0,4 mg/kg terveille aikuispotilaille opioidi- (tiopentaali/fentanyyli/midatsolaami) tai propofolianestesian aikana.
Taulukko 1: Farmakodynaamisten tietojen keskiarvot eri sisatrakuuriannoksilla
Nimbex alkuinj. mg/kg | anestesiamuoto | aika 90 % T1* suppressioon (minuuttia) | Aika max T1* suppressioon (minuuttia) | Aika 25 % spont. T1* palautum. (minuuttia) |
0,1 | opioidi | 3,4 | 4,8 | 45 |
0,15 | propofoli | 2,6 | 3,5 | 55 |
0,2 | opioidi | 2,4 | 2,9 | 65 |
0,4 | opioidi | 1,5 | 1,9 | 91 |
* T1 yksittäisen supistumisen vaste sekä adductor pollicis-lihaksen TOF-vasteen ensimmäinen komponentti ulnaris-hermon supramaksimaalisen sähköstimulaation seurauksena.
Enfluraani- ja isofluraanianestesia voivat pidentää Nimbex-alkuannoksen kliinisesti tehokasta vaikutusaikaa jopa 15 %.
Ylläpito. Hermolihasliitoksen salpausta voidaan pidentää antamalla Nimbex -ylläpitoannoksia. 0,03 mg/kg:n annos saa aikaan noin 20 lisäminuuttia kliinisesti riittävää lihasrelaksaatiota opioidi- tai propofolianestesiassa.
Tämän jälkeen annettavat ylläpitoannokset eivät pidennä vaikutusta progressiivisesti.
Spontaani palautuminen. Kun spontaani palautuminen lihasrelaksaatiosta on alkanut, nopeus on riippumaton annetusta Nimbex-annoksesta. Opioidi- tai propofolianestesiassa keskimääräiset palautumisajat 25 %:sta 75 %:iin ja 5 %:sta 95 %:iin ovat noin 13 ja 30 minuuttia.
Vaikutuksen kumoaminen. Nimbexillä aikaansaatu hermolihasliitoksen salpaus voidaan hyvin kumota käyttäen tavanomaisia annoksia antikoliiniesteraaseja. Keskimääräinen palautumisaika 25 %:sta 75 %:iin on noin 4 minuuttia ja täydelliseen kliiniseen palautumiseen (T4:T1 ≥ 0,7) noin 9 minuuttia, kun käytetään vaikutuksen kumoavaa ainetta keskimäärin tilanteessa 10 % T1.
Annostus lapsipotilaille:
Trakeaalinen intubaatio (lapset iältään 1 kk –12 vuotta): Kuten aikuisille, suositeltu Nimbex-intubaatioannos on 0,15 mg/kg annettuna nopeasti 5-10 sekuntia kestävänä injektiona. Tämä annos aikaansaa hyvät tai erinomaiset olosuhteet trakeaalista intubaatiota varten 120 sekunnissa Nimbex-injektion antamisesta. Tätä annosta koskevat farmakodynaamiset ominaisuudet on kuvattu taulukoissa 2, 3 ja 4.
Nimbexiä ei ole tutkittu intubaatioon ASA III-IV -luokkiin kuuluvilla lapsipotilailla. Nimbexin käytöstä alle 2-vuotiaille lapsipotilaille, joille tehdään pitkäkestoinen tai iso leikkaus, on vain rajoitetusti tietoa.
1 kk–12-vuotiailla lapsilla Nimbexin kliinisesti tehokas aika on lyhyempi ja spontaani palautuminen on nopeampi kuin aikuisilla vastaavissa anestesiaolosuhteissa. Ikäryhmien 1–11 kuukautta ja 1–12 vuotta farmakodynaamisissa profiileissa havaittiin pieniä eroja, jotka on esitetty yhteenvedonomaisesti taulukoissa 2 ja 3.
Taulukko 2: 1–11 kk:n ikäiset lapset
Nimbex- annos mg/kg | anestesiamuoto | aika 90 % suppressioon (minuuttia) | aika max suppressioon (minuuttia) | aika 25 % spont. T1* palautum. (minuuttia) |
0,15 | halotaani | 1,4 | 2,0 | 52 |
0,15 | opioidi | 1,4 | 1,9 | 47 |
Taulukko 3: 1–12-vuotiaat lapset
Nimbex- annos mg/kg | anestesiamuoto | aika 90 % suppressioon (minuuttia) | aika max suppressioon (minuuttia) | aika 25 % spont. T1* palautum. (minuuttia) |
0,15 | halotaani | 2,3 | 3,0 | 43 |
0,15 | opioidi | 2,6 | 3,6 | 38 |
Kun Nimbexiä ei tarvita intubointiin:Alle 0,15 mg/kg:n annosta voidaan käyttää. Farmakodynaamiset ominaisuudet annoksilla 0,08 ja 0,1 mg/kg 2–12-vuotiaille lapsipotilaille on kuvattu taulukossa 4.
Taulukko 4: 2–12 –vuotiaat lapset
Nimbex- annos mg/kg | anestesiamuoto | aika 90 % suppressioon (minuuttia) | aika max suppressioon (minuuttia) | aika 25 % spont. T1 palautum. (minuuttia) |
0,08 | halotaani | 1,7 | 2,5 | 31 |
0,1 | opioidi | 1,7 | 2,8 | 28 |
Nimbexin antoa suksametoniumin jälkeen ei ole tutkittu lapsipotilailla (ks. kohta Yhteisvaikutukset.).
Halotaanin voidaan odottaa pidentävän Nimbex-annoksen kliinisesti tehokasta vaikutusaikaa noin 20 %:lla. Nimbexin käytöstä lapsilla muiden halogenoitujen fluorohiilianestesia-aineiden kanssa ei ole tietoja, mutta myös näiden aineiden voidaan olettaa pidentävän Nimbex-annoksen kliinisesti tehokasta vaikutusaikaa.
Ylläpito (2–12-vuotiailla lapsipotilailla). Lihasrelaksaatiota voidaan pitää yllä antamalla Nimbex-ylläpitoannoksia. 2–12 vuotiailla lapsipotilailla 0,02 mg/kg:n annos saa aikaan noin 9 minuuttia lisää kliinisesti riittävää lihasrelaksaatiota halotaanianestesian yhteydessä. Tämän jälkeen annettavat ylläpitoannokset eivät pidennä vaikutusta progressiivisesti.
Käytettävissä ei ole riittävästi tietoa, jotta voitaisiin antaa suositukset ylläpitoannostuksesta alle 2-vuotiaille lapsille. Kuitenkin hyvin rajoitetut tiedot alle 2-vuotiailla lapsilla tehdyistä kliinisistä tutkimuksista antavat aiheen olettaa, että 0,03 mg/kg:n ylläpitoannos saattaa pidentää kliinisesti tehokasta hermolihasliitoksen salpautumista 25 minuutilla opioidianestesiassa.
Spontaani palautuminen. Kun spontaani palautuminen on alkanut, palautumisnopeus ei ole riippuvainen annetusta Nimbex-annoksesta. Opioidi- tai halotaanianestesiassa keskimääräinen palautumisaika 25 %:sta 75 %:iin on noin 11 minuuttia ja 5 %:sta 95 %:iin noin 28 minuuttia.
Vaikutuksen kumoaminen. Nimbexillä aikaansaatu hermolihasliitoksen salpaus voidaan hyvin kumota käyttäen tavanomaisia annoksia antikoliiniesteraaseja. Keskimääräinen palautumisaika 25 %:sta 75 %:iin on noin 2 minuuttia ja täydelliseen kliiniseen palautumiseen (T4:T1 ≥ 0,7) noin 5 minuuttia, kun käytetään vaikutuksen kumoavaa ainetta keskimäärin tilanteessa 13 % T1.
Käyttö iv-infuusiona
Annostus aikuisille ja 2–12 -vuotiaille lapsille
Lihasrelaksaatiota voidaan pitää yllä antamalla Nimbexiä infuusiona. Alkuinfuusionopeudeksi suositellaaan 3 µg/kg/min (0,18 mg/kg/h). Tällä ylläpidetään 89-99 % T1 suppressiota seuraten spontaanin palautumisen merkkejä. Kun lihasrelaksaatio on saatu stabiloitua, annoksen 1-2 µg/kg/min (0,06-0,12 mg/kg/h) pitäisi useimmilla potilailla riittää ylläpitämään lihasrelaksaatio tällä
tasolla.
Infuusionopeutta voi olla tarve pienentää jopa 40 % silloin, kun sitä annetaan isofluraani- tai enfluraanianestesian yhteydessä (ks. kohta Yhteisvaikutukset.).
Infuusionopeus on riippuvainen infuusioliuoksen sisatrakuuripitoisuudesta, toivotusta lihasrelaksaation asteesta ja potilaan painosta. Taulukko 5 on ohjeellinen laimentamattoman Nimbexin annostelua varten
Taulukko 5: Nimbex 2 mg/ml:n infuusionopeus
Potilaan paino (kg) | Annos (µg/kg/min) | Infuusionopeus | |||
1,0 | 1,5 | 2,0 | 3,0 | ||
20 | 0,6 | 0,9 | 1,2 | 1,8 | ml/h |
70 | 2,1 | 3,2 | 4,2 | 6,3 | ml/h |
100 | 3,0 | 4,5 | 6,0 | 9,0 | ml/h |
Tasanopeuksinen jatkuva Nimbex-infuusio ei johda lihasrelaksaation progressiiviseen lisääntymiseen tai vähenemiseen. Nimbex-infuusion jälkeen spontaani palautuminen lihasrelaksaatiosta etenee samassa ajassa kuin yksittäisen boluksen antamisen jälkeen.
Annostus vastasyntyneille (alle 1 kk)
Nimbexin käyttöä vastasyntyneille ei suositella, koska sitä ei ole tutkittu tässä potilasryhmässä.
Annostus vanhuksille
Annoksia ei tarvitse muuttaa vanhuksille. Näillä potilailla Nimbexin farmakodynaaminen profiili on samankaltainen kuin nuorilla aikuisilla, mutta kuten muiden lihasrelaksanttien kohdalla, vaikutus saattaa alkaa jonkin verran hitaammin.
Annostus potilaille, joiden munuaistoiminta on heikentynyt
Annoksia ei tarvitse muuttaa potilaille, joiden munuaistoiminta on heikentynyt. Näillä potilailla Nimbexin farmakodynaaminen profiili on samankaltainen kuin potilailla, joiden munuaistoiminta on normaali, mutta vaikutus saattaa alkaa jonkin verran hitaammin.
Annostus potilaille, joiden maksan toiminta on heikentynyt
Annoksia ei tarvitse muuttaa potilaille, joiden maksan toiminta on voimakkaasti heikentynyt. Näillä potilailla Nimbexin farmakodynaaminen profiili on samanlainen kuin potilailla, joiden maksan toiminta on normaali, mutta vaikutus voi alkaa nopeammin.
Annostus potilaille, joilla on sydän/verisuonisairaus
Kun Nimbexiä on annettu sydämen ohitusleikkauksessa nopeana bolusinjektiona (kesto 5 - 10 s) aikuispotilaille, joilla on vakava sydän/verisuonisairaus (New York Heart Association luokka I-III), tähän ei ole liittynyt kliinisesti merkittäviä sydän/verisuoni-vaikutuksia millään tutkitulla annoksella (ad 0,4 mg/kg = 8 x ED95). 0,3 mg/kg ylittävistä annoksista on kuitenkin vain vähän kokemuksia tällä potilasryhmällä.
Nimbexiä ei ole tutkittu lapsilla sydänkirurgiassa.
Annostus tehohoitopotilaille
Nimbexiä voidaan antaa aikuisille tehohoitopotilaille sekä boluksena että infuusiona.
Infuusion alkuannokseksi aikuisille tehohoitopotilaille suositellaan 3 µg/kg/min (0,18 mg/kg/h). Annostarve voi vaihdella paljon eri potilailla ja se voi lisääntyä tai vähentyä ajan kuluessa. Kliinisissä tutkimuksissa keskimääräinen infuusionopeus oli 3 µg/kg/min [vaihteluväli 0,5-10,2 µg/kg/min (0,03-0,6 mg/kg/h)].
Keskimääräinen spontaaniin täydelliseen palautumiseen kuluva aika pitkäaikaisen (jopa 6 päivää kestävän) Nimbex-infuusion jälkeen tehohoitopotilailla oli noin 50 minuuttia.
Palautuminen lihasrelaksaatiosta ei ole riippuvainen tehohoitopotilaille annetun Nimbex-infuusion kestosta.
Vasta-aiheet
Nimbex on kontraindisoitu potilaille, joiden tiedetään olevan yliherkkiä sisatrakuurille, atrakuurillle, tai bentseenisulfonihapolle.
Varoitukset ja käyttöön liittyvät varotoimet
Valmisteeseen liittyvät erityispiirteet
Sisatrakuuri lamaa hengitysteiden lihakset samoin kuin muut luustolihakset, mutta sillä ei tiedetä olevan vaikutusta tajunnan tasoon tai kipukynnykseen. Nimbexiä tulee antaa potilaalle vain anestesialääkärin tai muun lihasrelaksanttien käytön hyvin tuntevan lääkärin toimesta tai valvonnassa. Trakeaaliseen intubaatioon sekä keuhkojen ventilaation ja riittävän hapetuksen ylläpitoon tarvittavien laitteiden on oltava käytettävissä.
Varovaisuutta on noudatettava, kun Nimbexiä annetaan potilaille, joiden on osoitettu olevan yliherkkiä muille lihasrelaksanteille, koska tutkimuksissa allergisia ristireaktioita on esiintynyt usein (yli 50 %:lla) (ks. kohta Vasta-aiheet).
Sisatrakuurilla ei ole merkittäviä vagolyyttisiä tai ganglioita salpaavia ominaisuuksia. Siten Nimbexillä ei ole kliinisesti merkittävää vaikutusta pulssiin eikä se vaikuta estävästi bradykardiaan, jota monet anestesia-aineet ja nervus vaguksen ärsytys leikkauksen aikana aiheuttavat.
Potilaat, joilla on myastenia gravis tai jokin muu hermolihasliitoksen tauti ovat huomattavasti tavallista herkempiä non-depolarisoiville lihasrelaksanteille. Näille potilaille suositellaan korkeintaan 0,02 mg/kg Nimbex-alkuannosta.
Vakavat happo-emäs ja/tai seerumin elektrolyyttitasapainon häiriöt voivat lisätä tai vähentää potilaiden herkkyyttä lihasrelaksanteille.
Nimbexin käytöstä alle kuukauden ikäisille vastasyntyneille ei ole tietoa, koska sitä ei ole tutkittu tässä potilasryhmässä.
Nimbexiä ei ole tutkittu potilailla, joilla on ollut maligni hypertermia. Malignille hypertermialle herkillä sioilla sisatrakuuri ei laukaissut tätä oireyhtymää.
Sisatrakuuria ei ole tutkittu potilailla, joilla leikkaus suoritetaan hypotermiassa (25 – 28 °C:ssa). Kuten muidenkin hermolihasliitosta salpaavien aineiden kohdalla, oletetaan, että kirurgian ylläpitoon riittävään relaksaatioon tarvitaan näissä olosuhteissa tavallista alhaisempi infuusionopeus.
Sisatrakuuria ei ole tutkittu palovammapotilailla; kuten muidenkin non-depolarisoivien lihasrelaksanttien kohdalla, myös Nimbexiä annettaessa on otettava huomioon, että sitä voidaan tarvita suurempia annoksia ja vaikutuksen kesto voi olla lyhyempi.
Nimbex on hypotonista, eikä sitä saa antaa verensiirtoon käytettävään infuusioletkuun.
Tehohoitopotilaat:
Koe-eläimillä, joille on annettu suuria annoksia sisatrakuurin ja atrakuurin metaboliittia, laudanosiinia, on havaittu ohimenevää hypotensiota ja joillakin eläinlajeilla aivojen ärsytystä.
Herkimmillä eläinlajeilla näitä vaikutuksia on esiintynyt sellaisilla plasman laudanosiinipitoisuuksilla, joita on mitattu joillakin tehohoitopotilailla pitkäaikaisen atrakuuri-infuusion jälkeen.
Käytettäessä sisatrakuuria laudanosiinipitoisuudet plasmassa ovat noin kolmanneksen siitä kuin atrakuurin käytön yhteydessä, mikä on sopusoinnussa alemman infuusionopeuden kanssa.
Atrakuuria ja muita lääkkeitä saaneiden tehohoitopotilaiden on joskus raportoitu saaneen kouristuksia. Näillä potilailla on yleensä ollut yksi tai useampia sellaisia lääketieteellisiä ongelmia, jotka altistavat kouristuksille (esim. kallonmurtuma, enkefalopatia, aivoödeema, virusenkefaliitti, uremia). Syy-yhteyttä laudanosiiniin ei ole varmistettu.
Yhteisvaikutukset
Monien lääkkeiden on osoitettu vaikuttavan non-depolarisoivien lihasrelaksanttien vaikutuksen voimakkuuteen ja/tai kestoon, mm seuraavien:
Tehoa lisäävä vaikutus:
Anestesia-aineet, kuten enfluraani, isofluraani, halotaani (ks. kohta Annostus ja antotapa) ja ketamiini; muut non-depolarisoivat lihasrelaksantit tai muut lääkkeet, kuten antibiootit (aminoglykosidit, polymyksiinit, spektinomysiini, tetrasykliinit, linkomysiini ja klindamysiini), rytmihäiriölääkkeet (propranololi, kalsiumestäjät, lidokaiini, prokaiiniamidi ja kinidiini), diureetit (furosemidi ja mahdollisesti tiatsidit, mannitoli ja asetatsoliamidi), magnesium ja litiumsuolat sekä ganglioita salpaavat lääkkeet (trimetafaani, heksametoni).
Joskus harvoin tietyt lääkkeet voivat pahentaa latenttia myastenia gravista tai paljastaa sen tai jopa saada aikaan myastenisen oireyhtymän; tästä saattaa seurata lisääntynyt herkkyys non-depolarisoiville lihasrelaksanteille. Tällaisia lääkkeitä ovat erinäiset antibiootit, beetasalpaajat (propranololi, oksprenololi), rytmihäiriölääkkeet (prokaiiniamidi, kinidiini), reumalääkkeet (klorokiini, D-penisillamiini), trimetafaani, klooripromatsiini, steroidit, fenytoiini ja litium.
Suksametonin antaminen pidentämään non-depolarisoivien lihasrelaksanttien vaikutusta saattaa johtaa pidentyneeseen ja monimutkaiseen salpautumiseen, jota voi olla vaikea kumota antikoliiniesteraaseilla.
Tehoa vähentävä vaikutus:
Tehon vähenemistä on nähtävissä kroonisen fenytoiinin tai karbamatsepiinin käytön jälkeen.
Hoito antikoliiniesteraaseilla, esim. donepetsiililla, jota yleisesti käytetään Alzheimerin taudin hoitoon, voi lyhentää sisatrakuurilla saavutettavaa hermolihasliitoksen salpautumisaikaa ja heikentää sen voimakkuutta.
Ei vaikutusta:
Suksametonin käytöllä ennen Nimbexin antamista ei ole vaikutusta Nimbex-bolusinjektiolla saavutettavan lihasrelaksaation kestoon eikä se aiheuta tarvetta muuttaa infuusionopeutta.
Raskaus ja imetys
Raskaus
Nimbexin käytöstä raskauden aikana ei ole riittävästi tietoa. Eläinkokeet ovat riittämättömät, jotta lääkkeen vaikutus voitaisiin arvioida raskauteen, sikiönkehitykseen, synnytykseen ja postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta.
Nimbexiä ei tule käyttää raskauden aikana.
Imetys
Ei tiedetä erittyykö sisatrakuuri tai jokin sen metaboliitti äidinmaitoon.
Imeväiseen kohdistuvia riskejä ei voida poissulkea. Lyhyen puoliintumisajan vuoksi imeväiseen kohdistuvia vaikutuksia ei kuitenkaan ole odotettavissa, mikäli imetys aloitetaan uudelleen sen jälkeen kun lääkeaineen vaikutukset ovat hävinneet. Varmuuden vuoksi imetys on lopetettava hoidon ajaksi, ja imetystä on suositeltavaa välttää sisatrakuurin viiden puoliintumisajan verran eli kunnes viimeisestä annoksesta tai sisatrakuuri-infuusion päättymisestä on kulunut noin 3 tuntia.
Hedelmällisyys
Hedelmällisyystutkimuksia ei ole tehty.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Varoitus ei ole relevantti Nimbexin käytön yhteydessä. Nimbexiä käytetään aina yleisanestesian liitännäishoitona, joten on huomioitava tavanomaiset yleisanestesiaan liittyvät varotoimet.
Haittavaikutukset
Määriteltäessä haittavaikutusten frekvenssit hyvin yleisistä melko harvinaisiin käytettiin koottuja kliinisiä tutkimuksia. Haittavaikutusten frekvenssit määritellään seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1000, <1/100), harvinainen (≥1/10 000, <1/1000), hyvin harvinainen (<1/10 000).
Tiedot kliinisistä tutkimuksista | |
Sydän | |
Yleinen | Bradykardia |
Verisuonisto | |
Yleinen | Hypotensio |
Melko harvinainen | Ihon punoitus |
Hengityselimet, rintakehä ja välikarsina | |
Melko harvinainen | Bronkospasmi |
Iho ja ihonalainen kudos | |
Melko harvinainen | Ihottuma |
Tiedot markkinoilletulon jälkeen | |
Immuunijärjestelmä | |
Hyvin harvinainen | Anafylaktiset reaktiot, anafylaktinen sokki |
Vaikeusasteeltaan vaihtelevia anafylaktisia reaktioita, myös anafylaktista sokkia, on havaittu hermolihasliitosta salpaavien aineiden antamisen jälkeen. Vaikeita anafylaktisia reaktioita on raportoitu hyvin harvoin potilailla, jotka ovat saaneet Nimbexiä yhdessä yhden tai useamman anestesia-aineen kanssa. | |
Luusto, lihakset ja sidekudos | |
Hyvin harvinainen | Myopatia, lihasheikkous |
Lihasheikkoutta ja/tai myopatiaa on raportoitu vaikeasti sairailla tehohoitopotilailla, jotka ovat saaneet lihasrelaksantteja pitkään. Useimmat näistä potilaista saivat samanaikaisesti kortikosteroideja. Näitä haittavaikutuksia on raportoitu Nimbexin yhteydessä vain harvoin eikä syy-yhteyttä ole osoitettu. | |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta – tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Oireet
Pidentynyt lihasten paralyysi ja sen seuraukset ovat Nimbexin yliannostuksesta odotettavat oireet.
Hoito
On tärkeää ylläpitää mekaanista hengitystä ja hapetusta kunnes spontaani hengitys palaa riittävälle tasolle. Nukutuksen tulee olla täydellistä, sillä Nimbex ei heikennä tajunnan tasoa. Palautumista voidaan jouduttaa antamalla antikoliiniesteraaseja, silloin kun merkkejä spontaanin palautumisen alkamisesta on havaittavissa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Perifeerisesti vaikuttavat lihasrelaksantit, ATC-koodi: M03AC11.
Vaikutusmekanismi
Sisatrakuuri on keskipitkävaikutteinen non-depolarisoiva bentsyyli-isokinolini-lihasrelaksantti.
Farmakodynaamiset vaikutukset
Kliiniset lääketutkimukset ovat osoittaneet, että Nimbexin käyttöön ei liity annosriippuvaista histamiinin vapautumista edes käytettäessa 8 x ED95 annoksia.
Sisatrakuuri sitoutuu kolinergisiin reseptoreihin motorisessa päätelevyssä ja kumoaa asetyylikoliinin vaikutusta; seurauksena on hermolihasliitoksessa tapahtuvan välityksen kompetitiivinen salpaantuminen. Tämä vaikutus voidaan helposti kumota käyttäen antikoliiniesteraaseja, esim. neostigmiinia tai edrofonia.
Sisatrakuurin ED95 :n (annos joka tarvitaan salpaamaan adductor pollicis-lihaksessa ulnaris-hermon stimulaation seurauksena syntyvä supistumisvaste 95 %:sesti) arvioidaan olevan noin 0,05 mg/kg opioidi (tiopentaali, fentanyyli, midatsolaami) -anestesian yhteydessä.
Sisatrakuurin ED95 lapsilla halotaanianestesian yhteydessä on 0,04 mg/kg.
Farmakokinetiikka
Biotransformaatio/eliminaatio
Sisatrakuuri hajoaa elimistössä fysiologisen pH:n ja lämpötilan vallitessa ns. Hofmann eliminaation (kemiallinen tapahtuma) kautta muodostaen laudanosiinia ja monokvaternaarista akrylaattimetaboliittia. Tämä monokvaternaarinen akrylaatti hydrolysoituu epäspesifisten plasman esteraasien avulla muodostaen monokvaternaarisen alkoholimetaboliitin. Sisatrakuurin eliminaatio on suurelta osin riippumaton elimistöstä, mutta maksa ja munuaiset ovat sen metaboliittien ensisijaisia poistumisteitä.
Näillä metaboliiteilla ei ole lihasrelaksaatiota aikaansaavia vaikutuksia.
Farmakokinetiikka aikuispotilailla
Sisatrakuurin farmakokinetiikka on tutkitulla annosvälillä (0,1 - 0,2 mg/kg, ts. 2 - 4 x ED95) riippumatonta käytetystä annoksesta.
Farmakokineettiset väestötutkimukset vahvistavat nämä tulokset ja laajentavat ne annokseen 0,4 mg/kg (8 x ED95) saakka. Alla oleva taulukko on yhteenveto farmakokineettisistä parametreistä terveille aikuisille leikkauspotilaille annettujen 0,1 ja 0,2 mg/kg Nimbex-annosten jälkeen.
Parametri | Keskimääräisten arvojen ala- ja ylärajat |
Puhdistuma | 4,7 - 5,7 ml/min/kg |
Jakautumistilavuus steady state tilanteessa | 121 - 161 ml/kg |
Eliminaation puoliintumisaika | 22 - 29 min |
Farmakokinetiikka vanhuspotilailla
Sisatrakuurin farmakokinetiikassa ei ole kliinisesti merkittäviä eroja vanhusten ja nuorten aikuisten välillä. Palautumisprofiili on myös samanlainen.
Farmakokinetiikka potilailla, joilla on munuaisten tai maksan toiminnanvajaus
Sisatrakuurin farmakokinetiikassa ei ole kliinisesti merkittäviä eroja vaikeasta munuaisten tai maksan toiminnanvajauksesta kärsivien potilaiden ja terveiden aikuispotilaiden välillä. Myös palautumisprofiilit ovat samanlaiset.
Farmakokinetiikka, kun sisatrakuuri annetaan infuusiona
Sisatrakuurin farmakokinetiikka Nimbex-infuusioiden yhteydessä on samanlainen kuin yksittäisten bolusinjektioiden antamisen yhteydessä. Palautuminen Nimbex-infuusion jälkeen on riippumaton infuusion kestosta ja on samanlainen kuin yksittäisen bolusinjektion jälkeen.
Farmakokinetiikka tehohoitopotilailla
Sisatrakuurin farmakokinetiikka tehohoitopotilailla, jotka saavat pitkäaikaisia infuusioita on samanlainen kuin terveillä aikuisilla leikkauspotilailla, jotka saavat infuusioita tai bolusinjektioita. Tehohoitopotilaiden palautuminen Nimbex-infuusioiden jälkeen on riippumaton infuusion kestosta.
Metaboliittien pitoisuudet ovat korkeampia sellaisilla tehohoitopotilailla, joiden munuaisten ja/tai maksan toiminta poikkeaa normaalista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.). Näillä metaboliiteilla ei ole vaikutusta hermolihasliitoksen salpaukseen.
Prekliiniset tiedot turvallisuudesta
Akuutti toksisuus
Sisatrakuurilla ei ole voitu suorittaa sellaisia akuuttia toksisuutta koskevia tutkimuksia, joilla olisi merkitystä. Oireiden osalta ks. kohta Yliannostus.
Subakuutti toksisuus
Koirilla ja apinoilla tehdyt kolme viikkoa kestäneet tutkimukset, joissa annettiin toistuvia annoksia sisatrakuuria, eivät osoittaneet merkkejä yhdisteeseen liittyvästä toksisuudesta.
Mutageenisuus
Sisatrakuuri ei ollut mutageeninen in vitro mikrobitutkimuksessa, jossa pitoisuus oli ylimmillään 5000 µg/malja.
Rotilla tehdyssä in vivo sytogeneettisessa tutkimuksessa ei havaittu merkittäviä kromosomipoikkeamia s.c.-annoksilla ad 4 mg/kg.
Sisatrakuuri oli mutageeninen in vitro hiiren lymfoomasolumutageenisuustutkimuksessa 40 µg/ml ja sen ylittävillä pitoisuuksilla.
Yksittäinen mutageeninen tulos lääkkeellä, jota käytetään harvoin ja/tai lyhyen ajan, ei liene kliinisesti merkittävä.
Karsinogeenisuus
Karsinogeenisuustutkimuksia ei ole suoritettu.
Lisääntymistoksisuus
Fertiliteettitutkimuksia ei ole tehty. Lisääntymistutkimukset rotilla eivät ole osoittaneet sisatrakuurilla olevan haitallisia vaikutuksia sikiönkehitykseen.
Paikallinen siedettävyys
Kaneilla tehty valtimonsisäinen tutkimus osoitti, että Nimbex on hyvin siedettyä. Lääkkeen aiheuttamia muutoksia ei havaittu.
Farmaseuttiset tiedot
Apuaineet
Bentseenisulfonihappoliuos 32 % w/v
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Sisatrakuurin on osoitettu hajoavan nopeammin Ringerin laktaatissa ja Ringerin laktaatissa, johon on lisätty 5 % glukoosia kuin infuusioliuoksissa, jotka on lueteltu kohdassa Käyttö- ja käsittelyohjeet.
Tästä syystä suositellaan, että näitä Ringerin liuoksia ei käytetä Nimbex-infuusion valmistamisessa.
Koska Nimbex pysyy stabiilina vain happamissa liuoksissa, sitä ei tule sekoittaa samassa ruiskussa tai antaa samanaikaisesti tai saman neulan kautta emäksisten liuosten, kuten natriumtiopentaalin, kanssa. Nimbex ei sovi käytettäväksi yhdessä ketorolaakki-trometamolin tai injisoitavan propofoliemulsion kanssa.
Kestoaika
Kestoaika ennen laimentamista: 2 vuotta.
Käyttökuntoon saattamisen jälkeen valmiste säilyy kemiallisesti ja fysikaalisesti stabiilina ainakin 24 tuntia 5 °C:ssa ja 25 °C:ssa (ks. kohta Käyttö- ja käsittelyohjeet).
Mikrobiologisista syistä valmiste tulisi käyttää välittömästi. Jos valmistetta ei käytetä välittömästi, säilytysaika ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä normaalisti saa ylittää 24 tuntia 2-8 °C:ssa, mikäli käyttökuntoon saattaminen ei ole tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Ohjeet laimennetun lääkevalmisteen säilytyksestä, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NIMBEX injektio/infuusioneste, liuos
2 mg/ml 5 x 10 ml (71,34 €), 5 x 5 ml (38,13 €)
PF-selosteen tieto
5 x 2,5 ml, 5 x 5 ml, 5 x 10 ml
Tyypin I kirkas lasiampulli.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkasta, lähes väritöntä, lievästi kellertävää/vihertävänkellertävää. Käytännöllisesti katsoen ilman näkyviä hiukkasia.
Käyttö- ja käsittelyohjeet
Valmiste on tarkoitettu käytettäväksi yhdellä käyttökerralla. Vain kirkasta ja melkein väritöntä tai hieman kellertävää/vihertävänkellertävää liuosta tulee käyttää. Valmiste tulee tarkistaa visuaalisesti ennen käyttöä. Jos liuoksen ulkonäössä todetaan muutosta tai jos ampulli/lasipullo on rikkoutunut, se täytyy hävittää. Injektiopullo on otettava pois jääkaapista ja sen on annettava lämmetä huoneenlämpöiseksi ennen neulan asettamista pulloon.
Laimennettuna pitoisuuteen 0,1 - 2 mg/ml Nimbex on fysikaalisesti ja kemiallisesti käyttökelpoista 24 tuntia kun se säilytetään 5 - 25 °C:ssa. Laimennukseen tulee käyttää seuraavia infuusioliuoksia joko polyvinyylikloridi- tai polypropyleenipusseissa:
NaCl (0,9 % w/v)
Glukoosi (5 % w/v)
NaCl (0,18 % w/v) + Glukoosi (4 % w/v)
NaCl (0,45 % w/v) + Glukoosi (2,5 % w/v)
Koska valmiste ei sisällä antimikrobisia säilytysaineita, laimennus tulee tehdä välittömästi ennen käyttöä. Jos tämä ei ole mahdollista, laimennettu liuos tulee säilyttää kohdassa Kestoaika annetun ohjeistuksen mukaisesti.
Nimbexin on osoitettu olevan yhteensopiva seuraavien leikkausten yhteydessä yleisesti käytettävien lääkkeiden kanssa, kun se on sekoitettu niihin olosuhteissa, jotka simuloivat sen antamista sivukanyylin kautta juoksevaan iv-infuusioon : alfentaniilihydrokloridi, droperidoli, fentanyylisitraatti, midatsolaamihydrokloridi ja sufentaniilisitraatti.
Kun muita lääkkeitä annetaan saman kiinteän neulan tai kanyylin kautta kuin Nimbexiä, suositellaan, että kukin lääke huuhdellaan riittävällä volyymillä sopivaa iv-nestettä, esim NaCl (0,9 % w/v).
Annettaessa Nimbexiä pieneen suoneen, se tulee huuhdella soveltuvalla iv-nesteellä, esim. NaCl (0,9 % w/v), kuten muutkin suonensisäisesti annosteltavat lääkkeet.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
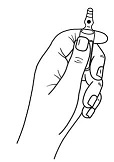
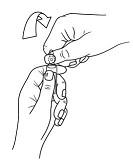
Ampullin avausohjeet (soveltuvat vain 2 mg/ml ampullille)
Ampulleissa on ns. OPC (One Point Cut) -avausmekanismi ja ne on avattava seuraavasti:
- Pidä kädellä kiinni ampullin alaosasta kuten kuvassa 1.
- Laita toinen käsi ampullin yläosaan peukalo värillisen pisteen päälle ja katkaise ampullin kaula kuten kuvassa 2.
Kuva 1
Kuva 2
Korvattavuus
NIMBEX injektio/infuusioneste, liuos
2 mg/ml 5 x 10 ml, 5 x 5 ml
- Ei korvausta.
ATC-koodi
M03AC11
Valmisteyhteenvedon muuttamispäivämäärä
30.09.2022
Yhteystiedot
Borupvang 3
2750 Ballerup
Denmark
+358 9 74790156
aspennordic@aspenpharma.eu
