TREMFYA injektioneste, liuos, esitäytetty ruisku 200 mg, TREMFYA PUSHPEN injektioneste, liuos, esitäytetty kynä 200 mg
Vaikuttavat aineet ja niiden määrät
Tremfya 200 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 200 mg guselkumabia 2 ml:ssa liuosta.
Tremfya 200 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 200 mg guselkumabia 2 ml:ssa liuosta.
Guselkumabi on ihmisen immunoglobuliini-G1-lambdan (IgG1λ) monoklonaalinen vasta-aine, joka tuotetaan yhdistelmä-DNA-tekniikalla kiinanhamsterin munasarjasoluissa.
Apuaine(et), joiden vaikutus tunnetaan
Tämä lääkevalmiste sisältää 1 mg:n polysorbaatti 80:tä (E433) per esitäytetty ruisku / esitäytetty kynä, mikä vastaa 0,5 mg:aa/ml.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste)
Injektioneste, liuos (injektioneste), esitäytetty kynä (PushPen)
Kliiniset tiedot
Käyttöaiheet
Haavainen paksusuolitulehdus
Tremfya on tarkoitettu keskivaikean tai vaikean aktiivisen haavaisen paksusuolitulehduksen hoitoon aikuisille potilaille, jotka eivät ole saaneet riittävää vastetta tavanomaiseen tai biologiseen hoitoon, joilla vaste on hävinnyt tai jotka eivät ole sietäneet tällaista hoitoa.
Crohnin tauti
Tremfya on tarkoitettu keskivaikean tai vaikean aktiivisen Crohnin taudin hoitoon aikuisille potilaille, jotka eivät ole saaneet riittävää vastetta tavanomaiseen tai biologiseen hoitoon, joilla vaste on hävinnyt tai jotka eivät ole sietäneet tällaista hoitoa.
Ehto
Valmiste on tarkoitettu käytettäväksi käyttöaiheessa mainitun sairauden diagnosointiin ja hoitoon perehtyneen lääkärin ohjauksessa ja seurannassa.
Annostus ja antotapa
Tämä lääkevalmiste on tarkoitettu käytettäväksi sen käyttöaiheisiin kuuluvien sairauksien diagnosointiin ja hoitoon perehtyneen lääkärin ohjauksessa ja seurannassa.
Annostus
Haavainen paksusuolitulehdus
Kumpaa tahansa seuraavista kahdesta induktiohoito-ohjelmasta suositellaan:
• 200 mg infuusiona laskimoon viikolla 0, viikolla 4 ja viikolla 8. Ks. Tremfya 200 mg infuusiokonsentraatin, liuosta varten, valmisteyhteenveto.
tai
• 400 mg injektiona ihon alle (kahtena peräkkäisenä injektiona, joista kumpikin on 200 mg) viikolla 0, viikolla 4 ja viikolla 8.
Induktiohoito-ohjelman päättymisen jälkeen suositeltu ylläpitoannos viikosta 16 alkaen on 100 mg injektiona ihon alle kahdeksan viikon välein. Jos potilaalla ei todeta kliinisen arvion perusteella riittävää hoidollista hyötyä induktiohoidosta, voidaan vaihtoehtoisesti harkita ylläpitoannosta 200 mg injektiona ihon alle viikosta 12 alkaen ja sen jälkeen neljän viikon välein (ks. kohta Farmakodynamiikka). Ks. 100 mg:n annosta koskevat tiedot Tremfya 100 mg injektionesteen, liuoksen, valmisteyhteenvedosta.
Immunomodulaattoreiden ja/tai kortikosteroidien käyttöä voidaan jatkaa guselkumabihoidon aikana. Jos potilas on saanut vasteen guselkumabihoitoon, kortikosteroidien käyttöä voidaan vähentää tai kortikosteroidihoito voidaan lopettaa tavanomaisen hoitokäytännön mukaisesti.
Jos potilaalla ei ole havaittu hoidollista hyötyä 24 viikon jälkeen, hoidon lopettamista pitää harkita.
Crohnin tauti
Kumpaa tahansa seuraavista kahdesta induktiohoito-ohjelmasta suositellaan:
- 200 mg infuusiona laskimoon viikolla 0, viikolla 4 ja viikolla 8. Ks. Tremfya 200 mg infuusiokonsentraatin, liuosta varten, valmisteyhteenveto.
tai
- 400 mg injektiona ihon alle (kahtena peräkkäisenä injektiona, joista kumpikin on 200 mg) viikolla 0, viikolla 4 ja viikolla 8.
Induktiohoito-ohjelman päättymisen jälkeen suositeltu ylläpitoannos viikosta 16 alkaen on 100 mg injektiona ihon alle kahdeksan viikon välein. Jos potilaalla ei todeta kliinisen arvion perusteella riittävää hoidollista hyötyä induktiohoidosta, voidaan vaihtoehtoisesti harkita ylläpitoannosta 200 mg injektiona ihon alle viikosta 12 alkaen ja sen jälkeen neljän viikon välein (ks. kohta Farmakodynamiikka). Ks. 100 mg:n annosta koskevat tiedot Tremfya 100 mg injektionesteen, liuoksen, valmisteyhteenvedosta.
Immunomodulaattoreiden ja/tai kortikosteroidien käyttöä voidaan jatkaa guselkumabihoidon aikana. Jos potilas on saanut vasteen guselkumabihoitoon, kortikosteroidien käyttöä voidaan vähentää tai kortikosteroidihoito voidaan lopettaa tavanomaisen hoitokäytännön mukaisesti.
Jos potilaalla ei ole havaittu hoidollista hyötyä 24 viikon jälkeen, hoidon lopettamista pitää harkita.
Väliin jäänyt annos
Jos annos on jäänyt väliin, se on annettava mahdollisimman pian. Sen jälkeen hoitoa jatketaan tavanomaisen hoitoaikataulun mukaisesti.
Erityiset potilasryhmät
Iäkkäät
Annoksen muuttaminen ei ole tarpeen (ks. kohta Farmakokinetiikka).
Iältään ≥ 65-vuotiaista potilaista on vähän tietoja, ja iältään ≥ 75-vuotiaista potilaista on hyvin vähän tietoja (ks. kohta Farmakokinetiikka).
Munuaisten tai maksan vajaatoiminta
Tremfya‑valmistetta ei ole tutkittu näillä potilasryhmillä. Näiden sairauksien ei yleisesti oleteta vaikuttavan merkittävästi monoklonaalisten vasta-aineiden farmakokinetiikkaan eikä annoksen muuttamista katsota tarpeelliseksi. Lisätietoja guselkumabin eliminaatiosta, ks. kohta Farmakokinetiikka.
Pediatriset potilaat
Tremfya‑valmisteen turvallisuutta ja tehoa lasten ja alle 18 vuoden ikäisten nuorten haavaisen paksusuolitulehduksen ja Crohnin taudin hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Vain ihon alle. Injektiokohtia ovat vatsa, reisi ja olkavarren takaosa. Tremfya-valmistetta ei pidä injisoida ihoalueille, missä on aristusta, mustelma, punoitusta, kovettuma, paksuuntumista tai hilseilyä.
Kun potilas on saanut asianmukaisen opastuksen ihon alle annettavien injektioiden injektiotekniikkaan, hän voi injisoida Tremfya‑injektiot itse, jos lääkäri katsoo sen tarkoituksenmukaiseksi. Lääkärin on kuitenkin varmistettava potilaan asianmukainen seuranta. Potilasta on neuvottava injisoimaan koko liuosmäärä kotelon sisältämien Käyttöohjeiden mukaisesti.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen valmistelusta ennen lääkkeen antoa.
Vasta-aiheet
Vakava yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Kliinisesti tärkeät aktiiviset infektiot (esim. aktiivinen tuberkuloosi, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Infektiot
Guselkumabi saattaa lisätä infektioiden riskiä. Jos potilaalla on kliinisesti tärkeä aktiivinen infektio, hoitoa ei saa aloittaa ennen kuin infektio on parantunut tai sitä on hoidettu riittävästi.
Guselkumabihoitoa saavia potilaita pitää kehottaa hakeutumaan lääkäriin, jos heille ilmaantuu kliinisesti tärkeän kroonisen tai akuutin infektion oireita tai löydöksiä. Jos potilaalle kehittyy kliinisesti tärkeä tai vakava infektio tai potilas ei saa hoitovastetta tavanomaiseen hoitoon, potilaan tilaa on seurattava tarkoin ja hoito on keskeytettävä, kunnes infektio on parantunut.
Tuberkuloosin tutkiminen ennen hoitoa
Potilailta on tutkittava tuberkuloosi-infektio ennen hoidon aloittamista. Guselkumabihoitoa saavia potilaita pitää seurata hoidon aikana ja sen jälkeen aktiivisen tuberkuloosin oireiden ja löydösten havaitsemiseksi. Jos potilaalla on aiemmin ollut piilevä tai aktiivinen tuberkuloosi, jonka riittävästä hoidosta ei voida varmistua, tuberkuloosihoidon antamista on harkittava ennen hoidon aloittamista.
Yliherkkyys
Valmisteen markkinoille tulon jälkeen on raportoitu vakavia yliherkkyysreaktioita, mukaan lukien anafylaksiaa (ks. kohta Haittavaikutukset). Osa vakavista yliherkkyysreaktioista ilmeni useita päiviä guselkumabihoidon jälkeen, mukaan lukien tapaukset, joihin liittyi urtikariaa ja hengenahdistusta. Jos ilmaantuu vakava yliherkkyysreaktio, guselkumabin antaminen on lopetettava heti, ja asianmukainen hoito on aloitettava.
Kohonnut maksan transaminaasipitoisuus
Nivelpsoriaasia koskeneissa kliinisissä tutkimuksissa suurentuneiden maksaentsyymipitoisuuksien ilmaantuvuus oli guselkumabihoitoa neljän viikon välein saaneilla potilailla suurempi kuin guselkumabihoitoa kahdeksan viikon välein tai lumehoitoa saaneilla potilailla (ks. kohta Haittavaikutukset).
Määrättäessä guselkumabia neljän viikon välein nivelpsoriaasin hoitoon maksaentsyymipitoisuus suositellaan arvioimaan hoitoa aloitettaessa ja sen jälkeen potilaan tavanomaisen hoidon mukaisesti. Jos alaniiniaminotransferaasiarvon (ALAT) tai aspartaattiaminotransferaasiarvon (ASAT) havaitaan suurentuneen ja epäillään lääkeaineen aiheuttamaa maksavauriota, hoito pitää keskeyttää tilapäisesti, kunnes diagnoosi on suljettu pois.
Rokotukset
Kaikkien asianmukaisten rokotusten antamista voimassa olevien rokotusohjeiden mukaisesti on harkittava ennen hoidon aloittamista. Guselkumabihoitoa saaville potilaille ei saa antaa samanaikaisesti eläviä taudinaiheuttajia sisältäviä rokotteita. Vasteesta eläville tai inaktivoiduille rokotteille ei ole tietoja.
Ennen eläviä viruksia tai eläviä bakteereja sisältävien rokotusten antamista hoito pitää keskeyttää vähintään 12 viikoksi viimeisen annoksen antamisen jälkeen, ja hoitoa voidaan jatkaa aikaisintaan 2 viikon kuluttua rokotuksesta. Lääkkeen määräävän lääkärin pitää tarkistaa kyseisen rokotteen valmisteyhteenvedosta lisätiedot ja ohjeet immunosuppressiivisten aineiden samanaikaisesta käytöstä rokotuksen jälkeen.
Apuaineet, joiden vaikutus tunnetaan
Polysorbaatti 80 -pitoisuus
Tämä lääkevalmiste sisältää 1 mg:n polysorbaatti 80:tä (E433) per esitäytetty ruisku / esitäytetty kynä, mikä vastaa 0,5 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Yhteisvaikutukset CYP450:n substraattien kanssa
Keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavilla potilailla tehdyssä vaiheen I tutkimuksessa muutokset systeemisessä altistuksessa (Cmax ja AUCinf) midatsolaamille, S‑varfariinille, omepratsolille, dekstrometorfaanille ja kofeiinille eivät olleet guselkumabikerta-annoksen jälkeen kliinisesti oleellisia, mikä osoittaa, että yhteisvaikutukset guselkumabin ja eri CYP-entsyymien substraattien (CYP3A4, CYP2C9, CYP2C19, CYP2D6 ja CYP1A2) välillä eivät ole todennäköisiä. Annosmuutokset eivät ole tarpeen, jos guselkumabia ja CYP450:n substraatteja annetaan samanaikaisesti.
Samanaikainen immunosuppressiivinen hoito tai valohoito
Guselkumabin tehoa ja turvallisuutta yhdistelmänä immunosuppressiivisten lääkeaineiden, mukaan lukien biologisten lääkkeiden, tai valohoidon kanssa ei ole tutkittu psoriaasia koskevissa tutkimuksissa. Nivelpsoriaasitutkimuksissa metotreksaatin samanaikainen käyttö ei näyttänyt vaikuttavan guselkumabin turvallisuuteen tai tehoon.
Haavaista paksusuolitulehdusta ja Crohnin tautia koskeneissa tutkimuksissa immunomodulaattoreiden (esim. atsatiopriini, 6-merkaptopuriini) tai kortikosteroidien samanaikainen käyttö ei näyttänyt vaikuttavan guselkumabin turvallisuuteen tai tehoon.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisymenetelmää hoidon aikana ja vähintään 12 viikon ajan hoidon päättymisen jälkeen.
Raskaus
Guselkumabin käytöstä raskaana oleville naisille on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria eikä epäsuoria haitallisia vaikutuksia raskauteen, alkion tai sikiön kehitykseen, synnytykseen tai syntymänjälkeiseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi Tremfya‑valmisteen käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö guselkumabi ihmisillä äidinmaitoon. Ihmisen IgG:t erittyvät tunnetusti äidinmaitoon muutaman päivän ajan synnytyksen jälkeen. Pian sen jälkeen pitoisuudet pienenevät vähäisiksi. Näin ollen imetettävälle lapselle tänä ajanjaksona aiheutuvaa riskiä ei voida sulkea pois. On päätettävä, lopetetaanko imetys vai pidättäydytäänkö Tremfya-hoidosta ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille. Ks. kohdasta Prekliiniset tiedot turvallisuudesta tietoja guselkumabin erittymisestä eläinten (cynomolgus-apinoiden) maitoon.
Hedelmällisyys
Guselkumabin vaikutusta ihmisen hedelmällisyyteen ei ole tutkittu. Eläinkokeissa ei ole havaittu suoria tai epäsuoria haitallisia vaikutuksia hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tremfya‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisin haittavaikutus oli hengitystieinfektiot (kliinisissä tutkimuksissa esiintyvyys noin 8 % haavaista paksusuolitulehdusta sairastavilla potilailla, 11 % Crohnin tautia sairastavilla potilailla ja 15 % psoriaasia ja nivelpsoriaasia sairastavilla potilailla).
Tremfya-hoitoa saaneiden psoriaasia, nivelpsoriaasia, haavaista paksusuolitulehdusta tai Crohnin tautia sairastavien potilaiden kokonaisturvallisuusprofiili on samankaltainen.
Haittavaikutustaulukko
Taulukossa 1 luetellaan haittavaikutukset, joita esiintyi psoriaasia, nivelpsoriaasia, haavaista paksusuolitulehdusta ja Crohnin tautia koskeneissa kliinisissä tutkimuksissa sekä valmisteen markkinoille tulon jälkeen raportoidut haittavaikutukset. Haittavaikutukset on luokiteltu MedDRA-elinjärjestelmän ja esiintymistiheyden mukaan seuraavaa käytäntöä noudattaen: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Taulukko 1. Haittavaikutusluettelo | ||
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
| Infektiot | Hyvin yleinen | Hengitystieinfektiot |
| Melko harvinainen | Herpes simplex ‑infektiot | |
| Melko harvinainen | Silsainfektiot | |
| Melko harvinainen | Gastroenteriitti | |
| Immuunijärjestelmä | Harvinainen | Yliherkkyys |
| Harvinainen | Anafylaksia | |
| Hermosto | Yleinen | Päänsärky |
| Ruoansulatuselimistö | Yleinen | Ripuli |
| Iho ja ihonalainen kudos | Yleinen | Ihottuma |
| Melko harvinainen | Urtikaria | |
| Luusto, lihakset ja sidekudos | Yleinen | Nivelkipu |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Injektiokohdan reaktiot |
| Tutkimukset | Yleinen | Suurentunut transaminaasipitoisuus |
| Melko harvinainen | Pienentynyt neutrofiilien määrä | |
Valikoitujen haittavaikutusten kuvaus
Suurentunut transaminaasipitoisuus
Kahdessa vaiheen III kliinisessä nivelpsoriaasitutkimuksessa lumekontrolloitujen jaksojen aikana raportoitiin haittavaikutuksina suurentuneita transaminaasipitoisuuksia (joita olivat suurentunut ALAT-arvo, suurentunut ASAT-arvo, suurentunut maksaentsyymipitoisuus, suurentunut transaminaasipitoisuus, poikkeavuudet maksan toimintakokeissa, hypertransaminasemia) guselkumabihoitoa saaneissa ryhmissä (100 mg ihon alle neljän viikon välein saaneessa ryhmässä 8,6 % ja 100 mg ihon alle kahdeksan viikon välein saaneessa ryhmässä 8,3 %) yleisemmin kuin lumeryhmässä (4,6 %). Suurentuneita transaminaasiarvoja (kuten edellä) raportoitiin 1. vuonna haittavaikutuksina 12,9 %:lla potilaista hoitoa neljän viikon välein saaneessa ryhmässä ja 11,7 %:lla potilaista hoitoa kahdeksan viikon välein saaneessa ryhmässä.
Transaminaasipitoisuuden (ASAT ja ALAT) suureneminen oli laboratoriotutkimusten perusteella useimmiten ≤ 3 x ULN (ULN = upper limit of normal, viitearvojen yläraja). Transaminaasipitoisuus suureni harvoin tasoille > 3 – ≤ 5 x ULN ja > 5 x ULN, ja tällaista havaittiin guselkumabihoitoa neljän viikon välein saaneessa ryhmässä useammin kuin guselkumabihoitoa kahdeksan viikon välein saaneessa ryhmässä (taulukko 2). Kaksi vuotta kestäneen vaiheen III kliinisen nivelpsoriaasitutkimuksen loppuun mennessä havaittiin, että esiintyvyys vaikeusasteittain ja hoitoryhmittäin oli samankaltainen.
| Taulukko 2. Suurentuneen transaminaasipitoisuuden esiintyvyys lähtötilanteen jälkeen kahdessa vaiheen III kliinisessä nivelpsoriaasitutkimuksessa | |||||
| 24 viikon aikanaa | 1 vuoden aikanab | ||||
Lumelääke N = 370c | guselkumabi 100 mg 8 viikon välein N = 373c | guselkumabi 100 mg 4 viikon välein N = 371c | guselkumabi 100 mg 8 viikon välein N = 373c | guselkumabi 100 mg 4 viikon välein N = 371c | |
| ALAT | |||||
| > 1 – ≤ 3 x ULN | 30,0 % | 28,2 % | 35,0 % | 33,5 % | 41,2 % |
| > 3 – ≤ 5 x ULN | 1,4 % | 1,1 % | 2,7 % | 1,6 % | 4,6 % |
| > 5 x ULN | 0,8 % | 0,8 % | 1,1 % | 1,1 % | 1,1 % |
| ASAT | |||||
| > 1 – ≤ 3 x ULN | 20,0 % | 18,8 % | 21,6 % | 22,8 % | 27,8 % |
| > 3 – ≤ 5 x ULN | 0,5 % | 1,6 % | 1,6 % | 2,9 % | 3,8 % |
| > 5 x ULN | 1,1 % | 0,5 % | 1,6 % | 0,5 % | 1,6 % |
| a lumekontrolloitu jakso b mukana ei ole lumehoitoon lähtötilanteessa satunnaistettuja ja myöhemmin guselkumabihoitoon siirtyneitä potilaita c niiden potilaiden lukumäärä, joista ajanjakson aikana vähintään yksi lähtötilanteen jälkeen tehty tietyn laboratoriokokeen tulos | |||||
Kliinisissä psoriaasitutkimuksissa ensimmäisen vuoden aikana suurentuneen transaminaasipitoisuuden (ALAT ja ASAT) esiintyvyys oli guselkumabihoitoa kahdeksan viikon välein saaneessa ryhmässä samankaltainen kuin kliinisissä nivelpsoriaasitutkimuksissa guselkumabihoitoa kahdeksan viikon välein saaneessa ryhmässä. Suurentuneiden transaminaasipitoisuuksien ilmaantuvuus ei lisääntynyt viiden vuoden aikana kutakin guselkumabihoitovuotta kohden arvioituna. Transaminaasipitoisuuksien suureneminen oli useimmiten ≤ 3 x ULN.
Transaminaasipitoisuuden suureneminen oli useimmiten ohimenevää eikä johtanut hoidon lopettamiseen.
Yhdistetyissä vaiheen II ja vaiheen III kliinisissä Crohnin tautia koskeneissa tutkimuksissa suurentuneita transaminaasipitoisuuksia (käsittää suurentuneen ALAT-arvon, suurentuneen ASAT-arvon, suurentuneen maksaentsyymipitoisuuden, suurentuneen transaminaasipitoisuuden ja suurentuneet maksan toimintakokeiden tulokset) koskevia haittavaikutuksia raportoitiin koko lumekontrolloidun induktiojakson (viikot 0–12) aikana yleisemmin guselkumabihoitoa saaneissa ryhmissä (1,7 %:lla potilaista) kuin lumeryhmässä (0,6 %:lla potilaista). Yhdistetyissä vaiheen II ja vaiheen III kliinisissä Crohnin tautia koskeneissa tutkimuksissa suurentuneita transaminaasipitoisuuksia (käsittää suurentuneen ALAT-arvon, suurentuneen ASAT-arvon, suurentuneen maksaentsyymipitoisuuden, suurentuneen transaminaasipitoisuuden, poikkeavan maksan toiminnan ja suurentuneet maksan toimintakokeiden tulokset) koskevia haittavaikutuksia raportoitiin noin yhden vuoden raportointijakson aikana 3,4 %:lla potilaista 200 mg guselkumabia ihon alle neljän viikon välein saaneessa hoitoryhmässä ja 4,1 %:lla potilaista 100 mg guselkumabia ihon alle kahdeksan viikon välein saaneessa hoitoryhmässä verrattuna 2,4 %:iin lumeryhmässä.
Yhdistetyissä vaiheen II ja vaiheen III kliinisissä Crohnin tautia koskeneissa tutkimuksissa tehtyjen laboratoriotutkimusten perusteella kohonneiden ALAT- tai ASAT-arvojen yleisyys oli pienempi kuin nivelpsoriaasia koskeneissa vaiheen III kliinisissä tutkimuksissa. Yhdistettyjen vaiheen II ja vaiheen III kliinisten Crohnin tautia koskeneiden tutkimusten lumekontrolloidun jakson (viikko 12) aikana guselkumabihoitoa saaneilla potilailla raportoitiin tasolle ≥ 3 x ULN kohonneita ALAT-arvoja (< 1 %:lla potilaista) ja ASAT-arvoja (< 1 %:lla potilaista). Yhdistetyissä vaiheen II ja vaiheen III kliinisissä Crohnin tautia koskeneissa tutkimuksissa tasolle ≥ 3 x ULN kohonneita ALAT-arvoja ja/tai ASAT-arvoja raportoitiin noin yhden vuoden raportointijakson aikana 2,7 %:lla potilaista 200 mg guselkumabia ihon alle neljän viikon välein saaneessa ryhmässä ja 2,6 %:lla potilaista 100 mg guselkumabia ihon alle kahdeksan viikon välein saaneessa ryhmässä verrattuna 1,9 %:iin lumeryhmässä. Transaminaasipitoisuuden suureneminen oli useimmiten ohimenevää eikä johtanut hoidon keskeyttämiseen.
Pienentynyt neutrofiilimäärä
Pienentyneitä neutrofiilimääriä raportoitiin kahdessa vaiheen III kliinisessä nivelpsoriaasitutkimuksessa lumekontrolloidun jakson aikana haittavaikutuksena guselkumabihoitoa saaneessa ryhmässä (0,9 %) yleisemmin kuin lumeryhmässä (0 %). Pienentyneitä neutrofiilimääriä raportoitiin 1. vuonna haittavaikutuksena 0,9 %:lla guselkumabihoitoa saaneista potilaista. Veren neutrofiilimäärän väheneminen oli useimmiten lievää, ohimenevää, infektioon liittymätöntä, eikä se johtanut hoidon keskeyttämiseen.
Gastroenteriitti
Gastroenteriittiä esiintyi kahden vaiheen III kliinisen psoriaasitutkimuksen lumekontrolloidun jakson aikana yleisemmin guselkumabihoitoa saaneessa ryhmässä (1,1 %) kuin lumeryhmässä (0,7 %). Viikkoon 264 mennessä 5,8 % kaikista guselkumabihoitoa saaneista potilaista raportoi gastroenteriittiä. Haittavaikutuksena esiintyneet gastroenteriitit eivät olleet vakavia eivätkä johtaneet viikkoon 264 mennessä guselkumabihoidon keskeyttämiseen. Gastroenteriitin esiintyvyyden havaittiin olleen kliinisten nivelpsoriaasitutkimusten lumekontrolloidun jakson aikana samankaltainen kuin kliinisissä psoriaasitutkimuksissa.
Injektiokohdan reaktiot
Injektiokohdan reaktioita liittyi kahden vaiheen III kliinisen psoriaasitutkimuksen viikkoon 48 mennessä 0,7 %:iin guselkumabi‑injektioista ja 0,3 %:iin lumeinjektioista. Viikkoon 264 mennessä 0,4 %:iin guselkumabi-injektioista liittyi injektiokohdan reaktioita. Injektiokohdan reaktiot olivat yleensä vaikeusasteeltaan lieviä tai keskivaikeita, yksikään tapauksista ei ollut vakava; yksi tapaus johti guselkumabihoidon keskeyttämiseen.
Kahdessa vaiheen III kliinisessä nivelpsoriaasitutkimuksessa viikkoon 24 mennessä yhden tai useampia injektiokohdan reaktioita raportoineiden potilaiden lukumäärä oli pieni ja guselkumabiryhmissä hieman suurempi kuin lumeryhmässä: guselkumabihoitoa kahdeksan viikon välein saaneessa ryhmässä 5 (1,3 %) potilasta, guselkumabihoitoa neljän viikon välein saaneessa ryhmässä 4 (1,1 %) potilasta ja lumeryhmässä 1 (0,3 %) potilas. Yksi potilas lopetti guselkumabihoidon kliinisen nivelpsoriaasitutkimuksen lumekontrolloidun jakson aikana injektiokohdan reaktion vuoksi. Yhden tai useamman injektiokohdan reaktion raportoineiden potilaiden osuus 1. vuonna oli 1,6 % guselkumabihoitoa kahdeksan viikon välein saaneessa ryhmässä ja 2,4 % guselkumabihoitoa neljän viikon välein saaneessa ryhmässä. Sellaisten injektioiden lukumäärän, joihin liittyi injektiokohdan reaktioita, havaittiin olleen kliinisten nivelpsoriaasitutkimusten lumekontrolloidun jakson aikana yleisesti samankaltainen kuin kliinisissä psoriaasitutkimuksissa.
Vaiheen III kliinisessä haavaisen paksusuolitulehduksen ylläpitohoitoa koskeneessa tutkimuksessa viikkoon 44 mennessä yhden tai useampia guselkumabista aiheutuneita injektiokohdan reaktioita raportoineiden osuus oli 200 mg guselkumabia ihon alle neljän viikon välein (haavaisen paksusuolitulehduksen ylläpitohoitoa koskeneessa vaiheen III kliinisessä tutkimuksessa 200 mg guselkumabia annettiin kahtena 100 mg:n injektiona) saaneiden potilaiden ryhmässä 7,9 % (2,5 %:ssa injektioista). 100 mg guselkumabia ihon alle kahdeksan viikon välein saaneessa ryhmässä ei raportoitu injektiokohdan reaktioita. Valtaosa injektiokohdan reaktioista oli lieviä eikä yksikään niistä ollut vakava.
Vaiheen II ja vaiheen III kliinisissä Crohnin tautia koskeneissa tutkimuksissa viikkoon 48 mennessä yhden tai useampia guselkumabista aiheutuneita injektiokohdan reaktioita raportoineiden osuus oli 4,1 % (0,8 %:ssa injektioista) hoitoryhmässä, joka sai 200 mg guselkumabia laskimoon induktiohoitona ja sen jälkeen 200 mg guselkumabia ihon alle neljän viikon välein, ja 1,4 % potilaista (0,6 %:ssa injektioista) ryhmässä, joka sai 200 mg guselkumabia laskimoon induktiohoitona ja sen jälkeen 100 mg ihon alle kahdeksan viikon välein. Injektiokohdan reaktiot olivat kaiken kaikkiaan lieviä eikä yksikään niistä ollut vakava.
Vaiheen III kliinisessä Crohnin tautia koskeneessa tutkimuksessa viikkoon 48 mennessä yhden tai useampia guselkumabista aiheutuneita injektiokohdan reaktioita raportoineiden osuus oli 7 % (1,3 %:ssa injektioista) hoitoryhmässä, joka sai 400 mg ihon alle induktiohoitona ja sen jälkeen 200 mg ihon alle neljän viikon välein, ja 4,3 % potilaista (0,7 %:ssa injektioista) ryhmässä, joka sai 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 100 mg ihon alle kahdeksan viikon välein. Valtaosa injektiokohdan reaktioista oli lieviä eikä yksikään niistä ollut vakava.
Immunogeenisuus
Guselkumabin immunogeenisuutta tutkittiin herkän ja lääkettä sietävän immunomäärityksen avulla.
Vaiheen II ja vaiheen III yhdistetyissä psoriaasi- ja nivelpsoriaasipotilaiden analyyseissä 5 %:lle (n = 145) guselkumabihoitoa saaneista potilaista kehittyi lääkevasta-aineita enintään 52 viikon hoidon aikana. Niistä potilaista, joille lääkevasta-aineita kehittyi, noin 8 %:lla (n = 12) vasta-aineet luokiteltiin neutraloiviksi, mikä vastaa 0,4 %:a kaikista guselkumabihoitoa saaneista potilaista. Vaiheen III yhdistetyissä psoriaasipotilaiden analyyseissa todettiin, että hoitoviikkoon 264 mennessä lääkevasta-aineita oli kehittynyt noin 15 %:lle guselkumabihoitoa saaneista potilaista. Niistä potilaista, joille lääkevasta-aineita kehittyi, noin 5 %:lla vasta-aineet luokiteltiin neutraloiviksi, mikä vastaa 0,76 %:a kaikista guselkumabihoitoa saaneista potilaista. Lääkevasta-aineisiin ei liittynyt hoidon tehon heikkenemistä eikä injektiokohdan reaktioiden kehittymistä.
Vaiheen II ja vaiheen III yhdistetyissä analyyseissä niistä haavaista paksusuolitulehdusta sairastavista potilaista, jotka saivat induktiohoidon laskimoon ja sen jälkeen ylläpitohoitoa ihon alle, noin 12 %:lle (n = 58) guselkumabihoitoa enintään 56 viikon ajan saaneista potilaista kehittyi lääkevasta-aineita. Niistä potilaista, joille lääkevasta-aineita kehittyi, noin 16 %:lla (n = 9) oli neutraloiviksi luokiteltavia vasta-aineita, mikä vastaa 2 %:a kaikista guselkumabihoitoa saaneista potilaista. Vaiheen III analyysissa viikkoon 24 saakka, induktiohoidon ihon alle ja sen jälkeen ylläpitohoitoa ihon alle saaneista haavaista paksusuolitulehdusta sairastavista potilaista noin 9 %:lle (n = 24) guselkumabihoitoa saaneista potilaista kehittyi lääkevasta-aineita. Niistä potilaista, joille lääkevasta-aineita kehittyi, 13 %:lla (n = 3) oli neutraloiviksi luokiteltavia vasta-aineita, mikä vastaa 1 %:a guselkumabihoitoa saaneista potilaista. Lääkevasta-aineisiin ei liittynyt heikompaa tehoa eikä injektiokohdan reaktioiden kehittymistä.
Vaiheen II ja vaiheen III yhdistetyissä Crohnin tautia sairastavien potilaiden analyyseissä viikkoon 48 saakka guselkumabia laskimoon annettavana induktiohoitona ja sen jälkeen ihon alle annettavana ylläpitohoitona saaneista potilaista noin 5 %:lle (n = 30) kehittyi lääkevasta-aineita. Niistä potilaista, joille lääkevasta-aineita kehittyi, noin 7 %:lla (n = 2) oli neutraloiviksi luokiteltavia vasta-aineita, mikä vastaa 0,3 %:a guselkumabihoitoa saaneista potilaista. Vaiheen III analyysissä viikkoon 48 saakka Crohnin tautia sairastavista potilaista, jotka saivat guselkumabihoitoa ihon alle annettavana induktiohoitona ja sen jälkeen ihon alle annettavana ylläpitohoitona, noin 9 %:lle (n = 24) kehittyi lääkevasta-aineita. Näistä potilaista 13 %:lla (n = 3) oli vasta-aineita, jotka luokiteltiin neutraloiviksi vasta-aineiksi, mikä vastaa 1 %:a guselkumabihoitoa saaneista potilaista. Lääkevasta-aineisiin ei liittynyt hoidon tehon heikkenemistä eikä injektiokohdan reaktioiden kehittymistä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa guselkumabia on annettu laskimoon enintään annoksina 1 200 mg sekä ihon alle enintään annoksina 400 mg yhdellä lääkkeen antoon liittyneellä käynnillä, eikä annosta rajoittavaa toksisuutta esiintynyt. Yliannostapauksessa potilasta on seurattava haittavaikutusten oireiden ja löydösten havaitsemiseksi, ja tarkoituksenmukaista oireenmukaista hoitoa on annettava heti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunosuppressantit, interleukiinin estäjät, ATC-koodi: L04AC16.
Vaikutusmekanismi
Guselkumabi on ihmisen IgG1λ monoklonaalinen vasta-aine, joka sitoutuu erittäin spesifisesti ja suurella affiniteetilla antigeenin sitoutumiskohdan kautta selektiivisesti interleukiini-23-proteiiniin (IL‑23). IL-23 on sytokiini, joka osallistuu inflammatorisiin ja immuunivasteisiin. Guselkumabi estää IL-23:n sitoutumisen reseptoriinsa ja estää siten IL-23-riippuvaista solusignalointia ja tulehdusta edistävien sytokiinien vapautumista.
Läiskäpsoriaasia sairastavan potilaan ihossa IL‑23:n pitoisuus on koholla. Haavaista paksusuolitulehdusta tai Crohnin tautia sairastavilla potilailla koolonkudoksen IL-23-pitoisuus on koholla. Guselkumabin osoitettiin in vitro ‑malleissa estävän IL‑23:n biologista aktiivisuutta salpaamalla sen vuorovaikutuksen solun pinnalla olevan IL‑23-reseptorin kanssa ja keskeyttämällä siten IL‑23-välitteisen signaalinvälityksen, aktivaation ja sytokiinikaskadit. Guselkumabin kliiniset hoitovaikutukset läiskäpsoriaasissa, nivelpsoriaasissa, haavaisessa paksusuolitulehduksessa ja Crohnin taudissa perustuvat IL‑23:n sytokiinireitin salpaukseen.
Psoriaasissa, haavaisessa paksusuolitulehduksessa ja Crohnin taudissa Fc-gamma-reseptoria 1 (CD64) ilmentävien myeloidisolujen on osoitettu olevan tulehtuneessa kudoksessa IL-23:n pääasiallinen lähde. Guselkumabin on osoitettu in vitro salpaavan IL-23:a ja sitoutuvan CD64:ään. Nämä tulokset viittaavat siihen, että guselkumabi kykenee neutraloimaan IL-23:n tulehduksen lähdesoluissa.
Farmakodynaamiset vaikutukset
Guselkumabihoito johti vaiheen I tutkimuksessa IL-23/Th17-reitin geenien ilmentymisen ja psoriaasiin liittyvien geenien ilmentymisprofiilien vähenemiseen. Tämä osoitettiin läiskäpsoriaasia sairastavien potilaiden leesioista otettujen ihon biopsianäytteiden mRNA-analyyseillä viikolla 12 lähtötilanteeseen verrattuna. Guselkumabihoito johti samassa vaiheen I tutkimuksessa psoriaasin histologisten mittareiden paranemiseen viikolla 12, mukaan lukien epidermiksen ohenemiseen ja T‑solutiheyden vähenemiseen. Guselkumabihoitoa saaneilla potilailla havaittiin lisäksi vaiheen II ja vaiheen III läiskäpsoriaasitutkimuksissa seerumin IL-17A-, IL-17F- ja IL-22-pitoisuuksien pienenemistä verrattuna lumelääkkeeseen. Nämä tulokset ovat yhdenmukaisia läiskäpsoriaasia sairastavilla potilailla guselkumabihoidosta havaitun kliinisen hyödyn kanssa.
Vaiheen III nivelpsoriaasitutkimuksissa akuutin vaiheen proteiinien C-reaktiivisen proteiinin, seerumin amyloidi A:n ja IL-6:n sekä Th17-efektorisytokiinien IL-17A, IL-17F ja IL-22 pitoisuus seerumissa oli lähtötilanteessa koholla. Guselkumabi pienensi näiden proteiinien pitoisuutta 4 viikon kuluessa hoidon aloittamisesta. Guselkumabi lisäksi pienensi näiden proteiinien pitoisuutta viikkoon 24 mennessä lähtötilanteeseen ja myös lumelääkkeeseen verrattuna.
Haavaista paksusuolitulehdusta tai Crohnin tautia sairastavilla potilailla guselkumabihoito pienensi tulehdusmerkkiaineiden, mukaan lukien C-reaktiivisen proteiinin (CRP) ja ulosteen kalprotektiinin, pitoisuutta induktiohoitoviikkoon 12 saakka, ja pitoisuudet pysyivät pienentyneinä yhden ylläpitohoitovuoden ajan. IL-17A-, IL-22- ja IFNγ ‑proteiinien pitoisuus seerumissa oli pienentynyt jo viikolla 4, ja pitoisuudet pienenivät edelleen induktiohoitoviikkoon 12 saakka. Guselkumabi pienensi myös koolonin limakalvobiopsiasta mitattujen IL-17A:n, IL-22:n ja IFNγ:n RNA-pitoisuuksia viikon 12 aikapisteessä.
Kliininen teho ja turvallisuus
Haavainen paksusuolitulehdus
Guselkumabin tehoa ja turvallisuutta arvioitiin kolmessa vaiheen III satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa (QUASAR-tutkimus laskimoon annettavasta induktiohoidosta, QUASAR-tutkimus ylläpitohoidosta ja ASTRO-tutkimus ihon alle annettavasta induktiohoidosta) aikuisilla potilailla, joilla oli keskivaikea tai vaikea aktiivinen haavainen paksusuolitulehdus ja joiden vaste kortikosteroideihin, tavanomaisiin immunomodulaattoreihin (atsatiopriini, merkaptopuriini), biologiseen hoitoon (TNF-estäjät, vedolitsumabi), januskinaasin (JAK) estäjään ja/tai sfingosiini-1-fosfaattireseptorin muuntajiin (koskee vain ASTRO-tutkimusta), oli ollut riittämätön, joiden vaste näihin oli hävinnyt tai jotka eivät olleet sietäneet tällaisia hoitoja. Guselkumabin tehoa ja turvallisuutta arvioitiin lisäksi satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen IIb induktiohoidon annoshakututkimuksessa (QUASAR- induktiohoidon annoshakututkimus), johon otettiin mukaan samankaltainen haavaista paksusuolitulehdusta sairastava potilasjoukko kuin vaiheen III induktiohoitotutkimukseen.
Sairauden aktiivisuutta arvioitiin modifioidulla Mayo-pisteytyksellä (mMS). Se on kolmen osa-alueen Mayo-pisteytys (0–9), joka koostuu seuraavien osa-alueiden pisteiden summasta (jokaisen osa-alueen pisteet 0–3): ulostustiheys, peräsuoliverenvuoto ja keskitetysti arvioidut endoskopialöydökset. Keskivaikean tai vaikean aktiivisen haavaisen paksusuolitulehduksen määritelmä täyttyi jos: modifioidut Mayo-pisteet 5–9, peräsuoliverenvuodon osa-alueen pisteet ≥ 1 ja endoskopialöydösten osa-alueen pisteet 2 (määritelty merkittäväksi punoitukseksi, verisuonikuvioituksen puuttumiseksi, kosketusverenvuodoksi ja/tai eroosioiksi) tai endoskopialöydösten osa-alueen pisteet 3 (määritelty spontaaniksi verenvuodoksi ja haavautumiseksi).
Induktiohoitotutkimus: QUASAR IS
QUASAR IS ‑induktiohoitotutkimuksessa potilaat satunnaistettiin suhteessa 3:2 saamaan joko 200 mg guselkumabia tai lumehoitoa infuusiona laskimoon viikolla 0, viikolla 4 ja viikolla 8. Yhteensä 701 potilasta arvioitiin. Modifioitujen Mayo-pisteiden mediaani oli lähtötilanteessa 7, ja 35,5 %:lla potilaista lähtötilanteen modifioidut Mayo-pisteet olivat 5–6, 64,5 %:lla modifioidut Mayo-pisteet olivat 7–9 ja 67,9 %:lla potilaista lähtötilanteen endoskopialöydösten osa-alueen pisteet olivat 3. Iän mediaani oli 39 vuotta (vaihteluväli 18–79 vuotta); 43,1 % oli naisia, ja 72,5 % identifioitui valkoihoisiksi, 21,4 % aasialaisiksi ja 1 % mustaihoisiksi.
Tutkimukseen mukaan otettujen potilaiden oli sallittua käyttää vakaina annoksina suun kautta otettavia aminosalisylaatteja, metotreksaattia, merkaptopuriinia, atsatiopriinia ja/tai suun kautta otettavia kortikosteroideja. Lähtötilanteessa 72,5 % potilaista sai aminosalisylaatteja, 20,8 % potilaista sai immunomodulaattoreita (metotreksaatti, merkaptopuriini tai atsatiopriini) ja 43,1 % potilaista sai kortikosteroideja. Samanaikaiset biologiset hoidot tai JAK-estäjät eivät olleet sallittuja.
Yhteensä 49,1 %:lla potilaista vähintään yksi aiempi biologinen hoito ja/tai hoito JAK-estäjällä oli epäonnistunut. Näistä potilaista 87,5 %:lla oli aiemmin epäonnistunut TNF-estäjähoito, 54,1 %:lla vedolitsumabihoito ja 18 %:lla JAK-estäjähoito, ja 47,4 %:lla potilaista näistä hoidoista oli epäonnistunut vähintään kaksi. Yhteensä 48,4 % potilaista ei ollut aiemmin saanut biologista hoitoa tai JAK-estäjähoitoa, ja 2,6 % oli aiemmin saanut biologista hoitoa tai JAK-estäjähoitoa eikä hoito ollut epäonnistunut.
Ensisijainen päätetapahtuma oli kliininen remissio, joka määriteltiin modifioidulla Mayo-pisteytyksellä viikon 12 aikapisteessä. Toissijaisia päätetapahtumia viikon 12 aikapisteessä olivat oireenmukainen remissio, endoskooppinen paraneminen, kliininen vaste, histologis-endoskooppinen limakalvon paraneminen, uupumuksen suhteen todettu vaste ja remissio tulehduksellista suolistosairautta koskevan IBDQ (Inflammatory Bowel Disease Questionnaire) ‑kyselyn perusteella (taulukko 3).
Viikon 12 aikapisteessä merkittävästi suurempi osuus guselkumabihoitoa saaneen ryhmän kuin lumeryhmän potilaista oli kliinisessä remissiossa.
| Taulukko 3. Tehon päätetapahtumat QUASAR IS ‑induktiohoitotutkimuksen viikon 12 aikapisteessä täyttäneiden potilaiden osuus | |||
| Päätetapahtuma | Lumelääke % | 200 mg guselkumabia laskimoon induktiohoitonaa % | Hoitojen ero (95 %:n luottamusväli) |
| Kliininen remissiob | |||
| Kokonaispotilasjoukko | 8 % (N = 280) | 23 % (N = 421) | 15 % (10 %; 20 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 12 % (N = 137) | 32 % (N = 202) | 20 % (12 %; 28 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 4 % (N = 136) | 13 % (N = 208) | 9 % (3 %; 14 %) |
| Oireenmukainen remissiof | |||
| Kokonaispotilasjoukko | 21 % (N = 280) | 50 % (N = 421) | 29 % (23 %; 36 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 26 % (N = 137) | 60 % (N = 202) | 34 % (24 %; 44 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 14 % (N = 136) | 38 % (N = 208) | 24 % (16 %; 33 %) |
| Endoskooppinen paranemineng | |||
| Kokonaispotilasjoukko | 11 % (N = 280) | 27 % (N = 421) | 16 % (10 %; 21 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 17 % (N = 137) | 38 % (N = 202) | 21 % (12 %; 30 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 5 % (N = 136) | 15 % (N = 208) | 10 % (4 %; 16 %) |
| Kliininen vasteh | |||
| Kokonaispotilasjoukko | 28 % (N = 280) | 62 % (N = 421) | 34 % (27 %; 41 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 35 % (N = 137) | 71 % (N = 202) | 36 % (26 %; 46 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 20 % (N = 136) | 51 % (N = 208) | 32 % (22 %; 41 %) |
| Histologis-endoskooppinen limakalvon paranemineni | |||
| Kokonaispotilasjoukko | 8 % (N = 280) | 24 % (N = 421) | 16 % (11 %; 21 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 11 % (N = 137) | 33 % (N = 202) | 22 % (13 %; 30 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 4 % (N = 136) | 13 % (N = 208) | 9 % (3 %; 15 %) |
| Uupumuksen suhteen todettu vastej | |||
| Kokonaispotilasjoukko | 21 % (N = 280) | 41 % (N = 421) | 20 % (13 %; 26 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 29 % (N = 137) | 42 % (N = 202) | 12 % (2 %; 23 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 13 % (N = 136) | 38 % (N = 208) | 25 % (17 %; 34 %) |
| IBDQ-kyselyyn perustuva remissiok | |||
| Kokonaispotilasjoukko | 30 % (N = 280) | 51 % (N = 421) | 22 % (15 %; 29 %)c |
| Ei aiempaa biologista tai JAK-estäjähoitoad | 34 % (N = 137) | 62 % (N = 202) | 28 % (18 %; 38 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunute | 24 % (N = 136) | 39 % (N = 208) | 15 % (5 %; 25 %) |
| a 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8. b Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet lähtötilanteesta, peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 ja endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. c p < 0,001, Cochran–Mantel–Haenszelin menetelmään perustuva (korjattu ositustekijöiden suhteen: biologisen ja/tai JAK-estäjähoidon epäonnistumisstatus ja kortikosteroidien samanaikainen käyttö lähtötilanteessa) korjattu hoitojen ero (95 %:n luottamusväli). d Lisäksi 7 potilasta lumeryhmässä ja 11 potilasta guselkumabiryhmässä oli aiemmin altistunut biologiselle hoidolle tai JAK-estäjälle eikä hoito ollut epäonnistunut. e Sisältää riittämättömän vasteen haavaiseen paksusuolitulehdukseen annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi) ja/tai JAK-estäjään sekä vasteen häviämisen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. f Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet induktiohoidon lähtötilanteesta sekä peräsuoliverenvuotoa koskevan osa-alueen pisteet 0. g Endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. h Modifioitujen Mayo-pisteiden pieneneminen induktiohoidon lähtötilanteesta ≥ 30 % ja ≥ 2 pistettä ja joko peräsuoliverenvuotoa koskevassa osa-alueessa ≥ 1 pisteen pieneneminen lähtötilanteesta tai peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 tai 1. i Seuraavien yhdistelmä: histologinen paraneminen (Geboes-pisteytyksen mukaan neutrofiilien infiltraatiota < 5 %:ssa kryptoista, ei kryptojen tuhoutumista eikä eroosioita, haavaumia eikä granulaatiokudosta) ja endoskooppinen paraneminen, kuten edellä määritelty. j Uupumusta arvioitiin PROMIS-Fatigue Short form 7a ‑kyselyllä. Uupumusta koskevaksi vasteeksi määriteltiin ≥ 7 pisteen paraneminen lähtötilanteesta, mikä katsotaan kliinisesti merkittäväksi. k IBDQ‑kyselyn kokonaispisteet ≥ 170. | |||
QUASAR IS ‑induktiohoitotutkimukseen ja QUASAR- induktiohoidon annoshakututkimukseen otettiin mukaan myös 48 potilasta, joiden lähtötilanteen modifioidut Mayo-pisteet olivat 4, mukaan lukien endoskopialöydösten osa-alueen pisteet 2 tai 3 ja peräsuoliverenvuoto ≥ 1. Potilailla, joiden lähtötilanteen modifioidut Mayo-pisteet olivat 4, guselkumabin teho lumehoitoon verrattuna oli kliinisellä remissiolla, kliinisellä vasteella ja endoskooppisella paranemisella viikon 12 aikapisteessä mitattuna yhdenmukainen koko keskivaikeaa tai vaikeaa aktiivista haavaista paksusuolitulehdusta sairastavan potilasjoukon kanssa.
Peräsuoliverenvuotoa ja ulostamistiheyttä koskevien osa-alueiden pisteet
Peräsuoliverenvuotoa ja ulostamistiheyttä koskevien osa-alueiden pisteiden havaittiin pienentyneen guselkumabihoitoa saaneilla potilailla jo viikolla 2 ja väheneminen jatkui viikkoon 12 saakka.
Ylläpitohoitotutkimus: QUASAR MS
QUASAR MS ‑ylläpitohoitotutkimuksessa arvioitiin 568 potilasta, joilla todettiin kliininen vaste 12 viikon aikapisteessä sen jälkeen, kun guselkumabia oli annettu laskimoon joko QUASAR IS ‑induktiohoitotutkimuksessa tai QUASAR- induktiohoidon annoshakututkimuksessa. QUASAR MS ‑ylläpitohoitotutkimuksessa nämä potilaat satunnaistettiin saamaan ihon alle annettavana ylläpitohoitona joko 100 mg guselkumabia 8 viikon välein, 200 mg guselkumabia 4 viikon välein tai lumehoitoa 44 viikon ajan.
Ensisijainen päätetapahtuma oli kliininen remissio, joka määriteltiin viikon 44 aikapisteen modifioiduilla Mayo-pisteillä. Toissijaisia päätetapahtumia viikon 44 aikapisteessä olivat mm. oireenmukainen remissio, endoskooppinen paraneminen, kliininen remissio ilman kortikosteroideja, histologis-endoskooppinen limakalvon paraneminen, uupumuksen suhteen todettu vaste ja IBDQ-kyselyyn perustuva remissio (taulukko 4).
Viikon 44 aikapisteessä merkittävästi suurempi osuus kummankin guselkumabihoitoa saaneen ryhmän potilaista kuin lumehoitoa saaneen ryhmän potilaista oli kliinisessä remissiossa.
| Taulukko 4. Tehon päätetapahtumat QUASAR MS ‑ylläpitotutkimuksen viikon 44 aikapisteessä täyttäneiden potilaiden osuus | |||||
| Päätetapahtuma | Lumelääke % | 100 mg guselkumabia injektiona ihon alle 8 viikon väleina % | 200 mg guselkumabia injektiona ihon alle 4 viikon väleinb % | Hoitojen ero (95 %:n luottamusväli) | |
| 100 mg guselkumabia | 200 mg guselkumabia | ||||
| Kliininen remissioc | |||||
| Kokonaispotilasjoukkod | 19 % (N = 190) | 45 % (N = 188) | 50 % (N = 190) | 25 % (16 %; 34 %)e | 30 % (21 %; 38 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 26 % (N = 108) | 50 % (N = 105) | 58 % (N = 96) | 24 % (12 %; 36 %) | 29 % (17 %; 41 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 8 % (N = 75) | 40 % (N = 77) | 40 % (N = 88) | 30 % (19 %; 42 %) | 32 % (21 %; 44 %) |
| Oireenmukainen remissioh | |||||
| Kokonaispotilasjoukkod | 37 % (N = 190) | 70 % (N = 188) | 69 % (N = 190) | 32 % (23 %; 41 %)e | 31 % (21 %; 40 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 46 % (N = 108) | 74 % (N = 105) | 76 % (N = 96) | 28 % (15 %; 40 %) | 28 % (15 %; 41 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 24 % (N = 75) | 65 % (N = 77) | 60 % (N = 88) | 39 % (26 %; 52 %) | 37 % (23 %; 50 %) |
| Kliininen remissio ilman kortikosteroidejai | |||||
| Kokonaispotilasjoukkod | 18 % (N = 190) | 45 % (N = 188) | 49 % (N = 190) | 26 % (17 %; 34 %)e | 29 % (20 %; 38 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 26 % (N = 108) | 50 % (N = 105) | 56 % (N = 96) | 24 % (12 %; 36 %) | 27 % (14 %; 39 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 7 % (N = 75) | 40 % (N = 77) | 40 % (N = 88) | 32 % (21 %; 43 %) | 34 % (23 %; 45 %) |
| Endoskooppinen paraneminenj | |||||
| Kokonaispotilasjoukkod | 19 % (N = 190) | 49 % (N = 188) | 52 % (N = 190) | 30 % (21 %; 38 %)e | 31 % (22 %; 40 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 26 % (N = 108) | 53 % (N = 105) | 59 % (N = 96) | 27 % (15 %; 40 %) | 30 % (18 %; 42 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 8 % (N = 75) | 45 % (N = 77) | 42 % (N = 88) | 36 % (24 %; 48 %) | 35 % (23 %; 46 %) |
| Histologis-endoskooppinen limakalvon paraneminenk | |||||
| Kokonaispotilasjoukkod | 17 % (N = 190) | 44 % (N = 188) | 48 % (N = 190) | 26 % (17 %; 34 %)e | 30 % (21 %; 38 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 23 % (N = 108) | 50 % (N = 105) | 56 % (N = 96) | 26 % (14 %; 38 %) | 30 % (17 %; 42 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 8 % (N = 75) | 38 % (N = 77) | 39 % (N = 88) | 28 % (16 %; 39 %) | 31 % (20 %; 43 %) |
| Kliininen vastel | |||||
| Kokonaispotilasjoukkod | 43 % (N = 190) | 78 % (N = 188) | 75 % (N = 190) | 34 % (25 %; 43 %)e | 31 % (21 %; 40 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 54 % (N = 108) | 83 % (N = 105) | 81 % (N = 96) | 29 % (17 %; 41 %) | 26 % (14 %; 39 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 28 % (N = 75) | 70 % (N = 77) | 67 % (N = 88) | 41 % (27 %; 54 %) | 39 % (26 %; 53 %) |
| Kliinisen remission säilyminen viikon 44 aikapisteessä potilailla, joilla todettiin kliininen remissio 12 viikkoa induktiohoidon jälkeen | |||||
| Kokonaispotilasjoukkoq | 34 % (N = 59) | 61 % (N = 66) | 72 % (N = 69) | 26 % (9 %; 43 %)m | 38 % (23 %; 54 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoar | 34 % (N = 41) | 65 % (N = 43) | 79 % (N = 48) | 31 % (9 %; 51 %) | 45 % (25 %; 62 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 27 % (N = 15) | 60 % (N = 20) | 56 % (N = 18) | 33 % (-1 %; 62 %) | 29 % (-6 %; 59 %) |
| Endoskooppinen normalisoituminenn | |||||
| Kokonaispotilasjoukkod | 15 % (N = 190) | 35 % (N = 188) | 34 % (N = 190) | 18 % (10 %; 27 %)e | 17 % (9 %; 25 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 20 % (N = 108) | 38 % (N = 105) | 42 % (N = 96) | 17 % (6 %; 29 %) | 17 % (6 %; 29 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 8 % (N = 75) | 31 % (N = 77) | 24 % (N = 88) | 21 % (10 %; 33 %) | 16 % (6 %; 26 %) |
| Uupumuksessa todettu vasteo | |||||
| Kokonaispotilasjoukkod | 29 % (N = 190) | 51 % (N = 188) | 43 % (N = 190) | 20 % (11 %; 29 %)e | 13 % (3 %; 22 %)m |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 36 % (N = 108) | 51 % (N = 105) | 53 % (N = 96) | 15 % (2 %; 28 %) | 16 % (3 %; 29 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 19 % (N = 75) | 47 % (N = 77) | 32 % (N = 88) | 27 % (13 %; 40 %) | 13 % (1 %; 26 %) |
| IBDQ-kyselyyn perustuva remissiop | |||||
| Kokonaispotilasjoukkod | 37 % (N = 190) | 64 % (N = 188) | 64 % (N = 190) | 26 % (17 %; 36 %)e | 26 % (16 %; 35 %)e |
| Ei aiempaa biologista tai JAK-estäjähoitoaf | 49 % (N = 108) | 68 % (N = 105) | 74 % (N = 96) | 19 % (6 %; 32 %) | 24 % (11 %; 37 %) |
| Aiempi biologinen ja/tai JAK-estäjähoito epäonnistunutg | 19 % (N = 75) | 58 % (N = 77) | 53 % (N = 88) | 38 % (26 %; 50 %) | 35 % (23 %; 48 %) |
| a 100 mg guselkumabia injektiona ihon alle 8 viikon välein induktiohoito-ohjelman jälkeen. b 200 mg guselkumabia injektiona ihon alle 4 viikon välein induktiohoito-ohjelman jälkeen. c Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet lähtötilanteesta, peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 ja endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. d Potilaat, joilla todettiin kliininen vaste 12 viikon kuluttua guselkumabin antamisesta laskimoon joko QUASAR-induktiotutkimuksessa tai QUASAR- induktiohoidon annoshakututkimuksessa. e p < 0,001, satunnaistamisen ositustekijöillä korjattuun Cochran–Mantel–Haenszelin menetelmään perustuva korjattu hoitojen ero (95 %:n luottamusväli). f Lisäksi 7 potilasta lumeryhmässä, 6 potilasta 100 mg guselkumabia saaneessa ryhmässä ja 6 potilasta 200 mg guselkumabia saaneessa ryhmässä oli aiemmin altistunut jollekin biologiselle hoidolle tai JAK-estäjälle eivätkä nämä hoidot olleet epäonnistuneet. g Sisältää riittämättömän vasteen haavaiseen paksusuolitulehdukseen annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi) ja/tai JAK-estäjään sekä vasteen häviämiseen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. h Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet induktiohoidon lähtötilanteesta sekä peräsuoliverenvuotoa koskevan osa-alueen pisteet 0. i Ei vaatinut kortikosteroidihoitoa vähintään 8 viikkoon ennen viikkoa 44 ja täytti myös kliinisen remission kriteerit viikon 44 aikapisteessä. j Endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. k Seuraavien yhdistelmä: histologinen paraneminen (Geboes-pisteytyksen mukaan neutrofiilien infiltraatiota < 5 %:ssa kryptoista, ei kryptojen tuhoutumista eikä eroosioita, haavaumia eikä granulaatiokudosta) ja endoskooppinen paraneminen, kuten edellä määritelty. l Modifioitujen Mayo-pisteiden pieneneminen induktiohoidon lähtötilanteesta ≥ 30 % ja ≥ 2 pistettä ja joko peräsuoliverenvuotoa koskevassa osa-alueessa ≥ 1 pisteen pieneneminen lähtötilanteesta tai peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 tai 1. m p < 0,01, satunnaistamisen ositustekijöillä korjattuun Cochran–Mantel–Haenszelin menetelmään perustuva korjattu hoitojen ero (95 %:n luottamusväli) n Endoskopialöydöksiä koskevan osa-alueen pisteet 0. o Uupumusta arvioitiin PROMIS-Fatigue Short form 7a ‑kyselyllä. Uupumusta koskevaksi vasteeksi määriteltiin ≥ 7 pisteen paraneminen induktiohoidon lähtötilanteesta, mikä katsotaan kliinisesti merkittäväksi. p IBDQ‑kyselyn kokonaispisteet ≥ 170. q Tutkittavat, joilla todettiin kliininen remissio 12 viikon kuluttua guselkumabin antamisesta laskimoon joko QUASAR-induktiotutkimuksessa tai QUASAR- induktiohoidon annoshakututkimuksessa. r Lisäksi 3 potilasta lumeryhmässä, 3 potilasta 100 mg guselkumabia saaneessa ryhmässä ja 3 potilasta 200 mg guselkumabia saaneessa ryhmässä oli aiemmin altistunut jollekin biologiselle hoidolle tai JAK-estäjälle eivätkä nämä hoidot olleet epäonnistuneet. | |||||
QUASAR IS ‑induktiohoitotutkimuksessa ja QUASAR MS ‑ylläpitohoitotutkimuksessa guselkumabin teho ja turvallisuus osoitettiin yhdenmukaisesti riippumatta iästä, sukupuolesta, etnisestä taustasta, painosta ja aiemmasta hoidosta biologisella valmisteella tai JAK-estäjällä.
QUASAR MS ‑ylläpitohoitotutkimuksessa potilaat, joilla oli suuri tulehdustaakka induktiohoidon päättymisen jälkeen, saivat lisähyötyä 200 mg:n guselkumabiannoksista ihon alle 4 viikon välein verrattuna 100 mg ihon alle 8 viikon välein annostukseen. Näiden kahden guselkumabiannosryhmän välillä havaittiin viikon 44 aikapisteessä seuraavien päätetapahtumien osalta kliinisesti merkittäviä > 15 %:n numeerisia eroja potilailla, joiden CRP-pitoisuus oli > 3 mg/l induktiohoidon päättymisen jälkeen: kliininen remissio (48 % annoksen 200 mg 4 viikon välein yhteydessä vs. 30 % annoksen 100 mg 8 viikon välein yhteydessä), kliinisen remission säilyminen (88 % annoksen 200 mg 4 viikon välein yhteydessä vs. 50 % annoksen 100 mg 8 viikon välein yhteydessä), kliininen remissio ilman kortikosteroideja (46 % annoksen 200 mg 4 viikon välein yhteydessä vs. 30 % annoksen 100 mg 8 viikon välein yhteydessä), endoskooppinen paraneminen (52 % annoksen 200 mg 4 viikon välein yhteydessä vs. 35 % annoksen 100 mg 8 viikon välein yhteydessä) ja histologis-endoskooppinen limakalvon paraneminen (46 % annoksen 200 mg 4 viikon välein yhteydessä vs. 29 % annoksen 100 mg 8 viikon välein yhteydessä).
QUASAR MS ‑ylläpitohoitotutkimukseen otettiin mukaan 31 potilasta, joilla induktiohoidon lähtötilanteen modifioidut Mayo-pisteet olivat 4, mukaan lukien endoskopialöydösten osa-alueen pisteet 2 tai 3 ja peräsuoliverenvuotoa koskevat pisteet ≥ 1 ja joilla todettiin kliininen vaste 12 viikon kuluttua guselkumabin antamisesta laskimoon QUASAR IS ‑induktiohoitotutkimuksessa tai QUASAR- induktiohoidon annoshakututkimuksessa. Näillä potilailla guselkumabin teho lumelääkkeeseen verrattuna viikon 44 aikapisteessä oli kliinisellä remissiolla, kliinisellä vasteella ja endoskooppisella paranemisella mitattuna yhdenmukainen kokonaispotilasjoukon kanssa.
Oireenmukainen remissio ajan kuluessa
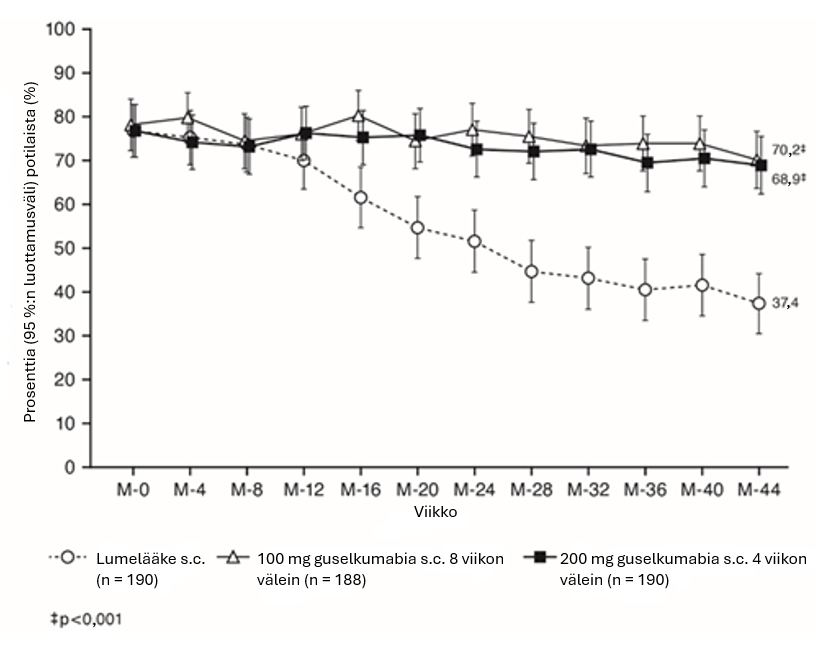
QUASAR MS ‑ylläpitohoitotutkimuksessa oireenmukainen remissio, joksi määriteltiin ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eikä pisteiden suurenemista induktiohoidon lähtötilanteesta, ja peräsuoliverenvuotoa koskevan osa-alueen pisteet 0, säilyi kummassakin guselkumabihoitoryhmässä viikkoon 44 saakka, kun taas lumelääkeryhmässä näissä havaittiin huononemista (kuva 1):
Kuva 1. Oireenmukaisessa remissiossa olevien potilaiden osuus QUASAR MS ‑ylläpitohoitotutkimuksen viikkoon 44 mennessä
Pidennettyyn guselkumabihoitoon viikolla 24 vasteen saaneet
Guselkumabihoitoa saaneet potilaat, jotka eivät olleet saavuttaneet kliinistä vastetta induktiohoidon viikolla 12, saivat 200 mg guselkumabia ihon alle viikoilla 12, 16 ja 20. QUASAR IS ‑induktiohoitotutkimuksessa 120 guselkumabihoitoa saaneesta potilaasta, joilla ei ollut kliinistä vastetta induktiohoidon viikolla 12, 66:lla (55 %) todettiin kliininen vaste viikolla 24. Potilaat, joilla oli vaste guselkumabihoitoon viikolla 24, otettiin mukaan QUASAR MS ‑ylläpitohoitotutkimukseen, jossa he saivat 200 mg guselkumabia ihon alle 4 viikon välein. Näistä QUASAR MS ‑ylläpitohoitotutkimuksen 123 potilaasta 83:lla (67 %) kliininen vaste oli säilynyt ja 37:llä (30 %) todettiin kliininen remissio viikon 44 aikapisteessä.
Tehon saavuttaminen uudelleen guselkumabihoitovasteen hävittyä
Yhdeksäntoista potilasta, jotka saivat 100 mg guselkumabia ihon alle 8 viikon välein ja joilla vaste hävisi ensimmäisen kerran (10 %) QUASAR MS ‑ylläpitohoitotutkimuksen viikkojen 8 ja 32 välillä, sai sokkoutetun guselkumabiannoksen 200 mg guselkumabia ihon alle 4 viikon välein. Yhdellätoista näistä potilaista (58 %) todettiin oireenmukainen vaste, ja 5 potilaalla (26 %) todettiin oireenmukainen remissio 12 viikon jälkeen.
Histologinen ja endoskooppinen arviointi
Histologiseksi remissioksi määriteltiin Geboesin histologiset pisteet ≤ 2 B.0 (Geboes-pisteytyksen mukaan limakalvoilla [sekä limakalvon tukikerroksessa että epiteelissä] ei neutrofiilejä, ei kryptojen tuhoutumista eikä eroosioita, haavaumia eikä granulaatiokudosta). QUASAR IS ‑induktiohoitotutkimuksessa histologinen remissio todettiin viikon 12 aikapisteessä 40 %:lla guselkumabihoitoa saaneista potilaista ja 19 %:lla lumeryhmän potilaista. QUASAR MS ‑ylläpitohoitotutkimuksessa histologinen remissio todettiin viikon 44 aikapisteessä 59 %:lla 100 mg guselkumabia ihon alle 8 viikon välein saaneista potilaista ja 61 %:lla 200 mg guselkumabia ihon alle 4 viikon välein saaneista potilaista sekä 27 %:lla lumeryhmän potilaista.
Limakalvon endoskooppiseksi normalisoitumiseksi määriteltiin endoskopialöydöksiä koskevan osa-alueen pisteet 0. QUASAR IS ‑induktiohoitotutkimuksessa endoskooppinen normalisoituminen todettiin viikon 12 aikapisteessä 15 %:lla guselkumabihoitoa saaneista potilaista ja 5 %:lla lumeryhmän potilaista.
Limakalvon yhdistetyt histologis-endoskooppiset päätetapahtumat
Oireenmukaisen remission, endoskooppisen normalisoitumisen, histologisen remission ja ulosteen kalprotektiinipitoisuuden ≤ 250 mg/kg yhdistelmä todettiin viikon 44 aikapisteessä suuremmalla osalla 100 mg guselkumabia ihon alle 8 viikon välein tai 200 mg guselkumabia ihon alle 4 viikon välein saaneista kuin lumelääkettä saaneista potilaista (22 %:lla 100 mg guselkumabia ihon alle 8 viikon välein saaneista, 28 %:lla 200 mg guselkumabia ihon alle 4 viikon välein saaneista vs. 9 %:lla lumelääkettä saaneista potilaista).
Terveyteen liittyvä elämänlaatu
QUASAR IS ‑induktiohoitotutkimuksessa guselkumabia saaneilla potilailla todettiin viikon 12 aikapisteessä tulehduksellisen suolistosairauden (IBD) suhteen spesifisessä elämänlaadussa suurempaa ja kliinisesti merkittävää paranemista lähtötilanteesta kuin lumelääkettä saaneilla. Tulehduksellisen suolistosairauden suhteen spesifistä elämänlaatua arvioitiin IBDQ-kokonaispisteiden ja kaikkien IBDQ-osa-alueiden (suolisto-oireet, mukaan lukien vatsakipu ja ulostamispakko, systeemiset toiminnot, emotionaaliset toiminnot ja sosiaaliset toiminnot) perusteella. Tämä paraneminen säilyi guselkumabihoitoa QUASAR MS ‑ylläpitohoitotutkimuksessa saaneilla potilailla viikkoon 44 saakka.
Haavaiseen paksusuolitulehdukseen liittyvä sairaalahoito
QUASAR IS ‑induktiohoitotutkimuksen viikkoon 12 mennessä pienempi osuus guselkumabiryhmän kuin lumeryhmän potilaista oli joutunut sairaalahoitoon haavaisen paksusuolitulehduksen vuoksi (guselkumabiryhmässä 1,9 %, 8/421 vs. lumeryhmässä 5,4 %, 15/280).
ASTRO
ASTRO-tutkimuksessa potilaat satunnaistettiin suhteessa 1:1:1 saamaan induktiohoitona 400 mg guselkumabia ihon alle viikoilla 0, 4 ja 8 ja sen jälkeen ylläpitohoitona 100 mg guselkumabia ihon alle 8 viikon välein tai induktiohoitona 400 mg guselkumabia ihon alle viikoilla 0, 4 ja 8 ja sen jälkeen ylläpitohoitona 200 mg guselkumabia ihon alle 4 viikon välein tai lumehoitoa.
Yhteensä 418 potilasta arvioitiin. Potilaiden iän mediaani oli 40 vuotta (vaihteluväli 18–80 vuotta); 38,8 % oli naisia ja 64,6 % identifioitui valkoihoisiksi, 28,9 % aasialaisiksi ja 3,1 % mustaihoisiksi.
Tutkimukseen mukaan otettujen potilaiden oli sallittua käyttää vakaina annoksina suun kautta otettavia aminosalisylaatteja, immunomodulaattoreita (atsatiopriini, 6‑merkaptopuriini, metotreksaatti) ja/tai suun kautta otettavia kortikosteroideja (enintään 20 mg/vrk prednisonia tai vastaavaa). Lähtötilanteessa 77,3 % potilaista sai aminosalisylaatteja, 20,1 % potilaista sai immunomodulaattoreita ja 32,8 % potilaista sai kortikosteroideja. Samanaikaiset biologiset hoidot, JAK-estäjät tai sfingosiini-1-fosfaatti (S1P) ‑reseptorin muuntajat eivät olleet sallittuja. Yhteensä 40,2 %:lla potilaista vähintään yksi aiempi biologinen hoito, hoito JAK-estäjällä ja/tai S1P-reseptorin muuntajalla oli epäonnistunut. 58,1 % ei ollut aiemmin saanut biologista hoitoa, JAK-estäjää tai S1P-reseptorin muuntajaa, ja 1,7 % oli aiemmin saanut jotakin biologista hoitoa, JAK-estäjää tai S1P-reseptorin muuntajaa eikä hoito ollut epäonnistunut.
ASTRO-tutkimuksen ensisijainen päätetapahtuma oli kliininen remissio viikon 12 aikapisteessä modifioidulla Mayo-pisteytyksellä määriteltynä. Toissijaisia päätetapahtumia viikon 12 aikapisteessä olivat oireenmukainen remissio, endoskooppinen paraneminen, kliininen vaste ja histologis-endoskooppinen limakalvon paraneminen (ks. taulukko 5). Toissijaisia päätetapahtumia viikon 24 aikapisteessä olivat kliininen remissio ja endoskooppinen paraneminen (ks. taulukko 6).
| Taulukko 5. Tehon päätetapahtumat ASTRO-tutkimuksen viikon 12 aikapisteessä täyttäneiden potilaiden osuus | |||
| Päätetapahtuma | Lumelääke % | 400 mg guselkumabia ihon alle induktiohoitonaa % | Hoidon ero lumehoitoon verrattuna (95 %:n luottamusväli)b |
| Kliininen remissioc | |||
| Kokonaispotilasjoukko | 6 % (N = 139) | 28 % (N = 279) | 21 % (15 %; 28 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 9 % (N = 79) | 36 % (N = 164) | 27 % (18 %; 37 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 4 % (N = 56) | 16 % (N = 112) | 12 % (3 %; 20 %) |
| Oireenmukainen remissiod | |||
| Kokonaispotilasjoukko | 21 % (N = 139) | 51 % (N = 279) | 30 % (22 %; 39 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 25 % (N = 79) | 59 % (N = 164) | 34 % (22 %; 46 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 14 % (N = 56) | 41 % (N = 112) | 26 % (13 %; 39 %) |
| Endoskooppinen paraneminenh | |||
| Kokonaispotilasjoukko | 13 % (N = 139) | 37 % (N = 279) | 24 % (17 %; 32 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 18 % (N = 79) | 46 % (N = 164) | 28 % (17 %; 40 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 7 % (N = 56) | 24 % (N = 112) | 16 % (6 %; 26 %) |
| Kliininen vastei | |||
| Kokonaispotilasjoukko | 35 % (N = 139) | 66 % (N = 279) | 31 % (22 %; 40 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 42 % (N = 79) | 71 % (N = 164) | 30 % (17 %; 43 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 25 % (N = 56) | 57 % (N = 112) | 31 % (17 %; 45 %) |
| Histologis-endoskooppinen limakalvon paraneminenj | |||
| Kokonaispotilasjoukko | 11 % (N = 139) | 30 % (N = 279) | 20 % (12 %; 27 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 14 % (N = 79) | 38 % (N = 164) | 25 % (14 %; 35 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 7 % (N = 56) | 19 % (N = 112) | 11 % (1 %; 20 %) |
a 400 mg guselkumabia ihon alle induktiohoitona viikolla 0, viikolla 4 ja viikolla 8. b Korjattu hoitojen ero ja luottamusvälit perustuvat yleiseen eroon riskissä ja on saatu käyttämällä Mantel–Haenszelin ositepainoja ja Saton varianssiestimaattoria. Osituksen muuttujina käytettiin aiemman biologisen hoidon, JAK-estäjähoidon ja/tai S1P-reseptorin muuntajalla annetun hoidon epäonnistumisstatusta (kyllä tai ei) sekä Mayon endoskopialöydöksiä koskevan osa-alueen pisteitä lähtötilanteessa (keskivaikea [2] tai vaikea [3]). c Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet lähtötilanteesta, peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 ja endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. d Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet induktiohoidon lähtötilanteesta sekä peräsuoliverenvuotoa koskevan osa-alueen pisteet 0. e p < 0,001 f Lisäksi 4 potilasta lumeryhmässä ja 3 potilasta guselkumabiryhmässä oli aiemmin altistunut biologiselle hoidolle, JAK-estäjälle tai S1P-reseptorin muuntajalle eikä hoito ollut epäonnistunut. g Sisältää riittämättömän vasteen haavaiseen paksusuolitulehdukseen annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi), JAK-estäjään ja/tai S1P-reseptorin muuntajaan, vasteen häviämisen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. h Endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. i Modifioitujen Mayo-pisteiden pieneneminen lähtötilanteesta ≥ 30 % ja ≥ 2 pistettä ja joko peräsuoliverenvuotoa koskevassa osa-alueessa ≥ 1 pisteen pieneneminen lähtötilanteesta tai peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 tai 1. j Endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa ja Geboes-pisteytys ≤ 3.1 (mikä osoittaa neutrofiilien infiltraatiota < 5 %:ssa kryptoista, ei kryptojen tuhoutumista eikä eroosioita, haavaumia eikä granulaatiokudosta). | |||
| Taulukko 6. Tehon päätetapahtumat ASTRO-tutkimuksen viikon 24 aikapisteessä täyttäneiden potilaiden osuus | |||||
| Päätetapahtuma | Lumelääke % | 400 mg guselkumabia ihon alle induktio-hoitona→ 100 mg injektiona ihon alle 8 viikon välein a % | 400 mg guselkumabia ihon alle induktio-hoitona→ 200 mg injektiona ihon alle 4 viikon välein b % | Hoidon ero lumehoitoon verrattuna (95 %:n luottamusväli)c | |
| 100 mg guselkumabia | 200 mg guselkumabia | ||||
| Kliininen remissiod | |||||
| Kokonaispotilasjoukko | 9 % (N = 139) | 35 % (N = 139) | 36 % (N = 140) | 26 % (17 %; 35 %)e | 27 % (18 %; 36 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 13 % (N = 79) | 49 % (N = 81) | 43 % (N = 83) | 37 % (24 %; 50 %) | 31 % (18 %; 44 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 5 % (N = 56) | 16 % (N = 57) | 27 % (N = 55) | 10 % (‑1 %; 21 %) | 21 % (9 %; 34 %) |
| Endoskooppinen paraneminenh | |||||
| Kokonaispotilasjoukko | 12 % (N = 139) | 40 % (N = 139) | 45 % (N = 140) | 28 % (18 %; 38 %)e | 33 % (23 %; 42 %)e |
| Ei aiempaa biologista hoitoa, JAK-estäjähoitoa tai hoitoa S1P-reseptorin muuntajallaf | 18 % (N = 79) | 54 % (N = 81) | 52 % (N = 83) | 37 % (23 %; 51 %) | 34 % (21 %; 48 %) |
| Aiempi biologinen hoito, JAK-estäjähoito ja/tai hoito S1P-reseptorin muuntajalla epäonnistunutg | 5 % (N = 56) | 19 % (N = 57) | 36 % (N = 55) | 13 % (1 %; 25 %) | 30 % (17 %; 44 %) |
a 400 mg guselkumabia ihon alle induktiohoitona viikoilla 0, 4 ja 8, minkä jälkeen 100 mg guselkumabia ihon alle ylläpitohoitona 8 viikon välein. b 400 mg guselkumabia ihon alle induktiohoitona viikoilla 0, 4 ja 8, minkä jälkeen 200 mg guselkumabia ihon alle ylläpitohoitona 4 viikon välein c Korjattu hoitojen ero ja luottamusvälit perustuvat yleiseen eroon riskissä ja on saatu käyttämällä Mantel–Haenszelin ositepainoja ja Saton varianssiestimaattoria. Osituksen muuttujina käytettiin aiemman biologisen hoidon, JAK-estäjähoidon ja/tai S1P-reseptorin muuntajalla annetun hoidon epäonnistumisstatusta (kyllä tai ei) sekä Mayon endoskopialöydöksiä koskevan osa-alueen pisteitä lähtötilanteessa (keskivaikea [2] tai vaikea [3]). d Ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eivätkä suurentuneet lähtötilanteesta, peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 ja endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa. e p < 0,001 f Lisäksi 4 potilasta lumeryhmässä, 1 potilas 100 mg guselkumabia saaneessa ryhmässä ja 2 potilasta 200 mg guselkumabia saaneessa ryhmässä oli aiemmin altistunut biologiselle hoidolle, JAK-estäjälle tai S1P-reseptorin muuntajalle eikä hoito ollut epäonnistunut. g Sisältää riittämättömän vasteen haavaiseen paksusuolitulehdukseen annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi), JAK-estäjään ja/tai S1P-reseptorin muuntajaan, vasteen häviämisen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. h Endoskopialöydöksiä koskevan osa-alueen pisteet 0 tai 1 eikä kosketusverenvuotoa | |||||
Oireenmukainen remissio ajan kuluessa
ASTRO-tutkimuksessa oireenmukaiseksi remissioksi määriteltiin ulostamistiheyttä koskevan osa-alueen pisteet 0 tai 1 eikä pisteiden suurenemista lähtötilanteesta ja peräsuoliverenvuotoa koskevan osa-alueen pisteet 0 viikon 12 aikapisteeseen saakka. Oireenmukainen remissio todettiin suuremmalla osalla guselkumabihoitoryhmien potilaista kuin lumeryhmän potilaista (kuva 2):
Kuva 2. Oireenmukaisessa remissiossa olevien potilaiden osuus ASTRO-tutkimuksen viikkoon 12 mennessä

Peräsuoliverenvuotoa ja ulostamistiheyttä koskevien osa-alueiden pisteet
Peräsuoliverenvuotoa ja ulostamistiheyttä koskevien osa-alueiden pisteiden havaittiin pienentyneen guselkumabihoitoa saaneilla potilailla lumehoitoon verrattuna jo viikolla 2.
Histologinen ja endoskooppinen arviointi
Histologinen remissio todettiin viikon 12 aikapisteessä 44 %:lla potilaista, jotka olivat saaneet induktiohoitona 400 mg guselkumabia ihon alle, verrattuna 20 %:iin lumehoitoa saaneista potilaista.
Endoskooppinen normalisoituminen todettiin viikon 24 aikapisteessä 21 %:lla potilaista, jotka olivat saaneet induktiohoitona 400 mg guselkumabia ihon alle ja sen jälkeen 100 mg guselkumabia injektiona ihon alle viikolla 16 ja sitten 8 viikon välein, ja 26 %:lla potilaista, jotka olivat saaneet induktiohoitona 400 mg guselkumabia ihon alle ja sen jälkeen 200 mg guselkumabia injektiona ihon alle viikolla 12 ja sitten 4 viikon välein, verrattuna 4 %:iin lumehoitoa saaneista potilaista.
Vatsakipu ja ulostamispakko
Suuremmalla osalla 400 mg guselkumabia ihon alle induktiohoitona saaneista potilaista kuin lumehoitoa saaneista potilaista ei ollut viikon 12 aikapisteessä vatsakipua (56 % vs. 31 %) eikä ulostamispakkoa (49 % vs. 24 %).
Terveyteen liittyvä elämänlaatu
Sairausspesifistä terveyteen liittyvää elämänlaatua arvioitiin tulehduksellista suolistosairautta (IBD) koskevalla spesifisellä elämänlaatuarvioinnilla (IBDQ). IBDQ-pisteillä arvioituna remissio todettiin viikon 12 aikapisteessä suuremmalla osalla potilaista yhdistetyissä guselkumabiryhmissä (61%), jotka saivat 400 mg:n annoksia ihon alle, kuin lumeryhmässä (34 %).
Crohnin tauti
Guselkumabin tehoa ja turvallisuutta arvioitiin kolmessa vaiheen III kliinisessä tutkimuksessa aikuisilla potilailla, joilla oli keskivaikea tai vaikea aktiivinen Crohnin tauti ja joiden vaste suun kautta otettaviin kortikosteroideihin, tavanomaisiin immunomodulaattoreihin (atsatiopriini, merkaptopuriini, metotreksaatti) ja/tai biologiseen hoitoon (TNF-estäjät tai vedolitsumabi) oli ollut riittämätön, joiden vaste näihin oli hävinnyt tai jotka eivät olleet sietäneet tällaisia hoitoja. Kyseiset tutkimukset olivat kaksi 48 viikon pituista satunnaistettua, kaksoissokkoutettua, lumevalmisteella ja vaikuttavalla aineella (ustekinumabi) kontrolloitua rinnakkaisryhmillä tehtyä monikeskustutkimusta, joiden tutkimusasetelmat olivat identtiset (GALAXI 2 ja GALAXI 3), sekä yksi 24 viikon pituinen satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, rinnakkaisryhmillä tehty monikeskustutkimus (GRAVITI). Kaikissa kolmessa tutkimuksessa oli treat-through-tutkimusasetelma, mikä tarkoitti, että guselkumabihoitoon (tai GALAXI 2- ja GALAXI 3 ‑tutkimuksissa ustekinumabihoitoon) satunnaistetut potilaat jatkoivat samaa heille osoitettua hoitoa koko tutkimuksen ajan.
GALAXI 2 ja GALAXI 3
Vaiheen III GALAXI 2- ja GALAXI 3 ‑tutkimuksissa keskivaikean tai vaikean aktiivisen Crohnin taudin määritelmä oli CDAI (Crohn’s Disease Activity Index) ‑pisteet ≥ 220 – ≤ 450 ja SES-CD (Simple Endoscopic Score for CD) ‑pisteet ≥ 6 (tai ≥ 4, jos potilaalla oli ileumiin rajoittunut tauti). Muita kriteereitä GALAXI 2/3 ‑tutkimuksissa olivat keskimääräistä päivittäistä ulostustiheyttä koskevat pisteet > 3 tai keskimääräiset päivittäistä vatsakipua koskevat pisteet > 1.
GALAXI 2- ja GALAXI 3 ‑tutkimuksissa potilaat satunnaistettiin suhteessa 2:2:2:1 saamaan 200 mg guselkumabia laskimoon induktiohoitona viikoilla 0, 4 ja 8 ja sen jälkeen 200 mg guselkumabia ihon alle neljän viikon välein ylläpitohoitona tai 200 mg guselkumabia laskimoon induktiohoitona viikoilla 0, 4 ja 8 ja sen jälkeen 100 mg guselkumabia ihon alle kahdeksan viikon välein ylläpitohoitona tai noin 6 mg/kg ustekinumabia laskimoon induktiohoitona viikolla 0 ja sen jälkeen 90 mg ustekinumabia ihon alle kahdeksan viikon välein ylläpitohoitona tai lumelääkettä. Tutkittavat, jotka eivät saaneet vastetta lumelääkkeeseen, saivat viikosta 12 alkaen ustekinumabia.
GALAXI 2- (n = 508) ja GALAXI 3 (n = 513) ‑tutkimuksissa arvioitiin yhteensä 1 021 potilasta. Iän mediaani oli 34 vuotta (vaihteluväli 18–83 vuotta); 57,6 % oli miehiä, ja 74,3 % identifioitui valkoihoisiksi, 21,3 % aasialaisiksi ja 1,5 % mustaihoisiksi.
GALAXI 2 ‑tutkimuksessa 52,8 %:lla potilaista vähintään yksi aiempi biologinen hoito oli epäonnistunut (50,6 % ei ollut sietänyt vähintään yhtä aiempaa TNFα-estäjähoitoa tai se oli epäonnistunut, 7,5 % ei ollut sietänyt aiempaa vedolitsumabihoitoa tai se oli epäonnistunut), 41,9 % ei ollut aiemmin saanut biologista hoitoa ja 5,3 % oli aiemmin saanut biologista hoitoa eikä hoito ollut epäonnistunut. Lähtötilanteessa 37,4 % potilaista sai suun kautta otettavia kortikosteroideja ja 29,9 % potilaista sai tavanomaisia immunomodulaattoreita.
GALAXI 3 ‑tutkimuksessa 51,9 %:lla potilaista vähintään yksi aiempi biologinen hoito oli epäonnistunut (50,3 % ei ollut sietänyt vähintään yhtä aiempaa TNFα-estäjähoitoa tai se oli epäonnistunut, 9,6 % ei ollut sietänyt aiempaa vedolitsumabihoitoa tai se oli epäonnistunut), 41,5 % ei ollut aiemmin saanut biologista hoitoa ja 6,6 % oli aiemmin saanut biologista hoitoa eikä hoito ollut epäonnistunut. Lähtötilanteessa 36,1 % potilaista sai suun kautta otettavia kortikosteroideja ja 30,2 % potilaista sai tavanomaisia immunomodulaattoreita.
Rinnakkaisten ensisijaisten ja tärkeimpien toissijaisten päätetapahtumien tulosten vertailu lumelääkkeeseen GALAXI 2- ja GALAXI 3 ‑tutkimuksissa esitetään taulukoissa 7 (viikko 12) ja 8 (viikko 48). Tärkeimpien toissijaisten päätetapahtumien viikon 48 tulosten vertailu ustekinumabiin esitetään taulukoissa 9 ja 10.
| Taulukko 7. Guselkumabihoidolla rinnakkaiset ensisijaiset päätetapahtumat ja tärkeimmät toissijaiset tehon päätetapahtumat GALAXI 2- ja GALAXI 3 ‑tutkimusten viikon 12 aikapisteessä saavuttaneiden potilaiden osuus verrattuna lumelääkkeeseen | ||||
| GALAXI 2 | GALAXI 3 | |||
Lumelääke % | Guselkumabi laskimoon induktiohoitonaa % | Lumelääke % | Guselkumabi laskimoon induktiohoitonaa % | |
| Rinnakkaiset ensisijaiset päätetapahtumat | ||||
| Kliininen remissiob viikon 12 aikapisteessä | ||||
| Kokonaispotilasjoukko | 22 % (N = 76) | 47 %i (N = 289) | 15 % (N = 72) | 47 %i (N = 293) |
| Ei aiempaa biologista hoitoac | 18 % (N = 34) | 50 % (N = 121) | 15 % (N = 27) | 50 % (N = 123) |
| Aiempi biologinen hoito epäonnistunutd | 23 % (N = 39) | 45 % (N = 150) | 15 % (N = 39) | 47 % (N = 150) |
| Endoskooppinen vastee viikon 12 aikapisteessä | ||||
| Kokonaispotilasjoukko | 11 % (N = 76) | 38 %i (N = 289) | 14 % (N = 72) | 36 %i (N = 293) |
| Ei aiempaa biologista hoitoac | 15 % (N = 34) | 51 % (N = 121) | 22 % (N = 27) | 41 % (N = 123) |
| Aiempi biologinen hoito epäonnistunutd | 5 % (N = 39) | 27 % (N = 150) | 8 % (N = 39) | 31 % (N = 150) |
| Tärkeimmät toissijaiset tehon päätetapahtumat | ||||
| PRO-2-remissiof viikon 12 aikapisteessä | ||||
| Kokonaispotilasjoukko | 21 % (N = 76) | 43 %i (N = 289) | 14 % (N = 72) | 42 %i (N = 293) |
| Ei aiempaa biologista hoitoac | 24 % (N = 34) | 43 % (N = 121) | 15 % (N = 27) | 47 % (N = 123) |
| Aiempi biologinen hoito epäonnistunutd | 13 % (N = 39) | 41 % (N = 150) | 13 % (N = 39) | 39 % (N = 150) |
| Uupumuksen suhteen todettu vasteg viikon 12 aikapisteessä | ||||
| Kokonaispotilasjoukko | 29 % (N = 76) | 45 %j (N = 289) | 18 % (N = 72) | 43 %i (N = 293) |
| Ei aiempaa biologista hoitoac | 32 % (N = 34) | 48 % (N = 121) | 19 % (N = 27) | 46 % (N = 123) |
| Aiempi biologinen hoito epäonnistunutd | 26 % (N = 39) | 41 % (N = 150) | 18 % (N = 39) | 43 % (N = 150) |
| Endoskooppinen remissioh viikon 12 aikapisteessä | ||||
| Kokonaispotilasjoukko | 1 % (N = 76) | 15 % (N = 289) | 8 % (N = 72) | 16 % (N = 293) |
| Ei aiempaa biologista hoitoac | 3 % (N = 34) | 22 % (N = 121) | 19 % (N = 27) | 25 % (N = 123) |
| Aiempi biologinen hoito epäonnistunutd | 0 % (N = 39) | 9 % (N = 150) | 0 % (N = 39) | 9 % (N = 150) |
| a 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8 – Tässä sarakkeessa kaksi guselkumabihoitoryhmää on yhdistetty, sillä potilaat saivat samansuuruisina annoksina laskimoon annettavan induktiohoito-ohjelman ennen viikon 12 aikapistettä. b Kliiniseksi remissioksi on määritelty CDAI-pisteet < 150. c Lisäksi 9 potilasta lumeryhmässä ja 38 potilasta 200 mg guselkumabia laskimoon saaneessa ryhmässä oli aiemmin altistunut biologiselle hoidolle eikä hoito ollut epäonnistunut. d Sisältää riittämättömän vasteen Crohnin tautiin annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi) sekä vasteen häviämisen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. e Endoskooppiseksi vasteeksi on määritelty SES-CD-pisteiden ≥ 50 %:n paraneminen lähtötilanteesta tai SES-CD-pisteet ≤ 2. f PRO-2-remissioksi on määritelty vatsakipua koskevat keskimääräiset päivittäiset pisteet enintään 1 ja ulostustiheyttä koskevat keskimääräiset päivittäiset pisteet enintään 3 eikä vatsakivun pahenemista tai ulostustiheyden lisääntymistä lähtötilanteesta. g Uupumuksen suhteen todetuksi vasteeksi on määritelty ≥ 7 pisteen paraneminen PROMIS Fatigue Short Form 7a ‑kyselyssä. h Endoskooppiseksi remissioksi on määritelty SES-CD-pisteet ≤ 2. i p < 0,001 j p < 0,05 | ||||
| Taulukko 8. Guselkumabihoidolla tärkeimmät toissijaiset tehon päätetapahtumat GALAXI 2- ja GALAXI 3 ‑tutkimusten viikon 48 aikapisteessä saavuttaneiden potilaiden osuus verrattuna lumelääkkeeseen | ||||||
| GALAXI 2 | GALAXI 3 | |||||
| Lumelääke | Guselkumabi laskimoon induktio-hoitona → 100 mg injektiona ihon alle 8 viikon väleina | Guselkumabi laskimoon induktio-hoitona → 200 mg injektiona ihon alle 4 viikon väleinb | Lumelääke (N = 72) | Guselkumabi laskimoon induktio-hoitona → 100 mg injektiona ihon alle 8 viikon väleina | Guselkumabi laskimoon induktio-hoitona → 200 mg injektiona ihon alle 4 viikon väleinb | |
| Kliininen remissio ilman kortikosteroidejac viikon 48 aikapisteessäf | ||||||
| Kokonaispotilasjoukko | 12 % (N = 76) | 45 %e (N = 143) | 51 %e (N = 146) | 14 % (N = 72) | 44 %e (N = 143) | 48 %e (N = 150) |
| Endoskooppinen vasted viikon 48 aikapisteessäf | ||||||
| Kokonaispotilasjoukko | 7 % (N = 76) | 38 %e (N = 143) | 38 %e (N = 146) | 6 % (N = 72) | 33 %e (N = 143) | 36 %e (N = 150) |
| a 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8, jonka jälkeen 100 mg guselkumabia ihon alle 8 viikon välein enintään 48 viikon ajan. b 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8, jonka jälkeen 200 mg guselkumabia ihon alle 4 viikon välein enintään 48 viikon ajan. c Kliiniseksi remissioksi ilman kortikosteroideja määriteltiin CDAI-pisteet < 150 viikon 48 aikapisteessä eikä kortikosteroidihoitoa viikon 48 aikapisteessä. d Endoskooppiseksi vasteeksi on määritelty SES-CD-pisteiden ≥ 50 %:n paraneminen lähtötilanteesta tai SES-CD-pisteet ≤ 2. e p < 0,001 f Riittämättömän vasteen kriteerit viikon 12 aikapisteessä täyttäneiden tutkittavien suhteen katsottiin, ettei heillä ollut vastetta viikon 48 aikapisteessä hoitohaarasta riippumatta. | ||||||
| Taulukko 9. Guselkumabihoidolla tärkeimmät toissijaiset tehon päätetapahtumat GALAXI 2- ja GALAXI 3 ‑tutkimusten viikon 48 aikapisteessä saavuttaneiden potilaiden osuus verrattuna ustekinumabiin | ||||||
| GALAXI 2 | GALAXI 3 | |||||
| 6 mg/kg ustekinumabia laskimoon induktio-hoitona → 90 mg injektiona ihon alle 8 viikon väleina | Guselkumabi laskimoon induktio-hoitona → 100 mg injektiona ihon alle 8 viikon väleinb | Guselkumabi laskimoon induktio-hoitona → 200 mg injektiona ihon alle 4 viikon väleinc | 6 mg/kg ustekinumabia laskimoon induktio-hoitona → 90 mg injektiona ihon alle 8 viikon väleina | Guselkumabi laskimoon induktio-hoitona→ 100 mg injektiona ihon alle 8 viikon väleinb | Guselkumabi laskimoon induktio-hoitona → 200 mg injektiona ihon alle 4 viikon väleinc | |
| Kliininen remissio viikon 48 aikapisteessä ja endoskooppinen vasted viikon 48 aikapisteessä | ||||||
| Kokonaispotilasjoukko | 39 % (N = 143) | 42 % (N = 143) | 49 % (N = 146) | 28 % (N = 148) | 41 %k (N = 143) | 45 %k (N = 150) |
| Endoskooppinen vastee viikon 48 aikapisteessäl | ||||||
| Kokonaispotilasjoukko | 42 % (N = 143) | 49 % (N = 143) | 56 % (N = 146) | 32 % (N = 148) | 47 % (N = 143) | 49 % (N = 150) |
| Endoskooppinen remissiof viikon 48 aikapisteessä | ||||||
| Kokonaispotilasjoukko | 20 % (N = 143) | 27 % (N = 143) | 24 % (N = 146) | 13 % (N = 148) | 24 %k (N = 143) | 19 % (N = 150) |
| Kliininen remissiog viikon 48 aikapisteessä | ||||||
| Kokonaispotilasjoukko | 65 % (N = 143) | 64 % (N = 143) | 75 % (N = 146) | 61 % (N = 148) | 66 % (N = 143) | 66 % (N = 150) |
| Kliininen remissio ilman kortikosteroidejah viikon 48 aikapisteessäl | ||||||
| Kokonaispotilasjoukko | 61 % (N = 143) | 63 % (N = 143) | 71 % (N = 146) | 59 % (N = 148) | 64 % (N = 143) | 64 % (N = 150) |
| Pysyvä kliininen remissioi viikon 48 aikapisteessä | ||||||
| Kokonaispotilasjoukko | 45 % (N = 143) | 46 % (N = 143) | 52 % (N = 146) | 39 % (N = 148) | 50 % (N = 143) | 49 % (N = 150) |
| PRO-2-remissioj viikon 48 aikapisteessä | ||||||
| Kokonaispotilasjoukko | 59 % (N = 143) | 60 % (N = 143) | 69 % (N = 146) | 53 % (N = 148) | 58 % (N = 143) | 56 % (N = 150) |
| a 6 mg/kg ustekinumabia laskimoon induktiohoitona viikolla 0, jonka jälkeen 90 mg ustekinumabia ihon alle 8 viikon välein enintään 48 viikon ajan. b 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8, jonka jälkeen 100 mg guselkumabia ihon alle 8 viikon välein enintään 48 viikon ajan. c 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8, jonka jälkeen 200 mg guselkumabia ihon alle 4 viikon välein enintään 48 viikon ajan. d Kliinisen remission ja endoskooppisen vasteen yhdistelmä, kuten määritelty jäljempänä. e Endoskooppiseksi vasteeksi on määritelty SES-CD-pisteiden ≥ 50 %:n paraneminen lähtötilanteesta tai SES-CD-pisteet ≤ 2. f Endoskooppiseksi remissioksi on määritelty SES-CD-pisteet ≤ 2. g Kliiniseksi remissioksi on määritelty CDAI-pisteet < 150. h Kliiniseksi remissioksi ilman kortikosteroideja on määritelty CDAI-pisteet < 150 viikon 48 aikapisteessä eikä kortikosteroidihoitoa viikon 48 aikapisteessä. i Pysyväksi kliiniseksi remissioksi on määritelty CDAI-pisteet < 150, jotka todetaan ≥ 80 %:lla kaikista käynneistä viikon 12 ja viikon 48 välillä (vähintään kahdeksalla käynnillä kymmenestä), jonka täytyy sisältää viikko 48. j PRO-2-remissioksi on määritelty vatsakipua koskevat keskimääräiset päivittäiset pisteet enintään 1 ja ulostustiheyttä koskevat keskimääräiset päivittäiset pisteet enintään 3 eikä vatsakivun pahenemista tai ulostustiheyden lisääntymistä lähtötilanteesta. k p < 0,05 l Vasteet arvioitiin viikon 48 aikapisteessä riippumatta kliinisestä vasteesta viikon 12 aikapisteessä. | ||||||
| Taulukko 10.Guselkumabihoidolla tehon päätetapahtumat yhdistettyjen GALAXI 2- ja GALAXI 3 ‑tutkimusten viikon 48 aikapisteessä saavuttaneiden potilaiden osuus verrattuna ustekinumabiin | |||
| 6 mg/kg ustekinumabia laskimoon induktiohoitona → 90 mg injektiona ihon alle 8 viikon väleina | Guselkumabi laskimoon induktiohoitona → 100 mg injektiona ihon alle 8 viikon väleinb | Guselkumabi laskimoon induktiohoitona → 200 mg injektiona ihon alle 4 viikon väleinc | |
| Kliininen remissio viikon 48 aikapisteessä ja endoskooppinen vasted viikon 48 aikapisteessä | |||
| Kokonaispotilasjoukko | 34 % (N = 291) | 42 % (N = 286) | 47 % (N = 296) |
| Ei aiempaa biologista hoitoae | 43 % (N = 121) | 51 % (N = 116) | 55 % (N = 128) |
| Aiempi biologinen hoito epäonnistunutf | 26 % (N = 156) | 37 % (N = 153) | 41 % (N = 147) |
| Endoskooppinen vasteg viikon 48 aikapisteessä | |||
| Kokonaispotilasjoukko | 37 % (N = 291) | 48 % (N = 286) | 53 % (N = 296) |
| Ei aiempaa biologista hoitoae | 43 % (N = 121) | 59 % (N = 116) | 59 % (N = 128) |
| Aiempi biologinen hoito epäonnistunutf | 31 % (N = 156) | 43 % (N = 153) | 47 % (N = 147) |
| Endoskooppinen remissioh viikon 48 aikapisteessä | |||
| Kokonaispotilasjoukko | 16 % (N = 291) | 25 % (N = 286) | 21 % (N = 296) |
| Ei aiempaa biologista hoitoae | 19 % (N = 121) | 34 % (N = 116) | 27 % (N = 128) |
| Aiempi biologinen hoito epäonnistunutf | 13 % (N = 156) | 21 % (N = 153) | 14 % (N = 147) |
| Kliininen remissioi viikon 48 aikapisteessä | |||
| Kokonaispotilasjoukko | 63 % (N = 291) | 65 % (N = 286) | 70 % (N = 296) |
| Ei aiempaa biologista hoitoae | 75 % (N = 121) | 73 % (N = 116) | 77 % (N = 128) |
| Aiempi biologinen hoito epäonnistunutf | 53 % (N = 156) | 61 % (N = 153) | 64 % (N = 147) |
| a 6 mg/kg ustekinumabia laskimoon induktiohoitona viikolla 0, jonka jälkeen 90 mg ustekinumabia ihon alle 8 viikon välein enintään 48 viikon ajan. b 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8, jonka jälkeen 100 mg guselkumabia ihon alle 8 viikon välein enintään 48 viikon ajan. c 200 mg guselkumabia laskimoon induktiohoitona viikolla 0, viikolla 4 ja viikolla 8, jonka jälkeen 200 mg guselkumabia ihon alle 4 viikon välein enintään 48 viikon ajan. d Kliinisen remission ja endoskooppisen vasteen yhdistelmä, kuten määritelty jäljempänä. e Lisäksi 14 potilasta ustekinumabiryhmässä, 21 potilasta 200 mg guselkumabia ihon alle 4 viikon välein saaneessa ryhmässä ja 17 potilasta 100 mg guselkumabia ihon alle 8 viikon välein saaneessa ryhmässä oli aiemmin altistunut biologiselle hoidolle eikä hoito ollut epäonnistunut. f Sisältää riittämättömän vasteen Crohnin tautiin annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi) sekä vasteen häviämisen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. g Endoskooppiseksi vasteeksi on määritelty SES-CD-pisteiden ≥ 50 %:n paraneminen lähtötilanteesta tai SES-CD-pisteet ≤ 2. h Endoskooppiseksi remissioksi on määritelty SES-CD-pisteet ≤ 2. i Kliiniseksi remissioksi on määritelty CDAI-pisteet < 150. | |||
GALAXI 2- ja GALAXI 3 ‑tutkimuksissa guselkumabin teho ja turvallisuus osoitettiin yhdenmukaisesti iästä, sukupuolesta, etnisestä taustasta ja painosta riippumatta.
Yhdistettyjen vaiheen III GALAXI-tutkimusten potilaiden osajoukkoanalyysissa potilaat, joilla oli suuri tulehdustaakka induktiohoidon päättymisen jälkeen, saivat lisähyötyä 200 mg:n guselkumabiannoksista ihon alle 4 viikon välein verrattuna 100 mg:n annoksina ihon alle 8 viikon välein annettuun ylläpitohoitoon. Potilailla, joiden CRP-arvo oli induktiohoidon päättymisen jälkeen > 5 mg/l, havaittiin kahden guselkumabiannosryhmän välillä kliinisesti merkittävä ero kliinistä remissiota viikon 48 aikapisteessä koskevissa päätetapahtumissa (100 mg ihon alle 8 viikon välein 54,1 % vs. 200 mg ihon alle 4 viikon välein 71,0 %), endoskooppisessa vasteessa viikon 48 aikapisteessä (100 mg ihon alle 8 viikon välein 36,5 % vs. 200 mg ihon alle 4 viikon välein 50,5 %) ja PRO-2-remissiossa viikon 48 aikapisteessä (100 mg ihon alle 8 viikon välein 51,8 % vs. 200 mg ihon alle 4 viikon välein 61,7 %).
Kliininen remissio ajan kuluessa
CDAI-pisteet kirjattiin potilaiden jokaisella käynnillä. Kliinisessä remissiossa olevien potilaiden osuus viikkoon 48 mennessä esitetään kuvassa 3.
Kuva 3. Kliinisessä remissiossa olevien potilaiden osuus yhdistettyjen GALAXI 2- ja GALAXI 3 ‑tutkimusten viikkoon 48 mennessä
Terveyteen liittyvä elämänlaatu
Guselkumabihoitoryhmissä havaittiin viikon 12 aikapisteessä elämänlaadun paranemista lähtötilanteesta enemmän kuin lumehoidon yhteydessä, mikä todettiin tulehduksellista suolistosairautta (IBD) koskevan spesifisen elämänlaatuarvioinnin IBDQ-kokonaispisteillä arvioituna. Tämä paraneminen säilyi kummassakin tutkimuksessa viikkoon 48 saakka.
GRAVITI
Vaiheen III GRAVITI-tutkimuksessa keskivaikean tai vaikean aktiivisen Crohnin taudin määritelmä oli CDAI-pisteet ≥ 220 – ≤ 450 ja Crohnin tautia koskevat (SES-CD) pisteet ≥ 6 (tai ≥ 4, jos potilaalla oli ileumiin rajoittunut tauti) sekä keskimääräinen päivittäinen ulostamistiheys ≥ 4 tai keskimääräiset päivittäiset vatsakipua koskevat pisteet ≥ 2.
GRAVITI-tutkimuksessa potilaat satunnaistettiin suhteessa 1:1:1 saamaan 400 mg guselkumabia ihon alle induktiohoitona viikoilla 0, 4 ja 8 ja sen jälkeen 100 mg guselkumabia 8 viikon välein ihon alle ylläpitohoitona tai 400 mg guselkumabia ihon alle induktiohoitona viikoilla 0, 4 ja 8 ja sen jälkeen 200 mg guselkumabia 4 viikon välein ihon alle ylläpitohoitona tai lumelääkettä. Kaikki lumeryhmän potilaat, jotka täyttivät varalääkityksen kriteerit, saivat induktioannostuksena 400 mg guselkumabia ihon alle viikoilla 16, 20 ja 24 ja sen jälkeen 100 mg guselkumabia ihon alle 8 viikon välein.
Yhteensä 347 potilasta arvioitiin. Potilaiden iän mediaani oli 36 vuotta (vaihteluväli 18–83 vuotta); 58,5 % oli miehiä, ja 66 % identifioitui valkoihoisiksi, 21,9 % aasialaisiksi ja 2,6 % mustaihoisiksi.
GRAVITI-tutkimuksessa 46,4 %:lla potilaista vähintään yksi aiempi biologinen hoito oli epäonnistunut, 46,4 % ei ollut aiemmin saanut biologista hoitoa ja 7,2 % oli aiemmin saanut biologista hoitoa eikä hoito ollut epäonnistunut. Lähtötilanteessa 29,7 % potilaista sai suun kautta otettavia kortikosteroideja ja 28,5 % potilaista sai tavanomaisia immunomodulaattoreita.
Rinnakkaisten ensisijaisten ja tärkeimpien toissijaisten tehon päätetapahtumien viikon 12 aikapisteen tulosten vertailu lumelääkkeeseen esitetään taulukossa 11.
| Taulukko 11. Guselkumabihoidolla rinnakkaiset ensisijaiset ja tärkeimmät toissijaiset tehon päätetapahtumat GRAVITI‑tutkimuksen viikon 12 aikapisteessä saavuttaneiden potilaiden osuus verrattuna lumelääkkeeseen | ||
| Lumelääke | 400 mg guselkumabia injektiona ihon allea | |
| Rinnakkaiset ensisijaiset tehon päätetapahtumat | ||
| Kliininen remissiob viikon 12 aikapisteessä | ||
| Kokonaispotilasjoukko | 21 % (N = 117) | 56 %c (N = 230) |
| Ei aiempaa biologista hoitoad | 25 % (N = 56) | 50 % (N = 105) |
| Aiempi biologinen hoito epäonnistunute | 17 % (N = 53) | 60 % (N = 108) |
| Endoskooppinen vastef viikon 12 aikapisteessä | ||
| Kokonaispotilasjoukko | 21 % (N = 117) | 41 %c (N = 230) |
| Ei aiempaa biologista hoitoad | 27 % (N = 56) | 49 % (N = 105) |
| Aiempi biologinen hoito epäonnistunute | 17 % (N = 53) | 33 % (N = 108) |
| Tärkeimmät toissijaiset tehon päätetapahtumat | ||
| Kliininen vasteg viikon 12 aikapisteessä | ||
| Kokonaispotilasjoukko | 33 % (N = 117) | 73 %c (N = 230) |
| Ei aiempaa biologista hoitoad | 38 % (N = 56) | 68 % (N = 105) |
| Aiempi biologinen hoito epäonnistunute | 28 % (N = 53) | 78 % (N = 108) |
| PRO-2-remissioh viikon 12 aikapisteessä | ||
| Kokonaispotilasjoukko | 17 % (N = 117) | 49 %c (N = 230) |
| Ei aiempaa biologista hoitoad | 18 % (N = 56) | 44 % (N = 105) |
| Aiempi biologinen hoito epäonnistunute | 17 % (N = 53) | 52 % (N = 108) |
| a 400 mg guselkumabia ihon alle viikolla 0, viikolla 4 ja viikolla 8 b Kliininen remissio: CDAI-pisteet < 150 c p < 0,001 d Lisäksi 8 potilasta lumeryhmässä ja 17 potilasta 400 mg guselkumabia ihon alle saaneessa ryhmässä oli aiemmin altistunut biologiselle hoidolle eikä hoito ollut epäonnistunut. e Sisältää riittämättömän vasteen Crohnin tautiin annettuun biologiseen hoitoon (TNF-estäjät, vedolitsumabi) sekä vasteen häviämisen näille hoidoille tai kyvyttömyyden sietää näitä hoitoja. f Endoskooppinen vaste: SES-CD-pisteiden paraneminen ≥ 50 % lähtötilanteesta. g Kliininen vaste: CDAI-pisteiden pieneneminen ≥ 100 pistettä lähtötilanteesta tai CDAI-pisteet < 150. h PRO-2-remissio: vatsakipua koskevat keskimääräiset päivittäiset pisteet enintään 1 ja ulostustiheyttä koskevat keskimääräiset päivittäiset pisteet enintään 3 eikä vatsakivun pahenemista tai ulostustiheyden lisääntymistä lähtötilanteesta. | ||
Merkittävästi suuremmalla osuudella potilaista, jotka saivat 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 100 mg guselkumabia ihon alle 8 viikon välein tai 200 mg ihon alle 4 viikon välein, todettiin kliininen remissio viikon 24 aikapisteessä verrattuna lumelääkettä saaneisiin (400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 100 mg guselkumabia ihon alle 8 viikon välein saaneista 60,9 % ja 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 200 mg ihon alle 4 viikon välein saaneista 58,3 % vs. lumehoitoa saaneista 21,4 %, kummankin vertailun p-arvo < 0,001). Kliininen remissio todettiin viikon 48 aikapisteessä 60 %:lla potilaista, jotka saivat 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 100 mg guselkumabia ihon alle 8 viikon välein, ja 66,1 %:lla potilaista, jotka saivat 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 200 mg ihon alle 4 viikon välein (kummankin p-arvo < 0,001 lumelääkkeeseen verrattuna).
Endoskooppinen vaste todettiin viikon 48 aikapisteessä 44,3 %:lla potilaista, jotka saivat 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 100 mg guselkumabia ihon alle 8 viikon välein, ja 51,3 %:lla potilaista, jotka saivat 400 mg guselkumabia ihon alle induktiohoitona ja sen jälkeen 200 mg ihon alle 4 viikon välein (kummankin p-arvo < 0,001 lumelääkkeeseen verrattuna).
Terveyteen liittyvä elämänlaatu
GRAVITI-tutkimuksessa IBD-spesifisessä elämänlaadussa havaittiin kliinisesti merkittävää paranemista lumelääkkeeseen verrattuna arvioitaessa sitä IBDQ-kokonaispisteillä viikon 12 ja viikon 24 aikapisteissä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset guselkumabin käytöstä haavaisen paksusuolitulehduksen ja Crohnin taudin hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Terveille tutkittaville ihon alle annetun 100 mg:n kertainjektion jälkeen guselkumabin maksimipitoisuus (Cmax) seerumissa oli keskimäärin (± keskihajonta) 8,09 ± 3,68 mikrog/ml noin 5,5 vuorokauteen mennessä annoksen jälkeen. Guselkumabin absoluuttisen biologisen hyötyosuuden arvioitiin olevan terveille tutkittaville ihon alle annetun 100 mg:n kertainjektion jälkeen noin 49 %.
Läiskäpsoriaasia sairastavilla potilailla guselkumabin vakaan tilan pitoisuus seerumissa saavutettiin viikoilla 0 ja 4 ja sen jälkeen 8 viikon välein ihon alle annettujen 100 mg:n guselkumabiannosten jälkeen viikkoon 20 mennessä. Vakaan tilan pienimmät guselkumabipitoisuudet seerumissa olivat läiskäpsoriaasia sairastavilla potilailla tehdyissä kahdessa vaiheen III tutkimuksessa keskimäärin (± keskihajonta) 1,15 ± 0,73 mikrog/ml ja 1,23 ± 0,84 mikrog/ml.
Guselkumabin farmakokinetiikka oli nivelpsoriaasia sairastavilla potilailla samankaltainen kuin psoriaasia sairastavilla potilailla. Viikoilla 0 ja 4 sekä sen jälkeen 8 viikon välein ihon alle annettujen 100 mg:n guselkumabiannosten jälkeen vakaan tilan pienimmät guselkumabipitoisuudet seerumissa olivat myös keskimäärin noin 1,2 mikrog/ml. Ihon alle 4 viikon välein annettujen 100 mg:n guselkumabiannosten jälkeen vakaan tilan pienimmät guselkumabipitoisuudet seerumissa olivat keskimäärin noin 3,8 mikrog/ml.
Guselkumabin farmakokinetiikka oli haavaista paksusuolitulehdusta ja Crohnin tautia sairastavilla potilailla samankaltainen. Haavaista paksusuolitulehdusta sairastavilla potilailla guselkumabin keskimääräinen huippupitoisuus seerumissa oli 8 viikon aikapisteessä suositellun laskimoon annettavan induktiohoito-ohjelman jälkeen, eli viikoilla 0, 4 ja 8 annettujen 200 mg:n guselkumabiannosten jälkeen, 68,27 mikrog/ml, ja Crohnin tautia sairastavilla potilailla se oli 70,5 mikrog/ml.
Guselkumabin keskimääräiseksi huippupitoisuudeksi seerumissa viikon 8 aikapisteessä arvioitiin haavaista paksusuolitulehdusta sairastavilla potilailla 28,8 mikrog/ml ja Crohnin tautia sairastavilla potilailla 27,7 mikrog/ml, kun potilaat olivat saaneet suositellun induktiohoito-ohjelman 400 mg guselkumabia ihon alle viikoilla 0, 4 ja 8. Systeeminen kokonaisaltistus (AUC) oli suositellun induktiohoidon jälkeen samankaltainen annettaessa induktiohoito ihon alle tai laskimoon.
Haavaista paksusuolitulehdusta sairastavilla potilailla guselkumabin keskimääräinen vakaan tilan pienin (trough) pitoisuus seerumissa oli ihon alle annettavan ylläpitohoidon jälkeen seuraava: 8 viikon välein annettujen 100 mg:n guselkumabiannosten jälkeen 1,4 mikrog/ml ja 4 viikon välein annettujen 200 mg:n guselkumabiannosten jälkeen 10,7 mikrog/ml.
Crohnin tautia sairastavilla potilailla guselkumabin keskimääräinen vakaan tilan pienin (trough) pitoisuus seerumissa oli ihon alle annettavan ylläpitohoidon jälkeen seuraava: 8 viikon välein annettujen 100 mg:n guselkumabiannosten jälkeen 1,2 mikrog/ml ja 4 viikon välein annettujen 200 mg:n guselkumabiannosten jälkeen 10,1 mikrog/ml.
Jakautuminen
Terminaalisen vaiheen (Vz) jakautumistilavuuden keskiarvo oli terveille tutkittaville laskimoon annetun kerta-annoksen jälkeen kaikissa tutkimuksissa noin 7–10 l.
Biotransformaatio
Guselkumabin tarkkaa metaboliareittiä ei ole selvitetty. Guselkumabi on ihmisen IgG monoklonaalinen vasta-aine, joten se hajoaa oletettavasti pieniksi peptideiksi ja aminohapoiksi kataboliareittien kautta samalla tavoin kuin endogeeninen IgG.
Eliminaatio
Systeemisen puhdistuman (CL) keskiarvo oli terveille tutkittaville laskimoon annetun kerta-annoksen jälkeen kaikissa tutkimuksissa 0,288–0,479 l/vrk. Guselkumabin puoliintumisajan (T½) keskiarvo oli terveillä tutkittavilla noin 17 vuorokautta, läiskäpsoriaasia sairastavilla potilailla noin 15–18 vuorokautta kaikissa tutkimuksissa ja haavaista paksusuolitulehdusta sairastavilla tai Crohnin tautia potilailla noin 17 vuorokautta.
Populaatiofarmakokineettiset analyysit osoittivat, että tulehduskipulääkkeiden, atsatiopriinin, merkaptopuriinin, suun kautta otettavien kortikosteroidien ja csDMARD-lääkkeiden, kuten metotreksaatin, samanaikainen käyttö ei vaikuttanut guselkumabin puhdistumaan.
Lineaarisuus/ei-lineaarisuus
Terveille tutkittaville tai läiskäpsoriaasia sairastaville potilaille ihon alle annetun 10−300 mg:n kertainjektion jälkeen guselkumabin systeeminen altistus (Cmax ja AUC) suureni suunnilleen suhteessa annokseen. Haavaista paksusuolitulehdusta tai Crohnin tautia sairastavilla potilailla guselkumabipitoisuus seerumissa oli suunnilleen suhteessa annokseen, kun valmiste annettiin laskimoon.
Pediatriset potilaat
Guselkumabin farmakokinetiikkaa haavaista paksusuolitulehdusta ja Crohnin tautia sairastavilla pediatrisilla potilailla ei ole varmistettu.
Iäkkäät potilaat
Iäkkäillä potilailla ei ole tehty erityisiä tutkimuksia. Guselkumabille vaiheen III kliinisissä tutkimuksissa altistuneista ja populaatiofarmakokineettiseen analyysiin mukaan otetuista 1 384 läiskäpsoriaasia sairastavasta potilaasta 70 potilasta oli vähintään 65-vuotiaita, ja heistä 4 potilasta oli vähintään 75-vuotiaita. Guselkumabille vaiheen III kliinisissä tutkimuksissa altistuneista 746 nivelpsoriaasia sairastavasta potilaasta yhteensä 38 potilasta oli vähintään 65-vuotiaita ja yksikään potilas ei ollut 75‑vuotias tai vanhempi. Guselkumabille vaiheen II/III kliinisissä tutkimuksissa altistuneista ja populaatiofarmakokineettiseen analyysiin mukaan otetuista 859:stä haavaista paksusuolitulehdusta sairastavasta potilaasta yhteensä 52 potilasta oli vähintään 65-vuotiaita ja 9 potilasta oli vähintään 75-vuotiaita. Guselkumabille vaiheen III kliinisissä tutkimuksissa altistuneista ja populaatiofarmakokineettiseen analyysiin mukaan otetuista 1 009 Crohnin tautia sairastavasta potilaasta yhteensä 39 potilasta oli vähintään 65-vuotiaita ja 5 potilasta oli vähintään 75‑vuotiaita.
Läiskäpsoriaasia, nivelpsoriaasia, haavaista paksusuolitulehdusta ja Crohnin tautia sairastavista potilaista tehdyt populaatiofarmakokineettiset analyysit eivät osoittaneet CL/F-estimaatissa ilmeisiä muutoksia ≥ 65-vuotiailla verrattuna < 65-vuotiaisiin, mikä viittaa siihen, että iäkkäiden potilaiden annosta ei tarvitse muuttaa.
Munuaisten tai maksan vajaatoimintaa sairastavat potilaat
Munuaisten tai maksan vajaatoiminnan vaikutuksesta guselkumabin farmakokinetiikkaan ei ole tehty spesifisiä tutkimuksia. Muuttumaton guselkumabi on monoklonaalinen IgG vasta-aine, ja sen eliminaatio munuaisten kautta on oletettavasti vähäistä ja merkitys on vähäinen. Vastaavasti maksan vajaatoiminta ei oletettavasti vaikuta guselkumabin puhdistumaan, koska monoklonaaliset IgG vasta-aineet eliminoituvat pääasiassa kataboloitumalla solunsisäisesti. Populaatiofarmakokineettisten analyysien perusteella kreatiniinipuhdistumalla tai maksan toiminnalla ei ollut merkittävää vaikutusta guselkumabin puhdistumaan.
Paino
Guselkumabin puhdistuma lisääntyy ja jakautumistilavuus suurenee painon lisääntyessä, mutta kliinisiin tutkimustietoihin perustuvat havainnot osoittavat, ettei annosta tarvitse muuttaa painon perusteella.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, lisääntymistoksisuutta ja pre- ja postnataalista kehitystä koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Cynomolgus-apinoilla tehdyissä toistuvan altistuksen aiheuttamaa toksisuutta koskeneissa tutkimuksissa laskimoon ja ihon alle annettu guselkumabi oli hyvin siedetty. Viikoittain apinoille ihon alle annetuista 50 mg/kg annoksista aiheutuva altistus (AUC) oli vähintään 23-kertainen verrattuna suurimpaan kliiniseen altistukseen laskimoon annetun 200 mg:n annoksen jälkeen. Cynomolgus-apinoilla tehdyissä toistuvan altistuksen aiheuttamaa toksisuutta tai kohdennettua kardiovaskulaarista turvallisuutta koskeneissa farmakologisissa tutkimuksissa ei havaittu haitallista immunotoksisuutta tai kardiovaskulaarista turvallisuutta koskevia farmakologisia vaikutuksia.
Histopatologisissa tutkimuksissa ei havaittu preneoplastisia muutoksia eläimillä, joita hoidettiin enintään 24 viikon ajan, eikä 12 viikon toipumisjakson jälkeen, jolloin vaikuttavaa ainetta oli seerumissa havaittavissa.
Guselkumabilla ei tehty mutageenisuus- eikä karsinogeenisuustutkimuksia.
Guselkumabia ei havaittu cynomolgus-apinoiden maidossa, kun mittaus tehtiin 28 päivää synnytyksen jälkeen.
Farmaseuttiset tiedot
Apuaineet
Histidiini
Histidiinimonohydrokloridimonohydraatti
Polysorbaatti 80 (E433)
Sakkaroosi
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C). Ei saa jäätyä.
Pidä esitäytetty ruisku tai esitäytetty kynä ulkopakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TREMFYA injektioneste, liuos, esitäytetty ruisku
200 mg (L:ei) 1 kpl (2 ml (100 mg/ml), neulansuojus, automaattinen neulanpistosuoja) (2002,04 €)
TREMFYA PUSHPEN injektioneste, liuos, esitäytetty kynä
200 mg (L:ei) 1 kpl (2 ml (100 mg/ml), automaattinen neulanpistosuoja) (2002,04 €)
PF-selosteen tieto
Tremfya 200 mg injektioneste, liuos, esitäytetty ruisku
2 ml liuosta lasisessa esitäytetyssä ruiskussa, jossa on bromobutyylikumitulppa, kiinteä neula ja neulansuojus sekä automaattinen neulanpistosuoja.
Tremfya-injektionestettä on saatavana yhden esitäytetyn ruiskun pakkauksina sekä kahden esitäytetyn ruiskun (kaksi yhden esitäytetyn ruiskun pakkausta sisältävinä) kerrannaispakkauksina.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Tremfya 200 mg injektioneste, liuos, esitäytetty kynä
2 ml liuosta lasisessa esitäytetyssä ruiskussa esitäytetyn kynän sisällä. Esitäytetyssä ruiskussa on bromobutyylikumitulppa, ja kynässä on automaattinen neulanpistosuoja.
Tremfya-injektionestettä on saatavana yhden esitäytetyn kynän pakkauksina sekä kahden esitäytetyn kynän (kaksi yhden esitäytetyn kynän pakkausta sisältävinä) kerrannaispakkauksina.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkasta ja väritöntä tai vaaleankeltaista ja se saattaa sisältää joitakin pieniä valkoisia tai kirkkaita hiukkasia. Sen tavoite-pH on 5,8 ja likimääräinen osmolaarisuus on 367,5 mOsm/l.
Käyttö- ja käsittelyohjeet
Kun esitäytetty ruisku tai esitäytetty kynä on otettu jääkaapista, anna esitäytetyn ruiskun tai esitäytetyn kynän olla ulkopakkauksessa ja anna sen lämmetä huoneenlämpöiseksi. Odota 30 minuuttia ennen kuin annat Tremfya‑injektion. Esitäytettyä ruiskua tai esitäytettyä kynää ei saa ravistaa.
Esitäytetty ruisku tai esitäytetty kynä suositellaan tarkistamaan silmämääräisesti ennen käyttöä. Liuoksen pitää olla kirkasta, väritöntä tai vaaleankeltaista, ja se saattaa sisältää joitakin pieniä valkoisia tai kirkkaita hiukkasia. Jos liuos on sameaa tai värjäytynyttä tai siinä on isoja hiukkasia, Tremfya‑liuosta ei saa käyttää.
Jokainen pakkaus sisältää Käyttöohjeet, joissa on tarkat ohjeet injektion valmisteluun ja esitäytetyn ruiskun tai esitäytetyn kynän käyttöön.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TREMFYA injektioneste, liuos, esitäytetty ruisku
200 mg 1 kpl
TREMFYA PUSHPEN injektioneste, liuos, esitäytetty kynä
200 mg 1 kpl
- Ei korvausta.
ATC-koodi
L04AC16
Valmisteyhteenvedon muuttamispäivämäärä
18.12.2025
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
