FABHALTA kapseli, kova 200 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Potilaan turvakortti - Tärkeää turvallisuustietoa FABHALTA-valmistetta käyttäville potilaille
Terveydenhuollon ammattilainen
Terveydenhuollon ammattilaisen opas FABHALTA iptakopaani
Yleinen
Opas potilaalle/potilasta hoitavalle, Fabhalta iptakopaani
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi kapseli sisältää iptakopaanihydrokloridimonohydraattia määrän, joka vastaa 200 mg iptakopaania (iptacopan).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova kapseli (kapseli)
Kliiniset tiedot
Käyttöaiheet
Kohtauksittainen yöllinen hemoglobinuria
FABHALTA on tarkoitettu monoterapiahoidoksi kohtauksittaista yöllistä hemoglobinuriaa (PNH) sairastaville aikuispotilaille, joilla on hemolyyttinen anemia (ks. kohta Farmakodynamiikka).
Komplementin 3 glomerulopatia
FABHALTA on tarkoitettu komplementin 3 glomerulopatiaa (C3G) sairastaville aikuispotilaille käytettäväksi yhdessä reniini-angiotensiinijärjestelmän (RAS) estäjän kanssa tai kun potilas ei siedä RAS:n estäjiä tai kun RAS:n estäjät ovat vasta-aiheisia (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Suositeltu annos on 200 mg suun kautta kahdesti vuorokaudessa.
Terveydenhuollon ammattilaisten on korostettava potilaille annostusaikataulun noudattamisen tärkeyttä. PNH-potilailla annostusaikataulun noudattaminen on tärkeää hemolyysiriskin minimoimiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos annos tai annoksia on jäänyt ottamatta, potilaita on neuvottava ottamaan yksi annos mahdollisimman pian (vaikka seuraavaan aikataulun mukaiseen annokseen olisi lyhyt aika) ja noudattamaan sen jälkeen tavanomaista annostusaikataulua. Jos PNH-potilaalta on jäänyt ottamatta useita peräkkäisiä annoksia, häntä on seurattava mahdollisten hemolyysin merkkien ja oireiden havaitsemiseksi.
PNH on sairaus, joka edellyttää pitkäaikaista hoitoa. Tämän lääkevalmisteen käytön lopettamista ei suositella, ellei se ole kliinisesti tarpeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
PNH-potilaat, joiden hoidoksi vaihdetaan iptakopaani C5 ‑estäjän (ekulitsumabi, ravulitsumabi) tai muun PNH:n hoidon tilalle
Mahdollisen hemolyysiriskin pienentäminen hoidon äkillisen lopettamisen yhteydessä:
- Ekulitsumabihoidosta vaihtaville potilaille iptakopaani on aloitettava viimeistään viikon kuluttua viimeisen ekulitsumabiannoksen jälkeen.
- Ravulitsumabista vaihtaville potilaille iptakopaani on aloitettava viimeistään 6 viikon kuluttua viimeisen ravulitsumabiannoksen jälkeen.
Ekulitsumabia ja ravulitsumabia lukuun ottamatta vaihtoa muista komplementin estäjistä ei ole tutkittu.
C3G-potilaat, joille on tehty munuaisensiirto (uusiutunut C3G)
Uusiutuneen C3G:n diagnoosi tulee tehdä histologisen siirretyn munuaisen glomeruluksiin kertyneen C3:n perusteella. C3:n kertyminen voidaan havaita rutiininomaisessa siirron jälkeisessä biopsiassa; muutoin biopsia on tehtävä, kun kliiniset oireet viittaavat uusiutuneeseen C3G:hen. Kuten tutkimuksessa X2202 (ks. kohta Farmakodynamiikka), iptakopaanihoito voidaan aloittaa ennen kliinisten oireiden, kuten arvioidun glomerulussuodatusnopeuden (eGFR) pienenemisen tai virtsan proteiini-kreatiniinisuhteen (UPCR) suurenemisen, ilmaantumista. Kliinisistä tutkimuksista on saatavilla vain vähän tietoa iptakopaanin käytöstä potilailla, joilla on elinsiirron jälkeen uusiutunut C3G (ks. kohta Farmakodynamiikka).
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa 65 vuotta täyttäneille (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä (GFRe 60 – < 90 ml/min) tai keskivaikea (GFRe 30 – < 60 ml/min) munuaisten vajaatoiminta. Tällä hetkellä tietoja ei ole saatavilla potilaista, joilla on vaikea munuaisten vajaatoiminta tai jotka ovat dialyysihoidossa, joten annossuosituksia ei voida antaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Iptakopaanin käyttöä ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (Child–Pugh‑luokka C). Annosta ei tarvitse muuttaa potilaille, joilla maksan vajaatoiminta on lievä (Child–Pugh‑luokka A) tai keskivaikea (Child–Pugh‑luokka B) (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
FABHALTA‑valmisteen turvallisuutta ja tehoa alle 18‑vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Suun kautta.
Tämä lääkevalmiste voidaan ottaa ruoan kanssa tai ilman ruokaa (ks. kohta Farmakokinetiikka).
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Potilaalla ei ole voimassa olevia Neisseria meningitidis‑ ja Streptococcuspneumoniae ‑rokotuksia, paitsi, jos hoidon viivästymisen aiheuttama riski arvioidaan suuremmaksi kuin näiden kapselillisten bakteerien aiheuttamien infektioiden kehittymisen riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Potilaalla on kapselillisen bakteerin, kuten Neisseria meningitidis‑, Streptococcus pneumoniae‑ tai tyypin B Haemophilus influenzae ‑bakteerin aiheuttama infektio, kun hoito on tarkoitus aloittaa.
Varoitukset ja käyttöön liittyvät varotoimet
Kapselillisten bakteerien aiheuttamat vakavat infektiot
Komplementin estäjien, kuten iptakopaanin, käyttö voi altistaa henkilön kapselillisten bakteerien aiheuttamille vakaville, henkeä uhkaaville tai kuolemaan johtaville infektioille. Infektioriskin pienentämiseksi kaikki potilaat on rokotettava kapselillisia bakteereja, kuten Neisseria meningitidis‑ ja Streptococcus pneumoniae ‑bakteereja, vastaan. Myös tyypin B Haemophilus influenzae ‑rokotusta suositellaan, jos rokote on saatavilla. Terveydenhuollon ammattilaisten on tutustuttava paikallisiin rokotussuosituksiin.
Rokotukset on annettava vähintään kaksi viikkoa ennen ensimmäistä iptakopaaniannosta. Jos hoito täytyy aloittaa ennen rokotusta, potilas on rokotettava mahdollisimman pian ja hänelle on annettava profylaktista mikrobilääkehoitoa, kunnes rokotuksesta on kulunut kaksi viikkoa.
Tarvittaessa potilaat voidaan rokottaa uudelleen paikallisten rokotussuositusten mukaisesti.
Rokotus pienentää vakavan infektion riskiä, mutta ei poista sitä kokonaan. Vakava infektio voi edetä nopeasti henkeä uhkaavaksi tai kuolemaan johtavaksi, ellei sitä tunnisteta ja hoideta varhaisessa vaiheessa. Potilaille on kerrottava vakavien infektioiden varhaisista merkeistä ja oireista, ja heitä on seurattava niiden varalta. Infektiota epäiltäessä potilaan tila on arvioitava ja hoito aloitettava välittömästi. Iptakopaanin käyttöä vakavan infektion hoidon aikana voidaan harkita riskien ja hyötyjen arvioinnin perusteella (ks. kohta Haittavaikutukset).
PNH:n laboratorioseuranta
Iptakopaanihoitoa saavia PNH-potilaita on seurattava säännöllisesti hemolyysin merkkien ja oireiden varalta, mukaan lukien mittaamalla laktaasidehydrogenaasiarvo (LDH).
PNH:n oireiden seuranta hoidon lopetuksen jälkeen
Jos PNH-potilaan hoito on lopetettava, häntä on seurattava hemolyysin oireiden ja löydösten varalta vähintään kaksi viikkoa viimeisen annoksen jälkeen. Näitä oireita ja löydöksiä ovat esimerkiksi LDH-arvon suureneminen samanaikaisesti äkillisen hemoglobiiniarvon pienenemisen tai PNH‑kloonin koon pienenemisen kanssa, uupumus, hemoglobinuria, vatsakipu, hengenahdistus, nielemisvaikeus, erektiohäiriö ja merkittävät vaskulaariset haittatapahtumat, kuten laskimo‑ tai valtimotromboosi. Jos hoito on lopetettava, on harkittava toista hoitovaihtoehtoa.
Jos iptakopaanin käytön lopettamisen jälkeen ilmenee hemolyysiä, hoidon aloittamista uudelleen on harkittava.
Samanaikainen käyttö muiden lääkevalmisteiden kanssa
Iptakopaanin käyttöä samanaikaisesti voimakkaiden CYP2C8:n, UGT1A1:n, Pgp:n, BCRP:n ja OATP1B1/3:n indusorien kanssa ei ole kliinisesti tutkittu, joten samanaikaista käyttöä ei suositella iptakopaanin tehon mahdollisen heikentymisen takia (ks. kohta Yhteisvaikutukset). Jos vaihtoehtoista lääkevalmistetta ei pystytä valitsemaan, PNH-potilaita on seurattava mahdollisten hemolyysin merkkien ja oireiden havaitsemiseksi.
C3G-potilaiden hoito
Immunosuppressiivisilla lääkevalmisteilla hoidetuilla C3G-potilailla iptakopaani saattaa vähentää proteinuriaa vain vaatimattomasti, mikä liittyy todennäköisesti C3G:n hoitoresistentimpään luonteeseen näillä potilailla.
Iptakopaanin käytöstä potilailla, joilla on C3G omassa munuaisessa ja joiden proteinuria on hoidon alkaessa alle 1 g/g, ei ole kokemusta.
Koulutusmateriaali
Jokaisen lääkärin, joka aikoo määrätä FABHALTA‑valmistetta, on varmistettava, että hän on saanut lääkäreille tarkoitetun koulutusmateriaalin ja tutustunut siihen. Lääkärin on selitettävä potilaalle FABHALTA‑hoitoon liittyvät hyödyt ja riskit ja keskusteltava niistä potilaan kanssa sekä annettava potilaalle potilaan tietopaketti. Potilasta on neuvottava hakeutumaan välittömästi hoitoon, jos hän havaitsee vakavan infektion merkkejä tai oireita tai hoidon lopettamisen jälkeen ilmaantuvia merkkejä tai oireita vakavasta hemolyysistä (PNH-potilaat).
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutukset iptakopaaniin
Voimakkaat CYP2C8:n, UGT1A1:n, PgP:n, BCRP:n ja OATP1B1/3:n indusorit
Iptakopaanin käyttöä samanaikaisesti voimakkaiden CYP2C8:n, UGT1A1:n, PgP:n, BCRP:n ja OATP1B1/3:n indusorien, kuten rifampisiinin kanssa ei ole kliinisesti tutkittu, mutta niiden samanaikaista käyttöä iptakopaanin kanssa ei suositella, koska iptakopaanin teho saattaa heikentyä (ks. Kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iptakopaanin vaikutukset muihin lääkevalmisteisiin
CYP3A4:n substraatit
In vitro -tietojen perusteella iptakopaanilla on CYP3A4-entsyymiä indusoiva vaikutus, ja se saattaa pienentää altistusta sensitiivisille CYP3A4:n substraateille. Iptakopaanin ja sensitiivisten CYP3A4:n substraattien samanaikaista käyttöä ei ole tutkittu kliinisesti. Varovaisuutta on noudatettava, jos on tarpeen käyttää iptakopaania samanaikaisesti sensitiivisten CYP3A4:n substraattien kanssa, erityisesti jos kyse on lääkeaineista, joiden terapeuttinen leveys on pieni (esim. karbamatsepiini, siklosporiini, ergotamiini, fentanyyli, pimotsidi, kinidiini, sirolimuusi, takrolimuusi).
CYP2C8:n substraatit
In vitro -tietojen perusteella iptakopaanilla on aikariippuvainen CYP2C8-entsyymiä estävä vaikutus, ja se saattaa suurentaa altistusta sensitiivisille CYP2C8:n substraateille, kuten repaglinidille, dasabuviirille tai paklitakselille. Iptakopaanin ja sensitiivisten CYP2C8:n substraattien samanaikaista käyttöä ei ole tutkittu kliinisesti. Varovaisuutta on noudatettava, jos on tarpeen käyttää iptakopaania samanaikaisesti sensitiivisten CYP2C8:n substraattien kanssa.
Raskaus ja imetys
Raskaus
Iptakopaanin käytöstä raskaana oleville naisille ei ole olemassa tietoja tai on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria eikä epäsuoria lisääntymistoksisia vaikutuksia 2–8-kertaisilla altistuksilla verrattuna ihmisen suurimpiin suositusannoksiin (MRHD) (ks. kohta Prekliiniset tiedot turvallisuudesta).
PNH:hon liittyy raskauden aikana äitiin kohdistuvia haitallisia vaikutuksia, kuten vaikeutuvia sytopenioita, tromboottisia tapahtumia, infektioita, verenvuotoja, keskenmenoja ja lisääntynyttä äitikuolleisuutta, sekä sikiöön kohdistuvia haitallisia vaikutuksia, kuten sikiökuolemia ja ennenaikaisia synnytyksiä.
C3G:hen saattaa liittyä raskauden aikana äitiin kohdistuvia haitallisia vaikutuksia, erityisesti pre-eklampsiaa ja keskenmenoja, sekä sikiöön kohdistuvia haitallisia vaikutuksia, kuten ennenaikaisuutta ja pieni syntymäpaino.
Iptakopaanin käyttöä raskaana olevilla tai raskautta suunnittelevilla naisilla voidaan tarvittaessa harkita vain huolellisen riskien ja hyötyjen arvioinnin perusteella.
Imetys
Ei tiedetä, erittyykö iptakopaani ihmisillä äidinmaitoon. Iptakopaanin vaikutuksia imetettävään vauvaan tai maidoneritykseen ei tunneta.
Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. On päätettävä, lopetetaanko imetys vai pidättäydytäänkö FABHALTA‑hoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Iptakopaanin vaikutuksista ihmisen hedelmällisyyteen ei ole olemassa tietoja. Saatavilla olevat ei‑kliiniset tiedot eivät viittaa siihen, että iptakopaanihoidolla olisi vaikutusta hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
FABHALTA‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitettuja haittavaikutuksia aikuisilla PNH-potilailla olivat ylähengitystieinfektio (18,9 %), päänsärky (18,3 %) ja ripuli (11,0 %). Yleisimmin ilmoitettu vakava haittavaikutus oli virtsatieinfektio (1,2 %).
Yleisimmin ilmoitettu haittavaikutus aikuisilla C3G-potilailla oli ylähengitystieinfektio (12,9 %). Yleisimmin ilmoitettu vakava haittavaikutus oli pneumokokin aiheuttama infektio (1 %).
Haittavaikutustaulukko
Taulukossa 1 esitetään haittavaikutukset, joita havaittiin kliinisissä tutkimuksissa, joissa iptakopaania annettiin PNH- ja C3G-potilaille. Haittavaikutukset on luokiteltu MedDRA‑elinjärjestelmän ja esiintymistiheyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000).
Haittavaikutukset on esitetty kussakin yleisyysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1 Haittavaikutukset
Elinjärjestelmäluokka Haittavaikutus | Yleisyysluokka | |
| PNH | C3G | |
| Infektiot | ||
| Ylähengitystieinfektio1 | Hyvin yleinen | Hyvin yleinen |
| Virtsatieinfektio2 | Yleinen | |
| Bronkiitti3 | Yleinen | |
| Pneumokokin aiheuttama infektio4 | Yleinen | |
| Keuhkokuume, bakteeriperäinen | Melko harvinainen | |
| Veri ja imukudos | ||
| Trombosyyttimäärän pieneneminen | Yleinen | |
| Hermosto | ||
| Päänsärky5 | Hyvin yleinen | |
| Huimaus | Yleinen | |
| Ruoansulatuselimistö | ||
| Ripuli | Hyvin yleinen | |
| Vatsakipu6 | Yleinen | |
| Pahoinvointi | Yleinen | |
| Iho ja ihonalainen kudos | ||
| Nokkosihottuma | Melko harvinainen | |
| Luusto, lihakset ja sidekudos | ||
| Nivelkipu | Yleinen | |
1 Ylähengitystieinfektio sisältää seuraavat haittavaikutustermit: influenssa, nasofaryngiitti, faryngiitti, riniitti, sinusiitti, ylähengitystieinfektio ja virusperäinen ylähengitystieinfektio. 2 Virtsatieinfektio sisältää seuraavat haittavaikutustermit: virtsatieinfektio ja Escherichia coli ‑bakteerin aiheuttama kystiitti. 3 Bronkiitti sisältää seuraavat haittavaikutustermit: bronkiitti, hemofilusbronkiitti ja bakteeribronkiitti. 4 Pneumokokin aiheuttama infektio sisältää seuraavat haittavaikutustermit: pneumokokin aiheuttama keuhkokuume ja pneumokokin aiheuttama sepsis. 5 Päänsärky sisältää seuraavat haittavaikutustermit: päänsärky ja epämukava tunne päässä. 6 Vatsakipu sisältää seuraavat haittavaikutustermit: vatsakipu, ylävatsakipu, vatsan arkuus ja epämukava tunne vatsassa. | ||
Valikoitujen haittavaikutusten kuvaus
Infektiot
PNH:ta koskeneissa kliinisissä tutkimuksissa yhdellä PNH-potilaalla 164:stä (0,6 %) ilmoitettiin vakava bakteeriperäinen keuhkokuume iptakopaanihoidon aikana; potilas oli saanut Neisseria meningitidis-, Streptococcus pneumoniae- ja tyypin B Haemophilus influenzae -rokotteet ja parani antibioottihoidolla samalla, kun iptakopaanihoitoa jatkettiin.
C3G:tä koskeneissa päättyneissä kliinisissä tutkimuksissa yhdellä C3G-potilaalla ilmoitettiin vakava pneumokokin aiheuttama keuhkokuume ja sepsis iptakopaanihoidon aikana; potilas oli saanut Neisseria meningitidis-, Streptococcus pneumoniae- ja tyypin B Haemophilus influenzae -rokotteet ja parani antibioottihoidolla. Iptakopaanihoito keskeytettiin ja sitä jatkettiin potilaan parannuttua infektiosta.
PNH-potilaiden trombosyyttimäärän pieneneminen
Trombosyyttimäärän pienenemistä ilmoitettiin 12 PNH‑potilaalla 164:stä (7 %). Näistä potilaista viidellä haittatapahtuma oli vaikeusasteeltaan lievä, viidellä keskivaikea ja kahdella vaikea. Potilailla, joilla haittatapahtuma oli vaikea, oli samanaikaisesti trombosyyttivasta‑aineita tai idiopaattinen luuytimen aplasia ja edeltävästi trombosytopenia. Haittatapahtumat ilmaantuivat iptakopaanihoidon kahden ensimmäisen kuukauden aikana seitsemällä ja pitemmän altistuksen jälkeen (111–951 vuorokautta) viidellä potilaalla 12:sta. Cut‑off‑ajankohtana seitsemän (58 %) potilaista oli toipunut tai haittatapahtumat olivat lievittymässä, ja iptakopaanihoitoa jatkettiin koko ajan kaikilla potilailla.
PNH-potilaiden veren kolesteroliarvon ja verenpaineen suureneminen
PNH:ta koskeneissa kliinisissä tutkimuksissa iptakopaania 200 mg kahdesti vuorokaudessa saaneilla potilailla kokonaiskolesteroliarvon ja LDL‑kolesteroliarvon keskimääräinen suureneminen lähtötilanteeseen verrattuna oli 0,7 mmol/l kuukauden 6 kohdalla. Keskiarvot pysyivät normaaleilla viitealueilla. Verenpainearvoissa havaittiin suurenemista, erityisesti diastolisessa verenpaineessa (suurenemisen keskiarvo 4,7 mmHg kuukauden 6 kohdalla). Diastolisen verenpaineen keskiarvo ei ylittänyt arvoa 80 mmHg. PNH‑potilaiden kokonaiskolesteroliarvojen, LDL‑kolesteroliarvojen ja diastolisten verenpainearvojen suureneminen korreloi hemoglobiiniarvon suurenemisen kanssa (anemian parantuessa) (ks. kohta Farmakodynamiikka).
C3G.tä koskeneessa kliinisessä tutkimuksessa iptakopaania 200 mg kahdesti vuorokaudessa saaneilla potilailla ei havaittu kliinisesti merkittävää eroa kokonaiskolesteroliarvossa, LDL-kolesteroliarvossa eikä verenpaineessa lumevalmistetta saaneisiin verrattuna.
PNH-potilaiden sydämen sykkeen hidastuminen
Potilailla, jotka saivat kliinisissä PNH-tutkimuksissa iptakopaania 200 mg kahdesti vuorokaudessa, havaittiin kuukauden 6 kohdalla sydämenlyöntien hidastuminen keskimäärin noin 5 lyönnillä minuutissa (keskiarvo 68 lyöntiä minuutissa).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa muutamat potilaat ottivat iptakopaania enintään annoksena 800 mg vuorokaudessa, ja tämä annos oli hyvin siedetty. Terveillä vapaaehtoisilla suurin annos oli 1 200 mg kerta‑annoksena, ja tämä annos oli hyvin siedetty.
Yliannostusta epäiltäessä on aloitettava yleiset tukitoimet ja oireenmukainen hoito.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: immunosuppressantit, komplementin estäjät, ATC‑koodi: L04AJ08
Vaikutusmekanismi
Iptakopaani on proksimaalisen komplementin estäjä, jonka kohde on tekijä B (FB) ja joka estää selektiivisesti vaihtoehtoista reaktioreittiä. PNH:ssa komplementtikaskadin vaihtoehtoisen reitin tekijä B:n inhibitio estää C3‑konvertaasin aktivaation ja sitä seuraavan C5‑konvertaasin muodostumisen ja rajoittaa siten sekä C3‑välitteistä ekstravaskulaarista hemolyysiä (EVH) että terminaalisen komplementin välittämää intravaskulaarista hemolyysiä (IVH).
C3G:ssä komplementin vaihtoehtoisen reitin yliaktivoituminen johtaa C3:n kertymiseen glomeruluksiin, mikä käynnistää inflammaation, glomerulusten vaurioitumisen ja munuaisfibroosin. Iptakopaani salpaa selektiivisesti vaihtoehtoisen reitin yliaktivoitumista estämällä vaihtoehtoisen reitin C3-konvertaasiaktiivisuutta, minkä seurauksena C3:n pilkkoutuminen ja kertyminen munuaisiin vähenee.
Farmakodynaamiset vaikutukset
Komplementin vaihtoehtoisen reitin inhibitio alkoi, kun terveille vapaaehtoisille annetusta yksittäisestä iptakopaaniannoksesta oli kulunut ≤ 2 tuntia. Määritys tehtiin mittaamalla Bb-taso (tekijä B:n b-fragmentti) ja plasman C5b9-pitoisuus ex vivo vaihtoehtoisen reitin testillä.
Iptakopaanin vaikutuksen todettiin olevan samankaltainen sekä PNH‑potilailla, jotka olivat aiemmin altistuneetC5-estäjille, että PNH‑potilailla, joita ei ollut aiemmin hoidettu.
PNH‑potilailla, jotka eivät olleet saaneet aiempaa lääkehoitoa, iptakopaani annoksella 200 mg kahdesti vuorokaudessa pienensi LDH‑pitoisuutta yli 60 % lähtötilanteeseen verrattuna 12 viikon kuluttua, ja vaikutus säilyi tutkimuksen loppuun asti.
C3G-potilailla seerumin keskimääräinen C3-pitoisuus oli suurentunut 249 % lähtötilanteeseen verrattuna iptakopaanihoidon päivänä 14, mikä kuvaa patologisen C3-pilkkoutumisen estymistä. Plasman liukoisen C5b-9:n pitoisuus oli pienentynyt 71,8 % ja virtsan liukoisen C5b-9:n pitoisuus 92,1 % lähtötilanteeseen verrattuna ensimmäisenä mittausajankohtana, kun iptakopaanihoito annoksella 200 mg kahdesti vuorokaudessa oli jatkunut 30 vuorokautta. Vaikutus säilyi 12 kuukautta kestäneen seurantajakson ajan. Myös C3:n kertymisen glomeruluksiin havaittiin 6 kuukauden kohdalla vähentyneen C3:n kertymäpistemäärän muutoksen perusteella.
Sydämen elektrofysiologia
Kliinisessä QTc‑tutkimuksessa terveille vapaaehtoisille annettiin yksittäinen, hoitoannosta suurempi annos iptakopaania. Annokset olivat enintään 1 200 mg (mikä on enemmän kuin nelinkertainen altistus verrattuna annokseen 200 mg kahdesti vuorokaudessa), eikä niillä havaittu vaikutusta sydämen repolarisaatioon tai QT‑aikaan.
Kliininen teho ja turvallisuus
Kohtauksittainen yöllinen hemoglobinuria
Iptakopaanin tehoa ja turvallisuutta aikuisilla PNH‑potilailla arvioitiin kahdessa avoimessa, 24 viikkoa kestäneessä vaiheen III monikeskustutkimuksessa: vertailuvalmisteella kontrolloidussa tutkimuksessa (APPLY‑PNH) ja yksiryhmäisessä tutkimuksessa (APPOINT‑PNH).
APPLY‑PNH: PNH‑potilaat, jotka olivat aiemmin saaneet C5‑estäjää
APPLY‑PNH‑tutkimukseen otettiin aikuisia PNH‑potilaita (punasolukloonin koko ≥ 10 %), joilla oli residuaalianemia (hemoglobiini < 10 g/dl) säännöllisestä, vähintään kuusi kuukautta ennen satunnaistamista kestäneestä C5‑estäjähoidosta (ekulitsumabi tai ravulitsumabi) huolimatta.
Potilaat (N = 97) satunnaistettiin suhteessa 8:5 joko saamaan iptakopaania annoksella 200 mg kahdesti vuorokaudessa suun kautta (N = 62) tai jatkamaan C5‑estäjähoitoa (ekulitsumabi N = 23; tai ravulitsumabi N = 12) 24 viikkoa kestäneen satunnaistetun kontrolloidun vaiheen ajan. Satunnaistaminen stratifioitiin kuuden edeltäneen kuukauden C5‑estäjähoidon ja punasolusiirtojen perusteella.
Potilaiden demografiset tiedot ja sairauden piirteet lähtötilanteessa olivat kummassakin hoitoryhmässä pääosin samankaltaiset. Lähtötilanteessa potilaiden iän keskiarvo (keskihajonta) oli iptakopaaniryhmässä 51,7 (16,9) vuotta (vaihteluväli 22-84) ja C5-estäjäryhmässä 49,8 (16,7) vuotta (vaihteluväli 20-82), ja 69 % potilaista oli naisia molemmissa ryhmissä. Hemoglobiinin keskiarvo (keskihajonta) oli iptakopaaniryhmässä 8,9 (0,7) g/dl ja C5-estäjäryhmässä 8,9 (0,9) g/dl. Satunnaistamista edeltäneiden 6 kuukauden aikana 57 % potilaista sai vähintään yhden punasolusiirron iptakopaaniryhmässä ja 60 % C5-estäjäryhmässä punasolusiirtojen lukumäärän keskiarvon (keskihajonta) ollessa 3,1 (2,6) iptakopaaniryhmässä ja 4,0 (4,3) C5-estäjäryhmässä. LDH-arvon keskiarvo (keskihajonta) oli 269,1 (70,1) U/l iptakopaaniryhmässä ja 272,7 (84,8) U/l C5-estäjäryhmässä. Absoluuttisen retikulosyyttimäärän keskiarvo (keskihajonta) oli 193,2 (83,6) 109/l iptakopaaniryhmässä ja 190,6 (80,9) 109/l C5-estäjäryhmässä. PNH punasolukloonin koon keskiarvo (keskihajonta) yhteensä (tyypit II + III) oli iptakopaaniryhmässä 64,6 % (27,5 %) ja 57,4 % (29,7 %) C5-estäjäryhmässä.
Satunnaistetun kontrolloidun vaiheen aikana yksi iptakopaaniryhmän potilas keskeytti hoidon raskauden takia; C5‑estäjäryhmässä kukaan ei keskeyttänyt hoitoa.
Iptakopaanin paremmuus C5‑estäjähoitoon verrattuna hematologisen vasteen saavuttamisessa 24 viikkoa kestäneessä hoidossa ilman punasolusiirtoja osoitettiin kahden ensisijaisen päätetapahtuman perusteella: 1) potilaiden osuus, joilla hemoglobiiniarvo suureni pitkäkestoisesti ≥ 2 g/dl lähtötilanteeseen verrattuna (hemoglobiiniarvon paraneminen) ja/tai 2) potilaiden osuus, joilla hemoglobiiniarvo pysyi pitkäkestoisesti tasolla ≥ 12 g/dl.
Iptakopaani osoittautui paremmaksi kuin C5‑estäjähoito kahden ensisijaisen päätetapahtuman ja useiden toissijaisten päätetapahtumien osalta. Näitä toissijaisia päätetapahtumia olivat punasolusiirtojen väheneminen, hemoglobiiniarvon muutos lähtötilanteeseen verrattuna, uupumuksen arvioinnin FACIT‑pisteet (Functional Assessment of Chronic Illness Therapy), absoluuttiset retikulosyyttimäärät (ARC) sekä kliinisesti todettujen hemolyysitapausten vuotuinen määrä (ks. taulukko 2).
Iptakopaanihoidon vaikutus hemoglobiiniarvoihin oli havaittavissa jo päivänä 7, ja se säilyi tutkimuksen aikana (ks. kuva 1).
Taulukko 2 Tehotulokset 24 viikkoa kestäneellä satunnaistetulla hoitojaksolla APPLY‑PNH‑tutkimuksessa
| Päätetapahtumat | Iptakopaani (N = 62) | C5-estäjä (N = 35) | Ero (95 %:n lv) p‑arvo |
| Ensisijaiset päätetapahtumat | |||
| Niiden potilaiden lukumäärä, joiden hemoglobiiniarvo parani (pitkäkestoinen hemoglobiiniarvon suureneminen ≥ 2 g/dl lähtötilanteeseen verrattunaa ilman punasolusiirtoja) | 51/60b | 0/35b | |
| Vasteosuusc (%) | 82,3 | 2,0 | 80,2 (71,2, 87,6) < 0,0001 |
| Niiden potilaiden lukumäärä, jotka saavuttivat pitkäkestoisesti hemoglobiiniarvon ≥ 12 g/dla ilman punasolusiirtoja | 42/60b | 0/35b | |
| Vasteosuusc (%) | 68,8 | 1,8 | 67,0 (56,4, 76,9) < 0,0001 |
| Toissijaiset päätetapahtumat | |||
| Niiden potilaiden lukumäärä, jotka eivät tarvinneet punasolusiirtojad,e | 59/62b | 14/35b | |
| Vasteosuusc (%) | 94,8 | 25,9 | 68,9 (51,4, 83,9) < 0,0001 |
| Hemoglobiiniarvon muutos lähtötilanteeseen verrattuna (g/dl) (korjattu keskiarvof) | 3,60 | ‑0,06 | 3,66 (3,20, 4,12) < 0,0001 |
| Muutos FACIT‑uupumuspisteissä lähtötilanteeseen verrattuna (korjattu keskiarvog) | 8,59 | 0,31 | 8,29 (5,28, 11,29) < 0,0001 |
| Kliinisesti todettu hemolyysih,i, % (n/N) | 3,2 (2/62) | 17,1 (6/35) | |
| Kliinisesti todettujen hemolyysitapausten vuotuinen määrä | 0,07 | 0,67 | RR = 0,10 (0,02, 0,61) 0,01 |
| Absoluuttisen retikulosyyttimäärän muutos lähtötilanteeseen verrattuna (109/l) (korjattu keskiarvog) | ‑115,8 | 0,3 | ‑116,2 (‑132,0, ‑100,3) < 0,0001 |
| LDH‑suhde lähtötasoon (korjattu geometrinen keskiarvog) | 0,96 | 0,98 | Suhde = 0,99 (0,89, 1,10) 0,84 |
Merkittävät vaskulaariset haittatapahtumath, % (n/N) | 1,6 (1/62) | 0 | |
| Merkittävien vaskulaaristen haittatapahtumien vuotuinen määräh | 0,03 | 0 | 0,03 (‑0,03, 0,10) 0,32 |
RR: ilmaantuvuustiheyksien suhde (rate ratio); LDH: laktaattidehydrogenaasi a,d,h Arvioitu välillä: päivät 126 ja 168(a), päivät 14 ja 168(d), päivät 1 ja 168(h). b Perustuu arvioitavissa olevien potilaiden havainnointitietoihin. (Kahdella potilaalla, joilta osin puuttui keskeisiä hemoglobiinitietoja päivien 126 ja 168 väliltä, hematologista vastetta ei voitu todeta yksiselitteisesti. Hematologinen vaste saatiin käyttämällä vasteettomuusimputointia. Näiden potilaiden hoitoa ei kuitenkaan lopetettu.) c Vasteosuus kuvastaa mallista arvioitua osuutta. e Punasolusiirtotarpeen puuttumisen määritelmä: potilas ei ole saanut punasolusiirtoja tai täyttänyt punasolusiirron kriteerejä päivien 14 ja 168 välillä. f,g Korjattu keskiarvo arvioitu päivien 126 ja 168 välillä, 30 päivän kuluessa punasolusiirrosta saadut arvot on poistettu(f)/sisällytetty(g) analyysissa. i Kliinisesti todetun hemolyysin määritelmä: kliinisten kriteerien täyttyminen (hemoglobiiniarvon pieneneminen ≥ 2 g/dl verrattuna edelliseen määritykseen tai 15 vuorokauden aikana tai merkittävän hemoglobinurian oireet tai löydökset, kipukriisi, nielemisvaikeus tai jokin muu merkittävä PNH:hon liittyvä kliininen oire tai löydös) ja laboratoriokriteerien täyttyminen (LDH > 1,5 x ULN ja suurempi kuin kaksi viimeisintä mitattua arvoa). | |||
Kuva 1 Hemoglobiiniarvojen keskiarvo* (g/dl) 24 viikkoa kestäneen satunnaistetun hoitojakson aikana APPLY‑PNH‑tutkimuksessa
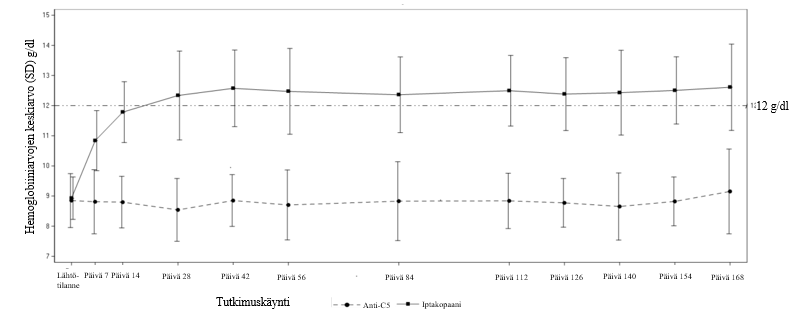
*Huom. Kuvassa esitetään kaikki tutkimuksessa kerätyt tiedot hemoglobiiniarvoista, mukaan lukien arvot, jotka on mitattu 30 vuorokauden sisällä punasolusiirroista.
Hoidon jatkaminen
Yhteensä 95 APPLY-PNH-potilasta osallistui 24 viikon jatkovaiheeseen, jossa kaikki potilaat saivat iptakopaania, jolloin kokonaishoitoaika oli enintään 48 viikkoa. Tehotulokset viikolla 48 olivat yhdenmukaiset viikon 24 tulosten kanssa ja osoittivat iptakopaanihoidon tehon säilymisen.
APPOINT‑PNH: potilaat, joita ei ollut aiemmin hoidettu komplementin estäjillä
APPOINT‑PNH oli yksiryhmäinen tutkimus, johon otettiin 40 aikuista PNH‑potilasta (punasolukloonin koko ≥ 10 %), joiden hemoglobiiniarvo oli < 10 g/dl ja LDH‑arvo > 1,5 x ULN ja joita ei ollut aiemmin hoidettu komplementin estäjillä. Kaikki 40 potilasta saivat iptakopaania annoksella 200 mg kahdesti vuorokaudessa suun kautta 24 viikkoa kestäneen avoimen varsinaisen hoitovaiheen aikana.
Lähtötilanteessa potilaiden iän keskiarvo (keskihajonta) oli 42,1 (15,9) vuotta (vaihteluväli 18-81) ja 43 % oli naisia. Hemoglobiinin keskiarvo (keskihajonta) oli 8,2 (1,1) g/dl. Potilaista 70 % oli saanut vähintään yhden punasolusiirron hoitoa edeltävien 6 kuukauden aikana punasolusiirtojen lukumäärän keskiarvon (keskihajonta) ollessa 3,1 (2,1). LDH-arvon keskiarvo (keskihajonta) oli 1 698,8 (683,3) U/l ja absoluuttisen retikulosyyttimäärän keskiarvo (keskihajonta) oli 154,3 (63,7) 109/l. PNH punasolukloonin koon keskiarvo (keskihajonta) yhteensä (tyypit II + III) oli 42,7 % (21,2 %).Yksikään potilas ei keskeyttänyt hoitoa tutkimuksen varsinaisessa hoitovaiheessa.
Iptakopaanihoidon tehon arviointi perustui seuraavaan ensisijaiseen päätetapahtumaan: niiden potilaiden osuus, joiden hemoglobiiniarvo parani (hemoglobiiniarvo suureni pitkäkestoisesti ≥ 2 g/dl lähtötilanteeseen verrattuna ilman punasolusiirtoja viikon 24 kohdalla).
Taulukossa 3 esitetään tarkat tehotiedot ja Kuvassa 2 LDH‑arvojen keskiarvon muutos 24 viikkoa kestäneen varsinaisen hoitovaiheen aikana.
Taulukko 3 Tehotulokset 24 viikkoa kestäneen varsinaisen hoitovaiheen aikana APPOINT‑PNH‑tutkimuksessa
| Päätetapahtumat | Iptakopaani (N = 40) 95 %:n lv |
| Ensisijainen päätetapahtuma | |
| Niiden potilaiden lukumäärä, joiden hemoglobiiniarvo parani (pitkäkestoinen hemoglobiiniarvon suureneminen ≥ 2 g/dl lähtötilanteeseen verrattunaa ilman punasolusiirtoja) | 31/33b |
| Vasteosuusc (%) | 92,2 (82,5; 100,0)d |
| Toissijaiset päätetapahtumat | |
| Niiden potilaiden lukumäärä, jotka saavuttivat pitkäkestoisesti hemoglobiiniarvon ≥ 12 g/dla ilman punasolusiirtoja | 19/33b |
| Vasteosuusc (%) | 62,8 (47,5, 77,5) |
| Niiden potilaiden lukumäärä, jotka eivät tarvinneet punasolusiirtojae,f | 40/40b |
| Vasteosuusc (%) | 97,6 (92,5, 100,0) |
| Hemoglobiiniarvon muutos lähtötilanteeseen verrattuna (g/dl) (korjattu keskiarvog) | +4,3 (3,9, 4,7) |
| Kliinisesti todettu hemolyysii,j, % (n/N) | 0/40 |
| Kliinisesti todettujen hemolyysitapausten vuotuinen määrä | 0,0 (0,0, 0,2) |
| Absoluuttisen retikulosyyttimäärän muutos lähtötilanteeseen verrattuna (109/l) (korjattu keskiarvoh) | ‑82,5 (‑89,3, ‑75,6) |
| LDH‑arvon prosentuaalinen muutos lähtötilanteeseen verrattuna (korjattu keskiarvoh) | ‑83,6 (‑84,9, ‑82,1) |
| Niiden potilaiden osuus, joilla oli merkittäviä vaskulaarisia haittatapahtumiaj, % | 0,0 |
a,e,j Arvioitu välillä: päivät 126 ja 168(a), päivät 14 ja 168(e), päivät 1 ja 168(j). b Perustuu arvioitavissa olevien potilaiden havainnointitietoihin. (Seitsemällä potilaalla, joilta osin puuttui keskeisiä hemoglobiinitietoja päivien 126 ja 168 väliltä, hematologista vastetta ei voitu todeta yksiselitteisesti. Hematologinen vaste saatiin käyttämällä vasteettomuusimputointia. Näiden potilaiden hoitoa ei kuitenkaan lopetettu.) c Vasteosuus kuvastaa mallista arvioitua osuutta. d Hyödyn osoittamisen kynnysarvo oli 15 %, joka olisi ollut oletettu taso C5‑vasta‑ainehoidossa. f Punasolusiirtotarpeen puuttumisen määritelmä: potilas ei ole saanut punasolusiirtoja tai täyttänyt punasolusiirron kriteerejä päivien 14 ja 168 välillä. g,h Korjattu keskiarvo arvioitu päivien 126 ja 168 välillä, 30 päivän kuluessa punasolusiirrosta saadut arvot on poistettu(g)/sisällytetty(h) analyysissa. i Kliinisesti todetun hemolyysin määritelmä: kliinisten kriteerien täyttyminen (hemoglobiiniarvon pieneneminen ≥ 2 g/dl verrattuna edelliseen määritykseen tai 15 vuorokauden aikana tai merkittävän hemoglobinurian oireet tai löydökset, kipukriisi, nielemisvaikeus tai jokin muu merkittävä PNH:hon liittyvä kliininen oire tai löydös) ja laboratoriokriteerien täyttyminen (LDH > 1,5 x ULN ja suurempi kuin kaksi viimeisintä mitattua arvoa). | |
Kuva 2 LDH‑arvojen keskiarvo (U/l) 24 viikkoa kestäneen varsinaisen hoitojakson aikana APPOINT‑PNH‑tutkimuksessa
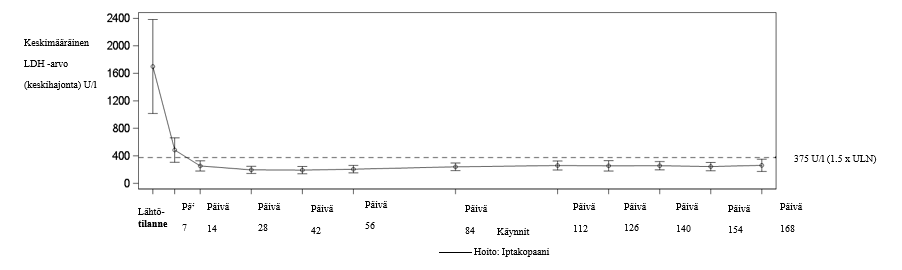
Hoidon jatkaminen
Kaikki 40 APPOINT-PNH-potilasta siirtyivät 24 viikon jatkovaiheeseen, jossa kaikki potilaat jatkoivat iptakopaanihoidolla, jolloin kokonaishoitoaika oli enintään 48 viikkoa. Tehotulokset viikolla 48 olivat yhdenmukaiset viikon 24 tulosten kanssa, mikä osoittaa iptakopaanihoidon tehon säilymisen.
Komplementin 3 glomerulopatia
Iptakopaanin tehoa ja turvallisuutta C3G:n hoidossa arvioitiin 101 C3G-potilaalla yhdessä vaiheen III avaintutkimuksessa (APPEAR-C3G, potilailla joilla oli oma munuainen, N = 74) ja kahdessa avoimessa tutkimuksessa (tutkimus X2202 potilailla, joilla oli oma munuainen (N = 16) ja potilailla, joilla oli uusiutunut C3G (N = 11), sekä jatkotutkimuksessa).
APPEAR-C3G
APPEAR-C3G oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus, johon otettiin 74 aikuispotilasta, joilla oli koepalalla varmistettu C3G, UPCR ≥ 1 g/g ja eGFR-arvo ≥ 30 ml/min/1,73 m2.
Potilaat satunnaistettiin (suhteessa 1:1) saamaan joko iptakopaania annoksella 200 mg kahdesti vuorokaudessa suun kautta (N = 38) tai lumevalmistetta (N = 36) 6 kuukauden ajan, minkä jälkeen seuranneella avoimella hoitojaksolla potilaat saivat 6 kuukauden ajan iptakopaania annoksella 200 mg kahdesti vuorokaudessa suun kautta. Kaikki 74 potilasta jatkoivat tutkimukseen osallistumista kaksoissokkoutetun vaiheen loppuun ja 73 potilasta jatkoi osallistumista avoimen iptakopaanihoitojakson loppuun.
Potilaat käyttivät reniini-angiotensiinijärjestelmän (RAS) estäjää vakaalla suurimmalla siedetyllä annoksella. Satunnaistaminen stratifioitiin sen perusteella, käyttivätkö potilaat samanaikaisesti immunosuppressiivista hoitoa (kortikosteroidi ja/tai mykofenolaattimofetiili/‑natrium [MMF/MPS]). Kaikkien näiden valmisteiden (RAS:n estäjien, kortikosteroidien ja MMF:n/MPS:n) annosten oli oltava vakaalla tasolla 90 vuorokauden ajan ennen satunnaistamista ja koko tutkimuksen ajan.
Lähtötilanteessa potilaiden iän keskiarvo (keskihajonta) oli iptakopaaniryhmässä 26,1 (10,4) vuotta (vaihteluväli 18–52) ja lumeryhmässä 29,8 (10,8) vuotta (vaihteluväli 18–60). C3G:n diagnoosihetkellä iptakopaaniryhmän potilaista 40 % ja lumeryhmän potilaista 17 % oli ollut alle 18-vuotiaita. Naisten osuus potilaista oli iptakopaaniryhmässä 29 % ja lumeryhmässä 44 %. UPCR:n geometrinen keskiarvo oli iptakopaaniryhmässä 3,33 g/g ja lumeryhmässä 2,58 g/g. Historiallinen laskennallinen eGRF-arvon keskimääräinen kulmakerroin ennen satunnaistamista oli iptakopaaniryhmässä -10,75 ja lumeryhmässä -7,64 ml/min/1,73 m2 vuodessa. eGFR-arvon keskiarvo (keskihajonta) oli iptakopaaniryhmässä 89,3 (35,2) ml/min/1,73 m2 ja lumeryhmässä 99,2 (26,9) ml/min/1,73 m2. Alatyypeistä C3-glomerulonefriitti (C3GN) oli 68 %:lla iptakopaaniryhmän potilaista ja 89 %:lla lumeryhmän potilaista ‑ja tiivissaostumatauti (DDD) 23,7 %:lla iptakopaaniryhmän potilaista ja 2,8 %:lla lumeryhmän potilaista. Immunosuppressiivisena hoitona kortikosteroidia ja/tai MMF-/MPS-valmistetta vakaalla annoksella käytti iptakopaaniryhmän potilaista 42 % ja lumeryhmän potilaista 47 %.
Tehon ensisijainen päätetapahtuma oli 24 tunnin UPCR-arvon prosentuaalinen pienenemä lähtötilanteeseen verrattuna 6 kuukautta kestäneen hoidon jälkeen.
Iptakopaani oli lumevalmistetta parempi, ja sillä osoitettiin lumeeseen verrattuna tilastollisesti merkitsevä 35,1 %:n pienenemä (95 %:n lv: 13,8 %, 51,1 %, yksitahoinen p-arvo = 0,0014) 24 tunnin UPCR-arvossa lähtötilanteeseen verrattuna 6 kuukautta kestäneen hoidon jälkeen (iptakopaani −30,2 %, lume +7,6 %). Iptakopaanin vaikutus 24 tunnin UPCR-arvoon säilyi 12 kuukauteen asti (−40,0 % lähtötilanteeseen verrattuna). Potilailla, jotka siirtyivät lumevalmisteesta iptakopaanihoitoon 6 kuukauden avoimessa hoitojaksossa, todettiin 31,0 % pienenemä 24 tunnin UPCR-arvossa kuukaudesta 6 kuukauteen 12. Ensimmäisen aamuvirtsan (FMV) UPCR-kaari on kuvattu Kuvassa 3.
Jälkianalyysissa iptakopaanihoito pienensi niiden potilaiden prosentuaalista osuutta, joilla oli nefroottinen proteinuria (määritelmä: UPCR ≥ 3 g/g) lähtötilanteen 55,3 %:sta 31,6 %:iin kuukauden 6 ja 36,8 %:iin kuukauden 12 kohdalla. Lumeryhmään satunnaistettujen potilaiden prosentuaalinen osuus, joilla oli nefroottinen proteinuria, suurentui lähtötilanteen 30,6 %:sta 41,7 %:iin kuukauden 6 kohdalla. Iptakopaanihoitoon vaihtamisen jälkeen se pienentyi 27,8 %:iin kuukauden 12 kohdalla.
Kuva 3Ensimmäisen aamuvirtsan UPCR-arvon geometrisen keskiarvon prosentuaalinen muutos lähtötilanteeseen verrattuna 12 kuukauteen asti (APPEAR-C3G)
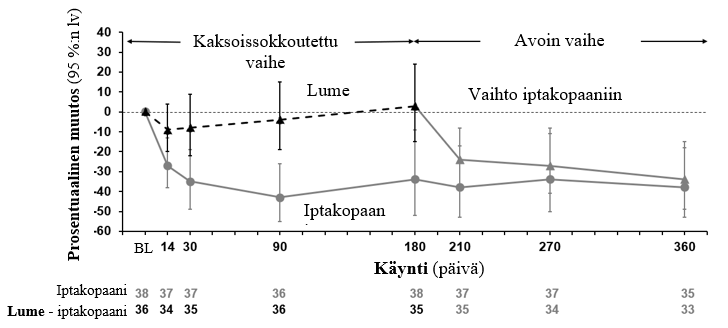
6 kuukautta kestäneellä iptakopaanihoidolla saavutettu eGFR-arvon numeerinen kohenema lähtötilanteesta oli 2,2 ml/min/1,73 m2 (95 %:n lv: −2,7, 7,1, yksitahoinen p-arvo = 0,3241) lumeeseen verrattuna (iptakopaani 1,3 ml/min/1,73 m2 ja lume −0,9 ml/min/1,73 m2). Iptakopaaniryhmän potilailla eGFR-arvo pysyi vakaana 12 kuukautta kestäneen tutkimuksen ajan (+0,4 ml/min/1,73 m2 lähtötilanteesta).
6 kuukautta kestänyt iptakopaanihoito johti C3:n glomeruluksiin kertymisen keskiarvon muutokseen -1,9 (95 %:n lv: -3,3, -0,5; nimellinen yksitahoinen p-arvo = 0,0053) lähtötilanteesta lumeeseen verrattuna. Muutos lähtötilanteesta oli iptakopaanilla -0,78 (95 %:n lv: -1,81, 0,25) verrattuna 1,09 (95 %:n lv: 0,11, 2,08) suurenemaan lumelääkkeellä.
X2202 ja jatkotutkimus
Iptakopaanin tehosta aikuisilla C3G-potilailla tukevat tiedot 3 kuukautta kestäneestä avoimesta vaiheen II tutkimuksesta X2202, johon osallistuneilla potilailla oli C3G omissa munuaisissa (N = 16) tai uusiutunut C3G munuaissiirron jälkeen (N = 11).
Uusiutuneen C3G:n diagnoosi edellytti siirretyn munuaisen tuoreesta biopsiasta tehtyä glomerulusten C3-värjäytymisintensiteetin histologista arviointia. Iän keskiarvo oli lähtötasossa 35 vuotta (vaihteluväli 18-70), UPCR-arvon geometrinen keskiarvo 0,32 g/g, eGFR:n keskiarvo (keskihajonta) 52,2 (17,29) ml/min/1,73 m2, ja C3-kertymäpistemäärän mediaani 3 asteikolla 0-12 lähtötasossa. Kaikki potilaat saivat MMF/MPS- ja/tai kortikosteroidihoitoa kalsineuriinin estäjien lisäksi.
Potilailla, joille ei ollut tehty munuaissiirtoa, iptakopaanihoidolla saavutettiin tilastollisesti merkitsevä 45 %:n (-162,6 g/mol) pienenemä 24 tunnin UPCR-arvossa (p = 0,0003) 3 kuukauden kohdalla. Potilailla, joilla oli uusiutunut C3G, iptakopaanihoidolla saavutettiin histologisessa C3-kertymäpistemäärässä merkitsevä 2,50 pisteen pienenemä (p = 0,0313) 3 kuukauden kohdalla.
Tutkimukseen osallistuneista potilaista suurin osa (N = 26) siirtyi meneillään olevaan jatkotutkimukseen, jossa he saavat iptakopaania annoksella 200 mg kahdesti vuorokaudessa enintään 39 kuukauden ajan. Keskimääräiset UPCR- ja eGFR-arvot pysyivät vakaina koko tutkimuksen ajan niillä 16:lla C3G-potilaalla, joille ei ollut tehty munuaissiirtoa. Niistä 10 potilaasta, joilla C3G uusiutui elinsiirron jälkeen, 2 potilasta jätti tutkimuksen kesken munuaisten toiminnan heikkenemisen vuoksi. Muiden 8 osallistujan eGFR- ja UPCR-arvot pysyivät pääosin vakioina seurantajakson loppuun asti (48 kuukauteen asti).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset FABHALTA‑valmisteen käytöstä PNH:n ja C3G:n hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Peroraalisen annostelun jälkeen iptakopaanin huippupitoisuus plasmassa saavutetaan noin 2 tunnin kuluttua. Suositellulla annostuksella 200 mg kahdesti vuorokaudessa vakaa tila saavutetaan noin 5 vrk:n kuluessa vähäisellä (1,4‑kertaisella) akkumulaatiolla. Terveillä vapaaehtoisilla vakaan tilan Cmax,ss (geometrinen keskiarvo [%CV]) oli 4 020 ng/ml (23,8 %) ja AUCtau,ss 25 400 ng*hr/ml (15,2 %). Iptakopaanin farmakokinetiikan yksilöiden välinen ja yksilökohtainen vaihtelu on vähäistä tai kohtalaista.
Terveillä vapaaehtoisilla toteutetun, ruoan vaikutusta runsasrasvaisella ja runsaskalorisella aterialla selvittäneen tutkimuksen tulosten perusteella ruoka ei näyttänyt vaikuttavan iptakopaanin Cmax‑ ja AUC‑arvoihin (pitoisuus-aikakäyrän alle jäävä pinta-ala). Näin ollen iptakopaani voidaan ottaa ruoan kanssa tai ilman ruokaa.
Jakautuminen
Iptakopaanilla havaittiin pitoisuudesta riippuvainen sitoutuminen plasman proteiiniin, joka johtuu sen sitoutumisesta kohteeseensa, tekijä B:hen, systeemisessä verenkierrossa. Iptakopaani oli in vitro 75–93‑prosenttisesti sitoutunut proteiiniin olennaisissa kliinisissä plasmapitoisuuksissa. Kun iptakopaania annettiin 200 mg kahdesti vuorokaudessa, sen näennäinen vakaan tilan jakautumistilavuus (geometrinen keskiarvo) oli noin 265 litraa.
Biotransformaatio
Iptakopaanin pääasiallinen eliminaatioreitti on metaboloituminen ja noin 50 % annoksesta metaboloituu oksidatiivisia reittejä. Iptakopaanin metaboliareaktioita ovat N‑dealkylaatio, O‑de‑etylaatio, oksidaatio ja dehydrogenaatio, pääasiallisesti CYP2C8‑entsyymin ja vähäisessä määrin myös CYP2D6‑entsyymin vaikutuksesta. Vähäisempi metaboliareitti on suora glukuronidaatio (UGT1A1‑, UGT1A3‑ ja UGT1A8‑entsyymien vaikutuksesta). Plasmassa iptakopaani oli pääasiallinen komponentti, jota vastasi 83 %:a AUC0‑48 h‑arvosta. Ainoat plasmassa havaitut metaboliitit olivat kaksi asyyliglukuronidia, joita esiintyi vähäisesti vastaten 8 %:a ja 5 %:a AUC0‑48 h‑arvosta. Iptakopaanin metaboliitteja ei pidetä farmakologisesti aktiivisina.
Eliminaatio
Terveillä vapaaehtoisilla tehdyssä tutkimuksessa yhden peroraalisen 100 mg:n [14C]‑leimatun iptakopaaniannoksen radioaktiivisuuden kokonaiserityksestä (iptakopaani ja metaboliitit) keskimäärin 71,5 % tapahtui ulosteeseen ja 24,8 % virtsaan. Annoksesta 17,9 % erittyi muuttumattomana iptakopaanina virtsaan ja 16,8 % ulosteeseen. Annostuksella 200 mg kahdesti vuorokaudessa iptakopaanin vakaan tilan näennäispuhdistuma (CL/F) on 7 960 ml/h. Iptakopaanin vakaan tilan puoliintumisaika (t½) on noin 25 tuntia annostuksella 200 mg kahdesti vuorokaudessa.
Lineaarisuus/ei ‑lineaarisuus
Kun iptakopaania annosteltiin 25–100 mg kahdesti vuorokaudessa, iptakopaaniannosten jälkeisten farmakokineettisten arvojen todettiin kaikkiaan poikkeavan toisistaan vähemmän kuin annosriippuvaisessa suhteessa. Suun kautta otettujen 100 mg:n ja 200 mg:n annosten osalta arvot olivat kuitenkin suunnilleen annosriippuvaisia. Ei‑lineaarisuuden pääteltiin johtuvan pääasiassa iptakopaanin saturoivasta sitoutumisesta tekijä B:hen plasmassa.
Lääkkeiden yhteisvaikutukset
Terveillä vapaaehtoisilla tehdyssä yhteisvaikutustutkimuksessa, jossa iptakopaania annettiin samanaikaisesti muiden lääkevalmisteiden kanssa, ei ilmennyt kliinisesti merkittäviä yhteisvaikutuksia.
Iptakopaani substraattina
CYP2C8:n estäjät
Kun iptakopaania annetaan samanaikaisesti klopidogreelin (keskivahva CYP2C8:n estäjä) kanssa, iptakopaanin Cmax-arvo suureni 5 % ja AUC-arvo 36 %.
OATP1B1:n/OATP1B3:n estäjät
Kun iptakopaania annettiin samanaikaisesti siklosporiinin (vahva OATP1B1:n/1B3:n estäjä sekä PgP:n ja BCRP:n estäjä) kanssa, iptakopaanin Cmax-arvo suureni 41 % ja AUC-arvo 50 %.
Iptakopaani estäjänä
PgP:n substraatit
Iptakopaanin läsnä ollessa digoksiinin (PgP:n substraatti) Cmax-arvo suureni 8 %, kun taas sen AUC-arvo ei muuttunut.
OATP:n substraatit
Iptakopaanin läsnä ollessa rosuvastatiinin (OATP:n substraatti) Cmax- ja AUC-arvot pysyivät muuttumattomina.
Erityisryhmät
Populaatiofarmakokinetiikan analyysi tehtiin 234 potilaan tiedoista. Ikä (18–84 vuotta), paino, eGFR, etninen tausta ja sukupuoli eivät vaikuttaneet merkitsevästi iptakopaanin farmakokinetiikkaan. Aasialaisia tutkittavia sisältäneet tutkimukset osoittivat, että iptakopaanin farmakokinetiikka oli heillä samanlainen kuin valkoihoisilla tutkittavilla.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta iptakopaanin puhdistumaan arvioitiin populaatiofarmakokinetiikan analyysilla. Iptakopaanin puhdistumassa ei ollut kliinisesti merkittävää eroa henkilöillä, joiden munuaisten toiminta on normaali tai joilla on lievä (eGFR 60–90 ml/min) tai keskivaikea (eGFR 30–60 ml/min) munuaisten vajaatoiminta, eikä annosta tarvitse muuttaa näille potilaille (ks. kohta Annostus ja antotapa). Potilaita, joilla on vaikea munuaisten vajaatoiminta tai jotka ovat dialyysihoidossa, ei ole tutkittu.
Maksan vajaatoiminta
Tutkimuksessa lievä (Child–Pugh‑luokka A, n = 8), keskivaikea (Child–Pugh‑luokka B, n = 8) tai vaikea (Child–Pugh‑luokka C, n = 6) maksan vajaatoiminta vaikutti hyvin vähäisesti iptakopaanin systeemiseen kokonaisaltistukseen verrattuna normaaliin maksan toimintaan. Sitoutumattoman iptakopaanin Cmax‑arvo suureni 1,4‑kertaiseksi lievää, 1,7‑kertaiseksi keskivaikeaa ja 2,1‑kertaiseksi vaikeaa maksan vajaatoimintaa sairastavilla, ja sitoutumattoman iptakopaanin AUCinf‑arvo suureni 1,5‑kertaiseksi lievää, 1,6‑kertaiseksi keskivaikeaa ja 3,7‑kertaiseksi vaikeaa maksan vajaatoimintaa sairastavilla potilailla (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis‑ ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Lisääntymistoksisuus
Peroraalista annostelua koskeneessa eläimillä tehdyssä hedelmällisyystutkimuksessa iptakopaani ei vaikuttanut urosrottien hedelmällisyyteen suurimmallakaan testatulla annoksella (750 mg/kg/vrk), joka vastasi AUC‑arvon perusteella kuusinkertaisesti ihmisille suositeltua enimmäisannosta. Toistuvaisannoksen toksisuutta koskeneissa tutkimuksissa havaittiin korjaantuvia vaikutuksia urosten lisääntymiselimiin (siementiehyiden degeneraatio ja hypospermatogeneesi), kun rotille ja koirille annettiin suun kautta annoksia, jotka vastasivat AUC‑arvon perusteella yli kolminkertaisesti ihmisille suositeltua enimmäisannosta. Näkyvää vaikutusta siittiöiden määrään, morfologiaan tai liikkuvuuteen tai eläinten hedelmällisyyteen ei havaittu.
Rotilla tehdyssä, naaraiden hedelmällisyyttä ja varhaista alkionkehitystä selvittäneessä tutkimuksessa iptakopaaniin liittyvät löydökset rajoittuivat ennen kiinnittymistä ja sen jälkeen tapahtuneiden alkionmenetysten lisääntymiseen, jonka seurauksena elävien alkioiden määrä pieneni. Tämä todettiin vain suurimmalla peroraalisella annoksella, joka oli 1 000 mg/kg/vrk ja vastaa kokonais‑AUC‑arvon perusteella noin viisinkertaisesti ihmisille suositeltua enimmäisannosta. Haitaton vaikutustaso (NOAEL) on 300 mg/kg/vrk, joka vastaa AUC‑arvon perusteella noin kaksinkertaisesti ihmisille suositeltua enimmäisannosta.
Eläinten lisääntymistutkimuksissa rotilla ja kaniineilla todettiin, että organogeneesin aikana peroraalisesti annosteltu iptakopaani ei aiheuttanut haitallista alkio- tai sikiötoksisuutta suurimmillakaan annoksilla, jotka vastasivat AUC-arvon perusteella viisinkertaisesti (rotilla) ja kahdeksankertaisesti (kaniineilla) ihmisille suositeltua enimmäisannosta (MRHD) 200 mg kahdesti vuorokaudessa.
Rotilla tehdyssä pre- ja postnataalista kehitystä koskevassa tutkimuksessa, jossa iptakopaania annettiin naaraille suun kautta tiineyden, synnytyksen ja laktaation aikana (tiineyspäivästä 6 laktaatiopäivään 21), ei ilmennyt haitallisia vaikutuksia tiineisiin emoihin tai jälkeläisiin suurimmallakaan testatulla annoksella 1 000 mg/kg/vrk (AUC:n perusteella arviolta viisinkertainen MRHD-annos).
Toistuvaisannosten toksisuus
Kroonista toksisuutta koskevassa tutkimuksessa yksi uroskoira, jolle annettiin suurinta annosta (marginaali kliiniseen altistukseen nähden lähes 20-kertainen), jouduttiin lopettamaan 103 päivän kuluttua iptakopaanin annon päättymisestä korjautumattoman, ei-regeneratiivisen, vaikean anemian vuoksi, johon liittyi luuytimen fibroosi. Hoitovaiheen aikana havaittiin hematologisia löydöksiä, jotka viittasivat tulehdukseen ja dyserytropoieesiin. Mitään mekanismia havaituille löydöksille ei ole tunnistettu, eikä yhteyttä hoitoon voida sulkea pois.
Mutageenisuus ja karsinogeenisuus
Iptakopaani ei ollut genotoksinen eikä mutageeninen in vitro‑ ja in vivo ‑määrityksissä.
Iptakopaanin karsinogeenisuututkimuksissa hiirillä ja rotilla peroraalisella annostelulla ei havaittu karsinogeenista potentiaalia. Suurimmat tutkitut iptakopaaniannokset olivat AUC‑arvon perusteella hiirillä (1 000 mg/kg/vrk) noin nelinkertaiset ja rotilla (750 mg/kg/vrk) noin 12‑kertaiset suurimpaan ihmisille suositeltuun annokseen verrattuna.
Valotoksisuus
In vitro- ja in vivo -valotoksisuustestit olivat moniselitteisiä. In vivo-valotoksisuustutkimuksessa iptakopaanin annoksilla 100-1 000 mg/kg (vastaa 38-kertaisesti ihmisen Cmax-arvoa suurimmalla suositellulla annoksella) osalla hiiristä havaittiin annosvasteesta riippumatonta vähäistä ohimenevää punoitusta, rupeutumista ja kuivuutta sekä säteilytyksen jälkeistä vähäistä keskimääräisen korvien painon suurenemista.
Farmaseuttiset tiedot
Apuaineet
Kapselin kuori
Liivate
Punainen rautaoksidi (E172)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Painomuste
Musta rautaoksidi (E172)
Ammoniakkiliuos, väkevä (E527)
Kaliumhydroksidi (E525)
Propyleeniglykoli (E1520)
Sellakka (E904)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FABHALTA kapseli, kova
200 mg (L:ei) 56 fol (28066,51 €)
PF-selosteen tieto
FABHALTA toimitetaan PVC/PE/PVDC‑läpipainopakkauksissa, joissa on alumiinista valmistettu taustakalvo.
Pakkaus sisältää 28 tai 56 kovaa kapselia.
Monipakkaus sisältää 168 kovaa kapselia (3 pakkausta, joissa kussakin 56 kovaa kapselia).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Koon 0 vaaleankeltainen, läpinäkymätön kova kapseli (21,2–22,2 mm), jonka runko‑osassa on merkintä ”LNP200” ja kansiosassa merkintä ”NVR” ja jonka sisällä on jauhetta, jonka väri vaihtelee valkoisesta tai melkein valkoisesta vaaleaan vaaleanpunaviolettiin.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
FABHALTA kapseli, kova
200 mg 56 fol
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Iptakopaani ja pegsetakoplaani: Aikuisten kohtauksittaisen yöllisen hemoglobiinivirtsaisuuden (PNH) hoito erityisin edellytyksin (3078).
ATC-koodi
L04AJ08
Valmisteyhteenvedon muuttamispäivämäärä
19.12.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
