SALMETEROL/FLUTICASON ORION inhalaatiosumute, suspensio 25/250 mikrog/annos
Vaikuttavat aineet ja niiden määrät
Yksi mitattu salmeteroli/flutikasonipropionaatti-annos inhalaatiosumutetta sisältää:
25 mikrogrammaa salmeterolia (salmeteroliksinafoaattina) ja 125 tai 250 mikrogrammaa flutikasonipropionaattia (venttiilistä). Tämä vastaa 21:tä mikrogrammaa salmeterolia ja 110:tä tai 220:tä mikrogrammaa flutikasonipropionaattia annostelijasta (annostelijasta vapautunut annos).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiosumute, suspensio.
Kliiniset tiedot
Käyttöaiheet
Salmeterol/Fluticason Orion -valmistetta käytetään astman säännölliseen hoitoon silloin kun lääkitys yhdistelmälääkkeellä (pitkävaikutteinen beeta2-agonisti ja inhaloitava kortikosteroidi) on tarkoituksenmukaista:
- potilaat, joiden oireita ei ole saatu riittävästi hallintaan inhaloitavilla kortikosteroideilla ja ”tarvittaessa” inhaloitavalla lyhytvaikutteisella beeta2-agonistilla.
tai
- potilaat, joiden oireet ovat jo riittävästi hallinnassa samanaikaisesti käytetyillä inhaloitavilla kortikosteroideilla ja pitkävaikutteisella beeta2-agonistilla.
Annostus ja antotapa
Annostus
Salmeterol/Fluticason Orion on tarkoitettu käytettäväksi vain inhalaationa.
Potilaalle on selvitettävä, että parhaan hyödyn saamiseksi Salmeterol/Fluticason Orion ‑inhalaatiosumutetta on käytettävä päivittäin myös silloin, kun potilas on oireeton.
Lääkärin tulee säännöllisesti uudelleenarvioida potilaan tilaa, jotta potilaan saama Salmeterol/Fluticason Orion -inhalaatiosumutteen vahvuus pysyy optimaalisena, ja sitä muutetaan vain lääkärin ohjeen mukaan. Annos sovitetaan pienimmäksi annokseksi, jolla oireet pysyvät tehokkaasti hallinnassa. Jos yhdistelmälääkkeen pienin vahvuus kahdesti vuorokaudessa annettuna riittää oireiden hallintaan, voidaan seuraavaksi kokeilla pelkkää inhaloitavaa kortikosteroidia. Pitkävaikutteista beeta2-agonistia tarvitsevat potilaat voivat vaihtoehtoisesti ottaa salmeteroli/flutikasonipropionaattia kerran vuorokaudessa, jos se hoitavan lääkärin mielestä riittää taudin hallintaan. Jos kerran vuorokaudessa annostusta käytetään potilaalle, jolla on ollut oireita öisin, annos on otettava illalla, ja jos potilaan oireet ovat aiemmin ilmenneet pääasiassa päiväaikaan, on lääke otettava aamulla.
Potilaalle tulee antaa Salmeterol/Fluticason Orion ‑inhalaatiosumutteesta sitä vahvuutta, jonka flutikasonipropionaattiannos sopii potilaan sairauden vaikeusasteeseen.
Lääkettä määräävän lääkärin on hyvä tietää, että muihin inhaloitaviin steroideihin verrattuna flutikasonipropionaatti on astman hoidossa yhtä tehokas noin puolta pienemmällä vuorokausiannoksella mikrogrammoina. Jos yksittäinen potilas tarvitsee suositellusta hoito-ohjelmasta poikkeavaa annostusta, hänelle tulee määrätä sopiva annos beeta-agonistia ja/tai kortikosteroidia.
Suositellut annokset
Aikuiset ja vähintään 12-vuotiaat nuoret
- Kaksi inhalaatiota, joissa on 25 mikrogrammaa salmeterolia ja 125 mikrogrammaa flutikasonipropionaattia, kaksi kertaa vuorokaudessa.
tai
- kaksi inhalaatiota, joissa on 25 mikrogrammaa salmeterolia ja 250 mikrogrammaa flutikasonipropionaattia, kaksi kertaa vuorokaudessa.
Selvää hyötyä ei ole osoitettu verrattuna ylläpitohoidon aloitukseen pelkällä inhaloitavalla flutikasonipropionaatilla silloin kun yksi tai kaksi vaikeusastekriteeriä ei täyty. Inhaloitava kortikosteroidi on yleensä edelleen ensilinjan hoito useimmille potilaille. Salmeterol/Fluticason Orion ‑valmistetta ei ole tarkoitettu lievän astman aloitushoitoon.
Potilaalle, jolla on tai jolla todennäköisesti voi olla vaikeuksia koordinoida sumuteannoksen vapauttaminen sisäänhengityksen kanssa, suositellaan tilajatkeen käyttöä Salmeterol/Fluticason Orion ‑inhalaatiosumutteen kanssa.
Tilajatketta, kuten Volumatic‑ tai AeroChamber Plus ‑tilajatketta tai muuta tilajatketta, voidaan käyttää (kansallisten ohjeiden mukaisesti). Kerta-annoksen farmakokineettiset tiedot ovat osoittaneet, että systeeminen altistus salmeterolille ja flutikasonille voi muuttua käytettäessä erilaisia tilajatkeita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Potilasta on neuvottava käyttämään ja hoitamaan inhalaattoria ja tilajatketta oikein, ja potilaan tekniikka on tarkastettava inhaloitavan lääkevalmisteen optimaalisen keuhkoihin pääsyn varmistamiseksi. Potilaan tulee käyttää koko ajan samantyyppistä tilajatketta, sillä vaihtaminen tilajatkeesta toiseen voi aiheuttaa muutoksia keuhkoihin menevän lääkkeen määrässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annos on aina sovitettava uudestaan pienimmäksi tehokkaaksi annokseksi, kun tilajatke otetaan käyttöön tai vaihdetaan.
Erityispotilasryhmät
Annosta ei tarvitse muuttaa iäkkäille tai munuaisten vajaatoimintaa sairastaville potilaille. Salmeteroli/flutikasonipropionaatin käytöstä maksan vajaatoimintaa sairastaville potilaille ei ole tietoja.
Käyttöohje
Potilaalle on neuvottava inhalaattorin oikea käyttötapa (ks. pakkausseloste).
Inhaloidessaan potilaan pitää mieluiten joko istua tai seistä. Inhalaattori on pidettävä käytön aikana pystysuorassa asennossa.
Inhalaattorin testaus
Ennen kuin inhalaattoria käytetään ensimmäisen kerran, potilaan tulee irrottaa suukappaleen suojus puristamalla sitä kevyesti molemmilta sivuilta, ravistaa inhalaattoria kunnolla, pitää siitä kiinni sormilla ja peukalolla niin, että peukalo tukee inhalaattoria pohjasta, suukappaleen alapuolelta, ja vapauttaa neljä annosta ilmaan laitteen oikean toiminnan varmistamiseksi. Inhalaattoria on ravistettava aina juuri ennen kuin sumuteannos vapautetaan. Jos inhalaattori on ollut käyttämättömänä viikon tai kauemmin, on suukappaleen suojus irrotettava, potilaan tulee ravistaa inhalaattoria kunnolla ja vapauttaa kaksi annosta ilmaan.
Antotapa
- Potilaan tulee poistaa suukappaleen suojus puristamalla sitä kevyesti molemmilta sivuilta.
- Potilaan tulee tarkistaa, että inhalaattorin sisä- tai ulkopuolella tai suukappaleessa ei ole irrallisia kappaleita.
- Potilaan tulee ravistaa inhalaattoria kunnolla. Näin varmistetaan, että mahdolliset irtokappaleet poistuvat ja että inhalaattorin sisältö sekoittuu tasaiseksi.
- Potilaan on pidettävä inhalaattoria pystysuorassa peukalon ja muiden sormien välissä siten, että peukalo tukee inhalaattoria pohjasta, suukappaleen alapuolelta.
- Potilaan tulee hengittää ulos niin pitkään kuin tuntuu mukavalta. Sen jälkeen suukappale viedään suuhun hampaiden väliin ja huulet suljetaan kunnolla sen ympärille. Potilasta on neuvottava olemaan purematta suukappaletta.
- Heti kun potilas aloittaa sisäänhengityksen suun kautta, potilaan tulee painaa inhalaattorin yläosaa napakasti alaspäin, jolloin salmeteroli/flutikasonipropionaatti-annos vapautuu, jatkaen samalla tasaista, syvää sisäänhengitystä.
- Hengitystä pidättäen potilaan tulee ottaa inhalaattori pois suusta ja nostaa sormi inhalaattorin päältä. Potilaan on pidätettävä hengitystä edelleen niin pitkään kuin tuntuu mukavalta.
- Toisen inhalaation ottamiseksi potilaan on pidettävä inhalaattori pystyssä ja odotettava noin puoli minuuttia ennen vaiheiden 3–7 toistamista.
- Potilaan tulee asettaa suukappaleen suojus heti paikalleen oikeassa asennossa painamalla se napakasti kiinni niin, että se naksahtaa paikalleen. Suojuksen paikoilleen naksauttaminen ei vaadi suurta voimaa.
TÄRKEÄÄ
Potilaan ei tule kiirehtiä vaiheiden 5, 6 ja 7 kohdalla. On tärkeää, että potilas alkaa hengittää sisään mahdollisimman hitaasti juuri ennen inhalaattorin käyttöä. Potilaan pitäisi muutamalla ensimmäisellä kerralla harjoitella inhalaatiotekniikkaa peilin edessä. Jos inhalaattorin yläosasta tai suupielistä näyttää tulevan "sumua", potilaan tulee aloittaa uudelleen kohdasta 3.
Potilaan tulee huuhdella suu vedellä ja sylkeä vesi pois ja/tai harjata hampaat jokaisen lääkeannoksen jälkeen suun ja nielun kandidiaasin sekä äänen käheytymisen riskin minimoimiseksi.
Potilaan on valmistauduttava hankkimaan uusi inhalaattori, kun annoslaskimessa on lukema ”40” ja sen väri muuttuu vihreästä punaiseksi. Inhalaattorin käyttö on lopetettava, kun annoslaskimen lukema on ”0”, sillä laitteessa olevasta määrästä ei välttämättä saada täyttä annosta. Annoslaskimen numeroita ei pidä yrittää muuttaa eikä laskinta pidä irrottaa inhalaattorista. Annoslaskin on kiinteä osa inhalaattoria, eikä sen lukemaa voi asettaa uudelleen.
Puhdistaminen
Inhalaattori pitää puhdistaa vähintään kerran viikossa.
- Irrota suukappaleen suojus.
- Älä irrota annossäiliötä muovikuoresta.
- Pyyhi suukappaleen sisä- ja ulkopuoli ja muovikuori kuivalla kangas- tai paperiliinalla.
- Aseta suukappaleen suojus takaisin paikalleen oikeassa asennossa. Tämä ei vaadi suurta voimaa vaan suojuksen pitäisi naksahtaa paikoilleen.
METALLISÄILIÖTÄ EI SAA PANNA VETEEN
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Salmeteroli/flutikasonipropionaattia ei tule käyttää nopeaa ja lyhytvaikutteista bronkodilataatiota edellyttävien akuuttien astmaoireiden hoitoon. Potilasta on neuvottava pitämään aina mukanaan lääkevalmiste, jota hän käyttää akuutin astmakohtauksen lievitykseen.
Potilaalle ei pidä aloittaa salmeteroli/flutikasonipropionaatti-lääkitystä, silloin kun hänellä on astman pahenemisvaihe tai selvästi vaikeutuva tai äkillisesti vaikeutuva astma.
Vakavia astmaan liittyviä haittatapahtumia ja pahenemisvaiheita saattaa esiintyä salmeteroli/flutikasonipropionaatti-hoidon aikana. Potilasta on kehotettava jatkamaan lääkitystä, mutta kääntymään lääkärin puoleen, jos astman oireita ei saada hallintaan tai ne pahenevat salmeteroli/flutikasonipropionaatti-hoidon aloittamisen jälkeen.
Kohtauslääkkeiden (lyhytvaikutteisten bronkodilataattorien) käyttötarpeen lisääntyminen tai heikentynyt vaste niihin viittaa astman hallinnan heikkenemiseen ja lääkärin täytyy arvioida potilaan tila.
Astman hallinnan äkillinen ja etenevä huononeminen on mahdollisesti hengenvaarallinen tila, ja lääkärin on arvioitava potilaan tila kiireellisesti. Kortikosteroidiannoksen suurentamista on harkittava.
Kun astman oireet on saatu hallintaan, voidaan harkita salmeteroli/flutikasonipropionaatti-annoksen asteittaista pienentämistä. Potilaan säännöllinen seuranta on tärkeää lääkitystä vähennettäessä. Pienintä tehokasta salmeteroli/flutikasonipropionaatti-annosta tulee käyttää (ks. kohta Annostus ja antotapa).
Hoitoa salmeteroli/flutikasonipropionaatilla ei pidä lopettaa äkillisesti astman pahenemisriskin vuoksi. Lääkitystä on vähennettävä asteittain lääkärin valvonnassa.
Kuten aina kortikosteroideja sisältävässä inhalaatiolääkityksessä, varovaisuutta on noudatettava annettaessa salmeteroli/flutikasonipropionaattia potilaalle, jolla on aktiivinen tai lepotilassa oleva keuhkotuberkuloosi tai sienestä, viruksesta tai muusta syystä johtuva hengitystieinfektio. Asianmukainen hoito tulisi aloittaa tarvittaessa nopeasti.
Salmeteroli/flutikasonipropionaatti voi joissakin harvinaisissa tapauksissa aiheuttaa sydämen rytmihäiriöitä, kuten supraventrikulaarista takykardiaa, sydämen lisälyöntisyyttä ja eteisvärinää, sekä suuria hoitoannoksia käytettäessä seerumin kaliumpitoisuuden vähäistä ohimenevää pienenemistä. Salmeteroli/flutikasonipropionaattia tulee antaa varoen potilaalle, jolla on vaikeita sydän- ja verisuonihäiriöitä, rytmihäiriöitä, diabetes mellitus, tyreotoksikoosi, korjaamaton hypokalemia tai taipumusta seerumin pieneen kaliumpitoisuuteen.
Veren glukoosipitoisuuden nousua on raportoitu joissakin hyvin harvinaisissa tapauksissa (ks. kohta Haittavaikutukset). Tämä on syytä ottaa huomioon määrättäessä tätä lääkevalmistetta potilaalle, jolla on anamneesissa diabetes mellitus.
Kuten muussakin inhalaatiohoidossa, annostuksen jälkeen voi ilmetä paradoksaalista bronkospasmia ja siihen liittyvää välitöntä hengityksen vinkunan lisääntymistä ja hengenahdistusta. Paradoksaalinen bronkospasmi lievittyy nopeavaikutteisella bronkodilataattorilla ja on hoidettava välittömästi. Salmeteroli/flutikasonipropionaatin käyttö on välittömästi lopetettava ja tilannearvion mukaan tarvittaessa aloitettava muu vaihtoehtoinen hoito.
Beeta2-agonistihoidon farmakologisia haittavaikutuksia, kuten vapinaa, sydämentykytystä ja päänsärkyä on raportoitu. Ne ovat kuitenkin yleensä ohimeneviä ja vähenevät säännöllisessä hoidossa.
Kaikki inhaloitavat kortikosteroidit voivat aiheuttaa systeemivaikutuksia, etenkin jos niitä käytetään suurina annoksina pitkiä aikoja. Tällaisten vaikutusten ilmaantuminen on huomattavasti vähemmän todennäköistä kuin käytettäessä suun kautta otettavia kortikosteroideja. Mahdollisia systeemivaikutuksia ovat Cushingin oireyhtymä, Cushingin oireyhtymän kaltaiset piirteet, lisämunuaisten lama, luiden mineraalitiheyden väheneminen, kaihi ja glaukooma sekä harvemmin erilaiset psyykkiset ja käyttäytymiseen liittyvät vaikutukset, mukaan lukien psykomotorinen hyperaktiivisuus, unihäiriöt, ahdistuneisuus, masennus tai aggressio (erityisesti lapsilla) (ks. jäljempänä olevasta alakohdasta ”Pediatriset potilaat” tietoa inhaloitavien kortikosteroidien systeemivaikutuksista lapsilla ja nuorilla). Siksi on tärkeää, että potilaan tila arvioidaan säännöllisesti ja että inhaloitavasta kortikosteroidista käytetään pienintä annosta, jolla astma pysyy tehokkaasti hallinnassa.
Pitkäaikainen hoito inhaloitavan kortikosteroidin suurilla annoksilla voi johtaa lisämunuaisten lamaan ja akuuttiin lisämunuaisten kriisiin. Lisämunuaisten lamaa ja akuuttia lisämunuaisten kriisiä on kuvattu joissakin hyvin harvinaisissa tapauksissa myös silloin, kun flutikasonipropionaattiannos on ollut vähintään 500 mutta alle 1 000 mikrogrammaa. Akuutin lisämunuaisten kriisin mahdollisia laukaisijoita voivat olla trauma, kirurginen toimenpide, infektio tai annostuksen nopea pienentäminen. Ilmenevät oireet ovat tyypillisesti epämääräisiä, ja niitä voivat olla ruokahaluttomuus, vatsakipu, painonmenetys, väsymys, päänsärky, pahoinvointi, oksentelu, hypotensio, tajunnantason heikkeneminen, hypoglykemia ja kouristuskohtaukset. Systeemisen kortikosteroidisuojan lisäämistä tulisi harkita stressitilanteissa tai elektiivisessä kirurgiassa.
Salmeterolin ja flutikasonipropionaatin systeeminen imeytyminen tapahtuu pääasiassa keuhkojen kautta. Koska tilajatkeen käyttö inhalaattorin kanssa voi lisätä keuhkoihin tulevan lääkkeen määrää, on huomattava, että tämä saattaa mahdollisesti lisätä systeemisten haittavaikutusten riskiä. Kerta-annoksen farmakokineettisten tietojen perusteella systeeminen altistus salmeterolille ja flutikasonipropionaatille voi jopa kaksinkertaistua, silloin kun salmeteroli‑ ja flutikasonipropionaatti-inhalaatiosumute, suspensio otetaan Volumatic-tilajatkeen avulla verrattuna käyttöön Aerochamber Plus ‑tilajatkeen kanssa.
Inhaloitavan flutikasonipropionaattihoidon hyötyjen pitäisi minimoida tarve käyttää steroideja suun kautta, mutta suun kautta otettavasta steroidihoidosta siirtyvällä potilaalla lisämunuaisten heikentyneen toiminnan riski saattaa säilyä huomattavan pitkään. Siksi tällaista potilasta hoidettaessa on noudatettava erityistä varovaisuutta ja lisämunuaiskuoren toimintaa tulisi seurata säännöllisesti. Myös potilas, joka on aikaisemmin tarvinnut suuria kortikosteroidiannoksia hätätilanteissa, voi olla vaarassa. Potilaalle todennäköisesti stressiä aiheuttavissa hätätilanteissa ja elektiivisissä tilanteissa on aina pidettävä mielessä mahdollisuus, etteivät potilaan lisämunuaiset vieläkään toimi kunnolla ja harkittava asianmukaista kortikosteroidihoitoa. Vaikea lisämunuaisten vajaatoiminta voi vaatia erikoislääkärin konsultaatiota ennen elektiivisiä toimenpiteitä.
Ritonaviiri saattaa voimakkaasti suurentaa flutikasonipropionaatin pitoisuutta plasmassa. Siksi flutikasonipropionaatin ja ritonaviirin samanaikaista käyttöä on vältettävä, ellei mahdollinen hyöty potilaalle ole suurempi kuin systeemisten kortikosteroidihaittojen riski. Systeemisten haittavaikutusten riski kasvaa myös käytettäessä flutikasonipropionaattia yhdessä muiden voimakkaiden CYP3A:n estäjien kanssa (ks. kohta Yhteisvaikutukset).
Keuhkokuume keuhkoahtaumatautipotilailla
3-vuotisessa keuhkoahtaumatautia (COPD) sairastavia potilaita koskeneessa tutkimuksessa raportoitiin, että alempia hengitystietulehduksia (erityisesti keuhkokuumetta ja bronkiittia) oli enemmän potilailla, jotka saivat salmeterolin ja flutikasonipropionaatin kiinteää yhdistelmää Diskuksella/Accuhalerilla, kuin potilailla, jotka saivat plaseboa (ks. kohta Haittavaikutukset). 3-vuotisessa COPD-tutkimuksessa suurin riski saada keuhkokuume oli iäkkäillä potilailla sekä potilailla, joiden painoindeksi oli pieni (< 25 kg/m2), ja potilailla, joiden tauti oli hyvin vaikea (FEV1 < 30 % viitearvosta), riippumatta siitä, mitä hoitoa he saivat. Hoitavien lääkäreiden tulee pitää mielessä keuhkokuumeen ja muiden alempien hengitystieinfektioiden mahdollisuus, koska näiden infektioiden oireet ovat usein samanlaisia kuin COPD:n pahenemisen oireet. Jos potilaalla, jolla on vaikea COPD, on ollut keuhkokuume, Salmeterol/Fluticason Orion -hoito on uudelleenarvioitava. Salmeterol/Fluticason Orion -hoidon turvallisuutta ja tehoa ei ole osoitettu COPD-potilailla, ja siksi Salmeterol/Fluticason Orion -valmistetta ei ole tarkoitettu COPD-potilaiden hoitoon.
Systeemisesti annettavan ketokonatsolin samanaikainen käyttö lisää systeemistä salmeterolialtistusta merkitsevästi. Tämä voi lisätä systeemisten vaikutusten (esim. QTc‑ajan pidentymisen ja sydämentykytyksen) ilmaantuvuutta. Ketokonatsolin ja muiden voimakkaiden CYP3A4:n estäjien käyttöä tulee sen vuoksi välttää, elleivät hyödyt ole suuremmat kuin salmeterolihoidon systeemisten haittavaikutusten riskin mahdollinen suureneminen (ks. kohta Yhteisvaikutukset).
Pediatriset potilaat
Alle 16-vuotiailla nuorilla, jotka saavat suuria annoksia flutikasonipropionaattia (tyypillisesti ≥ 1 000 mikrogrammaa vuorokaudessa), voi olla erityinen riski saada systeemisiä vaikutuksia. Niitä voi ilmaantua varsinkin, kun suuria annoksia käytetään pitkiä aikoja. Mahdollisia systeemivaikutuksia ovat Cushingin oireyhtymä, Cushingin oireyhtymän kaltaiset piirteet, lisämunuaisten lama, akuutti lisämunuaisten kriisi, nuorten kasvun hidastuminen, sekä harvemmin erilaiset psyykkiset ja käyttäytymiseen liittyvät vaikutukset, kuten psykomotorinen hyperaktiivisuus, unihäiriöt, ahdistuneisuus, masennus tai aggressio. Nuorelle on harkittava lähetettä lasten hengityssairauksien erikoislääkärille.
Pitkäaikaista inhaloitavaa kortikosteroidihoitoa saavan nuoren pituuskasvun säännöllistä seuraamista suositellaan.
Inhaloitavasta kortikosteroidista tulee käyttää pienintä annosta, jolla astma pysyy tehokkaasti hallinnassa.
Näköhäiriö
Systeemisesti tai topikaalisesti käytettävien kortikosteroidien käytön yhteydessä saatetaan ilmoittaa näköhäiriöistä. Jos potilaalla esiintyy oireita, kuten näön hämärtymistä tai muita näköhäiriöitä, potilas on ohjattava silmälääkärille, joka arvioi oireiden mahdolliset syyt. Niitä voivat olla kaihi, glaukooma tai harvinaiset sairaudet, kuten sentraalinen seroosi korioretinopatia, joista on ilmoitettu systeemisten tai topikaalisten kortikosteroidien käytön jälkeen.
Yhteisvaikutukset
Beeta-adrenergiset salpaajat voivat heikentää tai estää salmeterolin vaikutusta. Sekä ei-selektiivisten että selektiivisten beetasalpaajien käyttöä tulee välttää hoidettaessa potilaita, joilla on astma, elleivät pakottavat syyt vaadi niiden käyttöä. Beeta2‑agonistihoito voi aiheuttaa mahdollisesti vakavan hypokalemian. Erityistä varovaisuutta tulee noudattaa vaikean akuutin astmakohtauksen aikana, koska ksantiinijohdannaisten, steroidien ja diureettien samanaikainen käyttö voi voimistaa tätä vaikutusta.
Muiden beeta-adrenergisia aineita sisältävien lääkevalmisteiden samanaikaisella käytöllä saattaa olla mahdollisesti additiivinen vaikutus.
Flutikasonipropionaatti
Flutikasonipropionaatin pitoisuus plasmassa on normaalisti hyvin pieni inhalaationa otetun annoksen jälkeen, mikä johtuu laajasta ensikierron metaboliasta ja sytokromi CYP3A4:n kautta välittyvästä suuresta systeemisestä puhdistumasta suolessa ja maksassa. Tämän vuoksi flutikasonipropionaatilla ei todennäköisesti ole kliinisesti merkittäviä yhteisvaikutuksia muiden lääkeaineiden kanssa.
Terveillä henkilöillä tehdyssä yhteisvaikutustutkimuksessa, jossa annettiin intranasaalista flutikasonipropionaattia, ritonaviiri (hyvin voimakas sytokromi CYP3A4:n estäjä) 100 mg kahdesti vuorokaudessa suurensi plasman flutikasonipropionaattipitoisuuden monisatakertaiseksi sillä seurauksella, että seerumin kortisolipitoisuus pieneni huomattavasti. Inhaloitavan flutikasonipropionaatin suhteen ei ole tietoa tästä yhteisvaikutuksesta, mutta flutikasonipropionaattipitoisuuden plasmassa odotetaan suurenevan huomattavasti. Yhteiskäytön CYP3A:n estäjien, mukaan lukien kobisistaattia sisältävien valmisteiden, kanssa odotetaan suurentavan systeemisten haittavaikutusten riskiä. Cushingin oireyhtymää ja lisämunuaiskuoren toiminnan lamaantumista on raportoitu. Tämän yhdistelmän käyttöä on vältettävä, ellei hyöty ole suurempi kuin systeemisten kortikosteroidihaittojen suurentunut riski, jolloin potilasta on seurattava systeemisten kortikosteroidihaittojen varalta.
Pienessä terveillä tutkittavilla tehdyssä tutkimuksessa vähemmän voimakas CYP3A:n estäjä ketokonatsoli lisäsi flutikasonipropionaattialtistusta yhden inhalaation jälkeen 150 %. Tämän seurauksena plasman kortisolipitoisuus pieneni enemmän kuin käytettäessä pelkkää flutikasonipropionaattia. Flutikasonipropionaatin ja muiden voimakkaiden CYP3A:n estäjien (kuten itrakonatsolin ja kobisistaattia sisältävien valmisteiden) ja kohtalaisen voimakkaiden CYP3A:n estäjien (kuten erytromysiinin) yhteiskäytön odotetaan myös lisäävän systeemistä altistusta flutikasonipropionaatille ja systeemisten haittavaikutusten riskiä. Yhteiskäyttöä on vältettävä, ellei hoidosta saatava hyöty ole suurempi kuin systeemiseen kortikosteroidialtistukseen liittyvien mahdollisten haittavaikutusten riski, jolloin potilaan tilaa on seurattava kortikosteroidien systeemisten haittavaikutusten varalta.
Salmeteroli
Voimakkaat CYP3A4:n estäjät
Ketokonatsolin (400 mg kerran vuorokaudessa suun kautta) anto yhdessä salmeterolin (50 mikrogrammaa kahdesti vuorokaudessa inhalaationa) kanssa 15 terveelle tutkittavalle 7 vuorokauden ajan sai aikaan merkitsevän nousun plasman salmeterolialtistuksessa (1,4‑kertainen Cmax ja 15‑kertainen AUC). Tämä voi johtaa salmeterolihoidon muiden systeemivaikutusten (esim. QTc-ajan pidentymisen ja sydämentykytysten) ilmaantuvuuden lisääntymiseen verrattuna pelkän salmeterolin tai ketokonatsolin käyttöön (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Verenpaineessa, sydämen lyöntitiheydessä, veren glukoosi- ja kaliumpitoisuuksissa ei havaittu kliinisesti merkitseviä vaikutuksia. Samanaikainen anto ketokonatsolin kanssa ei pidentänyt salmeterolin eliminaation puoliintumisaikaa eikä lisännyt salmeterolin kumuloitumista toistuvassa annossa.
Ketokonatsolin samanaikaista antoa tulee välttää, elleivät hyödyt ole suuremmat kuin salmeterolihoidon systeemisten haittavaikutusten mahdollisesti suurentunut riski. Muihin voimakkaisiin CYP3A4:n estäjiin (esim. itrakonatsoli, telitromysiini, ritonaviiri) liittyy todennäköisesti samankaltainen yhteisvaikutusriski.
Kohtalaisen voimakkaat CYP3A4:n estäjät
Erytromysiinin (500 mg kolme kertaa vuorokaudessa suun kautta) samanaikainen anto salmeterolin (50 mikrogrammaa kahdesti vuorokaudessa inhalaationa) kanssa 15 terveelle tutkittavalle 6 vuorokauden ajan suurensi salmeterolialtistusta hieman, mutta ei tilastollisesti merkitsevästi (1,4‑kertainen Cmax ja 1,2‑kertainen AUC). Samanaikaiseen antoon erytromysiinin kanssa ei liittynyt vakavia haittavaikutuksia.
Raskaus ja imetys
Raskaus
Laajat tiedot (yli 1 000 raskaudesta) salmeteroli/flutikasonipropionaatin käytöstä raskaana olevien naisten hoidossa eivät viittaa epämuodostumia aiheuttavaan, fetaaliseen tai neonataaliseen toksisuuteen. Eläinkokeissa on havaittu lisääntymistoksisuutta beeta‑2-adrenoreseptoriagonistien ja glukokortikosteroidien annon jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Salmeteroli/flutikasonipropionaatin antoa raskaana oleville naisille tulee harkita vain, jos äidille odotettavissa oleva hyöty on suurempi kuin sikiölle mahdollisesti aiheutuva riski.
Hoidettaessa raskaana olevia naisia tulee käyttää pienintä tehokasta flutikasonipropionaattiannosta, jolla astma pysyy riittävästi hallinnassa.
Imetys
Ei tiedetä, erittyvätkö salmeteroli ja flutikasonipropionaatti tai niiden metaboliitit ihmisen rintamaitoon.
Tutkimukset ovat osoittaneet, että salmeteroli ja flutikasonipropionaatti ja niiden metaboliitit erittyvät imettävien rottien maitoon.
Rintaruokittuihin vastasyntyneisiin/imeväisiin kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai salmeteroli/flutikasonipropionaatti-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ei ole olemassa tietoa ihmisistä. Eläinkokeissa salmeterolilla tai flutikasonipropionaatilla ei ollut vaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Potilaille pitää neuvoa, että salmeteroli/flutikasonipropionaatti -lääkehoidon aikana saattaa esiintyä näön hämärtymistä. Auton ajossa ja koneiden käytössä on siksi noudatettava varovaisuutta.
Haittavaikutukset
Koska salmeteroli/flutikasonipropionaatti-inhalaatiosumute, suspensio sisältää sekä salmeterolia että flutikasonipropionaattia, on odotettavissa samankaltaisia ja samanasteisia haittavaikutuksia kuin käytettäessä kumpaakin lääkeainetta yksin. Näiden kahden lääkeaineen yhteiskäytön ei ole havaittu aiheuttavan muita haittavaikutuksia.
Salmeterolin/flutikasonipropionaatin käyttöön liittyvät haittavaikutukset on lueteltu seuraavassa elinjärjestelmittäin ja esiintymistiheyksittäin. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Haittavaikutusten esiintymistiheydet perustuvat kliinisiin tutkimustietoihin. Ilmaantuvuutta lumelääkeryhmässä ei ole otettu huomioon.
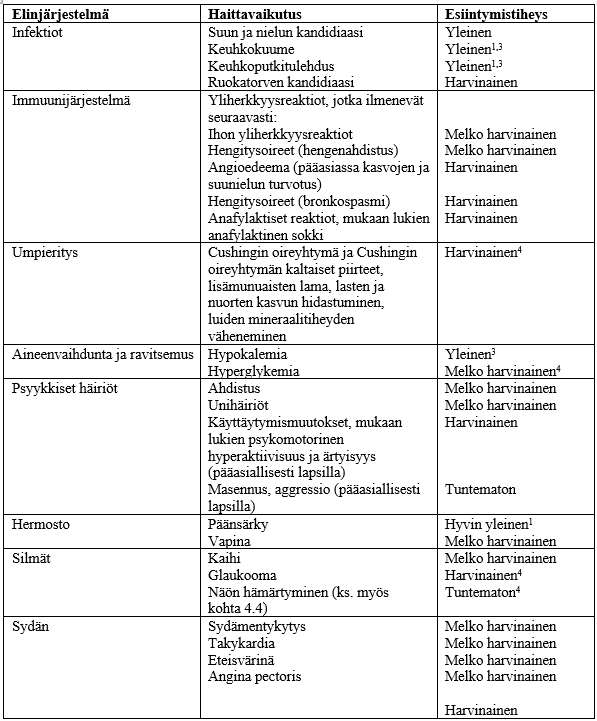

1. Raportoitu yleisesti lumelääkkeellä
2. Raportoitu hyvin yleisesti lumelääkkeellä
3. Raportoitu COPD-tutkimuksessa kolmen vuoden aikana
4. Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet
Valikoitujen haittavaikutusten kuvaus
Beeta2-agonistihoidon farmakologisia haittavaikutuksia, kuten vapinaa, sydämentykytystä ja päänsärkyä, on raportoitu. Ne ovat kuitenkin yleensä ohimeneviä ja vähenevät lääkityksen jatkuessa säännöllisenä.
Kuten muunkin inhalaatiohoidon yhteydessä, paradoksaalinen bronkospasmi voi ilmetä, jolloin hengityksen vinkuna ja hengenahdistus lisääntyvät heti lääkkeen ottamisen jälkeen. Paradoksaalinen bronkospasmi lievittyy nopeavaikutteisella bronkodilataattorilla ja tulisi hoitaa välittömästi. Tällöin salmeterolin ja flutikasonipropionaatin käyttö tulisi välittömästi lopettaa, potilaan tilanne arvioida ja tarvittaessa aloittaa muu hoito.
Tämän yhdistelmälääkkeen flutikasonipropionaattikomponentti saattaa aiheuttaa joillekin potilaille äänen käheyttä ja suun ja nielun kandidiaasia (sammasta) ja joissakin harvinaisemmissa tapauksissa ruokatorven kandidiaasia. Sekä käheyden että suun ja nielun kandidiaasin ilmaantuvuutta voi yrittää vähentää huuhtomalla suu vedellä ja/tai harjaamalla hampaat tämän lääkevalmisteen käytön jälkeen. Oireista suun ja nielun kandidiaasia voidaan hoitaa paikallisilla sienilääkkeillä keskeyttämättä salmeteroli/flutikasonipropionaatti-hoitoa.
Pediatriset potilaat
Mahdollisia systeemivaikutuksia ovat Cushingin oireyhtymä, Cushingin oireyhtymän kaltaiset piirteet, lisämunuaisten lama sekä nuorten kasvun hidastuminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Nuoret saattavat myös kokea ahdistuneisuutta, unihäiriöitä ja käyttäytymismuutoksia, mukaan lukien hyperaktiivisuutta ja ärtyneisyyttä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Salmeteroli/flutikasonipropionaatin yliannostuksesta ei ole kliinisistä tutkimuksista saatua tietoa. Seuraavassa on kuitenkin tietoa kummankin yksittäisen lääkeaineen yliannostuksesta.
Salmeteroli
Salmeterolin yliannostuksen oireet ja löydökset ovat heitehuimaus, systolisen verenpaineen nousu, vapina, päänsärky ja takykardia. Jos hoito salmeteroli/flutikasonipropionaatilla joudutaan keskeyttämään lääkevalmisteen beeta-agonistiosan yliannostuksen vuoksi, tulee harkita asianmukaista korvaavaa steroidihoitoa. Hypokalemiaa saattaa myös esiintyä, ja siksi seerumin kaliumpitoisuutta on seurattava. Korvaavan kaliumin antamista on harkittava.
Flutikasonipropionaatti
Akuutti yliannostus
Akuutti suositeltuja suurempien flutikasonipropionaattiannosten inhalointi saattaa lamauttaa lisämunuaisten toiminnan tilapäisesti. Hätätoimet eivät ole tarpeen, sillä lisämunuaisten toiminta palautuu normaaliksi muutaman päivän kuluessa, mikä voidaan todeta plasman kortisolimittauksilla.
Krooninen yliannostus
Lisämunuaisten toimintaa tulee seurata, ja hoito systeemisellä kortikosteroidilla saattaa olla tarpeellista. Hoitoa tulee jatkaa inhaloitavan kortikosteroidin suositusannoksella lisämunuaisten toiminnan vakauduttua. Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet: lisämunuaisten laman riski.
Lisämunuaisten toiminnan seuraaminen saattaa olla tarpeen. Flutikasonipropionaatin sekä akuuteissa että kroonisissa yliannostustapauksissa salmeteroli/flutikasonipropionaatti-hoitoa tulee jatkaa sopivalla annostuksella, jolla oireet pysyvät hallinnassa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergiset lääkeaineet yhd.valmisteina kortikosteroidien tai muiden lääkeaineiden kanssa, ATC-koodi: R03AK06
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Salmeteroli/flutikasonipropionaatti-inhalaatiosumute, suspensio sisältää salmeterolia ja flutikasonipropionaattia, joiden vaikutustavat ovat erilaiset.
Kummankin lääkeaineen vaikutusmekanismit on kuvattu seuraavassa.
Salmeteroli
Salmeteroli on selektiivinen pitkävaikutteinen (12 tuntia) beeta2‑adrenoreseptoriagonisti, jonka pitkä sivuketju sitoutuu reseptorin toissijaiseen sitoutumiskohtaan (exo-site).
Salmeteroli laajentaa keuhkoputkia vähintään 12 tunnin ajaksi, eli kauemmin kuin tavanomaiset lyhytvaikutteiset beeta2‑agonistit suositusannoksina.
Flutikasonipropionaatti
Inhaloitavan flutikasonipropionaatin suositusannokset saavat keuhkoissa aikaan anti-inflammatorisen glukokortikoidivaikutuksen, jolloin astman oireet ja pahenemisvaiheet lievittyvät vähemmillä haittavaikutuksilla kuin käytettäessä systeemisesti annettavia kortikosteroideja.
Kliininen teho ja turvallisuus
Salmeteroli / flutikasonipropionaatilla suoritetut kliiniset astmatutkimukset
Kaksitoista kuukautta kestäneessä tutkimuksessa (Gaining Optimal Asthma ControL, GOAL), johon osallistui 3 416 jatkuvaa astmaa sairastanutta aikuista ja nuorta, verrattiin salmeteroli/flutikasonipropionaatin turvallisuutta ja tehoa pelkkään inhaloitavaan kortikosteroidiin (flutikasonipropionaatti) tarkoituksena selvittää, ovatko astman hallinnan tavoitteet saavutettavissa. Annosta suurennettiin 12 viikon välein, kunnes astma saatiin **täysin hallintaan tai tutkimuslääke oli nostettu suurimpaan annokseen. GOAL osoitti, että salmeteroli/flutikasonipropionaattia saaneilla potilailla astma saatiin hallintaan useammin kuin pelkkää inhaloitavaa kortikosteroidia saaneilla potilailla ja että astman hallinta saavutettiin pienemmällä kortikosteroidiannoksella.
Astman * hyvä hallinta saavutettiin nopeammin salmeteroli/flutikasonipropionaatilla kuin pelkällä inhaloitavalla kortikosteroidilla. Hoitoaika ensimmäiseen viikkoon, jolloin 50 %:lla potilaista astma oli hyvässä hallinnassa, oli 16 päivää salmeteroli/ flutikasonipropionaattia saaneiden ryhmässä ja 37 päivää inhaloitavaa kortikosteroidia saaneiden ryhmässä. Alaryhmässä, johon kuuluneet astmapotilaat eivät olleet aikaisemmin saaneet steroideja, aika kunkin potilaan ensimmäiseen viikkoon, jolloin astma oli hyvässä hallinnassa, oli 16 päivää salmeteroli/flutikasonipropionaattia saaneiden ryhmässä ja 23 päivää inhaloitavaa kortikosteroidia saaneilla.
Yhteenveto tutkimustuloksista:
| Prosentuaalinen osuus potilaista, joiden astma saatiin *hyvään hallintaan (well controlled, WC) ja **täysin hallintaan (totally controlled, TC) 12 kuukauden aikana | ||||
| Salmeteroli/FP | FP | |||
| Lääkitys ennen tutkimusta | WC | TC | WC | TC |
| Ei inhaloitavaa kortikosteroidia (pelkkä lyhytvaikutteinen beeta-agonisti) | 78 % | 50 % | 70 % | 40 % |
| Pieni annos inhaloitavaa kortikosteroidia (≤ 500 mikrogrammaa beklometasonidipropionaattia tai vastaavaa/päivä) | 75 % | 44 % | 60 % | 28 % |
| Keskisuuri annos inhaloitavaa kortikosteroidia (> 500–1 000 mikrogrammaa beklometasonidipropionaattia tai vastaavaa/päivä) | 62 % | 29 % | 47 % | 16 % |
| Kolmen hoitotason tulosten yhteenveto | 71 % | 41 % | 59 % | 28 % |
* Hyvässä hallinnassa oleva astma: oirepistemäärä on ollut suurempi kuin 1 enintään 2 päivän ajan (oirepistemäärä 1 on määritelty seuraavasti: oireita esiintyi lyhytkestoisesti kerran päivässä), lyhytvaikutteisen beeta-agonistin käyttöä enintään 2 päivänä ja enintään 4 kertaa viikossa, uloshengityksen huippuvirtaus (PEF) aamulla vähintään 80 % viitearvosta, ei heräämisiä öisin, ei pahenemisvaiheita eikä hoitomuutosta vaativia haittavaikutuksia.
** Täysin hallinnassa oleva astma: ei oireita, ei lyhytvaikutteisten beeta-agonistien käyttöä, uloshengityksen huippuvirtaus (PEF) aamulla vähintään 80 % viitearvosta, ei heräämisiä öisin, ei pahenemisvaiheita eikä hoitomuutosta vaativia haittavaikutuksia.
Tämän tutkimuksen tulosten perusteella salmeteroli- ja flutikasonipropionaatti-inhalaatiosumutetta 50/100 mikrogrammaa/annos kaksi kertaa vuorokaudessa voidaan harkita aloitushoidoksi potilaille, joilla on keskivaikea jatkuva astma ja joiden astman saamista nopeasti hallintaan pidetään välttämättömänä (ks. kohta Annostus ja antotapa).
Satunnaistetussa rinnakkaisryhmin tehdyssä kaksoissokkotutkimuksessa, johon osallistuneilla ≥ 18-vuotiailla 318 potilaalla oli jatkuva astma, arvioitiin turvallisuutta ja siedettävyyttä annettaessa kaksi salmeteroli/flutikasonipropionaatti-inhalaatiota kahdesti vuorokaudessa (kaksinkertainen annos) kahden viikon ajan. Tutkimus osoitti, että kunkin salmeteroli/flutikasonipropionaatti-vahvuuden kaksinkertaisen inhalaatiomäärän ottaminen 14 vuorokauden ajan lisäsi hieman beeta-agonisteihin liittyviä haittatapahtumia (vapina; 1 potilas [1 %] vs. 0, sydämentykytys; 6 [3 %] vs. 1 [< 1 %], lihaskouristukset 6 [3 %] vs. 1 [< 1 %]), ja inhaloitaviin kortikosteroideihin liittyvien haittatapahtumien ilmaantuvuus oli samaa luokkaa (esim. suun kandidiaasi; 6 [6 %] vs. 16 [8 %], käheys; 2 [2 %] vs. 4 [2 %]) verrattuna yhteen inhalaatioon kahdesti vuorokaudessa. Tämä pieni lisäys beeta-agonisteihin liittyvien haittatapahtumien määrässä on otettava huomioon, jos harkitaan salmeteroli/flutikasonipropionaatti-annoksen kaksinkertaistamista aikuispotilaalle, joka tarvitsee lyhytaikaista (enintään 14 vuorokauden) lisähoitoa inhaloitavalla kortikosteroidilla.
Astma
Salmeterolilla tehty kliininen monikeskustutkimus astman hoidossa (The Salmeterol Multicenter Asthma Research Trial, SMART)
Salmeterolilla tehty kliininen astman monikeskustutkimus (Salmeterol Multi-center Asthma Research Trial SMART) oli 28 viikkoa kestänyt USA:ssa tehty tutkimus, jossa arvioitiin salmeterolin turvallisuutta tavanomaisen astmalääkityksen lisänä lumelääkkeeseen verrattuna. Tutkimukseen osallistui aikuisia ja nuoria potilaita. Vaikka päätetapahtumassa, joka oli hengitykseen liittyvien kuolemien ja hengenvaarallisten tapahtumien lukumäärän yhdistelmä, ei ollut merkitseviä eroja, tutkimus osoitti astmaan liittyvien kuolemien lisääntyneen merkitsevästi salmeterolia saaneilla potilailla (13 176:n salmeterolilääkitystä saaneen potilaan ryhmässä oli 13 kuolemantapausta, kun taas 13 179:n lumelääkettä saaneen potilaan ryhmässä kuolemantapauksia oli 3). Tutkimusta ei oltu suunniteltu arvioimaan inhaloitujen kortikosteroidien samanaikaisen käytön vaikutusta ja vain 47 % koehenkilöistä ilmoitti lähtötilanteessa käyttävänsä inhaloitavaa kortikosteroidia.
Salmeteroli / flutikasonipropionaatin turvallisuus ja teho pelkkään flutikasonipropionaattiin verrattuna astman hoidossa
Salmeteroli/flutikasonipropionaatin ja pelkän flutikasonipropionaatin turvallisuuden ja tehon vertaamista varten tehtiin kaksi 26 viikkoa kestävää monikeskustutkimusta. Toiseen osallistui aikuisia ja nuoria tutkittavia (AUSTRI-tutkimus) ja toiseen 4–11 vuoden ikäisiä lapsipotilaita (VESTRI-tutkimus). Molempiin tutkimuksiin osallistuvilla tutkittavilla oli keskivaikea tai vaikea jatkuva astma ja astmaan liittyvä sairaalahoitojakso tai astman pahenemisvaihe edellisen vuoden aikana. Kummankin tutkimuksen ensisijainen tavoite oli verrata pitkävaikutteista beeta-agonistia ja inhaloitavaa kortikosteroidia (salmeteroli/flutikasonipropionaatti) ja pelkkää inhaloitavaa kortikosteroidia (flutikasonipropionaatti) käyttävien potilaiden hoidon aikaisia vakavia astmaan liittyviä tapahtumia (astmaan liittyvä sairaalahoito, endotrakeaalinen intubaatio ja kuolema) non-inferiority-asetelmassa. Näiden tutkimusten toissijainen tehoa koskeva tavoite oli arvioida, oliko hoito pitkävaikutteisen beeta-agonistin ja inhaloitavan kortikosteroidin yhdistelmällä (salmeteroli/flutikasonipropionaatti) parempi kuin pelkällä inhaloitavalla kortikosteroidilla (flutikasonipropionaatti) vaikeiden astman pahenemisvaiheiden kannalta (vaikeaksi astman pahenemisvaiheeksi määritettiin tilanne, jossa astman vaikeutuminen edellytti systeemisten kortikosteroidien käyttöä vähintään 3 päivän ajan tai potilaan sairaalahoitoa tai päivystyskäyntiä johtuen astmasta, jonka hoito edellytti systeemisten kortikosteroidien käyttöä).
AUSTRI-tutkimukseen satunnaistettiin 11 679 tutkittavaa ja VESTRI-tutkimukseen 6 208 tutkittavaa, jotka saivat hoitoa. Molemmissa tutkimuksissa saavutettiin tavoite (non-inferiority) turvallisuuden ensisijaisen päätetapahtuman osalta (ks. alla oleva taulukko).
Vakavat astmaan liittyvät tapahtumat 26 viikon AUSTRI- ja VESTRI-tutkimuksissa
| AUSTRI | VESTRI | |||
Salmeteroli-flutikasoni-propionaatti (n=5 834) | Pelkkä flutikasoni-propionaatti (n=5 845) | Salmeteroli-flutikasoni-propionaatti (n=3 107) | Pelkkä flutikasoni-propionaatti (n=3 101) | |
Yhdistetty päätetapahtuma (astmaan liittyvä sairaalahoito, endotrakeaalinen intubaatio tai kuolema) | 34 (0,6 %) | 33 (0,6 %) | 27 (0,9 %) | 27 (0,7 %) |
Salmeteroli-flutikasoni-propionaatin/ flutikasonipropionaatin riskisuhde (95 % CI) | 1,029 (0,638-1,662)a | 1,285 (0,726-2,272)b | ||
| Kuolema | 0 | 0 | 0 | 0 |
Astmaan liittyvä sairaalahoito | 34 | 33 | 27 | 21 |
Endotrakeaalinen intubaatio | 0 | 2 | 0 | 0 |
a Jos tulokseksi saatu arvio suhteellisen riskin 95 %:n luottamusvälin ylemmälle rajalle oli alle 2,0, hoito todettiin vertailukelpoiseksi (non-inferiority).
b Jos tulokseksi saatu arvio suhteellisen riskin 95 %:n luottamusvälin ylemmälle rajalle oli alle 2,675, hoito todettiin vertailukelpoiseksi (non-inferiority).
Toissijaisen tehon päätetapahtuman osalta salmeteroli-flutikasonipropionaatin ensimmäiseen astman pahenemisvaiheeseen kuluvan ajan lyheneminen suhteessa flutikasonipropionaattiin havaittiin molemmissa tutkimuksissa. Kuitenkin vain AUSTRI-tutkimuksessa tulos oli tilastollisesti merkitsevä:
| AUSTRI | VESTRI | |||
Salmeteroli-flutikasoni-propionaatti (n=5 834) | Pelkkä flutikasoni-propionaatti (n=5 845) | Salmeteroli-flutikasoni-propionaatti (n=3 107) | Pelkkä flutikasoni-propionaatti (n=3 101) | |
| Tutkittavat, joiden astma paheni | 480 (8 %) | 597 (10 %) | 265 (9 %) | 309 (10 %) |
Salmeteroli-flutikasoni-propionaatin/ flutikasonipropionaatin riskisuhde (95 %:n CI) | 0,787 (0,698, 0,888) | 0,859 (0,729, 1,012) | ||
Flutikasonipropionaattia sisältävät lääkkeet astman hoidossa raskauden aikana
Havainnoivassa retrospektiivisessä epidemiologisessa kohorttitutkimuksessa hyödynnettiin Ison‑Britannian sähköisiä potilaskertomuksia, jotta voitiin arvioida merkittävien synnynnäisten epämuodostumien riskiä ryhmässä, joka oli ensimmäisen raskauskolmanneksen aikana altistunut pelkälle inhaloitavalle flutikasonipropionaatille ja/tai inhaloitavan salmeterolin ja flutikasonipropionaatin yhdistelmälle verrattuna muihin inhaloitaviin kortikosteroideihin, jotka eivät sisältäneet flutikasonipropionaattia. Tässä tutkimuksessa ei käytetty lumelääkevertailua.
Astmakohortissa, jossa oli mukana 5 362 ensimmäisellä raskauskolmanneksella inhaloitavalle kortikosteroidille altistunutta raskautta, todettiin 131 merkittävää synnynnäistä epämuodostumaa. 1 612 tapauksista (30 %) altistui flutikasonipropionaatille tai salmeterolin ja flutikasonipropionaatin yhdistelmälle, ja näistä 42 tapauksessa todettiin merkittävä synnynnäinen epämuodostuma. Korjattu kerroinsuhde yhteen vuoteen mennessä diagnosoidulle merkittävälle synnynnäiselle epämuodostumalle oli keskivaikeaa astmaa sairastavilla naisilla 1,1 (95 % luottamusväli: 0,5–2,3) ja huomattavaa tai vaikeaa astmaa sairastavilla naisilla 1,2 (95 % luottamusväli: 0,7–2,0), kun flutikasonipropionaatille altistuneita verrattiin muille inhaloitaville kortikosteroideille (ei sisältänyt flutikasonipropionaattia) altistuneisiin.
Merkittävien synnynnäisten epämuodostumien riskissä ei havaittu eroa ensimmäisen raskauskolmanneksen aikana pelkälle inhaloitavalle flutikasonipropionaatille altistuneiden, ja inhaloitavan salmeterolin ja flutikasonipropionaatin yhdistelmälle altistuneiden ryhmien välillä. Merkittävien synnynnäisten epämuodostumien absoluuttinen riski kaikissa astman vaikeusasteissa vaihteli välillä 2,0‑2,9 sataa flutikasonipropionaatille altistunutta raskautta kohti, mikä on verrattavissa yleislääketieteen tutkimustietokannan (General Practice Research Database) tutkimustuloksiin, jotka oli saatu 15 840 raskaudesta, joissa ei käytetty astmahoitoja (2,8 merkittävää synnynnäistä epämuodostumaa 100 raskautta kohti).
Farmakokinetiikka
Kun salmeterolia ja flutikasonipropionaattia annettiin yhdessä inhalaationa, kummankin komponentin farmakokinetiikka oli samankaltainen kuin mitä on havaittu annettaessa näitä lääkeaineita erikseen. Sen vuoksi kummankin lääkkeen farmakokinetiikkaa voidaan tarkastella erikseen.
Salmeteroli
Salmeteroli vaikuttaa paikallisesti keuhkoissa; siksi plasman lääkepitoisuus ei ole osoitus hoitovaikutuksista. Salmeterolin farmakokinetiikasta on lisäksi vain vähän tietoa, koska salmeterolin pitoisuus plasmassa on hoitoannosten inhalaation jälkeen niin pieni (noin 200 pikogrammaa/ml tai vähemmän), että sitä on teknisesti vaikea määrittää.
Flutikasonipropionaatti
Inhaloitavan flutikasonipropionaatin kerta-annoksen absoluuttinen hyötyosuus terveissä henkilöissä on noin 5–11 % nimellisannoksesta käytetyn inhalaattorin mukaan. Astmapotilaiden systeemisen altistuksen inhaloitavalle flutikasonipropionaatille on havaittu olevan vähäisempää.
Systeeminen imeytyminen tapahtuu pääasiassa keuhkoista ja on alussa nopeaa, mutta hidastuu sen jälkeen. Inhalaatioannoksen loppuosa voi tulla niellyksi, mutta sen vaikutus systeemiseen altistukseen on hyvin pieni lääkeaineen vähäisen vesiliukoisuuden ja ensikierron metabolian takia. Näiden vuoksi oraalinen hyötyosuus on alle 1 %. Systeeminen altistuminen kasvaa lineaarisesti inhalaatioannoksen suurenemisen myötä.
Flutikasonipropionaatin eliminaatiolle on ominaista suuri plasmapuhdistuma (1 150 ml/min), suuri vakaan tilan jakautumistilavuus (noin 300 l) ja noin 8 tunnin terminaalinen puoliintumisaika.
Sitoutuminen plasman proteiineihin on 91 %.
Flutikasonipropionaatti poistuu hyvin nopeasti systeemisestä verenkierrosta metaboloitumalla pääasiassa sytokromi P450:n CYP3A4-entsyymin avulla inaktiiviseksi karboksyylihappometaboliitiksi. Myös muita tunnistamattomia metaboliitteja on löytynyt ulosteesta.
Flutikasonipropionaatin munuaispuhdistuma on lähes olematon. Alle 5 % annoksesta erittyy virtsaan, pääasiassa metaboliitteina. Suurin osa annoksesta erittyy ulosteeseen metaboliitteina ja muuttumattomana lääkeaineena.
Prekliiniset tiedot turvallisuudesta
Eläinkokeissa erikseen annettujen salmeterolin ja flutikasonipropionaatin ainoat turvallisuuteen liittyvät huolenaiheet ihmisen kannalta olivat liian voimakkaiden farmakologisten vaikutusten seuraukset.
Eläinten lisääntymistutkimuksissa glukokortikosteroidien on todettu aiheuttavan epämuodostumia (kitalakihalkio, luuston epämuodostumat). Näiden eläinkokeiden tuloksilla ei kuitenkaan näytä olevan merkitystä käytettäessä suositeltuja annoksia ihmiselle. Salmeterolilla tehdyissä eläinkokeissa on ilmennyt alkio- ja sikiötoksisuutta ainoastaan korkeilla altistustasoilla. Annettaessa molempia lääkeaineita yhdessä havaittiin rotilla esiintyvän useammin napavaltimon siirtymää ja takaraivoluun epätäydellistä luutumista käytettäessä annoksia, joilla glukokortikoidien tiedetään aiheuttavan epämuodostumia. Salmeteroliksinafoaatti tai flutikasonipropionaatti eivät kumpikaan osoittaneet potentiaalia geneettiseen toksisuuteen.
Useita eläinlajeja altistettiin päivittäin kahden vuoden ajan hyvin suurille sumutepitoisuuksille, jotka ylittivät selvästi potilaiden todennäköisesti saamat annokset. Näissä kokeissa CFC:tä sisältämättömällä ponneaine norfluraanilla ei todettu olevan toksista vaikutusta.
Farmaseuttiset tiedot
Apuaineet
Ponneaine: Norfluraani (HFA 134a).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Säilytys
Laita suukappaleen suojus napakasti paikalleen ja napsauta se kiinni.
Säiliössä on paineistettua nestettä.
Säilytä alle 25 °C:ssa. Älä altista yli 50 °C:n lämpötiloille. Säiliötä ei pidä ilmeisen tyhjänäkään puhkaista, rikkoa tai polttaa.
Useimpien painepakkauksessa olevien inhaloitavien lääkevalmisteiden tavoin myös tämän lääkevalmisteen hoitoteho saattaa heikentyä silloin, kun säiliö on kylmä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SALMETEROL/FLUTICASON ORION inhalaatiosumute, suspensio
25/250 mikrog/annos (L:ei) 120 annosta (17,56 €)
PF-selosteen tieto
Salmeteroli/flutikasonipropionaatti-inhalaatiosumute, suspensio on alumiinisäiliössä, jossa on tarkoitukseen sopiva annosventtiili ja muovinen annostelija, jossa on annoslaskin ja pölysuojus. Valmiste on pussissa, jossa on piidioksidigeeliä.
Jokaisessa inhalaattorissa on 120 mitattua annosta.
Pakkauskoko: 1 x 120 mitattua annosta/inhalaattori.
Valmisteen kuvaus:
Säiliössä oleva suspensio on valkoista ja homogeenista.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SALMETEROL/FLUTICASON ORION inhalaatiosumute, suspensio
25/250 mikrog/annos 120 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AK06
Valmisteyhteenvedon muuttamispäivämäärä
22.07.2020
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
