ANZUPGO emulsiovoide 20 mg/g
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi gramma emulsiovoidetta sisältää 20 mg delgositinibia (delgocitinib).
Apuaineet, joiden vaikutus tunnetaan
Yksi gramma emulsiovoidetta sisältää 10 mg bentsyylialkoholia (E 1519), 0,2 mg butyylihydroksianisolia (E 320) ja 72 mg setostearyylialkoholia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Emulsiovoide
Kliiniset tiedot
Käyttöaiheet
Anzupgo on tarkoitettu keskivaikean ja vaikean kroonisen käsiekseeman ( chronic hand eczema, CHE) hoitoon aikuisille, joille hoito paikallisilla kortikosteroideilla ei riitä tai ei sovi (ks. kohta Farmakodynamiikka).
Ehto
Hoidon saavat aloittaa ja sitä saavat valvoa lääkärit, joilla on kokemusta kroonisen käsiekseeman diagnosoinnista ja hoidosta.
Annostus ja antotapa
Anzupgo-hoidon saavat aloittaa ja sitä saavat valvoa lääkärit, joilla on kokemusta kroonisen käsiekseeman diagnosoinnista ja hoidosta.
Annostus
Ohut kerros Anzupgo-valmistetta levitetään kahdesti vuorokaudessa käsien ja ranteiden hoidettavalle iholle, kunnes ihossa ei ole sairauden merkkejä tai se on lähes ilman merkkejä (ks. kohta Farmakodynamiikka). On suositeltavaa levittää emulsiovoidetta säännöllisin väliajoin, noin 12 tunnin välein.
Jos kroonisen käsiekseeman merkit ja oireet uusiutuvat (pahenemisvaihe), kahdesti vuorokaudessa toteutettava hoito tulee tarvittaessa aloittaa uudelleen.
Hoito on lopetettava, jos paranemista ei ole havaittavissa 12 viikkoa kestäneen jatkuvan hoidon jälkeen.
Annoksen unohtuminen
Jos annos unohtuu, emulsiovoidetta on levitettävä mahdollisimman pian. Tämän jälkeen hoitoa jatketaan tavanomaisen aikataulun mukaisesti.
Erityisryhmät
Iäkkäät potilaat
Annosta ei tarvitse muuttaa iäkkäille potilaille.
Maksan ja munuaisten vajaatoiminta
Anzupgo-valmisteella ei ole tehty tutkimuksia vaikeaa maksan tai munuaisten vajaatoimintaa sairastavilla potilailla. Annoksen muuttamista ei kuitenkaan suositella, sillä paikallisesti annostellun delgositinibin systeeminen altistus on hyvin pieni (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Anzupgo-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Anzupgo on tarkoitettu käytettäväksi vain iholle. Ohut kerros Anzupgo-valmistetta levitetään käsien ja ranteiden hoidettavien alueiden puhtaalle ja kuivalle iholle. Potilaiden tulee välttää muiden paikallisesti annosteltavien valmisteiden käyttöä välittömästi ennen Anzupgo-valmisteen levittämistä ja välittömästi sen jälkeen (ks. kohta Yhteisvaikutukset). Perusvoiteiden samanaikaista käyttöä 2 tunnin sisällä ennen delgositinibin käyttöä ja sen jälkeen ei ole tutkittu.
Jos joku toinen levittää emulsiovoiteen potilaan puolesta, häntä on kehotettava pesemään kädet sen jälkeen.
Kosketusta silmien, suun tai muiden limakalvojen kanssa tulee välttää. Jos valmistetta pääsee limakalvoille, huuhtele alue perusteellisesti vedellä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ei-melanoomatyyppinen ihosyöpä
Paikallista JAK-estäjähoitoa saaneilla potilailla on raportoitu ei-melanoomatyyppisiä ihosyöpiä (NMSC), pääasiassa tyvisolukarsinoomia. Levityskohdan iho on suositeltavaa tutkia säännöllisesti kaikilla potilailla, etenkin potilailla, joilla on ihosyövän riskitekijöitä.
Apuaineet, joiden vaikutus tunnetaan
Bentsyylialkoholi
Tämä lääkevalmiste sisältää 10 mg bentsyylialkoholia (E 1519) per yksi gramma emulsiovoidetta.
Bentsyylialkoholi saattaa aiheuttaa allergisia reaktioita tai lievää paikallisärsytystä.
Butyylihydroksianisoli
Butyylihydroksianisoli (E 320) saattaa aiheuttaa paikallisia ihoreaktioita (esim. kosketusihottumaa) tai silmä- ja limakalvoärsytystä.
Setostearyylialkoholi
Setostearyylialkoholi saattaa aiheuttaa paikallisia ihoreaktioita (esim. kosketusihottumaa).
Yhteisvaikutukset
Paikallisesti tai systeemisesti annettavalla delgositinibilla ei ole tehty kliinisiä yhteisvaikutustutkimuksia ( in vitro -yhteisvaikutustutkimukset, ks. kohta Farmakokinetiikka). Kun otetaan huomioon, että delgositinibin metabolia on vähäistä, valmistetta levitetään vain pienelle kehon alueelle (käsiin ja ranteisiin) ja paikallisesti annosteltavan delgositinibin systeeminen altistus on hyvin pieni, yhteisvaikutukset systeemisten hoitojen kanssa ovat epätodennäköisiä.
Delgositinibia ei ole arvioitu yhdessä muiden paikallisesti annosteltavien lääkevalmisteiden kanssa, eikä käyttöä samalle ihoalueelle suositella.
Raskaus ja imetys
Raskaus
Delgositinibin käytöstä raskaana oleville naisille ei ole tietoja tai on vain vähän tietoja (alle 300 raskaudesta).
Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoraa tai epäsuoraa haitallista vaikutusta lisääntymistoksisuuden osalta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Varmuuden vuoksi Anzupgo-valmisteen käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Vaikutuksia imetettäviin vauvoihin ei ole odotettavissa, sillä imettävän naisen systeeminen altistus delgositinibille on erittäin pieni (ks. kohta Prekliiniset tiedot turvallisuudesta).
Anzupgo-valmistetta voidaan käyttää imetyksen aikana.
Kun Anzupgo-valmistetta käytetään imetyksen aikana, on varottava, ettei emulsiovoide pääse kosketuksiin nännin tai sitä ympäröivän alueen kanssa käsiin ja/tai ranteisiin levittämisen jälkeen.
Varmuuden vuoksi suoraa ihokosketusta on pyrittävä välttämään, kun imeväisikäistä hoidetaan välittömästi Anzupgo-valmisteen käsiin ja/tai ranteisiin levittämisen jälkeen.
Hedelmällisyys
Tietoja delgositinibin vaikutuksista ihmisten hedelmällisyyteen ei ole saatavilla.
Naarasrotilla tehtyjen löydösten perusteella delgositinibin antaminen suun kautta aiheutti hedelmällisyyden heikentymistä altistuksilla, jotka ylittävät suurimman ihmisille käytettävän annostuksen riittävän suuressa määrin (ks. kohta Prekliiniset tiedot turvallisuudesta).
Eläimillä tehdyissä tutkimuksissa ei ole havaittu urosten hedelmällisyyteen kohdistuvia vaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Anzupgo-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Hoitokohdan reaktiot (1,0 %) olivat yleisimpiä haittavaikutuksia.
Haittavaikutustaulukko
Taulukossa 1 luetellaan kliinisissä tutkimuksissa todetut haittavaikutukset. Haittavaikutukset luetellaan MedDRA-elinjärjestelmäluokan ja yleisyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000).
Taulukko 1 Haittavaikutukset
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Hoitokohdan reaktiot* |
*ks. Valikoitujen haittavaikutusten kuvaus
Valikoitujen haittavaikutusten kuvaus
Hoitokohdan reaktiot
Kolmen yhdistetyn vehikkelikontrolloidun kliinisen tutkimuksen viikolla 16 oli raportoitu 9 hoitokohdan reaktiota (mukaan lukien hoitokohdan kipu, hoitokohdan parestesia, hoitokohdan kutina ja hoitokohdan eryteema) 1,0 %:lla delgositinibiemulsiovoidetta käyttäneistä potilaista. Hoitokohdan reaktioista 8 oli vakavuudeltaan lieviä ja yksi keskivaikea. Seitsemän reaktiota yhdeksästä ilmeni ensimmäisen hoitoviikon aikana. Yksikään hoitokohdan reaktio ei johtanut hoidon keskeyttämiseen, ja oireiden häviämisen mediaani oli 3 vuorokautta.
Pitkäkestoisessa jatkotutkimuksessa hoitokohdan reaktioiden esiintyvyys (0,56 tapahtumaa 100 potilasvuotta kohti) oli pienempi kuin 16 viikkoa kestäneissä vehikkelikontrolloiduissa kliinisissä tutkimuksissa (4,11 tapahtumaa 100 potilasvuotta kohti).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Systeemisiä yliannostuksen merkkejä ei ole odotettavissa Anzupgo-valmisteen paikalliskäytön yhteydessä, koska delgositinibin systeeminen imeytyminen on hyvin vähäistä. Jos emulsiovoidetta on levitetty liikaa, ylimäärän voi pyyhkiä pois.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut ihotautien lääkkeet, ihottumalääkkeet, lukuun ottamatta kortikosteroideja, ATC-koodi: D11AH11
Vaikutusmekanismi
Delgositinibi on kaikkien januskinaasien (JAK) estäjä, jonka vaikutus kohdistuu kaikkien neljän JAK‑entsyymiperheen jäsenen (JAK1, JAK2, JAK3 ja tyrosiinikinaasi 2 [TYK2]) toimintaan pitoisuudesta riippuvalla tavalla.
Ihmisen soluissa delgositinibin JAK-STAT-reittiin kohdistuva estovaikutus vaimentaa useiden proinflammatoristen sytokiinien (mukaan lukien interleukiini 2 [IL-2], IL-4, IL-6, IL-13, IL‑21, IL‑23, granulosyytti-makrofagikasvutekijä [GM-CSF] ja alfainterferoni [IFN-α]) signaalinvälitystä ja vähentää siten immuuni- ja tulehdusvasteita kroonisen käsiekseeman kannalta merkityksellisissä soluissa.
Farmakodynaamiset vaikutukset
Terveillä henkilöillä tehdyssä perusteellisessa QT tutkimuksessa delgositinibilla ei havaittu merkkejä QTc aikaa pidentävästä vaikutuksesta, kun suun kautta annettu kerta-annos oli enintään 12 mg (Cmax‑arvon perusteella noin 200 kertainen altistus verrattuna ihmisen altistukseen paikallisen annostelun jälkeen). Näin ollen Anzupgo-valmisteen ei odoteta vaikuttavan sydämen repolarisaatioon kliinisissä käyttöolosuhteissa.
Ihon turvallisuustutkimukset
Terveillä vapaaehtoisilla tehdyissä kliinisissä tutkimuksissa osoitettiin, että delgositinibiemulsiovoide ei aiheuttanut fototoksisia tai fotoallergisia ihoreaktioita.
Kliininen teho ja turvallisuus
Delgositinibiemulsiovoiteen turvallisuutta ja tehoa arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa, vehikkelikontrolloidussa avaintutkimuksessa, joiden tutkimusasetelmat olivat samankaltaiset (DELTA 1 ja DELTA 2). Krooninen käsiekseema määriteltiin käsiekseemaksi, joka on kestänyt yli 3 kuukautta tai uusiutunut vähintään kahdesti viimeisten 12 kuukauden aikana. Tutkimuksiin osallistui 960 potilasta, jotka olivat vähintään 18-vuotiaita ja joilla oli keskivaikea tai vaikea krooninen käsiekseema. Tämä määriteltiin pisteeksi 3 tai 4 (keskivaikea tai vaikea) Investigator’s Global Assessment for chronic hand eczema (IGA-CHE) -määrityksessä (ks. taulukko 2) ja edellytti käden ekseeman oirepäiväkirjan (Hand Eczema Symptom Diary, HESD) kutinapistearvoa ≥ 4 lähtötilanteessa. Tutkimukseen soveltuvien potilaiden vaste aiemmille paikallisesti annosteltaville kortikosteroideille oli ollut riittämätön, tai paikallisesti annosteltavien kortikosteroidien käyttö ei ollut suositeltavaa (esim. merkittävien haittavaikutusten tai turvallisuusriskien takia).
Taulukko 2 Investigator’s Global Assessment for chronic hand eczema (IGA-CHE)
| IGA-CHE-vaikeusaste | IGA-CHE pisteet | Sairauden merkki ja sen voimakkuus |
| Ei merkkejä | 0 | Ei jälkiä eryteemasta, hilseilystä, hyperkeratoosista/jäkälöitymisestä, vesirakkuloiden muodostumisesta, ödeemasta tai halkeamista |
| Lähes ilman merkkejä | 1 | Vaivoin erottuva eryteema Ei jälkiä eryteemasta, hilseilystä, hyperkeratoosista/jäkälöitymisestä, vesirakkuloiden muodostumisesta, ödeemasta tai halkeamista |
| Lievä | 2 | Ainakin yksi seuraavista:
ja ainakin yksi seuraavista:
|
| Keskivaikea | 3 | Ainakin yksi seuraavista:
ja ainakin yksi seuraavista:
|
| Vaikea | 4 | Ainakin yksi seuraavista:
ja ainakin yksi seuraavista:
|
DELTA 1- ja DELTA 2 -tutkimuksissa potilaat käyttivät joko delgositinibi 20 mg/g emulsiovoidetta tai vehikkeliemulsiovoidetta, jota levitettiin käsien ja ranteiden hoidettaville alueille kahdesti vuorokaudessa 16 viikon ajan. Kaikki potilaat, jotka suorittivat nämä kaksi avaintutkimusta loppuun, saivat osallistua pitkäkestoiseen DELTA 3 -jatkotutkimukseen.
Päätetapahtumat
DELTA 1- ja DELTA 2 -tutkimuksissa ensisijainen päätetapahtuma oli niiden potilaiden osuus, joiden hoito onnistui IGA-CHE-arvioinnin perusteella (IGA‑CHE TS) eli joiden IGA‑CHE-piste oli 0 (ei merkkejä) tai 1 (lähes ilman merkkejä: vain vaivoin erottuva eryteema) ja joiden tila oli parantunut vähintään 2 asteella lähtötilanteesta viikolla 16. IGA-CHE-määrityksessä sairauden yleinen vaikeusaste arvioidaan 5-pisteisellä asteikolla 0:sta (ei merkkejä) 4:ään (vaikea).
Muita tehon tulosmuuttujia olivat käsiekseeman vaikeusasteindeksi ( Hand Exczema Severity Index, HECSI) ja HESD eri ajankohtina. HECSI-asteikolla arvioidaan kuuden kliinisen merkin (eryteema, infiltraatio/papulaatio, rakkulat, halkeamat, hilseily ja ödeema) vaikeusastetta ja ihomuutosten laajuutta kullakin viidellä käden alueella (sormenpäät, sormet, kämmenet, kädenselät ja ranteet). HESD on päivittäin tehtävä 6‑kohtainen potilaan raportoimien tulosten ( patient-reported outcome, PRO) kysely, joka on suunniteltu kroonisen käsiekseeman merkkien ja oireiden (kutina, kipu, halkeilu, punoitus, kuivuus ja hilseily) pahimman vaikeusasteen arviointiin 11-pisteisellä numeerisella arviointiasteikolla.
Ominaisuudet lähtötilanteessa
DELTA 1- ja DELTA 2 -tutkimusten kaikissa hoitoryhmissä potilaiden keskimääräinen ikä oli 44,1 vuotta, 7,6 % potilaista oli vähintään 65-vuotiaita, 64,4 % oli naisia, 90,4 % oli valkoihoisia, 3,5 % oli aasialaisia ja 0,7 % oli tummaihoisia. Kroonisen käsiekseeman yleisyydet alatyypin mukaan olivat atooppinen käden ekseema 35,9 %, hyperkeratoottinen ekseema 21,5 %, ärsytyskosketusihottuma 19,6 %, allerginen kosketusihottuma 13,9 %, rakkulainen käsiekseema (pomfolyx) 9,1 %, ja kosketusurtikaria/proteiinikosketusihottuma 0,1 %. DELTA 1 ja DELTA 2 -tutkimuksissa lähtötilanteen IGA‑CHE-piste oli 71,6 %:lla potilaista 3 (keskivaikea krooninen käsiekseema) ja 28,4 %:lla potilaista 4 (vaikea krooninen käsiekseema). Lähtötilanteessa ihosairauksiin liittyvän elämänlaatuindeksin (Dermatology Life Quality Index, DLQI) pistearvo oli keskimäärin 12,5, HECSI-pistearvo oli 71,6 ja HESD-pistearvo oli 7,1. HESD-kyselyn keskimääräiset kutinapisteet olivat 7,1 ja kipupisteet 6,7.
Kliininen vaste
DELTA 1 ja DELTA 2
DELTA 1- ja DELTA 2 -tutkimuksissa tilastollisesti merkitsevästi suurempi osa delgositinibiemulsiovoidetta saamaan satunnaistetuista potilaista saavutti ensisijaisen päätetapahtuman (IGA‑CHE TS) verrattuna vehikkeliä saaneisiin potilaisiin viikolla 16. Ensisijaista päätetapahtumaa ja oleellisimpia multiplisiteetin suhteen kontrolloituja toissijaisia päätetapahtumia koskevat tulokset esitetään taulukossa 3. Kuvassa 1 esitetään niiden potilaiden osuudet, jotka saavuttivat ≥ 4 pisteen paraneman HESD:n kutinapisteissä ja ≥ 4 pisteen paraneman HESD:n kipupisteissä ajan mittaan DELTA 1- ja DELTA 2 -tutkimuksissa.
Taulukko 3 Delgositinibiemulsiovoiteen tehoa koskevat tulokset viikolla 16 DELTA 1- ja DELTA 2 ‑tutkimuksissa
| DELTA 1 | DELTA 2 | |||
Delgositinibi (N = 325) | Vehikkeli (N = 162) | Delgositinibi (N = 313) | Vehikkeli (N = 159) | |
| IGA-CHE TS, vasteen saavuttaneet (%)a | 19,7# | 9,9 | 29,1§ | 6,9 |
| HECSI-90, vasteen saavuttaneet (%)a, b | 29,5§ | 12,3 | 31,0§ | 8,8 |
| HECSI-75, vasteen saavuttaneet (%)a, c | 49,2§ | 23,5 | 49,5§ | 18,2 |
| HECSI, LS-keskiarvon (%) muutos lähtötilanteesta (± SE)d | -56,5§ (± 3,4) | -21,2 (± 4,8) | -58,9§ (± 3,2) | -13,4 (± 4,5) |
| ≥ 4 pisteen paranema HESD:n kutinapisteissä, vasteen saavuttaneet (%)a, e | 47,1§ (152/323) | 23,0 (37/161) | 47,2§ (146/309) | 19,9 (31/156) |
| ≥ 4 pisteen paranema HESD:n kipupisteissä, vasteen saavuttaneet (%)a, e | 49,1§ (143/291) | 27,5 (41/149) | 48,6§ (143/294) | 22,7 (32/141) |
| ≥ 4 pisteen paranema HESD:n pisteissä, vasteen saavuttaneet (%)a, e | 47,2§ (146/309) | 24,4 (38/156) | 44,5§ (137/308) | 20,9 (32/153) |
#p < 0,01, §p < 0,001
Kaikki p-arvot olivat tilastollisesti merkitseviä vehikkeliin verrattuna, kun ne korjattiin multiplisiteetin suhteen.
Lyhenteet: LS = pienin neliösumma; N = potilaiden lukumäärä koko analysoitavassa joukossa (kaikki satunnaistetut ja annoksen saaneet potilaat); SE = keskivirhe
a. Varahoidon aloittamisen jälkeen kertyneet tiedot, hoidon pysyvä lopettaminen tai puuttuvat tiedot tulkittiin vasteen puuttumiseksi ( non-response).
b. HECSI-90-vasteen saavuttaneet olivat potilaita, joiden HECSI-pistearvo parani ≥ 90 % lähtötilanteesta.
b. HECSI-75-vasteen saavuttaneet olivat potilaita, joiden HECSI-pistearvo parani ≥ 75 % lähtötilanteesta.
d. Varahoidon aloittamisen tai hoidon pysyvän lopettamisen jälkeen kertyneet tiedot tai puuttuvat tiedot tulkittiin vasteen puuttumiseksi ( non-response) käyttäen huonointa käytettävissä olevaa havaintoa ( worst observation carried forward).
e. Perustuu niiden potilaiden lukumäärään, joiden lähtöarvo oli ≥ 4 (asteikolla 0–10).
Sekä DELTA 1- että DELTA 2 -tutkimuksessa tilastollisesti merkitsevästi suurempi osa delgositinibiemulsiovoiteella hoidetuista potilaista saavutti IGA‑CHE TS -vasteen ja ≥ 4 pisteen paraneman HESD-pistearvossa jo viikolla 4 verrattuna vehikkeliin. Tilastollisesti merkitsevästi suurempi osuus delgositinibiemulsiovoiteella hoidetuista potilaista saavutti HECSI-75-vasteen viikolla 8 verrattuna vehikkeliin.
Kuva 1 Niiden potilaiden osuudet, jotka saavuttivat ≥ 4 pisteen paraneman HESD:n kutinapisteissä ja ≥ 4 pisteen paraneman HESD:n kipupisteissä ajan mittaan – DELTA 1- ja DELTA 2 -tutkimusten yhdistetyt tiedot
| ≥ 4 pisteen paranema HESD:n kutinapisteissäa | ≥ 4 pisteen paranema HESD:n kipupisteissäa | ||||||
| Vasteen saavuttaneet (%) (95 % CI) | 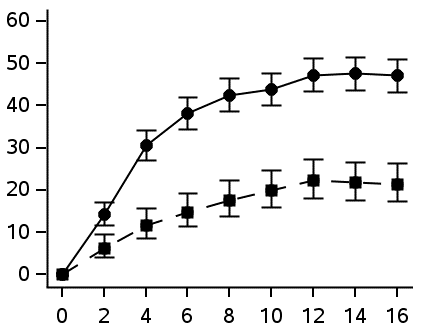 | Vasteen saavuttaneet (%) (95 % CI) | 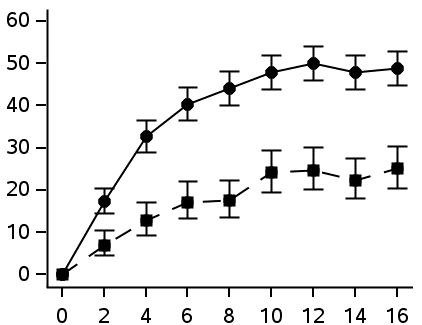 | ||||
| Viikko | Viikko | ||||||
| Delgositinibi 20 mg/g (N = 632) | Delgositinibi 20 mg/g (N = 585) | ||||||
| Vehikkeli (N = 317) | Vehikkeli (N = 290) | ||||||
CI = luottamusväli
a. Perustuu niiden potilaiden lukumäärään, joiden lähtöarvo oli ≥ 4 (asteikolla 0–10).
Muut elämänlaatutulokset / potilaiden raportoimat tulokset
Sekä DELTA 1- että DELTA 2 -tutkimuksessa delgositinibiemulsiovoiteella hoidetuilla potilailla todettiin lähtötilanteen ja viikon 16 välisenä aikana tilastollisesti merkitsevästi suurempia parannuksia käsiekseeman vaikutusasteikon ( Hand Eczema Impact Scale, HEIS) (ks. taulukko 4) pisteissä vehikkeliin verrattuna. HEIS-asteikolla arvioidaan, miten potilas kokee sairauden vaikuttavan päivittäisiin toimiinsa (saippuoiden/puhdistusaineiden käyttö, kotityöt, joissa kädet kastuvat, peseytyminen, kiusaantuneisuus, turhautuminen, uni, työ ja kyky pidellä esineitä tai tarttua niihin). Yhdeksän kohtaa arvioidaan 5-pisteisellä asteikolla, jolla 0 = ei lainkaan ja 4 = erittäin paljon. HEIS-pistearvo lasketaan 9 kohdan pistekeskiarvona.
DELTA 1- ja DELTA 2 -tutkimuksissa delgositinibia saaneilla potilailla todettiin viikolla 16 tilastollisesti merkitsevästi suurempia parannuksia DLQI-asteikolla mitatussa terveyteen liittyvässä elämänlaadussa vehikkeliin verrattuna (ks. taulukko 4).
Taulukko 4 Delgositinibiemulsiovoiteella saavutetut elämänlaatutulokset / potilaiden raportoimat tulokset viikolla 16 DELTA 1- ja DELTA 2 -tutkimuksissa
| DELTA 1 | DELTA 2 | |||
Delgositinibi (N = 325) | Vehikkeli (N = 162) | Delgositinibi (N = 313) | Vehikkeli (N = 159) | |
| HEIS, LS-keskiarvon muutos lähtötilanteesta (± SE)a | -1,46§ (± 0,05) | -0,82 (± 0,08) | -1,45§ (± 0,06) | -0,64 (± 0,08) |
| HEIS PDAL, LS-keskiarvon muutos lähtötilanteesta (± SE)a, b | -1,46§ (± 0,06) | -0,86 (± 0,08) | -1,48§ (± 0,06) | -0,66 (± 0,08) |
| ≥ 4 pisteen paranema DLQI-pistearvossa, vasteen saavuttaneet (%)c, d | 74,4§ (227/305) | 50,0 (74/148) | 72,2§ (216/299) | 45,8 (70/153) |
§p < 0,001
Kaikki p-arvot olivat tilastollisesti merkitseviä vehikkeliin verrattuna, kun ne korjattiin multiplisiteetin suhteen.
Lyhenteet: LS = pienin neliösumma; N = potilaiden lukumäärä koko analysoitavassa joukossa (kaikki satunnaistetut ja annoksen saaneet potilaat); PDAL = proksimaaliset päivittäisen aktiivisuuden rajoitukset; SE = keskivirhe
a. Varahoidon aloittamisen tai hoidon pysyvän lopettamisen jälkeen kertyneet tiedot tai puuttuvat tiedot tulkittiin vasteen puuttumiseksi käyttäen huonointa käyttävissä olevaa havaintoa ( worst observation carried forward).
b. HEIS PDAL -asteikolla arvioidaan potilaan kykyä käyttää saippuoita/puhdistusaineita, tehdä kotitöitä ja peseytyä. HEIS PDAL -pistearvo lasketaan 3 kohdan pistekeskiarvona.
c. Varahoidon aloittamisen jälkeisen tiedot, hoidon pysyvä lopettaminen tai puuttuvat tiedot tulkittiin vasteen puuttumiseksi ( non-response).
d. Perustuu niiden potilaiden lukumäärään, joiden lähtöarvo oli ≥ 4.
Jatkotutkimus (DELTA 3)
Potilaat, jotka suorittivat loppuun joko DELTA 1 -tutkimuksen tai DELTA 2 -tutkimuksen, saivat osallistua 36 viikkoa kestävään avoimeen jatkotutkimukseen (DELTA 3). DELTA 3 -tutkimuksessa tarpeen mukaan käytettävän delgositinibihoidon pitkäaikaisturvallisuutta ja -tehoa arvioitiin 801 potilaalla. Potilaat aloittivat delgositinibiemulsiovoiteen levittämisen hoitoalueille kahdesti vuorokaudessa, kun heidän IGA-CHE-pisteensä oli ≥ 2 (lievä tai pahempi), ja lopettivat hoidon, kun he olivat saavuttaneet IGA-CHE-pisteen 0 tai 1 (ei merkkejä tai lähes ilman merkkejä). Potilaat, joiden IGA‑CHE-piste oli DELTA 3 -tutkimuksen alussa 0 tai 1, eivät aloittaneet hoitoa ennen kuin vaste menetettiin (IGA-CHE-piste ≥ 2).
Niiden potilaiden osuudet, jotka saavuttivat IGA-CHE-pisteen 0 tai 1, HECSI‑75-vasteen, HECSI‑90-vasteen, ≥ 4 pisteen paraneman HESD-kutinapisteissä ja ≥ 4 pisteen paraneman HESD-kipupisteissä ensimmäisen 16 viikkoa kestäneen delgositinibiemulsiovoiteella toteutetun hoitovaiheen jälkeen, pysyivät samoina viikolle 52 asti tarpeen mukaan annettavalla hoidolla. Avaintutkimuksissa (DELTA 1 ja DELTA 2) delgositinibiemulsiovoidetta käyttämään satunnaistetuilla 560 potilaalla, jotka osallistuivat DELTA 3 -tutkimukseen, oli keskimäärin 1,5 (vaihteluväli 0–6) hoitojaksoa. Hoitojakson keskimääräinen kesto oli 123 vuorokautta ja hoitovastepäivien (päivät, jolloin IGA‑CHE-piste oli 36 viikkoa kestäneen hoitovaiheen aikana 0 tai 1) keskimääräinen kumulatiivinen lukumäärä oli 46. Hoitovastepäivien keskimääräinen kumulatiivinen lukumäärä oli 111 potilailla, jotka saavuttivat IGA-CHE TS -vasteen avaintutkimusten viikolla 16.
Avaintutkimuksissa delgositinibiemulsiovoidetta käyttämään satunnaistetuilla potilailla, jotka saavuttivat IGA-CHE TS -vasteen viikolla 16, vasteen mediaanikesto ilman hoitoa oli 4 viikkoa, ja 28,3 %:lla vaste säilyi vähintään 8 viikon ajan. IGA-CHE-pisteen 0 tai 1 saavuttamiseen kulunut mediaaniaika hoidon uudelleenaloittamisen jälkeen oli 8 viikkoa. Potilaista, jotka eivät saavuttaneet avaintutkimuksissa IGA-CHE TS -vastetta delgositinibihoidon viikolla 16, 48,1 % saavutti IGA‑CHE-pisteen 0 tai 1, kun delgositinibihoitoa jatkettiin DELTA 3 -tutkimuksessa.
Vaiheen 3 tutkimus aktiivisesta vertailuvalmisteesta verrattuna alitretinoiiniin (DELTA FORCE)
Delgositinibiemulsiovoiteen tehoa ja turvallisuutta verrattuna alitretinoiiniin arvioitiin satunnaistetussa, arvioijasokkoutetussa 24 viikon tutkimuksessa, johon osallistui 513 vähintään 18-vuotiasta potilasta, joilla oli vaikea CHE eli IGA-CHE-pisteet 4. Tutkimukseen soveltuvilla potilailla oli aiemmin ollut riittämätön vaste topikaalisiin kortikosteroideihin tai heille ei suositeltu topikaalisia kortikosteroideja. Potilaat satunnaistettiin käyttämään joko 20 mg/g:n delgositinibiemulsiovoidetta kaksi kertaa vuorokaudessa 16 viikon ajan tai 30 mg:n alitretinoiinikapseleita kerran vuorokaudessa (vaihtoehtona oli pienentää annos 10 mg:aan kerran vuorokaudessa) 12 viikon ajan. Hoitoa voitiin jatkaa enintään 24 viikkoa. Hoidon pysyvä lopettaminen (35,9 % alitretinoiiniryhmässä vs. 13,4 % delgositinibiryhmässä) ja varalääkityksen käyttö (8,1 % alitretinoiiniryhmässä vs. 4,7 % delgositinibiryhmässä) oli yleisempää alitretinoiinilla hoidetuilla potilailla kuin delgositinibilla hoidetuilla potilailla.
Ensisijaisessa päätetapahtumassa, eli HECSI-pisteiden muutoksessa lähtötilanteesta viikolle 12, saavutettiin tilastollisesti merkitsevästi suurempia parannuksia delgositinibiemulsiovoiteella verrattuna alitretinoiiniin. Delgositinibiemulsiovoiteella saavutettin myös tilastollisesti merkitsevästi suurempia parannuksia HECSI-90- ja IGA-CHE TS-pisteiden osalta. Ensisijaisen ja oleellisimpien toissijaisten päätetapahtumien tulokset on esitetty taulukossa 5.
Taulukko 5 DELTA FORCE ‑tutkimuksen – delgositinibiemulsiovoide vs. alitretinoiini – tehotulokset viikolla 12
| DELTA FORCE | ||
Delgositinibi (N = 250) | Alitretinoiini (N = 253) | |
| HECSI, LS:n keskimääräinen muutos lähtötilanteesta (± SE)a | –67,6§ (± 3,37) | –51,5 (± 3,36) |
| HECSI‑90, % vasteen saaneistab, c | 38,6# (96/249) | 26,0 (65/250) |
| HECSI‑75, % vasteen saaneistab, d, e | 55,4* (138/249) | 46,0 (115/250) |
| IGA‑CHE TS, % vasteen saaneistab | 27,2# | 16,6 |
*p < 0,05, #p < 0,01, §p < 0,001 Kaikki p-arvot olivat tilastollisesti merkitseviä alitretinoiiniin verrattuna, kun ne korjattiin multiplisiteetin suhteen, paitsi HECSI‑75 % ‑vasteen saaneista, mikä ei ollut multiplisiteetin suhteen korjattu päätetapahtuma. Lyhenteet: LS = pienin neliösumma; N = potilaiden lukumäärä koko analysoitavassa joukossa; SE = keskivirhe a. Varahoidon aloittamisen tai hoidon pysyvän lopettamisen jälkeen kertyneet tiedot tai puuttuvat tiedot tulkittiin vasteen puuttumiseksi käyttäen huonointa käyttävissä olevaa havaintoa (worst observation carried forward). b. Varahoidon aloittamisen tai hoidon pysyvän lopettamisen jälkeen kertyneet tiedot tai puuttuvat tiedot tulkittiin vasteen puuttumiseksi. c. HECSI-90-vasteen saavuttaneet olivat potilaita, joiden HECSI-pistearvo parani ≥ 90 % lähtötilanteesta. d. HECSI-75-vasteen saavuttaneet olivat potilaita, joiden HECSI-pistearvo parani ≥ 75 % lähtötilanteesta. e. HECSI-75 % ‑vasteen saavuttaneet eivät olleet multiplisiteetin suhteen korjattu päätetapahtuma. Delgositinibiemulsiovoiteella havaittiin suurempia parannuksia, mitattuna HECSI-pisteiden keskimääräisellä muutoksella, viikolla 1, ja ne säilyivät viikolle 24 asti. | ||
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset delgositinibin käytöstä kroonisen käsiekseeman hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Delgositinibiemulsiovoiteen farmakokinetiikkaa arvioitiin tutkimuksessa, johon osallistui 15 iältään 22–69-vuotiasta potilasta, joilla oli keskivaikea tai vaikea krooninen käsiekseema. Potilaat levittivät keskimäärin 0,87 g delgositinibi 20 mg/g -emulsiovoidetta käsien ja ranteiden hoidettaville alueille kahdesti vuorokaudessa 8 vuorokauden ajan.
Plasman enimmäispitoisuuden (Cmax) ja pitoisuuskäyrän alapuolisen alueen (0–12 tunnin ajanjaksolla) (AUC0-12) geometriset keskiarvot (GSD) päivänä 8 olivat 0,46 ng/ml (1,74) ja vastaavasti 3,7 ng*h/ml (1,74). Vakaa tila saavutettiin päivään 8 mennessä. Systeeminen altistus (AUC ja Cmax) oli samankaltainen päivänä 1 ja päivänä 8.
Kun delgositinibi 20 mg/g -emulsiovoidetta annosteltiin kahdesti vuorokaudessa DELTA 2 ‑tutkimuksessa, 2–6 tuntia annostelun jälkeen päivänä 113 todettu plasman lääkeainepitoisuuden geometrinen keskiarvo oli 48 % pienempi kuin päivänä 8 (0,11 mg/ml ja vastaavasti 0,21 ng/ml).
Delgositinibin suhteellinen biologinen hyötyosuus paikallisen annostelun jälkeen on noin 0,6 % verrattuna suun kautta otettaviin tabletteihin.
Jakautuminen
In vitro -tutkimuksen perusteella delgositinibi sitoutuu plasman proteiineihin 22–29-prosenttisesti.
Biotransformaatio
Delgositinibi ei metaboloidu suuressa määrin, joten muuttumattomassa muodossa oleva delgositinibi on pääasiallinen plasmassa todettava komponentti. Suun kautta tapahtuvan annon jälkeen havaittiin neljä metaboliittia (oksidaation ja glukuronidikonjugaation kautta muodostuneita), joiden pitoisuudet plasmassa olivat < 2 % muuttumattomassa muodossa olevan delgositinibin keskimääräisestä pitoisuudesta. Delgositinibin rajallinen metabolia tapahtuu pääasiallisesti CYP3A4/5:n ja vähemmässä määrin CYP1A1:n, CYP2C19:n ja CYP2D6:n vaikutuksesta.
In vitro -yhteisvaikutustutkimukset
In vitro -tietojen perusteella delgositinibi ei estä eikä indusoi sytokromi P450 -entsyymejä eikä estä kuljetusjärjestelmiä, kuten orgaanisten anionien kuljettajia (OAT), orgaanisten anionien kuljettajapolypeptidejä (OATP), orgaanisten kationien kuljettajia (OCT), P-glykoproteiinia (P-gp), rintasyövän resistenssiproteiinia (BCRP) tai monilääke- ja toksiiniekstruusioproteiineja (MATE) kliinisesti merkityksellisinä pitoisuuksina.
Delgositinibi on P-glykoproteiinin (P‑gp:n) substraatti ja ihmisen orgaanisten kationien kuljettajaproteiini 2:n (OTC2) ja ihmisen orgaanisten anionien kuljettajaproteiini 3:n (OAT3) heikko substraatti.
Eliminaatio
Delgositinibi eliminoituu pääasiallisesti munuaisteitse, sillä noin 70–80 % suun kautta annetusta kokonaisannoksesta erittyy muuttumattomassa muodossa virtsaan.
Delgositinibiemulsiovoiteen toistuvan paikalliskäytön jälkeen delgositinibin keskimääräisen puoliintumisajan arvioitiin olevan 20,3 tuntia.
Erityisryhmät
Maksan vajaatoiminta
Delgositinibiemulsiovoiteella ei ole tehty muodollisia tutkimuksia maksan vajaatoimintaa sairastavilla potilailla.
Paikallisesti annostellun delgositinibin systeeminen altistus on hyvin vähäistä ja delgositinibin metabolia rajallista, joten maksan toiminnan muutoksilla ei todennäköisesti ole mitään vaikutusta delgositinibin eliminaatioon (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Delgositinibin farmakokineettisiä parametreja analysoitiin DELTA 2 -tutkimuksessa 96 potilaalla, joilla oli lievä tai keskivaikea munuaisten vajaatoiminta (eGFR 30–89 ml/min/1,73 m2). Lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla ei todettu kliinisesti merkityksellisiä farmakokinetiikan eroja verrattuna koko tutkimuspopulaatioon. Paikallisesti annostellun delgositinibin systeeminen altistus on hyvin vähäistä, joten munuaisten vajaatoiminta ei todennäköisesti johda kliinisesti merkittäviin muutoksiin delgositinibin altistuksessa (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, genotoksisuutta, fototoksisuutta, paikallista siedettävyyttä, ihon herkistymistä ja juveniilia toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Haittoja on toistuvan altistuksen aiheuttamaa toksisuutta koskevissa tutkimuksissa todettu vain silloin, kun on käytetty altistusta, joka ylittää paikallishoidossa suurimman ihmisille käytettävän annostuksen riittävän suuressa määrin.
Karsinogeenisuus
Hiirillä tehdyssä, 2 vuoden pituisessa karsinogeenisuustutkimuksessa ei todettu mitään lääkkeeseen liittyviä paikallisia tai systeemisiä neoplastisia vaikutuksia (altistuksilla, jotka olivat AUC-arvon perusteella noin 600‑kertaisia ihmisten altistukseen verrattuna).
Hedelmällisyys ja varhaisvaiheen alkionkehitys
Suun kautta otettu delgositinibi ei vaikuttanut hedelmällisyyteen millään urosrotilla arvioidulla annostasolla (altistukset olivat noin 1 700‑kertaisia ihmisten altistukseen verrattuna). Naarasrotille suun kautta annettu delgositinibi vaikutti naaraiden hedelmällisyyteen (hedelmällisyysindeksin lasku, vähemmän keltarauhasia ja vähemmän implantaatioita), kun altistukset olivat noin 5 800‑kertaisia ihmisten altistukseen verrattuna. Implantaation jälkeisiä alkionmenetyksiä ja elävien alkioiden lukumäärän pienenemistä todettiin altistuksilla, jotka olivat noin 432‑kertaisia ja vastaavasti 1 000‑kertaisia ihmisten altistukseen verrattuna.
Alkion- ja sikiönkehitys
Suun kautta annettu delgositinibi ei aiheuttanut haittavaikutuksia rottien tai kaniinien sikiöille altistuksilla, jotka olivat noin 120‑kertaisia ja vastaavasti 194‑kertaisia ihmisten altistukseen verrattuna. Teratogeenisia vaikutuksia ei todettu millään rotilla tai kaniineilla tutkitulla annoksella (altistukset olivat noin 1 400‑kertaisia ja vastaavasti 992‑kertaisia ihmisten altistukseen verrattuna).
Rotilla todettiin sikiöiden painon pienenemistä ja luustomuutoksia altistuksilla, jotka olivat 512‑kertaisia ihmisten altistukseen verrattuna, ja taipumusta implantaation jälkeisten alkionmenetysten lisääntymiseen altistuksilla, jotka olivat noin 1 400‑kertaisia ihmisten altistukseen verrattuna. Kaniineilla todettiin implantaation jälkeisten alkionmenetysten lisääntymistä, elävien sikiöiden määrän pienenemistä ja taipumusta sikiöiden painon pienenemiseen altistuksilla, jotka olivat noin 992‑kertaisia ihmisten altistukseen verrattuna.
Raskaudenaikaisia vaikutuksia ei ole odotettavissa, sillä systeeminen altistus delgositinibille on erittäin pieni. Varmuuden vuoksi delgositinibin käyttöä on suositeltavaa välttää raskauden aikana (ks. kohta Raskaus ja imetys).
Pre - ja postnataalinen kehitys
Rotilla suun kautta annettu delgositinibi aiheutti sikiöiden elinkelpoisuuden heikentymistä ja poikasten painon pienenemistä varhaisen postnataalisen vaiheen aikana altistuksilla, jotka olivat > 2 000‑kertaisia ihmisten altistukseen verrattuna. Millään tutkitulla annoksella ei ollut vaikutusta jälkeläisten käyttäytymisen ja oppimisen arviointeihin, sukupuoliseen kypsymiseen tai lisääntymiskykyyn.
Suun kautta annettu delgositinibi erittyi imettävien rottien maitoon pitoisuuksina, jotka olivat noin 3‑kertaisia plasman pitoisuuksiin verrattuna.
Vaikutuksia imetettäviin vauvoihin ei ole odotettavissa, sillä imettävän naisen systeeminen altistus delgositinibille on erittäin pieni. Näin ollen delgositinibia voidaan käyttää imetyksen aikana (ks. kohta Raskaus ja imetys).
Farmaseuttiset tiedot
Apuaineet
Bentsyylialkoholi (E 1519)
Butyylihydroksianisoli (E 320)
Setostearyylialkoholi
Sitruunahappomonohydraatti (E 330)
Dinatriumedetaatti
Kloorivetyhappo (E 507) (pH:n säätämiseen)
Nestemäinen parafiini
Makrogolisetostearyylieetteri
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Ensimmäisen avaamisen jälkeen: 1 vuosi
Säilytys
Ei saa jäätyä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ANZUPGO emulsiovoide
20 mg/g (L:ei) 60 g (987,30 €)
PF-selosteen tieto
Laminaattituubi, jossa on alumiinista valmistettu suojakerros ja pientiheyspolyeteenistä valmistettu sisäkerros sekä polypropeenista valmistettu napsautuskorkki.
Pakkauskoot:
- Yksi 15 g:n tai 60 g:n tuubi.
- Monipakkaus, jossa 3 tuubia (kaksi 15 g:n tuubia ja yksi 60 g:n tuubi)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai hieman rusehtava emulsiovoide
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ANZUPGO emulsiovoide
20 mg/g 60 g
- Ei korvausta.
ATC-koodi
D11AH11
Valmisteyhteenvedon muuttamispäivämäärä
23.10.2025
Yhteystiedot
Karhumäentie 3
01530 Vantaa
020 721 8440
www.leo-pharma.fi
info.fi@leo-pharma.com
