ADZYNMA injektiokuiva-aine ja liuotin, liuosta varten 500 IU, 1500 IU
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Terveydenhuollon ammattilainen
Tärkeitä tietoja riskien minimoinnista ADZYNMA®-valmistetta (rekombinantti ADAMTS13 [rADAMTS13]) määrääville lääkäreille
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
ADZYNMA 500 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiokuiva-ainetta sisältävä injektiopullo sisältää nimellisesti 500 kansainvälistä yksikköä (IU) rADAMTS13*-aktiivisuutta voimakkuutena mitattuna.
Kun liuos on saatettu käyttökuntoon 5 ml:lla pakkauksessa toimitettua liuotinta, sen voimakkuus on noin 100 IU/ml.
ADZYNMA 1 500 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiokuiva-ainetta sisältävä injektiopullo sisältää nimellisesti 1 500 IU rADAMTS13*-aktiivisuutta voimakkuutena mitattuna.
Kun liuos on saatettu käyttökuntoon 5 ml:lla pakkauksessa toimitettua liuotinta, sen voimakkuus on noin 300 IU/ml.
* ADZYNMA on puhdistettu bivariantti ihmisen rekombinantti ”disintegriini ja metalloproteinaasi, jossa on trombospondiini 13 ‑rakennekuvioita” (rADAMTS13), joka ekspressoituu kiinanhamsterin munasarjasoluissa (CHO) yhdistelmä-DNA-tekniikan avulla (sekoitus natiivia rADAMTS13 Q23:a ja rADAMTS13 R23 ‑varianttia, joiden suhteen vaihteluväli on kontrolloitu) ja johon viitataan nimellä rADAMTS13.
Täydellinen apuaineluettelo, ks. kohta Apuaineet
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Valkoinen, kylmäkuivattu jauhe.
Liuotin on kirkas ja väritön liuos.
Käyttökuntoon saatetun liuoksen pH on 6,7–7,3 ja osmolaalisuus vähintään 240 mOsmol/kg.
Kliiniset tiedot
Käyttöaiheet
ADZYNMA on entsyymikorvaushoito, joka on tarkoitettu synnynnäistä tromboottista trombosytopeenista purppuraa (cTTP) sairastavien lasten ja aikuisten ADAMTS13-puutoksen hoitoon.
ADZYNMA-valmistetta voidaan käyttää kaikille ikäryhmille.
Ehto
Valmistetta saa antaa vain hematologisia häiriöitä sairastavien potilaiden hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
ADZYNMA-hoito on aloitettava sellaisen lääkärin valvonnassa, jolla on kokemusta hematologisia häiriöitä sairastavien potilaiden hoidosta.
Annostus
Ennaltaehkäisevä entsyymikorvaushoito
- 40 IU/kg joka toinen viikko.
- Estohoidossa antotiheyttä voidaan muuttaa 40 IU:hun/kg kerran viikossa kliinisen vasteen perusteella (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Tarvittaessa annettava akuuttien TTP-kohtausten entsyymikorvaushoito
Akuuttien tromboottisen trombosytopeenisen purppuran (TTP) kohtausten hoitoon suositeltu ADZYNMA-annos on:
- 40 IU/kg päivänä 1.
- 20 IU/kg päivänä 2.
-
15 IU/kg päivästä 3 lähtien kerran vuorokaudessa, kunnes akuutin tapahtuman korjaantumisesta on kulunut kaksi vuorokautta (ks. kohta Farmakodynamiikka).
Erityisryhmät
Iäkkäät
ADZYNMA-valmisteen käytöstä yli 65-vuotiaille potilaille on vain vähän tietoa. Populaatiofarmakokineettisen analyysin tulosten perusteella iäkkäiden potilaiden annosta ei tarvitse muuttaa (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
rADAMTS13 on molekyylipainoltaan suuri rekombinanttiproteiini, joten se ei erity munuaisteitse, eikä munuaisten vajaatoimintaa sairastavien potilaiden annosta tarvitse muuttaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
rADAMTS13 on molekyylipainoltaan suuri rekombinanttiproteiini, joten se poistuu elimistöstä katabolian (eikä maksametabolian) kautta, eikä maksan vajaatoimintaa sairastavien potilaiden annosta tarvitse muuttaa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Kehon painoon perustuva, pediatrisille potilaille suositeltu annostus on sama kuin aikuisilla. Populaatiofarmakokineettisen analyysin tulosten perusteella < 10 kg painavat imeväisikäiset saattavat todennäköisemmin tarvita annostiheyden muuttamista joka toinen viikko tapahtuvasta annosta antoon kerran viikossa (ks. kohta Farmakokinetiikka)
Antotapa
Vain laskimoon, käyttökuntoon saattamisen jälkeen.
ADZYNMA 500 IU ja ADZYNMA 1 500 IU injektiokuiva-aine ja liuotin, liuosta varten, annetaan nopeudella 2–4 ml/min.
Kotihoito tai itselääkitys
Kotihoitoa tai itselääkitystä terveydenhuollon ammattilaisen valvonnassa voidaan harkita potilaille, jotka sietävät injektiot hyvin. Päätös siitä, voiko potilas siirtyä kotihoitoon tai itselääkitykseen, on tehtävä hoitavan lääkärin arvion ja suosituksen pohjalta. Hoitavan lääkärin ja/tai sairaanhoitajan on annettava potilaalle ja/tai omaishoitajalle asianmukaista koulutusta ennen kotihoitoon tai itselääkitykseen siirtymistä. Kotihoidossa annos ja antonopeus on pidettävä muuttumattomina, eikä niitä saa muuttaa keskustelematta asiasta hoitavan lääkärin kanssa. Jos potilaalla esiintyy yliherkkyysreaktion varhaisia merkkejä kotihoidossa, lääkkeen anto on lopetettava välittömästi ja asianmukainen hoito on aloitettava (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Myöhemmät injektiot on annettava hoitopaikassa. Hoitavan lääkärin on seurattava hoitoa tiiviisti.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Henkeä uhkaava yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyysreaktiot
Allergistyyppisiä yliherkkyysreaktioita, anafylaktiset reaktiot mukaan lukien, voi esiintyä. Potilaille on kerrottava yliherkkyysreaktioiden varhaisista merkeistä, joita voivat olla esimerkiksi takykardia, puristava tunne rinnassa, hengityksen vinkuminen ja/tai akuutti hengitysvaikeus, hypotensio, yleistynyt nokkosihottuma, kutina, rinokonjunktiviitti, angioedeema, letargia, pahoinvointi, oksentelu, parestesia ja levottomuus. Tila voi edetä anafylaktiseksi sokiksi. Jos vaikeiden allergisten reaktioiden merkkejä ja oireita ilmenee, tämän lääkevalmisteen anto on lopetettava välittömästi ja potilaalle on annettava asianmukaista tukihoitoa.
Immunogeenisuus
Kuten kaikkien terapeuttisten proteiinien kohdalla, immunogeenisuuden mahdollisuus on olemassa. Potilaille voi muodostua ADZYNMA-hoidon jälkeen rADAMTS13-vasta-aineita, jotka saattavat heikentää vastetta rADAMTS13:lle (ks. kohta Farmakodynamiikka). Jos tällaisten vasta-aineiden muodostumista epäillään, eikä hoito tehoa, on harkittava muita hoitostrategioita.
Natriumpitoisuus
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per millilitra eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Raskaus ja imetys
Raskaus
ADZYNMA-valmisteen käytöstä raskaana oleville naisille ei ole olemassa tietoja tai on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). ADZYNMA-valmisteen käyttöä raskauden aikana voidaan harkita vain perusteellisen yksilöllisen hyöty-riskiarvion jälkeen, jonka hoitava lääkäri tekee ennen hoidon aloittamista ja hoidon aikana.
Imetys
rADAMTS13:n erittymisestä maitoon ihmisillä tai eläimillä ei ole riittävästi tietoa, mutta suuren molekyylipainon takia on epätodennäköistä, että se erittyisi ihmisillä äidinmaitoon. Päätettäessä, lopetetaanko imetys vai lopetetaanko ADZYNMA-hoito, on otettava huomioon tämän lääkevalmisteen tärkeys äidille.
Hedelmällisyys
Ihmisistä peräisin olevia tietoja rADAMTS13:n vaikutuksista miesten ja naisten hedelmällisyyteen ei ole saatavilla. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria tai epäsuoria urosten tai naaraiden hedelmällisyyteen kohdistuvia haittavaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Rekombinantilla ADAMTS13:lla voi olla vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. ADZYNMA-valmisteen annon jälkeen voi esiintyä heitehuimausta ja uneliaisuutta (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimpiä kliinisissä tutkimuksissa raportoituja haittavaikutuksia olivat päänsärky (31,5 %), ripuli (17,8 %), heitehuimaus (16,4 %), ylähengitystieinfektio (15,1 %), pahoinvointi (13,7 %) ja migreeni (11 %).
Haittavaikutustaulukko
Haittavaikutukset on lueteltu taulukossa 1.
Haittavaikutukset on lueteltu alla MedDRA-elinjärjestelmäluokan ja yleisyyden mukaisesti. Yleisyydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin elinjärjestelmäluokassa (SOC) yleisyyden mukaan alenevassa järjestyksessä. Haittavaikutukset on esitetty kussakin yleisyysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: ADZYNMA-hoitoa saaneilla potilailla raportoidut haittavaikutukset
MedDRA-elinjärjestelmäluokka (SOC) | Haittavaikutukset suositeltujen termien mukaisesti | Yleisyysluokitus alueen mukaisesti |
| Infektiot | Ylähengitystieinfektio | Hyvin yleinen |
| Veri ja imukudos | Trombosytoosi | Yleinen |
| Hermosto | Päänsärky | Hyvin yleinen |
| Heitehuimaus | Hyvin yleinen | |
| Migreeni | Hyvin yleinen | |
| Uneliaisuus | Yleinen | |
| Ruoansulatuselimistö | Ripuli | Hyvin yleinen |
| Pahoinvointi | Hyvin yleinen | |
| Ummetus | Yleinen | |
| Vatsan turvotus | Yleinen | |
| Yleisoireet ja antopaikassa todettavat haitat | Heikkous | Yleinen |
| Kuumuuden tunne | Yleinen | |
| Tutkimukset | Poikkeava ADAMTS13-aktiivisuus | Yleinen |
Pediatriset potilaat
ADZYNMA-valmisteella tehdyistä kontrolloiduista tutkimuksista on saatu vain vähän tietoa pediatrisista potilaista. Pediatrisia potilaita koskeva turvallisuusarviointi perustuu tietoihin, jotka on saatu yhdestä vaiheen 3 kliinisestä tutkimuksesta, jossa ADZYNMA-hoitoa verrattiin plasmapohjaisiin hoitoihin (tutkijan määräämä jääplasma, poolattu liuottimella/pesuaineella [S/D] käsitelty plasma tai tekijä VIII:von Willebrandin tekijä [FVIII‑VWF] -konsentraatit), sekä yhdestä vaiheen 3b tutkimuksesta. Tutkimuksissa oli mukana 2–17-vuotiaita pediatrisia potilaita, joista 20 osallistui ennaltaehkäisevän hoidon kohorttiin ja yksi tarvittaessa annettavan hoidon kohorttiin. Yleisesti ottaen näiden pediatristen potilaiden turvallisuusprofiili oli samankaltainen kuin aikuisilla potilailla.
Yhdelle 36 tunnin ikäiselle vastasyntyneelle annettiin ADZYNMA-hoitoa erityisluvalla, eikä hänellä raportoitu mitään turvallisuuteen tai immunogeenisuuteen liittyviä ongelmia 2 vuotta kestäneen estohoidon jälkeen.
Lapsilla esiintyvien haittavaikutusten yleisyyden, tyypin ja vaikeusasteen odotetaan olevan samoja kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa käytettiin enintään 160 IU:n/kg kerta-annoksia, ja niiden turvallisuusprofiili vastasi yleisesti ottaen cTTP-potilailla tehdyistä kliinisistä tutkimuksista saatuja tuloksia.
Yliannostustapauksessa verenvuodon riski voi suurentua rADAMTS13:n farmakologisen vaikutuksen takia (ks. kohta Farmakodynamiikka).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antitromboottiset lääkeaineet, entsyymit, ATC-koodi: B01AD13
Vaikutusmekanismi
rADAMTS13 on endogeenisen ADAMTS13:n rekombinantti muoto. ADAMTS13 on plasman sinkkimetalloproteaasi, joka säätelee von Willebrandin tekijän (VWF) aktiivisuutta pilkkomalla suuret ja erittäin suuret VWF-multimeerit pienemmiksi yksiköiksi ja vähentämällä siten VWF:n kykyä sitoutua verihiutaleisiin ja sen taipumusta muodostaa mikrotrombooseja. rADAMTS13 oletettavasti vähentää tai estää VWF:n ja verihiutaleiden muodostamien mikrotromboosien spontaania muodostumista, joka kuluttaa verihiutaleita ja aiheuttaa trombosytopeniaa cTTP-potilailla.
Farmakodynaamiset vaikutukset
Immunogeenisuus
Lääkevasta-aineita (ADA) havaittiin hyvin yleisesti. Näyttöä lääkevasta‑aineiden vaikutuksesta farmakokinetiikkaan, tehoon tai turvallisuuteen ei todettu, mutta tietoja on edelleen niukasti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliininen teho ja turvallisuus
Kliinistä tehoa ja turvallisuutta arvioitiin kahdessa käynnissä olevassa tutkimuksessa (tutkimus 281102 ja tutkimus 3002).
Tutkimus 281102
ADZYNMA-valmistetta tutkittiin maailmanlaajuisessa vaiheen 3 prospektiivisessa, satunnaistetussa, kontrolloidussa, avoimessa, kaksivaiheisessa, vaihtovuoroisessa monikeskustutkimuksessa, jota seurasi yhdellä hoitoryhmällä toteutettu jatkovaihe (tutkimus 281102). Tutkimuksessa arvioitiin ennaltaehkäisevästi ja tarvittaessa annettavan ADZYNMA-entsyymikorvaushoidon tehoa ja turvallisuutta verrattuna plasmapohjaisiin hoitoihin potilailla, joilla oli vaikea cTTP (ADAMTS13-aktiivisuus < 10 %).
Ennaltaehkäisevä entsyymikorvaushoito cTTP-potilailla
ADZYNMA-estohoidon tehoa cTTP-potilailla arvioitiin estohoitokohortin 46 potilaalla, jotka satunnaistettiin saamaan 6 kuukauden ajan estohoitona joko ADZYNMA-annosta 40 IU/kg (± 4 IU/kg) tai plasmapohjaisia hoitoja (jakso 1) kerran viikossa (potilaat, jotka olivat jo saaneet plasmapohjaisia hoitoja kerran viikossa ennen tutkimukseen osallistumista) tai joka toinen viikko. Tämän jälkeen potilaat siirrettiin toiseen hoitoon 6 kuukauden ajaksi (jakso 2). Jaksojen 1 ja 2 jälkeen kaikki potilaat siirtyivät yhdellä hoitoryhmällä toteutettuun 6 kuukauden pituiseen hoitojaksoon, jossa he saivat ADZYNMA-valmistetta (jakso 3). ADZYNMA-estohoidon antotiheys oli aluksi joka toinen viikko 35 (76,1 %) potilaalle ja kerran viikossa 9 (19,6 %) potilaalle.
Keskimääräinen (keskihajonta) ikä oli 30,5 (16,0) vuotta (vaihteluväli: 3–58 vuotta). 46 potilaasta 4 (8,7 %) oli < 6-vuotiaita, 4 (8,7 %) oli ≥ 6 – < 12-vuotiaita, 4 (8,7 %) oli ≥ 12 – < 18-vuotiaita ja 34 (73,9 %) oli ≥ 18-vuotiaita. Keskimääräinen (keskihajonta) paino oli 65,9 kg (21,8) (vaihteluväli: 18,5–102,4 kg), suurin osa potilaista oli valkoihoisia (65,2 %) ja naispuolisia (58,7 %), ja heistä 74,1 % oli naisia, jotka voivat tulla raskaaksi.
Ennen tutkimukseen osallistumista suurin osa (69,6 %) potilaista sai jääplasmaa, 21,7 % sai liuottimella/pesuaineella (S/D) käsiteltyä plasmaa ja 6,5 % sai FVIII-VWF-konsentraattia.
ADZYNMA-estohoidon tehoa cTTP-potilailla arvioitiin seuraavien perusteella: akuuttien TTP-tapahtumien ilmaantuvuus (joka määriteltiin trombosyyttiarvon laskuksi [≥ 50 % lähtöarvosta tai trombosyyttiarvo < 100 x 109/l] ja laktaattidehydrogenaasiarvon [LDH] nousuksi [> 2 × lähtöarvo tai > 2 × viitealueen yläraja (ULN)]); subakuutit TTP-tapahtumat (jotka määriteltiin trombosytopeniatapahtumaksi tai mikroangiopaattiseksi hemolyyttiseksi anemiatapahtumaksi; ja elinkohtaiset oireet ja löydökset, joita olivat esimerkiksi munuaisten toimintahäiriötapahtumat, neurologisten oireiden tapahtumat, kuume, väsymys/letargia ja/tai vatsakipu), sekä TTP:n ilmentymät (kuten trombosytopenia, mikroangiopaattinen hemolyyttinen anemia, neurologiset oireet, munuaisten toimintahäiriö ja vatsakipu); sekä subakuuttien TTP-tapahtumien edellyttämien lisäannosten ilmaantuvuus (ks. taulukko 2).
Taulukko 2: Tehotulokset estohoitokohortin cTTP-potilailla (jaksot 1 ja 2)
ADZYNMA N = 45 | Plasmapohjaiset hoidot N = 46 | |
| Akuutit TTP-tapahtumat | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 0 (0) | 1 (1) |
| Subakuutit TTP-tapahtumat | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 1 (1) | 6 (7) |
| Tutkittavat, jotka saivat lisäannoksen subakuutin tapahtuman takia | 0 | 4 |
| Subakuutin tapahtuman edellyttämien lisäannosten lukumäärä | 0 | 9 |
| TTP:n ilmentymät | ||
| Trombosytopeniatapahtumata | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 13 (49) | 23 (91) |
| Malliin perustuva tapahtumien vuosittainen määrä,b LSM (SE) | 0,92 (0,262) | 1,72 (0,457) |
| Mikroangiopaattiset hemolyyttiset anemiatapahtumatc | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 8 (23) | 12 (32) |
| Malliin perustuva tapahtumien vuosittainen määrä,b LSM (SE) | 0,37 (0,136) | 0,59 (0,194) |
| Neurologisten oireiden tapahtumatd | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 4 (18) | 7 (29) |
| Malliin perustuva tapahtumien vuosittainen määrä,b LSM (SE) | 0,13 (0,068) | 0,23 (0,109) |
| Munuaisten toimintahäiriötapahtumate | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 5 (11) | 2 (5) |
| Malliin perustuva tapahtumien vuosittainen määrä,b LSM (SE) | 0,17 (0,090) | 0,08 (0,052) |
| Vatsakiputapahtumat | ||
Tutkittavat, joilla todettiin tapahtuma (tapahtumien lukumäärä) | 2 (4) | 6 (8) |
| Malliin perustuva tapahtumien vuosittainen määrä,b LSM (SE) | 0,09 (0,055) | 0,17 (0,086) |
LSM = pienimmän neliösumman keskiarvo; SE = keskivirhe; TTP = tromboottinen trombosytopeeninen purppura.
a Trombosyyttiarvon lasku ≥ 25 %:lla lähtöarvosta tai trombosyyttiarvo < 150 x 109/l.
b Negatiivisesta binomisesta sekamallista.
c LDH-arvon nousu tasolle > 1,5 × lähtöarvo tai > 1,5 x ULN.
d Hermoston häiriöitä (esim. päänsärky, sekavuus, muistiongelmat, ärtyneisyys, parestesia, dysartria, dysfonia, näköhäiriöt, fokaaliset tai yleiset motoriset oireet, mukaan lukien kouristuskohtaukset).
e Seerumin kreatiniiniarvon nousu tasolle > 1,5 × lähtöarvo.
ADZYNMA-valmisteen tehotulokset olivat yleisesti ottaen samankaltaisia koko tutkimuksen ajan ja myös jakson 3 aikana sekä kaikissa ikäryhmissä.
Tarvittaessa annettava akuuttien TTP-kohtausten entsyymikorvaushoito
Tarvittaessa annettavan akuuttien TTP-kohtausten entsyymikorvaushoidon tehoa arvioitiin niiden akuuttien TTP-tapahtumien osuuden perusteella, joiden kohdalla sekä estohoitokohortissa että tarvittaessa annettavan hoidon kohortissa saavutettiin vaste ADZYNMA-hoidolle koko tutkimuksen keston ajan.
Akuutti TTP-tapahtuma, joka vastasi ADZYNMA-hoitoon, määriteltiin TTP-tapahtuman korjaantumiseksi siten, että trombosyyttiarvo oli ≥ 150 x 109/l tai 25 %:n sisällä lähtöarvosta (näistä se, joka saavutettiin ensin) ja LDH-arvo oli ≤ 1,5 x lähtöarvosta tai ≤ 1,5 x ULN, eikä minkään muun ADAMTS13:a sisältävän lääkkeen käyttö ollut tarpeen.
Tarvittaessa annettavan hoidon kohortissa oli mukana viisi aikuispotilasta (≥ 18-vuotiaita) ja yksi pediatrinen potilas (< 6-vuotias). Tähän kohorttiin otetuilla potilailla todettiin yhteensä seitsemän akuuttia TTP-tapahtumaa. Näistä kuudesta potilaasta kaksi satunnaistettiin saamaan tarvittaessa annettavaa ADZYNMA-hoitoa ja neljä plasmapohjaisia hoitoja. Kaikki seitsemän akuuttia TTP-tapahtumaa korjaantuivat viiden vuorokauden kuluessa ADZYNMA-hoidon tai plasmapohjaisten hoitojen antamisen jälkeen.
Suurin osa potilaista (66,7 %) oli miespuolisia ja valkoihoisia (50 %), ja potilaiden iän mediaani (minimi; maksimi) oli 20 (5; 36) vuotta, keskimääräinen (keskihajonta) paino 56,4 (18,6) kg ja painon mediaani (minimi; maksimi) 64,3 (23,0; 74,0) kg.
Tutkimus 3002 (jatkotutkimus)
Tutkimuksen 3 (tutkimus 281102) loppuun suorittaneilla potilailla oli mahdollisuus osallistua pitkäkestoiseen jatkotutkimukseen (tutkimus 3002). Estohoitokohortissa oli mukana 65 potilasta, joista 40 siirtyi tutkimuksesta 281102 ja 25 ei ollut osallistunut aiempaan tutkimukseen. Niistä 40 potilaasta, jotka siirtyivät aiemmasta tutkimuksesta, 7 (17,5 %) oli ≥ 12 – < 18-vuotiaita ja 33 (82,5 %) oli ≥ 18‑vuotiaita. Niistä 25 potilaasta, jotka eivät olleet osallistuneet aiempaan tutkimukseen 3 (12 %) oli < 6-vuotiaita, 3 (12 %) oli ≥ 6 – < 12-vuotiaita, 3 (12 %) oli ≥ 12 – < 18-vuotiaita ja 16 (64 %) oli ≥ 18-vuotiaita. Tarvittaessa annettavan hoidon kohortissa oli mukana yksi potilas, jonka ikä oli ≥ 6 – < 12 vuotta. Kaikki potilaat saivat ADZYNMA-hoitoa. Estohoidon keskimääräinen kesto oli 0,98 vuotta ja enimmäiskesto 2,17 vuotta. Akuuttien ja subakuuttien TPP-tapahtumien ja TPP:n ilmentymien ilmaantuvuudet vastasivat tutkimuksen 281102 tuloksia.
Pediatriset potilaat
Teho pediatrisilla potilailla oli yleisesti ottaen samankaltainen kuin aikuispotilaiden ryhmässä.
Poikkeukselliset perusteet
Tämän lääkevalmisteen myyntilupa on myönnetty poikkeuksellisin perustein. Se tarkoittaa, että lääkevalmisteesta ei ole ollut mahdollista saada täydellisiä tietoja sairauden harvinaisuuden vuoksi. Euroopan lääkevirasto arvioi vuosittain mahdolliset uudet tiedot, ja tarvittaessa tämä valmisteyhteenveto päivitetään.
Farmakokinetiikka
ADZYNMA-valmisteen farmakokineettinen profiili määritettiin kliinisten tutkimusten ADAMTS13-aktiivisuutta koskevien tietojen analyyseista.
Kun aikuisille ja nuorille annettiin ADZYNMA-valmistetta laskimoon kerta-annoksena 5 IU/kg, 20 IU/kg ja 40 IU/kg, todettiin yksilöllisen ADAMTS13-aktiivisuuden annokseen liittyvää nousua, joka saavutti huippuarvon noin 1 tunnin kuluttua lääkkeen antamisesta tai aikaisemmin. Kliinisellä annoksella 40 IU/kg keskimääräinen (keskihajonta) puoliintumisaika ja keskimääräinen elimistössä oloaika (mean residence time, MRT) olivat aikuisilla 47,8 (13,7) tuntia ja nuorilla 63,8 (16,0) tuntia.
ADAMTS13-aktiivisuuden populaatiofarmakokineettiset parametrit aikuisilla, nuorilla ja nuoremmilla lapsilla ADZYNMA 40 IU/kg -annoksen laskimoon annon jälkeen on kuvattu taulukossa 3.
Taulukko 3: ADAMTS13-aktiivisuuden farmakokineettiset parametrit cTTP-potilailla ADZYNMA-valmisteen laskimoon annon jälkeen
| Parametri (yksikkö) | Keskiarvo (keskihajonta) Minimi; maksimi (N = 83) |
Cmax (IU/ml) | 1,13 (0,29) 0,72; 2,29 |
AUC (IU*h/ml) | 72,8 (37,4) 38,7; 274 |
ADAMTS13-aktiivisuuden pysyvyys yli 10 %:ssa (vuorokautta) | 8,85 (2,45) 4,51; 14,0 |
AUC = ADAMTS13-aktiivisuus-aikakäyrän alle jäävä alue; Cmax = suurin ADAMTS13-aktiivisuus.
Huomautus: 1 IU/ml ADAMTS13-aktiivisuutta vastaa 100 %:a keskimääräisestä normaalista aktiivisuudesta.
ADZYNMA-annoksen 40 IU/kg anto laskimoon suurensi altistuksen ADAMTS13-aktiivisuudelle (Cmax, AUC ja ADAMTS13-aktiivisuuden pysyvyys yli 10 %:ssa) yli 5‑kertaiseksi ja sen vaihtelu oli vähäisempää verrattuna plasmapohjaisiin hoitoihin.
Erityisryhmät
Ikä, sukupuoli, etninen tausta ja muut sisäsyntyiset tekijät
Painoon perustuvaa annostusta lukuun ottamatta muita sisäsyntyisiä tekijöitä (kuten ikä, sukupuoli, etninen tausta, lähtötilanteen arvioitu glomerulusten suodatusnopeus (eGFR) ja lähtötilanteen bilirubiiniarvo) ei tunnistettu ADAMTS13:n farmakokinetiikkaan vaikuttaviksi kovariaateiksi.
ADAMTS13-aktiivisuuden farmakokineettiset ominaisuudet (MRT, vakaan tilan jakautumistilavuus [Vss] ja puhdistuma [CL]) olivat samankaltaiset kaikissa cTTP-potilaiden ikäryhmissä. Painoon perustuvalla ADZYNMA-valmisteen annostuksella saavutetaan samankaltaiset ADAMTS13-aktiivisuuden farmakokineettiset parametrit (Cmax ja keskimääräinen ADAMTS13-aktiivisuus [Cave]) kaikissa ikäryhmissä ja myös < 12-vuotiailla pediatrisilla potilailla.
ADAMTS13-aktiivisuuden yli 10 %:ssa pysyvyyden mediaanin on arvioitu olevan < 10 kg painavilla imeväisikäisillä lyhyempi (noin 5–6 vuorokautta) kuin aikuisilla (noin 10 vuorokautta).
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, kerta-annoksen aiheuttamaa toksisuutta, lisääntymis- ja kehitystoksisuutta, paikallista siedettävyyttä ja immunogeenisuutta koskevien tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Tutkimuksia rADAMTS13:n mutageenisuuden ja karsinogeenisuuden arvioimiseksi ei ole tehty.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine
Natriumkloridi
Kalsiumklorididihydraatti
L-histidiini
Mannitoli
Sakkaroosi
Polysorbaatti 80 (E433)
Liuotin
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
3 vuotta
Käyttökuntoon saattamisen jälkeen
Valmisteen on osoitettu säilyvän käytön aikana kemiallisesti ja fysikaalisesti stabiilina 6 tunnin ajan 25 °C:n lämpötilassa.
Mikrobiologiselta kannalta valmiste tulee käyttää välittömästi, ellei avaus- / käyttökuntoon saattamis- / laimennusmenetelmä poista mikrobikontaminaation mahdollisuutta. Jos valmistetta ei käytetä välittömästi, käytönaikainen säilytysaika ja säilytysolosuhteet ovat käyttäjän vastuulla.
Säilytys
Kuiva-aine
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Kylmäkuivatussa muodossa olevaa ADZYNMA-valmistetta saa säilyttää huoneenlämmössä enintään 30 °C:ssa enintään 6 kuukauden ajan, mutta ei kuitenkaan viimeistä käyttöpäivämäärää pidempään.
Huoneenlämmössä säilytettyä ADZYNMA-valmistetta ei saa palauttaa jääkaappisäilytykseen.
Merkitse ADZYNMA-valmisteen koteloon päivä, jolloin valmiste poistettiin jääkaapista.
Käyttökuntoon saattamisen jälkeen
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ADZYNMA injektiokuiva-aine ja liuotin, liuosta varten
500 IU (L:ei) 1 kpl (500 IU + 5 ml, BAXJECT II Hi-Flow) (1576,65 €)
1500 IU (L:ei) 1 kpl (1500 IU + 5 ml, BAXJECT II Hi-Flow) (4436,85 €)
PF-selosteen tieto
ADZYNMA 500 IU injektiokuiva-aine ja liuotin, liuosta varten
Yhden pakkauksen sisältö:
- kuiva-aine injektiopullossa (tyypin I lasia), jossa on butyylikumitulppa
- 5 ml liuotinta injektiopullossa (tyypin I lasia), jossa on butyylikumitulppa
- yksi laite valmisteen käyttökuntoon saattamista varten (BAXJECT II Hi-Flow)
- yksi 10 ml:n kertakäyttöruisku
- yksi 25 gaugen infuusiosetti
- kaksi alkoholipyyhettä
ADZYNMA 1 500 IU injektiokuiva-aine ja liuotin, liuosta varten
Yhden pakkauksen sisältö:
- kuiva-aine injektiopullossa (tyypin I lasia), jossa on butyylikumitulppa
- 5 ml liuotinta injektiopullossa (tyypin I lasia), jossa on butyylikumitulppa
- yksi laite valmisteen käyttökuntoon saattamista varten (BAXJECT II Hi-Flow)
- yksi 20 ml:n kertakäyttöruisku
- yksi 25 gaugen infuusiosetti
- kaksi alkoholipyyhettä
Valmisteen kuvaus:
Valkoinen, kylmäkuivattu jauhe.
Liuotin on kirkas ja väritön liuos.
Käyttökuntoon saatetun liuoksen pH on 6,7–7,3 ja osmolaalisuus vähintään 240 mOsmol/kg.
Käyttö- ja käsittelyohjeet
ADZYNMA annetaan laskimoon sen jälkeen, kun injektiokuiva-aine on saatettu käyttökuntoon pakkauksessa toimitetulla injektionesteisiin käytettävällä vedellä.
Yleisohjeet
- Laske annettava annos ja tilavuus potilaan painon perusteella.
- Käytä aseptista tekniikkaa koko toimenpiteen ajan.
- Tarkista valmisteen viimeinen käyttöpäivämäärä ennen käyttöä.
- Älä käytä ADZYNMA-valmistetta, jos sen viimeinen käyttöpäivämäärä on ohitettu.
- Jos potilas tarvitsee useampia ADZYNMA-injektiopulloja yhtä injektiota kohti, jokainen injektiopullo on saatettava käyttökuntoon kohdassa ”Käyttökuntoon saattaminen” annettujen ohjeiden mukaisesti. Huomaathan, että BAXJECT II Hi-Flow -laite on tarkoitettu käytettäväksi vain yhden ADZYNMA-injektiopullon ja injektionesteisiin käytettävän veden kanssa. Näin ollen toisen injektiopullon sisällön käyttökuntoon saattamiseen ja ruiskuun siirtämiseen tarvitaan toinen BAXJECT II Hi-Flow -laite.
- Parenteraalisesti annettavat lääkevalmisteet on tarkastettava silmämääräisesti ennen antoa mahdollisten hiukkasten ja värimuutosten varalta, mikäli liuos ja pakkaus sen mahdollistavat. Käyttökuntoon saatetun ADZYNMA-liuoksen on oltava kirkasta ja väritöntä.
- Älä anna liuosta, jos siinä on näkyviä hiukkasia tai värimuutoksia.
- Anna ADZYNMA 3 tunnin kuluessa käyttökuntoon saattamisesta, mikäli sitä säilytetään huoneenlämmössä.
-
Älä anna ADZYNMA-valmistetta saman letkuston tai säiliön kautta samanaikaisesti muiden infuusiona annettavien lääkevalmisteiden kanssa.
Käyttökuntoon saattaminen
1. Valmistele puhdas ja tasainen työtaso ja kerää kaikki tarvikkeet, joita tarvitset valmisteen käyttökuntoon saattamiseen ja antoon (kuva A).
2. Anna ADZYNMA-injektiopullojen ja laimentimen lämmetä huoneenlämpöisiksi ennen käyttöä.
3. Pese ja kuivaa kädet huolellisesti.
4. Poista ADZYNMA-valmistetta ja laimenninta sisältävien injektiopullojen muovikorkit ja aseta injektiopullot tasaiselle alustalle (kuva B).
Kuva B
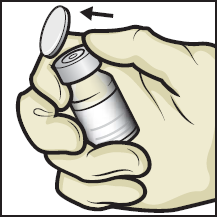
5. Pyyhi kumitulpat alkoholipyyhkeellä ja anna niiden kuivua ennen käyttöä (kuva C).
Kuva C
6. Avaa BAXJECT II Hi‑Flow -laitteen pakkaus vetämällä kansi irti sisältöön koskematta (kuva D).
- Älä poista BAXJECT II Hi-Flow -laitetta pakkauksesta.
- Älä koske kirkkaaseen muovipiikkiin.
Kuva D
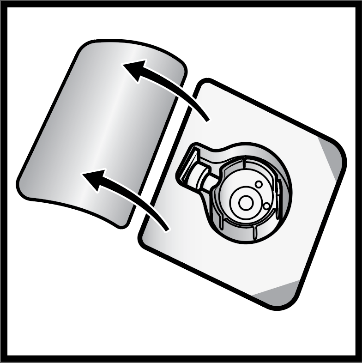
7. Käännä BAXJECT II Hi-Flow -laitteen pakkaus ylösalaisin ja aseta se laimenninta sisältävän injektiopullon päälle. Paina suoraan alaspäin, kunnes kirkas muovipiikki lävistää laimenninta sisältävän injektiopullon tulpan (kuva E).
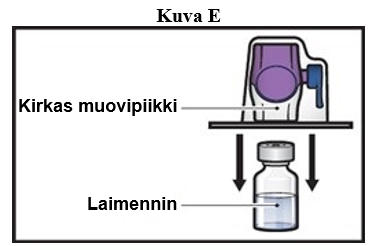
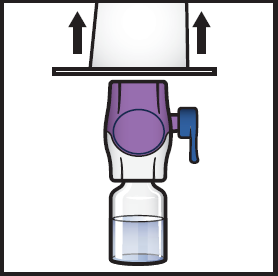
8. Tartu BAXJECT II Hi-Flow -laitteen pakkauksen reunaan ja vedä pakkaus pois laitteen päältä (kuva F).
- Älä poista BAXJECT II Hi‑Flow -laitteen sinistä korkkia.
- Älä koske paljastuneeseen violettiin muovipiikkiin.
Kuva F
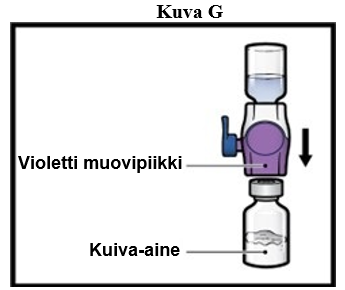
9. Käännä järjestelmä ympäri niin, että laimenninta sisältävä injektiopullo on ylimpänä. Paina BAXJECT II Hi‑Flow -laitetta suoraan alaspäin, kunnes violetti muovipiikki lävistää ADZYNMA-kuiva-ainetta sisältävän injektiopullon tulpan (kuva G). Tyhjiö imee laimentimen ADZYNMA-kuiva-ainetta sisältävään injektiopulloon.
- Saatat huomata hieman ilmakuplia tai vaahtoa – se on normaalia, ja niiden pitäisi hävitä nopeasti.
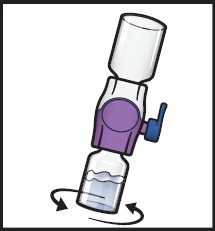
10. Pyörittele yhdistettyjä injektiopulloja varovasti ja tauotta, kunnes kuiva-aine on liuennut täysin (kuva H).
- Älä ravista injektiopulloa.
Kuva H
11. Tarkista käyttökuntoon saatettu liuos silmämääräisesti hiukkasten varalta ennen antoa.
-
Älä käytä liuosta, jos siinä on näkyviä hiukkasia tai värimuutoksia.
12. Jos annokseen tarvitaan useampia ADZYNMA-injektiopulloja, saata kukin injektiopullo käyttökuntoon yllä olevia vaiheita noudattaen.
-
Käytä jokaisen ADZYNMA-injektiopullon ja laimentimen käyttökuntoon saattamiseen eri BAXJECT II Hi‑Flow -laitetta.
Anto-ohjeet
13. Poista BAXJECT II Hi-Flow -laitteen sininen korkki (kuva I). Kiinnitä luer‑lock -ruisku (kuva J).
- Älä injektoi ilmaa järjestelmään.
Kuva I |
Kuva J |
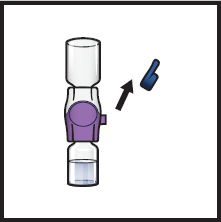 | 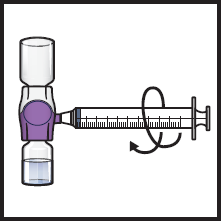 |
14. Käännä järjestelmä ylösalaisin (ADZYNMA-injektiopullo on nyt ylimpänä). Vedä käyttökuntoon saatettu liuos ruiskuun vetämällä mäntää hitaasti taaksepäin (kuva K).
Kuva K
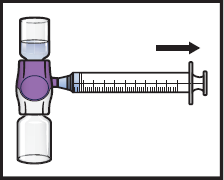
15. Jos potilaan annokseen tarvitaan useampia ADZYNMA-injektiopulloja, useampien injektiopullojen sisällön saa vetää samaan ruiskuun. Toista mainitut vaiheet kaikkien käyttökuntoon saatettujen ADZYNMA-injektiopullojen osalta, kunnes potilaalle annettava kokonaistilavuus saavutetaan.
16. Irrota ruisku ja kiinnitä siihen sopiva injektioneula tai infuusiosetti.
17. Käännä neulan kärki ylöspäin ja poista ilmakuplat naputtelemalla ruiskua varovasti sormella ja työntämällä ilma ruiskusta ja neulasta hitaasti ja varovasti.
18. Aseta kiristysside paikoilleen ja puhdista valitsemasi pistoskohta alkoholipyyhkeellä (kuva L).
Kuva L
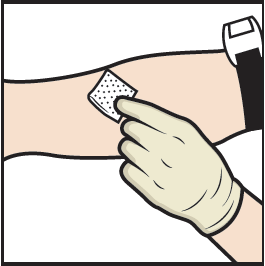
19. Vie neula suoneen ja poista kiristysside.
20. Anna käyttökuntoon saatettu ADZYNMA hitaana infuusiona nopeudella 2–4 ml minuutissa (kuva M).
-
Antonopeuden hallintaan voidaan käyttää ruiskupumppua.
Kuva M
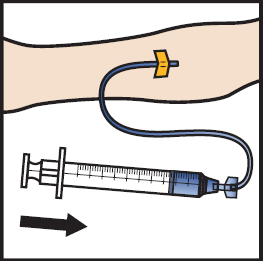
21. Vedä neula pois suonesta ja paina pistoskohtaa useiden minuuttien ajan.
-
Älä laita korkkia takaisin neulan päälle.
22. Laita neula, ruisku ja tyhjät injektiopullot pistonkestävään terävän jätteen säiliöön.
-
Älä hävitä ruiskuja ja neuloja talousjätteiden mukana.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ADZYNMA injektiokuiva-aine ja liuotin, liuosta varten
500 IU 1 kpl
1500 IU 1 kpl
- Ei korvausta.
ATC-koodi
B01AD13
Valmisteyhteenvedon muuttamispäivämäärä
09.01.2026
Yhteystiedot
 TAKEDA OY
TAKEDA OY PL 1406, Ilmalankuja 3
00101 Helsinki
0800 774 051
www.takeda.fi
etunimi.sukunimi@takeda.com
