OKEDI injektiokuiva-aine ja liuotin, depotsuspensiota varten 75 mg, 100 mg
Huomioitavaa
Vaikuttavat aineet ja niiden määrät
OKEDI 75 mg injektiokuiva-aine ja liuotin depotsuspensiota varten
1 esitäytetty ruisku sisältää 75 mg risperidonia.
OKEDI 100 mg injektiokuiva-aine ja liuotin depotsuspensiota varten
1 esitäytetty ruisku sisältää 100 mg risperidonia. Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin depotsuspensiota varten
Kliiniset tiedot
Käyttöaiheet
OKEDI on tarkoitettu skitsofrenian hoitoon aikuisille, joilla risperidonin siedettävyys ja teho on varmistettu suun kautta otettavalla risperidonilla.
Annostus ja antotapa
Annostus
OKEDI annetaan injektiona lihakseen (i.m.) 28 päivän välein. OKEDI-hoito pitää aloittaa potilaan kliinisen tilanteen mukaan:
Potilaat, joilla on aiemmin saavutettu vaste risperidonille, ja joiden tila on tällä hetkellä vakaa suun kautta otettavilla psykoosilääkkeillä (lieviä tai keskivaikeita psykoosioireita)
Potilaat, joiden tila on vakaa suun kautta otettavalla risperidonilla, voidaan siirtää OKEDI-hoitoon ilman edeltävää annostitrausta.
Jos potilaan tila on vakautettu jollakin muulla psykoosilääkkeellä (ei risperidonilla), annoksen titraus tehdään suun kautta otettavalla risperidonilla ennen OKEDI-hoidon aloittamista. Titrausvaiheen on oltava riittävän pitkä (vähintään 6 päivää), jotta risperidonin siedettävyys ja hoitovasteen saavuttaminen voidaan varmistaa.
Potilaat, joita ei ole koskaan aiemmin hoidettu suun kautta otettavalla risperidonilla
Jos potilaalle voidaan harkita OKEDI-hoitoa, mutta häntä EI ole aiemmin hoidettu risperidonilla, risperidonin siedettävyys ja hoitovasteen saavuttaminen on varmistettava hoitamalla potilasta ensin jonkin aikaa suun kautta otettavalla risperidonilla ennen OKEDI-hoidon aloittamista. Titrausvaiheen suositeltu kesto on vähintään 14 päivää.
Siirtyminen suun kautta otettavasta risperidonista OKEDI-valmisteeseen
Suun kautta otettavan risperidonin ja OKEDI-valmisteen suositellut annokset, joilla aktiivisen fraktion vakaan tilan altistus saadaan pidettyä samalla tasolla, ovat seuraavat:
| Jos suun kautta otettavan risperidonin annos oli 3 mg/vrk, siirrytään 75 mg:n OKEDI-injektioon 28 päivän välein |
| Jos suun kautta otettavan risperidonin annos oli 4 mg/vrk tai enemmän, siirrytään 100 mg:n OKEDI-injektioon 28 päivän välein |
OKEDI-hoito on aloitettava noin 24 tunnin kuluttua viimeisestä suun kautta otetusta risperidoniannoksesta. OKEDI-annosta voidaan säätää 28 päivän välein. OKEDI-valmisteen suositeltu ylläpitoannos on yleensä 75 mg 28 päivän välein. Kliinisestä vasteesta ja siedettävyydestä riippuen jotkut potilaat voivat kuitenkin hyötyä 100 mg:n OKEDI-annoksesta 28 päivän välein. OKEDI- valmistetta käytettäessä ei suositella kyllästysannosta eikä risperidonin antamista myös suun kautta.
Siirtyminen joka toinen viikko annettavasta pitkävaikutteisesta risperidoni-injektiosta OKEDI- valmisteeseen
Siirryttäessä joka toinen viikko annettavasta pitkävaikutteisesta risperidoni-injektiosta OKEDI- valmisteeseen OKEDI-hoito aloitetaan joka toinen viikko annettavan pitkävaikutteisen risperidoni- injektion sijasta seuraavana aikataulun mukaisena antopäivänä (eli kun edellisen joka toinen viikko annettavan pitkävaikutteisen risperidoni-injektion antamisesta on kulunut kaksi viikkoa). Tämän jälkeen OKEDI-hoitoa jatketaan 28 päivän välein. Risperidonin antamista samanaikaisesti suun kautta ei suositella.
Kun potilas, jonka tila on aiemmin vakautettu joka toinen viikko annettavilla pitkävaikutteisilla risperidoni-injektioilla, siirretään OKEDI-hoitoon, suositeltu annos, jolla aktiivisen fraktion vakaan tilan altistus saadaan pidettyä samalla tasolla, on seuraava:
| Jos joka toinen viikko annettavan pitkävaikutteisen risperidoni-injektion annos oli 37,5 mg, siirrytään 75 mg:n OKEDI-injektioon 28 päivän välein |
| Jos joka toinen viikko annettavan pitkävaikutteisen risperidoni-injektion annos oli 50 mg, siirrytään 100 mg:n OKEDI-injektioon 28 päivän välein |
Siirtyminen OKEDI-valmisteesta suun kautta otettavaan risperidoniin
OKEDI-valmistemuodon depotominaisuudet on otettava huomioon siirrettäessä potilaita OKEDI- injektioista takaisin suun kautta otettavaan risperidonihoitoon. Yleisesti ottaen suun kautta otettava risperidonihoito suositellaan aloittamaan 28 päivän kuluttua OKEDI-valmisteen viimeisestä antokerrasta.
Annosten jääminen väliin
Miten vältetään annosten jääminen väliin
Jotta vältetään 28 päivän välein annettavan annoksen jääminen väliin, potilaan injektio voidaan antaa enintään 3 päivää ennen 28 päivän täyttymistä. Jos annos viivästyy yhdellä viikolla, pienimmän pitoisuuden mediaani pienenee noin 50%:lla kyseisen viikon aikana. Tämän kliinistä merkitystä ei tunneta. Annoksen viivästyessä seuraavan 28 päivän välein annettavan injektion ajankohta määritetään edellisen injektion antopäivän perusteella.
Erityisryhmät
Iäkkäät
OKEDI-valmisteen tehoa ja turvallisuutta > 65-vuotiailla iäkkäillä potilailla ei ole varmistettu injektiona annettavan OKEDI-depotsuspension osalta. OKEDI-valmistetta on käytettävä varoen iäkkäille potilaille. Ennen OKEDI-valmisteen antoa on luotettavasti varmistettava, että potilas sietää suun kautta otettavaa risperidonia ≥ 3 mg:n annoksena.
Yleisesti ottaen risperidonin suositeltu annos iäkkäille potilaille, joiden munuaiset toimivat normaalisti, on sama kuin aikuisille potilaille, joiden munuaiset toimivat normaalisti. OKEDI-hoidon aloittamista 75 mg:n annoksella voidaan kuitenkin harkita, jos se katsotaan kliinisesti tarpeelliseksi (annossuositukset munuaisten vajaatoimintapotilaille, ks. Munuaisten vajaatoiminta alla).
Munuaisten vajaatoiminta
OKEDI-valmistetta ei ole systemaattisesti tutkittu munuaisten vajaatoimintaa sairastavilla potilailla. OKEDI-annosta ei tarvitse muuttaa potilaille, joilla on lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma 60–89 ml/min).
OKEDI-hoitoa ei suositella potilaille, joilla on keskivaikea tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma < 60 ml/min).
Maksan vajaatoiminta
OKEDI-valmistetta ei ole systemaattisesti tutkittu maksan vajaatoimintaa sairastavilla potilailla. Risperidonin vapaan fraktion pitoisuus plasmassa suurenee maksan vajaatoimintapotilailla.
OKEDI-valmistetta on käytettävä varoen näille potilasryhmille. Annoksen huolellista titrausta suun kautta otettavalla risperidonilla (aloitusannosten puolittamista ja titrauksen tekemistä hitaammin) suositellaan ennen OKEDI-hoidon aloittamista 75 mg:n annoksella, jos vähintään 3 mg:n suun kautta otettavan annoksen siedettävyys on varmistettu.
Pediatriset potilaat
OKEDI-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
OKEDI on tarkoitettu annettavaksi vain lihakseen, eikä sitä pidä antaa laskimoon eikä ihon alle (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Käyttö- ja käsittelyohjeet) eikä minkään muun reitin kautta. Valmisteen antaa terveydenhuollon ammattilainen.
OKEDI-valmiste annetaan injektiona syvälle hartia- tai pakaralihakseen asianmukaisella steriilillä neulalla. Hartialihakseen injektio annetaan käyttämällä yhden tuuman neulaa, ja injektio annetaan vuorotellen kumpaankin olkavarteen. Pakaralihakseen injektio annetaan käyttämällä kahden tuuman neulaa, ja injektio annetaan vuorotellen kumpaankin pakaraan.
OKEDI-kuiva-ainetta sisältävä esitäytetty ruisku saatetaan käyttökuntoon mukana toimitetulla, liuotinta sisältävällä esitäytetyllä ruiskulla välittömästi ennen valmisteen antamista injektiona.
Käyttökuntoon saattaminen tehdään käyttöohjeiden mukaisesti, ks. kohta Käyttö- ja käsittelyohjeet. Virheet käyttökuntoon saattamisessa voivat vaikuttaa kuiva-aineen liukenemiseen, ja tästä voi olla seurauksena suurempi risperidonin huippupitoisuus (yliannostus) ensimmäisinä tunteina valmisteen annon jälkeen sekä pienempi AUC-arvo (aliannostus) koko annosjakson aikana.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jos potilasta ei ole aiemmin hoidettu risperidonilla, siedettävyyden varmistamista suun kautta otettavalla risperidonilla suositellaan ennen OKEDI-hoidon aloittamista (ks. kohta Annostus ja antotapa).
Lääkevalmisteen depotominaisuudet ja risperidonin pitkä eliminaation puoliintumisaika on otettava huomioon arvioitaessa hoitotarpeita ja mahdollista hoidon lopettamisen tarvetta.
Iäkkäät dementiapotilaat
Iäkkäiden dementiapotilaiden lisääntynyt kuolleisuus
OKEDI-valmistetta ei ole tutkittu iäkkäillä dementiapotilailla, eikä sitä pidä käyttää tälle potilasryhmälle. Atyyppisillä psykoosilääkkeillä (myös risperidonilla) tehtyjen 17 kontrolloidun tutkimuksen meta-analyysissa todettiin, että atyyppisillä psykoosilääkkeillä hoidettujen iäkkäiden dementiapotilaiden kuolleisuus oli lisääntynyt verrattuna lumelääkettä saaneisiin potilaisiin. Tässä potilaspopulaatiossa tehdyissä lumekontrolloiduissa risperidonitutkimuksissa kuolleisuuden ilmaantuvuus oli risperidonihoitoa saaneilla potilailla 4% ja lumelääkettä saaneilla 3,1%.
Kerroinsuhde (95%:n eksakti luottamusväli) oli 1,21 (0,7; 2,1). Kuolleiden potilaiden keski-ikä oli 86 vuotta (vaihteluväli 67–100 vuotta). Kahden suuren havainnointitutkimuksen tulokset osoittivat, että myös perinteisillä psykoosilääkkeillä hoidettavilla iäkkäillä dementiapotilailla on hieman kohonnut kuolleisuusriski verrattuna niihin, joita ei hoideta. Tiedot eivät riitä riskin suuruuden tarkkaan arviointiin, ja syy kohonneeseen riskiin on tuntematon. Ei myöskään tiedetä varmasti, missä määrin havainnointitutkimuksissa todettu lisääntynyt kuolleisuus liittyy psykoosilääkkeiden käyttöön eikä potilaiden joihinkin ominaisuuksiin.
Furosemidin samanaikainen käyttö
Iäkkäillä dementiapotilailla tehdyissä lumekontrolloiduissa risperidonitutkimuksissa kuolleisuuden ilmaantuvuus oli suurempi furosemidin ja risperidonin yhdistelmää saaneilla potilailla (7,3%, keski- ikä 89 vuotta, vaihteluväli 75–97) verrattuna pelkkää risperidonia saaneisiin potilaisiin (3,1%, keski- ikä 84 vuotta, vaihteluväli 70–96) tai pelkkää furosemidia saaneisiin potilaisiin (4,1%, keski-ikä 80 vuotta, vaihteluväli 67–90). Furosemidin ja risperidonin yhdistelmän käyttöön liittyvää lisääntynyttä kuolleisuutta todettiin kahdessa neljästä kliinisestä tutkimuksesta. Risperidonin ja muiden diureettien (lähinnä pieninä annoksina käytettyjen tiatsididiureettien) samanaikaiseen käyttöön ei liittynyt vastaavia löydöksiä.
Tämän löydöksen selittävää patofysiologista mekanismia ei ole tunnistettu, eikä yhdenmukaista kuolinsyytä ole todettu. Siitä huolimatta varovaisuutta on noudatettava, ja tämän lääkeyhdistelmän tai muiden voimakkaiden diureettien samanaikaisen käytön riskejä ja hyötyjä on punnittava ennen hoitopäätöksen tekemistä. Muita diureetteja samanaikaisesti risperidonin kanssa käyttäneiden potilaiden kuolleisuus ei lisääntynyt. Lääkityksestä riippumatta nestehukka oli kuolleisuuden yleinen riskitekijä, joten sitä on pyrittävä huolellisesti välttämään iäkkäillä dementiapotilailla.
Aivoverenkiertoon liittyvät haittatapahtumat
Aivoverenkiertoon liittyvien haittatapahtumien riskin on dementiapotilailla tehdyissä satunnaistetuissa lumekontrolloiduissa kliinisissä tutkimuksissa havaittu suurentuneen noin kolminkertaiseksi joidenkin atyyppisten psykoosilääkkeiden käytön yhteydessä. Kuudesta lumekontrolloidusta, pääosin iäkkäillä (> 65-vuotiailla) dementiapotilailla tehdystä risperidonitutkimuksesta saadut yhdistetyt tiedot osoittivat että aivoverenkiertoon liittyviä haittatapahtumia (vakavat ja ei-vakavat yhteensä) esiintyi 3,3%:lla (33/1 009) risperidonia saaneista potilaista ja 1,2%:lla (8/712) lumelääkettä saaneista potilaista. Kerroinsuhde (95%:n eksakti luottamusväli) oli 2,96 (1,34; 7,50). Suurentuneen riskin mekanismia ei tunneta. Suurentunutta riskiä ei myöskään voida sulkea pois muiden psykoosilääkkeiden tai muiden potilasryhmien osalta.
OKEDI-valmistetta on annettava varoen potilaille, joilla on aivohalvauksen riskitekijöitä.
Ortostaattinen hypotensio
Risperidonin alfasalpausvaikutuksen vuoksi (ortostaattista) hypotensiota voi esiintyä etenkin hoidon alkuvaiheessa. Joitakin hypotension tai ortostaattisen hypotension tapauksia on ilmoitettu OKEDI- valmisteen kliinisen kehitysohjelman aikana 50–100 mg:n annoksia käytettäessä. Kliinisesti merkittävää hypotensiota on todettu markkinoille tulon jälkeen, kun risperidonia on käytetty samanaikaisesti verenpainetta alentavien lääkkeiden kanssa. OKEDI-valmistetta on käytettävä varoen potilaille, joilla on tiedossa oleva sydän- ja verisuonitauti (esim. sydämen vajaatoiminta, sydäninfarkti, johtumishäiriöt, nestehukka, hypovolemia tai aivoverisuonisairaus). OKEDI-hoidon jatkamisen hyöty- riskisuhde pitää arvioida, jos kliinisesti merkittävä ortostaattinen hypotensio jatkuu pitkään.
Leukopenia, neutropenia ja agranulosytoosi
Leukopeniaa, neutropeniaa ja agranulosytoosia on raportoitu risperidonin käytön yhteydessä. Agranulosytoosia on raportoitu hyvin harvoin (< 1/10 000 potilaalla) valmisteen markkinoille tulon jälkeisessä seurannassa.
Jos potilaalla on aiemmin ollut kliinisesti merkittävää veren valkosolujen niukkuutta tai lääkkeestä aiheutunut leukopenia/neutropenia, potilasta on seurattava muutamien ensimmäisten hoitokuukausien aikana ja OKEDI-hoidon lopettamista on harkittava veren valkosolumäärän kliinisesti merkittävään laskuun viittaavien ensimmäisten löydösten ilmaantuessa, jos potilaalla ei ole muita tällaisia löydöksiä aiheuttavia tekijöitä.
Jos potilaalla on kliinisesti merkittävää neutropeniaa, häntä on seurattava kuumeen ja muiden infektion oireiden ja löydösten varalta ja hoidettava heti, jos tällaisia oireita tai löydöksiä ilmaantuu. Jos potilaalla on vaikea neutropenia (absoluuttinen neutrofiilimäärä < 1 × 109/l), OKEDI-hoito on lopetettava ja veren valkosolumäärää on seurattava potilaan toipumiseen saakka.
Tardiivi dyskinesia / ekstrapyramidaalioireet
Dopamiinireseptoreita salpaavien lääkkeiden käyttöön on liittynyt tardiivin dyskinesian kehittymistä. Erityisesti kielen ja/tai kasvojen lihasten tahdosta riippumattomat rytmiset liikkeet ovat tyypillisiä tardiiville dyskinesialle. Ekstrapyramidaalioireiden ilmeneminen on tardiivin dyskinesian riskitekijä. Jos tardiivin dyskinesian oireita ja löydöksiä ilmenee, on harkittava kaikkien psykoosilääkkeiden käytön lopettamista.
Varovaisuutta on syytä noudattaa hoidettaessa potilaita, jotka käyttävät samanaikaisesti sekä psykostimulantteja (esim. metyylifenidaattia) että risperidonia, sillä toisen tai molempien lääkeaineiden annosmuutokset saattavat johtaa ekstrapyramidaalioireisiin. Stimulanttihoidon lopettamista asteittain suositellaan (ks. kohta Yhteisvaikutukset).
Maligni neuroleptioireyhtymä
Psykoosilääkkeiden käytön yhteydessä on raportoitu malignia neuroleptioireyhtymää, jolle ominaisia oireita ovat hypertermia, lihasjäykkyys, autonomisen hermoston häiriöt, tajunnan tason muutokset ja seerumin kreatiinifosfokinaasiarvon nousu. Muita löydöksiä voivat olla myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta. Tällaisessa tilanteessa OKEDI-hoito on lopetettava.
Parkinsonin tauti ja Lewyn kappale -dementia
Hoidon riskejä ja hyötyjä on punnittava, jos OKEDI-valmistetta aiotaan määrätä Parkinsonin tautia tai Lewyn kappale -dementiaa sairastaville potilaille. Risperidonihoito voi pahentaa Parkinsonin tautia.
Kummallakin potilasryhmällä malignin neuroleptioireyhtymän riski saattaa olla suurentunut ja herkkyys psykoosilääkkeille saattaa olla lisääntynyt. Näitä potilaita ei otettu kliinisiin tutkimuksiin. Tällainen lisääntynyt herkkyys voi ilmetä sekavuutena, turtuneisuutena, kehon asennon epävakautena ja siihen liittyvinä toistuvina kaatumisina sekä ekstrapyramidaalioireina.
Hyperglykemia ja diabetes
Hyperglykemiaa, diabetesta ja aiemmin puhjenneen diabeteksen pahenemista on raportoitu risperidonihoidon aikana. Joissakin tapauksissa ilmoitettiin edeltävää painonnousua, joka saattaa olla altistava tekijä. Näihin on raportoitu liittyneen hyvin harvoin ketoasidoosia ja harvoin diabeettinen kooma. Asianmukaista kliinistä seurantaa suositellaan psykoosilääkkeiden käytöstä annettujen ohjeiden mukaisesti. OKEDI-valmisteella hoidettavia potilaita on seurattava hyperglykemian oireiden (kuten polydipsian, polyurian, polyfagian ja heikotuksen) havaitsemiseksi, ja diabetesta sairastavien potilaiden tilaa on seurattava säännöllisesti glukoositasapainon heikkenemisen varalta.
Painonnousu
Risperidonin käytön yhteydessä on raportoitu huomattavaa painon nousua. Painoa on seurattava säännöllisesti.
Hyperprolaktinemia
Hyperprolaktinemia on risperidonihoidon yleinen haittavaikutus. Plasman prolaktiinipitoisuuden mittausta suositellaan, jos potilaalla on viitteitä mahdollisista prolaktiiniin liittyvistä haittavaikutuksista (esim. gynekomastiaa, kuukautishäiriöitä, anovulaatio, hedelmällisyyden häiriöitä, sukupuolista haluttomuutta, erektiohäiriöitä tai maidonvuotoa).
Kudosviljelytutkimukset viittaavat siihen, että prolaktiini saattaa kiihdyttää solujen kasvua ihmisen rintarauhaskasvaimissa. Vaikka selvää yhteyttä psykoosilääkkeiden käyttöön ei ole toistaiseksi osoitettu kliinisissä ja epidemiologisissa tutkimuksissa, varovaisuutta on syytä noudattaa potilailla, joilla on todettu tällaisia kasvaimia. OKEDI-valmistetta on käytettävä varoen potilaille, joilla on ennestään hyperprolaktinemia tai mahdollisesti prolaktiiniriippuvaisia kasvaimia.
QT-ajan piteneminen
QT-ajan pitenemistä on raportoitu hyvin harvoin. Jos potilaalla on sydän- ja verisuonitauti, hänen suvussaan tiedetään esiintyneen QT-ajan pitenemistä, bradykardiaa, tai elektrolyyttitasapainon häiriöitä (hypokalemiaa, hypomagnesemiaa), risperidonia määrättäessä on noudatettava varovaisuutta, koska rytmihäiriöitä aiheuttavat vaikutukset saattavat voimistua. Varovaisuutta on noudatettava myös silloin, kun risperidonia käytetään samanaikaisesti tunnetusti QT-aikaa pidentävien lääkkeiden kanssa.
Kouristuskohtaukset
OKEDI-valmistetta on käytettävä varoen potilaille, joilla on aiemmin esiintynyt kouristuskohtauksia tai joilla on muu kouristuskynnystä mahdollisesti alentava sairaustila.
Priapismi
OKEDI-valmisteen alfa-adrenergisen salpaajavaikutuksen vuoksi hoidon yhteydessä voi esiintyä priapismia.
Kehon lämpötilan säätely
Psykoosilääkkeiden käyttöön on liittynyt häiriöitä elimistön kyvyssä alentaa kehon ydinlämpötilaa. Asianmukaista varovaisuutta suositellaan määrättäessä OKEDI-valmistetta potilaalle, joka altistuu elimistön ydinlämpötilan nousua edistäville olosuhteille, joita ovat esim. raskas liikunta, altistuminen erittäin korkeille lämpötiloille, samanaikainen hoito antikolinergisesti vaikuttavilla lääkeaineilla tai nestehukka.
Antiemeettinen vaikutus
Risperidonilla tehdyissä prekliinisissä tutkimuksissa todettiin antiemeettinen vaikutus. Jos ihmisellä esiintyy tällainen vaikutus, se saattaa peittää tiettyjen lääkkeiden yliannostuksen tai tiettyjen sairauksien, kuten suolitukoksen, Reyen oireyhtymän ja aivokasvaimen, oireet ja löydökset.
Laskimotromboembolia
Laskimotromboemboliaa on raportoitu psykoosilääkkeiden käytön yhteydessä. Koska psykoosilääkkeitä saavilla potilailla on usein hankittuja laskimotromboembolialle altistavia riskitekijöitä, kaikki mahdolliset riskitekijät on tunnistettava ennen OKEDI-hoidon aloittamista sekä hoidon aikana, ja ennaltaehkäiseviin toimenpiteisiin on ryhdyttävä.
Leikkauksenaikainen velton värikalvon oireyhtymä
Risperidonihoitoa saaneilla potilailla on todettu kaihileikkauksen aikana velton värikalvon oireyhtymää (IFIS) (ks. kohta Haittavaikutukset).
IFIS saattaa suurentaa silmäkomplikaatioiden riskiä leikkauksen aikana ja sen jälkeen. Alfa-1a- adrenergisia reseptoreja salpaavien lääkkeiden senhetkisestä tai aiemmasta käytöstä on kerrottava silmäleikkauksen tekevälle kirurgille ennen leikkausta. Alfa-1-salpaajien käytön lopettamisen mahdollista hyötyä ennen kaihileikkausta ei ole varmistettu, joten se on arvioitava psykoosilääkkeen käytön lopettamisesta aiheutuviin riskeihin nähden.
Yliherkkyys
Jos potilas ei ole aiemmin saanut risperidonihoitoa, risperidonin siedettävyys on varmistettava suun kautta otettavalla lääkemuodolla ennen hoidon aloittamista. Siitä huolimatta parenteraalisen risperidonin käytön yhteydessä on raportoitu markkinoille tulon jälkeen harvinaisia anafylaktisia reaktioita potilailla, jotka ovat aiemmin sietäneet suun kautta otettavaa risperidonia. Jos yliherkkyysreaktioita ilmenee, OKEDI-valmisteen käyttö on lopetettava, kliinisesti tarkoituksenmukainen elintoimintoja tukeva hoito aloitettava ja potilasta seurattava, kunnes oireet ja löydökset häviävät.
Käyttökuntoon saattaminen ja anto
Virheet käyttökuntoon saattamisessa voivat heikentää valmisteen tehoa (ks. kohdat Annostus ja antotapa ja Käyttö- ja käsittelyohjeet).
Varovaisuutta on noudatettava, jotta OKEDI-valmistetta ei pistetä vahingossa verisuoneen tai ihonalaiskudokseen. Jos OKEDI-valmistetta pistetään laskimoon, valmisteen ominaispiirteiden vuoksi on odotettavissa, että se kiinteytyy välittömästi ja tukkii neulan. Tällöin injektiokohdassa voi esiintyä verenvuotoa. Jos valmiste annetaan ihon alle, injektio voi olla kivuliaampi ja risperidonin vapautuminen on todennäköisesti hitaampaa.
Jos annos annetaan virheellisesti laskimoon tai ihon alle, ei uutta annosta pidä antaa, sillä virheellisen annon aiheuttamaa lääkeainealtistusta on vaikea arvioida. Potilasta on seurattava tiiviisti ja hoidettava kliinisesti tarkoituksenmukaisella tavalla seuraavaan aikataulun mukaiseen, 28 päivän välein annettavaan kuukausittaiseen OKEDI-injektioon asti.
Yhteisvaikutukset
OKEDI-valmisteen ja muiden samanaikaisesti käytettyjen lääkevalmisteiden yhteisvaikutuksia ei ole systemaattisesti arvioitu. Tässä kohdassa esitetyt tiedot yhteisvaikutuksista perustuvat suun kautta otettavalla risperidonilla tehtyihin tutkimuksiin.
Farmakodynamiikkaan liittyvät yhteisvaikutukset
QT-aikaa tunnetusti pidentävät lääkkeet
Varovaisuutta on syytä noudattaa määrättäessä OKEDI-valmistetta samanaikaisesti QT-aikaa tunnetusti pidentävien lääkkeiden, kuten seuraavien, kanssa: rytmihäiriölääkkeet (esim. kinidiini, disopyramidi, prokaiiniamidi, propafenoni, amiodaroni, sotaloli), trisykliset masennuslääkkeet (esim. amitriptyliini), tetrasykliset masennuslääkkeet (esim. maprotiliini), jotkin antihistamiinit, muut psykoosilääkkeet, jotkin malarialääkkeet (esim. kiniini ja meflokiini), elektrolyyttitasapainon häiriöitä (hypokalemiaa, hypomagnesemiaa) tai bradykardiaa aiheuttavat lääkkeet ja risperidonin maksametaboliaa estävät lääkkeet. Luettelo on suuntaa-antava eikä se ole kattava.
Keskushermostoon vaikuttavat lääkkeet ja alkoholi
Lisääntyneen sedaatiovaaran vuoksi OKEDI-valmistetta on käytettävä varoen muiden keskushermostoon vaikuttavien aineiden, etenkin alkoholin, opiaattien, antihistamiinien ja bentsodiatsepiinien, kanssa.
Levodopa ja dopamiiniagonistit
OKEDI saattaa estää levodopan ja muiden dopamiiniagonistien vaikutusta. Jos näiden lääkkeiden samanaikainen käyttö on välttämätöntä, erityisesti loppuvaiheen Parkinsonin taudin hoidossa, potilaalle määrätään molempien lääkkeiden osalta pienin tehokas annos.
Hypotensiivisesti vaikuttavat lääkkeet
Markkinoille tulon jälkeen on todettu kliinisesti merkittävää hypotensiota, kun risperidonia käytettiin samanaikaisesti verenpainetta alentavan lääkityksen kanssa.
Psykostimulantit
Psykostimulanttien (esim. metyylifenidaatin) ja OKEDI-valmisteen samanaikainen käyttö voi johtaa ekstrapyramidaalioireisiin, jos toisen tai molempien lääkkeiden annostusta muutetaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Paliperidoni
OKEDI-valmisteen ja paliperidonin samanaikaista käyttöä ei suositella, koska paliperidoni on risperidonin aktiivinen metaboliitti, ja näiden lääkkeiden yhteiskäyttö voi johtaa additiiviseen vaikutukseen aktiivisen fraktion altistuksessa.
Farmakokinetiikkaan liittyvät yhteisvaikutukset
OKEDI metaboloituu pääasiassa sytokromi P (CYP) 2D6:n välityksellä ja vähemmässä määrin CYP3A4:n välityksellä. Sekä risperidoni että sen aktiivinen metaboliitti 9-hydroksirisperidoni ovat
P-glykoproteiinin (P-gp:n) substraatteja. CYP2D6:n aktiivisuutta muuttavat aineet tai CYP3A4:n ja/tai P-gp:n aktiivisuutta voimakkaasti estävät tai indusoivat aineet saattavat vaikuttaa risperidonin aktiivisen fraktion farmakokinetiikkaan.
Voimakkaat CYP2D6:n estäjät
OKEDI-valmisteen ja voimakkaan CYP2D6:n estäjän samanaikainen käyttö saattaa suurentaa plasman risperidonipitoisuutta, mutta aktiivisen fraktion pitoisuutta plasmassa vähemmän. Voimakas CYP2D6:n estäjä (esim. paroksetiini, ks. jäljempänä) saattaa suurina annoksina suurentaa risperidonin aktiivisen fraktion pitoisuutta. Muut CYP2D6:n estäjät, kuten kinidiini, saattavat oletettavasti vaikuttaa samalla tavoin plasman risperidonipitoisuuteen. Kun samanaikaisesti käytetyn paroksetiinin, kinidiinin tai muun voimakkaan CYP2D6:n estäjän käyttö etenkin suurina annoksina aloitetaan tai lopetetaan, lääkärin on arvioitava OKEDI-annos uudelleen.
CYP3A4:n tai P-gp:n estäjät
OKEDI-valmisteen ja voimakkaan CYP3A4:n tai P-gp:n estäjän samanaikainen käyttö saattaa suurentaa risperidonin aktiivisen fraktion pitoisuutta plasmassa huomattavasti. Kun itrakonatsolin tai muun voimakkaan CYP3A4:n tai P-gp:n estäjän samanaikainen käyttö aloitetaan tai lopetetaan, lääkärin on arvioitava OKEDI-annos uudelleen.
CYP3A4:n tai P-gp:n indusorit
OKEDI-valmisteen ja voimakkaan CYP3A4:n tai P-gp:n indusorin samanaikainen käyttö saattaa pienentää risperidonin aktiivisen fraktion pitoisuutta plasmassa. Kun karbamatsepiinin tai muun voimakkaan CYP3A4:n tai P-gp:n indusorin samanaikainen käyttö aloitetaan tai lopetetaan, lääkärin on arvioitava OKEDI-annos uudelleen. CYP3A4:n indusorien vaikutukset ovat aikariippuvaisia, ja maksimaalisen vaikutuksen saavuttaminen saattaa kestää vähintään 2 viikkoa hoidon aloittamisen jälkeen. Hoidon lopettamisen jälkeen CYP3A4:n induktion väheneminen saattaa vastaavasti kestää vähintään 2 viikkoa.
Proteiineihin voimakkaasti sitoutuvat lääkkeet
Kun risperidonia käytetään yhdessä proteiineihin voimakkaasti sitoutuvien lääkkeiden kanssa, kumpikaan lääke ei syrjäydy kliinisesti merkittävissä määrin plasman proteiineista.
Muita lääkkeitä samanaikaisesti käytettäessä kyseisen lääkkeen metaboliareitti ja mahdollinen annoksen säätämisen tarve on tarkistettava valmistetiedoista.
Esimerkkejä
Seuraavassa on lueteltu esimerkkejä lääkkeistä, joilla saattaa olla yhteisvaikutuksia risperidonin kanssa, tai joiden osalta on osoitettu, ettei yhteisvaikutuksia ole:
Muiden lääkevalmisteiden vaikutus risperidonin farmakokinetiikkaan
Bakteerilääkkeet:
- Erytromysiini, joka on kohtalainen CYP3A4:n estäjä ja P-gp:n estäjä, ei muuta risperidonin ja aktiivisen fraktion farmakokinetiikkaa.
- Rifampisiini, joka on voimakas CYP3A4:n indusori ja P-gp:n indusori, pienensi aktiivisen fraktion pitoisuutta plasmassa.
Koliiniesteraasin estäjät:
- Donepetsiilin ja galantamiinin, jotka ovat sekä CYP2D6:n että CYP3A4:n substraatteja, ei ole havaittu vaikuttavan kliinisesti merkittävällä tavalla risperidonin ja aktiivisen fraktion farmakokinetiikkaan.
Epilepsialääkkeet:
- Karbamatsepiinin, joka on voimakas CYP3A4:n indusori ja P-gp:n indusori, on osoitettu pienentävän aktiivisen fraktion pitoisuutta plasmassa. Samankaltaisia vaikutuksia saatetaan havaita käytettäessä esim. fenytoiinia tai fenobarbitaalia, jotka myös indusoivat CYP3A4- maksaentsyymiä ja P-glykoproteiinia.
- Topiramaatti vähensi risperidonin, mutta ei aktiivisen fraktion, hyötyosuutta hieman. Tällä yhteisvaikutuksella ei siten todennäköisesti ole kliinistä merkitystä.
Sienilääkkeet:
- Itrakonatsoli, joka on voimakas CYP3A4:n estäjä ja P-gp:n estäjä, suurensi annoksella 200 mg/vrk aktiivisen fraktion pitoisuutta plasmassa noin 70%, kun risperidoniannokset olivat 2–8 mg/vrk.
- Ketokonatsoli, joka on voimakas CYP3A4:n estäjä ja P-gp:n estäjä, suurensi annoksella 200 mg/vrk risperidonin pitoisuutta plasmassa ja pienensi 9-hydroksirisperidonin pitoisuutta plasmassa.
Psykoosilääkkeet:
- Fentiatsiinit saattavat suurentaa risperidonin, mutta eivät aktiivisen fraktion, pitoisuutta plasmassa.
Viruslääkkeet:
- Proteaasinestäjät: Muodollisia tutkimustietoja ei ole saatavilla, mutta koska ritonaviiri on voimakas CYP3A4:n estäjä ja heikko CYP2D6:n estäjä, ritonaviiri ja ritonaviirilla tehostetut proteaasinestäjät saattavat suurentaa risperidonin aktiivisen fraktion pitoisuutta.
Beetasalpaajat:
- Jotkin beetasalpaajat saattavat suurentaa risperidonin, mutta eivät aktiivisen fraktion, pitoisuutta plasmassa.
Kalsiuminestäjät:
- Verapamiili, joka on kohtalainen CYP3A4:n estäjä ja P-gp:n estäjä, suurentaa risperidonin ja aktiivisen fraktion pitoisuutta plasmassa.
Maha-suolikanavan lääkkeet:
- H2-reseptorin salpaajat: Simetidiini ja ranitidiini, jotka ovat heikkoja CYP2D6:n ja CYP3A4:n estäjiä, suurensivat risperidonin hyötyosuutta, mutta ne suurensivat aktiivisen fraktion hyötyosuutta vain marginaalisesti.
SSRI-lääkkeet ja trisykliset masennuslääkkeet:
- Fluoksetiini, joka on voimakas CYP2D6:n estäjä, suurentaa risperidonin pitoisuutta plasmassa, mutta aktiivisen fraktion pitoisuutta plasmassa vähemmän.
- Paroksetiini, joka on voimakas CYP2D6:n estäjä, suurentaa risperidonin pitoisuutta plasmassa, mutta enintään annoksina 20 mg/vrk käytettynä se suurentaa aktiivisen fraktion pitoisuutta vähemmän. Suuremmat paroksetiiniannokset saattavat kuitenkin suurentaa risperidonin aktiivisen fraktion pitoisuutta.
- Trisykliset masennuslääkkeet saattavat suurentaa risperidonin, mutta eivät aktiivisen fraktion, pitoisuutta plasmassa. Amitriptyliini ei vaikuta risperidonin eikä aktiivisen fraktion farmakokinetiikkaan.
- Sertraliiniin, joka on CYP2D6:n heikko estäjä, ja fluvoksamiiniin, joka on CYP3A4:n heikko estäjä, ei enintään annoksina 100 mg/vrk käytettynä liittynyt kliinisesti merkittäviä risperidonin aktiivisen fraktion pitoisuuden muutoksia. Yli 100 mg/vrk annoksina sertraliini tai fluvoksamiini saattavat kuitenkin suurentaa risperidonin aktiivisen fraktion pitoisuutta.
Risperidonin vaikutus muiden lääkevalmisteiden farmakokinetiikkaan
Epilepsialääkkeet:
- Risperidonilla ei ole kliinisesti merkittävää vaikutusta valproaatin tai topiramaatin farmakokinetiikkaan.
Psykoosilääkkeet:
- Aripipratsoli, CYP2D6:n ja CYP3A4:n substraatti: Risperidonitabletit tai -injektiot eivät vaikuttaneet aripipratsolin ja sen aktiivisen metaboliitin, dehydroaripipratsolin, yhteismäärän farmakokinetiikkaan.
Digitalisglykosidit:
- Risperidonilla ei ole kliinisesti merkittävää vaikutusta digoksiinin farmakokinetiikkaan.
Litium:
- Risperidonilla ei ole kliinisesti merkittävää vaikutusta litiumin farmakokinetiikkaan.
Risperidonin samanaikainen käyttö furosemidin kanssa
Ks. kohdasta Varoitukset ja käyttöön liittyvät varotoimet tiedot furosemidia samanaikaisesti käyttäneiden iäkkäiden dementiapotilaiden lisääntyneestä kuolleisuudesta.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja risperidonin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Psykoosilääkkeille (myös risperidonille) viimeisen raskauskolmanneksen aikana altistuneet vastasyntyneet ovat vaarassa saada haittavaikutuksia, mm. ekstrapyramidaali- ja/tai vieroitusoireita. Synnytyksen jälkeen ilmenevien oireiden vaikeusaste ja kesto voivat vaihdella. Kiihtymystä, hypertoniaa, hypotoniaa, vapinaa, uneliaisuutta, hengitysvaikeuksia ja syömishäiriöitä on ilmoitettu. Siksi vastasyntyneiden vointia on seurattava huolellisesti.
OKEDI-valmistetta ei pidä käyttää raskauden aikana, mikäli käyttö ei ole selvästi välttämätöntä.
Imetys
Fysikaalis-kemialliset tiedot viittaavat siihen, että risperidoni/metaboliitit erittyvät rintamaitoon. Imeväiseen kohdistuvia riskejä ei voida poissulkea.
On päätettävä lopetetaanko rintaruokinta vai lopetetaanko OKEDI-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Risperidoni suurentaa prolaktiinipitoisuutta. Hyperprolaktinemia saattaa vähentää GnRH:n erittymistä hypotalamuksesta, jolloin gonadotropiinin erittyminen aivolisäkkeestä vähenee. Tämä saattaa puolestaan estää lisääntymistoimintoja heikentämällä steroidien muodostumista sekä nais- että miespotilaiden sukupuolirauhasissa.
Ei-kliinisissä tutkimuksissa ei havaittu oleellisia vaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
OKEDI-valmisteella voi olla vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn, koska hermostoon ja näkökykyyn kohdistuvat vaikutukset ovat mahdollisia (ks. kohta Haittavaikutukset). Siksi potilaita kehotetaan välttämään autolla ajamista ja koneiden käyttöä, kunnes heidän yksilöllinen herkkyytensä tällaisille vaikutuksille on tiedossa.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Vaiheen 3 kliinisessä tutkimuksessa yleisimmin ilmoitettuja haittavaikutuksia olivat: veren prolaktiinipitoisuuden nousu (11,7%), hyperprolaktinemia (7,2%), akatisia (5,5%), päänsärky (4,8%),
uneliaisuus (4,1%), painonnousu (3,8%), pistoskohdan kipu (3,1%) ja huimaus (3,1%). Haittavaikutustaulukko
Seuraavassa on lueteltu kaikki risperidonin kliinisissä tutkimuksissa ja markkinoille tulon jälkeisessä käytössä ilmoitetut haittavaikutukset risperidonin kliinisten tutkimusten perusteella arvioidun yleisyyden mukaisesti.
Haittavaikutusten yleisyydet ilmoitetaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Elinjärjestelmä | Haittavaikutus | |||||
Yleisyys | ||||||
Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon | |
Infektiot |
| keuhkokuume, keuhkoputkitulehdus, ylähengitystieinfektio, sinuiitti,virtsatieinfektio, korvatulehdus, influenssa | hengitystieinfektio, kystiitti, silmätulehdus, tonsilliitti, kynsisilsa, paikallinen selluliitti, virusinfektio, akarodermatiitti | infektio |
|
|
Veri ja imukudos |
|
| neutropenia, veren valkosolumäärän lasku, trombosytopenia, anemia, hematokriittiarvon lasku, eosinofiiniarvon nousu | agranulosytoosic |
|
|
Immuunijärjestelmä |
|
| yliherkkyys | anafylaktinen reaktioc |
|
|
Umpieritys |
| hyperprolaktinemiaa |
| antidiureettisen hormonin epätarkoituksenmukainen eritys, glukosuria |
|
|
Aineenvaihdunta ja ravitsemus |
| painon nousu, ruokahalun lisääntyminen, ruokahalun heikkeneminen | diabetes mellitusb, hyperglykemia, polydipsia, painon lasku, ruokahaluttomuus, veren kolesterolipitoisuuden nousu, veren triglyseridipitoisuuden nousu | vesimyrkytysc, hypoglykemia, hyperinsulinemiac | diabeettinen ketoasidoosi |
|
Psyykkiset häiriöt | unettomuusd | unihäiriö, kiihtyneisyys, masennus, ahdistuneisuus | mania, sekavuus, sukupuolinen haluttomuus, hermostuneisuus, painajaiset | katatonia, unissakävely, uneen liittyvä syömishäiriö, tunnetilojen latistuminen, orgasmivaikeudet |
|
|
Elinjärjestelmä | Haittavaikutus | |||||
Yleisyys | ||||||
Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon | |
Hermosto | parkinsonismid, päänsärky | sedaatio/ uneliaisuus, akatisiad, dystoniad, heitehuimaus, dyskinesiad, vapina | tardiivi dyskinesia, aivoiskemia, tajunnan menetys, kouristuksetd, pyörtyminen, psykomotorinen yliaktiivisuus, tasapainohäiriö, koordinaation poikkeavuudet, asentohuimaus, tarkkaavuushäiriö, dysartria, makuhäiriö, hypestesia, parestesia | maligni neuroleptioireyhtymä, aivoverisuonihäiriö, diabeettinen kooma, pään vapina, reagoimattomuus ärsykkeisiin, tajunnan tason aleneminen |
|
|
Silmät |
| näön sumeneminen, sidekalvotulehdus | valonarkuus, kuivat silmät, lisääntynyt kyynelnesteen eritys, silmien verekkyys | glaukooma, silmien liikehäiriö, silmien pyöriminen, silmäluomen reunan karstoittuminen, velton värikalvon oireyhtymä (leikkauksen yhteydessä)c |
|
|
Kuulo ja tasapainoelin |
|
| kiertohuimaus, tinnitus, korvakipu |
|
|
|
Sydän |
| takykardia | eteisvärinä, eteis- kammiokatkos, johtumishäiriö, EKG:ssä havaittava QT- ajan piteneminen, bradykardia, EKG-poikkeamat, sydämentykytys | sinusperäinen rytmihäiriö |
|
|
Verisuonisto |
| hypertensio | hypotensio, ortostaattinen hypotensio, kasvojen punoitus | keuhkoembolia, laskimotromboosi |
|
|
Elinjärjestelmä | Haittavaikutus | |||||
Yleisyys | ||||||
Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon | |
Hengityselimet, rintakehä ja välikarsina |
| hengenahdistus, nielun ja kurkunpään kipu, yskä, nenän tukkoisuus | hengitysteiden verentungos, hengityksen vinkuminen, nenäverenvuoto | uniapneaoireyhtymä, hyperventilaatio, keuhkojen rahina, aspiraatiokeuhkokuume, keuhkostaasi, dysfonia, hengityshäiriö |
|
|
Ruoansulatuselimistö |
| vatsakipu, epämiellyttävät tuntemukset vatsassa, oksentelu, pahoinvointi, ummetus, ripuli, ruoansulatus vaivat, suun kuivuminen, hammassärky | ulosteenpidätyskyvyttömyys, fekalooma, gastroenteriitti, nielemishäiriö, ilmavaivat | haimatulehdus, suolitukos, kielen turpoaminen, huulitulehdus | ileus |
|
Maksa ja sappi |
|
| transaminaasiarvojen nousu, gammaglutamyylitransferaasiarvon nousu, maksaentsyymiarvojen nousu | keltaisuus |
|
|
Iho ja ihonalainen kudos |
| ihottuma, punoitus | nokkosihottuma, kutina, hiustenlähtö, hyperkeratoosi, ekseema, kuiva iho, ihon värimuutokset, akne, seborrooinenc ihottuma, ihosairaus, iholeesio | lääkeihottuma, hilse | angioedeema | Stevens- Johnsonin oireyhtymä / toksinen epidermaalinen nekrolyysic |
Elinjärjestelmä | Haittavaikutus | |||||
Yleisyys | ||||||
Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon | |
Luusto, lihakset ja sidekudos |
| lihasspasmit, tuki- ja liikuntaelimistön kipu, selkäkipu, nivelkipu | veren kreatiinifosfokinaasipitoisuuden nousu, poikkeava ryhti, nivelten jäykkyys, nivelten turpoaminen, lihasheikkous, niskakipu | rabdomyolyysi |
|
|
Munuaiset ja virtsatiet |
| virtsanpidätyskyvyttömyys | tiheävirtsaisuus, virtsaumpi, virtsaamisvaivat |
|
|
|
Raskauteen, synnytykseen ja perinataalikauteen liittyvät haitat |
|
|
| vastasyntyneen vieroitusoireyhtymäc |
|
|
Sukupuolielimet ja rinnat |
|
| erektiohäiriö, ejakulaatiohäiriö, amenorrea, kuukautishäiriöd, gynekomastia, maidonvuoto, seksuaalinen toimintahäiriö, rintojen kipu, epämiellyttävä tunne rinnoissa, erite emättimestä | priapismic, kuukautisten viivästyminen, rintojen turpoaminen, rintojen suureneminen, erite rinnoista |
|
|
Yleisoireet ja antopaikassa todettavat haitat |
| turvotusd, kuume, rintakipu, voimattomuus, väsymys, kipu | kasvojen turvotus, vilunväreet, ruumiinlämmön nousu, poikkeava kävely, jano, epämiellyttävä tunne rinnassa, huonovointisuus, epänormaali olo, epämukavuus | hypotermia, ruumiinlämmön lasku, ääreisosien kylmyys, vieroitusoireyhtymä, kovettumac |
|
|
Vammat, myrkytykset ja hoitokomplikaatiot | Kaatuminen, pistoskohdan kipu, pistoskohdan turvotus | toimenpiteeseen liittyvä kipu, epämiellyttävä tunne pistoskohdassa, pistoskohdan punoitus | ||||
a Hyperprolaktinemiasaattaa joissakin tapauksissa aiheuttaa gynekomastiaa, kuukautishäiriöitä, amenorreaa, anovulaatiota, maidonvuotoa, hedelmällisyyden häiriöitä, sukupuolista haluttomuutta tai erektiohäiriöitä. b Lumekontrolloiduissa tutkimuksissa diabetesta raportoitiin 0,18%:lla risperidonihoitoa saaneista tutkittavista verrattuna 0,11%:n esiintyvyyteen lumeryhmässä. Kokonaisilmaantuvuus kaikissa kliinisissä tutkimuksissa risperidonia saaneilla tutkittavilla oli 0,43%. c Ei todettu risperidonilla tehdyissä kliinisissä tutkimuksissa, mutta todettu risperidonin markkinoille tulon jälkeisessä käytössä. d Ekstrapyramidaalihäiriöitä voi esiintyä: parkinsonismi (runsas syljeneritys, luurankolihasten jäykkyys, parkinsonismi, kuolaaminen, hammasratasilmiö, bradykinesia, hypokinesia, kasvojen ilmeettömyys, lihaskireys, akinesia, niskajäykkyys, lihasjäykkyys, parkinsonistinen kävely, epänormaali glabellaheijaste ja parkinsonistinen lepovapina), akatisia (akatisia, levottomuus, hyperkinesia ja levottomat jalat -oireyhtymä), vapina, dyskinesia (dyskinesia, lihasten nykiminen, koreoatetoosi, atetoosi ja myoklonus), dystonia. Dystonia kattaa seuraavat oireet: dystonia, hypertonia, torticollis, tahdosta riippumattomat lihassupistukset, lihaskontraktuura, luomikouristus, silmien kiertoliike, kielihalvaus, kasvojen spasmi, laryngospasmi, myotonia, opistotonus, suunieluspasmi, pleurototonus, kielispasmi ja leukalukko. On huomattava, että luettelo sisältää laajan kirjon oireita, joiden syntymekanismi ei välttämättä ole ekstrapyramidaalinen. Unettomuus kattaa seuraavat: nukahtamisvaikeus, katkonainen uni. Kouristukset kattaa seuraavat: grand mal -kouristukset. Kuukautishäiriöt kattaa seuraavat: epäsäännölliset kuukautiset, harvatkuukautiset. Turvotus kattaa seuraavat: yleistynyt turvotus, raajojen turvotus, kuoppaturvotus. |
Valikoitujen haittavaikutusten kuvaukset
Pistoskohdan reaktiot
Kipu oli yleisimmin raportoitu pistoskohtaan liittyvä haittavaikutus. Vaiheen 3 tutkimuksessa
14 potilasta 386:sta (3,6%) raportoi 18 tapahtumaa, joissa esiintyi pistoskohdan kipua, kun annettuja OKEDI-injektioita oli yhteensä 2 827 (0,6%). Suurin osa näistä raportoiduista vaikutuksista oli vaikeusasteeltaan lieviä tai keskivaikeita. Tutkittavien visuaalisella analogiasteikolla antamien arvioiden perusteella pistoskohdan kivun yleisyys ja voimakkuus useimmiten vähenivät ajan mittaan.
Sydän
Posturaalinen ortostaattinen takykardiaoireyhtymä
Luokkavaikutukset
Risperidonin markkinoille tulon jälkeen on hyvin harvinaisissa tapauksissa raportoitu QT-ajan pitenemiseen liittyviä kammioperäisiä rytmihäiriöitä (kammiovärinä, kammiotakykardia), äkkikuolemia, sydänpysähdyksiä ja kääntyvien kärkien takykardiaa.
Laskimotromboembolia
Psykoosilääkkeiden käytön yhteydessä on raportoitu laskimotromboembolioita, mukaan lukien keuhkoembolioita ja syviä laskimotukoksia (näiden yleisyys on tuntematon).
Painon muutokset
12 viikkoa kestäneestä kaksoissokkoutetusta, lumekontrolloitusta tutkimuksesta saatujen tietojen mukaan OKEDI-valmistetta 75 mg saaneiden tutkittavien paino oli noussut hoidon jälkeen keskimäärin 1,4 (-8–18) kg, OKEDI-valmistetta 100 mg saaneiden 0,8 (-8–47) kg ja lumelääkettä
saaneiden 0,2 (-12–18) kg lähtötilanteeseen nähden.
Erityisryhmiä koskevia lisätietoja
Pediatriset potilaat
OKEDI-valmisteen tehosta ja turvallisuudesta lapsilla ei ole tietoja.
Iäkkäät potilaat
OKEDI-valmisteen tehosta ja turvallisuudesta iäkkäillä skitsofrenia- tai dementiapotilailla on vain vähän tietoja. Suun kautta otetulla risperidonilla tehdyissä kliinisissä tutkimuksissa ohimeneviä aivoverenkiertohäiriöitä raportoitiin 1,4%:lla ja aivoverenkiertohäiriöitä 1,5%:lla iäkkäistä dementiapotilaista, mikä oli enemmän kuin muilla aikuispotilailla. Lisäksi seuraavia haittavaikutuksia raportoitiin ≥ 5%:lla iäkkäistä dementiapotilaista, ja niiden yleisyys oli vähintään kaksinkertainen verrattuna muihin aikuispopulaatioihin: virtsatieinfektio, ääreisosien turvotus, letargia ja yskä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Raportoidut oireet ja löydökset ovat yleensä johtuneet risperidonin tunnettujen farmakologisten vaikutusten ylikorostumisesta. Oireita ovat olleet väsymys ja sedaatio, takykardia ja hypotensio sekä ekstrapyramidaalioireet. Yliannostuksen yhteydessä on raportoitu QT-ajan pitenemistä ja kouristuksia. Risperidonin ja paroksetiinin samanaikaisen yliannostuksen yhteydessä on raportoitu kääntyvien kärkien takykardiaa.
Akuutin yliannostuksen tapauksessa on huomioitava mahdollinen useiden lääkkeiden osallisuus.
Hoito
Hengitystiet on pidettävä vapaina, ja riittävä hapen saanti ja ventilaatio on varmistettava. Kardiovaskulaarinen seuranta on aloitettava välittömästi, ja sisältäen EKG:n jatkuvan seurannan mahdollisten rytmihäiriöiden havaitsemiseksi.
OKEDI-valmisteelle ei ole spesifistä vastalääkettä. Siksi potilaalle on annettava asianmukaista elintoimintoja tukevaa hoitoa. Hypotensiota ja mahdollista verenkiertosokkia on hoidettava asianmukaisesti laskimonsisäisellä nesteytyksellä ja/tai sympatomimeettisillä lääkkeillä. Vaikeiden ekstrapyramidaalioireiden tapauksessa potilaalle on annettava antikolinergista lääkettä. Tiivistä lääketieteellistä valvontaa ja seurantaa on jatkettava potilaan toipumiseen asti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Psykoosilääkkeet, muut psykoosilääkkeet, ATC-koodi: N05AX08.
Vaikutusmekanismi
Risperidoni on selektiivinen monoamiinien vaikutuksia salpaava aine, jolla on ainutlaatuisia ominaisuuksia. Se sitoutuu voimakkaasti serotonergisiin 5-HT2- ja dopaminergisiin D2-reseptoreihin. Risperidoni salpaa myös alfa 1-adrenergisia reseptoreita ja jonkin verran heikommin H1-histaminergisiä ja alfa 2-adrenergisia reseptoreita. Risperidoni ei sitoudu kolinergisiin reseptoreihin. Vaikka risperidoni onkin voimakas D2-reseptoriantagonisti, jonka vaikutuksen odotetaan lievittävän skitsofrenian positiivisia oireita, se heikentää motorisia toimintoja vähemmän ja aiheuttaa vähemmän katalepsiaa kuin perinteiset psykoosilääkkeet. Tasapainoinen sentraalinen serotoniini- ja dopamiiniantagonismi saattaa vähentää ekstrapyramidaalisia haittavaikutuksia ja laajentaa terapeuttista aktiivisuutta skitsofrenian negatiivisiin ja affektiivisiin oireisiin.
Farmakodynaamiset vaikutukset
Kliininen teho
OKEDI-valmisteen (75 mg ja 100 mg) teho aikuisten skitsofrenian hoidossa vahvistettiin yhdessä vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, rinnakkaisryhmillä toteutetussa monikeskustutkimuksessa. Tutkimukseen otettiin potilaita, joilla oli parhaillaan skitsofrenian akuutti pahenemisvaihe tai relapsi (DSM-5-kriteerit) ja joiden lähtötilanteen pistearvo skitsofrenian positiivisten ja negatiivisten oireiden asteikolla (PANSS) oli 80–120. Seulontakäynnillä kaikki potilaat, jotka eivät olleet aiemmin saaneet risperidonia, saivat ensin suun kautta otettavaa risperidonia 2 mg/vrk kolmen päivän ajan sen varmistamiseksi, ettei yliherkkyysreaktioita ilmenisi. Potilaat, joita oli aiemmin hoidettu risperidonilla, eivät saaneet seulontavaiheessa suun kautta otettavaa risperidonia vaan aloittivat suoraan OKEDI-hoidon (75 mg tai 100 mg) tai lumehoidon satunnaistamisen jälkeen. Yhteensä 438 potilasta satunnaistettiin saamaan kolme annosta OKEDI- valmistetta (75 mg tai 100 mg) tai lumelääkettä lihakseen 28 päivän välein. Potilaiden keski-ikä oli 42,0 (keskihajonta: 11,02) vuotta. Tutkimukseen ei osallistunut < 18-vuotiaita tai > 65-vuotiaita potilaita. Demografiset muut lähtötilanteen ominaisuudet olivat hoitoryhmissä samankaltaiset.
Tutkimuksen aikana ei sallittu ylimääräisen suun kautta otettavan risperidonin käyttöä.
Ensisijainen päätetapahtuma oli PANSS-kokonaispisteiden muutos lähtötilanteesta tutkimuksen päättymiseen (päivä 85). Ensisijaisen päätetapahtuman osalta sekä OKEDI-valmisteen 75 mg:n että 100 mg:n annoksilla todettiin tilastollisesti merkitsevä paranema lumelääkkeeseen verrattuna (Taulukko 1 ja Kuva 1). Tulokset tukevat koko hoidon ajan kestävää tehoa ja PANSS-pisteiden paranemista, ja vaikutus oli todettavissa jo päivänä 4. Lumelääkkeeseen verrattuna merkittävä ero oli nähtävissä 100 mg:n ryhmässä päivään 8 mennessä ja 75 mg:n ryhmässä päivään 15 mennessä.
PANSS-kokonaispisteiden tavoin myös PANSS-pisteiden kolmessa, positiivisten, negatiivisten ja yleisten psykopatologisten oireiden alaosiossa havaittiin paranemista (pistemäärän pienenemistä) lähtötilanteesta ajan mittaan.
Taulukko 1: PANSS- ja CGI-S-kokonaispisteiden keskimääräinen muutos lähtötilanteesta tutkimuksen päättymiseen (päivä 85) (mITT-populaatio)
| Lumelääke N = 132 | OKEDI 75 mg N = 129 | OKEDI 100 mg N = 129 | |
| PANSS-kokonaispisteet(a) | |||
| Keskimääräiset pisteet lähtötilanteessa (keskihajonta) | 96,4 (7,21) | 96,3 (8,47) | 96,1 (8,42) |
Muutoksen pienimmän neliösumman keskiarvo, 95%:n luottamusväli(a) | -11,0, -14,1...-8,0 | -24,6, -27,5...-21,6 | -24,7, -27,7...-21,6 |
| Hoitoero, 95%:n luottamusväli(b) | -13,0, -17,3...-8,8 | -13,3, -17,6...-8,9 | |
| P-arvo | < 0,0001 | < 0,0001 | |
| CGI-S-kokonaispisteet(c) | |||
| Keskimääräiset pisteet lähtötilanteessa (keskihajonta) | 4,9 (0,52) | 5,0 (0,65) | 4,9 (0,48) |
Muutoksen pienimmän neliösumman keskiarvo, 95%:n luottamusväli(a) | -0,6, -0,8...-0,4 | -1,3, -1,5...-1,2 | -1,3, -1,5...-1,2 |
| Hoitoero, 95%:n luottamusväli(b) | -0,7, -1,0...-0,5 | -0,7, -1,0...-0,5 | |
| P-arvo | < 0,0001 | < 0,0001 | |
a Tiedot analysoitiin toistomittausten sekamallia (MMRM) käyttäen.
b Ero (OKEDI miinus lumelääke) pienimmän neliösumman keskiarvossa muutokselle lähtötilanteesta korjattiin Lawrencen ja Hungin menetelmällä.
c Lääkärin yleisarviossa sairauden vaikeusasteesta (CGI-S) lääkäriä pyydetään vastaamaan yhteen kysymykseen: ”Kun otetaan huomioon kokonaisvaltainen kliininen kokemuksesi tästä nimenomaisesta potilaspopulaatiosta, miten psyykkisesti sairas potilas on tällä hetkellä?” Vastaus annetaan seuraavalla 7-portaisella asteikolla: 1 = normaali, ei lainkaan sairas; 2 = rajatapaus psyykkisen sairauden suhteen; 3 = lievästi sairas; 4 = kohtalaisen sairas; 5 = huomattavan sairas; 6 = vaikeasti sairas; 7 = yksi vaikeimmin sairaista potilaista.
Kuva 1: PANSS-kokonaispisteiden muutos lähtötilanteesta kaksoissokkoutetun vaiheen kussakin aikapisteessä (mITT-populaatio)
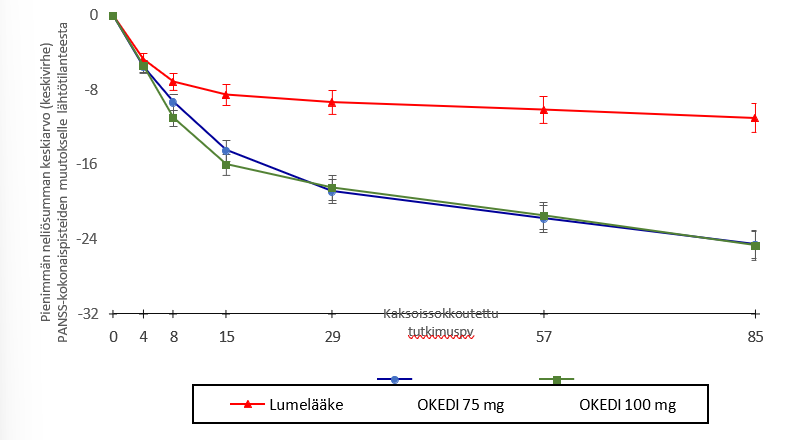
| Vs. lumelääke | |||||
OKEDI 75 mg | *** | **** | **** | **** | |
OKEDI 100 mg | ** | **** | **** | **** | **** |
** p < 0,01; *** p < 0,001; **** p < 0,0001.
Tärkein toissijainen tehon päätetapahtuma oli lääkärin yleisarviossa sairauden vaikeusasteesta (CGI-S) tapahtunut keskimääräinen muutos lähtötilanteesta päivänä 85. Molemmissa OKEDI-hoitoryhmissä todettiin tilastollisesti merkitsevästi paremmat CGI-S-pisteet kuin lumeryhmässä päivästä 8 eteenpäin. Pienenemä lähtötilanteen pisteistä oli -0,4 (0,05) 75 mg:n ryhmässä ja -0,6 (0,05) 100 mg:n ryhmässä.
Kokonaisvasteen (PANSS-kokonaispisteiden pienentyminen > 30% ja/tai CGI-I-arviona joko 2 eli ”suuri parannus” tai 1 eli ”hyvin suuri parannus”) saavuttaneiden osuus päätetapahtuman ajankohtana oli OKEDI-valmisteella 56%. Kokonaisvasteen saavuttaneiden osuus oli kummallakin annoksella tilastollisesti merkitsevä lumelääkkeeseen verrattuna päivästä 8 ja päivästä 15 eteenpäin.
OKEDI-valmisteen pitkäaikaistehoa (12 kuukauden ajalta) arvioitiin päätutkimuksen avoimessa jatkovaiheessa 215 skitsofreniapotilaalla. Jatkotutkimukseen otettiin potilaita kaksoissokkoutetusta vaiheesta (siirtyviä potilaita) ja lisäksi tilaltaan vakaita potilaita, jotka eivät olleet osallistuneet tutkimukseen aiemmin (uusia potilaita). Uudet potilaat siirrettiin suun kautta otettavasta risperidonista OKEDI-hoitoon annoksella 75 mg tai 100 mg. Teho säilyi ajan kuluessa. Relapsiprosentti oli 10,7% (95%:n luottamusväli 6,9–15,6%) ja remissioprosentti 61,0% (95%:n luottamusväli 53,7–68,4%).
Farmakokinetiikka
Risperidoni metaboloituu 9-hydroksirisperidoniksi, jolla on samankaltainen farmakologinen vaikutus kuin risperidonilla (ks. Biotransformaatio ja Eliminaatio).
Imeytyminen
OKEDI-valmisteen sisältämä risperidoni on suspensiomuodossa ja noudattaa yhdistettyä imeytymisprosessia. Pieni määrä lääkettä vapautuu välittömästi lihakseen injektoinnin yhteydessä ja suurentaa pitoisuudet plasmassa vaikuttavalle tasolle. Ensimmäisen pitoisuushuipun saavuttamisen jälkeen keskimääräiset pitoisuudet plasmassa pienenevät tasaisesti päivään 14 saakka ja lähtevät sitten taas nousuun siten, että toinen pitoisuushuippu saavutetaan noin päivän 21 ja päivän 24 välisenä aikana. Toisen pitoisuushuipun jälkeen pitoisuudet plasmassa pienenevät vähitellen ajan mittaan.
Suspensio muodostaa lääkevaraston, joka ylläpitää terapeuttisia pitoisuuksia plasmassa 28 päivän annosvälin ajan.
Lihakseen annetun OKEDI-kertainjektion jälkeen aktiivisen fraktion keskimääräinen pitoisuus, joka on 75 mg:n annoksella 13 ± 9 ng/ml ja 100 mg:n annoksella 29 ± 13 ng/ml, saavutetaan 2 tunnissa annosta. Aktiivisen fraktion pitoisuus plasmassa kuukauden kuluttua lääkkeen antamisesta on 17 ± 8 ng/ml 75 mg:n annoksella ja 21 ± 17 ng/ml 100 mg:n annoksella, ja useimmilla potilailla lääke on kokonaan eliminoitunut 75 päivän kuluttua annosta, jolloin aktiivisen fraktion pitoisuus on alle 1 ng/ml.
Aktiivisen fraktion keskimääräiset pienimmät pitoisuudet plasmassa (Ctrough) ja keskimääräiset huippupitoisuudet plasmassa (Cmax) toistuvien lihakseen annettujen OKEDI-injektioiden jälkeen on esitetty Taulukko 2.
Taulukko 2: Aktiivisen fraktion Ctrough ja Cmax toistuvien lihakseen annettujen OKEDI-injektioiden jälkeen
| Annos | Ctrough (SD) ng/ml | Cmax (SD) ng/ml |
| 75 mg(a) | 17,6 | 35,9 |
| 100 mg(b) | 28,9 (13,7) | 69,7 (27,8) |
a Yhteenveto farmakokineettisten muuttujien simuloiduista arvioista kolmannen OKEDI 75 mg -annoksen jälkeen populaatiofarmakokineettisessä mallissa
b Yhteenveto tilastollisista farmakokineettisistä muuttujista neljännen OKEDI 100 mg -annoksen jälkeen kliinisessä moniannostutkimuksessa
SD: keskihajonta
Vakaan tilan pitoisuudet saavutettiin tyypillisellä tutkittavalla ensimmäisen annoksen jälkeen.
Keskimääräinen vakaan tilan altistus oli samankaltainen riippumatta siitä, annettiinko injektio hartia- vai pakaralihakseen.
Jakautuminen
Risperidoni jakautuu nopeasti. Jakautumistilavuus on 1–2 l/kg. Risperidoni sitoutuu plasmassa albumiiniin ja happamaan alfa 1-glykoproteiiniin. Risperidonista 90% ja 9-hydroksirisperidonista 77% sitoutuu plasman proteiineihin.
Biotransformaatio ja eliminaatio
Risperidoni metaboloituu CYP2D6:n välityksellä 9-hydroksirisperidoniksi, jolla on samankaltainen farmakologinen vaikutus kuin risperidonilla. Risperidoni ja 9-hydroksirisperidoni muodostavat yhdessä aktiivisen fraktion. CYP2D6-entsyymeissä ilmenee geneettistä polymorfiaa. Nopeilla CYP2D6-metaboloijilla risperidoni muuttuu nopeasti 9-hydroksirisperidoniksi, kun taas hitailla metaboloijilla muuttuminen tapahtuu paljon hitaammin. Vaikka nopeilla metabolojilla risperidonipitoisuus on pienempi ja 9-hydroksirisperidonipitoisuus suurempi kuin hitailla metaboloijilla, risperidonin ja 9-hydroksirisperidonin yhdistetyt farmakokineettiset ominaisuudet (aktiivinen fraktio) kerta-annoksen ja useiden annosten jälkeen ovat samankaltaiset nopeilla ja hitailla CYP2D6-metaboloijilla.
Toinen risperidonin metaboliareitti on N-dealkylaatio. Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittivat, että kliinisesti oleellisina pitoisuuksina risperidoni ei merkittävästi estä sytokromi P450-isoentsyymien, kuten CYP1A2, CYP2A6, CYP2C8/9/19, CYP2D6, CYP2E1, CYP3A4 ja CYP3A5, välityksellä metaboloituvien lääkeaineiden metaboliaa. Viikon kuluttua lääkkeen antamisesta 70% annoksesta on erittynyt virtsaan ja 14% ulosteeseen. Virtsassa risperidonin ja 9-hydroksirisperidonin osuus annoksesta on 35–45%. Loppu on inaktiivisia metaboliitteja. Kun risperidonia annetaan suun kautta psykoosipotilaille, sen eliminaation puoliintumisaika on noin 3 tuntia. 9-hydroksirisperidonin ja aktiivisen fraktion eliminaation puoliintumisaika on 24 tuntia.
Aktiivinen fraktio on eliminoitunut 75 päivän kuluessa OKEDI-valmisteen annosta, jolloin aktiivisen fraktion pitoisuus on useimmilla potilailla alle 1 ng/ml.
OKEDI-injektio verrattuna suun kautta otettavaan risperidoniin
Plasman lääkeainepitoisuudet OKEDI-hoidon aloitusvaiheessa olivat altistusalueella, joka saavutetaan suun kautta otettavalla 3–4 mg:n risperidoniannoksella. Vakaan tilan altistus OKEDI 100 mg -annoksen jälkeen oli AUC-arvon osalta 39% suurempi, Cmax-arvon osalta 32% suurempi ja Cmin-arvon osalta samankaltainen verrattuna suun kautta otettavaan 4 mg:n risperidoniannokseen.
Populaatiofarmakokineettiseen mallinnukseen perustuvat simulaatiot osoittivat, että OKEDI 75 mg -annoksella saavutettava altistus on samaa luokkaa kuin suun kautta otettavalla 3 mg:n risperidoniannoksella vakaassa tilassa.
Siirryttäessä suun kautta otettavasta risperidonista OKEDI-hoitoon aktiivisen fraktion altistuksen ennustetaan olevan samankaltaisella alueella, myös huippupitoisuuksien suhteen.
Lineaarisuus/ei-lineaarisuus
OKEDI-valmisteen farmakokinetiikan on todettu olevan lineaarinen ja annoksesta riippuva annoksilla 75 mg ja 100 mg.
Iäkkäät
OKEDI-valmistetta ei ole systemaattisesti tutkittu iäkkäillä potilailla (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
OKEDI-valmistetta ei ole systemaattisesti tutkittu munuaisten vajaatoimintaa sairastavilla potilailla. OKEDI-valmistetta saaneilla lievää munuaisten vajaatoimintaa (kreatiniinipuhdistuma 60–89 ml/min) sairastavilla potilailla todettu aktiivisen fraktion altistus oli samaa luokkaa kuin potilailla, joiden munuaiset toimivat normaalisti.
Tietoja potilaista, joilla on keskivaikea tai vaikea munuaissairaus, ei ole saatavilla.
Maksan vajaatoiminta
OKEDI-valmistetta ei ole systemaattisesti tutkittu maksan vajaatoimintaa sairastavilla potilailla.
Painoindeksi
Populaatiofarmakokineettiset simulaatiot ovat osoittaneet, että OKEDI-valmisteen pitoisuudet plasmassa saattavat suurentua lihavilla tai sairaalloisen lihavilla naisilla verrattuna normaalipainoisiin potilaisiin, mutta tämän kliininen vaikutus on merkityksetön.
Sukupuoli, rotu ja tupakointi
Populaatiofarmakokineettisessä analyysissa sukupuolella, rodulla tai tupakoinnilla ei todettu olevan ilmeistä vaikutusta risperidonin tai aktiivisen fraktion farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Eläinmalleilla on osoitettu in vitro ja in vivo, että suuret risperidoniannokset saattavat aiheuttaa QT- ajan pitenemistä. QT-ajan piteneminen on yhdistetty kääntyvien kärkien takykardian teoreettisesti suurentuneeseen riskiin potilailla.
(Sub)kroonista oraalista toksisuutta selvittäneissä tutkimuksissa, joissa lääkkeen anto aloitettiin sukupuolisesti kehittymättömille rotille ja koirille, annoksesta riippuvia vaikutuksia havaittiin urosten ja naaraiden sukuelimissä ja maitorauhasissa. Nämä vaikutukset liittyivät kohonneisiin seerumin prolaktiinipitoisuuksiin, jotka johtuivat risperidonin D2-dopamiinireseptoreja salpaavasta vaikutuksesta. Lisäksi kudosviljelytutkimukset viittaavat siihen, että prolaktiini saattaa kiihdyttää solujen kasvua ihmisen rintarauhaskasvaimissa.
Merkittävimmät OKEDI-hoidon vaikutukset, joita todettiin kroonista (lääkettä annettiin 12 kuukauden ajan lihakseen) toksisuutta selvittäneissä tutkimuksissa koirilla ja kaniineilla, vastasivat risperidonin oraalisen annon jälkeen todettuja löydöksiä rotilla ja koirilla ja liittyivät risperidonin farmakologisiin vaikutuksiin.
Koirilla ja kaniineilla tehdyissä 12 syklin toksisuustutkimuksissa OKEDI-valmisteen lihakseen annon jälkeen todettiin paikallisia muutoksia (kyhmyjä) pistoskohdassa. Ne muodostuivat lihaksensisäisen vierasaineen aiheuttamasta granulomatoottisesta tulehduksesta, jonka katsottiin olevan elimistön luonnollinen reaktio vierasaineelle. Muut paikalliset muutokset, joita todettiin kaniineilla annoksella 15 mg/kg (risperidonia), liittyivät valmisteen sisältämään dimetyylisulfoksidiin. Kaikki nämä muutokset olivat täysin paikallisia, ja niiden korjaantumisesta saatiin näyttöä. Koirilla valmisteen sisältämään dimetyylisulfoksidiin liittyvää ohimenevää kipua todettiin välittömästi valmisteen antamisen jälkeen.
Risperidonin tai OKEDI-valmisteen genotoksisuudesta ei havaittu näyttöä.
Oraalisen risperidonin karsinogeenisuutta selvittäneissä tutkimuksissa rotilla ja hiirillä havaittiin aivolisäkkeen adenoomien (hiirillä), haiman endokriinisten adenoomien (rotilla) ja maitorauhasen adenoomien (molemmilla lajeilla) lisääntymistä. Nämä kasvaimet saattavat liittyä pitkäaikaiseen D2-dopamiiniantagonismiin ja hyperprolaktinemiaan. Näiden jyrsijöillä todettujen kasvainlöydösten merkitystä ihmisille ei tunneta.
Risperidoni ei ollut teratogeeninen rotilla eikä kaniineilla. Rotilla tehdyissä risperidonin lisääntymistoksisuutta selvittäneissä tutkimuksissa havaittiin vanhempien parittelukäyttäytymiseen sekä jälkeläisten syntymäpainoon ja eloonjäämiseen kohdistuvia haittavaikutuksia. Rotilla risperidonille altistumiseen kohdussa liittyi kognitiivisia puutoksia aikuisiässä. Tiineille eläimille annettujen muiden dopamiiniantagonistien on todettu vaikuttavan haitallisesti jälkeläisten oppimiskykyyn ja motoriseen kehitykseen.
Nuorilla rotilla tehdyssä toksisuustutkimuksessa havaittiin lisääntynyttä poikaskuolleisuutta ja fyysisen kehityksen hidastumista. Nuorilla koirilla tehdyssä 40 viikkoa kestäneessä tutkimuksessa koirien sukupuolinen kypsyminen viivästyi. AUC-arvon perusteella 3,6-kertainen ihmisen suurin altistus nuorille (1,5 mg/vrk) ei vaikuttanut koirien pitkien luiden kasvuun, mutta 15-kertaisen ihmisen suurimman altistuksen nuorille havaittiin vaikuttavan pitkiin luihin ja sukupuoliseen kypsymiseen.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine esitäytetyssä ruiskussa
Poly(D,L-laktidi-ko-glykolidi)
Liuotin esitäytetyssä ruiskussa
Dimetyylisulfoksidi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
3 vuotta
OKEDI on käytettävä heti käyttökuntoon saattamisen jälkeen.
Säilytys
Säilytä alle 30 ºC.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle. Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OKEDI injektiokuiva-aine ja liuotin, depotsuspensiota varten
75 mg (L:ei) 1 pakkaus (2 neulaa) (230,79 €)
100 mg (L:ei) 1 pakkaus (2 neulaa) (275,01 €)
PF-selosteen tieto
Kuiva-ainetta sisältävä esitäytetty ruisku
Syklisestä olefiinipolymeeristä valmistettu ruisku, jossa on suuttimen peittävä korkki ja klorobutyylikumista valmistettu ja polytetrafluoroetyleenillä pinnoitettu männän pysäytin.
Liuotinta sisältävä esitäytetty ruisku
Syklisestä olefiinipolymeeristä valmistettu ruisku, jossa on kärjen peittävä korkki ja bromobutyylikumista valmistettu ja etyleeni-tetrafluoroetyleenikopolymeerillä pinnoitettu männän pysäytin.
Annokset erottaa toisistaan liuotinta sisältävän esitäytetyn ruiskun sormituen värin perusteella: 100 mg sininen ja 75 mg punainen.
Liuotin käyttökuntoon saattamiseen on saatavana seuraavina annosvahvuuksina:
- Liuotinta sisältävä esitäytetty ruisku, joka sisältää 0,383 ml dimetyylisulfoksidia (liuotin OKEDI 75 mg -valmisteelle).
- Liuotinta sisältävä esitäytetty ruisku, joka sisältää 0,490 ml dimetyylisulfoksidia (liuotin OKEDI 100 mg -valmisteelle).
Yksi OKEDI-pakkaus sisältää seuraavat:
- Alumiinifoliopussi, joka sisältää yhden kuiva-ainetta sisältävän esitäytetyn ruiskun ja silikageelikuivatusainepussin.
- Alumiinifoliopussi, joka sisältää yhden liuotinta sisältävän esitäytetyn ruiskun ja silikageelikuivatusainepussin.
- Yksi turvasuojuksella varustettu steriili 2 tuuman (0,90 x 51 mm [20G]) injektioneula, pakaralihakseen annettavaan injektioon.
- Yksi turvasuojuksella varustettu steriili 1 tuuman (0,80 x 25 mm [21G]) injektioneula, hartialihakseen annettavaan injektioon.
Valmisteen kuvaus:
Kuiva-aine esitäytetyssä ruiskussa
Valkoinen tai kellertävänvalkoinen irtonainen jauhe.
Liuotin esitäytetyssä ruiskussa lääkkeen käyttökuntoon saattamista varten
Kirkas liuos.
Käyttö- ja käsittelyohjeet
TÄRKEÄÄ TIETOA
- Vain lihakseen.
- Injektio on annettava potilaalle heti käyttökuntoon saattamisen jälkeen.
- Pakkauksessa on kaksi turvasuojuksella varustettua neulaa, joista toinen on tarkoitettu hartialihakseen ja toinen pakaralihakseen annettavaan injektioon. Pistoskohdista valitaan jompikumpi ennen lääkkeen antamista.
- Lue ohjeet huolellisesti ennen käyttöä. OKEDI-valmisteen täydelliset käyttö- ja käsittelyohjeet ovat pakkausselosteessa (ks. Ohjeet terveydenhuollon ammattilaisille).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
OKEDI injektiokuiva-aine ja liuotin, depotsuspensiota varten
75 mg 1 pakkaus
100 mg 1 pakkaus
- Ylempi erityiskorvaus (100 %). Vaikeat psykoosit ja muut vaikeat mielenterveyden häiriöt (112), Älyllisesti kehitysvammaisilla esiintyvät käyttäytymisen häiriöt (113).
- Peruskorvaus (40 %).
ATC-koodi
N05AX08
Valmisteyhteenvedon muuttamispäivämäärä
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
