BOSUTINIB STADA tabletti, kalvopäällysteinen 100 mg, 400 mg, 500 mg
not_interestedSaatavuushäiriö
Ei saatavilla
BOSUTINIB STADA tabletti, kalvopäällysteinen
- 100 mg28 fol06.05.2025 - 31.03.2026
- 400 mg28 fol06.05.2025 - 31.03.2026
Saatavilla
Saman valmisteen muut pakkaukset ja/tai vaihtokelpoiset valmisteet / BOSUTINIB STADA tabletti, kalvopäällysteinen 100 mg
BOSULIF tabletti, kalvopäällysteinen
- 100 mg28 fol
Saman valmisteen muut pakkaukset ja/tai vaihtokelpoiset valmisteet / BOSUTINIB STADA tabletti, kalvopäällysteinen 400 mg
BOSULIF tabletti, kalvopäällysteinen
- 400 mg28 fol
Muut samaa lääkeainetta sisältävät valmisteet
BOSUTINIB STADA tabletti, kalvopäällysteinen
- 500 mg28 fol
BOSULIF tabletti, kalvopäällysteinen
- 500 mg28 fol
Vaikuttavat aineet ja niiden määrät
Bosutinib Stada 100 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 100 mg bosutinibia.
Bosutinib Stada 400 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 400 mg bosutinibia.
Bosutinib Stada 500 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 500 mg bosutinibia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti.
Kliiniset tiedot
Käyttöaiheet
Tämä lääkevalmiste on tarkoitettu aikuispotilaille:
- äskettäin todetun Philadelphia-kromosomipositiivisen kroonisen myelooisen leukemian (Ph+ KML) kroonisen vaiheen hoitoon
- Ph+ KML:n kroonisen vaiheen, akseleraatiovaiheen ja blastikriisivaiheen hoitoon silloin, kun potilas on aiemmin saanut hoitoa yhdellä tai useammalla tyrosiinikinaasin estäjällä (TKI) ja kun imatinibin, nilotinibin ja dasatinibin ei katsota olevan tarkoituksenmukaisia hoitovaihtoehtoja.
Ehto
Hoidon saa aloittaa kroonisen myelooisen leukemian (KML) diagnosointiin ja hoitoon perehtynyt lääkäri.
Annostus ja antotapa
Hoidon aloittavan lääkärin tulee olla perehtynyt kroonisen myelooisen leukemian diagnosointiin ja hoitoon.
Annostus
Äskettäin todetun Ph+ KML:n krooninen vaihe
Bosutinibin suositeltu annos on 400 mg kerran vuorokaudessa.
Ph+ KML:n krooninen vaihe, akseleraatiovaihe tai blastikriisivaihe potilailla, jotka ovat resistenttejä tai intolerantteja aiemmalle hoidolle
Bosutinibin suositeltu annos on 500 mg kerran vuorokaudessa.
Kummankin käyttöaiheen kliinisissä tutkimuksissa bosutinibihoitoa jatkettiin taudin etenemiseen saakka tai kunnes potilas ei enää sietänyt hoitoa.
Annoksen muuttaminen
Vaiheen 1/2 kliinisessä tutkimuksessa, johon osallistuneet KML-potilaat olivat resistenttejä tai intolerantteja aiemmalle hoidolle, annoksen sai suurentaa 500 mg:sta 600 mg:aan kerran vuorokaudessa ruoan kanssa otettuna, jos potilaalla ei voitu osoittaa täydellistä hematologista vastetta (complete haematological response, CHR) viikkoon 8 mennessä tai täydellistä sytogeneettistä vastetta (complete cytogenetic response, CCyR) viikkoon 12 mennessä. Lisäksi potilaalla sai olla korkeintaan vaikeusasteen 2 haittatapahtumia, jotka saattoivat liittyä tutkimusvalmisteeseen. Vaiheen 3 kliinisessä tutkimuksessa, jossa äskettäin todetun KML:n kroonista vaihetta hoidettiin 400 mg:n bosutinibiannoksella, annosta sai suurentaa 100 mg:n lisäyksin enintään 600 mg:aan kerran vuorokaudessa ruoan kanssa otettuna, jos ei saavutettu ≤ 10 %:a BCR-ABL(breakpoint cluster region-Abelson) -transkripteja kuukauden 3 kohdalla. Lisäksi potilaalla ei saanut olla vaikeusasteen 3 tai 4 haittavaikutusta annoksen suurentamishetkellä ja kaikkien vaikeusasteen 2 ei-hematologisten toksisuuksien tuli olla lievittyneitä vähintään vaikeusasteelle 1. Vaiheen 4 kliinisessä tutkimuksessa Ph+ KML -potilaiden, joita oli aiemmin hoidettu yhdellä tai useammalla tyrosiinikinaasin estäjällä, annosta sai suurentaa 500 mg:sta 600 mg:aan kerran vuorokaudessa ruoan kanssa otettuna, jos potilaiden vaste oli riittämätön tai ilmeni merkkejä taudin etenemisestä ilman mitään vaikeusasteen 3 tai 4 haittatapahtumaa tai ilman pitkittyviä vaikeusasteen 2 haittatapahtumia.
Vaiheen 1/2 tutkimuksessa, johon osallistuneet KML-potilaat olivat resistenttejä tai intolerantteja aiemmalle hoidolle ja joiden hoito aloitettiin ≤ 500 mg:n annoksella, 93 potilaalla 558:sta (16,7 %) annos suurennettiin 600 mg:aan vuorokaudessa.
Vaiheen 3 tutkimuksessa, jossa äskettäin todetun KML:n kroonisen vaiheen bosutinibihoito aloitettiin 400 mg:n annoksella, yhteensä 58 potilaan (21,6 %) annos suurennettiin 500 mg:aan vuorokaudessa. Lisäksi 10,4 %:lla bosutinibiryhmän potilaista annosta suurennettiin vielä 600 mg:aan vuorokaudessa.
Vaiheen 4 tutkimuksessa, johon osallistuneita Ph+ KML -potilaita oli aiemmin hoidettu yhdellä tai useammalla tyrosiinikinaasin estäjällä ja joiden bosutinibihoito aloitettiin annoksella 500 mg vuorokaudessa, yhden potilaan (0,6 %) annos suurennettiin enintään 600 mg:aan vuorokaudessa.
Yli 600 mg:n vuorokausiannoksia ei ole tutkittu eikä niitä pitäisi siksi antaa.
Annosmuutokset haittavaikutusten vuoksi
Ei-hematologiset haittavaikutukset
Bosutinibihoito tulee keskeyttää, jos potilaalle kehittyy kliinisesti merkittävää keskivaikeaa tai vaikeaa ei-hematologista toksisuutta. Hoitoa voidaan jatkaa 100 mg pienemmällä vuorokausiannoksella, kun toksisuus on korjaantunut. Annoksen suurentamista takaisin pienentämistä edeltäneeseen kerran vuorokaudessa otettavaan annokseen tulee harkita, jos se on kliinisesti perusteltua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Potilaille on käytetty alle 300 mg:n vuorokausiannoksia, mutta tehoa ei ole varmistettu.
Kohonneet maksan transaminaasiarvot: Maksan transaminaasiarvojen noustessa > 5-kertaisiksi viitevälin ylärajaan nähden bosutinibihoito tulee keskeyttää, kunnes transaminaasiarvot laskevat ≤ 2,5-kertaisiksi viitevälin ylärajaan nähden. Tämän jälkeen hoitoa voidaan jatkaa annoksella 400 mg kerran vuorokaudessa. Bosutinibihoidon lopettamista on harkittava, jos transaminaasiarvojen korjaantuminen vie kauemmin kuin 4 viikkoa. Bosutinibihoito tulee lopettaa, jos transaminaasiarvot nousevat ≥ 3-kertaisiksi viitevälin ylärajaan nähden, mikäli tähän liittyy samanaikainen bilirubiiniarvon nousu > 2-kertaiseksi viitevälin ylärajaan nähden ja alkalisen fosfataasin arvo on < 2-kertainen viitevälin ylärajaan nähden (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ripuli: Bosutinibihoito tulee keskeyttää, jos potilaalla ilmenee vaikeusasteen 3–4 ripulia NCI Common Terminology Criteria for Adverse Events (CTCAE) -vaikeusasteluokituksen mukaan. Hoitoa voidaan jatkaa annoksella 400 mg kerran vuorokaudessa sen jälkeen, kun ripuli on lievittynyt vaikeusasteelle ≤ 1 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hematologiset haittavaikutukset
Vaikea-asteisessa tai pitkittyvässä neutropeniassa ja trombosytopeniassa annosta suositellaan pienentämään taulukossa 1 kuvatun mukaisesti.
Taulukko 1 –Annoksen muuttaminen neutropenian ja trombosytopenian ilmaantuessa
B-Neut < 1,0 x 109/l ja/tai B-Trom < 50 x 109/l | Keskeytä bosutinibihoito, kunnes B-Neut on ≥ 1,0 x 109/l ja B‑Trom ≥ 50 x 109/l. Aloita bosutinibihoito uudelleen samalla annoksella, jos arvot korjaantuvat enintään 2 viikon hoitotauon aikana. Jos veriarvot pysyvät alhaisina yli 2 viikkoa, arvojen korjaannuttua aloita hoito uudelleen 100 mg pienemmällä annoksella. Jos sytopenia uusiutuu, aloita hoito uudelleen vielä 100 mg pienemmällä annoksella veriarvojen korjaannuttua. Alle 300 mg:n vuorokausiannoksia on käytetty, mutta tehoa ei ole varmistettu. |
Erityispotilasryhmät
Iäkkäät potilaat (≥ 65-vuotiaat)
Iäkkäät potilaat eivät tarvitse erityisiä annossuosituksia. Koska iäkkäiden hoidosta ei ole riittävästi tietoa, varovaisuutta tulee noudattaa hoidettaessa näitä potilaita.
Munuaisten vajaatoiminta
KML-tutkimuksiin ei otettu mukaan potilaita, joiden seerumin kreatiniiniarvo oli > 1,5 kertaa viitevälin ylärajaa suurempi. Tutkimuksissa keskivaikeaa ja vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla havaittiin altistuksen (pitoisuus-aikakuvaajan alle jäävä pinta-ala [AUC]) suurentumista.
Äskettäin todetun Ph+ KML:n krooninen vaihe
Jos potilaalla on keskivaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma [ClCr] 30–50 ml/min, laskettuna Cockroft-Gaultin kaavalla), bosutinibin suositeltu annostus on 300 mg vuorokaudessa ruoan kanssa otettuna (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Jos potilaalla on vaikea munuaisten vajaatoiminta (ClCr < 30 ml/min, laskettuna Cockroft-Gaultin kaavalla), bosutinibin suositeltu annostus on 200 mg vuorokaudessa ruoan kanssa otettuna (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla annoksen suurentamista 400 mg:aan vuorokaudessa ruoan kanssa otettuna ja vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla 300 mg:aan vuorokaudessa voidaan harkita, jos potilailla ei ole vaikeita eikä pitkään jatkuvia keskivaikeita haittavaikutuksia ja jos heillä ei saavuteta riittävää hematologista, sytogeneettistä tai molekulaarista vastetta.
Ph+ KML:n krooninen vaihe, akseleraatiovaihe tai blastikriisivaihe potilailla, jotka ovat resistenttejä tai intolerantteja aiemmalle hoidolle
Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (kreatiniinipuhdistuma [ClCr] 30–50 ml/min, laskettuna Cockroft-Gaultin kaavalla) bosutinibin suositeltu annostus on 400 mg vuorokaudessa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (ClCr < 30 ml/min, laskettuna Cockroft-Gaultin kaavalla) bosutinibin suositeltu annostus on 300 mg vuorokaudessa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla annoksen suurentamista 500 mg:aan kerran vuorokaudessa ja vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla 400 mg:aan kerran vuorokaudessa voidaan harkita, jos potilailla ei ole vaikeita eikä pitkään jatkuvia keskivaikeita haittavaikutuksia ja jos heillä ei saavuteta riittävää hematologista, sytogeneettistä tai molekulaarista vastetta.
Sydänsairaudet
Kliinisiin tutkimuksiin ei otettu mukaan potilaita, joilla oli huonossa hoitotasapainossa oleva tai merkittävä sydänsairaus (esim. äskettäinen sydäninfarkti, kongestiivinen sydämen vajaatoiminta tai epästabiilii angina pectoris). Varovaisuutta tulee noudattaa potilaalla, jolla on merkittävä sydänsairaus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Äskettäinen tai jatkuva kliinisesti merkittävä maha-suolikanavan toiminnan häiriö
Kliinisiin tutkimuksiin ei otettu mukaan potilaita, joilla oli äskettäin ollut tai oli parhaillaan kliinisesti merkittäviä maha-suolikanavan toiminnan häiriöitä (esim. vaikea-asteista oksentelua ja/tai ripulia). Varovaisuutta tulee noudattaa potilaalla, jolla on äskettäin ollut tai on edelleen kliinisesti merkittäviä maha-suolikanavan toiminnan häiriöitä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Bosutinibin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Bosutinib Stada otetaan suun kautta ruoan kanssa kerran vuorokaudessa (ks. kohta Farmakokinetiikka). Jos annos jää ottamatta ja on kulunut yli 12 tuntia tavanomaisesta ottoajankohdasta, potilaan ei tule ottaa unohtunutta annosta. Potilaan tulee ottaa tavanomainen lääkärin määräämä annos seuraavana päivänä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Maksan vajaatoiminta (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Varoitukset ja käyttöön liittyvät varotoimet
Maksan toiminnan poikkeavuudet
Bosutinibihoitoon voi liittyä seerumin transaminaasiarvojen (alaniiniaminotransferaasi [ALAT], aspartaattiaminotransferaasi [ASAT]) kohoamista.
Transaminaasiarvojen kohoamista on tavallisesti esiintynyt hoitojakson alkuvaiheessa (> 80 %:lla niistä potilaista, joilla esiintyi jonkinasteista transaminaasiarvojen kohoamista, arvojen kohoaminen todettiin ensimmäisen kerran 3 kuukauden sisällä bosutinibihoidon aloittamisesta). Bosutinibia saavista potilaista tulee ottaa maksan toimintakokeet ennen hoidon aloittamista ja kuukausittain 3 ensimmäisen hoitokuukauden ajan sekä kliinisen tarpeen mukaan.
Transaminaasiarvojen kohoaminen saattaa edellyttää bosutinibihoidon tilapäistä keskeyttämistä (hoidon jatkamista pienemmällä annoksella voidaan harkita, kun arvot ovat korjautuneet vaikeusasteeseen 1 tai lähtötasolle) ja/tai pysyvää lopettamista. Transaminaasiarvojen kohoaminen erityisesti samanaikaisen bilirubiiniarvon nousun kanssa saattaa olla varhainen merkki lääkeaineen aiheuttamasta maksavauriosta. Tällaiset potilaat tulee hoitaa asianmukaisesti (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Ripuli ja oksentelu
Bosutinibihoitoon voi liittyä ripulia ja oksentelua. Siksi potilaiden, joilla on äskettäin ollut tai on parhaillaan kliinisesti merkittäviä maha-suolikanavan toiminnan häiriöitä, tulee käyttää tätä lääkevalmistetta varoen ja ainoastaan huolellisen hyöty-riskisuhteen arvioinnin jälkeen, koska tällaisia potilaita ei otettu mukaan kliinisiin tutkimuksiin. Potilaita, joilla ilmenee ripulia ja oksentelua, tulee hoitaa tavanomaisin keinoin, kuten ripuli- tai pahoinvointilääkevalmisteella ja/tai nestekorvaushoidolla. Lisäksi ripulin ja oksentelun hoito voi edellyttää bosutinibihoidon tilapäistä keskeyttämistä, annoksen pienentämistä ja/tai hoidon lopettamista (ks. kohdat Annostus ja antotapa ja Haittavaikutukset). Pahoinvointilääke domperidoni voi voimistaa QT-ajan (QTc) pitenemistä ja aiheuttaa kääntyvien kärkien (torsade de pointes) takykardiaa, joten domperidonin samanaikaista käyttöä on vältettävä. Sitä tulee käyttää vain, jos muut lääkkeet eivät tehoa. Tällaisissa tilanteissa riskien ja hyötyjen tapauskohtainen arviointi on välttämätöntä ja potilasta on seurattava QTc-ajan pitenemisen havaitsemiseksi.
Myelosuppressio
Bosutinibihoitoon voi liittyä myelosuppressiota, jolle tyypillistä on anemia, neutropenia ja trombosytopenia. Täydellinen verenkuva tulee ottaa viikoittain ensimmäisen hoitokuukauden ajan ja sen jälkeen kuukausittain, tai kliinisen tarpeen mukaan. Myelosuppression hoito saattaa edellyttää bosutinibihoidon tilapäistä keskeyttämistä, annoksen pienentämistä ja/tai hoidon lopettamista (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Nesteretentio
Bosutinibihoitoon saattaa liittyä nesteen kerääntymistä elimistöön, mukaan lukien perikardiumeffuusio, pleuraeffuusio, keuhkoödeema ja/tai perifeerinen edeema. Potilaita tulee seurata ja hoitaa tavanomaisilla menetelmillä. Nesteretention hoito saattaa lisäksi edellyttää bosutinibihoidon tilapäistä keskeyttämistä, annoksen pienentämistä ja/tai hoidon lopettamista (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Seerumin lipaasi
Kohonnutta seerumin lipaasia on havaittu. Varovaisuutta suositellaan noudattamaan hoidettaessa potilaita, joilla on aiemmin ollut haimatulehdus. Jos kohonneeseen lipaasiin liittyy vatsaoireita, bosutinibihoito tulee keskeyttää ja harkita asianmukaisia diagnostisia toimenpiteitä haimatulehduksen poissulkemiseksi (ks. kohta Annostus ja antotapa).
Infektiot
Bosutinibi saattaa altistaa potilaan bakteeri-, sieni-, virus- tai alkueläininfektioille.
Rytmihäiriöitä aiheuttava potentiaali
Automaattisesti analysoitua QTc-ajan pitenemistä ilman siihen liittyviä rytmihäiriöitä on havaittu. Varovaisuutta tulee noudattaa annettaessa bosutinibia potilaille, joilla on aiemmin esiintynyt QTc-ajan pitenemistä tai joilla on alttius QTc-ajan pitenemiseen, joilla on huonossa hoitotasapainossa oleva tai merkittävä sydänsairaus, kuten äskettäinen sydäninfarkti, kongestiivinen sydämen vajaatoiminta, epästabiili angina pectoris tai kliinisesti merkittävä bradykardia, tai jotka käyttävät QTc-aikaa tunnetusti pidentäviä lääkevalmisteita (esim. rytmihäiriölääkkeitä ja muita QTc-aikaa mahdollisesti pidentäviä lääkeaineita, ks. kohta Yhteisvaikutukset). Hypokalemia ja hypomagnesemia saattavat voimistaa tätä vaikutusta.
QTc-aikaan kohdistuvia vaikutuksia tulee seurata ja lähtötilanteen sydänfilmi (EKG)on suositeltavaa rekisteröidä ennen bosutinibihoidon aloittamista sekä kliinisen tarpeen mukaan. Hypokalemia tai hypomagnesemia on korjattava ennen bosutinibin antoa, ja kalium- ja magnesiumarvoja tulee seurata määräajoin hoidon aikana.
Munuaisten vajaatoiminta
Bosutinibihoito voi aiheuttaa munuaisten toiminnan kliinisesti merkittävän heikentymisen kroonista myelooista leukemiaa (KML) sairastavilla potilailla. Kliinisissä lääketutkimuksissa bosutinibilla hoidetuilla potilailla on havaittu laskennallisen glomerulusten suodatusnopeuden (eGFR) pienenemistä ajan kuluessa. Potilailla, joiden äskettäin todetun KML:n kroonista vaihetta hoidettiin 400 mg:n annoksella, eGFR:n laskun mediaani lähtötilanteesta oli 11,1 ml/min/1,73 m2 1 vuoden kohdalla ja 14,1 ml/min/1,73 m2 5 vuoden kohdalla hoidossa olevilla potilailla. Aiemmin hoitamattomilla KML-potilailla, joita hoidettiin 500 mg:n annoksella, eGFR:n laskun mediaani oli 9,2 ml/min/1,73 m2 1 vuoden kohdalla,12,0 ml/min/1,73 m2 5 vuoden kohdalla ja 16,6 ml/min/1,73 m2 10 vuoden kohdalla hoidossa olevilla potilailla. Aiempaa hoitoa saaneilla KML:n kroonista vaihetta ja pitkälle edennyttä KML:ää sairastavilla potilailla, joita hoidettiin 500 mg:n annoksella, eGFR:n laskun mediaani oli 7,6 ml/min/1,73 m2 1 vuoden kohdalla, 12,3 ml/min/1,73 m2 5 vuoden kohdalla ja 15,9 ml/min/1,73 m2 10 vuoden kohdalla hoidossa olevilla potilailla. Aiempaa hoitoa yhdellä tai useammalla tyrosiinikinaasin estäjällä saaneilla Ph+ KML potilailla, joita hoidettiin 500 mg:n annoksella, eGFR:n laskun mediaani lähtötilanteesta oli 9,2 ml/min/1,73 m2 1 vuoden kohdalla ja 14,5 ml/min/1,73 m2 4 vuoden kohdalla hoidossa olevilla potilailla.
On tärkeää arvioida munuaisten toiminta ennen hoidon aloittamista ja seurata sitä tarkoin bosutinibihoidon aikana. Erityistä huomiota tulee kiinnittää potilaisiin, joiden munuaisten toiminta on jo ennalta heikentynyt tai joilla on munuaisten toimintahäiriön riskitekijöitä, mukaan lukien sellaisten lääkevalmisteiden samanaikainen käyttö, jotka voivat mahdollisesti aiheuttaa munuaistoksisuutta ja joita ovat esimerkiksi diureetit, angiotensiinikonvertaasientsyymin estäjät (ACE:n estäjät), angiotensiinireseptorin salpaajat ja tulehduskipulääkkeet (NSAIDit).
Munuaisten vajaatoimintaa selvittävässä tutkimuksessa bosutinibialtistukset suurenivat tutkittavilla, joiden munuaisten toiminta oli kohtalaisesti tai vaikeasti heikentynyt. Annoksen pienentämistä suositellaan potilaille, joilla on keskivaikea tai vaikea munuaisten vajaatoiminta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
KML-tutkimuksiin ei otettu mukaan potilaita, joiden seerumin kreatiniiniarvo oli > 1,5 kertaa viitevälin ylärajaa suurempi. Populaatiofarmakokineettisessä analyysissä havaittiin altistuksen (AUC) suurenemista potilailla, joilla oli tutkimushoitoa aloitettaessa keskivaikea tai vaikea munuaisten vajaatoiminta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Kliinisiä tietoja on hyvin niukasti (n = 3) sellaisista KML-potilaista, joilla on keskivaikea munuaisten vajaatoiminta ja jotka saivat bosutinibia suurennetulla 600 mg:n annostuksella.
Aasialaiset potilaat
Populaatiofarmakokineettisten analyysien perusteella aasialaisilla puhdistuma oli pienempi, mikä johti suurentuneeseen altistukseen. Siksi näitä potilaita tulee seurata tarkoin haittavaikutusten varalta erityisesti, jos annostusta suurennetaan.
Vakavat ihoreaktiot
Bosutinibi voi aiheuttaa vakavia ihoreaktioita, kuten Stevens‑Johnsonin oireyhtymää ja toksista epidermaalista nekrolyysia. Bosutinibin käyttö on lopetettava pysyvästi potilaalla, jolla ilmenee vakava ihoreaktio hoidon aikana.
Tuumorilyysioireyhtymä
Koska tuumorilyysioireyhtymän kehittyminen on mahdollista, on suositeltavaa, että kliinisesti merkittävä nestevajaus ja suurentuneet virtsahappopitoisuudet korjataan ennen bosutinibihoidon aloittamista (ks. kohta Haittavaikutukset).
Hepatiitti B:n uudelleenaktivoituminen
Hepatiitti B:n (HBV) uudelleenaktivoitumista on tapahtunut kyseisen viruksen pysyvillä kantajilla sen jälkeen, kun potilas on saanut BCR-ABL-tyrosiinikinaasin estäjiä. Tämä aiheutti joissakin tapauksissa akuuttia maksan vajaatoimintaa tai fulminanttia hepatiittia, joka johti maksansiirtoon tai kuolemaan.
Potilaat on testattava HBV-infektion varalta ennen bosutinibihoidon aloittamista. Maksasairauksien ja HBV:n hoitoon perehtyneitä asiantuntijoita on kuultava ennen hoidon aloittamista, jos potilaan HBV-serologia on positiivinen (mukaan lukien potilaat, joilla sairaus on aktiivinen) tai jos potilas saa positiivisen HBV-testituloksen hoidon aikana. HBV:n kantajia, jotka tarvitsevat bosutinibihoitoa, on seurattava tarkasti aktiivisen HBV-infektion oireiden varalta koko hoidon ajan ja useita kuukausia hoidon jälkeen (ks. kohta Haittavaikutukset).
Valoherkkyys
Altistumista suoralle auringonvalolle tai ultravioletti (UV) -säteilylle tulisi välttää tai minimoida, koska bosutinibihoitoon liittyy valoherkkyyden riski. Potilaita tulee neuvoa käyttämään peittävää vaatetusta ja aurinkovoidetta, jossa on korkea auringonsuojakerroin (SPF, Sun Protection Factor).
Sytokromi P450 (CYP) 3A:n estäjät
Bosutinibin samanaikaista käyttöä voimakkaiden tai kohtalaisten CYP3A:n estäjien kanssa tulee välttää, koska bosutinibipitoisuus plasmassa suurenee (ks. kohta Yhteisvaikutukset).
Jos mahdollista, samanaikaiseen käyttöön suositellaan valitsemaan lääkevalmiste, joka ei estä CYP3A:ta tai estää sitä mahdollisimman vähän.
Jos bosutinibihoidon aikana on välttämätöntä käyttää voimakasta tai kohtalaista CYP3A:n estäjää, bosutinibihoidon keskeyttämistä tai sen annoksen pienentämistä tulisi harkita.
CYP3A:n induktorit
Bosutinibin samanaikaista käyttöä voimakkaiden tai kohtalaisten CYP3A:n induktorien kanssa tulee välttää, koska bosutinibipitoisuus plasmassa pienenee (ks. kohta Yhteisvaikutukset).
Ruoan vaikutus
Greippiä sisältäviä tuotteita, kuten greippimehua, ja muita CYP3A:ta tunnetusti estäviä ruoka-aineita tulee välttää (ks. kohta Yhteisvaikutukset).
Natriumin määrä
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 100 mg:n, 400 mg:n tai 500 mg:n tabletti. Potilaille, joilla on ruokavalion natriumrajoitus, voidaan sanoa, että tämä lääkevalmiste on ”natriumiton”.
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus bosutinibiin
CYP3A:n estäjät
Bosutinibin samanaikaista käyttöä voimakkaiden CYP3A:n estäjien (mm. itrakonatsoli, ketokonatsoli, posakonatsoli, vorikonatsoli, klaritromysiini, telitromysiini, nefatsodoni, mibefradiili, indinaviiri, lopinaviiri/ritonaviiri, nelfinaviiri, ritonaviiri, sakinaviiri, bosepreviiri, telapreviiri, greippihedelmävalmisteet, mukaan lukien greippimehu) tai kohtalaisten CYP3A:n estäjien (mm. flukonatsoli, siprofloksasiini, erytromysiini, diltiatseemi, verapamiili, amprenaviiri, atatsanaviiri, darunaviiri/ritonaviiri, fosamprenaviiri, aprepitantti, kritsotinibi, imatinibi) kanssa tulisi välttää, koska bosutinibipitoisuus plasmassa suurenee.
Varovaisuutta on noudatettava heikkojen CYP3A:n estäjien ja bosutinibin samanaikaisessa käytössä.
Jos mahdollista, samanaikaiseen käyttöön suositellaan valitsemaan lääkevalmiste, joka ei estä CYP3A-entsyymejä tai estää niitä mahdollisimman vähän.
Jos bosutinibihoidon aikana on välttämätöntä käyttää voimakasta tai kohtalaista CYP3A:n estäjää, bosutinibin annon keskeyttämistä tai sen annoksen pienentämistä tulisi harkita.
Kun tutkimuksessa 24 terveelle tutkittavalle annettiin paastotilassa viisi 400 mg:n vuorokausiannosta ketokonatsolia (voimakas CYP3A:n estäjä) samanaikaisesti yhden 100 mg:n bosutinibikerta-annoksen kanssa, ketokonatsoli suurensi bosutinibin huippupitoisuuden (Cmax) 5,2‑kertaiseksi ja bosutinibin AUC-arvon plasmassa 8,6-kertaiseksi verrattuna bosutinibin käyttöön yksinään.
Kun tutkimuksessa 20 terveelle tutkittavalle annettiin aterian jälkeen yksi 125 mg:n kerta-annos aprepitanttia (kohtalainen CYP3A:n estäjä) samanaikaisesti yhden 500 mg:n bosutinibikerta-annoksen kanssa, aprepitantti suurensi bosutinibin huippupitoisuuden (Cmax) 1,5-kertaiseksi ja bosutinibin AUC-arvon plasmassa 2,0-kertaiseksi verrattuna bosutinibin käyttöön yksinään.
CYP3A:n induktorit
Bosutinibin samanaikaista käyttöä voimakkaiden CYP3A:n induktorien (mm. karbamatsepiini, fenytoiini, rifampisiini, mäkikuisma) tai kohtalaisten CYP3A:n induktorien (mm. bosentaani, efavirentsi, etraviriini, modafiniili, nafsilliini) kanssa tulisi välttää, koska bosutinibin pitoisuus plasmassa pienenee.
Kun bosutinibia annettiin samanaikaisesti rifampisiinin kanssa, bosutinibialtistus pieneni huomattavasti. Siksi bosutinibin annoksen suurentaminen samanaikaisessa käytössä voimakkaiden tai kohtalaisten CYP3A-induktorien kanssa ei todennäköisesti kompensoi riittävästi pienentynyttä altistusta.
Varovaisuutta on noudatettava heikkojen CYP3A:n induktorien ja bosutinibin samanaikaisessa käytössä.
Kun bosutinibikerta-annos annettiin samanaikaisesti kuuden rifampisiinin 600 mg:n vuorokausiannoksen kanssa, 24 terveen tutkittavan ruokailun jälkeinen bosutinibialtistus (Cmax ja AUC plasmassa) pieneni 14 %:iin (Cmax) ja 6 %:iin (AUC) arvoista, jotka todettiin annettaessa 500 mg:n bosutinibiannoksia yksinään.
Protonipumpun estäjät
Bosutinibin ja protonipumpun estäjien samanaikaisessa käytössä tulee noudattaa varovaisuutta. Vaihtoehtoina protonipumpun estäjille tulee harkita lyhytvaikutteisia antasideja. Lisäksi bosutinibi ja antasidit tulee ottaa eri aikaan (esim. bosutinibi otetaan aamulla ja antasidit illalla) aina, kun mahdollista. Bosutinibin vesiliukoisuus on pH-riippuvainen in vitro. Kun tutkimuksessa annettiin 24 terveelle tutkittavalle paastotilassa suun kautta kerta-annos bosutinibia (400 mg) samanaikaisesti suun kautta annettujen toistuvien lansopratsoliannosten (60 mg) kanssa, bosutinibin Cmax pieneni 54 %:iin ja AUC pieneni 74 %:iin arvoista, jotka todettiin annettaessa bosutinibia (400 mg) yksinään.
Bosutinibin vaikutus muihin lääkevalmisteisiin
Kun tutkimuksessa 27 terveelle tutkittavalle annettiin aterian jälkeen yksi 500 mg:n kerta-annos bosutinibia samanaikaisesti yhden 150 mg:n dabigatraanieteksilaattimesilaattikerta-annoksen (P-glykoproteiinin [P-gp:n] substraatti) kanssa, bosutinibi ei suurentanut dabigatraanin huippupitoisuutta (Cmax) tai AUC-arvoa plasmassa verrattuna dabigatraanieteksilaattimesilaatin käyttöön yksinään. Tutkimustulokset osoittavat, että bosutinibilla ei ole kliinisesti merkittävää P-gp:n estovaikutusta.
In vitro -tutkimuksen perusteella on epätodennäköistä, että bosutinibi aiheuttaisi terapeuttisina annoksina yhteisvaikutuksia, jotka johtuvat siitä, että bosutinibi indusoi sellaisten lääkeaineiden metaboliaa, jotka ovat CYP1A2:n, CYP2B6:n, CYP2C9:n, CYP2C19:n ja CYP3A4:n substraatteja.
In vitro -tutkimusten perusteella on epätodennäköistä, että bosutinibi aiheuttaisi terapeuttisina annoksina yhteisvaikutuksia, jotka johtuvat siitä, että bosutinibi estää sellaisten lääkeaineiden metaboliaa, jotka ovat CYP1A2:n, CYP2A6:n, CYP2C8:n, CYP2C9:n, CYP2C19:n, CYP2D6:n tai CYP3A4/5:n substraatteja.
In vitro -tutkimusten perusteella bosutinibin rintasyövän resistenssiproteiinia (BCRP, systeemisesti), orgaanisten anionien kuljettajapolypeptidia (OATP)1B1, OATP1B3:a, orgaanisten anionien kuljettajaa (OAT)1, OAT3:a tai orgaanisten kationien kuljettajaa (OCT)2 estävä potentiaali kliinisesti merkittävinä pitoisuuksina on vähäinen. Bosutinibi mahdollisesti estää BCRP:tä maha-suolikanavassa ja OCT1:tä.
Rytmihäiriölääkkeet ja muut QT-aikaa mahdollisesti pidentävät aineet
Bosutinibia tulee käyttää varoen potilailla, joille on kehittynyt tai saattaa kehittyä QT-ajan pitenemistä, mukaan lukien potilaat, jotka käyttävät rytmihäiriölääkkeitä (esim. amiodaronia, disopyramidia, prokaiiniamidia, kinidiiniä ja sotalolia) tai muita mahdollisesti QT-ajan pitenemistä aiheuttavia lääkevalmisteita (esim. klorokiinia, halofantriinia, klaritromysiinia, domperidonia, haloperidolia, metadonia ja moksifloksasiinia) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy
Naisia, jotka voivat tulla raskaaksi, on kehotettava käyttämään tehokasta ehkäisyä bosutinibihoidon aikana ja vähintään 1 kuukauden ajan viimeisen annoksen saamisen jälkeen ja välttämään raskaaksi tuloa bosutinibihoidon aikana. Lisäksi potilaalle tulee kertoa, että oksentelu tai ripuli saattaa heikentää ehkäisytablettien tehoa, koska ne eivät imeydy täydellisesti.
Raskaus
Bosutinibin käytöstä raskaana oleville naisille on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Bosutinibin käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi mutta eivät käytä ehkäisyä. Jos bosutinibia käytetään raskauden aikana tai jos potilas tulee raskaaksi hoidon aikana, hänelle on kerrottava sikiölle mahdollisesti aiheutuvasta vaarasta.
Imetys
Ei tiedetä, erittyvätkö bosutinibi ja sen metaboliitit ihmisillä äidinmaitoon. Rotilla tehty tutkimus [14C]-radioisotooppileimatulla bosutinibilla osoitti bosutinibista peräisin olevaa radioaktiivisuutta erittyneen nisämaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Imetys on lopetettava bosutinibihoidon ajaksi.
Hedelmällisyys
Bosutinibi saattaa non-kliinisten löydösten perusteella heikentää ihmisen lisääntymistoimintoja ja hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).Miehet tulisi ohjeistaa hakeutumaan siemennesteen talteenottoa koskevaan neuvontaan ennen kuin bosutinibihoito aloitetaan, koska hoito voi heikentää hedelmällisyyttä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Bosutinibilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Jos bosutinibia käyttävällä potilaalla esiintyy huimausta, väsymystä, näkökyvyn heikkenemistä tai muita haittavaikutuksia, jotka saattavat vaikuttaa auton ajamiseen ja koneiden käyttämiseen turvallisesti, hänen on vältettävä näitä toimia kunnes haittavaikutus on hävinnyt.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yhteensä 1 372 leukemiapotilasta sai vähintään yhden bosutinibikerta-annoksen. Hoidon mediaanikesto oli 26,30 kuukautta (vaihteluväli: 0,03–170,49 kuukautta). Näillä potilailla oli joko äskettäin todetun KML:n krooninen vaihe tai he eivät sietäneet aiempaa KML:n krooniseen vaiheeseen, akseleraatiovaiheeseen tai blastikriisivaiheeseen tai Ph+ akuuttiin lymfaattiseen leukemiaan (ALL) annettua hoitoa tai heidän tautinsa ei vastannut aiempaan hoitoon. Näistä potilaista 268 (aloitusannos 400 mg) ja 248 (aloitusannos 500 mg) oli mukana kahdessa vaiheen 3 tutkimuksessa, jotka tehtiin aiemmin hoitamattomilla KML-potilailla, 60 (aloitusannos 400 mg) oli mukana vaiheen 2 tutkimuksessa, joka tehtiin aiemmin hoitamattomilla KML-potilailla, ja 570 ja 63 potilasta (vaihe 2: aloitusannos 500 mg) oli mukana kahdessa vaiheen 1/2 tutkimuksessa, jotka tehtiin aiemmin hoitoa saaneilla Ph+-leukemiaa sairastavilla potilailla. Lisäksi 163 potilasta (aloitusannos 500 mg) oli mukana vaiheen 4 tutkimuksessa, joka tehtiin aiemmin hoitoa saaneilla KML-potilailla. Hoidon mediaanikesto oli vastaavasti 55,1 kuukautta (vaihteluväli: 0,2–60,05 kuukautta), 61,6 kuukautta (0,03–145,86 kuukautta), 15,3 kuukautta (0,3–21,8 kuukautta), 11,1 kuukautta (vaihteluväli: 0,03−170,49 kuukautta), 30,2 kuukautta (vaihteluväli: 0,2−85,6 kuukautta) ja 37,80 kuukautta (vaihteluväli: 0,16−50,0 kuukautta). Turvallisuusanalyyseihin sisältyi tietoja päättyneestä jatkotutkimuksesta.
1 349 potilaalla (98,3 %) raportoitiin vähintään yksi minkä tahansa vaikeusasteen haittavaikutus. Yleisimmin (≥ 20 %:lla potilaista) raportoituja haittavaikutuksia olivat ripuli (80,4 %), pahoinvointi (41,5 %), vatsakipu (35,6 %), trombosytopenia (34,4 %),oksentelu (33,7 %), ihottuma (32,8 %), suurentunut ALAT-arvo (28,0 %), anemia (27,2 %), kuume (23,4 %), suurentunut ASAT-arvo (22,5 %), väsymys (32,0 %) ja päänsärky (20,3 %). 943 potilaalla (68,7 %) raportoitiin vähintään yksi vaikeusasteen 3 tai 4 haittavaikutus. Vaikeusasteen 3 tai 4 haittavaikutuksia, joita raportoitiin ≥ 5 %:lla potilaista, olivat trombosytopenia (19,7 %), suurentunut ALAT-arvo (14,6 %), neutropenia (10,6 %), ripuli (10,6 %), anemia (10,3 %), suurentunut lipaasiarvo (10,1 %), suurentunut ASAT-arvo (6,7 %) ja ihottuma (5,0 %).
Haittavaikutustaulukko
Seuraavia haittavaikutuksia on raportoitu bosutinibilla tehdyissä kliinisissä tutkimuksissa mukana olleilla potilailla (taulukko 2). Tiedot perustuvat 1 372 potilaan haittavaikutustietojen arviointiin. Potilaat sairastivat joko äskettäin todettua KML:n kroonista vaihetta tai KML:n kroonista vaihetta, akseleraatiovaihetta tai blastikriisivaihetta, joka ei vastannut aiempaan hoitoon tai potilas ei sietänyt aiemmin saamaansa hoitoa, tai Ph+ ALL:aa. Potilaat olivat saaneet vähintään yhden bosutinibikerta-annoksen. Haittavaikutukset on lueteltu elinjärjestelmän ja esiintyvyyden mukaan. Esiintymistiheyksiksi on määritelty: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000,< 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko2 – Bosutinibin haittavaikutukset
Infektiot | |
Hyvin yleinen | Hengitystieinfektio (mukaan lukien alahengitystieinfektio, hengitysteiden virusinfektio, ylähengitystieinfektio, ylempien hengitysteiden virusinfektio), nasofaryngiitti |
Yleinen | Keuhkokuume (mukaan lukien atyyppinen keuhkokuume, bakteerikeuhkokuume, sienikeuhkokuume, nekrotisoiva keuhkokuume, streptokokkikeuhkokuume), influenssa (mukaan lukien H1N1-influenssa), keuhkoputkitulehdus |
Hyvän-ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | |
Melko harvinainen | Tuumorilyysioireyhtymä** |
Veri ja imukudos | |
Hyvin yleinen | Trombosytopenia (mukaan lukien trombosyyttimäärän pieneneminen), neutropenia (mukaan lukien neutrofiilimäärän pieneneminen), anemia (mukaan lukien hemoglobiiniarvon pieneneminen, punasolujen määrän pieneminen) |
Yleinen | Leukopenia (mukaan lukien valkosolumäärän pieneneminen) |
Melko harvinainen | Kuumeinen neutropenia, granulosytopenia |
Immuunijärjestelmä | |
Yleinen | Lääkeaineyliherkkyys |
Melko harvinainen | Anafylaktinen sokki |
Aineenvaihdunta ja ravitsemus | |
Hyvin yleinen | Heikentynyt ruokahalu |
Yleinen | Elimistön kuivuminen, hyperkalemia (mukaan lukien suurentunut veren kaliumpitoisuus), hypofosfatemia (mukaan lukien pienentynyt veren fosforipitoisuus) |
Hermosto | |
Hyvin yleinen | Huimaus, päänsärky |
Yleinen | Makuaistin häiriöt |
Kuulo ja tasapainoelin | |
Yleinen | Tinnitus |
Sydän | |
Yleinen | Perikardiumeffuusio |
Melko harvinainen | Perikardiitti |
Verisuonisto | |
Yleinen | Hypertensio (mukaan lukien kohonnut verenpaine, kohonnut systolinen verenpaine, primaarinen hypertensio, hypertensiivinen kriisi) |
Hengityselimet, rintakehä ja välikarsina | |
Hyvin yleinen | Pleuraeffuusio, hengenahdistus, yskä |
Yleinen | Keuhkoverenpainetauti (mukaan lukien keuhkovaltimoiden verenpainetauti, kohonnut keuhkovaltimoiden verenpaine), hengityslama |
Melko harvinainen | Akuutti keuhkoedeema (mukaan lukien keuhkoedeema) |
Tuntematon | Interstitiaalinen keuhkosairaus |
Ruoansulatuselimistö | |
Hyvin yleinen | Ripuli, oksentelu, pahoinvointi, vatsakipu (mukaan lukien epämukava tunne vatsassa, alavatsakipu, ylävatsakipu, vatsan arkuus, ruoansulatuselimistön kipu) |
Yleinen | Maha-suolikanavan verenvuoto (mukaan lukien verenvuoto peräaukosta, mahalaukun verenvuoto, suoliston verenvuoto, alemman maha-suolikanavan verenvuoto, peräsuolen verenvuoto, ylemmän maha-suolikanavan verenvuoto), haimatulehdus (mukaan lukien akuutti haimatulehdus), gastriitti |
Maksa ja sappi | |
Yleinen | Maksatoksisuus (mukaan lukien hepatiitti, toksinen hepatiitti, maksahäiriö), epänormaali maksan toiminta (mukaan lukien suurentuneet maksaentsyymiarvot, poikkeavuudet maksan toimintakokeissa, maksan toimintakoearvojen suureneminen, suurentuneet transaminaasiarvot) |
Melko harvinainen | Maksavaurio (mukaan lukien lääkkeen aiheuttama maksavaurio, maksasoluvaurio) |
Iho ja ihonalainen kudos | |
Hyvin yleinen | Ihottuma (mukaan lukien makulaarinen ihottuma, makulopapulaarinen ihottuma, papulaarinen ihottuma, kutiseva ihottuma), kutina |
Yleinen | Valoherkkyysreaktio (mukaan lukien monimuotoinen valoihottuma), urtikaria, akne |
Melko harvinainen | Erythema multiforme, hilseilevä ihottuma, lääkeaineihottuma |
Tuntematon | Stevens‑Johnsonin oireyhtymä**, toksinen epidermaalinen nekrolyysi** |
Luusto, lihakset ja sidekudos | |
Hyvin yleinen | Nivelkipu, selkäkipu |
Yleinen | Lihaskipu |
Munuaiset ja virtsatiet | |
Yleinen | Akuutti munuaisten vajaatoiminta, munuaisten vajaatoiminta, munuaisfunktion huononeminen |
Yleisoireet ja antopaikassa todettavat haitat | |
Hyvin yleinen | Turvotus (mukaan lukien silmäluomen turvotus, kasvojen turvotus, yleistynyt turvotus, paikallinen turvotus, raajojen turvotus, periorbitaalinen turvotus, periorbitaalinen turpoaminen, raajojen turpoaminen, turpoaminen, silmäluomen turpoaminen), kuume, väsymys (mukaan lukien astenia, huonovointisuus) |
Yleinen | Rintakipu (mukaan lukien epämukava tunne rinnassa), kipu |
Tutkimukset | |
Hyvin yleinen | Suurentunut lipaasiarvo (mukaan lukien hyperlipasemia), suurentunut alaniiniaminotransferaasiarvo (mukaan lukien poikkeava alaniiniaminotransferaasiarvo), suurentunut aspartaattiaminotransferaasiarvo, suurentunut veren kreatiniiniarvo |
Yleinen | EKG:ssä todettu pidentynyt QT-aika (mukaan lukien pitkän QT-ajan oireyhtymä), suurentunut amylaasiarvo (mukaan lukien hyperamylasemia), suurentunut veren kreatiinikinaasiarvo, suurentunut gammaglutamyylitransferaasiarvo, suurentunut veren bilirubiiniarvo (mukaan lukien hyperbilirubinemia, suurentunut konjugoituneen bilirubiinin arvo, suurentunut veren konjugoitumattoman bilirubiinin arvo) |
**Haittavaikutus tunnistettu markkinoilletulon jälkeen.
Valikoitujen haittavaikutusten kuvaus
Seuraavassa esitetyt kuvaukset perustuvat 1 372 potilaan turvallisuustietoihin. Potilaat saivat vähintään yhden bosutinibiannoksen. Turvallisuustiedoissa on mukana äskettäin todettua KML:n kroonista vaihetta sairastavia potilaita ja KML:n kroonista vaihetta, akseleraatiovaihetta tai blastikriisivaihetta sairastavia potilaita, jotka olivat resistenttejä tai intolerantteja aiemmalle hoidolle, tai Ph+ ALL:aa sairastavia potilaita.
Veri ja imukudos
Anemiaa raportoitiin haittavaikutuksena 372 potilaalla (27,1 %), joista 6 lopetti bosutinibihoidon anemian vuoksi. Enintään vaikeusasteen 1 toksisuutta esiintyi 95 potilaalla (25,5 %), vaikeusasteen 2 toksisuutta 135 potilaalla (36,3 %), vaikeusasteen 3 toksisuutta 113 potilaalla (30,4 %) ja vaikeusasteen 4 toksisuutta 29 potilaalla (7,8 %). Näillä potilailla mediaaniaika tapahtuman ensimmäiseen ilmaantumiskertaan oli 29 vuorokautta (vaihteluväli:1−3 999 vuorokautta) ja mediaanikesto esiintymiskertaa kohden oli 22 vuorokautta (vaihteluväli:1−3 682 vuorokautta).
Neutropeniaa raportoitiin haittavaikutuksena 209 potilaalla(15,2 %), joista 19 lopetti bosutinibihoidon neutropenian vuoksi. Enintään vaikeusasteen 1 toksisuutta esiintyi 19 potilaalla (9,1 %), vaikeusasteen 2 toksisuutta 45 potilaalla (21, 5%), vaikeusasteen 3 toksisuutta 95 potilaalla (45,5 %) ja vaikeusasteen 4 toksisuutta 50 potilaalla (23,9 %). Näillä potilailla mediaaniaika tapahtuman ensimmäiseen ilmaantumiskertaan oli 56 vuorokautta (vaihteluväli:1–1 769 vuorokautta) ja mediaanikesto esiintymiskertaa kohden oli 15 vuorokautta (vaihteluväli:1–913 vuorokautta).
Trombosytopeniaa raportoitiin haittavaikutuksena 472 potilaalla (34,4 %), joista 42 lopetti bosutinibihoidon trombosytopenian vuoksi. Enintään vaikeusasteen 1 toksisuutta esiintyi 114 potilaalla (24,2 %), vaikeusasteen 2 toksisuutta 88 potilaalla(18,6 %), vaikeusasteen 3 toksisuutta 172 potilaalla (36,4 %) ja vaikeusasteen 4 toksisuutta 98 potilaalla (20,8 %). Näillä potilailla mediaaniaika tapahtuman ensimmäiseen ilmaantumiskertaan oli 28 vuorokautta (vaihteluväli:1–1 688 vuorokautta) ja mediaanikesto esiintymiskertaa kohden oli 15 vuorokautta (vaihteluväli:1–3 921 vuorokautta).
Maksa ja sappi
Potilailla, joilla raportoitiin haittavaikutuksena minkä tahansa vaikeusasteen ALAT- tai ASAT-arvon kohoamista, mediaaniaika arvon kohoamiseen oli 29 vuorokautta (vaihteluväli molempien osalta 1–3 995 vuorokautta). ALAT-arvot pysyivät koholla 17 vuorokautta (mediaani, vaihteluväli: 1–1 148 vuorokautta) ja ASAT-arvot pysyivät koholla 15 vuorokautta (mediaani, vaihteluväli:1–803 vuorokautta).
Kaksi tapausta, jotka sopivat lääkkeen aiheuttamaan maksavaurioon (määritelmä ALAT- tai ASAT-arvon samanaikainen suureneminen ≥ 3-kertaiseksi, kokonaisbilirubiiniarvon suureneminen > 2‑kertaiseksi, ja alkalisen fosfataasin arvo < 2-kertainen viitevälin ylärajaan nähden), on ilmennyt ilman muuta syytä 2 potilaalla 1 711:stä bosutinibia saaneesta potilaasta (0,1 %).
Hepatiitti B:n uudelleenaktivoituminen
Hepatiitti B:n uudelleenaktivoitumista on ilmoitettu BCR-ABL-tyrosiinikinaasin estäjien käytön yhteydessä. Tämä aiheutti joissakin tapauksissa maksan vajaatoimintaa tai fulminanttia hepatiittia, joka johti maksansiirtoon tai kuolemaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ruoansulatuselimistö
Ripulin sai 1 103 potilasta (80,4 %), joista 14 lopetti bosutinibihoidon tämän haittatapahtuman vuoksi. Ripulin hoitoon annettiin samanaikaisia lääkevalmisteita 756 potilaalle (68,5 %). Enintään vaikeusasteen 1 toksisuutta esiintyi 575 potilaalla (52,1 %), vaikeusasteen 2 toksisuutta 383 potilaalla (34,7 %), vaikeusasteen 3 toksisuutta 144 potilaalla (13,1 %) ja vaikeusasteen 4 haittatapahtuma yhdellä potilaalla (0,1 %). Mediaaniaika tapahtuman ensimmäiseen ilmaantumiskertaan oli 2 vuorokautta (vaihteluväli:1–2 702 vuorokautta) ja kaikkien vaikeusasteiden ripulin mediaanikestoaika oli 2 vuorokautta (vaihteluväli:1–4 247 vuorokautta).
Ripulin saaneista 1 103 potilaasta 218 potilaan (19,8 %) ripuli hoidettiin keskeyttämällä hoito, ja näistä 208 potilasta (95,4 %) sai uudelleen bosutinibia. Bosutinibia uudelleen saaneista potilaista 201:llä (96,6 %) ei enää esiintynyt ripulia tai heidän bosutinibihoitoaan ei keskeytetty ripulin uusiutumisen vuoksi.
Sydän
Seitsemällä potilaalla (0,5 %) esiintyi QTcF-ajan pitenemistä (yli 500 ms). Yhdellätoista potilaalla (0,8 %) esiintyi QTcF-ajan pitenemistä lähtötasosta > 60 ms. Kliinisiin tutkimuksiin ei otettu mukaan potilaita, joilla oli huonossa hoitotasapainossa oleva tai merkittävä sydän- ja verisuonitauti, kuten QTc-ajan piteneminen (ks. kohdat Farmakodynamiikka ja Prekliiniset tiedot turvallisuudesta).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kokemus bosutinibin yliannostuksesta rajoittui kliinisissä tutkimuksissa yksittäisiin tapauksiin. Bosutinibin yliannostustapauksessa potilasta on seurattava ja hänelle on annettava asianmukaista elintoimintoja tukevaa hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastiset lääkeaineet, proteiinikinaasin estäjät, ATC-koodi: L01EA04.
Vaikutusmekanismi
Bosutinibi kuuluu kinaasin estäjiksi kutsuttujen lääkevalmisteiden farmakologiseen luokkaan. Bosutinibi estää poikkeavaa BCR-ABL-kinaasia, joka edistää kroonista myelooista leukemiaa. Mallinnustutkimukset osoittavat, että bosutinibi sitoo BCR-ABL:n kinaasidomeenin. Bosutinibi on myös Scr-kinaasiperheen (mukaan lukien Scr, Lyn ja Hck) estäjä. Bosutinibi estää hyvin vähäisessä määrin verihiutalekasvutekijän (PDGF) reseptoria ja KIT-proto-onkogeenia (c-Kit).
Bosutinibi esti in vitro -tutkimuksissa todennettujen KML-solulinjojen, Ph+ ALL -solulinjojen ja potilaasta peräisin olevien primaaristen primitiivisten KML-solujen proliferaatiota ja eloonjääntiä. Bosutinibi esti 16:ta hiiren myelooisissa solulinjoissa ilmentyvää imatinibille resistenttiä BCR-ABL-muotoa kaikkiaan 18:sta tällaisesta BCR-ABL-muodosta. Bosutinibi pienensi nude-hiirten KML-kasvainten kokoa ja esti imatinibille resistenttiä BCR-ABL-muotoa ilmentävien hiiren myelooisten kasvainten kasvua. Bosutinibi estää myös reseptorityrosiinikinaaseja c-Fms ja EphA, B-reseptoreja, Trk-perheen kinaaseja, Axl-perheen kinaaseja, Tec-perheen kinaaseja, joitakin ErbB-perheeseen kuuluvia kinaaseja, ei-reseptorityrosiinikinaasia Csk, Ste20-perheen seriini-treoniinikinaaseja ja kahta kalmoduliiniriippuvaista proteiinikinaasia.
Farmakodynaamiset vaikutukset
500 mg:n bosutinibiannoksen vaikutusta QTc-aikaan selvitettiin satunnaistetussa, kerta-annoksella toteutetussa, bosutinibin suhteen kaksoissokkoutetussa, lumekontrolloidussa ja avoimessa moksifloksasiinikontrolloidussa ristikkäistutkimuksessa terveillä tutkittavilla.
Tästä tutkimuksesta saadut tiedot osoittavat, että bosutinibi ei pidennä terveiden tutkittavien QTc-aikaa käytettäessä 500 mg:n vuorokausiannosta ruoan kanssa eikä myöskään olosuhteissa, joissa pitoisuus plasmassa suurenee terapeuttisia pitoisuuksia suuremmaksi. Terveille tutkittaville suun kautta annetun 500 mg:n bosutinibikerta-annoksen (terapeuttinen annos) antamisen jälkeen ja 500 mg:n bosutinibiannoksen ja 400 mg:n ketokonatsoliannoksen yhdistelmän (bosutinibin terapeuttista pitoisuutta suuremman pitoisuuden saavuttamiseksi) antamisen jälkeen QTc-ajan keskimuutoksen yksisuuntaisen 95 %:n luottamusvälin yläraja oli alle 10 ms jokaisena annoksen antamisen jälkeisenä ajankohtana eikä QTc-ajan pitenemiseen viittaavia haittatapahtumia havaittu.
Maksan vajaatoimintaa sairastavilla potilailla tehdyssä tutkimuksessa havaittiin, että maksan toiminnan heikentyessä QTc-ajan pitenemistä arvoon > 450 ms esiintyi useammin. Aiempaa hoitoa saaneilla Ph+-leukemiaa sairastavilla potilailla, joita hoidettiin 500 mg:lla bosutinibia vaiheen 1/2 kliinisessä tutkimuksessa, QTcF-ajan pitenemistä > 60 ms lähtötilanteesta havaittiin 9 potilaalla (1,6 %) 570 potilaasta. Äskettäin todettua KML:n kroonista vaihetta sairastavilla potilailla, joita hoidettiin 400 mg:lla bosutinibia vaiheen 3 kliinisessä tutkimuksessa, QT-aika ei pidentynyt > 60 ms lähtötilanteesta yhdelläkään bosutinibiryhmän potilaista (N = 268). Äskettäin todettua Ph+ KML:n kroonista vaihetta sairastavilla potilailla, joita hoidettiin 500 mg:lla bosutinibia vaiheen 3 kliinisessä tutkimuksessa, QTcF-ajan pitenemistä > 60 ms lähtötilanteesta havaittiin 2 potilaalla (0,8 %) 248:sta bosutinibia saaneesta potilaasta. Aiempaa hoitoa yhdellä tai useammalla tyrosiinikinaasin estäjällä saaneilla Ph+ KML -potilailla, joita hoidettiin 500 mg:lla bosutinibia vaiheen 4 kliinisessä tutkimuksessa (N = 163), QTcF-aika ei pidentynyt > 60 ms lähtötilanteesta yhdelläkään potilaalla. Bosutinibin proarytmistä potentiaalia ei voida sulkea pois.
Kliininen teho ja turvallisuus
Kliininen tutkimus potilailla, joilla oli aiemmin hoitamaton kroonisen vaiheen KML
Bosutinibi 400 mg -tutkimus
Lääkeaineiden paremmuutta arvioineessa kaksihaaraisessa vaiheen 3 avoimessa monikeskustutkimuksessa verrattiin kerran vuorokaudessa monoterapiana annetun 400 mg:n bosutinibiannoksen turvallisuutta ja tehoa kerran vuorokaudessa monoterapiana annettuun 400 mg:n imatinibiannokseen aikuispotilailla, joilla oli äskettäin todetun Ph+ KML:n krooninen vaihe. Tutkimuksessa satunnaistettiin 536 potilasta (268 kummassakin hoitoryhmässä), joilla oli joko äskettäin todetun Ph+ tai Ph- KML:n krooninen vaihe (hoitoaikeen mukainen potilasjoukko, intent-to-treat population [ITT]). Tässä potilasjoukossa oli mukana 487 Ph+ KML:aa sairastavaa potilasta, jotka ilmensivät b2a2- ja/tai b3a2-transkripteja ja joilla oli lähtötilanteessa BCR-ABL-kopioita > 0 (modifioitu hoitoaikeen mukainen [mITT] potilasjoukko).
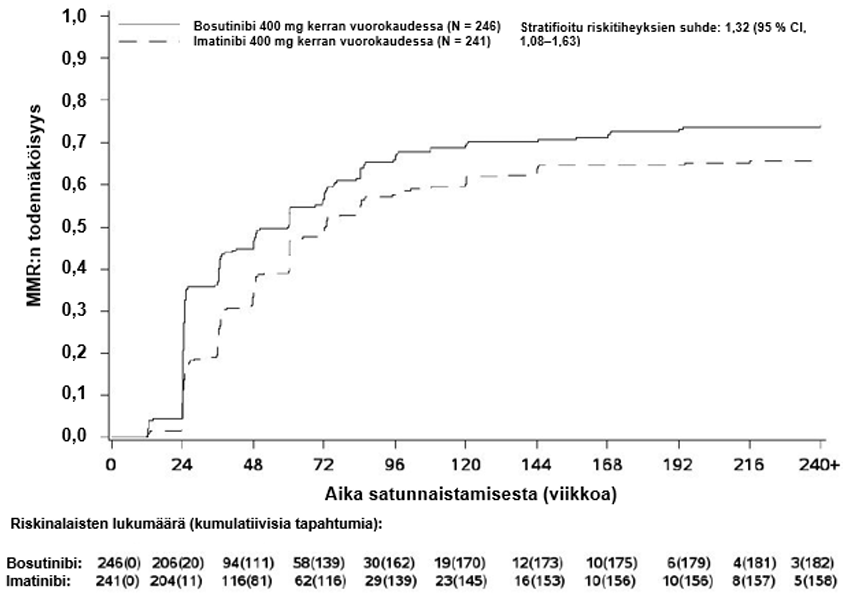
Tehon ensisijainen päätetapahtuma oli niiden potilaiden osuus, joilla voitiin osoittaa merkittävä molekulaarinen vaste (major molecular response, MMR) 12 kuukauden (48 viikon) kohdalla bosutinibiryhmässä verrattuna imatinibiryhmään mITT-potilasjoukossa. MMR:n määritelmä oli ≤ 0,1 %:n BCR-ABL/ABL-suhde kansainvälisellä asteikolla (IS) (vastaa ≥ 3 logaritmiyksikön pienenemää vakioidusta lähtötilanteesta) ja vähintään 3 000 ABL-transkriptia keskuslaboratorion määrityksen mukaan.
Keskeiset toissijaiset päätetapahtumat olivat CCyR (täydellinen sytogeneettinen vaste) 12. kuukauteen mennessä, CCyR:n kesto, MMR:n kesto, tapahtumavapaa elinaika (event-free survival, EFS) ja kokonaiselinaika (overall survival, OS). CCyR 12. kuukauteen mennessä määriteltiin Ph+-metafaasien puuttumiseksi raitavärjäysanalyysissa, jossa oli mukana ≥ 20 luuydinaspiraatista saatua metafaasia, tai MMR:ksi, jos riittävää sytogeneettistä arviota ei ollut saatavilla. Vain seuraavien päätetapahtumien p-arvoille tehtiin monivertailukorjaus: MMR 12 kuukauden kohdalla ja CCyR 12. kuukauteen mennessä.
mITT-potilasjoukon lähtötilanteen tiedot olivat vertailukelpoisia tutkimuksen kahden hoitoryhmän välillä seuraavien ominaisuuksien suhteen: ikä (bosutinibiryhmässä mediaani-ikä oli 52 vuotta ja imatinibiryhmässä 53 vuotta, bosutinibiryhmässä 19,5 % potilaista ja imatinibiryhmässä 17,4 % potilaista oli vähintään 65-vuotiaita), sukupuoli (naisia 42,3 % ja 44,0 %), etninen tausta (valkoihoisia 78,0 % ja 77,6 %, aasialaisia 12,2 % ja 12,4 %, mustaihoisia tai afrikkalaisamerikkalaisia 4,1 % ja 4,1 %, muita 5,7 % ja 5,4 % ja 1 tuntematon imatinibiryhmässä) ja Sokal-pisteet (pieni riski 35,0 % ja 39,4 %, keskiriski 43,5 % ja 38,2 %, suuri riski 21,5 % ja 22,4 %).
Kun mITT-potilasjoukon seurantaa oli jatkettu 60 kuukautta, 60,2 % bosutinibilla hoidetuista potilaista (N = 246) ja 59,8 % imatinibilla hoidetuista potilaista (N = 239) sai edelleen ensilinjan hoitoa.
Kun mITT-potilasjoukon seurantaa oli jatkettu 60 kuukautta, 0,8 % bosutinibilla hoidetuista potilaista ja 1,7 % imatinibilla hoidetuista potilaista keskeytti hoidon KML:n edettyä akseleraatiovaiheeseen tai blastikriisivaiheeseen. KML transformoitui kuudella bosutinibipotilaalla (2,4 %) ja seitsemällä imatinibipotilaalla (2,9 %) akseleraatiovaiheeseen tai blastikriisivaiheeseen. Hoidon keskeytti suboptimaalisen vasteen tai hoidon epäonnistumisen vuoksi tutkijan arvion mukaan 5,3 % bosutinibiryhmän potilaista ja 15,5 % imatinibiryhmän potilaista. Kaksitoista bosutinibiryhmän potilasta (4,9 %) ja 14 imatinibiryhmän potilasta (5,8 %) kuoli tutkimuksen aikana. Hoitoaikeen mukaisessa (ITT, intention to treat) potilasjoukossa ei tapahtunut lisätransformoitumisia, ja ITT-potilasjoukon bosutinibiryhmässä kuoli lisäksi kaksi potilasta.
Taulukossa 3 on yhteenveto tehoa koskevista tuloksista (MMR ja CCyR).
Taulukko 3 – Yhteenveto: MMR kuukausien 12 ja 18 kohdalla ja CCyR 12. kuukauteen mennessä mITT-potilasjoukossa hoitoryhmittäin
| Vaste | Bosutinibi (N = 246) | Imatinibi (N = 241) | Vetosuhde (odds ratio) (95 %:n CI)a |
Merkittävä molekulaarinen vaste MMR kuukauden 12 kohdalla, n (%) (95 %:n CI) | 116 (47,2)b (40,9, 53,4) | 89 (36,9) (30,8, 43,0) | 1,55 (1,07, 2,23) |
| Yksisuuntainen p-arvo | 0,0100b | ||
MMR kuukauden 18 kohdalla, n (%) (95 %:n CI) | 140 (56,9) (50,7, 63,1) | 115 (47,7) (41,4, 54,0) | 1.45 (1,02, 2,07) |
| Yksisuuntainen p-arvo | 0,0208c | ||
Täydellinen sytogeneettinen vaste CcyR 12. kuukauteen mennessä, n (%) (95 %:n CI) | 190 (77,2)b (72,0, 82,5) | 160 (66,4) (60,4, 72,4) | 1.74 (1,16, 2,61) |
| Yksisuuntainen p-arvo | 0,0037b | ||
Huomaa: MMR:n määritelmä oli ≤ 0,1 %:n BCR-ABL/ABL-suhde IS-asteikolla (vastaa ≥ 3 logaritmiyksikön pienenemää vakioidusta lähtöarvosta) ja vähintään 3 000 ABL-transkriptia keskuslaboratorion arvion mukaan. Täydellisen sytogeneettisen vasteen määritelmä oli Ph+-metafaasien puuttuminen raitavärjäysanalyysissa, jossa oli ≥ 20 luuydinaspiraatista saatua metafaasia, tai MMR, jos riittävää sytogeneettistä arviota ei ollut saatavilla.
Lyhenteet: BCR-ABL = breakpoint cluster region-Abelson, CI = luottamusväli, CMH = Cochran‑Mantel‑Haenszel, CCyR = täydellinen sytogeneettinen vaste, mITT = modified intent-to-treat, modifioitu hoitoaikeen mukainen, MMR = merkittävä molekulaarinen vaste, N = potilaiden lukumäärä, Ph+ = Philadelphia-kromosomipositiivinen.
a Korjattu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
b Tilastollisesti merkitsevä vertailu ennalta määritetyllä merkitsevyystasolla; perustuu CMH-testiin, joka on stratifioitu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
c Perustuu CMH-testiin, joka on stratifioitu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
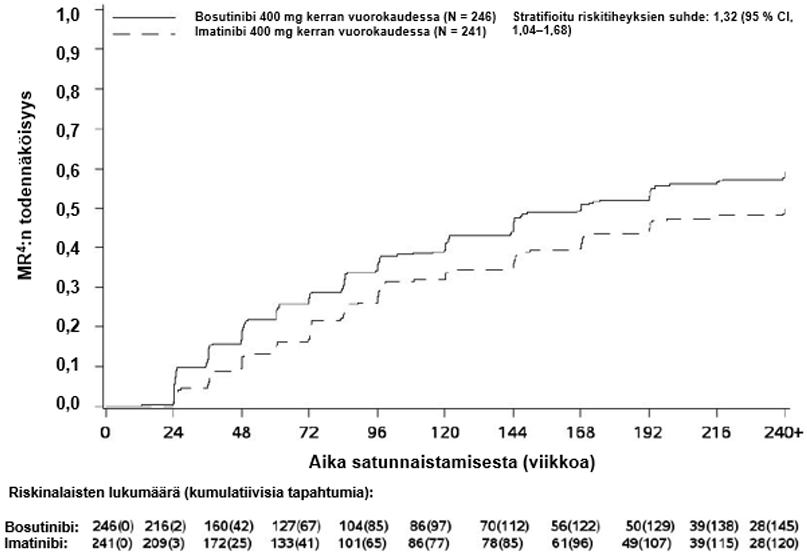
Kuukauden 12 kohdalla MR4:n saavuttaneiden osuus (määritelmä: ≤ 0,01 % BCR-ABL-transkripteja [vastaa ≥ 4 logaritmiyksikön pienenemää vakioidusta lähtöarvosta] ja vähintään 9 800 ABL-transkriptia) oli mITT-potilasjoukossa suurempi bosutinibiryhmässä kuin imatinibiryhmässä (20,7 % [95 %:n CI: 15,7 %, 25,8 %] vs 12,0 % [95 %:n CI: 7,9 %, 16,1 %], vetosuhde (OR) 1,88 [95 %:n CI: 1,15, 3,08], yksisuuntainen p-arvo = 0,0052).
Kuukausien 3, 6 ja 9 kohdalla MMR:n saavuttaneiden osuus oli suurempi bosutinibiryhmässä kuin imatinibiryhmässä (taulukko 4).
Taulukko 4 – MMR:n vertailu hoitoryhmittäin kuukausien 3, 6 ja 9 kohdalla mITT-potilasjoukossa
| Ajankohta | MMR:n saavuttaneiden tutkittavien lukumäärä (%) | Vetosuhde (95 %:n CI)a | |
Bosutinibi (N = 246) | Imatinibi (N = 241) | ||
Kuukausi 3 (95 %:n CI) | 10 (4,1) (1,6, 6,5) | 4 (1.7) (0,0, 3,3) | 2.48 (0,77, 7,98) |
| Yksisuuntainen p-arvob | 0,0578 | ||
Kuukausi 6 (95 %:n CI) | 86 (35,0) (29,0, 40,9) | 44 (18,3) (13,4, 23,1) | 2,42 (1,59, 3,69) |
| Yksisuuntainen p-arvob | <0,0001 | ||
Kuukausi 9 (95 %:n CI) | 104 (42,3) (36,1, 48,4) | 71 (29,5) (23,7, 35,2) | 1,78 (1,22, 2,60) |
| Yksisuuntainen p-arvob | 0,0015 | ||
Huomaa: Prosentuaaliset osuudet perustuivat kummankin hoitoryhmän potilaiden lukumäärään. MMR:n määritelmä oli ≤ 0,1 %:n BCR-ABL/ABL-suhde IS-asteikolla (vastaa ≥ 3 logaritmiyksikön pienenemää vakioidusta lähtöarvosta) ja vähintään 3 000 ABL-transkriptia keskuslaboratorion arvion mukaan.
Lyhenteet: BCR-ABL = breakpoint cluster region-Abelson, CI = luottamusväli, CMH = Cochran‑Mantel‑Haenszel, mITT = modified intent-to-treat, modifioitu hoitoaikeen mukainen, MMR = merkittävä molekulaarinen vaste, N = potilaiden lukumäärä.
a Korjattu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
b Perustuu CMH-testiin, joka on stratifioitu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
60. kuukauteen mennessä MMR:n, MR4:n ja MR4.5:n saavuttaneiden osuus mITT-potilasjoukossa oli suurempi bosutinibiryhmässä kuin imatinibiryhmässä (taulukko 5). Taulukossa 6 on yhteenveto MMR-vasteista 60. kuukauteen mennessä Sokal-riskiryhmittäin.
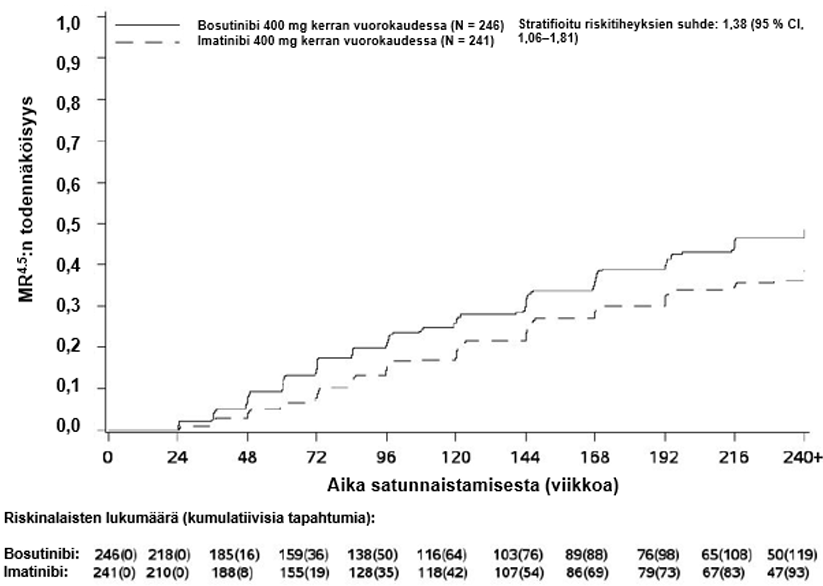
Taulukko 5 – Yhteenveto: molekulaarinen vaste mITT-potilasjoukossa 60. kuukauteen mennessä
| Vaste | Bosutinibi (N = 246) | Imatinibi (N = 241) | Vetosuhde (95 %:n CI)a |
Molekulaarinen vaste 60. kuukauteen mennessä, n (%) (95 %:n CI) | |||
| MMR | 182 (74,0) (68,5, 79,5) | 158 (65,6) (59,6, 71,6) | 1,52 (1,02, 2,25) |
| MR4 | 145 (58,9) (52,8, 65,1) | 120 (49,8) (43,5, 56,1) | 1,46 (1,02, 2,09) |
| MR4.5 | 119 (48,4) (42,1, 54,6) | 93 (38,6) (32,4, 44,7) | 1,50 (1,05, 2,16) |
Huomaa: MMR:n/MR4:n/MR4.5:n määritelmä oli ≤ 0,1/0,01/0,0032 %:n BCR-ABL/ABL-suhde IS‑asteikolla (vastaa ≥ 3 / 4 / 4,5 logaritmiyksikön pienenemää vakioidusta lähtöarvosta) ja vähintään 3 000 / 9 800 / 30 990 ABL-transkriptia keskuslaboratorion arvion mukaan.
Lyhenteet: BCR-ABL = breakpoint cluster region-Abelson, CI = luottamusväli, mITT = modified intent-to-treat, modifioitu hoitoaikeen mukainen, MMR = merkittävä molekulaarinen vaste, MR = molekulaarinen vaste, N = potilaiden lukumäärä.
a Korjattu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
Taulukko 6 – Yhteenveto: MMR 60. kuukauteen mennessä Sokal-riskipisteittäin mITT-potilasjoukossa
| Vaste | Bosutinibi | Imatinibi | Vetosuhde (95 %:n CI) |
Sokal – pieni riski MMR, n (%) (95 %:n CI) | N = 86 67 (77,9) (69,1, 86,7) | N = 95 68 (71,6) (62,5, 80,6) | 1,40 (0,71, 2,76) |
Sokal – keskiriski MMR, n (%) (95 %:n CI) | N = 107 79 (73,8) (65,5, 82,2) | N = 92 62 (67,4) (57,8, 77,0) | 1,37 (0,74, 2,52) |
Sokal – suuri riski MMR, n (%) (95 %:n CI) | N = 53 36 (67,9) (55,4, 80,5) | N = 54 28 (51,9) (38,5, 65,2) | 1,97 (0,90, 4,32) |
Huomaa: Prosentuaaliset osuudet perustuivat kummankin hoitoryhmän potilaiden lukumäärään. MMR:n määritelmä oli ≤ 0,1 %:n BCR-ABL/ABL-suhde IS-asteikolla (vastaa ≥ 3 logaritmiyksikön pienenemää vakioidusta lähtöarvosta) ja vähintään 3 000 ABL-transkriptia keskuslaboratorion arvion mukaan.
Lyhenteet: BCR-ABL = breakpoint cluster region-Abelson, CI = luottamusväli, mITT = modified intent-to-treat, modifioitu hoitoaikeen mukainen, MMR = merkittävä molekulaarinen vaste, N = potilaiden lukumäärä.
CCyR:n kumulatiivinen ilmaantuvuus, joka on korjattu kilpailevan riskin eli hoidon keskeyttämisen ilman CCyR:n saavuttamista suhteen, oli suurempi bosutinibiryhmässä kuin imatinibiryhmässä mITT-potilasjoukossa (83,3 % [95 %:n CI: 78,1 %, 87,4 %] vs 76,8 % [95 %:n CI: 70,9 %, 81,6 %] kuukautena 60; stratifioituun suhteellisten subdistributionaalisten riskitiheyksien malliin perustuva riskitiheyksien suhde [HR]: 1,35 [95 %:n CI: 1,11, 1,64]). Mediaaniaika CCyR:n saavuttamiseen (vain hoitoon vastanneilla) oli 24,0 viikkoa (vaihteluväli: 11,4–120,7) bosutinibiryhmässä ja 24,3 viikkoa (vaihteluväli: 11,4–96,6) imatinibiryhmässä.
Mediaaniaika MMR:n saavuttamiseen oli 36,1 viikkoa (vaihteluväli: 11,9–241,9), MR4:n saavuttamiseen 83,7 viikkoa (vaihteluväli: 12,4–244,3) ja MR4.5:n saavuttamiseen 108,0 viikkoa (vaihteluväli: 24,1–242,1) bosutinibiryhmässä verrattuna imatinibiryhmään, jossa vastaavat luvut olivat 47,7 viikkoa (vaihteluväli: 12,1–216,1), 84,4 viikkoa (vaihteluväli: 23,6–241,9) ja 120,4 viikkoa (vaihteluväli: 24,6–240,7), mITT-potilasryhmässä (vain hoitoon vastanneilla).
MMR:n, MR4:n ja MR4.5:n kumulatiivinen ilmaantuvuus, joka on korjattu kilpailevan riskin eli hoidon keskeyttämisen ilman tapahtumaa suhteen, oli suurempi bosutinibiryhmässä kuin imatinibiryhmässä, kuten kuvat 1–3 osoittavat.
Kuva 1 – MMR:n kumulatiivinen ilmaantuvuus (mITT-potilasjoukko)
Kuva 2 – MR4:n kumulatiivinen ilmaantuvuus (mITT-potilasjoukko )
Kuva 3 – MR4.5:n kumulatiivinen ilmaantuvuus (mITT-potilasjoukko)
mITT-potilasjoukossa CCyR:n saavuttaneilla potilailla vasteen säilymisen Kaplan–Meierin estimaatti vuoden 4 kohdalla oli bosutinibiryhmässä 97,4 % (95 %:n CI: 93,9 %, 98,9 %) ja imatinibiryhmässä 93,7 % (95 %:n CI: 88,9 %, 96,5 %) (HR 0,39 [95 %:n CI: 0,14, 1,13]). MMR:n saavuttaneilla potilailla vasteen säilymisen Kaplan–Meierin estimaatti vuoden 4 kohdalla oli bosutinibiryhmässä 92,2 % (95 %:n CI: 86,8 %, 95,4 %) ja imatinibiryhmässä 92,0 % (95 %:n CI: 85,9 %, 95,5 %) (HR 1,09 [95 %:n CI: 0,49, 2,44]).
60. kuukauteen mennessä mITT-potilasjoukossa bosutinibihoitoa saaneista potilaista 43,9 %:lla (95 %:n CI: 37,7 %, 50,1 %) ja imatinibihoitoa saaneista potilaista 38,6 %:lla (95 %:n CI: 32,4 %, 44,7 %) (OR 1,24 [95 %:n CI: 0,87, 1,78]) oli jatkuva MR4, joka määriteltiin seuraavien kriteerien mukaan: vähintään 3 vuoden hoito ja vähintään MR4 kaikissa 1 vuoden ajanjaksolla tehdyissä arvioissa.
Hoidonaikaista tapahtumavapaata elinaikaa koskevien tapahtumien kumulatiivinen ilmaantuvuus kuukauden 60 kohdalla mITT-potilasjoukossa oli bosutinibiryhmässä 6,9 % (95 %:n CI: 4,2 %, 10,5 %) ja imatinibiryhmässä 10,4 % (95 %:n CI: 6,9 %, 14,6 %) (HR 0,64, 95 %:n CI: 0,35, 1,17).
Kokonaiselinajan Kaplan–Meierin estimaatti oli mITT-potilasjoukossa kuukauden 60 kohdalla bosutinibipotilailla 94,9 % (95 %:n CI: 91,1 %, 97,0 %) ja imatinibipotilailla 94,0 % (95 %:n CI: 90,1 %, 96,4 %) (HR 0,80, 95 %:n CI: 0,37, 1,73).
Retrospektiivisessä analyysissä ITT-potilasjoukon arvioitavissa olleista potilaista useampi bosutinibiryhmässä, 200/248 (80,6 %), saavutti varhaisen molekulaarisen vasteen (BCR-ABL-transkripteja ≤ 10 % kuukauden 3 kohdalla) verrattuna imatinibiryhmän potilaisiin, 153/253 (60,5 %), OR 2,72 (95 %:n CI: 1,82, 4,08). Taulukossa 7 on yhteenveto MMR:sta ja tapahtumavapaasta elinajasta kuukauden 60 kohdalla bosutinibipotilailla, jotka saavuttivat varhaisen molekulaarisen vasteen tai eivät saavuttaneet sitä.
Taulukko 7 – Hoitotulokset kuukauden 60 kohdalla bosutinibipotilailla, joilla BCR-ABL oli ≤ 10 % vs > 10 % kuukauden 3 kohdalla (ITT-potilasjoukko)
| Bosutinibi (N = 248) | Potilaat, joilla BCR-ABL ≤ 10 % kuukauden 3 kohdalla (N = 200) | Potilaat, joilla BCR-ABL > 10 % kuukauden 3 kohdalla (N = 48) | Riskitiheyksien suhde (95 %:n CI)a |
| MMR:n kumulatiivinen ilmaantuvuus, % (95 %:n CI) | 84,0 (78,1, 88,4) | 56,5 (41,1, 69,4) | 2,67 (1,90, 3,75) |
| Tapahtumavapaan elinajan (EFS) tapahtumien kumulatiivinen ilmaantuvuus, % (95 %:n CI) | 5,5 (2,9, 9,3) | 12,5 (5,1, 23,4) | 0,40 (0,14, 1,17) |
Lyhenteet: BCR-ABL = breakpoint cluster region-Abelson, CI = luottamusväli, ITT = hoitoaikeen mukainen, intent-to-treat, MMR = merkittävä molekulaarinen vaste, EFS = tapahtumavapaa elinaika, N = niiden potilaiden lukumäärä, joilla oli ≥ 3 000 ABL-kopiota kuukauden 3 kohdalla.
a Korjattu maantieteellisen alueen ja satunnaistamishetken Sokal-pisteiden mukaan.
Bosutinibiryhmässä oli kuukauden 60 kohdalla vähemmän potilaita [6 potilasta (2,4 %) bosutinibiryhmässä ja 12 potilasta (5,0 %) imatinibiryhmässä], joilla havaittiin uusia mutaatioita mITT-potilasjoukossa.
Vaiheen 1/2 kliininen tutkimus KML:n kroonista vaihetta, akseleraatiovaihetta tai blastikriisivaihetta sairastavilla potilailla, jotka olivat imatinibille resistenttejä tai intolerantteja
Yksihaaraisessa vaiheen 1/2 avoimessa monikeskustutkimuksessa arvioitiin kerran vuorokaudessa 500 mg:n annoksella annetun bosutinibin tehoa ja turvallisuutta KML-potilailla, jotka olivat imatinibille resistenttejä tai intolerantteja. Potilaat oli jaettu eri kohortteihin sen perusteella, sairastivatko he kroonista vaihetta, akseleraatiovaihetta vai blastikriisivaihetta ja olivatko he saaneet aiemmin hoitoa yhdellä tyrosiinikinaasin estäjällä (imatinibilla) vai useammalla kuin yhdellä tyrosiinikinaasin estäjällä (imatinibilla, jonka jälkeen dasatinibilla ja/tai nilotinibilla).
Tässä tutkimuksessa bosutinibia sai 570 potilasta mukaan lukien KML:n kroonisen vaiheen potilaat, jotka olivat saaneet aiemmin hoitoa vain yhdellä tyrosiinikinaasin estäjällä (imatinibilla) tai jotka olivat aiemmin saaneet imatinibia sekä ainakin yhtä muuta tyrosiinikinaasin estäjää (dasatinibia ja/tai nilotinibia), KML:n akseleraatiovaiheen tai blastikriisivaiheen potilaat, jotka olivat aiemmin saaneet hoitoa ainakin yhdellä tyrosiinikinaasin estäjällä (imatinibilla), sekä Ph+ ALL:aa sairastavat potilaat, jotka olivat aiemmin saaneet hoitoa ainakin yhdellä tyrosiinikinaasin estäjällä (imatinibilla).
Tutkimuksessa tehon ensisijainen päätetapahtuma oli merkittävän sytogeneettisen vasteen (MCyR) osuus viikolla 24 imatinibille resistenteillä KML:n kroonista vaihetta sairastavilla potilailla, jotka olivat saaneet aiemmin hoitoa vain yhdellä tyrosiinikinaasin estäjällä (imatinibilla). Muita tehon päätetapahtumia olivat kumulatiiviset sytogeneettiset ja molekulaariset vasteet, aika sytogeneettisten ja molekulaaristen vasteiden saavuttamiseen ja vasteiden kestot, vaste lähtötilanteen mutaatioissa, taudin transformoituminen akseleraatio-/blastikriisivaiheeksi, taudin etenemisestä vapaa elinaika sekä kaikkien kohorttien OS.
Potilaat, jotka saivat edelleen bosutinibia vaiheen 1/2 tutkimuksen lopussa ja jotka tutkijan arvion mukaan hyötyivät bosutinibihoidosta, sekä potilaat, jotka olivat jo lopettaneet bosutinibihoidon osana vaiheen 1/2 tutkimusta ja jotka olivat eloonjäämisen pitkäaikaisseurannassa tai jotka olivat saattaneet vaiheen 1/2 tutkimuksen loppuun, olivat soveltuvia osallistumaan jatkotutkimukseen. Kukin potilas pysyi jatkotutkimuksessa joko bosutinibihoidossa tai eloonjäämisen pitkäaikaisseurannassa, kunnes viimeinen potilas saavutti 10 vuoden seuranta-ajan, joka laskettiin siitä päivästä, jolloin hänelle annettiin ensimmäinen bosutinibiannos vaiheen 1/2 tutkimuksessa.
Jatkotutkimuksessa tehon päätetapahtumia olivat sytogeneettisten ja molekulaaristen vasteiden kestot, taudin transformoituminen akseleraatio-/blastikriisivaiheeksi, taudin etenemisestä vapaa elinaika ja OS.
Tehoa koskevat analyysit sisältävät tiedot tästä päättyneestä jatkotutkimuksesta.
KML-potilaiden krooninen vaihe
Tehoa koskevat tulokset Ph+ KML:n kroonisen vaiheen potilaista, jotka olivat aiemmin saaneet imatinibia ja ainakin yhtä muuta tyrosiinikinaasin estäjää (seuranta-aika vähintään 120 kuukautta, hoidon mediaanikesto 9 kuukautta (vaihteluväli: 0,23–164,28 kuukautta), ja 20,2 % sai edelleen hoitoa 60 kuukauden kohdalla ja 7,6 % 120 kuukauden kohdalla), sekä tulokset Ph+ KML:n kroonisen vaiheen potilaista, jotka olivat aiemmin saaneet vain imatinibia (seuranta-aika vähintään 120 kuukautta, hoidon mediaanikesto 26 kuukautta (vaihteluväli: 0,16–170,49 kuukautta), ja 40,5 % sai edelleen hoitoa 60 kuukauden kohdalla ja 19,4 % 120 kuukauden kohdalla), on esitetty taulukossa 8.
KML-potilaiden akseleraatio- ja blastikriisivaihe
Tehoa koskevat tulokset Ph+ KML:n akseleraatiovaihetta (seuranta-aika vähintään 120 kuukautta, hoidon mediaanikesto 10 kuukautta (vaihteluväli: 0,10–156,15 kuukautta), ja 12,7 % sai edelleen hoitoa 60 kuukauden kohdalla ja 7,6 % 120 kuukauden kohdalla) ja blastikriisivaihetta (seuranta-aika vähintään 120 kuukautta, hoidon mediaanikesto 2,8 kuukautta (vaihteluväli: 0,03–71,38 kuukautta), ja 3,1 % sai edelleen hoitoa 60 kuukauden kohdalla ja 0 % 120 kuukauden kohdalla) sairastavista potilaista on esitetty taulukossa 8.
Taulukko 8 – Tehoa koskevat tulokset aiemmin hoitoa saaneilla KML:n kroonista ja edennyttä vaihetta sairastavilla potilailla*
Ph+ KML:n krooninen vaihe: aiempi hoito ainoastaan imatinibilla | Ph+ KML:n krooninen vaihe: aiempi hoito imatinibilla ja dasatinibilla tai nilotinibilla | Akseleraatio-vaihe: aiempi hoito ainakin imatinibilla | Blastikriisi-vaihe: aiempi hoito ainakin imatinibilla | |
Kumulatiivinen sytogeneettinen vastea MCyR, % (95 %:n CI) CCyR, % (95 %:n CI) | N = 262 59,9 (53,7, 65,9) 49,6 (43,4, 55,8) | N = 112 42,0 (32,7, 51,7) 32,1 (23,6, 41,6) | N = 72 40,3 (28,9, 52,5) 30,6 (20,2, 42,5) | N = 54 37,0 (24,3, 51,3) 27,8 (16,5, 41,6) |
Kumulatiivinen molekulaarinen vastea MMR, % (95 %:n CI) MR4, % (95 %:n CI) | N = 197 42,1 (35,1, 49,4) 37,1 (30,3, 44,2) | N = 107 17,8 (11,0, 26,3) 15,0 (8,8, 23,1) | N = 54 16,7 (7,9, 29,3) 13,0 (5,4, 24,9) | N = 48 10,4 (3,5, 22,7) 10,4 (3,5, 22,7) |
| Aika MCyR:n saavuttamiseen vain vasteen saaneillab, mediaani (vaihteluväli), viikkoa | 12,3 (4,0, 346,0) | 12,3 (3,9, 550,6) | 12,0 (3,9, 144,7) | 8,2 (3,9, 25,1) |
MCyR:n kestob K–M 5 vuoden kohdalla, % (95 %:n CI) K–M 10 vuoden kohdalla, % (95 %:n CI) Mediaani, viikkoa (95 %:n CI) | N = 157 70,7 (63,1, 78,3) 65,3 (56,6, 74,0) N/R | N = 47 66,6 (51,5, 81,7) 55,3 (36,3, 74,4) N/R | N = 29 40,8 (20,9, 60,7) 40,8 (20,9, 60,7) 84,0 (24,0, N/E) | N = 20 21,2 (0,1, 42,3) N/E 29,1 (11,9, 38,3) |
| Aika CCyR:n saavuttamiseen vain vasteen saaneillab, mediaani (vaihteluväli), viikkoa | 24,0 (7,7, 240,6) | 24,0 (11,6, 216,0) | 23,8 (4,1, 120,0) | 8,4 (3,9, 25,1) |
CCyR:n kestob K–M 5 vuoden kohdalla, % (95 %:n CI) K–M 10 vuoden kohdalla, % (95 %:n CI) Mediaani, viikkoa (95 %:n CI) | N = 130 69,7 (61,3, 78,2) 63,4 (54,0, 72,8) N/R | N = 36 54,4 (36,7, 72,1) 40,8 (22,0, 59,6) 252,0 (24,0, N/E) | N = 22 40,0 (18,5, 61,5) 40,0 (18,5, 61,5) 72,0 (36,1, N/E) | N = 15 24,9 (0,9, 48,9) N/E 20,0 (9,1, 29,6) |
| Aika MMR:n saavuttamiseen vain vasteen saaneillab, mediaani (vaihteluväli), viikkoa | 35,6 (3,1, 367,1) | 12,4 (4,0, 171,7) | 36,1 (12,1, 144,1) | 4,7 (3,9, 168,9) |
MMR:n kestob K–M 5 vuoden kohdalla, % (95 %:n CI) K–M 10 vuoden kohdalla, % (95 %:n CI) Mediaani, viikkoa (95 %:n CI) | N = 83 74,1 (64,2, 83,9) 63,4 (50,2, 76,6) N/R | N = 19 70,0 (47,5, 92,5) 70,0 (47,5, 92,5) N/R | N = 9 66,7 (35,9, 97,5) 66,7 (35,9, 97,5) N/R | N = 5 60,0 (17,1, 100,0) N/E N/R |
| Aika MR4:n saavuttamiseen vain vasteen saaneillab, mediaani (vaihteluväli), viikkoa | 28,0 (3,1, 583,1) | 23,8 (4,0, 240,1) | 24,1 (22,9, 96,0) | 4,7 (3,9, 284,9) |
MR4:n kestob,e K–M 5 vuoden kohdalla, % (95 %:n CI) K–M 10 vuoden kohdalla, % (95 %:n CI) Mediaani, viikkoa (95 %:n CI) | N = 73 74,7 (64,2, 85,2) 60,8 (46,1, 75,4) N/R | N/A | N/A | N/A |
Transformoituminen akseleraatio-/blastikriisivaiheeksic Transformoituminen hoidon aikana, n | N = 284 15 | N = 119 5 | N = 79 3 | N/A |
Taudin etenemisestä vapaa elinaikac KumIlm 5 vuoden kohdalla, % (95 %:n CI)d KumIlm 10 vuoden kohdalla, % (95 %:n CI)d | N = 284 19,7 (15,6, 24,9) 23,9 (19,5, 29,5) | N = 119 24,4 (17,8, 33,4) 26,9 (20,0, 36,2) | N = 79 41,8 (32,2, 54,2) 41,8 (32,2, 54,2) | N = 64 67,2 (56,6, 79,7) N/E |
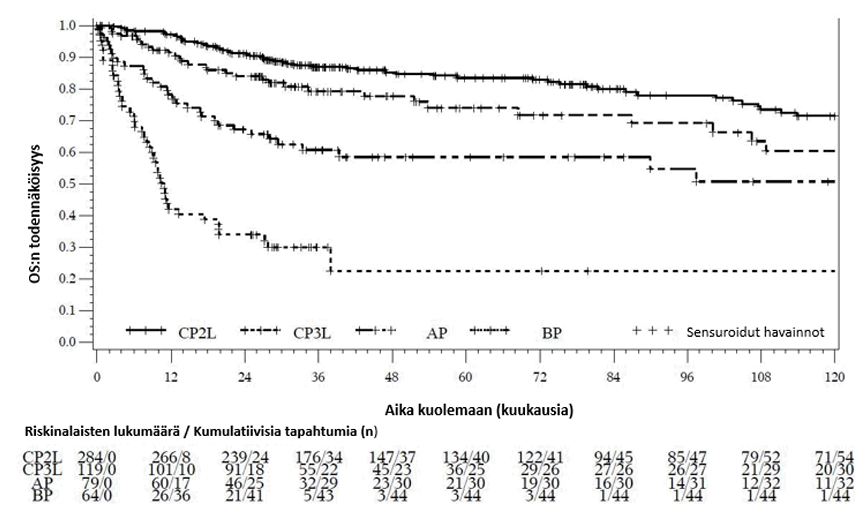
Kokonaiselinaikac K–M 5 vuoden kohdalla, % (95 %:n CI) K–M 10 vuoden kohdalla, % (95 %:n CI) Mediaani, kuukautta (95 %:n CI) | N = 284 83,5 (78,7, 88,3) 71,5 (64,4, 78,7) N/R | N = 119 74,1 (64,8, 83,4) 60,4 (47,2, 73,7) N/R | N = 79 58,5 (46,9, 70,2) 50,7 (36,5, 65,0) N/R | N = 64 22,5 (7,1, 37,9) 22,5 (7,1, 37,9) 10,9 (8,7, 19,7) |
* Tietojen keruupäivämäärä: Vaiheen 1/2 tutkimus 2. lokakuuta 2015, jatkotutkimus 2. syyskuuta 2020.
Sytogeneettisen vasteen kriteerit: MCyR sisälsi täydellisen [0 % Ph+-metafaaseja luuytimestä tai positiivisia soluja < 1 % FISH-tutkimuksessa (fluoresenssi in situ ‑hybridisaatio)] tai osittaisen (1–35 %) sytogeneettisen vasteen. Sytogeneettinen vaste perustui Ph+-metafaasien prosenttiosuuteen ≥ 20 metafaasisolusta kussakin luuydinnäytteessä.
FISH-analyysia (≥ 200 solua) voitiin käyttää lähtötilanteen jälkeen tehtäviin sytogeneettisiin arvioihin, jos ≥ 20 metafaasia ei ollut saatavissa. Jatkotutkimuksessa CCyR imputoitiin MMR:stä, jos käyttökelpoista sytogeneettistä arviointia ei ollut saatavana tietyltä päivältä.
Molekulaarisen vasteen kriteerit: Vaiheen 1/2 tutkimuksessa MMR/MR4 määriteltiin seuraavasti: ≤ 0,1/0,01 % BCR-ABL-transkriptejä keskuslaboratorion arvioimana (ei kansainvälisellä asteikolla). Jatkotutkimuksessa vasteen saaneilla MMR/MR4 merkittiin tapausraporttilomakkeeseen paikallisen laboratorion arvioinnin perusteella.
Lyhenteet: Ph+ = Philadelphia-kromosomipositiivinen, KML = krooninen myelooinen leukemia, K–M = Kaplan–Meierin estimaatti, N = potilaiden lukumäärä, N/A = ei käytettävissä, N/R = ei saavutettu vähimmäisseurannassa, N/E = ei arvioitavissa, CI = luottamusväli, MCyR = merkittävä sytogeneettinen vaste, CCyR = täydellinen sytogeneettinen vaste, KumIlm = kumulatiivinen ilmaantuvuus, MMR = merkittävä molekulaarinen vaste, BCR-ABL = breakpoint cluster region/Abelson
a Sisältää potilaat (N), joista on olemassa käypä lähtötilanteen arvio sytogeneettistä vastetta varten ja molekulaarista vastetta varten lukuun ottamatta potilaita Kiinasta, Etelä-Afrikasta, Intiasta tai Venäjältä, koska näistä maista ei voitu lähettää näytteitä molekulaarista arviointia varten. Lähtötilanteessa vasteen saaneet, joiden vaste säilyi lähtötilanteen jälkeen, voivat olla analyysissa vasteen saaneita. Vähimmäisseuranta-aika (aika viimeisen potilaan ensimmäisestä annoksesta tietojen keruupäivämäärään saakka) oli 120 kuukautta.
b Sisältää potilaat (N), jotka saavuttivat vasteen tai joilla se säilyi.
c Sisältää potilaat (N), jotka saivat vähintään yhden bosutinibiannoksen.
d Kumulatiivinen ilmaantuvuus -analyysi, joka on korjattu kilpailevan riskin eli hoidon keskeyttämisen ilman tapahtumaa suhteen.
e Ei analysoitu ryhmille, joissa rajallinen määrä potilaita.
Kokonaiselinaika kroonisen vaiheen, akseleraatiovaiheen ja blastikriisivaiheen kohorteissa on esitetty graafisesti kuvassa 4.
Kuva 4 – Kaplan–Meierin estimaatti kokonaiselinajalle (OS) kroonisen vaiheen 2. linjan hoidossa (CP2L), kroonisen vaiheen 3. linjan hoidossa (CP3L), akseleraatiovaiheessa (AP) ja blastikriisivaiheessa (BP)
Taulukko 9 – KML:n kroonista vaihetta sairastavien arvioitavissa olevien potilaiden vasteet lähtötilanteen BCR-ABL-mutaatiostatuksen mukaisesti: aikaisempi hoito imatinibi ja dasatinibi ja/tai nilotinibi (3. linjan hoito)
| Lähtötilanteen BCR-ABL-mutaatiostatus | Ilmaantuvuus lähtötilanteessa n (%)a | MCyR saavutettu tai säilytetty Resp/Evalb (%) N = 112 |
| Mutaatio määritetty | 98 (100,0) | 36/92 (39,1) |
| Ei mutaatiota | 59 (60,2) | 23/55 (41,8) |
| Vähintään 1 mutaatio | 39 (39,8) | 13/37 (35,1) |
| Dasatinibille resistentit mutaatiot | 10 (10,2) | 1/9 (11,1) |
| E255K/V | 2 (2,0) | 0/2 |
| F317L | 8 (8,2) | 1/7 (14,3) |
| Nilotinibille resistentit mutaatiotc | 13 (13,3) | 8/13 (61,5) |
| Y253H | 6 (6,1) | 5/6 (83,3) |
| E255K/V | 2 (2,0) | 0/2 |
| F359C/I/V | 7 (7,1) | 5/7 (71,4) |
Tietojen keruupäivämäärä: Vaiheen 1/2 tutkimus 2. lokakuuta 2015, jatkotutkimus 2. syyskuuta 2020
Huom.: Lähtötilanteen mutaatiot määritettiin ennen kuin potilas sai ensimmäisen annoksen tutkimuslääkettä.
Lyhenteet: BCR-ABL = breakpoint cluster region-Abelson, KML = krooninen myelooinen leukemia, MCyR = merkittävä sytogeneettinen vaste, N/n = potilaiden lukumäärä, Resp = vasteen saaneet potilaat, Eval = arvioitavissa olevat potilaat.
a Prosenttiluku perustuu niiden potilaiden lukumäärään, joiden mutaatiot määritettiin lähtötilanteessa.
b Arvioitavissa oleva potilasjoukko sisältää potilaat, joista on olemassa käypä sairauden arviointi lähtötilanteessa.
c 2 potilaalla oli useampi kuin yksi tähän luokkaan kuuluva mutaatio.
Yksi aikaisempaa nilotinibihoitoa saanut potilas, jolla oli E255V-mutaatio, sai parhaana vasteena täydellisen hematologisen vasteen (CHR).
In vitro -testaus osoitti, että bosutinibilla oli vain vähän aktiivisuutta T315I- ja V299L-mutaatioita vastaan. Siksi kliinistä aktiivisuutta ei ole odotettavissa potilailla, joilla on näitä mutaatioita.
Vaiheen 4 kliininen tutkimus Ph+ KML -potilailla, joita oli aikaisemmin hoidettu yhdellä tai useammalla tyrosiinikinaasin estäjällä
Yksihaaraisessa vaiheen 4 avoimessa ei-satunnaistetussa monikeskustutkimuksessa arvioitiin kerran vuorokaudessa 500 mg:n annoksella annetun bosutinibin tehoa ja turvallisuutta KML-potilailla, jotka olivat resistenttejä tai intolerantteja tyrosiinikinaasin estäjille. Potilaat oli jaettu eri kohortteihin sen perusteella, sairastivatko he kroonista vaihetta, akseleraatiovaihetta vai blastikriisivaihetta ja olivatko he saaneet aiemmin hoitoa yhdellä vai useammalla tyrosiinikinaasin estäjällä.
Tässä tutkimuksessa 163 potilasta sai bosutinibia, mukaan lukien 46 Ph+ KML:n kroonisen vaiheen potilasta, joita oli aikaisemmin hoidettu yhdellä tyrosiinikinaasin estäjällä (imatinibilla tai dasatinibilla tai nilotinibilla), 61 Ph+ KML:n kroonisen vaiheen potilasta, joita oli aikaisemmin hoidettu kahdella tyrosiinikinaasin estäjällä (imatinibilla ja/tai dasatinibilla ja/tai nilotinibilla), 49 Ph+ KML:n kroonisen vaiheen potilasta, joita oli aikaisemmin hoidettu kolmella tyrosiinikinaasin estäjällä (imatinibilla ja dasatinibilla ja nilotinibilla), 4 Ph+ KML:n akseleraatiovaiheen potilasta, joita oli aikaisemmin hoidettu vähintään yhdellä tyrosiinikinaasin estäjällä (2 potilasta kahdella tyrosiinikinaasin estäjällä ja 2 potilasta kolmella tyrosiinikinaasin estäjällä) ja 3 Ph‑ KML -potilasta, joita oli aikaisemmin hoidettu vähintään yhdellä tyrosiinikinaasin estäjällä.
Tehon ensisijainen päätetapahtuma oli kumulatiivinen vahvistettu MCyR 1. vuoteen (viikkoon 52) mennessä Ph+ KML:n kroonisen vaiheen potilailla, joita oli aikaisemmin hoidettu yhdellä tai kahdella tyrosiinikinaasin estäjällä, ja Ph+ KML:n kroonisen vaiheen potilailla, joita oli aikaisemmin hoidettu kolmella tyrosiinikinaasin estäjällä. Ph+ KML:n akseleraatiovaiheen ja blastikriisivaiheen potilailla, joita oli aikaisemmin hoidettu millä tahansa tyrosiinikinaasin estäjällä, tehon ensisijainen päätetapahtuma oli kumulatiivinen vahvistettu hematologinen kokonaisvaste (OHR) 1. vuoteen (viikkoon 52) mennessä. Muita tehon päätetapahtumia Ph+ KML:n kroonisen vaiheen potilailla olivat kumulatiivinen sytogeneettinen ja molekulaarinen vaste, sytogeneettisten ja molekulaaristen vasteiden kestot, vaste lähtötilanteen mutaatioissa, taudin transformoituminen akseleraatio-/blastikriisivaiheeksi, PFS ja OS. Muita päätetapahtumia Ph+ akseleraatiovaiheen/blastikriisivaiheen potilaiden kohortissa olivat sytogeneettisten ja molekulaaristen vasteiden kumulatiiviset osuudet, PFS ja OS.
KML-potilaiden krooninen vaihe
Ensisijainen päätetapahtuma, kumulatiivinen vahvistettu MCyR-osuus (95 %:n CI) 1. vuoteen (viikkoon 52) mennessä, oli 76,5 % (66,9, 84,5) potilailla, joita oli aikaisemmin hoidettu yhdellä tai kahdella tyrosiinikinaasin estäjällä, ja 62,2 % (46,5, 76,2) potilailla, joita oli aikaisemmin hoidettu kolmella tyrosiinikinaasin estäjällä.
Muut tehoa koskevat tulokset Ph+ KML:n kroonisen vaiheen potilailla tutkimuksen päätyttyä vähintään 3 vuoden seurannan jälkeen on esitetty taulukossa 10. Potilaita oli aikaisemmin hoidettu yhdellä tyrosiinikinaasin estäjällä (hoidon mediaanikesto 47,5 kuukautta (vaihteluväli: 0,9–50,1 kuukautta) ja 60,9 % edelleen hoidossa), kahdella tyrosiinikinaasin estäjällä (hoidon mediaanikesto 41,9 kuukautta (vaihteluväli: 0,4–48,9 kuukautta) ja 45,9 % edelleen hoidossa) ja kolmella tyrosiinikinaasin estäjällä (hoidon mediaanikesto 20,0 kuukautta (vaihteluväli: 0,2–48,9 kuukautta) ja 38,8 % edelleen hoidossa).
Taulukko 10 – Tehoa koskevat tulokset aiemmin hoitoa saaneilla Ph+ KML:n kroonisen vaiheen potilailla
| Ph+ KML:n krooninen vaihe: aiempi hoito 1 TKI:lla | Ph+ KML:n krooninen vaihe: aiempi hoito 2 TKI:lla | Ph+ KML:n krooninen vaihe: aiempi hoito 3 TKI:lla | Ph+ KML:n krooninen vaihe: koko kohortti | |
Kumulatiivinen vahvistettu MCyRa 1. vuoteen mennessä, % (95 %:n CI) | N = 43 83,7 (69,3, 93,2) | N = 55 70,9 (57,1, 82,4) | N = 45 62,2 (46,5, 76,2) | N = 143 72,0 (63,9, 79,2) |
Kumulatiivinen sytogeneettinen vastea,b MCyR, % (95 %:n CI) CCyR, % (95 %:n CI) | N = 46 88,4 (74,9, 96,1) 86,0 (72,1, 94,7) | N = 55 85,5 (73,3, 93,5) 83,6 (71,2, 92,2) | N = 45 77,8 (62,9, 88,8) 73,3 (58,1, 85,4) | N = 143 83,9 (76,9, 89,5) 81,1 (73,7, 87,2) |
Kumulatiivinen molekulaarinen vastea,b MMR, % (95 %:n CI) MR4, % (95 %:n CI) MR4.5, % (95 %:n CI) | N = 46 82,6 (68,6, 92,2) 73,9 (58,9, 85,7) 58,7 (43,2, 73,0) | N = 55 76,4 (63,0, 86,8) 63,6 (49,6, 76,2) 50,9 (37,1, 64,6) | N = 48 56,3 (41,2, 70,5) 41,7 (27,6, 56,8) 35,4 (22,2, 50,5) | N = 149 71,8 (63,9, 78,9) 59,7 (51,4, 67,7) 48,3 (40,1, 56,6) |
Aika sytogeneettiseen vasteeseen vain vasteen saaneillab, mediaani (vaihteluväli), kuukautta MCyR CCyR | 3,0 (1,0, 11,8) 3,0 (1,0, 17,6) | 2,9 (0,3, 6,4) 2,9 (0,3, 6,4) | 3,0 (1,8, 8,8) 3,0 (1,8, 8,8) | 3,0 (0,3, 11,8) 3,0 (0,3, 17,6) |
Sytogeneettisen vasteen kestob MCyR, K–M 3 vuoden kohdalla, % (95 %:n CI) CCyR, K–M 3 vuoden kohdalla, % (95 %:n CI) | 96,6 (77,9, 99,5) 94,4 (77,2, 99,5) | 94,4 (79,2, 98,6) 94,4 (79,2, 98,6) | 96,9 (79,8, 99,6) 100,0 (100,0, 100,0) | 95,6 (88,7, 98,4) 96,5 (89,5, 98,9) |
Aika molekulaariseen vasteeseen vain vasteen saaneillab, mediaani (vaihteluväli), kuukautta MMR MR4 MR4,5 | 3,0 (2,8, 23,3) 6,0 (2,8, 47,4) 9,2 (2,8, 47,6) | 3,0 (1,0, 35,9) 3,1 (1,0, 36,1) 6,0 (2,8, 36,2) | 3,1 (1,8, 9,3) 3,2 (1,8, 47,9) 5,8 (1,8, 18,0) | 3,0 (1,0, 35,9) 5,5 (1,0, 47,9) 6,0 (1,8, 47,6) |
Molekulaarisen vasteen kestob MMR, K–M 3 vuoden kohdalla, % (95 %:n CI) MR4, K–M 3 vuoden kohdalla, % (95 %:n CI) | 90,7 (73,9, 96,9) 89,5 (70,9, 96,5) | 81,5 (63,2, 91,3) 68,7 (48,0, 82,5) | 90,2 (65,9, 97,5) 85,2 (51,9, 96,2) | 87,2 (78,0, 92,7) 80,7 (69,4, 88,1) |
Tietojen keruupäivämäärä: 23. marraskuuta 2020. Lyhenteet: Ph+ = Philadelphia-kromosomipositiivinen, KML = krooninen myelooinen leukemia, TKI = tyrosiinikinaasin estäjä, K–M = Kaplan–Meierin estimaatti, N = potilaiden lukumäärä, CI = luottamusväli, MCyR = merkittävä sytogeneettinen vaste,CCyR = täydellinen sytogeneettinen vaste, MMR = merkittävä molekulaarinen vaste, MR4 = ≥ 4 logaritmiyksikön pienenemä BCR-ABL-transkripteissa vakioidusta lähtöarvosta, MR4.5 = ≥ 4,5 logaritmiyksikön pienenemä BCR-ABL-transkripteissa vakioidusta lähtöarvosta. Kumulatiivisen vahvistetun MCyR:n kriteerit: Vaste vahvistetaan kahdella peräkkäisellä arvioinnilla, joiden välissä on vähintään 28 vuorokautta. Jotta potilasta voidaan pitää vasteen saaneena, potilaan lähtötilanteen vasteen tulee olla säilynyt vähintään 52 viikkoa tai parantunut lähtötilanteeseen nähden. Potilaiden, joilla on osittainen sytogeneettinen vaste (PCyR) lähtötilanteessa, tulee saavuttaa CCyR hoidon aikana, jotta heitä voidaan pitää sytogeneettisen vasteen saaneina. Potilaat, joilla on vähintään MMR ja syvempi molekulaarinen vaste lähtötilanteeseen nähden, lasketaan vahvistetun CCyR:n saaneiksi. Kumulatiivisen sytogeneettisen vasteen kriteerit: Merkittävä sytogeneettinen vaste sisälsi täydellisen [0 % Ph+-metafaaseja luuytimestä tai positiivisia soluja < 1 % FISH-tutkimuksessa (fluoresenssi in situ ‑hybridisaatio)] tai osittaisen (1–35 %) sytogeneettisen vasteen. Sytogeneettinen vaste perustui Ph+-metafaasien prosenttiosuuteen ≥ 20 metafaasisolusta kussakin luuydinnäytteessä. FISH-analyysia (≥ 200 solua) voitiin käyttää CCyR:n arviointiin, jos ≥ 20 metafaasia ei ollut saatavissa. Potilaat, joista ei ole saatavilla käyttökelpoista luuydinnäytettä tai FISH-arviointia ja joilla on vähintään MMR, lasketaan CCyR:n saaneiksi. Kumulatiivisen molekulaarisen vasteen kriteerit: MMR:n/MR4:n/MR4.5:n määritelmä oli ≤ 0,1 %, ≤ 0,01 % ja ≤ 0,0032 % BCR-ABL/ABL-suhde IS-asteikolla (vastaa ≥ 3, ≥ 4 ja ≥ 4,5 logaritmiyksikön pienenemää vakioidusta lähtöarvosta) ja vähintään 10 000, 10 000 ja 32 000 ABL-transkriptia keskuslaboratorion arvion mukaan. a Sisältää potilaat (N), joista on olemassa käypä lähtötilanteen arvio. Vähimmäisseuranta-aika (aika viimeisen potilaan ensimmäisestä annoksesta tietojen keruupäivämäärään saakka) 36 kuukautta. b Sisältää potilaat (N), jotka saavuttivat vasteen tai joilla se säilyi. | ||||
MMR:n, MR4:n ja MR4.5:n kumulatiivinen ilmaantuvuus, joka on korjattu kilpailevan riskin eli hoidon keskeyttämisen ilman tapahtumaa suhteen, on esitetty kuvassa 5.
Kuva 5 – Molekulaaristen vasteiden (MR) ilmaantuvuus (kroonisen vaiheen arvioitavissa olevat potilaat)
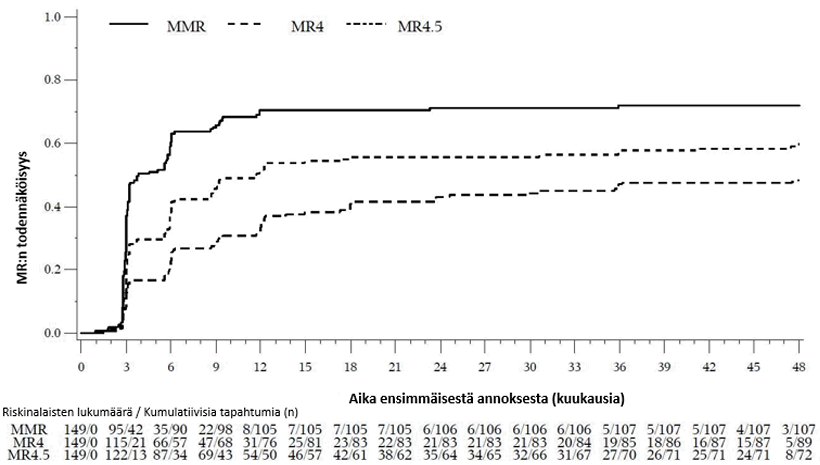
Saavutetut molekulaariset vasteet hoitolinjan mukaisesti on esitetty taulukossa 11.
Taulukko 11 – Saavutetut molekulaariset vasteet
| Ph+KML:n krooninen vaihe: aiempi hoito 1 TKI:lla | Ph+KML:n krooninen vaihe: aiempi hoito 2 TKI:lla | Ph+KML:n krooninen vaihe: aiempi hoito 3 TKI:lla | Ph+KML:n krooninen vaihe: koko kohortti | |
Potilaat ilman MMR:ää lähtötilanteessaa MMR, % (95 %:n CI) | N = 25 76,0 (54,9, 90,6) | N = 28 64,3 (44,1, 81,4) | N = 26 38,5 (20,2, 59,4) | N = 79 59,5 (47,9, 70,4) |
Potilaat ilman MR4:ää lähtötilanteessaa MR4, % (95 %:n CI) | N = 37 70,3 (53,0, 84,1) | N = 38 55,3 (38,3, 71,4) | N = 37 32,4 (18,0, 49,8) | N = 112 52,7 (43,0, 62,2) |
Potilaat ilman MR4.5:tä lähtötilanteessaa MR4,5, % (95 %:n CI) | N = 42 54,8 (38,7, 70,2) | N = 46 43,5 (28,9, 58,9) | N = 43 30,2 (17,2, 46,1) | N = 131 42,7 (34,1, 51,7) |
Potilaat, joilla MMR lähtötilanteessaa Syvempi MR, % (95 %:n CI) | N = 21 85,7 (63,7, 97,0) | N = 27 66,7 (46,0, 83,5) | N = 22 63,6 (40,7, 82,8) | N = 70 71,4 (59,4, 81,6) |
Tietojen keruupäivämäärä: 23. marraskuuta 2020. Lyhenteet: Ph+ = Philadelphia-kromosomipositiivinen, KML = krooninen myelooinen leukemia, TKI = tyrosiinikinaasin estäjä, N = potilaiden lukumäärä, CI = luottamusväli, MMR = merkittävä molekulaarinen vaste, MR = molekulaarinen vaste, MR4 = ≥ 4 logaritmiyksikön pienenemä BCR-ABL-transkripteissa vakioidusta lähtöarvosta, MR4.5 = ≥ 4,5 logaritmiyksikön pienenemä BCR-ABL-transkripteissa vakioidusta lähtöarvosta. a Sisältää potilaat (N), joista on olemassa käypä lähtötilanteen arvio. Jotta potilasta voidaan pitää vasteen saaneena, potilaan vasteen tulee olla parantunut lähtötilanteeseen nähden. Molekulaarisen vasteen kriteerit: MMR:n/MR4:n /MR4.5:n määritelmä oli ≤ 0,1 %, ≤ 0,01 % ja ≤ 0,0032 % BCR-ABL/ABL-suhde IS-asteikolla (vastaa ≥ 3, ≥ 4 ja ≥ 4,5 logaritmiyksikön pienenemää vakioidusta lähtöarvosta) ja vähintään 10 000, 10 000 ja 32 000 ABL-transkriptia keskuslaboratorion arvion mukaan. | ||||
Kroonisen vaiheen potilailla ei tapahtunut hoidon aikana taudin etenemistä KML:n akseleraatio- tai blastikriisivaiheeseen.
KML-potilaiden akseleraatiovaihe
Ph+ KML:n akseleraatiovaiheen potilailla hoidon mediaanikesto oli 22,1 kuukautta (vaihteluväli: 1,6–50,1 kuukautta), kumulatiivinen vahvistettu OHR 1. vuoteen (viikkoon 52) mennessä oli 75,0 % (95 %:n CI: 19,4, 99,4), kuten oli myös CCyR:n kumulatiivinen osuus, kaikki 3 potilasta säilyttivät CCyR:n hoidon aikana.
Vaste BCR-ABL-mutaatioiden perusteella lähtötilanteessa
Kymmenellä potilaalla kroonisen vaiheen kohortissa oli mutaatioita lähtötilanteessa (A365V, E453K, E255K, E255V, Q252H, L298V [n = 1 kutakin], Y253F ja G250E [n = 2 kumpaakin]). Yhdellä potilaalla kroonisen vaiheen kohortissa oli F359I-mutaatio, joka tunnistettiin tutkimuspäivänä 8. Yhdellä potilaalla akseleraatiovaiheen kohortissa oli 2 mutaatiota (F311L ja L387F) lähtötilanteessa. Kroonisen vaiheen kohortissa potilailla, joilla oli mutaatioita, molekulaarisia vasteita todettiin 4 potilaalla 11:stä (36,4 %), 1 potilas, jolla oli E255V-mutaatio, saavutti MMR:n, ja 3 potilasta, joilla oli vastaavasti F359I, Y253F ja A365V, saavutti MR4.5:n. Akseleraatiovaiheen kohortissa oleva potilas, jolla oli mutaatioita, ei saanut mitään vastetta.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset bosutinibia sisältävän viitelääkevalmisteen käytöstä KML:n hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Terveille tutkittaville ruoan kanssa annetun bosutinibin kerta-annoksen (500 mg) absoluuttinen biologinen hyötyosuus oli 34 %. Imeytyminen oli suhteellisen hidasta: mediaaniaika huippupitoisuuden saavuttamiseen (tmax) oli yli 6 tuntia. Bosutinibin AUC ja Cmax suurenevat suhteessa annokseen annosalueella 200–600 mg. Ruoka suurensi bosutinibin Cmax-arvon 1,8-kertaiseksi ja AUC-arvon 1,7-kertaiseksi paastotilaan verrattuna. Vakaassa tilassa KML-potilaiden Cmax (geometrinen keskiarvo, variaatiokerroin [CV] %) oli 145 (14) ng/ml ja AUCss (geometrinen keskiarvo, CV %) 2 700 (16) ng•h/ml, kun bosutinibia annettiin 400 mg vuorokaudessa ruoan kanssa. Kun bosutinibia annettiin 500 mg vuorokaudessa ruoan kanssa, Cmax oli 200 (6) ng/ml ja AUCss oli 3 640 (12) ng•h/ml. Bosutinibin liukoisuus riippuu pH:sta ja imeytyminen heikkenee mahanesteen pH:n noustessa (ks. kohta Yhteisvaikutukset).
Jakautuminen
Kun terveille tutkittaville annettiin bosutinibin 120 mg:n kerta-annos laskimonsisäisesti, jakautumistilavuuden keskiarvo (variaatiokerroin, CV %) oli 2 331 (32) l, mikä viittaa siihen, että bosutinibi jakautuu laajasti verisuoniston ulkopuoliseen kudokseen.
Bosutinibi sitoutui voimakkaasti ihmisen plasman proteiineihin in vitro (94 %) ja terveillä tutkittavilla ex vivo (96 %) eikä sitoutuminen ollut pitoisuudesta riippuvaista.
Biotransformaatio
In vitro- ja in vivo -tutkimukset viittasivat siihen, että bosutinibi (kanta-aine) käy ihmisellä läpi pääasiassa maksametabolian. Kerta-annoksena tai toistuvina annoksina ihmiselle annetun bosutinibin (400 tai 500 mg) tärkeimmät verenkierrossa esiintyvät metaboliitit näyttäisivät olevan oksidekloorautunut (M2) ja N-desmetyloitunut (M5) bosutinibi. Bosutinibi-N-oksidimetaboliittia (M6) esiintyi verenkierrossa vähäisemmässä määrin. Systeeminen altistus N-desmetyloituneelle metaboliitille oli 25 % kanta-aineesta, ja altistus oksidekloorautuneelle metaboliitille oli 19 % kanta-aineesta. Kaikkien kolmen metaboliitin aktiivisuus oli Src-transformoidun fibroblastin kiinnittymisestä riippumattomassa proliferaatiomäärityksessä ≤ 5 % bosutinibin aktiivisuudesta. Bosutinibi ja N-desmetyylibosutinibi olivat ulosteessa pääasialliset lääkkeeseen liittyneet yhdisteet. In vitro -tutkimukset ihmisen maksan mikrosomeilla osoittivat, että bosutinibin metaboliaan osallistuva pääasiallinen sytokromi P450 ‑isoentsyymi on CYP3A4. Lääkkeiden yhteisvaikutustutkimukset osoittivat, että ketokonatsolilla ja rifampisiinilla on merkittävä vaikutus bosutinibin farmakokinetiikkaan (ks. kohta Yhteisvaikutukset). CYP-entsyymien 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ja 3A5 ei havaittu metaboloivan bosutinibia.
Eliminaatio
Kun terveille tutkittaville annettiin bosutinibin 120 mg:n kerta-annos laskimonsisäisesti, terminaalisen eliminaation puoliintumisajan keskiarvo (CV %) oli 35,5 (24) tuntia ja puhdistuman keskiarvo (CV %) oli 61,9 (26) l/h. Massatasapainotutkimuksessa suun kautta otetulla bosutinibilla keskimäärin 94,6 % annetusta kokonaisannoksesta havaittiin 9 vuorokauden kuluessa; uloste (91,3 % annoksesta) oli tärkein erittymisreitti, ja 3,29 % annoksesta havaittiin virtsassa. 75 % annoksesta todettiin 96 tunnin kuluessa. Muuttumattoman bosutinibin erittyminen virtsaan oli vähäistä, noin 1 % annetusta annoksesta sekä terveillä tutkittavilla että potilailla, joilla oli pitkälle edennyt kiinteä syöpäkasvain.
Erityispotilasryhmät
Maksan vajaatoiminta
Ruoan kanssa otettua 200 mg:n bosutinibiannosta arvioitiin maksan vajaatoimintaa sairastavien 18 potilaan (Child–Pugh-luokat A, B ja C) kohortilla ja 9 kaltaistetulla terveellä tutkittavalla. Bosutinibin Cmax plasmassa suureni Child–Pugh-luokan A potilailla 2,4-kertaiseksi, Child–Pugh-luokan B potilailla 2-kertaiseksi ja Child–Pugh-luokan C potilailla 1,5-kertaiseksi, ja bosutinibin AUC plasmassa suureni Child–Pugh-luokan A potilailla 2,3-kertaiseksi, Child–Pugh-luokan B potilailla 2-kertaiseksi ja Child–Pugh-luokan C potilailla 1,9-kertaiseksi. Bosutinibin t1/2 suureni maksan vajaatoimintaa sairastavilla potilailla verrattuna terveisiin tutkittaviin.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa selvittävässä tutkimuksessa 26:lle lievää, keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavalle sekä 8 kaltaistetulle terveelle vapaaehtoiselle tutkittavalle annettiin ruoan kanssa kerta-annoksena 200 mg bosutinibia. Munuaisten vajaatoiminnan määritelmä perustui Cockcroft–Gaultin kaavalla laskettuun kreatiniinipuhdistumaan (ClCr): vaikea munuaisten vajaatoiminta < 30 ml/min, keskivaikea munuaisten vajaatoiminta 30 – ≤ 50 ml/min ja lievä munuaisten vajaatoiminta > 50 – ≤ 80 ml/min. Keskivaikeaa munuaisten vajaatoimintaa sairastavilla AUC-arvo suureni 35 % ja vaikeaa munuaisten vajaatoimintaa sairastavilla 60 % verrattuna terveisiin vapaaehtoisiin. Suurin bosutinibialtistus (Cmax) suureni 28 % keskivaikeaa vajaatoimintaa sairastavien ryhmässä ja 34 % vaikeaa vajaatoimintaa sairastavien ryhmässä. Bosutinibialtistus ei suurentunut lievää munuaisten vajaatoimintaa sairastavilla. Bosutinibin eliminaation puoliintumisaika munuaisten vajaatoimintaa sairastavilla oli vastaava kuin terveillä tutkittavilla.
Munuaisten vajaatoiminnan vuoksi tehdyt annosmuutokset perustuivat edellä mainitun tutkimuksen tuloksiin ja bosutinibin tunnetusti lineaariseen farmakokinetiikkaan annosalueella 200–600 mg.
Ikä, sukupuoli ja etninen tausta
Näiden demografisten tekijöiden vaikutuksen arvioimiseksi ei ole tehty varsinaisia tutkimuksia. Populaatiofarmakokineettiset analyysit Ph+-leukemiaa sairastavista potilaista tai potilaista, joilla oli kiinteä syöpäkasvain, sekä terveistä tutkittavista osoittavat, ettei iällä, sukupuolella tai painolla ole kliinisesti merkittävää vaikutusta. Populaatiofarmakokineettiset analyysit osoittivat, että aasialaisilla puhdistuma oli 18 % pienempi, mikä vastaa bosutinibialtistuksen (AUC) suurenemista noin 25 %.
Pediatriset potilaat
Bosulifia ei ole vielä tutkittu alle 18-vuotiailla lapsilla ja nuorilla.
Prekliiniset tiedot turvallisuudesta
Bosutinibia on tutkittu farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, lisääntymistoksisuutta ja fototoksisuutta arvioineissa tutkimuksissa.
Farmakologinen turvallisuus
Bosutinibi ei vaikuttanut hengitysfunktioihin. Keskushermostovaikutuksia selvittäneessä tutkimuksessa bosutinibihoitoa saaneilla rotilla esiintyi silmän mustuaisten supistumista ja kävelyn heikentymistä. Silmän mustuaisen koon kannalta vaikutuksetonta annosta (no observed effect level, NOEL) ei määritetty, mutta kävelyn heikentymisen osalta NOEL todettiin altistuksella, joka oli noin 11-kertainen verrattuna ihmisen saamaan altistukseen 400 mg:n kliinisestä annoksesta ja 8-kertainen verrattuna ihmisen saamaan altistukseen 500 mg:n kliinisestä annoksesta (kyseisten lajien vapaan lääkeaineen Cmax-arvon perusteella). Bosutinibin aktiivisuus hERG-määrityksissä in vitro viittasi sydänkammioiden repolarisaation (QTc-ajan) pidentymisen mahdollisuuteen. Koirilla tehdyssä tutkimuksessa suun kautta annettu bosutinibi ei aiheuttanut verenpaineen muutoksia, poikkeavia eteis- tai kammioperäisiä rytmihäiriötä eikä PR-, QRS- tai QTc-ajan pitenemistä EKG:ssä, kun altistus oli enintään 3-kertainen verrattuna ihmisen saamaan altistukseen 400 mg:n kliinisestä annoksesta ja 2-kertainen verrattuna ihmisen saamaan altistukseen 500 mg:n kliinisestä annoksesta (kyseisten lajien vapaan lääkeaineen Cmax-arvon perusteella). Viivästynyttä sydämen sykkeen nopeutumista havaittiin. Koirille laskimoon annetulla valmisteella tehdyssä tutkimuksessa havaittiin tilapäistä sydämen sykkeen nopeutumista ja verenpaineen alenemista sekä hyvin vähäistä QTc-ajan pitenemistä (< 10 ms) altistuksilla, jotka olivat noin 6–20-kertaisia verrattuna ihmisen saamaan altistukseen 400 mg:n kliinisestä annoksesta ja 4–15-kertaisia verrattuna ihmisen saamaan altistukseen 500 mg:n kliinisestä annoksesta (kyseisten lajien vapaan lääkeaineen Cmax-arvon perusteella). Havaittujen vaikutusten ja lääkehoidon välinen suhde ei varmistunut.
Toistuvan altistuksen toksisuus
Toistuvan altistuksen toksisuutta selvittäneissä tutkimuksissa, jotka kestivät rotilla enintään 6 kuukautta ja koirilla enintään 9 kuukautta, todettiin ruoansulatuselimistön olevan bosutinibin toksisuuden ensisijainen kohde-elin. Toksisuuden kliinisiä oireita olivat ulosteeseen liittyneet muutokset sekä vähentynyt ruoan kulutus ja painon aleneminen, jotka joissakin tapauksissa johtivat kuolemaan tai elektiiviseen eutanasiaan.
Histopatologisessa tutkimuksessa havaittiin luumenin laajenemista, pikarisolujen hyperplasiaa, suoliston verenvuotoja, eroosiota ja turvotusta sekä sinusten erytrosytoosia ja suoliliepeen imusolmukkeiden verenvuotoja. Myös maksa tunnistettiin toksisuuden kohde-elimeksi rotilla. Toksisuudelle oli tunnusomaista maksan painon suureneminen, joka korreloi hepatosellulaariseen hypertrofiaan ja ilmeni ilman maksaentsyymiarvojen suurenemista tai mikroskooppisia merkkejä hepatosellulaarisesta sytotoksisuudesta. Merkitystä ihmisille ei tunneta. Eri lajien altistuksen vertailu osoittaa, että rotilla tehdyssä 6 kuukautta kestäneessä toksisuustutkimuksessa ja koirilla tehdyssä 9 kuukautta kestäneessä toksisuustutkimuksessa altistukset, joista ei aiheutunut haittatapahtumia, olivat samankaltaisia kuin ihmisen saama altistus 400 mg:n tai 500 mg:n kliinisen annoksen antamisen jälkeen (kyseisten lajien vapaan lääkeaineen AUC-arvon perusteella).
Genotoksisuus
Genotoksisuustutkimuksissa bakteereilla in vitro -menetelmillä sekä nisäkkäillä in vitro- ja in vivo -menetelmillä, joihin saattoi liittyä metabolinen aktivaatio, ei todettu näyttöä bosutinibin mutageenisuudesta.
Lisääntymistoksisuus ja kehitystoksisuus
Rotilla tehdyssä hedelmällisyystutkimuksessa urosten hedelmällisyys oli hieman heikentynyt. Naarailla havaittiin lisääntyneitä alkion resorptioita sekä alkion kiinnittymisen ja elinkykyisten alkioiden vähenemistä. Hedelmällisyyden suhteen haitattomiksi annoksiksi uroksilla (30 mg/kg/vrk) ja naarailla (3 mg/kg/vrk) todettujen annosten altistus oli uroksilla 0,6-kertainen ja naarailla 0,3-kertainen verrattuna ihmiseen saamaan altistukseen 400 mg:n kliinisestä annoksesta ja uroksilla 0,5-kertainen ja naarailla 0,2-kertainen verrattuna ihmisen saamaan altistukseen 500 mg:n kliinisestä annoksesta (kyseisten lajien vapaan lääkeaineen AUC-arvon perusteella). Vaikutusta miehen hedelmällisyyteen ei voida sulkea pois (ks. kohta Raskaus ja imetys).
Sikiön altistuminen bosutinibista peräisin olevalle radioaktiivisuudelle tiineyden aikana osoitettiin tiineillä Sprague‑Dawley-rotilla tehdyssä lääkkeiden kulkeutumista istukan kautta selvittäneessä tutkimuksessa. Rotilla tehdyssä pre- ja postnataalisessa kehitystutkimuksessa poikasia syntyi lukumääräisesti vähemmän annoksella ≥ 30 mg/kg/vrk. Koko poikueen menetyksen ilmaantuvuus suureni ja jälkeläisten syntymänjälkeinen kasvu heikkeni annoksella 70 mg/kg/vrk. Annos, jolla ei havaittu mitään haitallisia kehitysvaikutuksia (10 mg/kg/vrk), johti rotilla altistukseen, joka vastasi 1,3-kertaisesti ihmisen saamaa altistusta 400 mg:n annoksesta ja 1,0-kertaisesti ihmisen saamaa altistusta 500 mg:n annoksesta (kyseisten lajien vapaan lääkeaineen AUC-arvon perusteella). Kaniineilla emolle toksisilla annoksilla tehdyssä kehitystoksisuustutkimuksessa todettiin sikiön poikkeavuuksia (kehittymässä olevan rintalastan yhteensulautuma ja kahdella sikiöllä oli erilaisia viskeraalisia löydöksiä) sekä vähäistä sikiön painon laskua. Altistus suurimmalla kaniineilla tutkitulla annoksella (10 mg/kg/vrk), josta ei aiheutunut sikiölle haittavaikutuksia, oli 0,9-kertainen verrattuna ihmisen saamaan altistukseen 400 mg:n annoksesta ja 0,7-kertainen verrattuna ihmisen saamaan altistukseen 500 mg:n annoksesta (kyseisten lajien vapaan lääkeaineen AUC-arvon perusteella).
Kun imettäville Sprague‑Dawley-rotille annettiin oraalinen [14C]-radioisotooppileimattu bosutinibikerta-annos (10 mg/kg), radioaktiivisuus erittyi nopeasti nisämaitoon jo puoli tuntia valmisteen annon jälkeen. Radioaktiivisuuspitoisuus oli maidossa 8-kertainen plasmaan verrattuna. Tämän vuoksi radioaktiivisuutta esiintyi mitattavina pitoisuuksina imetettyjen poikasten plasmassa.
Karsinogeenisuus
Bosutinibi ei ollut karsinogeeninen rotilla tehdyssä 2 vuotta kestäneessä ja rasH2-hiirillä tehdyssä 6 kuukautta kestäneessä karsinogeenisuustutkimuksessa.
Fototoksisuus
Bosutinibin on osoitettu voivan absorboida UV-B- ja UV-A-valoa, ja bosutinibi jakautuu pigmentillisten rottien ihoon ja silmän suonikalvostoon. Bosutinibilla ei kuitenkaan osoitettu ihoon tai silmiin kohdistuvaa fototoksisuutta altistettaessa pigmentilliset rotat bosutinibille UV-säteilyssä, kun bosutinibialtistus oli enintään 3-kertainen verrattuna ihmisen saamaan altistukseen 400 mg:n annoksesta ja 2-kertainen verrattuna ihmisen saamaan altistukseen 500 mg:n annoksesta (kyseisten lajien vapaan lääkeaineen Cmax-arvon perusteella).
Farmaseuttiset tiedot
Apuaineet
Tablettiydin
Mikrokiteinen selluloosa (E460)
Kroskarmelloosinatrium (E468)
Piidioksidi, kolloidinen, vedetön
Magnesiumstearaatti
Kalvopäällyste
Bosutinib Stada 100 mg kalvopäällysteiset tabletit
Polyvinyylialkoholi (E1203)
Makrogoli
Talkki (E553b)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Bosutinib Stada 400 mg kalvopäällysteiset tabletit
Polyvinyylialkoholi (E1203)
Makrogoli
Talkki (E553b)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Punainen rautaoksidi (E172)
Bosutinib Stada 500 mg kalvopäällysteiset tabletit
Polyvinyylialkoholi (E1203)
Makrogoli
Talkki (E553b)
Titaanidioksidi (E171)
Punainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BOSUTINIB STADA tabletti, kalvopäällysteinen
100 mg (L:ei) 28 fol (353,89 €)
400 mg (L:ei) 28 fol (1182,16 €)
500 mg (L:ei) 28 fol (1490,85 €)
PF-selosteen tieto
Tabletit on pakattu joko Al/PVC/Al/OPA-läpipainopakkauksiin tai yksittäispakattuihin Al/PVC/Al/OPA-läpipainopakkauksiin.
Bosutinib Stada 100 mg kalvopäällysteiset tabletit
Yksi kartonkikotelo sisältää 28 tai 112 tablettia.
Yksi kartonkikotelo sisältää 28x1 tai 112x1 tablettia.
Bosutinib Stada 400 mg kalvopäällysteiset tabletit
Yksi kartonkikotelo sisältää 28 tai 112 tablettia.
Yksi kartonkikotelo sisältää 28x1 tai 112x1 tablettia.
Bosutinib Stada 500 mg kalvopäällysteiset tabletit
Yksi kartonkikotelo sisältää 28 tai 112 tablettia.
Yksi kartonkikotelo sisältää 28x1 tai 112x1 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Bosutinib Stada 100 mg kalvopäällysteiset tabletit
Keltainen, soikea (leveys: 6 mm; pituus:11 mm), kaksoiskupera, kalvopäällysteinen tabletti, jonka toisella puolella on merkintä ”C18”.
Bosutinib Stada 400 mg kalvopäällysteiset tabletit
Oranssi, soikea (leveys: 9 mm; pituus:17 mm), kaksoiskupera, kalvopäällysteinen tabletti, jonka toisella puolella on merkintä ”C19”.
Bosutinib Stada 500 mg kalvopäällysteiset tabletit
Vaaleanpunainen, soikea (leveys: 10 mm; pituus:18 mm), kaksoiskupera, kalvopäällysteinen tabletti, jonka toisella puolella on merkintä ”C20”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BOSUTINIB STADA tabletti, kalvopäällysteinen
100 mg 28 fol
400 mg 28 fol
500 mg 28 fol
- Ylempi erityiskorvaus (100 %). Leukemiat, muut pahanlaatuiset veri- ja luuydintaudit sekä pahanlaatuiset imukudostaudit (117).
- Peruskorvaus (40 %).
ATC-koodi
L01EA04
Valmisteyhteenvedon muuttamispäivämäärä
19.01.2024
Yhteystiedot
PL 1310, Puolikkotie 8, 02230 Espoo (käyntiosoite)
00101 Helsinki
0207 416 888
