SIMPONI injektioneste, liuos, esitäytetty ruisku 50 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Vaikuttavat aineet ja niiden määrät
Yksi 0,5 ml:n esitäytetty ruisku sisältää 50 mg golimumabia*.
* Ihmisen monoklonaalinen IgG1қ-vasta‑aine, joka on tuotettu rekombinantti-DNA‑teknologialla hiiren hybridoomasolulinjassa.
Apuaineet, joiden vaikutus tunnetaan
Yksi esitäytetty ruisku sisältää 20,5 mg sorbitolia (E420) per 50 mg:n annos.
Yksi esitäytetty ruisku sisältää 0,075 mg polysorbaatti 80:tä (E433) per 50 mg:n annos.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste)
Kliiniset tiedot
Käyttöaiheet
Nivelreuma
Simponi, yhdessä metotreksaatin kanssa, on tarkoitettu
- kohtalaisen tai vaikean, aktiivisen nivelreuman hoitoon aikuisille, kun perinteisillä reumalääkkeillä (DMARD‑lääkkeillä), mukaan lukien metotreksaatti, on saatu riittämätön vaste
- vaikean, aktiivisen ja etenevän nivelreuman hoitoon aikuisille, joita ei ole aiemmin hoidettu metotreksaatilla.
Simponin, yhdessä metotreksaatin kanssa, on röntgenkuvien perusteella osoitettu hidastavan nivelvaurioiden etenemisnopeutta sekä parantavan fyysistä toimintakykyä.
Juveniili idiopaattinen artriitti
Idiopaattinen juveniili polyartriitti (pJIA)
Simponi, yhdessä metotreksaatin kanssa, on tarkoitettu idiopaattisen juveniilin polyartriitin hoitoon 2 vuotta täyttäneille lapsille, kun metotreksaatilla saatu vaste on ollut riittämätön.
Nivelpsoriaasi
Simponi, yksin tai yhdessä metotreksaatin kanssa, on tarkoitettu aktiivisen ja etenevän nivelpsoriaasin hoitoon aikuisille, kun DMARD‑lääkkeillä on saatu riittämätön vaste. Simponin on röntgenkuvien perusteella osoitettu hidastavan perifeerisen nivelvaurion etenemistä nivelpsoriaasipotilailla, joilla on symmetrinen moniniveltulehdus (ks. kohta Farmakodynamiikka), sekä parantavan fyysistä toimintakykyä.
Aksiaalinen spondylartriitti
Selkärankareuma
Simponi on tarkoitettu vaikean, aktiivisen selkärankareuman hoitoon aikuisille, kun tavanomaisilla hoitomuodoilla saatu vaste on ollut riittämätön.
Röntgennegatiivinen aksiaalinen spondylartriitti
Simponi on tarkoitettu vaikean, aktiivisen röntgennegatiivisen aksiaalisen spondylartriitin hoitoon aikuisille, joilla on selviä tulehduslöydöksiä, jotka näkyvät suurentuneena C-reaktiivisen proteiinin (CRP) pitoisuutena ja/tai magneettitutkimuksessa, silloin kun tulehduskipulääkkeillä (NSAIDit) ei ole saatu riittävää hoitovastetta tai kun potilas ei siedä niitä.
Haavainen koliitti
Simponi on tarkoitettu kohtalaisen tai vaikean aktiivisen haavaisen koliitin (haavaisen paksusuolitulehduksen) hoitoon aikuisille potilaille, kun tavanomaisilla hoitomuodoilla, mukaan lukien kortikosteroidit ja 6‑merkaptopuriini tai atsatiopriini, saatu vaste on ollut riittämätön tai potilas ei siedä näitä hoitoja tai lääketieteellinen vasta‑aihe estää niiden käytön.
Lapsuusiän haavainen koliitti
Simponi on tarkoitettu kohtalaisen tai vaikean aktiivisen haavaisen koliitin hoitoon 2 vuotta täyttäneille pediatrisille potilaille, joiden paino on vähintään 15 kg, kun tavanomaisilla hoitomuodoilla, mukaan lukien kortikosteroidit ja 6‑merkaptopuriini tai atsatiopriini, saatu vaste on ollut riittämätön tai potilas ei siedä näitä hoitoja tai lääketieteellinen vasta‑aihe estää niiden käytön.
Ehto
Hoidon saavat aloittaa valmisteyhteenvedossa mainittuun indikaatioon perehtyneet lääkärit.
Annostus ja antotapa
Hoidon aloittavan ja sitä valvovan lääkärin pitää olla perehtynyt nivelreuman, idiopaattisen juveniilin polyartriitin, nivelpsoriaasin, selkärankareuman, röntgennegatiivisen aksiaalisen spondylartriitin tai haavaisen koliitin diagnosointiin ja hoitoon. Simponi‑hoitoa saaville potilaille annetaan potilaskortti.
Annostus
Nivelreuma
50 mg Simponia annetaan kerran kuukaudessa, aina samana päivänä kuukaudesta.
Simponia annetaan yhdessä metotreksaatin kanssa.
Nivelpsoriaasi, selkärankareuma tai röntgennegatiivinen aksiaalinen spondylartriitti
50 mg Simponia annetaan kerran kuukaudessa, aina samana päivänä kuukaudesta.
Kaikissa yllä mainituissa käyttöaiheissa käytettävissä olevien tietojen mukaan kliininen vaste saavutetaan yleensä 12–14 viikon kuluessa hoidon aloituksesta (3–4 annoksen jälkeen). Hoidon jatkamista pitää harkita uudelleen niillä potilailla, joilla ei nähdä merkkejä hoidollisesta hyödystä tänä aikana.
Potilaat, jotka painavat yli 100 kg
Kaikissa yllä mainituissa käyttöaiheissa yli 100 kg painavilla potilailla, joilla on nivelreuma, nivelpsoriaasi, selkärankareuma tai röntgennegatiivinen aksiaalinen spondylartriitti ja joilla ei saavuteta riittävää kliinistä vastetta 3–4 annoksen jälkeen, golimumabiannoksen nostamista tasolle 100 mg kerran kuukaudessa voidaan harkita, ottaen huomioon 100 mg:n annokseen liittyvien tiettyjen vakavien haittavaikutusten riskin suureneminen verrattuna 50 mg:n annokseen (ks. kohta Haittavaikutukset). On tarpeen harkita uudelleen hoidon jatkamista niillä potilailla, joilla ei 3–4:n 100 mg:n lisäannoksen jälkeen nähdä merkkejä hoidollisesta hyödystä.
Idiopaattinen juveniili polyartriitti
50 mg Simponia annetaan kerran kuukaudessa, aina samana päivänä kuukaudesta, vähintään 40 kg painaville lapsille. Alle 40 kg painaville idiopaattista juveniilia polyartriittia sairastaville lapsille on saatavana 45 mg/0,45 ml esitäytetty kynä.
Käytettävissä olevien tietojen mukaan kliininen vaste saavutetaan yleensä 12–14 viikon kuluessa hoidon aloituksesta (3–4 annoksen jälkeen). Hoidon jatkamista pitää harkita uudelleen niillä lapsilla, joilla ei nähdä merkkejä hoidollisesta hyödystä tänä aikana.
Aikuisiän haavainen koliitti
Alle 80 kg painavat potilaat
Simponin aloitusannos on 200 mg, jonka jälkeen annetaan 100 mg viikolla 2. Potilaille, joilla vaste on riittävä, annetaan 50 mg viikolla 6 ja sen jälkeen 4 viikon välein. Potilaat, joilla vaste ei ole riittävä, saattavat hyötyä hoidon jatkamisesta 100 mg:n annoksella viikolla 6 ja sen jälkeen 4 viikon välein (ks. kohta Farmakodynamiikka).
80 kg tai enemmän painavat potilaat
Simponin aloitusannos on 200 mg, jonka jälkeen annetaan 100 mg viikolla 2 ja sen jälkeen 100 mg 4 viikon välein (ks. kohta Farmakodynamiikka).
Ylläpitohoidon aikana kortikosteroidiannosta voidaan pienentää asteittain hoitosuositusten mukaisesti.
Käytettävissä olevien tietojen mukaan kliininen vaste saavutetaan yleensä 12–14 viikon kuluessa hoidon aloituksesta (4 annoksen jälkeen). Hoidon jatkamista pitää harkita uudelleen niillä potilailla, joilla ei nähdä merkkejä hoidollisesta hyödystä tänä aikana.
Lapsuusiän haavainen koliitti
Simponin suositeltava annos 2–17-vuotiaille haavaista koliittia sairastaville potilaille perustuu painoon (taulukko 1). Simponi annetaan injektiona ihon alle.
Taulukko 1: Simponi-annos haavaista koliittia sairastaville pediatrisille potilaille
Potilaan paino | Induktioannos | Ylläpitoannos viikosta 6 alkaen | Valinnainen ylläpitoannoksen pienennys* |
≥ 80 kg |
|
| Ei sovellu |
≥ 40 kg – < 80 kg |
|
|
|
≥ 15 kg – < 40 kg |
|
|
|
* Lääkäri saattaa harkita ylläpitoannoksen pienentämistä, jos potilas on remissiossa viikolla 54 tai sen jälkeen. | |||
25 mg:n golimumabiannoksen annostus ja antaminen, ks. 45 mg/0,45 ml injektioneste, liuos, esitäytetty kynä ‑valmisteen valmisteyhteenvedon kohta Annostus ja antotapa.
100 mg:n golimumabiannoksen annostus ja antaminen, ks. 100 mg injektioneste, liuos, esitäytetty ruisku ‑valmisteen valmisteyhteenvedon kohta Annostus ja antotapa.
Käytettävissä olevien tietojen mukaan kliininen vaste saavutetaan yleensä 12–14 viikon kuluessa hoidon aloituksesta (4 annoksen jälkeen). Hoidon jatkamista pitää harkita uudelleen niillä lapsilla, joilla ei nähdä merkkejä hoidollisesta hyödystä tänä aikana.
Annoksen unohtaminen
Jos potilas unohtaa pistää Simponi‑annoksen suunniteltuna päivänä, unohtunut annos pistetään heti kun potilas sen muistaa. Potilasta pitää neuvoa, että hän ei saa ottaa kaksinkertaista annosta korvatakseen unohtamansa annoksen.
Seuraava annos otetaan alla olevien ohjeiden mukaan:
- jos annos on vähemmän kuin 2 viikkoa myöhässä, potilas pistää unohtuneen annoksen ja jatkaa alkuperäisen aikataulun mukaan
- jos annos on enemmän kuin 2 viikkoa myöhässä, potilas pistää unohtuneen annoksen ja tästä pistospäivästä alkaen laaditaan uusi aikataulu.
Erityiset potilasryhmät
Iäkkäät potilaat (≥ 65‑vuotiaat)
Annoksen muuttaminen iäkkäillä potilailla ei ole tarpeen.
Munuaisten ja maksan toiminnan heikkeneminen
Simponia ei ole tutkittu näissä potilasryhmissä. Annossuosituksia ei voida antaa.
Pediatriset potilaat
Simponin turvallisuutta ja tehoa alle 18 vuoden ikäisten potilaiden hoidossa ei ole varmistettu muissa käyttöaiheissa kuin idiopaattisessa juveniilissa polyartriitissa ja lapsuusiän haavaisessa koliitissa. Tietoja ei ole saatavilla.
Ei ole asianmukaista käyttää Simponi-valmistetta alle 2 vuoden ikäisten idiopaattista juveniilia polyartriittia tai lapsuusiän haavaista koliittia sairastavien potilaiden hoitoon.
Antotapa
Simponi annetaan ihon alle. Kun potilas on saanut riittävän opetuksen pistotekniikasta, hän voi itse pistää lääkkeen, jos lääkäri pitää sitä tarkoituksenmukaisena ja potilaan tilaa seurataan tarpeen mukaan. Potilasta neuvotaan pistämään koko Simponi‑määrä pakkausselosteessa olevien yksityiskohtaisten käyttöohjeiden mukaan. Jos tarvitaan useita pistoksia, ne on pistettävä kehon eri alueille. Jokainen esitäytetty ruisku on tarkoitettu yhdelle potilaalle yhtä käyttökertaa varten, ja se on hävitettävä heti käytön jälkeen.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkkeen antoon.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Aktiivinen tuberkuloosi tai jokin muu vaikea infektio, kuten sepsis, ja opportunistiset infektiot (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kohtalainen tai vaikea sydämen vajaatoiminta (NYHA:n luokat III/IV) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Infektiot
Potilaita on tarkkailtava huolellisesti infektioiden, mukaan lukien tuberkuloosin, varalta ennen golimumabihoitoa, sen aikana ja sen päätyttyä. Koska golimumabin eliminaatio saattaa kestää jopa 5 kuukautta, potilaan seurantaa jatketaan koko tämän ajan. Golimumabihoitoa ei enää jatkossa saa antaa, jos potilaalle kehittyy vakava infektio tai sepsis (ks. kohta Vasta-aiheet).
Golimumabia ei pidä antaa potilaille, joilla on kliinisesti merkittävä, aktiivinen infektio. Varovaisuutta on noudatettava, jos golimumabin käyttöä harkitaan potilaille, joilla on krooninen infektio tai joilla on ollut toistuva infektio. Potilaille on kerrottava mahdollisista infektioiden riskitekijöistä, ja heitä pitää neuvoa välttämään altistumista tällaisille riskitekijöille tilanteen mukaan.
Potilaat, jotka käyttävät TNF‑estäjiä, ovat alttiimpia saamaan vakavia infektioita.
Golimumabia saaneilla potilailla on raportoitu bakteeri‑infektioita (mukaan lukien sepsis ja keuhkokuume), mykobakteeri‑infektioita (mukaan lukien tuberkuloosi), invasiivisia sieni‑infektioita sekä opportunistisia infektioita, myös kuolemaan johtaneita. Joitain näistä vakavista infektioista on ilmennyt potilailla, jotka ovat saaneet samanaikaista immunosuppressiivista hoitoa, mikä taustalla olevan sairauden lisäksi saattaa altistaa heidät infektioille. Potilaita, joille kehittyy uusi infektio golimumabihoidon aikana, pitää tarkkailla huolellisesti, ja heille tehdään täydellinen diagnostinen arviointi. Golimumabihoito pitää keskeyttää, jos potilaalle kehittyy uusi vakava infektio tai sepsis, ja hänelle pitää aloittaa asianmukainen antimikrobinen tai antifungaalinen hoito, kunnes infektio on saatu hallintaan.
Potilailla, jotka ovat asuneet tai matkustaneet alueilla, joilla invasiivisia sieni‑infektioita, kuten histoplasmoosia, koksidioidomykoosia tai blastomykoosia, esiintyy endeemisenä, pitää golimumabihoidon hyötyjä ja riskejä pohtia huolellisesti ennen hoidon aloitusta. Jos golimumabihoitoa saaneille riskiryhmän potilaille kehittyy vakava systeeminen sairaus, on syytä epäillä invasiivista sieni-infektiota. Diagnosointi ja empiirisen antifungaalisen hoidon antaminen näille potilaille pitää tehdä konsultoimalla invasiivisten sieni-infektioiden hoitoon erikoistunutta lääkäriä, mikäli mahdollista.
Tuberkuloosi
Golimumabia saaneilla potilailla on raportoitu tuberkuloosia. Merkille pantavaa on, että suurimmassa osassa näistä raporteista tuberkuloosi oli muualle kuin keuhkoihin paikantuvaa, ilmeten joko paikallisena tai laajalle levinneenä tautina.
Ennen golimumabihoidon aloitusta kaikilta potilailta on arvioitava sekä aktiivinen että inaktiivinen (latentti) tuberkuloosi. Tähän arviointiin pitää kuulua yksityiskohtainen selvitys potilaan aiemmista sairauksista sekä henkilökohtainen tuberkuloositausta tai mahdolliset aiemmat tuberkuloosikontaktit sekä aiempi ja/tai nykyinen immunosuppressiivinen hoito. Kaikille potilaille pitää tehdä (paikallisia suosituksia soveltaen) asianmukaiset seulontatutkimukset, ts. tuberkuliini‑ihokoe tai verikoe ja keuhkoröntgen. On suositeltavaa, että näiden tutkimusten suorittaminen kirjataan potilaalle annettavaan potilaskorttiin. Lääkettä määräävän lääkärin on syytä muistaa, että tuberkuliini‑ihokokeesta on mahdollista saada vääriä negatiivisia tuloksia, erityisesti vaikeasti sairailla potilailla tai immuunipuutteisilla potilailla.
Jos potilaalla todetaan aktiivinen tuberkuloosi, golimumabihoitoa ei saa aloittaa (ks. kohta Vasta-aiheet).
Jos epäillään latenttia tuberkuloosia, on syytä konsultoida tuberkuloosin hoitoon perehtynyttä lääkäriä. Kaikissa alla kuvatuissa tilanteissa on golimumabihoidon hyöty-haittatasapainoa arvioitava erittäin huolellisesti.
Jos todetaan inaktiivinen (latentti) tuberkuloosi, on aloitettava latentin tuberkuloosin hoitoon tarkoitettu tuberkuloosilääkitys paikallisten hoitosuositusten mukaisesti ennen golimumabihoidon aloitusta.
Potilaille, joilla on useita tai merkittäviä tuberkuloosin riskitekijöitä ja joilla tulos latentin tuberkuloosin tutkimuksista on negatiivinen, on syytä harkita tuberkuloosilääkitystä ennen golimumabihoidon aloitusta. Tuberkuloosilääkitystä on syytä harkita myös ennen golimumabihoidon aloitusta potilaille, joilla on aiemmin ollut latentti tai aktiivinen tuberkuloosi ja joilla asianmukaisen lääkekuurin antoa ei voida varmistaa.
Aktiivista tuberkuloosia on ilmaantunut golimumabihoitoa saaville potilaille hoidettaessa latenttia tuberkuloosia tai sen jälkeen. Golimumabia saavia potilaita on tarkkailtava huolellisesti, jotta havaitaan aktiivisen tuberkuloosin merkit ja oireet. Tämä koskee myös potilaita, joilla latentin tuberkuloosin tutkimustulos oli negatiivinen, sekä potilaita, joita hoidetaan latentin tuberkuloosin vuoksi, ja potilaita, jotka ovat aiemmin saaneet hoitoa tuberkuloosi‑infektion vuoksi.
Kaikkia potilaita pitää neuvoa hakeutumaan lääkärin hoitoon, jos golimumabihoidon aikana tai sen jälkeen ilmenee mahdollisia tuberkuloosin merkkejä ja/tai oireita (esimerkiksi itsepintaista yskää, kuihtumista / painon alenemista, lievää kuumetta).
Hepatiitti B ‑viruksen reaktivaatio
Hepatiitti B:n reaktivaatiota on ilmennyt potilailla, jotka ovat saaneet TNF‑antagonistia, mukaan lukien golimumabia, ja jotka ovat tämän viruksen kroonisia kantajia (ts. pinta‑antigeenipositiivisia). Jotkin tapauksista ovat johtaneet kuolemaan.
Potilailta pitää testata HBV‑infektio ennen golimumabihoidon aloitusta. Jos HBV‑infektiotestin tulos on positiivinen, on suositeltavaa konsultoida hepatiitti B:n hoitoon erikoistunutta lääkäriä.
HBV:n kantajia, joille golimumabihoito on tarpeen, pitää tarkkailla huolellisesti aktiivisen HBV‑infektion merkkien ja oireiden varalta hoidon ajan sekä useita kuukausia hoidon lopettamisen jälkeen. Ei ole saatavilla riittäviä tietoja HBV:tä kantavien potilaiden HBV‑reaktivaation estosta viruslääkkeillä samanaikaisesti TNF‑antagonistihoidon kanssa. Jos potilaalle kehittyy HBV‑infektion reaktivaatio, golimumabihoito on lopetettava ja potilaalle on aloitettava tehokas antiviraalinen lääkitys sekä asianmukainen supportiivinen hoito.
Maligniteetit ja lymfoproliferatiiviset sairaudet
TNF‑estäjien mahdollista osuutta maligniteettien kehittymisessä ei tiedetä. Nykytiedon perusteella lymfoomien, leukemian tai muiden maligniteettien kehittymisen mahdollista riskiä ei voida sulkea pois TNF‑antagonistia saaneilla potilailla. Varovaisuutta on syytä noudattaa harkittaessa TNF‑estäjähoitoa potilaille, joilla on aiemmin todettu maligniteetti, tai kun harkitaan hoidon jatkamista potilailla, joille kehittyy maligniteetti.
Pediatrinen maligniteetti
TNF‑estäjiä saaneilla lapsilla, nuorilla ja nuorilla aikuisilla (22‑vuotiailla ja sitä nuoremmilla) on markkinoillaolon aikaisessa seurannassa raportoitu maligniteetteja, joista osa on johtanut kuolemaan. Potilaat olivat aloittaneet hoidon viimeistään 18 vuoden iässä. Noin puolet tapauksista oli lymfoomia. Muut olivat erilaisia maligniteetteja ja niihin kuului harvinaisia maligniteetteja, jotka tavallisesti liittyvät immunosuppressioon. Maligniteettien kehittymisen riskiä ei voida sulkea pois TNF‑estäjiä saaneilla lapsilla ja nuorilla.
Lymfooma ja leukemia
Kaikilla TNF‑estäjillä, mukaan lukien golimumabi, tehtyjen kliinisten tutkimusten kontrolloiduissa osioissa on TNF‑estäjiä saaneilla potilailla todettu enemmän lymfoomia kuin verrokkiryhmän potilailla. Simponilla tehdyissä faasi IIb:n ja faasi III:n kliinisissä nivelreuma‑, nivelpsoriaasi‑ ja selkärankareumatutkimuksissa lymfoomien ilmaantuvuus golimumabia saaneilla potilailla oli suurempi kuin normaaliväestössä on odotettavissa. Golimumabihoitoa saaneilla potilailla on raportoitu leukemiaa. Taustalla oleva lymfooma‑ ja leukemiariski on suurentunut nivelreumapotilailla, joilla on pitkäaikainen, hyvin aktiivinen ja tulehduksellinen tauti, mikä vaikeuttaa riskin arviointia.
Muita TNF‑estäjiä saaneilla potilailla on markkinoilletulon jälkeen raportoitu harvoin hepatospleenistä T‑solulymfoomaa (HSTCL) (ks. kohta Haittavaikutukset). Tämän harvinaisen T‑solulymfoomatyypin taudinkulku on hyvin aggressiivinen ja johtaa yleensä kuolemaan. Suurin osa tapauksista on esiintynyt teini‑ikäisillä pojilla ja nuorilla aikuisilla miehillä, joista lähes kaikki saivat samanaikaisesti atsatiopriinia (AZA) tai 6‑merkaptopuriinia (6‑MP) tulehduksellisen suolistosairauden hoitoon. AZA‑ tai 6‑MP‑hoidon ja golimumabin samanaikaisen käytön mahdollisia riskejä on punnittava huolellisesti. Hepatospleenisen T‑solulymfooman riskiä ei voida sulkea pois TNF‑estäjiä käytettäessä.
Maligniteetit, muut kuin lymfooma
Simponilla tehdyissä faasi IIb:n ja faasi III:n kliinisten tutkimusten kontrolloiduissa osioissa nivelreuman, nivelpsoriaasin, selkärankareuman ja haavaisen koliitin yhteydessä muiden maligniteettien kuin lymfooman (pois lukien ei‑melanoottiset ihosyövät) ilmaantuvuus oli samankaltainen golimumabi- ja verrokkiryhmissä.
Paksusuolen dysplasia / syöpä
Ei tiedetä, vaikuttaako golimumabihoito dysplasian tai paksusuolisyövän kehittymisen riskiin. Seulontatutkimuksia dysplasian toteamiseksi on tehtävä säännöllisin välein ennen hoidon aloittamista ja koko taudin keston ajan kaikille haavaista koliittia sairastaville potilaille, joilla on suurentunut dysplasian tai paksusuolisyövän riski (esimerkiksi potilaille, joilla on pitkäaikainen haavainen koliitti tai primaarinen sklerosoiva kolangiitti) tai joilla on aiemmin todettu dysplasia tai paksusuolisyöpä. Näihin seurantatutkimuksiin kuuluvat kolonoskopia ja biopsiat paikallisten suositusten mukaisesti. Jos golimumabia saavalla potilaalla on hiljattain diagnosoitu dysplasia, hoidon riskejä ja hyötyjä on punnittava tarkoin potilaskohtaisesti ja harkittava, pitäisikö potilaan hoitoa jatkaa.
Eksploratiivisessa kliinisessä tutkimuksessa, jossa arvioitiin golimumabin käyttöä potilaille, joilla on vaikea itsepintainen astma, raportoitiin enemmän maligniteetteja golimumabia saaneilla potilailla kuin verrokeilla (ks. kohta Haittavaikutukset). Tämän havainnon merkitystä ei tiedetä.
Eksploratiivisessa kliinisessä tutkimuksessa, jossa arvioitiin toisen anti‑TNF‑aineen, infliksimabin, käyttöä keskivaikeaa tai vaikeaa keuhkoahtaumatautia (COPD) sairastavilla potilailla, infliksimabia saaneilla raportoitiin enemmän maligniteetteja, lähinnä keuhkoissa tai pään ja kaulan alueella, kuin verrokkiryhmässä. Kaikki potilaat olivat tupakoineet runsaasti. Varovaisuutta on siksi noudatettava käytettäessä mitä tahansa TNF‑antagonistia COPD‑potilaille, kuten myös potilaille, joilla maligniteettiriski on kohonnut runsaan tupakoinnin vuoksi.
Ihosyövät
Melanoomaa ja merkelinsolukarsinoomaa on raportoitu TNF‑salpaajahoitoa, mukaan lukien golimumabia, saaneilla potilailla (ks. kohta Haittavaikutukset). On suositeltavaa tehdä säännöllisiä ihotutkimuksia, erityisesti potilaille, joilla on ihosyövän riskitekijöitä.
Sydämen vajaatoiminta
TNF‑estäjiä, mukaan lukien golimumabia, saaneilla potilailla on raportoitu sydämen vajaatoiminnan pahenemista sekä sydämen vajaatoiminnan ilmaantumisia. Jotkin tapaukset ovat johtaneet kuolemaan. Kliinisessä tutkimuksessa toisella TNF‑antagonistilla havaittiin sydämen vajaatoiminnan pahenemista sekä sydämen vajaatoiminnasta johtuvan kuolleisuuden lisääntymistä. Golimumabia ei ole tutkittu potilailla, joilla on sydämen vajaatoiminta. Golimumabia on käytettävä varoen potilaille, joilla on lievä sydämen vajaatoiminta (NYHA:n luokat I/II). Potilaiden tilaa pitää seurata tarkoin, ja golimumabihoito on keskeytettävä niillä potilailla, joille ilmaantuu uusia tai pahenevia sydämen vajaatoiminnan oireita (ks. kohta Vasta-aiheet).
Neurologiset tapahtumat
TNF‑estäjien, mukaan lukien golimumabi, käyttöön on liittynyt keskushermoston demyelinisoivien sairauksien, mukaan lukien multippeliskleroosin ja perifeeristen demyelinisoivien sairauksien, ilmaantumisia tai kliinisten oireiden ja/tai radiografisten löydösten pahenemisia. Jos potilaalla on aiempi tai äskettäin puhjennut demyelinisoiva sairaus, anti‑TNF‑hoidon hyödyt ja haitat on arvioitava huolellisesti ennen golimumabihoidon aloitusta. Golimumabihoidon lopettamista pitää harkita, jos näitä sairauksia ilmaantuu (ks. kohta Haittavaikutukset).
Kirurgiset toimenpiteet
Golimumabihoitoa saaneille potilaille tehdyistä kirurgisista toimenpiteistä, mukaan lukien artroplastia, on vain rajoitetusti turvallisuustietoa. Pitkä puoliintumisaika pitää ottaa huomioon, jos suunnitellaan kirurgista toimenpidettä. Kirurgista hoitoa tarvitsevaa potilasta, joka saa golimumabia, on tarkkailtava huolellisesti infektioiden varalta. Tilanteen mukaan on ryhdyttävä asianmukaisiin toimenpiteisiin.
Immunosuppressio
On mahdollista, että TNF‑estäjät, mukaan lukien golimumabi, vaikuttavat puolustusmekanismeihin infektioita ja maligniteetteja vastaan, sillä TNF toimii välittäjänä tulehduksessa ja muuntaa soluvälitteisiä immuunivasteita.
Autoimmuuniprosessit
Anti‑TNF‑hoidon aiheuttama suhteellinen TNF‑α‑vaje saattaa johtaa autoimmuuniprosessin käynnistymiseen. Jos golimumabihoitoa saaneelle potilaalle kehittyy lupuksen kaltaiseen oireyhtymään viittaavia oireita ja vasta‑aineita kaksisäikeiselle DNA:lle, golimumabihoito pitää lopettaa (ks. kohta Haittavaikutukset).
Hematologiset reaktiot
TNF‑estäjiä, mukaan lukien golimumabi, saaneilla potilailla on raportoitu pansytopeniaa, leukopeniaa, neutropeniaa, agranulosytoosia, aplastista anemiaa ja trombosytopeniaa. Kaikkia potilaita pitää neuvoa hakeutumaan välittömästi lääkärin hoitoon, jos heille kehittyy veren dyskrasiaan viittaavia merkkejä ja oireita (esim. itsepintaista kuumetta, mustelmia, verenvuotoa, kalpeutta). Golimumabihoidon lopettamista pitää harkita potilailla, joilla on varmistettu olevan merkittäviä hematologisia poikkeavuuksia.
TNF‑estäjien ja anakinran samanaikainen anto
Kliinisissä tutkimuksissa todettiin vakavia infektioita ja neutropeniaa käytettäessä samanaikaisesti anakinraa ja toista TNF‑estäjää, etanerseptiä, eikä yhdistelmähoidolla saavutettu kliinistä lisähyötyä. Tällä yhdistelmähoidolla havaittujen haittavaikutusten luonteen huomioiden samanlaista toksisuutta voi olla seurauksena myös käytettäessä anakinraa yhdessä muiden TNF‑estäjien kanssa. Golimumabin antamista samanaikaisesti anakinran kanssa ei suositella.
TNF‑estäjien ja abataseptin samanaikainen anto
Kliinisissä tutkimuksissa TNF‑estäjien ja abataseptin samanaikaiseen käyttöön on liittynyt infektioiden, mukaan lukien vakavien infektioiden, riskin lisääntyminen verrattuna hoitoon pelkillä TNF‑estäjillä, eikä yhdistelmähoidolla saavutettu kliinistä lisähyötyä. Golimumabin antamista samanaikaisesti abataseptin kanssa ei suositella.
Muiden biologisten lääkkeiden samanaikainen anto
Ei ole riittävästi tietoa golimumabin käytöstä samanaikaisesti muiden sellaisten biologisten lääkkeiden kanssa, joita käytetään samojen sairauksien hoitoon kuin golimumabia. Golimumabin samanaikaista käyttöä näiden biologisten lääkkeiden kanssa ei suositella johtuen infektioriskin suurenemisen mahdollisuudesta sekä muista mahdollisista farmakologisista yhteisvaikutuksista.
Vaihtaminen biologisesta DMARD‑lääkkeestä toiseen
Varovaisuutta on noudatettava ja potilaiden seurantaa jatkettava, kun vaihdetaan biologisesta lääkevalmisteesta toiseen, sillä biologisten aktiivisuuksien päällekkäisyys saattaa entisestään lisätä haittatapahtumien, muun muassa infektioiden, riskiä.
Rokotukset / hoidolliset tartunnanaiheuttajat
Golimumabihoitoa saaville potilaille voidaan antaa samanaikaisesti rokotuksia eläviä rokotteita lukuun ottamatta (ks. kohdat Yhteisvaikutukset ja Raskaus ja imetys). Anti‑TNF‑hoitoa saavista potilaista on vain vähän tietoa, joka koskee vastetta rokotukseen elävillä rokotteilla tai elävien rokotteiden aiheuttaman infektion sekundääritartuntaa. Elävien rokotteiden käyttö voi johtaa kliinisiin infektioihin, mukaan lukien laajalle levinneisiin infektioihin.
Hoidollisten tartunnanaiheuttajien, kuten elävien heikennettyjen bakteerien, muunlainen käyttö (esim. virtsarakon BCG‑huuhteluun syövän hoidossa) voi johtaa kliinisiin infektioihin, mukaan lukien laajalle levinneisiin infektioihin. On suositeltavaa, että hoidollisia tartunnanaiheuttajia ei anneta samanaikaisesti golimumabin kanssa.
Allergiset reaktiot
Markkinoillaolon aikaisessa käytössä on golimumabin antamisen jälkeen raportoitu vakavia systeemisiä yliherkkyysreaktioita (mukaan lukien anafylaktinen reaktio). Jotkin näistä reaktioista ilmenivät ensimmäisen golimumabiannoksen jälkeen. Jos ilmenee anafylaktinen reaktio tai muita vakavia allergisia reaktioita, golimumabin antaminen pitää keskeyttää välittömästi ja on aloitettava asianmukainen hoito.
Herkkyys lateksille
Esitäytetyn kynän tai esitäytetyn ruiskun neulan suojus on valmistettu kuivasta luonnonkumista, joka sisältää lateksia. Se saattaa aiheuttaa allergisen reaktion lateksille herkillä henkilöillä.
Erityiset potilasryhmät
Iäkkäät potilaat (≥ 65‑vuotiaat)
Nivelreumaa, nivelpsoriaasia, selkärankareumaa ja haavaista koliittia koskevissa faasi III:n tutkimuksissa ei havaittu kokonaiseroja haittatapahtumissa, vakavissa haittatapahtumissa tai vakavissa infektioissa 65‑vuotiailla ja sitä vanhemmilla potilailla, jotka saivat golimumabia, kun heitä verrattiin nuorempiin potilaisiin. Varovaisuutta on kuitenkin syytä noudattaa hoidettaessa iäkkäitä potilaita, ja on kiinnitettävä erityistä huomiota infektioiden ilmaantumiseen. Röntgennegatiivista aksiaalista spondylartriittia koskevaan tutkimukseen osallistui vain alle 45-vuotiaita potilaita.
Munuaisten ja maksan toiminnan heikkeneminen
Golimumabilla ei ole tehty erityisiä tutkimuksia potilailla, joilla munuaisten tai maksan toimintakyky on heikentynyt. Golimumabia on käytettävä varoen potilaille, joilla maksan toiminta on heikentynyt (ks. kohta Annostus ja antotapa).
Pediatriset potilaat
Rokotukset
On suositeltavaa, että lapsipotilaiden kaikki rokotukset saatetaan mahdollisuuksien mukaan kulloinkin voimassa olevien rokotussuositusten mukaisesti ajan tasalle ennen golimumabihoidon aloittamista (ks. edellä kohta Rokotukset / hoidolliset tartunnanaiheuttajat).
Apuaineet, joiden vaikutus tunnetaan
Sorbitoli
Simponi sisältää sorbitolia (E420). Sorbitolia (tai fruktoosia) sisältävien muiden valmisteiden samanaikaisen annon sekä ravinnosta saatavan sorbitolin (tai fruktoosin) additiivinen vaikutus on huomioitava hoidettaessa potilaita, joilla on harvinainen perinnöllinen fruktoosi‑intoleranssi (ks. kohta Vaikuttavat aineet ja niiden määrät).
Polysorbaatti 80
Simponi sisältää 0,075 mg polysorbaatti 80:tä (E433) per esitäytetty ruisku. Polysorbaatit saattavat aiheuttaa allergisia reaktioita (ks. kohta Vaikuttavat aineet ja niiden määrät).
Lääkitysvirheiden mahdollisuus
Simponilla on myyntilupa kahdelle ihon alle annettavalle vahvuudelle, 50 mg ja 100 mg. On tärkeää, että käytetään oikeaa vahvuutta, jotta saadaan annostusohjeen mukainen oikea annos (ks. kohta Annostus ja antotapa). On noudatettava huolellisuutta, että potilas saa oikean vahvuuden, jotta varmistetaan, ettei hän saa liian pientä tai liian suurta annosta.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Samanaikainen käyttö muiden biologisten lääkkeiden kanssa
Yhdistelmähoitoa golimumabilla ja muilla biologisilla lääkkeillä, joita käytetään samojen sairauksien hoitoon kuin golimumabia, mukaan lukien anakinra ja abatasepti, ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Elävät rokotteet / hoidolliset tartunnanaiheuttajat
Eläviä rokotteita ei pidä antaa samanaikaisesti golimumabihoidon kanssa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys).
Hoidollisia tartunnanaiheuttajia ei pidä antaa samanaikaisesti golimumabin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Metotreksaatti
Vaikka metotreksaatin samanaikainen käyttö nostaa golimumabin vakaan tilan pienimpiä (trough) pitoisuuksia nivelreuma‑, nivelpsoriaasi‑ ja selkärankareumapotilailla, käytettävissä olevien tietojen mukaan ei ole tarvetta golimumabin tai metotreksaatin annosten muuttamiseen (ks. kohta Farmakokinetiikka).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä asianmukaista raskauden ehkäisyä ja jatkettava sen käyttöä vähintään 6 kuukauden ajan viimeisen golimumabihoidon jälkeen.
Raskaus
Raskauden aikaisesta altistumisesta golimumabille on olemassa kohtalaisen laajat tiedot. Saatavilla on prospektiivisesti kerätyt tiedot noin 400 raskaudesta, jotka päättyivät elävän lapsen syntymään ja joissa lopputulos on tiedossa. Näistä raskauksista 220:ssä altistuminen oli tapahtunut ensimmäisellä raskauskolmanneksella. Pohjois-Euroopassa tehdyssä väestöpohjaisessa tutkimuksessa, jossa arvioitiin tietoja 131 raskaudesta (ja 134 lapsesta), merkittäviä synnynnäisiä epämuodostumia todettiin kuudella 134:stä Simponi-valmisteelle kohdussa altistuneesta lapsesta (4,5 %:lla). Ei-biologiselle systeemiselle hoidolle kohdussa altistuneilla lapsilla vastaava osuus oli 599 / 10 823 (5,5 %) ja tutkimuksen taustaväestössä 4,6 %. Sekoittavien tekijöiden suhteen korjattu kerroinsuhde oli 0,79 (95 %:n luottamusväli 0,35–1,81) verrattaessa Simponi-valmisteelle altistuneita lapsia ei-biologiselle systeemiselle hoidolle altistuneisiin lapsiin ja 0,95 (95 %:n luottamusväli 0,42–2,16) verrattaessa Simponi-valmisteelle altistuneita lapsia taustaväestöön.
Koska golimumabi estää TNF:ää, raskauden aikana annettu golimumabi saattaa vaikuttaa vastasyntyneen normaaleihin immuunivasteisiin. Eläinkokeiden perusteella ei ole saatu tietoa suorista tai epäsuorista haitallisista vaikutuksista raskauteen, alkion/sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta). Kliinistä kokemusta on vain vähän. Golimumabia pitäisi käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Golimumabi läpäisee istukan. Kun TNF:n toimintaa estävää monoklonaalista vasta‑ainetta on annettu raskauden aikana, vasta‑ainetta on havaittu hoitoa saaneille naisille syntyneiden lasten seerumista jopa 6 kuukauden ajan. Näillä lapsilla saattaa infektioriski täten olla suurentunut. Elävien rokotteiden antamista lapsille, jotka ovat altistuneet golimumabille kohdussa, ei suositella 6 kuukauteen äidin viimeisen raskaudenaikaisen golimumabi‑injektion jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Imetys
Ei tiedetä, erittyykö golimumabi ihmisillä äidinmaitoon tai imeytyykö se äidinmaitoa saaneen lapsen elimistöön. Golimumabin osoitettiin kulkeutuvan maitoon apinoilla, ja koska ihmisen immunoglobuliinit erittyvät maitoon, naiset eivät saa imettää golimumabihoidon aikana eivätkä vähintään 6 kuukauteen golimumabihoidon jälkeen.
Hedelmällisyys
Golimumabilla ei ole tehty hedelmällisyystutkimuksia eläimillä. Hedelmällisyystutkimuksessa, joka tehtiin hiirillä käyttäen analogista vasta‑ainetta, joka selektiivisesti estää hiirten TNF‑α:n funktionaalista aktiviteettia, ei havaittu merkittäviä vaikutuksia hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Simponi‑valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Simponin annon jälkeen saattaa kuitenkin ilmetä heitehuimausta (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Ylähengitystieinfektio oli yleisin raportoitu haittavaikutus nivelreuman, nivelpsoriaasin, selkärankareuman, röntgennegatiivisen aksiaalisen spondylartriitin ja haavaisen koliitin keskeisten tutkimusten kontrolloidussa vaiheessa. Sitä ilmeni 12,6 %:lla golimumabia saaneista potilaista ja 11,0 %:lla verrokkiryhmän potilaista. Vakavimpia golimumabiin liittyneitä raportoituja haittavaikutuksia olivat vakavat infektiot (mukaan lukien sepsis, keuhkokuume, tuberkuloosi, invasiiviset sieni‑infektiot ja opportunistiset infektiot), demyelinisoivat sairaudet, B‑hepatiitin reaktivaatio, sydämen vajaatoiminta, autoimmuuniprosessit (lupuksen kaltainen oireyhtymä), hematologiset reaktiot, vakavat systeemiset yliherkkyysreaktiot (mukaan lukien anafylaktinen reaktio), vaskuliitti, lymfooma ja leukemia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Taulukossa 2 on lueteltu haittavaikutukset, joita ilmeni kliinisissä tutkimuksissa ja joita on raportoitu golimumabin markkinoillaolon aikaisessa maailmanlaajuisessa käytössä. Haittavaikutukset on lueteltu elinjärjestelmäluokkien mukaan käyttäen seuraavanlaista esiintymistiheyden luokittelua: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Kaikissa esiintymistiheysryhmissä haittavaikutukset on lueteltu vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 2
Taulukoitu luettelo haittavaikutuksista
| Infektiot | |
| Hyvin yleinen: | Ylähengitystieinfektio (nasofaryngiitti, nielutulehdus, kurkunpäätulehdus ja riniitti) |
| Yleinen: | Bakteeri‑infektiot (kuten selluliitti), alahengitystieinfektio (kuten keuhkokuume), virusinfektiot (kuten influenssa ja herpes), keuhkoputkitulehdus, sinuiitti, pinnalliset sieni‑infektiot, absessi |
| Melko harvinainen: | Sepsis, mukaan lukien septinen sokki, pyelonefriitti |
| Harvinainen: | Tuberkuloosi, opportunistiset infektiot (kuten invasiiviset sieni-infektiot [histoplasmoosi, koksidioidomykoosi, pneumokystoosi], bakteeri-infektiot, epätyypilliset mykobakteeri-infektiot ja alkueläinperäiset infektiot), B-hepatiitin reaktivaatio, bakteerin aiheuttama niveltulehdus, infektiivinen bursiitti |
| Hyvän‑ ja pahanlaatuiset kasvaimet | |
| Melko harvinainen: | Neoplasmat (kuten ihosyöpä, okasolusyöpä ja melanosyyttiluomi) |
| Harvinainen: | Lymfooma, leukemia, melanooma, merkelinsolukarsinooma |
| Tuntematon: | Hepatospleeninen T‑solulymfooma*, Kaposin sarkooma |
| Veri ja imukudos | |
| Yleinen: | Leukopenia (mukaan lukien neutropenia), anemia |
| Melko harvinainen: | Trombosytopenia, pansytopenia |
| Harvinainen: | Aplastinen anemia, agranulosytoosi |
| Immuunijärjestelmä | |
| Yleinen: | Allergiset reaktiot (bronkospasmi, yliherkkyys, urtikaria), autovasta‑ainepositiivisuus |
| Harvinainen: | Vakava systeeminen yliherkkyysreaktio (mukaan lukien anafylaktinen reaktio), vaskuliitti (systeeminen), sarkoidoosi |
| Umpieritys | |
| Melko harvinainen: | Kilpirauhasen häiriö (kuten kilpirauhasen vajaatoiminta, kilpirauhasen liikatoiminta ja struuma) |
| Aineenvaihdunta ja ravitsemus | |
| Melko harvinainen: | Veren glukoosiarvon kohoaminen, lipidiarvojen kohoaminen |
| Psyykkiset häiriöt | |
| Yleinen: | Masennus, unettomuus |
| Hermosto | |
| Yleinen: | Heitehuimaus, päänsärky, tuntoharha |
| Melko harvinainen: | Tasapainohäiriöt |
| Harvinainen: | Demyelinisoivat sairaudet (sentraaliset sekä perifeeriset), makuhäiriö |
| Silmät | |
| Melko harvinainen: | Näköhäiriöt (kuten näön sumentuminen ja heikentynyt näöntarkkuus), sidekalvotulehdus, silmäallergia (kuten kutina ja ärsytys) |
| Sydän | |
| Melko harvinainen: | Rytmihäiriö, iskeemiset sepelvaltimosairaudet |
| Harvinainen: | Sydämen vajaatoiminta (uusi tai paheneva) |
| Verisuonisto | |
| Yleinen: | Kohonnut verenpaine |
| Melko harvinainen: | Tromboosi (kuten laskimon tai aortan), punastuminen |
| Harvinainen: | Raynaud’n oireyhtymä |
| Hengityselimet, rintakehä ja välikarsina | |
| Yleinen: | Astma ja vastaavanlaiset oireet (kuten hengityksen vinkuminen ja keuhkoputkien lisääntynyt supistumisherkkyys) |
| Melko harvinainen: | Interstitiaalinen keuhkosairaus |
| Ruoansulatuselimistö | |
| Yleinen: | Dyspepsia, maha‑suolikanavan sekä vatsan kipu, pahoinvointi, maha‑suolikanavan tulehdukselliset sairaudet (kuten mahatulehdus ja koliitti), suutulehdus |
| Melko harvinainen: | Ummetus, gastroesofageaalinen refluksitauti |
| Maksa ja sappi | |
| Yleinen: | Alaniiniaminotransferaasiarvon kohoaminen, aspartaattiaminotransferaasiarvon kohoaminen |
| Melko harvinainen: | Sappikivitauti, maksan häiriöt |
| Iho ja ihonalainen kudos | |
| Yleinen: | Kutina, ihottuma, alopesia, ihotulehdus |
| Melko harvinainen: | Rakkulaiset ihoreaktiot, psoriaasi (uusi tai olemassa olevan psoriaasin paheneminen, kämmenten/jalkapohjien sekä märkärakkulainen), urtikaria |
| Harvinainen: | Likenoidit reaktiot, ihon eksfoliaatio, vaskuliitti (kutaaninen) |
| Tuntematon: | Dermatomyosiitin oireiden paheneminen |
| Luusto, lihakset ja sidekudos | |
| Harvinainen: | Lupuksen kaltainen oireyhtymä |
| Munuaiset ja virtsatiet | |
| Harvinainen: | Virtsarakon häiriöt, munuaisiin liittyvät häiriöt |
| Sukupuolielimet ja rinnat | |
| Melko harvinainen: | Rintoihin liittyvät häiriöt, kuukautisiin liittyvät häiriöt |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Yleinen: | Kuume, voimattomuus, pistoskohdan reaktio (kuten pistoskohdan punoitus, urtikaria, kovettuma, kipu, mustelmat, kutina, ärsytys ja tuntoharha), epämukava tunne rinnassa |
| Harvinainen: | Paranemisen hidastuminen |
| Vammat, myrkytykset ja hoitokomplikaatiot | |
| Yleinen: | Luunmurtumat |
| * Havaittu muilla TNF‑estäjillä. | |
Tässä osiossa golimumabin käyttöaika esitetään seuranta-ajan mediaanina (noin 4 vuotta) kaiken golimumabihoidon osalta. Jos golimumabin käyttöä kuvataan annoksittain, seuranta-ajan mediaani vaihtelee (noin 2 vuotta, kun annos on 50 mg, ja noin 3 vuotta, kun annos on 100 mg), sillä potilaat ovat saattaneet vaihtaa annoksesta toiseen.
Valikoitujen haittavaikutusten kuvaus
Infektiot
Keskeisten tutkimusten kontrolloidussa vaiheessa ylähengitystieinfektio oli yleisin haittavaikutus, jota raportoitiin 12,6 %:lla golimumabia saaneista potilaista (ilmaantuvuus 100:aa potilasvuotta kohti: 60,8; 95 %:n luottamusväli: 55,0; 67,1) ja verrokkiryhmässä 11,0 %:lla (ilmaantuvuus 100:aa potilasvuotta kohti: 54,5; 95 %:n luottamusväli: 46,1; 64,0). Tutkimusten kontrolloiduissa sekä ei‑kontrolloiduissa osioissa, joissa seuranta‑ajan mediaani oli noin 4 vuotta, ylähengitystieinfektioiden ilmaantuvuus 100:aa potilasvuotta kohti oli 34,9 tapahtumaa (95 %:n luottamusväli: 33,8; 36,0) golimumabia saaneilla potilailla.
Keskeisten tutkimusten kontrolloidussa vaiheessa infektioita havaittiin 23,0 %:lla golimumabia saaneista potilaista (ilmaantuvuus 100:aa potilasvuotta kohti: 132,0; 95 %:n luottamusväli: 123,3; 141,1) ja verrokkiryhmässä 20,2 %:lla (ilmaantuvuus 100:aa potilasvuotta kohti: 122,3; 95 %:n luottamusväli: 109,5; 136,2). Tutkimusten kontrolloiduissa sekä ei‑kontrolloiduissa osioissa, joissa seuranta‑ajan mediaani oli noin 4 vuotta, infektioiden ilmaantuvuus 100:aa potilasvuotta kohti oli 81,1 tapahtumaa (95 %:n luottamusväli: 79,5; 82,8) golimumabia saaneilla potilailla.
Nivelreumaa, nivelpsoriaasia, selkärankareumaa ja röntgennegatiivista aksiaalista spondylartriittia koskevien tutkimusten kontrolloidussa vaiheessa vakavia infektioita havaittiin 1,2 %:lla golimumabia saaneista potilaista ja 1,2 %:lla verrokkiryhmässä. Vakavien infektioiden ilmaantuvuus seuranta‑ajan 100:aa potilasvuotta kohti nivelreumaa, nivelpsoriaasia, selkärankareumaa ja röntgennegatiivista aksiaalista spondylartriittia koskevien tutkimusten kontrolloidussa vaiheessa oli 7,3 (95 %:n luottamusväli: 4,6; 11,1) golimumabia 100 mg:n annoksella saaneiden ryhmässä, 2,9 (95 %:n luottamusväli: 1,2; 6,0) golimumabia 50 mg:n annoksella saaneiden ryhmässä ja 3,6 (95 %:n luottamusväli: 1,5; 7,0) plaseboryhmässä. Haavaisen koliitin golimumabi‑induktiohoidosta tehtyjen tutkimusten kontrolloidussa vaiheessa vakavia infektioita todettiin 0,8 %:lla golimumabihoitoa saaneista potilaista ja 1,5 %:lla verrokkiryhmässä. Golimumabia saaneilla potilailla todettuja vakavia infektioita olivat tuberkuloosi, bakteeri‑infektiot, mukaan lukien sepsis ja keuhkokuume, invasiiviset sieni‑infektiot ja muut opportunistiset infektiot. Jotkin näistä infektioista ovat johtaneet kuolemaan. Keskeisten tutkimusten kontrolloiduissa sekä ei‑kontrolloiduissa osioissa, joissa seuranta‑ajan mediaani oli enintään 3 vuotta, 100 mg:n annoksella golimumabia saaneiden ryhmässä vakavien infektioiden, mukaan lukien opportunistiset infektiot ja tuberkuloosi, ilmaantuvuus oli suurempi kuin 50 mg:n annoksella golimumabia saaneiden ryhmässä. Kaikkien vakavien infektioiden ilmaantuvuus 100:aa potilasvuotta kohti oli 4,1 (95 %:n luottamusväli: 3,6; 4,5) golimumabia 100 mg:n annoksella saaneilla potilailla ja 2,5 (95 %:n luottamusväli: 2,0; 3,1) golimumabia 50 mg:n annoksella saaneilla potilailla.
Maligniteetit
Lymfooma
Lymfoomien ilmaantuvuus oli keskeisissä tutkimuksissa golimumabia saaneilla potilailla suurempi kuin normaaliväestössä on odotettavissa. Näiden tutkimusten kontrolloiduissa sekä ei‑kontrolloiduissa osioissa, joissa seuranta-ajan mediaani oli enintään 3 vuotta, lymfooman ilmaantuvuus oli suurempi 100 mg:n annoksella golimumabia saaneiden potilaiden ryhmässä kuin 50 mg:n annoksella golimumabia saaneiden potilaiden ryhmässä. Lymfooma todettiin 11 potilaalla (yhdellä 50 mg:n annoksella golimumabia saaneiden ryhmässä ja kymmenellä 100 mg:n annoksella golimumabia saaneiden ryhmässä). Ilmaantuvuus (95 %:n luottamusväli) seuranta‑ajan 100:aa potilasvuotta kohti oli 0,03 tapahtumaa (0,00; 0,15) 50 mg:n annoksella golimumabia saaneilla ja 0,13 tapahtumaa (0,06; 0,24) 100 mg:n annoksella golimumabia saaneilla sekä 0,00 tapahtumaa (0,00; 0,57) plasebolla. Pääosa lymfoomista ilmaantui GO‑AFTER‑tutkimuksessa, jossa tutkimukseen otetut potilaat olivat aiemmin saaneet TNF‑estäjiä ja sairaus oli heillä pitkäkestoisempi ja huonommin hoitoon reagoiva (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maligniteetit, muut kuin lymfooma
Keskeisten tutkimusten kontrolloiduissa vaiheissa sekä noin 4 vuoden pituisena seuranta‑aikana muiden maligniteettien kuin lymfoomien (pois lukien ei‑melanoottiset ihosyövät) ilmaantuvuus oli samankaltainen golimumabi‑ ja verrokkiryhmissä. Noin 4 vuoden seuranta‑aikana muiden maligniteettien kuin lymfoomien (pois lukien ei‑melanoottiset ihosyövät) ilmaantuvuus oli samankaltainen kuin väestössä keskimäärin.
Keskeisten tutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa, joissa seuranta‑ajan mediaani oli enintään 3 vuotta, ei‑melanoottista ihosyöpää todettiin 5 potilaalla plaseboryhmässä, 10 potilaalla 50 mg:n annoksella golimumabia saaneiden ryhmässä ja 31 potilaalla 100 mg:n annoksella golimumabia saaneiden ryhmässä. Ilmaantuvuus (95 %:n luottamusväli) seuranta‑ajan 100:aa potilasvuotta kohti oli 0,36 (0,26; 0,49) yhdistetyssä golimumabia saaneiden ryhmässä ja 0,87 (0,28; 2,04) plasebolla.
Keskeisten tutkimusten kontrolloidussa ja ei‑kontrolloidussa vaiheessa, jossa seuranta‑ajan mediaani oli enintään 3 vuotta, muita maligniteetteja kuin melanoomaa, ei‑melanoottista ihosyöpää ja lymfoomaa todettiin 5 potilaalla plaseboryhmässä, 21 potilaalla 50 mg:n annoksella golimumabia saaneiden ryhmässä ja 34 potilaalla 100 mg:n annoksella golimumabia saaneiden ryhmässä. Ilmaantuvuus (95 %:n luottamusväli) seuranta‑ajan 100:aa potilasvuotta kohti oli 0,48 (0,36; 0,62) yhdistetyssä golimumabia saaneiden ryhmässä ja 0,87 (0,28; 2,04) plasebolla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisissä astmatutkimuksissa raportoidut tapaukset
Eksploratiivisessa kliinisessä tutkimuksessa vaikeaa, itsepintaista astmaa sairastavat potilaat saivat latausannoksen golimumabia (150 % sovitusta hoitoannoksesta) ihon alle viikolla 0 ja sen jälkeen 200 mg golimumabia, 100 mg golimumabia tai 50 mg golimumabia joka 4. viikko ihon alle viikolle 52 asti. Yhdistetyssä golimumabiryhmässä (n = 230) raportoitiin 8 maligniteettia ja plaseboa saaneiden ryhmässä ei yhtään (n = 79). Lymfooma raportoitiin 1 potilaalla, ei‑melanoottinen ihosyöpä 2 potilaalla ja muita maligniteetteja 5 potilaalla. Mitään erityistä kasautumista tietyntyyppisiin maligniteetteihin ei todettu.
Tutkimuksen plasebokontrolloidussa osiossa kaikkien maligniteettien ilmaantuvuus (95 %:n luottamusväli) seuranta‑ajan 100:aa potilasvuotta kohti oli 3,19 (1,38; 6,28) golimumabia saaneiden ryhmässä. Tässä tutkimuksessa lymfooman ilmaantuvuus seuranta‑ajan 100:aa potilasvuotta kohti (95 %:n luottamusväli) oli golimumabia saaneiden ryhmässä 0,40 (0,01; 2,20), ei‑melanoottisten ihosyöpien ilmaantuvuus 0,79 (0,10; 2,86) ja muiden maligniteettien ilmaantuvuus 1,99 (0,64; 4,63). Plaseboa saaneilla tutkittavilla näiden maligniteettien ilmaantuvuus (95 %:n luottamusväli) seuranta‑ajan 100:aa potilasvuotta kohti oli 0,00 (0,00; 2,94). Tämän havainnon merkitystä ei tiedetä.
Neurologiset tapahtumat
Keskeisten tutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa, joissa seuranta‑ajan mediaani oli enintään 3 vuotta, demyelinaation ilmaantuvuus oli suurempi 100 mg:n annoksella golimumabia saaneilla potilailla kuin 50 mg:n annoksella golimumabia saaneilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maksaentsyymiarvojen kohoaminen
Keskeisten nivelreuma‑ ja nivelpsoriaasitutkimusten kontrolloidussa vaiheessa tapahtui lievää ALAT‑arvojen kohoamista (> 1 ja < 3 x normaalin ylärajan) samassa suhteessa golimumabia saaneilla sekä verrokeilla nivelreuma‑ ja nivelpsoriaasitutkimuksissa (22,1–27,4 %:lla potilaista). Selkärankareumaa ja röntgennegatiivista aksiaalista spondylartriittia koskevissa tutkimuksissa golimumabia saaneilla potilailla esiintyi enemmän lievää ALAT‑arvojen kohoamista (26,9 %) kuin verrokeilla (10,6 %). Keskeisten nivelreuma‑ ja nivelpsoriaasitutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa, joissa seuranta‑ajan mediaani oli noin 5 vuotta, lievän ALAT‑arvojen kohoamisen ilmaantuvuus oli yhtä suuri golimumabia saaneilla potilailla kuin verrokeilla nivelreumaa ja nivelpsoriaasia koskevissa tutkimuksissa. Haavaisen koliitin keskeisten golimumabi‑induktiotutkimusten kontrolloidussa vaiheessa lievää ALAT‑arvojen kohoamista (> 1 ja < 3 x normaalin ylärajan) esiintyi samassa suhteessa golimumabia saaneilla (8,0 %) ja vertailuryhmän potilailla (6,9 %). Haavaisen koliitin keskeisten tutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa, joissa seuranta‑ajan mediaani oli noin 2 vuotta, lievää ALAT‑arvojen kohoamista esiintyi 24,7 %:lla potilaista, jotka saivat golimumabia haavaisen koliitin tutkimuksen ylläpitovaiheessa.
Keskeisten nivelreuma‑ ja selkärankareumatutkimusten kontrolloidussa vaiheessa ≥ 5 x normaalin ylärajan yli kohonneet ALAT‑arvot olivat melko harvinaisia ja niitä todettiin useammin golimumabia saaneilla potilailla (0,4–0,9 %) kuin verrokeilla (0,0 %). Tätä suuntausta ei havaittu nivelpsoriaasipotilaiden populaatiossa. Keskeisten nivelreuma‑, nivelpsoriaasi‑ ja selkärankareumatutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa, joissa seuranta‑ajan mediaani oli 5 vuotta, ALAT‑arvojen kohoamista ≥ 5 x normaalin ylärajan yli todettiin saman verran golimumabia saaneilla kuin verrokeilla. Yleensä nämä kohoamiset olivat oireettomia ja poikkeavuudet vähenivät tai hävisivät, kun joko jatkettiin golimumabin antoa tai keskeytettiin se tai muutettiin samanaikaista lääkitystä. Röntgennegatiivista aksiaalista spondylartriittia koskevan tutkimuksen kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa (enintään 1 vuosi) ei raportoitu yhtään tapausta. Haavaisen koliitin keskeisten golimumabi‑induktiohoitotutkimusten kontrolloiduissa vaiheissa ALAT‑arvojen kohoamista ≥ 5 x normaalin ylärajan yli esiintyi samassa suhteessa golimumabia saaneilla (0,3 %) ja plaseboa saaneilla (1,0 %) potilailla. Haavaisen koliitin keskeisten tutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa, joissa seuranta‑ajan mediaani oli noin 2 vuotta, ALAT‑arvojen kohoamista ≥ 5 x normaalin ylärajan yli todettiin 0,8 %:lla golimumabia saaneista potilaista haavaisen koliitin tutkimuksen ylläpito‑osiossa.
Keskeisissä nivelreumaa, nivelpsoriaasia, selkärankareumaa ja röntgennegatiivista aksiaalista spondylartriittia koskevissa tutkimuksissa yhdelle golimumabia saaneelle nivelreumatutkimukseen osallistuneelle potilaalle, jolla oli aiempia maksaan liittyviä poikkeavuuksia sekä tilannetta sekoittava lääkitys, kehittyi ei‑infektioosi kuolemaan johtanut maksatulehdus, johon liittyi ikterusta. Golimumabin roolia tähän myötävaikuttavana tai tätä pahentavana tekijänä ei voida sulkea pois.
Pistoskohdan reaktiot
Keskeisten tutkimusten kontrolloiduissa vaiheissa 5,4 % golimumabia saaneista potilaista ja 2,0 % verrokkiryhmän potilaista sai pistoskohdan reaktion. Golimumabin vasta‑aineiden esiintyminen saattaa lisätä pistoskohdan reaktioiden riskiä. Suurin osa pistoskohdan reaktioista oli lieviä tai kohtalaisia, ja yleisin ilmenemismuoto oli pistoskohdan punoitus. Pistoskohdan reaktiot eivät yleensä edellyttäneet lääkevalmisteen käytön lopettamista.
Kontrolloiduissa faasi IIb:n ja/tai faasi III:n nivelreumaa, nivelpsoriaasia, selkärankareumaa, röntgennegatiivista aksiaalista spondylartriittia sekä vaikeaa itsepintaista astmaa koskevissa tutkimuksissa ja faasi II/III:n haavaista koliittia koskevissa tutkimuksissa yhdellekään golimumabia saaneista potilaista ei ilmaantunut anafylaktisia reaktioita.
Autoimmuunivasta‑aineet
Keskeisten tutkimusten kontrolloiduissa ja ei‑kontrolloiduissa vaiheissa yhden vuoden pituisena seuranta‑aikana 3,5 % golimumabia saaneista potilaista ja 2,3 % verrokkiryhmän potilaista tuli ANA‑positiivisiksi (titterit 1:160 tai suurempia). dsDNA‑vasta‑aineita esiintyi vuoden pituisena seuranta‑aikana 1,1 prosentilla potilaista, jotka olivat lähtötilanteessa dsDNA‑vasta-ainenegatiivisia.
Pediatriset potilaat
Idiopaattinen juveniili polyartriitti
Golimumabin turvallisuutta on tutkittu faasi III:n tutkimuksessa, johon osallistui 173 iältään 2–17-vuotiasta idiopaattista juveniilia polyartriittia sairastavaa potilasta. Keskimääräinen seuranta-aika oli noin kaksi vuotta. Tässä tutkimuksessa raportoitujen haittatapahtumien laatu ja esiintymistiheys olivat yleensä samanlaisia kuin on raportoitu aikuisten nivelreumatutkimuksissa.
Haavainen koliitti
Golimumabin turvallisuutta on tutkittu faasi III:n tutkimuksessa, johon osallistui 69 iältään 4–17-vuotiasta, kohtalaista tai vaikeaa aktiivista haavaista koliittia sairastavaa potilasta. Tässä tutkimuksessa havaitut haittavaikutukset olivat yhdenmukaisia aikuisilla haavaista koliittia sairastavilla potilailla todetun golimumabin turvallisuusprofiilin kanssa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisessä tutkimuksessa on annettu jopa 10 mg/kg:n suuruisia kerta‑annoksia laskimoon ilman annosta rajoittavaa toksisuutta. Yliannostustapauksessa on suositeltavaa, että potilasta tarkkaillaan haittavaikutusten merkkien ja oireiden varalta sekä aloitetaan välittömästi asiaankuuluva oireenmukainen hoito.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunosuppressantit, tuumorinekroositekijä alfan (TNF‑α) estäjät, ATC‑koodi: L04AB06
Vaikutusmekanismi
Golimumabi on humaani monoklonaalinen vasta‑aine, joka sitoutuu suurella affiniteetilla bioaktiivisiin ihmisen TNF‑α:n liukoisiin ja transmembraanisiin muotoihin ja muodostaa pysyviä komplekseja niiden kanssa, mikä estää TNF‑α:n sitoutumisen reseptoreihinsa.
Farmakodynaamiset vaikutukset
On osoitettu, että sitoutuessaan ihmisen TNF:ään golimumabi neutraloi TNF‑α:n indusoimaa adheesiomolekyylien E‑selektiinin, VCAM‑1:n (vascular cell adhesion molecule‑1) ja ICAM‑1:n (intercellular adhesion molecule‑1) ilmentymistä ihmisen endoteelisolujen pinnalla. In vitro golimumabi esti myös TNF:n indusoimaa interleukiini‑6:n (IL‑6:n), IL‑8:n ja granulosyytti‑makrofagikasvutekijän (GM‑CSF) vapautumista ihmisen endoteelisoluissa.
C‑reaktiivisen proteiinin (CRP) arvot paranivat plaseboryhmiin verrattuna, ja Simponi‑hoito laski merkitsevästi seerumin IL‑6:n, ICAM‑1:n, matriksimetalloproteinaasi‑3:n (MMP‑3:n) ja verisuonten endoteelikasvutekijän (VEGF) pitoisuuksia lähtöarvosta vertailuhoitoon verrattuna. Lisäksi TNF‑α‑pitoisuus pieneni nivelreuma‑ ja selkärankareumapotilailla ja IL‑8:n pitoisuus nivelpsoriaasipotilailla. Nämä muutokset todettiin ensimmäisessä arvioinnissa (viikolla 4) ensimmäisen Simponi‑annoksen jälkeen, ja ne säilyivät yleensä viikkoon 24 asti.
Kliininen teho
Aikuisten nivelreuma
Simponin teho osoitettiin kolmessa plasebokontrolloidussa, satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa. Tutkimuksissa oli mukana yli 1 500 potilasta, jotka olivat ≥ 18‑vuotiaita ja joilla oli vähintään 3 kuukautta ennen seulontaa diagnosoitu kohtalaisen aktiivinen tai hyvin aktiivinen nivelreuma ACR:n (American College of Rheumatology) kriteerien perusteella. Potilailla oli vähintään 4 turvonnutta ja 4 aristavaa niveltä. Simponia tai plaseboa annettiin ihon alle 4 viikon välein.
GO‑FORWARD‑tutkimuksessa arvioitiin 444:ää potilasta, joilla oli aktiivinen nivelreuma vakaalla annoksella (vähintään 15 mg/viikko) annetusta metotreksaattihoidosta huolimatta ja jotka eivät olleet aikaisemmin saaneet TNF‑estäjiä. Potilaat saivat satunnaistetusti plaseboa + metotreksaattia, Simponia 50 mg + metotreksaattia, Simponia 100 mg + metotreksaattia tai Simponia 100 mg + plaseboa. Plaseboa + metotreksaattia saaneille potilaille vaihdettiin viikon 24 jälkeen hoidoksi Simponi 50 mg + metotreksaatti. Viikolla 52 potilaat siirtyivät avoimeen pitkäaikaiseen jatkotutkimukseen.
GO‑AFTER‑tutkimuksessa arvioitiin 445:tä potilasta, jotka olivat aikaisemmin saaneet yhtä tai useampaa TNF‑estäjää, adalimumabia, etanerseptiä tai infliksimabia. Potilaat saivat satunnaistetusti plaseboa, Simponia 50 mg:n annoksella tai Simponia 100 mg:n annoksella. Potilaat saivat jatkaa perinteisten reumalääkkeiden (DMARD) metotreksaatin, sulfasalatsiinin ja/tai hydroksiklorokiinin samanaikaista käyttöä tutkimuksen aikana. Aikaisemman TNF‑estäjähoidon lopettamisen syiksi ilmoitettiin tehon puuttuminen (58 %), se, että potilas ei sietänyt hoitoa (13 %), ja/tai muut kuin hoidon turvallisuuteen tai tehoon liittyvät syyt (29 %, pääasiassa taloudelliset syyt).
GO‑BEFORE‑tutkimuksessa arvioitiin 637:ää potilasta, joilla oli aktiivinen nivelreuma ja jotka eivät olleet saaneet metotreksaattia ja joita ei ollut aiemmin hoidettu TNF‑estäjillä. Potilaat satunnaistettiin saamaan plaseboa + metotreksaattia, Simponia 50 mg + metotreksaattia, Simponia 100 mg + metotreksaattia tai Simponia 100 mg + plaseboa. Viikolla 52 potilaat siirtyivät avoimeen pitkäaikaiseen jatkovaiheeseen, jossa niille potilaille, jotka olivat saaneet plaseboa + metotreksaattia ja joilla oli vähintään yksi aristava tai turvonnut nivel, vaihdettiin hoidoksi Simponi 50 mg + metotreksaatti.
GO‑FORWARD‑tutkimuksessa toinen ensisijainen päätetapahtuma oli ACR20‑vasteen saavuttaneiden potilaiden osuus viikolla 14 ja toinen HAQ‑toimintakykyindeksin (Health Assessment Questionnaire, HAQ) paraneminen lähtötilanteeseen verrattuna viikolla 24. GO‑AFTER‑tutkimuksessa ensisijainen päätetapahtuma oli ACR20‑vasteen saavuttaneiden potilaiden osuus viikolla 14. GO‑BEFORE‑tutkimuksessa rinnakkaiset ensisijaiset päätetapahtumat olivat ACR50‑vasteen saavuttaneiden potilaiden osuus viikolla 24 ja muutos lähtötilanteesta van der Heijde ‑modifioidulla Sharpin asteikolla (vdH‑S) viikolla 52. Ensisijaisten päätetapahtumien lisäksi arvioitiin Simponi‑hoidon vaikutusta niveltulehduksen merkkeihin ja oireisiin, radiografiseen vasteeseen, fyysiseen toimintakykyyn sekä terveyteen liittyvään elämänlaatuun.
Tehoa kuvaavissa tuloksissa ei havaittu yleisiä kliinisesti merkittäviä eroja 50 mg:n ja 100 mg:n Simponi‑annostusten välillä, kun niitä oli käytetty yhdessä metotreksaatin kanssa 104 viikon ajan GO‑FORWARD‑ ja GO‑BEFORE‑tutkimuksissa ja 24 viikon ajan GO‑AFTER‑tutkimuksessa. Jokaisessa nivelreumatutkimuksessa tutkimusasetelman mukaisesti potilaat saattoivat pitkäaikaisessa jatkovaiheessa vaihtaa 50 mg:n Simponi-annoksesta 100 mg:n annokseen tai päinvastoin tutkijalääkärin harkinnan mukaan.
Merkit ja oireet
Taulukossa 3 ovat tärkeimmät Simponin 50 mg:n annoksella viikoilla 14, 24 ja 52 GO‑FORWARD‑, GO‑AFTER‑ ja GO‑BEFORE‑tutkimuksissa saavutetut ACR‑tulokset, joita kuvataan seuraavassa. Vasteet todettiin ensimmäisessä arvioinnissa (viikolla 4) ensimmäisen Simponi‑annoksen jälkeen.
GO‑FORWARD‑tutkimuksessa 89 tutkittavasta, jotka satunnaistettiin saamaan Simponia 50 mg + metotreksaattia, 48 sai tätä hoitoa edelleen viikolla 104. Näistä 40 potilasta sai ACR20‑vasteen, 33 ACR50‑vasteen ja 24 ACR70‑vasteen viikolla 104. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, havaitut ACR20/50/70‑vasteiden määrät olivat samanlaisia viikoilla 104–256.
GO‑AFTER‑tutkimuksessa ACR20‑vasteen saavuttaneiden potilaiden osuus oli suurempi Simponi‑hoitoa kuin plaseboa saaneessa ryhmässä riippumatta siitä, mikä oli ilmoitettu syyksi yhden tai useamman aikaisemman TNF‑estäjähoidon lopettamiseen.
Taulukko 3
GO‑FORWARD‑, GO‑AFTER‑ ja GO‑BEFORE‑tutkimusten kontrolloitujen osioiden tärkeimmät tehoa kuvaavat tulokset
GO‑FORWARD Aktiivinen nivelreuma metotreksaattihoidosta (MTX) huolimatta | GO‑AFTER Aktiivinen nivelreuma, saaneet aikaisemmin yhtä tai useampaa TNF‑estäjää | GO‑BEFORE Aktiivinen nivelreuma, eivät saaneet aikaisemmin metotreksaattia (MTX) | ||||
Plasebo + MTX | Simponi 50 mg + MTX | Plasebo | Simponi 50 mg | Plasebo + MTX | Simponi 50 mg + MTX | |
na | 133 | 89 | 150 | 147 | 160 | 159 |
Hoitovaste, % potilaista | ||||||
ACR 20 | ||||||
Viikko 14 | 33 % | 55 %* | 18 % | 35 %* | NA | NA |
Viikko 24 | 28 % | 60 %* | 16 % | 31 % p = 0,002 | 49 % | 62 % |
Viikko 52 | NA | NA | NA | NA | 52 % | 60 % |
ACR 50 | ||||||
Viikko 14 | 10 % | 35 %* | 7 % | 15 % p = 0,021 | NA | NA |
Viikko 24 | 14 % | 37 %* | 4 % | 16 %* | 29 % | 40 % |
Viikko 52 | NA | NA | NA | NA | 36 % | 42 % |
ACR 70 | ||||||
Viikko 14 | 4 % | 14 % p = 0,008 | 2 % | 10 % p = 0,005 | NA | NA |
Viikko 24 | 5 % | 20 %* | 2 % | 9 % p = 0,009 | 16 % | 24 % |
Viikko 52 | NA | NA | NA | NA | 22 % | 28 % |
a n tarkoittaa satunnaistettuja potilaita; kutakin päätetapahtumaa varten arvioitavissa oleva todellinen potilasmäärä voi vaihdella ajankohdasta riippuen. * p ≤ 0,001 NA: Ei oleellinen | ||||||
GO‑BEFORE‑tutkimuksessa ensisijainen analyysi potilailla, joilla oli kohtalainen tai vaikea nivelreuma (yhdistetyt Simponi 50 ja 100 mg + metotreksaatti ‑ryhmät vs. pelkkä metotreksaatti ACR50‑vasteelle), ei ollut tilastollisesti merkitsevä viikolla 24 (p = 0,053). Viikolla 52 kokonaispopulaatiossa ACR‑vasteen saaneiden potilaiden osuus Simponia 50 mg + metotreksaattia saaneiden ryhmässä oli yleisesti korkeampi, mutta ei merkitsevästi erilainen kuin pelkkää metotreksaattia saaneilla (ks. taulukko 3). Lisäanalyysejä tehtiin alaryhmissä, jotka edustivat käyttöaiheen mukaista potilaspopulaatiota eli joiden potilailla oli vaikea, aktiivinen ja etenevä nivelreuma. Simponi 50 mg + metotreksaatti ‑hoidolla oli yleisesti suurempi teho kuin pelkällä metotreksaatilla käyttöaiheen mukaisessa populaatiossa verrattuna kokonaispopulaatioon.
GO‑FORWARD‑ ja GO‑AFTER‑tutkimuksissa todettiin kliinisesti merkittävät ja tilastollisesti merkitsevät vasteet taudin aktiivisuutta mittaavalla DAS28‑asteikolla (Disease Activity Scale 28) kumpanakin etukäteen määriteltynä arviointiajankohtana, viikolla 14 ja viikolla 24 (p ≤ 0,001). Potilailla, jotka pysyivät siinä Simponi‑hoidossa, jota saamaan heidät satunnaistettiin tutkimuksen alussa, DAS28‑vasteet säilyivät viikolle 104 asti. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, DAS28‑vasteet olivat samanlaisia viikoilla 104–256.
GO‑BEFORE‑tutkimuksessa mitattiin merkittävä kliininen vaste, joka määriteltiin ACR70‑vasteen säilymisenä yhtäjaksoisesti 6 kuukauden ajan. Viikolla 52 15 % potilaista Simponia 50 mg + metotreksaattia saaneiden ryhmässä ja vastaavasti 7 % potilaista plaseboa + metotreksaattia saaneiden ryhmässä sai merkittävän kliinisen vasteen (p = 0,018). 159 potilaasta, jotka oli satunnaistettu saamaan Simponia 50 mg + metotreksaattia, 96 sai tätä hoitoa edelleen viikolla 104. Näistä 85 potilasta sai ACR20‑vasteen, 66 sai ACR50‑vasteen ja 53 sai ACR70‑vasteen viikolla 104. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, havaitut ACR20/50/70‑vasteiden määrät olivat samanlaisia viikoilla 104–256.
Radiografinen vaste
GO‑BEFORE‑tutkimuksessa arvioitiin käsien/ranteiden ja jalkaterien rakenteellisten vaurioiden laajuutta vdH‑S‑pistemäärän muutoksella lähtötilanteesta. Tämä pistemäärä koostuu niveleroosioiden määrästä ja koosta ja nivelvälin kaventumisesta, jotka mitattiin radiografisesti. Taulukossa 4 on esitetty Simponin 50 mg:n annoksella viikolla 52 saadut tärkeimmät tulokset.
Niiden potilaiden lukumäärä, joilla ei havaittu uusia eroosioita tai joilla vdH‑S‑kokonaispistemäärän muutos lähtötilanteesta oli ≤ 0, oli merkitsevästi suurempi Simponia saaneiden ryhmässä kuin verrokkiryhmässä (p = 0,003). Viikolla 52 havaitut radiografiset vaikutukset säilyivät viikolle 104 asti. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, radiografiset vaikutukset olivat samanlaisia viikoilla 104–256.
Taulukko 4
Keskimääräiset radiografiset muutokset lähtötilanteesta (keskihajonta, SD) kokonaispistemääränä vdH‑S‑asteikolla viikolla 52 GO‑BEFORE‑tutkimuksen kokonaispopulaatiossa
Plasebo + MTX | Simponi 50 mg + MTX | |
na | 160 | 159 |
Kokonaispistemäärä | ||
Lähtötilanne | 19,7 (35,4) | 18,7 (32,4) |
Muutos lähtötilanteesta | 1,4 (4,6) | 0,7 (5,2)* |
Eroosiopistemäärä | ||
Lähtötilanne | 11,3 (18,6) | 10,8 (17,4) |
Muutos lähtötilanteesta | 0,7 (2,8) | 0,5 (2,1) |
Nivelvälin kaventumista kuvaava pistemäärä | ||
Lähtötilanne | 8,4 (17,8) | 7,9 (16,1) |
Muutos lähtötilanteesta | 0,6 (2,3) | 0,2 (2,0)** |
a n tarkoittaa satunnaistettuja potilaita * p = 0,015 ** p = 0,044 | ||
Fyysinen toimintakyky ja terveyteen liittyvä elämänlaatu
GO‑FORWARD‑ ja GO‑AFTER‑tutkimuksissa fyysistä toimintakykyä ja toiminnanvajavuutta (disability) arvioitiin erillisenä päätetapahtumana toiminnanvajavuutta kuvaavaa HAQ DI ‑indeksiä käyttäen. Näissä tutkimuksissa Simponi paransi HAQ DI ‑indeksiä kliinisesti merkittävästi ja tilastollisesti merkitsevästi lähtöarvosta vertailuryhmään verrattuna viikkoon 24 mennessä. Potilailla, jotka pysyivät siinä Simponi‑hoidossa, jota saamaan heidät satunnaistettiin tutkimuksen alussa, HAQ DI ‑indeksin paraneminen säilyi viikolle 104 asti. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, HAQ DI ‑indeksin paraneminen oli samanlaista viikoilla 104–256.
GO‑FORWARD‑tutkimuksessa todettiin Simponi‑hoitoa saaneiden potilaiden terveyteen liittyvän elämänlaadun kliinisesti merkittävä ja tilastollisesti merkitsevä paraneminen SF‑36‑asteikon fyysistä toimintakykyä mittaavalla osiolla plaseboa saaneisiin potilaisiin verrattuna viikolla 24. Potilailla, jotka pysyivät siinä Simponi‑hoidossa, jota saamaan heidät satunnaistettiin tutkimuksen alussa, SF‑36‑asteikon fyysistä toimintakykyä mittaavalla osiolla havaittu paraneminen säilyi viikolle 104 asti. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, SF-36‑asteikon fyysistä toimintakykyä mittaavalla osiolla havaittu paraneminen oli samanlaista viikoilla 104–256. GO‑FORWARD‑ ja GO‑AFTER‑tutkimuksissa todettiin väsymyksen tilastollisesti merkitsevä paraneminen väsymystä mittaavalla FACIT‑F‑asteikolla (Functional Assessment of Chronic Illness Therapy ‑ Fatigue).
Aikuisten nivelpsoriaasi
Simponin turvallisuutta ja tehoa verrattiin plaseboon satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa (GO‑REVEAL) 405 aikuispotilaalla, joilla oli aktiivinen nivelpsoriaasi (≥ 3 turvonnutta ja ≥ 3 aristavaa niveltä) tulehduskipulääkkeiden (NSAID) tai perinteisten reumalääkkeiden (DMARD) käytöstä huolimatta. Tämän tutkimuksen potilaiden nivelpsoriaasi oli diagnosoitu vähintään 6 kuukautta aikaisemmin, ja heillä oli vähintään lievä psoriaattinen tauti. Mukaan otettiin potilaita kustakin nivelpsoriaasin alatyypistä, joita olivat moniniveltulehdus, johon ei liittynyt reumakyhmyjä (43 %), epäsymmetrinen perifeerinen niveltulehdus (30 %), sormien tai varpaiden kärkinivelten (DIP‑nivelten) tulehdus (15 %), spondyliitti, johon liittyi perifeerinen artriitti (11 %), ja arthritis mutilans ‑niveltulehdus (1 %). Aikaisempaa hoitoa TNF‑estäjillä ei sallittu. Simponi tai plasebo annettiin ihon alle 4 viikon välein. Potilaat saivat satunnaistetusti plaseboa, Simponia 50 mg:n annoksella tai Simponia 100 mg:n annoksella. Plaseboa saaneet potilaat siirrettiin viikon 24 jälkeen Simponia 50 mg:n annoksella saavaan ryhmään. Viikolla 52 potilaat siirtyivät avoimeen pitkäaikaiseen jatkotutkimukseen. Noin 48 % potilaista jatkoi metotreksaattihoitoa vakailla annoksilla (≤ 25 mg/viikko). Rinnakkaiset ensisijaiset päätetapahtumat olivat ACR20‑vasteen saavuttaneiden potilaiden osuus viikolla 14 ja nivelpsoriaasiin mukautetulla vdH‑S‑asteikolla saadun kokonaispistemäärän muutos lähtötilanteesta viikolla 24.
Tehoa kuvaavissa tuloksissa ei havaittu yleisiä kliinisesti merkittäviä eroja 50 mg:n ja 100 mg:n Simponi‑annostusten välillä viikolle 104 asti. Tutkimusasetelman mukaisesti potilaat saattoivat pitkäaikaisessa jatkovaiheessa vaihtaa 50 mg:n Simponi-annoksesta 100 mg:n annokseen tai päinvastoin tutkijalääkärin harkinnan mukaan.
Merkit ja oireet
Taulukossa 5 ovat tärkeimmät 50 mg:n annoksella saavutetut tulokset viikoilla 14 ja 24, ja niitä kuvataan alla.
Taulukko 5
GO‑REVEAL‑tutkimuksen tärkeimmät tehoa kuvaavat tulokset
Plasebo | Simponi 50 mg* | |
na | 113 | 146 |
Hoitovaste, % potilaista | ||
ACR 20 | ||
Viikko 14 | 9 % | 51 % |
Viikko 24 | 12 % | 52 % |
ACR 50 | ||
Viikko 14 | 2 % | 30 % |
Viikko 24 | 4 % | 32 % |
ACR 70 | ||
Viikko 14 | 1 % | 12 % |
Viikko 24 | 1 % | 19 % |
PASIb 75c | ||
Viikko 14 | 3 % | 40 % |
Viikko 24 | 1 % | 56 % |
* p < 0,05 kaikissa vertailuissa a n tarkoittaa satunnaistettuja potilaita; kutakin päätetapahtumaa varten arvioitavissa oleva todellinen potilasmäärä voi vaihdella ajankohdasta riippuen. b Psoriasis Area and Severity Index c Perustuu niiden potilaiden alaryhmään, joilla psoriaasin osuus ihon pinta‑alasta (BSA) oli ≥ 3 % lähtötilanteessa, 79 potilasta (69,9 %) plaseboryhmässä ja 109 potilasta (74,3 %) 50 mg:n Simponi‑annoksia saaneessa ryhmässä. | ||
Vasteita havaittiin ensimmäisessä arvioinnissa (viikolla 4) ensimmäisen Simponi‑annoksen jälkeen. Samanlaiset ACR20‑vasteet todettiin viikolla 14 potilailla, joilla nivelpsoriaasin alatyyppi oli moniniveltulehdus, johon ei liittynyt reumakyhmyjä, tai epäsymmetrinen perifeerinen niveltulehdus. Muissa nivelpsoriaasin alatyypeissä potilasmäärät olivat niin pieniä, ettei pätevää arviota voitu tehdä. Simponi‑hoitoa saaneissa ryhmissä vasteet olivat samansuuruisia riippumatta siitä, saivatko potilaat samanaikaisesti metotreksaattia vai eivät. Simponia 50 mg:n annoksina saaneeseen ryhmään satunnaistetuista 146 potilaasta 70 jatkoi edelleen tätä hoitoa viikolla 104. Näistä 70 potilaasta ACR20‑vaste todettiin 64 potilaalla, ACR50‑vaste 46 potilaalla ja ACR70‑vaste 31 potilaalla. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, havaitut ACR20/50/70‑vasteiden määrät olivat samanlaisia viikoilla 104–256.
Myös DAS28‑asteikolla todettiin tilastollisesti merkitsevät vasteet viikoilla 14 ja 24 (p < 0,05).
Viikolla 24 Simponi‑hoitoa saaneilla potilailla havaittiin paranemista nivelpsoriaasille tyypillistä perifeeristä aktiivisuutta mittaavissa parametreissä (esim. turvonneiden nivelten lukumäärä, kipeiden/aristavien nivelten lukumäärä, daktyliitti ja entesiitti). Simponi‑hoito paransi merkitsevästi fyysistä toimintakykyä HAQ DI ‑indeksillä arvioituna. Myös terveyteen liittyvä elämänlaatu parani merkitsevästi SF‑36‑asteikon fyysisen ja psyykkisen osion yhdistettyjen tulosten perusteella. DAS28‑ ja HAQ DI ‑vasteet säilyivät viikolle 104 asti niiden potilaiden ryhmässä, jotka jatkoivat samaa Simponi‑hoitoa, johon heidät oli tutkimuksen alussa satunnaistettu. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, DAS28‑ ja HAQ DI ‑vasteet olivat samanlaisia viikoilla 104–256.
Radiografinen vaste
Molempien käsien ja jalkaterien rakenteellisia vaurioita arvioitiin radiografisesti nivelpsoriaasiin mukautetulla vdH‑S‑asteikolla, jossa olivat mukana myös sormien kärkinivelet, tarkastelemalla pistemäärän muutosta lähtötilanteesta.
Simponi‑hoito 50 mg:n annoksina hidasti perifeerisen nivelvaurion etenemistä plaseboon verrattuna viikolla 24 tehtyjen mittausten perusteella, kun arviointiperusteena oli modifioidulla vdH‑S‑asteikolla saadun kokonaispistemäärän muutos lähtöarvosta (pisteiden keskiarvo ± SD oli plaseboryhmässä 0,27 ± 1,3 ja Simponi‑ryhmässä ‑0,16 ± 1,3; p = 0,011). Niistä 146 potilaasta, jotka oli satunnaistettu 50 mg:n Simponi‑annoksia saavaan ryhmään, 52 viikon röntgentutkimusten tulokset olivat käytettävissä 126 potilaasta, joista 77 prosentilla tauti ei ollut edennyt lähtötilanteeseen verrattuna. Viikolla 104 röntgentutkimusten tulokset olivat käytettävissä 114 potilaasta, ja heistä 77 prosentilla tauti ei ollut edennyt lähtötilanteeseen verrattuna. Potilaista, jotka pysyivät tutkimuksessa ja saivat Simponia, niiden osuus, joilla tauti ei ollut edennyt lähtötilanteesta viikoilla 104–256, oli samansuuruinen.
Aikuisiän aksiaalinen spondylartriitti
Aikuisiän selkärankareuma
Simponin turvallisuutta ja tehoa verrattiin plaseboon satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa (GO‑RAISE) 356 aikuispotilaalla, joilla oli aktiivinen selkärankareuma (Bath Ankylosing Spondylitis Disease Activity Index [BASDAI] pistearvo ≥ 4 ja kipujanalla (VAS) mitattu koko selän kipu ≥ 4 asteikolla 0–10 cm). Tähän tutkimukseen otetuilla potilailla oli aktiivinen tauti senhetkisestä tai aikaisemmasta tulehduskipulääkityksestä (NSAID) tai perinteisten reumalääkkeiden (DMARD) käytöstä huolimatta, eivätkä he olleet saaneet aikaisemmin TNF‑estäjiä. Simponi tai plasebo annettiin ihon alle 4 viikon välein. Potilaille annettiin satunnaistetusti plaseboa, Simponia 50 mg:n annoksella tai Simponia 100 mg:n annoksella, ja he saivat jatkaa samanaikaista perinteisten reumalääkkeiden (DMARD) (metotreksaatin, sulfasalatsiinin ja/tai hydroksiklorokiinin) käyttöä. Ensisijainen päätetapahtuma oli ASAS20‑vasteen (ASAS, Ankylosing Spondylitis Assessment Study Group) saavuttaneiden potilaiden osuus viikolla 14. Plasebovertailuun perustuvat tehoa kuvaavat tulokset kerättiin ja analysoitiin 24 viikon ajalta.
Taulukossa 6 ovat tärkeimmät 50 mg:n annoksella saadut tulokset ja niitä kuvataan alla. Tehoa kuvaavissa tuloksissa ei havaittu yleisiä kliinisesti merkittäviä eroja 50 mg:n ja 100 mg:n Simponi‑annostusten välillä viikolle 24 asti. Tutkimusasetelman mukaisesti potilaat saattoivat pitkäaikaisessa jatkovaiheessa vaihtaa 50 mg:n Simponi-annoksesta 100 mg:n annokseen tai päinvastoin tutkijalääkärin harkinnan mukaan.
Taulukko 6
GO‑RAISE‑tutkimuksen tärkeimmät tehoa kuvaavat tulokset
Plasebo | Simponi 50 mg* | |
na | 78 | 138 |
Hoitovaste, % potilaista | ||
ASAS 20 | ||
Viikko 14 | 22 % | 59 % |
Viikko 24 | 23 % | 56 % |
ASAS 40 | ||
Viikko 14 | 15 % | 45 % |
Viikko 24 | 15 % | 44 % |
ASAS 5/6 | ||
Viikko 14 | 8 % | 50 % |
Viikko 24 | 13 % | 49 % |
* p ≤ 0,001 kaikissa vertailuissa a n tarkoittaa satunnaistettuja potilaita; kutakin päätetapahtumaa varten arvioitavissa oleva todellinen potilasmäärä voi vaihdella ajankohdasta riippuen. | ||
Potilaista, jotka pysyivät tutkimuksessa ja saivat Simponia, ASAS20- tai ASAS40-vasteen saavuttaneiden potilaiden osuus oli samansuuruinen viikoilla 24–256.
Viikoilla 14 ja 24 todettiin myös tilastollisesti merkitsevät vasteet BASDAI‑50, ‑70 ja ‑90‑vasteiden osalta (p ≤ 0,017). Tärkeimmissä taudin aktiivisuutta mittaavissa tuloksissa havaittiin paranemista ensimmäisessä arvioinnissa (viikolla 4) ensimmäisen Simponi‑annoksen jälkeen, ja muutokset säilyivät viikkoon 24 asti. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, havaitut BASDAI‑pistearvon muutokset lähtötilanteesta olivat samansuuruisia viikoilla 24–256. Viikolla 14 todettuun ASAS20‑vasteeseen perustuva teho oli yhdenmukainen riippumatta perinteisten reumalääkkeiden (DMARD) (metotreksaatin, sulfasalatsiinin ja/tai hydroksiklorokiinin) käytöstä, HLA‑B27‑antigeenistatuksesta tai lähtötilanteen CRP‑arvosta.
Simponi‑hoito johti merkitsevään fyysisen toimintakyvyn paranemiseen arvioituna BASFI‑indeksin muutoksena lähtötilanteeseen verrattuna viikoilla 14 ja 24. Terveyteen liittyvä elämänlaatu oli myös parantunut merkitsevästi SF‑36‑asteikon fyysisen osion pistearvon perusteella viikoilla 14 ja 24. Niillä potilailla, jotka pysyivät tutkimuksessa ja saivat Simponia, fyysisen toimintakyvyn ja terveyteen liittyvän elämänlaadun paraneminen olivat samansuuruisia viikoilla 24–256.
Aikuisiän röntgennegatiivinen aksiaalinen spondylartriitti
GO-AHEAD
Simponin turvallisuutta ja tehoa verrattiin plaseboon satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa (GO-AHEAD) 197 aikuispotilaalla, joilla oli vaikea aktiivinen röntgennegatiivinen aksiaalinen spondylartriitti (eli potilailla, jotka täyttivät ASAS-luokittelun kriteerit aksiaaliselle spondylartriitille mutta eivät täyttäneet modifioituja New York -kriteerejä selkärankareumalle). Tähän tutkimukseen otetuilla potilailla oli aktiivinen tauti (BASDAI ≥ 4 ja kipujanalla (VAS) mitattu koko selän kipu ≥ 4 asteikolla 0–10 cm) senhetkisestä tai aikaisemmasta tulehduskipulääkityksestä huolimatta, eivätkä he olleet saaneet aikaisemmin biologisia lääkkeitä, kuten TNF-estäjiä. Potilaat satunnaistettiin saamaan plaseboa tai Simponia 50 mg:n annoksella ihon alle 4 viikon välein. Viikolla 16 potilaat siirtyivät avoimeen vaiheeseen, jossa kaikki potilaat saivat Simponia 50 mg ihon alle 4 viikon välein viikolle 48 asti, ja tehon arviointia jatkettiin viikolle 52 ja turvallisuusseurantaa viikolle 60 asti. Noin 93 % potilaista, jotka saivat Simponia avoimen jatkovaiheen alussa (viikolla 16), jatkoi hoitoa tutkimuksen loppuun (viikolle 52) asti. Analyysit tehtiin sekä kaikkien hoidettujen potilaiden ryhmälle (N = 197) että niiden potilaiden ryhmälle, joilla oli objektiivisia tulehduslöydöksiä (N = 158, määriteltiin lähtötilanteessa suurentuneeksi C-reaktiivisen proteiinin (CRP) pitoisuudeksi ja/tai magneettitutkimuksessa todetuksi näytöksi risti-suoliluunivelen tulehduksesta). Plasebovertailuun perustuvat tehoa kuvaavat tulokset kerättiin ja analysoitiin 16 viikon ajalta. Ensisijainen päätetapahtuma oli ASAS 20 ‑vasteen saavuttaneiden potilaiden osuus viikolla 16. Keskeiset tulokset on esitetty taulukossa 7 ja kuvattu jäljempänä.
Taulukko 7
GO-AHEAD-tutkimuksen tärkeimmät tehoa kuvaavat tulokset viikolla 16
Oireiden ja merkkien paraneminen | ||||
Kaikki hoidetut potilaat | Potilaat, joilla oli objektiivisia tulehduslöydöksiä | |||
Plasebo | Simponi 50 mg | Plasebo | Simponi 50 mg | |
na | 100 | 97 | 80 | 78 |
Hoitovaste, % potilaista | ||||
ASAS 20 | 40 % | 71 %** | 38 % | 77 %** |
ASAS 40 | 23 % | 57 %** | 23 % | 60 %** |
ASAS 5/6 | 23 % | 54 %** | 23 % | 63 %** |
ASAS osittainen remissio | 18 % | 33 %* | 19 % | 35 %* |
ASDAS-Cb < 1,3 | 13 % | 33 %* | 16 % | 35 %* |
BASDAI 50 | 30 % | 58 %** | 29 % | 59 %** |
Risti-suoliluunivelen tulehduksen esto magneettitutkimuksella mitattuna | ||||
Plasebo | Simponi 50 mg | Plasebo | Simponi 50 mg | |
n C | 87 | 74 | 69 | 61 |
Risti-suoliluunivelen SPARCCd MRI ‑pistemäärän keskimääräinen muutos | ‑0,9 | ‑5,3** | ‑1,2 | ‑6,4** |
a n kuvaa satunnaistettuja ja hoitoa saaneita potilaita b Selkärankareuman aktiivisuutta kuvaava indeksi (Ankylosing Spondylitis Disease Activity Score C-Reactive Protein (kaikki hoidetut potilaat, plaseboryhmä, N = 90; kaikki hoidetut potilaat, Simponi 50 mg -ryhmä, N = 88; potilaat, joilla oli objektiivisia tulehduslöydöksiä, plaseboryhmä, N = 71; potilaat, joilla oli objektiivisia tulehduslöydöksiä, Simponi 50 mg -ryhmä, N = 71)) c n kuvaa niiden potilaiden määrää, joista oli saatavilla tiedot magneettitutkimuksesta lähtötilanteessa ja viikolla 16 d SPARCC (Spondyloarthritis Research Consortium of Canada) ** p < 0,0001 Simponin ja plasebon vertailuille * p < 0,05 Simponin ja plasebon vertailuille | ||||
Vaikea-asteisen aktiivisen röntgennegatiivisen aksiaalisen spondylartriitin oireissa ja merkeissä osoitettiin viikolla 16 plaseboon verrattuna tilastollisesti merkitseviä parannuksia potilailla, jotka olivat saaneet Simponia 50 mg:n annoksella (taulukko 6). Parannuksia todettiin ensimmäisessä arvioinnissa (viikolla 4) Simponin ensimmäisen annoksen jälkeen. Magneettitutkimuksella mitatussa SPARCC-pistemäärässä todettiin viikolla 16 plaseboon verrattuna tilastollisesti merkitsevä risti-suoliluunivelen tulehduksen väheneminen potilailla, jotka olivat saaneet Simponia 50 mg:n annoksella (taulukko 6). Myös koko selän kipuna ja yöllisenä selkäkipuna kipujanalla (VAS) arvioidussa kivussa sekä ASDAS-C-pisteinä mitatussa taudin aktiivisuudessa osoitettiin viikolla 16 plaseboon verrattuna tilastollisesti merkitsevä parannus lähtötilanteesta potilailla, jotka olivat saaneet Simponia 50 mg:n annoksella (p < 0,0001).
Selkärangan liikkuvuudessa BASMI-indeksillä (Bath Ankylosing Spondylitis Metrology Index) arvioituna ja fyysisessä toimintakyvyssä BASFI-indeksillä arvioituna osoitettiin tilastollisesti merkitseviä parannuksia Simponia 50 mg:n annoksella saaneilla potilailla verrattuna plaseboa saaneisiin potilaisiin (p < 0,0001). ASQoL- ja EQ‑5D ‑mittarilla sekä SF-36-mittarin fyysisinä ja psyykkisinä komponentteina arvioitu terveyteen liittyvä elämänlaatu parani Simponia saaneilla potilailla merkitsevästi enemmän kuin plaseboa saaneilla. WPAI-kyselyllä mitattuna myös tuottavuus parani Simponia saaneilla merkitsevästi verrattuna plaseboa saaneisiin, kun sitä arvioitiin työkyvyn kokonaisheikentymisen vähenemisenä ja aktiivisuuden paranemisena.
Kaikkien edellä kuvattujen päätetapahtumien suhteen tilastollisesti merkitsevät tulokset osoitettiin viikolla 16 myös siinä potilasryhmässä, jolla oli objektiivisia tulehduslöydöksiä.
Sekä kaikkien hoidettujen potilaiden potilasryhmässä että niiden ryhmässä, joilla oli objektiivisia tulehduslöydöksiä, löydösten ja oireiden, selkärangan liikkuvuuden, fyysisen toimintakyvyn, elämänlaadun ja tuottavuuden paraneminen, joka havaittiin Simponia 50 mg:n annoksella saaneessa ryhmässä viikolla 16, jatkui edelleen potilailla, jotka pysyivät tutkimuksessa viikolle 52 asti.
GO-BACK
Golimumabihoidon jatkamisen (tavanomaisella tai harvennetulla antotiheydellä) tehoa ja turvallisuutta verrattuna hoidon lopettamiseen arvioitiin aikuisilla (18–45‑vuotiailla) potilailla, joilla oli aktiivinen röntgennegatiivinen aksiaalinen spondylartriitti ja joiden tauti oli pitkäkestoisessa remissiossa, kun avointa Simponi-hoitoa oli annettu kerran kuukaudessa 10 kuukauden ajan (GO-BACK). Tutkimukseen soveltuneet potilaat (jotka saavuttivat kliinisen vasteen kuukauteen 4 mennessä ja joiden tauti oli inaktiivinen [ASDAS-pisteet < 1,3] sekä kuukauden 7 että kuukauden 10 kohdalla), jotka siirtyivät kaksoissokkoutettuun hoidon lopettamisen vaiheeseen, satunnaistettiin jatkamaan kerran kuukaudessa annettavaa Simponi-hoitoa (täysiannoksinen hoito, N = 63) tai saamaan kahden kuukauden välein annettavaa Simponi-hoitoa (harvennettu hoito, N = 63) tai kerran kuukaudessa annettavaa plasebohoitoa (hoidon lopettaminen, N = 62) enintään noin 12 kuukauteen asti.
Ensisijainen tehoa koskeva päätetapahtuma oli niiden potilaiden osuus, joilla ei ilmennyt taudin aktiivisuuden pahenemisvaihetta. Potilaat, joilla ilmeni pahenemisvaihe eli joilla todettiin kahdessa peräkkäisessä ASDAS-arvioinnissa molemmissa joko absoluuttinen pistemäärä ≥ 2,1 tai hoidon lopettamisen jälkeen ≥ 1,1 pistettä suurempi pistemäärä kuin kuukauden 10 kohdalla (avoimen vaiheen lopussa), aloittivat uudelleen kerran kuukaudessa annettavan Simponi-hoidon avoimessa uusintahoitovaiheessa kliinisen vasteen selvittämiseksi.
Kliininen vaste hoidon kaksoissokkoutetun lopettamisen jälkeen
Niistä 188 potilaasta, joiden tauti oli inaktiivinen ja jotka saivat vähintään yhden annoksen kaksoissokkoutettua hoitoa, merkitsevästi (p < 0,001) suuremmalla osalla potilaista ei ilmennyt taudin pahenemisvaihetta, kun Simponi-hoitoa jatkettiin joko täysiannoksisena hoitona (84,1 %) tai harvennettuna hoitona (68,3 %), verrattuna hoidon lopettaneisiin potilaisiin (33,9 %) (taulukko 8).
Taulukko 8
Analyysi niiden osallistujien osuudesta, joilla ei ilmennyt pahenemisvaihettaa
Koko analyysijoukon populaatio (vaihe 2 – kaksoissokkoutettu)
Ero, %, vs. plasebo | ||||
Hoito | n/N | % | Arvio (95 %:n luottamusväli)b | p‑arvob |
Golimumabi ihon alle kerran kuukaudessa | 53/63 | 84,1 | 50,2 (34,1; 63,6) | < 0,001 |
Golimumabi ihon alle kahden kuukauden välein | 43/63 | 68,3 | 34,4 (17,0; 49,7) | < 0,001 |
Plasebo | 21/62 | 33,9 | ||
Koko analyysijoukkoon kuuluvat kaikki satunnaistetut osallistujat, joiden tauti muuttui inaktiiviseksi vaiheessa 1 ja jotka saivat vähintään yhden annoksen sokkoutettua tutkimushoitoa. a Määritelmä: kahdella peräkkäisellä käynnillä tehdyissä ASDAS-arvioinneissa molemmissa joko absoluuttinen pistemäärä ≥ 2,1 tai pistemäärä suurentunut hoidon lopettamisen jälkeen ≥ 1,1 pisteellä verrattuna kuukauden 10 (käynnin 23) tietoihin. b Tyypin I virheen todennäköisyyttä eri hoitovertailuissa (golimumabi ihon alle kerran kuukaudessa vs. plasebo ja golimumabi ihon alle kahden kuukauden välein vs. plasebo) korjattiin sekventiaalisella (step-down) testaamismenettelyllä. Johdettiin ositetulla Miettisen ja Nurmisen menetelmällä, jossa oli ositustekijänä CRP-arvo (> 6 mg/l tai ≤ 6 mg/l). Osallistujilla, jotka lopettivat vaiheen 2 ennenaikaisesti ja ennen ”pahenemisvaihetta”, katsotaan olleen ”pahenemisvaihe”. N = osallistujien kokonaismäärä; n = niiden osallistujien määrä, joilla ei ilmennyt pahenemisvaihetta. | ||||
Hoidon lopettaneen ryhmän ja kahden Simponi-hoitoryhmän väliset erot ajassa ensimmäiseen pahenemisvaiheeseen on esitetty kuvassa 1 (log rank -testin p < 0,0001 molempien vertailujen kohdalla). Plaseboryhmässä pahenemisvaiheet alkoivat noin 2 kuukauden kuluttua Simponi-hoidon lopettamisesta, ja suurin osa pahenemisvaiheista ilmeni 4 kuukauden aikana hoidon lopettamisen jälkeen (kuva 1).
Kuva 1: Kaplan–Meier-analyysi ajasta ensimmäiseen pahenemisvaiheeseen
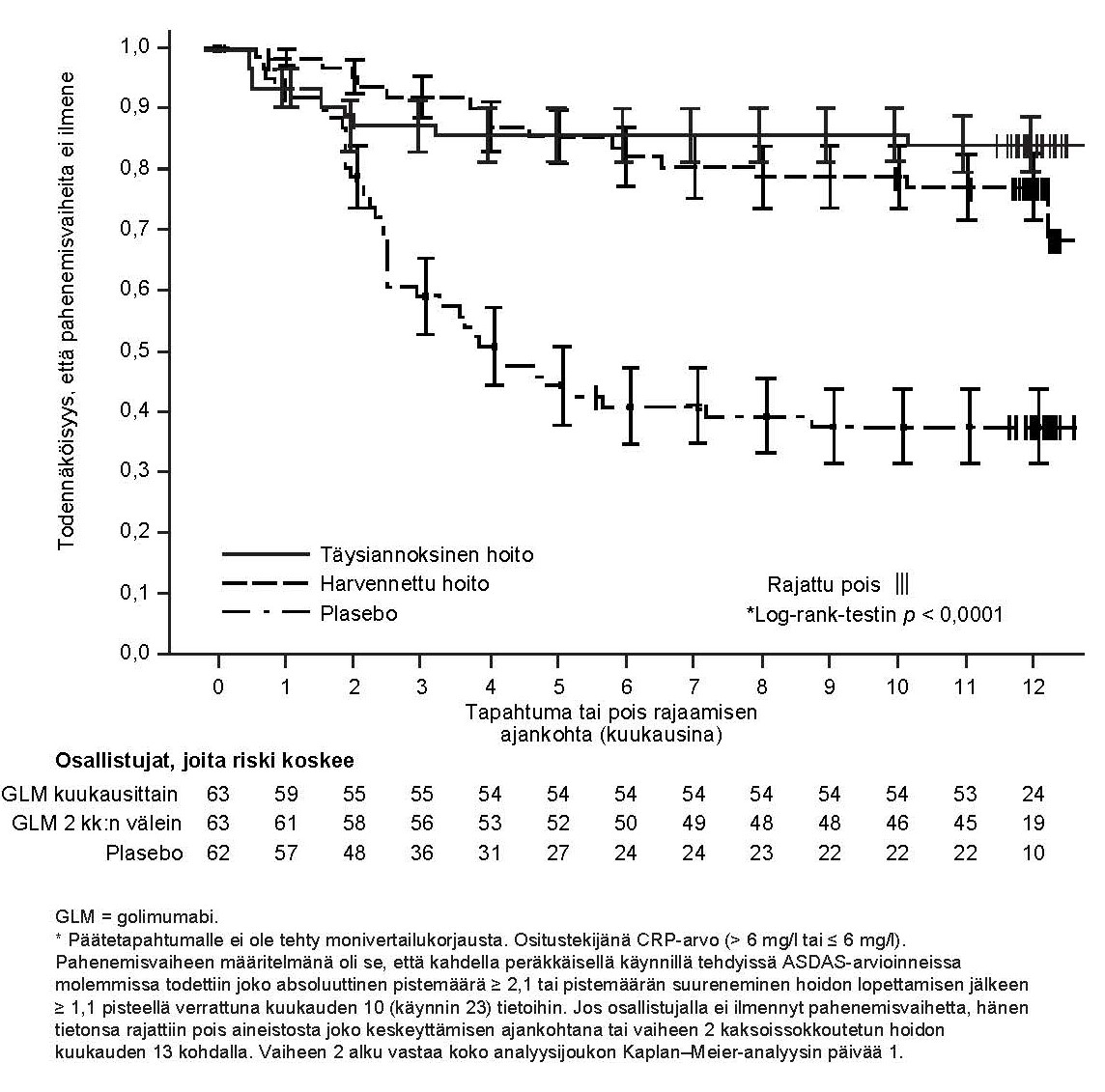
Kliininen vaste taudin pahenemisvaiheen vuoksi annettuun uusintahoitoon
Kliininen vaste määriteltiin BASDAI-pistearvon paranemiseksi ≥ 2 pistettä tai ≥ 50 % verrattuna taudin pahenemisvaiheeseen liittyneiden kahden peräkkäisen BASDAI-pistearvon keskiarvoon. Niistä 53 osallistujasta, jotka saivat harvennettua hoitoa tai joiden hoito lopetettiin ja joilla todettiin vahvistettu taudin pahenemisvaihe, 51 osallistujaa (96,2 %) saavutti kliinisen vasteen Simponi-hoidolle uusintahoidon ensimmäisten 3 kuukauden aikana, joskin vaste säilyi koko 3 kuukauden ajan pienemmällä osalla potilaista (71,7 %).
Aikuisiän haavainen koliitti
Simponin tehoa arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa, plasebokontrolloidussa kliinisessä tutkimuksessa aikuisten potilaiden hoidossa.
Induktiotutkimuksessa (PURSUIT‑Induction) oli mukana kohtalaista tai vaikeaa aktiivista haavaista koliittia (pisteet Mayo‑asteikolla 6–12, pisteet endoskopiaosiossa ≥ 2) sairastavia potilaita, joiden vaste tavanomaiseen hoitoon oli riittämätön tai jotka eivät sietäneet tavanomaisia hoitoja tai olivat riippuvaisia kortikosteroideista. Tutkimuksen annoksenmääritysosassa 761 potilasta jaettiin satunnaistetusti ryhmiin, jotka saivat joko 400 mg Simponia ihon alle viikolla 0 ja 200 mg viikolla 2 tai 200 mg Simponia ihon alle viikolla 0 ja 100 mg viikolla 2 tai plaseboa ihon alle viikoilla 0 ja 2. Oraalisten aminosalisylaattien, kortikosteroidien ja/tai immunomoduloivien lääkkeiden samanaikainen käyttö oli sallittua vakaina annoksina. Tässä tutkimuksessa arvioitiin Simponin tehoa viikolle 6 asti.
Ylläpitohoitotutkimuksen (PURSUIT‑Maintenance) tulokset perustuivat niiden 456 potilaan arviointiin, jotka saavuttivat kliinisen hoitovasteen aikaisemmalla Simponi‑induktiolla. Potilaat jaettiin satunnaistetusti ryhmiin, jotka saivat 50 mg Simponia, 100 mg Simponia tai plaseboa ihon alle 4 viikon välein. Oraalisten aminosalisylaattien ja/tai immunomoduloivien lääkkeiden samanaikainen käyttö oli sallittua vakaina annoksina. Kortikosteroideja oli tarkoitus vähentää asteittain ylläpitohoitotutkimuksen alkaessa. Tässä tutkimuksessa arvioitiin Simponin tehoa viikolle 54 asti. Potilaat, jotka olivat mukana ylläpitohoitotutkimuksen loppuun asti eli viikolle 54, jatkoivat hoitoa tutkimuksen jatkovaiheessa, jossa tehoa arvioitiin viikolle 216 asti. Tehon arviointi perustui tutkimuksen jatkovaiheessa muutoksiin kortikosteroidien käytössä, lääkärin yleisarvioon taudin aktiivisuudesta sekä elämänlaadun paranemiseen IBDQ-kyselyllä (inflammatory bowel disease questionnaire) mitattuna.
Taulukko 9
Tärkeimmät tehoa mittaavat tulokset PURSUIT‑Induction‑ ja PURSUIT‑Maintenance‑tutkimuksissa
PURSUIT‑Induction | |||
Plasebo N = 251 | Simponi 200/100 mg N = 253 | ||
Prosenttia (%) potilaista | |||
Potilaat, joilla todettiin kliininen hoitovaste viikolla 6a | 30 % | 51 %** | |
Potilaat, joilla todettiin kliininen remissio viikolla 6b | 6 % | 18 %** | |
Potilaat, joilla todettiin parantunut limakalvo viikolla 6c | 29 % | 42 %* | |
PURSUIT‑Maintenance | |||
Plasebod N = 154 | Simponi 50 mg N = 151 | Simponi 100 mg N = 151 | |
Prosenttia (%) potilaista | |||
Hoitovasteen säilyminen (potilaat, joilla kliininen vaste säilyi viikolle 54)e | 31 % | 47 %* | 50 %** |
Pitkäkestoinen remissio (potilaat, joilla todettiin kliininen remissio sekä viikolla 30 että viikolla 54)f | 16 % | 23 %g | 28 %* |
N = potilaiden lukumäärä ** p ≤ 0,001 * p ≤ 0,01 a Mayo‑asteikolla saatu pistearvo pienentynyt ≥ 30 % ja ≥ 3 pistettä lähtöarvosta sekä peräsuoliverenvuoto‑osion pistearvo pienentynyt ≥ 1 pistettä tai peräsuoliverenvuoto‑osion pistearvo 0 tai 1. b Pistearvo Mayo‑asteikolla ≤ 2 eikä minkään yksittäisen osion pistearvo ole > 1. c Mayo‑asteikon endoskopiaosion pistearvo 0 tai 1. d Pelkkä Simponi‑induktio. e Haavaisen koliitin aktiivisuus arvioitiin osittaisella Mayo‑asteikolla 4 viikon välein (hoitovasteen puuttuminen vahvistettiin endoskopian avulla). Potilaalla, jonka hoitovaste säilyi, oli siten jatkuva kliininen vaste jokaisessa arvioinnissa viikolle 54 asti. f Kestävän remission edellytyksenä oli, että tauti oli remissiossa sekä viikolla 30 että viikolla 54 (vasteen puuttumista ei saanut esiintyä minään ajankohtana viikolle 54 asti). g Alle 80 kg painavien potilaiden ryhmässä suuremmalla osalla 50 mg:n ylläpitoannosta saaneista potilaista todettiin pitkäkestoinen kliininen remissio plaseboa saaneisiin potilaisiin verrattuna. | |||
Limakalvon pitkäkestoinen paraneminen (potilaat, joilla todettiin parantunut limakalvo sekä viikolla 30 että viikolla 54) todettiin suuremmalla osalla potilaista Simponia 50 mg:n annoksina saaneessa ryhmässä (42 %, nimellinen p < 0,05) ja 100 mg:n annoksina saaneessa ryhmässä (42 %, p < 0,005) kuin plaseboryhmässä (27 %).
PURSUIT‑Maintenance‑tutkimuksen alkaessa 54 % potilaista sai samanaikaisesti kortikosteroideja (247/456). Tässä ryhmässä niiden potilaiden osuus, joiden kliininen vaste säilyi viikolle 54 asti ja jotka eivät käyttäneet kortikosteroideja viikolla 54, oli suurempi 50 mg:n annoksia saaneessa ryhmässä (38 %, 30/78) ja 100 mg:n annoksia saaneessa ryhmässä (30 %, 25/82) kuin plaseboryhmässä (21 %, 18/87). Niiden potilaiden osuus, jotka lopettivat kortikosteroidihoidon viikkoon 54 mennessä, oli suurempi 50 mg:n annoksia saaneessa ryhmässä (41 %, 32/78) ja 100 mg:n annoksia saaneessa ryhmässä (33 %, 27/82) kuin plaseboryhmässä (22 %, 19/87). Tutkimuksen jatkovaiheeseen siirtyneessä potilasryhmässä niiden potilaiden osuus, jotka eivät käyttäneet kortikosteroideja, pysyi pääosin samana viikolle 216 asti.
Potilaille, joilla ei ollut saavutettu kliinistä vastetta viikolla 6 PURSUIT-Induction-tutkimuksissa, annettiin Simponia 100 mg 4 viikon välein PURSUIT-Maintenance-tutkimuksessa. Viikolla 14 näistä potilaista 28 %:lla oli saavutettu vaste, joka määriteltiin osittaisella Mayo-asteikolla saadun pistearvon perusteella (pienentynyt ≥ 3 pistettä induktion alkuun verrattuna). Viikolla 54 näillä potilailla todetut kliiniset tulokset olivat samanlaisia kuin kliiniset tulokset, jotka ilmoitettiin potilailla, joilla oli saavutettu kliininen vaste viikolla 6.
Viikolla 6 Simponi oli parantanut elämänlaatua merkitsevästi, kun arviointiperusteena oli tautispesifisellä mittarilla, IBDQ‑kyselyllä (inflammatory bowel disease questionnaire), saatujen tulosten muutos lähtötasosta. Potilailla, jotka saivat Simponia ylläpitohoitona, IBDQ‑kyselyn tuloksiin perustuva elämänlaadun paraneminen säilyi viikolle 54 asti.
Noin 63 % potilaista, jotka saivat Simponia tutkimuksen jatkovaiheen alussa (viikolla 56), jatkoi hoitoa tutkimuksen loppuun asti (viimeinen golimumabiannos viikolla 212).
Pediatriset potilaat
Lapsuusiän idiopaattinen juveniili polyartriitti
Simponin turvallisuutta ja tehoa tutkittiin satunnaistetussa, kaksoissokkoutetussa, plasebokontrolloidussa hoidon lopettamista arvioineessa tutkimuksessa (GO-KIDS), johon osallistui 173 lasta (2–17-vuotiaita), joilla oli aktiivinen idiopaattinen juveniili polyartriitti ja vähintään 5 tulehtunutta niveltä eikä metotreksaatilla saatu riittävää vastetta. Tutkimukseen otettiin lapsia, joilla oli idiopaattinen juveniili polyartriitti (reumatekijäpositiivinen tai ‑negatiivinen polyartriitti, pitkittynyt oligoartriitti, juveniili nivelpsoriaasi tai systeeminen lastenreuma [JIA], mutta ei sillä hetkellä systeemisiä oireita). Tulehtuneiden nivelten määrän mediaani oli lähtötilanteessa 12 ja CRP-pitoisuuden mediaani 1,7 mg/l (0,17 mg/dl).
Tutkimuksen 1. osa koostui 16 viikon avoimesta vaiheesta, jossa tutkimukseen otetut 173 lasta saivat Simponia 30 mg/m2 (enintään 50 mg) ihon alle 4 viikon välein sekä metotreksaattia. 154 lasta, joilla oli saavutettu ACR Ped 30 ‑vaste viikolla 16, siirtyi tutkimuksen 2. osan satunnaistettuun hoidonlopettamisvaiheeseen, jossa he saivat Simponia 30 mg/m2 (enintään 50 mg) ja metotreksaattia tai plaseboa ja metotreksaattia 4 viikon välein. Taudin pahennuttua lapset saivat Simponia 30 mg/m2 (enintään 50 mg) ja metotreksaattia. Viikolla 48 lapset siirtyivät pitkäaikaiseen jatkotutkimukseen.
Tutkimukseen osallistuneilla lapsilla saavutettiin ACR Ped 30‑, 50‑, 70- ja 90‑vasteita viikosta 4 lähtien.
Viikolla 16 vasteet olivat: 87 %:lla lapsista ACR Ped 30, 79 %:lla lapsista ACR Ped 50, 66 %:lla lapsista ACR Ped 70 ja 36 %:lla lapsista ACR Ped 90. Viikolla 16 lapsista 34 %:lla sairaus oli inaktiivinen, jonka määritelmänä oli kaikkien seuraavien kriteerien täyttyminen: ei aktiivista niveltulehdusta; ei lastenreumasta johtuvaa kuumetta, ihottumaa, serosiittia, splenomegaliaa, hepatomegaliaa tai yleistynyttä lymfadenopatiaa; ei aktiivista uveiittia; normaali laskoarvo (< 20 mm/h) tai CRP-pitoisuus (< 10 mg/l [< 1,0 mg/dl]); lääkärin kokonaisarvio sairauden aktiivisuudesta (≤ 5 mm VAS-janalla); aamujäykkyyden kesto < 15 minuuttia.
Viikolla 16 kaikki ACR Ped ‑osatekijät osoittivat kliinisesti merkittävää paranemista lähtötilanteeseen verrattuna (ks. taulukko 10).
Taulukko 10
ACR Ped ‑osatekijöiden paraneminen lähtötilanteeseen verrattuna viikolla 16a
Paranemisprosentti, mediaani | |
Simponi 30 mg/m2 nb = 173 | |
Lääkärin kokonaisarvio sairaudesta (VASc 0–10 cm) | 88 % |
Tutkittavan/vanhemman kokonaisarvio yleisestä voinnista (VAS 0–10 cm) | 67 % |
Tulehtuneiden nivelten määrä | 92 % |
Sellaisten nivelten määrä, joiden liikkuvuus rajoittunut | 80 % |
Fyysinen toimintakyky CHAQd:n perusteella | 50 % |
Lasko (mm/h)e | 33 % |
a lähtötilanne = viikko 0 b ”n” tarkoittaa tutkimukseen otettujen potilaiden lukumäärää c VAS: Visual Analogue Scale (kipujana) d CHAQ: Child Health Assessment Questionnaire (kyselylomake) e Lasko (mm/h): millimetriä tunnissa | |
Ensisijaista päätetapahtumaa eli niiden lasten osuutta, jotka olivat saaneet ACR Ped 30 ‑vasteen viikolla 16 ja joille ei tullut sairauden pahenemisvaihetta viikkojen 16 ja 48 välillä, ei saavutettu. Suurimmalle osalle lapsista pahenemisvaihetta ei tullut viikkojen 16 ja 48 välillä (59 % Simponi ja metotreksaatti ‑ryhmässä ja 53 % plasebo ja metotreksaatti ‑ryhmässä, p = 0,41).
Ensisijaisen päätetapahtuman ennalta määrätyt alaryhmäanalyysit tehtiin lähtötilanteen CRP-pitoisuuden (≥ 10 mg/l vs. < 10 mg/l) mukaan. Näissä analyyseissä plasebo + metotreksaatti ‑hoitoa saaneilla havaittiin useammin taudin paheneminen verrattuna Simponi + metotreksaatti ‑hoitoa saaneisiin (87 % vs. 40 %, p = 0,0068) tutkittaviin, joilla CRP-pitoisuus oli lähtötilanteessa ≥ 10 mg/l.
48. viikolla 53 % Simponi + metotreksaatti ‑ryhmän ja 55 % plasebo + metotreksaatti ‑ryhmän lapsista oli saavuttanut ACR Ped 30 ‑vasteen ja 40 %:lla Simponi + metotreksaatti ‑ryhmän ja 28 %:lla plasebo + metotreksaatti ‑ryhmän lapsista sairaus oli inaktiivisessa tilassa.
Lapsuusiän haavainen koliitti
Simponin turvallisuutta ja tehoa tutkittiin faasi III:n avoimessa monikeskustutkimuksessa (PURSUIT 2), johon otettiin tutkimusasetelman mukaisesti 2–17-vuotiaita lapsia, joilla oli kohtalainen tai vaikea aktiivinen haavainen koliitti; määritelmän mukaan potilas sai lähtötilanteessa 6–12 pistettä täydellä Mayo-asteikolla ja ≥ 2 pistettä endoskopiaosiossa. Lapset, jotka olivat aiemmin altistuneet TNF‑α:n estäjille, eivät soveltuneet osallistumaan tutkimukseen. Suurin osa 69 tutkittavasta (97,1 %) sai parhaillaan haavaiseen koliittiin liittyvää lääkitystä (kortikosteroideja, immunomoduloivia lääkkeitä ja/tai 5‑aminosalisyylihappoa [5-ASA]); 52,2 % tutkittavista sai parhaillaan kortikosteroideja ja 88,4 % sai suun kautta 5‑aminosalisyylihappoa. Tutkittavien keskimääräinen ikä oli 13,4 vuotta (vaihteluväli 4–17). Tutkittavista 53,6 % (37) oli tyttöjä. Keskimääräinen paino oli 52,4 kg (vaihteluväli 16–107). Sairauden lähtötilanteen ominaisuudet koko golimumabipopulaatiossa vastasivat edustavasti sellaisia pediatrisia potilaita, joilla on kohtalainen tai vaikea aktiivinen haavainen koliitti.
Induktiovaiheessa (viikosta 0 viikkoon 6) lapset saivat painonmukaisen golimumabiannoksen ihon alle viikoilla 0 ja 2. Lapset, joiden paino oli ≥ 45 kg, saivat vakiosuuruisen induktioannoksen 200 mg ihon alle viikolla 0 ja 100 mg viikolla 2. Lapset, joiden paino oli < 45 kg, saivat kehon pinta-alan mukaan säädetyn induktioannoksen 120 mg/m2 ihon alle (enintään 200 mg) viikolla 0 ja 60 mg/m2 ihon alle (enintään 100 mg) viikolla 2. Teho ja turvallisuus lapsilla arvioitiin viikolla 6.
Ylläpitovaiheessa (viikosta 6 viikkoon 54) kliinisen vasteen golimumabiin saaneet lapset (täyden Mayo-asteikon pistemäärä pienentynyt lähtöarvosta ≥ 30 % ja ≥ 3 pistettä ja lisäksi joko peräsuoliverenvuoto‑osion pistearvo pienentynyt lähtöarvosta ≥ 1 pisteen tai peräsuoliverenvuoto‑osion pistearvo 0 tai 1; endoskopiaosion pistemäärä arvioitiin paikallisesti) saivat edelleen 100 mg (≥ 45 kg painavat lapset) tai 60 mg/m2 (< 45 kg painavat lapset) golimumabia ihon alle 4 viikon välein viikkoon 50 saakka. Lapsille, joilla ei ollut kliinistä vastetta viikolla 6, voitiin antaa lisäannos viikolla 6 ja viikolla 10, minkä jälkeen vaste arvioitiin viikolla 14 päätöksen tekemiseksi siitä, jatkaako lapsi 4 viikon välein annettavaa golimumabihoitoa viikkoon 50 saakka. Niistä 41 lapsesta, jotka jatkoivat ylläpitovaiheeseen, 39 oli tutkimuksessa mukana viikolla 54 (teho määritettiin täyden Mayo-asteikon pistemäärän avulla).
Ensisijaisen päätetapahtuman eli Mayo-pistemäärällä mitatun kliinisen remission määritelmänä oli Mayo-asteikon pistemäärä ≤ 2 eikä minkään yksittäisen osion pistearvo > 1 (kun paikallisesti tehdyn tähystystutkimuksen tekijä määritti Mayo-asteikon endoskopiaosion pisteet). Lapsista kaikkiaan 22:lla (31,9 %) todettiin kliininen remissio viikolla 6. Viikon 54 kohdalla 31,7 % tutkittavista, joilla oli viikolla 6 kliininen vaste, oli kliinisesti remissiossa.
Taulukko 11
Tärkeimmät tehoa mittaavat tulokset PURSUIT 2 – Induction- ja PURSUIT 2 – Maintenance ‑tutkimuksissa
PURSUIT 2 - Induction | ||
Ensisijainen päätetapahtuma | Simponi N = 69 | |
Tutkittavat, joilla todettiin Mayo-pisteillä arvioituna kliininen remissio viikolla 6a | 22 (31,9 %) | |
Merkittävät toissijaiset päätetapahtumat | ||
Tutkittavat, joilla todettiin kliininen hoitovaste viikolla 6b | 39 (56,5 %) | |
Tutkittavat, joilla todettiin endoskopiassa paranemista viikolla 6c | 28 (40,6 %) | |
PURSUIT 2 – Maintenance | ||
Merkittävät toissijaiset päätetapahtumat | Simponi N = 41 | |
Tutkittavat, joilla todettiin Mayo-pisteillä arvioituna kliininen remissio viikolla 54a,e | 13 (31,7 %) | |
Tutkittavat, joilla todettiin endoskopiassa paranemista viikolla 54c | 15 (36,6 %) | |
Tutkittavat, joilla todettiin Mayo-pisteillä arvioituna kliininen remissio viikolla 54, niistä tutkittavista, joilla oli kliininen remissio viikolla 6a,d,e | 12 (54,5 %) | |
N = potilaiden lukumäärä a Kliinisen remission määritelmänä oli pistearvo ≤ 2 Mayo-asteikolla eikä minkään yksittäisen osion pistearvo > 1. b Kliinisen vasteen määritelmänä oli Mayo-asteikolla saadun pistearvon pieneneminen ≥ 30 % ja ≥ 3 pistettä lähtöarvosta sekä joko peräsuoliverenvuoto‑osion pistearvon pieneneminen ≥ 1 lähtöarvosta tai peräsuoliverenvuoto‑osion pistearvo 0 tai 1. c Endoskopiassa todetuksi paranemiseksi määriteltiin endoskopiaosion pistearvo 0 tai 1 paikallisesti tehdyn endoskopian perusteella. d Nimittäjänä tutkittavat, joilla oli kliininen remissio viikolla 6. e Tutkittavilla, joiden endoskopiapisteet puuttuivat viikolla 54, ei katsottu olevan kliinistä remissiota. | ||
Immunogeenisuus
Golimumabin vasta‑aineita todettiin entsyymi-immunologisella menetelmällä (EIA) kaikissa faasi III:n nivelreuma‑, nivelpsoriaasi‑ ja selkärankareumatutkimuksissa 52 viikon aikana 5 prosentilla (105 / 2 062) golimumabia saaneista potilaista, ja testatuista lähes kaikki vasta‑aineet olivat neutraloivia in vitro. Vastaavia lukuja on saatu kaikissa reumatologisissa käyttöaiheissa. Golimumabin vasta‑aineita todettiin pienemmällä osalla niistä potilaista, jotka saivat samanaikaisesti metotreksaattia (noin 3 % [41 / 1 235]), kuin potilaista, jotka saivat golimumabia ilman metotreksaattia (8 % [64/827]).
Röntgennegatiivisen aksiaalisen spondylartriitin yhteydessä golimumabin vasta-aineita todettiin EIA-menetelmällä 7 %:lla (14/193) golimumabia saaneista potilaista viikkoon 52 mennessä.
Golimumabin vasta-aineita todettiin EIA-menetelmällä haavaisen koliitin faasi II:n ja III:n tutkimuksissa 54 viikon aikana 3 prosentilla (26/946) golimumabia saaneista potilaista. Vasta-ainepositiivisista potilaista 68 prosentilla (21/31) oli neutraloivia vasta-aineita in vitro. Golimumabin vasta-aineita todettiin pienemmällä osalla niistä potilaista, jotka saivat samanaikaisesti immunomoduloivia lääkkeitä (atsatiopriinia, 6-merkaptopuriinia tai metotreksaattia) (1 % [4/308]), kuin potilaista, jotka saivat golimumabia ilman immunomoduloivia lääkkeitä (3 % [22/638]). Tutkimuksen jatkovaiheeseen siirtyneistä potilaista, joilta saatiin arvioitavissa olevat näytteet viikolle 228 asti, golimumabin vasta-aineita todettiin 4 prosentilla (23/604) golimumabia saaneista potilaista. Vasta-ainepositiivisista potilaista 82 prosentilla (18/22) oli neutraloivia vasta-aineita in vitro.
Idiopaattisen juveniilin polyartriitin tutkimuksessa käytettiin lääketoleranttia (drug-tolerant) EIA-menetelmää golimumabin vasta-aineiden havaitsemiseen. Suuremman herkkyyden ja paremman lääketoleranssin vuoksi oli odotettavissa, että golimumabin vasta-aineita löytyisi enemmän lääketolerantilla EIA-menetelmällä kuin EIA-menetelmällä. Faasi III:n idiopaattisen juveniilin polyartriitin tutkimuksessa golimumabin vasta-aineita löytyi viikkoon 48 mennessä lääketolerantilla EIA-menetelmällä 40 %:lta (69/172) golimumabia saaneista lapsista, ja heistä suurimmalla osalla titteri oli alle 1:1 000. Vaikutus seerumin golimumabipitoisuuteen näkyi > 1:100 ‑tittereissä, kun taas vaikutus tehoon havaittiin vasta > 1:1 000 ‑tittereissä. Niiden lasten määrä, joilla titteri oli > 1:1 000, oli kuitenkin alhainen (N = 8). Neutraloivia vasta-aineita oli 39 %:lla (25/65) niistä lapsista, joille kehittyi golimumabin vasta-aineita. Lääketolerantilla EIA-menetelmällä todetulla vasta-aineiden suuremmalla esiintymistiheydellä ei ollut selvästi havaittavaa vaikutusta lääkepitoisuuksiin, tehoon ja turvallisuuteen, koska vasta-ainetitterit olivat enimmäkseen matalia, eikä uusia turvallisuuteen liittyviä signaaleja täten ilmennyt.
Golimumabin vasta‑aineiden ilmaantuminen saattaa lisätä pistoskohdan reaktioiden riskiä (ks. kohta Haittavaikutukset). Potilaita, joille kehittyi golimumabin vasta‑aineita, oli liian vähän, jotta voitaisiin tehdä varmoja johtopäätöksiä golimumabivasta‑aineiden yhteydestä kliinisen tehon tai turvallisuuden mittareihin.
Koska immunogeenisuustutkimukset ovat valmiste‑ ja analyysispesifisiä, vasta‑aineiden esiintymistä ei voida verrata muiden valmisteiden vastaaviin lukuihin.
Lapsuusiän haavaista koliittia koskeneessa faasi III:n tutkimuksessa 22 %:lla (15/69) Simponi-hoitoa saaneista potilaista todettiin lääketolerantilla EIA-menetelmällä golimumabin vasta-aineita turvallisuutta koskevaan loppukäyntiin mennessä. Suurimmalla osalla potilaista, joilla vasta-aineita oli, titterit olivat matalia. Golimumabin vasta-aineiden ilmaantuvuudet olivat vastaavanlaiset lapsuusiän ja aikuisiän haavaista koliittia sairastavilla potilailla. Niillä haavaista koliittia sairastavilla potilailla, joille golimumabin vasta-aineita kehittyi, vakaan tilan aikaiset pienimmät golimumabipitoisuudet (trough) seerumissa olivat yleensä pienemmät.
Farmakokinetiikka
Imeytyminen
Terveille tutkittaville tai nivelreumapotilaille annetun ihonalaisen golimumabikerta‑annoksen jälkeen golimumabin maksimipitoisuus seerumissa saavutettiin 2–6 vuorokauden (mediaani) kuluttua (tmax). Terveille tutkittaville ihonalaisena injektiona annetun 50 mg:n golimumabiannoksen jälkeen seerumista todetun maksimipitoisuuden (Cmax) keskiarvo ± keskihajonta oli 3,1 ± 1,4 μg/ml.
Golimumabi imeytyi samalla tavoin olkavarren, vatsan ja reiden ihon alle annetun 100 mg:n kerta‑annoksen jälkeen, ja absoluuttisen hyötyosuuden keskiarvo oli 51 %. Koska ihon alle annetun golimumabin farmakokinetiikka oli suunnilleen suhteessa annokseen, 50 mg:n tai 200 mg:n golimumabiannoksen absoluuttisen hyötyosuuden oletetaan olevan samanlainen.
Jakautuminen
Laskimoon annetun kerta‑annoksen jälkeen jakautumistilavuuden keskiarvo oli 115 ± 19 ml/kg.
Eliminaatio
Golimumabin systeemisen puhdistuman arvioitiin olevan 6,9 ± 2,0 ml/vrk/kg. Terminaalisen puoliintumisajan arvioitiin olevan noin 12 ± 3 vuorokautta terveillä tutkittavilla, ja vastaavia arvoja saatiin nivelreumaa, nivelpsoriaasia, selkärankareumaa tai haavaista koliittia sairastavilla potilailla.
Vakaan tilan pitoisuus seerumissa saavutettiin viikkoon 12 mennessä, kun nivelreumaa, nivelpsoriaasia tai selkärankareumaa sairastaville potilaille annettiin golimumabia 50 mg:n annoksina ihon alle 4 viikon välein. Kun golimumabia annettiin 50 mg:n annoksina ihon alle 4 viikon välein samanaikaisesti metotreksaatin kanssa, pienimpien vakaan tilan aikaisten golimumabipitoisuuksien (trough) keskiarvo (± keskihajonta) seerumissa oli noin 0,6 ± 0,4 μg/ml nivelreumapotilailla, joiden nivelreuma oli aktiivinen metotreksaattihoidosta huolimatta, noin 0,5 ± 0,4 μg/ml aktiivista nivelpsoriaasia sairastavilla potilailla ja noin 0,8 ± 0,4 μg/ml selkärankareumapotilailla. Pienimpien vakaan tilan aikaisten golimumabipitoisuuksien (trough) keskiarvot seerumissa olivat röntgennegatiivista aksiaalista spondylartriittia sairastavilla potilailla samansuuruisia kuin selkärankareumapotilailla, kun golimumabia annettiin 50 mg ihon alle 4 viikon välein.
Nivelreuma‑, nivelpsoriaasi‑ tai selkärankareumapotilailla, jotka eivät saaneet samanaikaisesti metotreksaattia, vakaan tilan aikaiset pienimmät golimumabipitoisuudet (trough) olivat noin 30 % pienempiä kuin potilailla, jotka saivat golimumabia samanaikaisesti metotreksaatin kanssa. Suppealla määrällä nivelreumapotilaita, jotka saivat golimumabia ihon alle yli 6 kuukauden ajan, samanaikainen metotreksaattihoito pienensi golimumabin näennäistä puhdistumaa noin 36 %. Populaatiofarmakokineettinen analyysi osoitti kuitenkin, että tulehduskipulääkkeiden (NSAID), suun kautta otettavien kortikosteroidien tai sulfasalatsiinin samanaikainen käyttö ei vaikuttanut golimumabin näennäiseen puhdistumaan.
Kun haavaista koliittia sairastaville potilaille annettiin golimumabia induktioannoksina 200 mg viikolla 0 ja 100 mg viikolla 2 ja sen jälkeen ylläpitoannoksina 50 mg tai 100 mg ihon alle 4 viikon välein, vakaan tilan golimumabipitoisuus seerumissa saavutettiin noin 14 viikon kuluttua hoidon alkamisesta. Kun golimumabia annettiin ylläpitovaiheessa 50 mg:n tai 100 mg:n annoksina ihon alle 4 viikon välein, vakaan tilan aikaisten pienimpien golimumabipitoisuuksien (trough) keskiarvo seerumissa oli 50 mg:n annoksia saaneilla potilailla noin 0,9 ± 0,5 μg/ml ja 100 mg:n annoksia saaneilla noin 1,8 ± 1,1 μg/ml.
Immunomoduloivien lääkkeiden samanaikainen käyttö ei vaikuttanut oleellisesti vakaan tilan aikaisiin pienimpiin golimumabipitoisuuksiin haavaista koliittia sairastavilla potilailla, jotka saivat golimumabia 50 mg tai 100 mg ihon alle 4 viikon välein.
Potilailla, joille kehittyi vasta‑aineita golimumabille, vakaan tilan aikaiset pienimmät golimumabipitoisuudet (trough) olivat yleensä pieniä (ks. kohta Farmakodynamiikka).
Lineaarisuus
Kerta‑annoksena laskimoon annetun golimumabin farmakokinetiikka oli nivelreumapotilailla suunnilleen suhteessa annokseen annosalueella 0,1–10,0 mg/kg. Myös terveille tutkittaville annetun ihonalaisen kerta‑annoksen jälkeen farmakokinetiikka oli suunnilleen suhteessa annokseen annosalueella 50–400 mg.
Painon vaikutus farmakokinetiikkaan
Golimumabin näennäinen puhdistuma näytti olevan sitä suurempi, mitä suurempi oli potilaan paino (ks. kohta Annostus ja antotapa).
Pediatriset potilaat
Idiopaattinen juveniili polyartriitti
Golimumabin farmakokinetiikka määritettiin 173:lla 2–17-vuotiaalla idiopaattista juveniilia polyartriittia sairastavalla lapsella. pJIA-tutkimuksessa niillä lapsilla, jotka saivat golimumabia 30 mg/m2 (enintään 50 mg) ihon alle 4 viikon välein, vakaan tilan pienimpien golimumabipitoisuuksien mediaanit olivat samalla tasolla eri ikäryhmissä ja lisäksi samalla tasolla tai hieman korkeampia kuin aikuisilla reumapotilailla, jotka olivat saaneet 50 mg golimumabia 4 viikon välein.
Populaatiofarmakokineettinen/farmakodynaaminen mallinnus ja simulointi pJIA-lapsilla vahvistivat seerumin lääkepitoisuuden perusteella todetun golimumabialtistuksen ja kliinisen tehon välisen yhteyden ja puoltavat sitä, että 50 mg:n golimumabiannos 4 viikon välein vähintään 40 kg painaville pJIA-lapsille saa aikaan altistuksen, joka on samanlainen kuin on aikuisilla osoitettu tehokkaaksi.
Haavainen koliitti
Golimumabin farmakokinetiikka oli samankaltainen sekä pediatrisilla että aikuisilla potilailla, joilla oli haavainen koliitti. Populaatiofarmakokinetiikka vahvisti, että Simponi-hoito suositellulla annostuksella johti pediatrisilla tutkittavilla kaikissa painoluokissa yhtä suuriin tai hieman suurempiin seerumin golimumabialtistuksiin kuin aikuisilla.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta sekä lisääntymis‑ ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Golimumabilla ei ole tehty mutageenisuustutkimuksia, hedelmällisyystutkimuksia eläimillä eikä pitkäaikaisia karsinogeenisuustutkimuksia.
Hiirien hedelmällisyyttä ja yleisiä lisääntymistoimintoja kartoittavassa tutkimuksessa tiineiden hiirien määrä pieneni, kun käytettiin analogista vasta‑ainetta, joka estää selektiivisesti hiiren TNF‑α:n toiminnallista aktiivisuutta. Ei tiedetä, johtuiko tämä löydös uros‑ vai naarashiiriin vai molempiin kohdistuneista vaikutuksista. Kehitystoksisuutta selvittävässä tutkimuksessa annettiin hiirille samaa analogista vasta‑ainetta ja cynomolgus‑apinoille golimumabia. Tutkimuksessa ei havaittu viitteitä emoon tai alkioon kohdistuvista toksisista vaikutuksista eikä teratogeenisuudesta.
Farmaseuttiset tiedot
Apuaineet
Sorbitoli (E420)
Histidiini
Histidiinihydrokloridimonohydraatti
Polysorbaatti 80 (E433)
Injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Pidä esitäytetty ruisku ulkopakkauksessa. Herkkä valolle.
Simponia voidaan säilyttää korkeintaan 25 °C:n lämpötilassa yksittäisen korkeintaan 30 vuorokauden pituisen ajanjakson ajan. Säilytysaika ei saa ylittää alkuperäistä koteloon painettua viimeistä käyttöpäivämäärää. Uusi viimeinen käyttöpäivämäärä on merkittävä koteloon (korkeintaan 30 vuorokautta päivästä, jolloin tuote on otettu pois jääkaapista).
Huoneenlämmössä säilytettyä Simponia ei saa palauttaa takaisin jääkaappisäilytykseen. Simponi on hävitettävä, jos sitä ei ole käytetty 30 vuorokauden huoneenlämpösäilytyksen aikana.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SIMPONI injektioneste, liuos, esitäytetty ruisku
50 mg (L:ei) 1 kpl (0,5 ml) (925,75 €)
PF-selosteen tieto
Simponi 50 mg injektioneste, liuos, esitäytetty ruisku
0,5 ml liuosta esitäytetyssä ruiskussa (tyypin I lasia), jossa on kiinteä neula (ruostumatonta terästä) sekä neulan suojus (lateksia sisältävää kumia). Simponi on saatavana 1 esitäytetyn ruiskun sisältävänä pakkauksena sekä kerrannaispakkauksena, jossa on 3 esitäytettyä ruiskua (3 yhden ruiskun sisältävää pakkausta).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkas tai hieman opaalinhohtoinen, väritön tai vaaleankeltainen.
Käyttö- ja käsittelyohjeet
Simponi on saatavana kertakäyttöön tarkoitetussa esitäytetyssä ruiskussa. Jokaisessa pakkauksessa on käyttöohjeet, joissa kerrotaan yksityiskohtaisesti ruiskun käytöstä. Kun esitäytetty ruisku on otettu jääkaapista, odotetaan 30 minuuttia, jotta se lämpenee huoneenlämpöiseksi ennen Simponin pistämistä. Ruiskua ei saa ravistaa.
Liuos on kirkas tai hieman opaalinhohtoinen, väritön tai vaaleankeltainen, ja se saattaa sisältää muutamia pieniä, läpikuultavia tai valkoisia proteiinihiukkasia. Tämä ei ole harvinaista liuoksille, jotka sisältävät proteiinia. Simponia ei pidä käyttää, jos liuos on värjäytynyttä tai sameaa tai sisältää silmin nähtäviä vierashiukkasia.
Pakkausselosteessa annetaan yksityiskohtaiset ohjeet Simponin esitäytetyn ruiskun valmistelusta ja pistoksen ottamisesta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SIMPONI injektioneste, liuos, esitäytetty ruisku
50 mg 1 kpl
- Alempi erityiskorvaus (65 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli ja tosilitsumabi (tulehdukselliset reumasairaudet): Nivelreuman, juveniilin polyartriitin, psoriaasiin liittyvän niveltulehduksen, selkärankareuman tai edellä mainittuja niveltulehduksia läheisesti muistuttavan niveltulehduksen hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman hoito erityisin edellytyksin (281).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli, tosilitsumabi ja ustekinumabi (tulehdukselliset reumasairaudet): Eräiden reumasairauksien hoito erityisin edellytyksin / Adalimumabi: Uveiitin hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman ja jättisoluarteriitin hoito erityisin edellytyksin (313), Adalimumabi, golimumabi, infliksimabi, risankitsumabi, ustekinumabi ja vedolitsumabi (tulehdukselliset suolistosairaudet): Eräiden suolistosairauksien hoito erityisin edellytyksin (326).
ATC-koodi
L04AB06
Valmisteyhteenvedon muuttamispäivämäärä
19.01.2026
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
