IXCHIQ pulver och vätska till injektionsvätska, lösning
Observera

Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Kvalitativ och kvantitativ sammansättning
Efter beredning innehåller en dos (0,5 ml):
Chikungunyavirus (CHIKV) Δ5nsP3-stam (levande, försvagad)* inte mindre än 3.0 log10 TCID50**
*Producerade i Vero-celler
**50 % infektiös dos i vävnadskultur
Denna produkt innehåller genetiskt modifierade organismer (GMO).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och vätska till injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
IXCHIQ är indicerat för aktiv immunisering för att förebygga sjukdomar orsakade av chikungunyavirus (CHIKV) hos individer som är 12 år och äldre.
Användning av detta vaccin ska ske i enlighet med officiella rekommendationer.
Dosering och administreringssätt
Dosering
Personer från 12 års ålder
IXCHIQ administreras som en engångsdos på 0,5 ml.
Revaccination (påfyllnadsvaccinering)
Behovet av revaccination har inte fastställts.
Pediatrisk population under 12 års ålder
Säkerheten och immunogeniciteten för IXCHIQ hos barn under 12 års ålder har inte fastställts. Inga data finns tillgängliga för barn under 12 års ålder.
Administreringssätt
Endast för intramuskulär injektion, efter beredning.
IXCHIQ ska administreras intramuskulärt i deltamuskeln inom 2 timmar efter beredning.
Vaccinet ska inte blandas i samma spruta som något annat vaccin eller läkemedel.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Immunbrist eller immunsupprimerade individer på grund av sjukdom eller medicinsk terapi (t.ex. från maligniteter, behandling med kemoterapi, immunsuppressiv terapi, medfödd immunbrist, hiv-infektion med allvarligt nedsatt immunförsvar).
Varningar och försiktighet
IXCHIQ ska endast ges när det finns en betydande risk för att förvärva chikungunyainfektion och efter noggrant övervägande av de potentiella riskerna och fördelarna (se avsnitt Kontraindikationer och nedan).
Allvarliga biverkningar har rapporterats vid användning av IXCHIQ, särskilt hos personer som är 65 år och äldre och hos personer med flera underliggande kroniska och/eller okontrollerade medicinska tillstånd (se avsnitt Biverkningar). Allvarlig reaktogenicitet eller chikungunyaliknande biverkningar kan leda till försämring av allmäntillståndet, inklusive sjukdomskänsla och minskad aptit, förvärring av redan befintliga sjukdomar, förvirringstillstånd, encefalopati eller encefalit, vilket kan leda till fall, sjukhusvistelse och dödsfall. Vaccinerade ska instrueras att omedelbart söka läkarvård om de efter vaccinationen upplever symtom som tyder på allvarlig reaktogenicitet eller allvarliga chikungunyaliknande biverkningar.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Överkänslighet och anafylaxi
Lämplig medicinsk behandling och övervakning ska alltid finnas lättillgänglig i händelse av en anafylaktisk incident efter administrering av vaccinet. Efter vaccinering rekommenderas noggrann observation under minst 15 minuter.
Ångestrelaterade reaktioner
Ångestrelaterade reaktioner, inklusive vasovagala reaktioner (synkope), hyperventilation eller stressrelaterade reaktioner kan förekomma i samband med vaccination som en psykogen respons på nålinjektionen. Det är viktigt att försiktighetsåtgärder vidtas för att undvika skador från svimning.
Samtidig sjukdom
Vaccinationen ska skjutas upp för personer som lider av akut svår febersjukdom eller akut infektion. Förekomst av en mindre infektion och/eller låggradig feber bör inte försena vaccinationen.
Trombocytopeni och koagulationsrubbningar
Vaccinet ska ges med försiktighet till personer som får antikoagulantia eller som har trombocytopeni eller någon koagulationsrubbning (såsom hemofili) eftersom blödning eller blåmärken kan uppstå efter intramuskulär injektion till dessa personer.
Begränsningar av vaccinets effektivitet
Förmågan hos IXCHIQ att förebygga sjukdom orsakad av chikungunyavirus baserades på en serologisk surrogatslutpunkt (se avsnitt Farmakodynamiska egenskaper). Som med alla vacciner kan det hända att ett skyddande immunsvar inte framkallas efter vaccination hos alla personer. Det rekommenderas att fortsätta vidta personliga skyddsåtgärder mot myggbett efter vaccination.
Graviditet
Ett beslut att administrera IXCHIQ under graviditet bör ta hänsyn till individens risk för CHIKV-infektion av vildtyp, gestationsålder och risk för vertikal överföring av CHIKV av vildtyp till fostret eller det nyfödda barnet (se avsnitt Fertilitet, graviditet och amning).
Blodgivning
Vaccinviremi upptäcktes hos 90 % av försökspersonerna 3 dagar efter vaccination. 7 dagar efter administrering av IXCHIQ minskade andelen vaccinerade med påvisbart virus till 17 % och ingen vaccinviremi upptäcktes 15 dagar efter vaccination. Se avsnitt Fertilitet, graviditet och amning och Biverkningar.
Individer som får IXCHIQ ska inte ge blod under minst 4 veckor efter vaccination.
Chikungunyaliknande biverkningar
IXCHIQ kan orsaka svåra eller långvariga chikungunyaliknande biverkningar (se avsnitt Biverkningar).
Encefalit
Encefalit (inklusive med dödlig utgång) har rapporterats efter godkännande för försäljning vid användning av IXCHIQ (se avsnitt Biverkningar).
Natrium
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos, det vill säga är nästan ”natriumfritt”.
Kalium
Detta läkemedel innehåller kalium, mindre än 1 mmol (39 mg) per dos, det vill säga är nästan ”kaliumfritt”.
Detta läkemedel innehåller 25 mg sorbitol per dos om 0,5 ml, vilket motsvarar 0,036 mg sorbitol/kg/0,5 ml. Tilläggseffekten av samtidigt administrerade produkter som innehåller sorbitol (eller fruktos) och intag av sorbitol (eller fruktos) via kosten bör beaktas.
Interaktioner
Samtidig administrering med andra vacciner
Det rekommenderas inte att administrera IXCHIQ samtidigt med andra vacciner, eftersom det inte finns några data om säkerhet och immunogenicitet efter samtidig administrering av IXCHIQ med andra vacciner.
Administrering av immunglobuliner eller blod- eller plasmatransfusioner 3 månader före eller upp till 1 månad efter administrering av IXCHIQ kan störa den förväntade immunresponsen.
Fertilitet, graviditet och amning
Graviditet
Djurstudier gav inga indikationer varken på direkta eller indirekta skadliga effekter med avseende på reproduktionstoxicitet (se avsnitt Prekliniska säkerhetsuppgifter).
Det finns begränsade mängder data från användning av IXCHIQ hos gravida kvinnor. Dessa data är inte tillräckliga för att dra slutsatser om frånvaron av potentiella effekter av IXCHIQ på graviditet, embryo-fosterutveckling, förlossning och postnatal utveckling.
Vertikal överföring av CHIKV av vildtyp från gravida individer med viremi vid förlossningen är vanligt och kan orsaka potentiellt dödlig CHIKV-sjukdom hos nyfödda. Vaccinviremi inträffar under den första veckan efter administrering av IXCHIQ, och upphör 14 dagar efter vaccination. Det är inte känt om vaccinviruset kan överföras vertikalt och orsaka biverkningar på fostret eller neonatala biverkningar.
Beslut att administrera IXCHIQ under graviditet bör ta hänsyn till individens risk att exponeras för CHIKV av vildtyp, gestationsålder och risk för vertikal överföring av CHIKV av vildtyp till fostret eller det nyfödda barnet.
Amning
Det är okänt om IXCHIQ utsöndras i modersmjölk. Det går inte att utesluta en risk för det ammade barnet. Utvecklings- och hälsofördelarna med amning bör beaktas, tillsammans med moderns kliniska behov av IXCHIQ och eventuella biverkningar på det ammade barnet orsakade av IXCHIQ.
Djurstudier gav inga indikationer varken på direkta eller indirekta skadliga effekter med avseende på amning (se avsnitt Prekliniska säkerhetsuppgifter).
Fertilitet
Inga specifika studier har utförts på fertilitet.
Djurstudier gav inga indikationer på skadliga effekter med avseende på kvinnlig fertilitet (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
IXCHIQ har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Vissa av de effekter som nämns i avsnitt Biverkningar kan dock tillfälligt påverka förmågan att framföra fordon eller använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Vuxna ≥ 18 år
Den övergripande säkerheten för IXCHIQ baseras på en analys av sammanslagna säkerhetsdata från tre avslutade kliniska fas I- och fas III-studier utförda i USA på 3 610 deltagare ≥ 18 år gamla, som fick en dos av IXCHIQ med en uppföljning på 6 månader .
De vanligaste reaktionerna på vaccinationsstället var ömhet (10,8 %) och smärta (6,1 %). De vanligaste systemiska biverkningarna var huvudvärk (32 %), trötthet (29,4 %), myalgi (23,7 %), artralgi (16,6 %), feber (13,8 %) och illamående (11,4 %).
Efter godkännande för försäljning har allvarliga biverkningar rapporterats, särskilt hos män som är 65 år och äldre med underliggande kroniska sjukdomstillstånd såsom hjärt-kärlsjukdom, diabetes mellitus eller kronisk njursjukdom. Dessa biverkningar inkluderade neurologiska händelser såsom dödlig encefalit, försämring av allmäntillståndet och försämring av kroniska sjukdomstillstånd (se avsnitt Varningar och försiktighet).
Ungdomar 12 till <18 år
Säkerhet hos ungdomar i 12 till <18 års ålder utvärderades hos 502 deltagare i Brasilien som fick en dos IXCHIQ med en uppföljning på 6 månader. 18,7 % av deltagarna hade redan befintliga antikroppar mot chikungunyavirus (94 ungdomar).
De vanligaste reaktionerna på vaccinationsstället hos ungdomar i 12 till <18 års ålder var ömhet (19,9 %) och smärta (19,3 %). De vanligaste systemiska biverkningarna var huvudvärk (51,0 %), myalgi (26,9 %), feber (24,1 %), trötthet (22,3 %), illamående (15,9 %) och artralgi (12,9 %).
Seropositiva ungdomar vid utgångsvaccination
Proportionen deltagare som upplevde påkallade systemiska biverkningar var högre i deltagare med seronegativa utgångsvärden som vaccinerats med IXCHIQ, än i deltagare med seropositiva utgångsvärden som vaccinerats med IXCHIQ (67,9 % respektive 44,7 %). Andelen deltagare som upplevde påkallade lokala biverkningar och oönskade biverkningar var liknande i IXCHIQ-armarna för varje stratum.
Laboratorieparametrar
Vuxna ≥ 18 år
De vanligaste onormala laboratorieparametrarna var neutropeni (41,8 %), leukopeni (31,2 %), lymfopeni (22,3 %), ökad alaninaminotransferas (ALAT: 15,5 %) och ökad aspartataminotransferas (ASAT: 11,7 %) (baserat på en immunogenicitetsundergrupp bestående av 372 IXCHIQ-mottagare).
Ungdomar 12 till <18 år
De vanligaste onormala laboratorieparametrarna var neutropeni (40,2 %), leukopeni (16,8 %) och lymfopeni (11,6 %) (baserat på en immunogenicitetsundergrupp bestående av 328 IXCHIQ-mottagare).
Vaccinviremi och utsöndring
Vaccinvirus visade sig vara närvarande i blod och urin och kan finnas i andra kroppsvätskor. Vaccinviremi och utsöndring (mätt med genomiska amplifieringsmetoder) efter vaccination med IXCHIQ utvärderades i en klinisk prövning för vuxna (VLA1553-101). Viremi upptäcktes hos 90 % av försökspersonerna 3 dagar efter vaccination. 7 dagar efter administrering av IXCHIQ minskade andelen vaccinerade med påvisbart virus till 17 % och ingen vaccinviremi upptäcktes 15 dagar efter vaccination. En enskild deltagare utsöndrade vaccinvirus i urinen 7 dagar efter vaccination.
Tabell över biverkningar
Biverkningar listas enligt följande frekvenskategorier:
Mycket vanliga: (≥ 1/10),
Vanliga: (≥ 1/100 till < 1/10),
Mindre vanliga: (≥ 1/1 000 till < 1/100),
Sällsynta: (≥ 1/10 000 till < 1/1 000),
Mycket sällsynta: (< 1/10 000).
Ingen känd frekvens (kan inte beräknas från tillgängliga data).
Inom varje frekvensgrupp presenteras biverkningarna efter fallande allvarlighetsgrad.
Tabell 1. Läkemedelsbiverkningar hos individer 12 år och äldre
| Systemorganklass | Frekvens | Biverkningar |
| Blodet och lymfsystemet | Vanliga | Lymfadenopatia |
| Mindre vanliga | Trombocytopeni | |
| Endokrina systemet | Sällsynta | Hypovolemisk hyponatremia |
| Centrala och perifera nervsystemet | Mycket vanliga | Huvudvärk |
| Vanliga | Yrselb | |
| Mindre vanliga | Parestesi, synkope | |
| Sällsynta | Förvirringstillstånd | |
| Ingen känd frekvens | Encefalopati, encefalit, aseptisk meningit. | |
| Ögon | Vanliga | Ögonsmärtab |
| Mindre vanliga | Hyperemi i bindhinnanc | |
| Öron och balansorgan | Mindre vanliga | Tinnitusa |
| Andningsvägar, bröstkorg och mediastinum | Mindre vanliga | Dyspné |
| Magtarmkanalen | Mycket vanliga | Illamående |
| Vanliga | Kräkningar, diarré | |
| Hud och subkutan vävnad | Vanliga | Hudutslag |
| Mindre vanliga | Hyperhidrosa | |
| Muskuloskeletala systemet och bindväv | Mycket vanliga | Myalgi, artralgi |
| Vanliga | Ryggsmärtaa | |
| Allmänna symtom och/eller symtom vid administreringsstället | Mycket vanliga | Trötthet, feber, reaktioner på vaccinationsstället (ömhet, smärta, erytem, induration, svullnad) |
| Vanliga | Frossa | |
| Mindre vanliga | Astenia, perifert ödema, sjukdomskänsla, minskad aptit | |
| Undersökningar och provtagningar | Mycket vanliga | Minskat antalet vita blodkroppard; ökat leverfunktionstestvärdea,e |
a. rapporterat endast hos vuxna, ej rapporterat hos ungdomar
b. ögonsmärta och yrsel: vanlig hos ungdomar, mindre vanlig hos vuxna
c. rapporterat endast hos ungdomar, ej rapporterat hos vuxna
d. inkluderar: leukopeni (minskat antal leukocyter), neutropeni (minskat antal neutrofiler) och lymfopeni (minskat antal lymfocyter).
e. inkluderar: Ökad alaninaminotransferas (ALAT) och ökad aspartataminotransferas (ASAT).
Chikungunyaliknande biverkningar
Vuxna
Förekomsten av vissa biverkningskombinationer, kallade chikungunyaliknande biverkningar, utvärderades retrospektivt i sammanslagna säkerhetsdata från kliniska fas I- och fas III-studier (N = 3 610). Chikungunyaliknande biverkningar var brett definierade, d.v.s. förekomst av feber (≥ 38 °C) och minst ett annat symtom som också rapporterats för chikungunya-sjukdom i akut skede, inklusive artralgi eller artrit, myalgi, huvudvärk, ryggsmärta, utslag, lymfadenopati, och vissa neurologiska symtom, hjärt- eller ögonsymtom; inom 30 dagar efter vaccination, oavsett tidpunkt för debut, allvarlighetsgrad eller de individuella symtomens varaktighet.
Biverkningskombinationer som kvalificerade som chikungunyaliknande biverkningar rapporterades hos 12,1 % av deltagarna. Bland dessa var kombinationer av feber med huvudvärk, trötthet, myalgi eller artralgi de vanligaste. Alla andra symtom rapporterades i färre än 10 % av chikungunyaliknande biverkningar. De rapporterade symtomen var oftast milda, 1,8 % av deltagarna rapporterade minst ett svårare symptom, oftast feber eller artralgi. Mediandebut av chikungunyaliknande biverkningar var 3 dagar efter vaccination och mediantiden tills de upphörde var 4 dagar. Längre bestående symtom ≥ 30 dagar förekom hos 0,4 % av deltagarna.
Ungdomar 12 till <18 år
Förekomsten av chikungunyaliknande biverkningar hos ungdomar (12 till <18 år) utvärderades i en post-hoc-analys av 502 deltagare från fas III-studie hos ungdomar. Chikungunyaliknande biverkningar hos ungdomar definierades som feber (≥ 37,8 °C) och minst ett annat symtom som också rapporterats för chikungunya-sjukdom i akut skede, inklusive artralgi eller artrit, myalgi, huvudvärk, eller vissa neurologiska symtom eller ögonsymtom, hudutslag eller vissa hudsymtom; inom 30 dagar efter vaccination, oavsett tidpunkt för debut, allvarlighetsgrad eller de individuella symtomens varaktighet. Chikungunyaliknande biverkningar rapporterades hos 23,1 % av ungdomar. Bland dessa var kombinationer av feber med huvudvärk, myalgi, trötthet eller artralgi de vanligaste, alla andra symtom rapporterades i färre än 10 % av deltagarna. 3,6 % av deltagarna rapporterade minst ett allvarligt symptom, oftast feber eller huvudvärk. Mediandebut av chikungunyaliknande biverkningar var 2 dagar efter vaccination och mediantiden till upplösning var 4 dagar. Det rapporterades inga längre bestående chikungunyaliknande biverkningar hos ungdomar (d.v.s. minst ett symtom som varade ≥30 dagar).
Seropositiva ungdomar vid utgångsvaccination
Proportionen deltagare som upplevde chikungunyaliknande biverkningar var högre i deltagare med seronegativa utgångsvärden än i deltagare med seropositiva utgångsvärden som vaccinerats med IXCHIQ.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Inga fall av överdosering har rapporterats i kliniska studier. I händelse av överdosering rekommenderas övervakning av vitala funktioner och eventuell symtomatisk behandling.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Andra virusvacciner, ATC-kod: Ännu ej tilldelad
Verkningsmekanism
IXCHIQ innehåller levande försvagad CHIKV av genotypen ECSA/IOL. Den exakta skyddsmekanismen mot CHIKV-infektion och/eller sjukdom har inte fastställts. IXCHIQ framkallar neutraliserande antikroppar mot CHIKV.
Immunogenicitet
Inga effektdata finns tillgängliga för IXCHIQ. Den kliniska effekten av IXCHIQ härleddes från en CHIKV-specifik neutraliserande antikroppstitertröskel efter vaccination.
En tröskel för CHIKV-specifik neutraliserande antikropp μPRNT50 med titer på ≥150 valdes som surrogatmarkör för skydd, kallad serorespons. Denna tröskel bestämdes från en passiv överföringsstudie av icke-mänskliga primater, där djur med titer ≥150 skyddades mot CHIKV-infektioner av vildtyp och hade odetekterbart virus i blodet under 14 dagar efter utmaningen. Data erhållna från en prospektiv human sero-epidemiologisk studie kunde dessutom ge stöd för tröskelvärdet.
VLA1553-301 var en placebokontrollerad studie som utvärderade immunogeniciteten och säkerheten hos allmänt friska individer på 18 år och äldre. Studien genomfördes i USA. Deltagarna i denna studie följdes upp i 6 månader efter immunisering. Andelen deltagare med CHIKV-specifika antikroppstiter om ≥ 150 µPRNT50, dvs. seroresponsfrekvens, 28 dagar efter vaccination i CHIKV-deltagarna som är negativa för IXCHIQ-armens CHIKV-neutraliserande antikroppar, var den primära slutpunkten.
Humoralt immunsvar utvärderades hos 362 deltagare (266 i IXCHIQ-armen och 96 i placeboarmen). Alla dessa deltagare var negativa vid utgångsvärdet (före vaccination) för CHIKV-neutraliserande antikroppar. Studiepopulationen inkluderade 82 deltagare på 65 år eller äldre (59 och 23 i IXCHIQ- och placeboarmen).
VLA1553-321 var en placebokontrollerad studie som utvärderade immunogeniciteten och säkerheten hos allmänt friska ungdomar i 12 till <18 års ålder. Studien genomfördes i Brasilien som är ett endemiskt land för chikungunya. Deltagarna i denna studie följdes i upp till 6 månader efter immunisering. Primärt effektmått liknade det i studien VLA1553-301.
Humoralt immunsvar utvärderades hos 351 deltagare (303 i IXCHIQ-armen och 48 i placeboarmen). 293 deltagare hade negativa och 58 deltagare hade positiva utgångsvärden (före vaccination) för CHIKV-neutraliserande antikroppar.
Antikroppsbeständighet utvärderas i studie VLA1553-303 (uppföljning av en undergrupp av deltagare i studien VLA1553-301). Data finns tillgängliga i upp till 2 år efter immunisering. I studien VLA1553-321 kommer en undergrupp av ungdomar i 12 till <18 års ålder att följas i upp till 1 år efter immunisering.
Seroresponsfrekvens
Vuxna
I den pivotala studien VLA1553-301 uppvisade 98,9 % av deltagarna som fick IXCHIQ CHIKV-specifik neutraliserande antikroppstiter om ≥150 µPRNT50 28 dagar efter vaccination. Denna procentandel bibehölls upp till 6 månader efter vaccination (96,3 %). Se tabell 2. Endast 1,6 % (n = 4/251) av deltagarna som vaccinerades med IXCHIQ hade en CHIKV-specifik neutraliserande antikroppstiter om ≥ 150 µPRNT50 vid dag 8. Ingen deltagare hade CHIKV-specifikt neutraliserande antikroppssvar om ≥ 150 µPRNT50 i placeboarmen av VLA1553-301.
Tabell 2. Seroresponsfrekvenser över tid, bestämd med µPRNT50-analys, i studie VLA1553-301 (PP-population)
Studie | VLA1553-301 | ||
Behandling | Placebo | IXCHIQ | |
N = 96 | N = 266 | ||
(n [95 % CI]) | (n (%) [95 % CI]) | ||
Utgångsvärde dag 1 | 0 (0) | 0 (0) | |
28 dagar efter vaccination | 0 [0,0, 3,8] | 263 (98,9) [96,7, 99,8] | |
6 månader efter vaccination | 0 [0,0, 4,0] | 233 (96,3) [93,1, 98,3] | |
Förkortningar: CI = konfidensintervall; µPRNT50 = 50 % neutralisationstest för mikroplackreduktion; PP = per protokoll (population)
Ungdomar 12 till <18 år
I studien VLA1553-321 med ungdomar uppvisade 98,8 % (248/251) av de CHIKV-seronegativa deltagarna som fick IXCHIQ en CHIKV-specifik neutraliserande antikroppstiter om ≥150 µPRNT50 28 dagar efter vaccination. Denna procentandel bibehölls upp till 6 månader efter vaccination (99,1 %) (232/234). 5,7 % (n = 14/245) av de CHIKV-seronegativa deltagarna som vaccinerades med IXCHIQ hade en CHIKV-specifik neutraliserande antikroppstiter om ≥ 150 µPRNT50 vid dag 8. De allra flesta CHIKV-seropositiva deltagarna (50/52) uppvisade CHIKV-specifika neutraliserande antikroppstiter ≥150 µPRNT50 före vaccination med IXCHIQ. Procentandelarna förblev i samma intervall i 28 dagar efter vaccination (52/52) och 6 månader efter vaccination (45/46).
Tabell 3. Seroresponsfrekvenser över tid, bestämd med µPRNT50-analys, i studie VLA1553-321 (PP-population)
Studie | VLA1553-321 | |||
Behandling | Placebo | IXCHIQ | ||
Seronegativa N = 42 | Seropositiva N = 6 | Seronegativa N = 251 | Seropositiva N = 52 | |
(n (%) [95 % CI]) | (n (%) [95 % CI]) | (n (%) [95 % CI]) | (n (%) [95 % CI]) | |
Utgångsvärde dag 1 | 0 (0) | 6 (100) | 0 (0) | 50 (96,2) |
28 dagar efter vaccination | 1 (2,4 %) [0,1; 12,6] | 6 (100) [54,1; 100,0] | 248 (98,8) [96,5; 99,8] | 52 (100) [93,2; 100,0] |
6 månader efter vaccination | 0 (0 %) [0,0; 9,0] | 6 (100) [54,1; 100,0] | 232 (99,1) [96,9; 99,9] | 45 (97,8) [88,5; 99,9] |
Förkortningar: CI = konfidensintervall; µPRNT50 = 50 % neutralisationstest för mikroplackreduktion; PP = per protokoll (population)
Antikroppsbeständighet
Immunsvarets beständighet utvärderades 12 och 24 månader efter vaccination i VLA1553-303. Alla deltagare var negativa vid utgångsvärdet (före vaccination) för CHIKV-specifika neutraliserande antikroppar. Andelen deltagare med ett CHIKV-specifikt neutraliserande antikroppssvar ≥ 150 µPRNT50 var 99,5 % (183/184) respektive 97,1 % (268/276), 1 respektive 2 år efter vaccination.
Pediatrisk population
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för
IXCHIQ-vaccin i en eller flera undergrupper av den pediatriska populationen vid aktiv immunisering för att förebygga sjukdom orsakad av chikungunyavirus (CHIKV) (se avsnitt Dosering och administreringssätt för information om pediatrisk användning).
Farmakokinetiska egenskaper
Ej relevant för vacciner.
Prekliniska säkerhetsuppgifter
Icke-kliniska data visar ingen speciell risk för människor baserat på konventionella studier av toxicitet vid upprepad dosering och reproduktions- och utvecklingstoxicitet.
En studie i reproduktionstoxicitet som genomfördes på honråttor visade att IXCHIQ administrerat före och efter parning inte påverkade reproduktionsparametrarna, förlossningen, eller utvecklingen av fostret eller dess unge. Det fanns tecken på placenta- och mjölköverföring av IXCHIQ-specifika antikroppar (se avsnitt Fertilitet, graviditet och amning).
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Pulver
Sackaros
D-sorbitol
L-metionin
Trinatriumcitratdihydrat
Magnesiumklorid
Dikaliumvätefosfat
Kaliumdivätefosfat
Rekombinant humant albumin (rHA) framställt i jäst (Saccharomyces cerevisiae)
Lösningsmedel
Sterilt vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
Oöppnad injektionsflaska
2 år.
Får ej frysas.
Efter beredning
Det färdigberedda vaccinets stabilitet under användning har visats i 2 timmar vid förvaring antingen i kylskåp (2–8 °C) eller i rumstemperatur (15–25 °C). Efter denna tid måste det färdigberedda vaccinet kasseras.
Ur mikrobiologisk synvinkel ska vaccinet användas omedelbart efter första öppnandet. Om det inte används omedelbart är förvaringstider och förvaringsförhållanden användarens ansvar.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2–8 °C).
Får ej frysas.
Förvaras i originalförpackningen för att skydda mot ljus.
Stabilitetsdata indikerar att vaccinets komponenter är stabila i 24 timmar i oöppnade injektionsflaskor när de förvaras vid temperaturer från 23 °C till 27 °C. I slutet av denna period ska IXCHIQ användas omedelbart eller kasseras. Dessa data är endast avsedda att vägleda sjukvårdspersonal vid tillfälliga temperaturavvikelser. Dessa förhållanden rekommenderas inte vid förvaring eller frakt.
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
IXCHIQ injektiokuiva-aine ja liuotin, liuosta varten
1 annos (ilman neulaa) (169,93 €)
PF-selosteen tieto
IXCHIQ levereras i en kartong som innehåller:
- En injektionsflaska för engångsdos (typ I-glas) innehållande lyofiliserat pulver av vaccinet med en gummipropp (bromobutyl) och en flip-off-kapsyl av aluminium med polypropenförslutning.
- Ett lösningsmedel bestående av 0,5 ml sterilt vatten för injektionsvätskor i en förfylld spruta med en gummipropp (Flurotec®) och ett sprutlock (bromobutyl) (förpackad utan nålar).
- Förpackningsstorlek: 1 injektionsflaska med pulver, 1 förfylld spruta med lösningsmedel utan nålar.
Läkemedlets utseende:
Före beredning är det lyofiliserade vaccinet ett vitt till svagt gulaktigt homogent pulver. Lösningsmedlet är en klar färglös vätska.
Särskilda anvisningar för destruktion och övrig hantering
Förberedelse för administrering
Vaccinet får endast beredas med den medföljande vätskan före administrering.
Det färdigberedda vaccinet är en klar, färglös till svagt gulaktig flytande lösning. Vaccinet ska före administrering inspekteras visuellt med avseende på främmande partiklar och missfärgning, närhelst lösningen och dess behållare så tillåter. Om något av dessa förhållanden föreligger ska vaccinet inte administreras.
En (22-25G)-nål med lämplig längd på helst minst 40 mm (1 1/2") bör användas för att bereda vaccinet.
Sprutan är endast avsedd för engångsbruk.
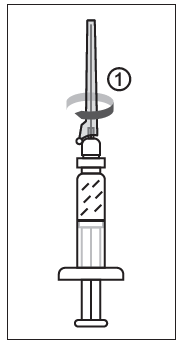
Figur 1
1) Efter att ha tagit bort sprutlocket, ska en nål fästas på sprutans luerlock.
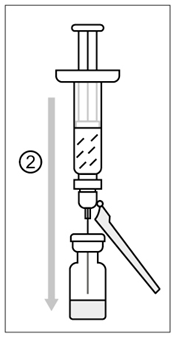
Figur 2
2) Rengör injektionsflaskans propp. Överför långsamt hela innehållet i den förfyllda sprutan (lösningsmedel) till injektionsflaskan (pulvret).
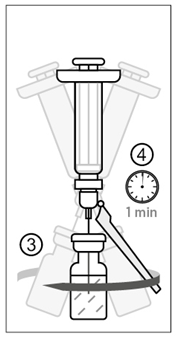
Figur 3
3) Snurra injektionsflaskan försiktigt för att lösa upp pulvret. Injektionsflaskan får inte skakas eller vändas.
4) Efter att flaskan har snurrats ska du vänta i minst en minut för fullständig beredning av vaccinet.
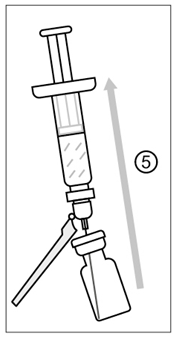
Figur 4
5) Efter beredning ska injektionsflaskan lutas lätt och hela innehållet (0,5 ml) av det beredda vaccinet dras upp i samma spruta. Vänd inte på injektionsflaskan för att säkerställa att den färdigberedda volymen dras upp fullständigt.
Efter beredning administreras IXCHIQ intramuskulärt inom 2 timmar. Om det inte används inom 2 timmar, ska det färdigberedda vaccinet kasseras (se avsnitt Hållbarhet).
Avfallshantering
Denna produkt innehåller genetiskt modifierade organismer (GMO).
Eventuellt oanvänt vaccin eller avfall ska kasseras i enlighet med gällande anvisningar för läkemedelsavfall. Eventuella spill bör saneras omedelbart och desinficeras enligt lokala riktlinjer. Kassera den använda sprutan och nålen i en behållare för vassa föremål, såsom en förslutningsbar, punkteringssäker behållare.
Ersättning
IXCHIQ injektiokuiva-aine ja liuotin, liuosta varten
1 annos
- Ei korvausta.
Atc-kod
J07BP01
Datum för översyn av produktresumén
12.09.2025
Yhteystiedot
SE-105 21 Stockholm
Sverige
+46 8-121 015 00
www.valneva.com
Lääketieteellisissä kysymyksissä puh: +358 (0) 306 705 310 (arkisin klo 8-16) sekä sähköpostitse infofinland@valneva.com
