FRUZAQLA kapseli, kova 1 mg, 5 mg
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
FRUZAQLA 1 mg kovat kapselit
Yksi kova kapseli sisältää 1 mg frukintinibia.
Apuaineet, joiden vaikutus tunnetaan
Yksi 1 mg:n kova kapseli sisältää väriaineina 0,0247 mg tartratsiinia (E102) ja 0,0004 mg paraoranssia (E110).
FRUZAQLA 5 mg kovat kapselit
Yksi kova kapseli sisältää 5 mg frukintinibia.
Apuaine, jonka vaikutus tunnetaan
Yksi 5 mg:n kova kapseli sisältää väriaineena 0,1829 mg alluranpunainen AC:tä (E129).
Täydellinen apuaineluettelo, ks. kohta Apuaineet
Lääkemuoto
Kova kapseli.
Kliiniset tiedot
Käyttöaiheet
FRUZAQLA on tarkoitettu monoterapiana aikuisten metastasoituneen kolorektaalisyövän (mCRC) hoitoon potilaille, joita on aiemmin hoidettu saatavilla olevilla vakiohoidoilla, mukaan lukien fluoropyrimidiini-, oksaliplatiini- ja irinotekaanipohjaisilla solunsalpaajahoidoilla, verisuonten endoteelikasvutekijän estäjillä (anti‑VEGF) ja epidermaalisen kasvutekijän reseptorin estäjillä (anti‑EGFR), ja joiden tauti on edennyt trifluridiini-tipirasiili- tai regorafenibihoidon aikana tai jotka eivät siedä trifluridiini-tipirasiilia tai regorafenibia.
Ehto
Hoito tulee aloittaa syövän hoitoon tarkoitettujen lääkevalmisteiden antamiseen perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
FRUZAQLA-hoito aloitetaan sellaisen lääkärin valvonnassa, jolla on kokemusta syöpähoitojen antamisesta.
Annostus
Frukintinibin suositeltu annos on 5 mg (yksi 5 mg:n kapseli) kerran vuorokaudessa otettuna suurin piirtein samaan kellonaikaan joka päivä 21 peräkkäisenä päivänä, minkä jälkeen pidetään 7 vuorokauden lepojakso, ja nämä yhdessä muodostavat 28 vuorokauden kokonaisjakson.
Hoidon kesto
Frukintinibia jatketaan, kunnes tauti etenee tai ilmenee toksisuutta, joka ei ole hyväksyttävissä.
Väliin jääneet annokset tai oksentelu
Jos annos jää väliin ja aikataulun mukaisesta ottamisajankohdasta on alle 12 tuntia, se tulisi ottaa, ja seuraava annos on otettava aikataulun mukaisesti.
Jos aikataulun mukaisesta ottamisajankohdasta on yli 12 tuntia, annos on jätettävä ottamatta, ja seuraava annos on otettava aikataulun mukaisesti.
Jos potilas oksentaa annoksen ottamisen jälkeen, hän ei saa ottaa toista annosta samana päivänä, vaan hänen on jatkettava aikataulun mukaista annostusta seuraavana päivänä.
Annoksen muuttaminen haittavaikutusten takia
Annosta on muutettava turvallisuuden ja siedettävyyden mukaan. Frukintinibi on lopetettava pysyvästi, jos potilas ei siedä 3 mg:n annosta kerran vuorokaudessa. Suositus annoksen pienentämiselle haittavaikutusten vuoksi on esitetty taulukossa 1.
Taulukko 1: Suositus FRUZAQLA-annoksen pienentämiseksi
| Annoksen pienennys | Annos | Kapselien määrä ja vahvuus |
| Ensimmäinen annoksen pienennys | 4 mg kerran vuorokaudessa | Neljä 1 mg:n kapselia kerran vuorokaudessa |
| Toinen annoksen pienennys | 3 mg kerran vuorokaudessa | Kolme 1 mg:n kapselia kerran vuorokaudessa |
Suositellut haittavaikutusten takia tehtävät annosmuutokset on esitetty taulukossa 2.
Taulukko 2: Suositeltu FRUZAQLA-annoksen muutos haittavaikutusten yhteydessä
| Haittavaikutus | Vaikeusaste1 | Annoksen muutos |
| Hypertensio | Aste 3 |
Jos potilaalla on edelleen asteen 3 hypertensiota sen jälkeen, kun hän on ottanut 3 mg kerran vuorokaudessa, lopeta hoito pysyvästi. |
| Aste 4 | Lopeta hoito pysyvästi. | |
| Verenvuototapahtumat | Aste 2 |
Jos potilaalla on edelleen asteen 2 verenvuototapahtumia sen jälkeen, kun hän on ottanut 3 mg vuorokaudessa, lopeta hoito pysyvästi. |
| Aste ≥ 3 | Lopeta hoito pysyvästi. | |
| Proteinuria | ≥ 2 g / 24 tuntia |
Jos potilaalla on edelleen proteinuriaa ≥ 2 g / 24 tuntia sen jälkeen, kun hän on ottanut 3 mg vuorokaudessa, lopeta hoito pysyvästi. Lopeta hoito pysyvästi nefroottisen oireyhtymän ilmetessä. |
| Poikkeavuudet maksan toimintakokeissa | Asteen 2 tai 3 poikkeavuuksia maksan toimintakokeissa |
Jos potilaalla on edelleen asteen 2 tai 3 poikkeavuuksia maksan toimintakokeissa sen jälkeen, kun hän on ottanut 3 mg vuorokaudessa, lopeta hoito pysyvästi. |
| Alaniiniaminotransferaasi (ALAT)-tai aspartaattiaminotransferaasi (ASAT)-pitoisuuksien suureneminen asteeseen ≥ 2 (> 3 x ULN) ja samanaikaisesti suurentunut kokonaisbilirubiiniarvo > 2 x ULN, kun potilaalla ei ole kolestaasia; asteen 4 poikkeavuuksia maksan toimintakokeissa | Lopeta hoito pysyvästi. | |
| Käsi-jalkaoireyhtymä (palmoplantaarinen erytrodysestesia, PPE) | Aste 2 |
|
| Aste 3 |
Jos potilaalla on edelleen asteen 3 PPE-oireita sen jälkeen, kun hän on ottanut 3 mg vuorokaudessa, lopeta hoito pysyvästi. | |
| Muut haittavaikutukset | Aste 3 |
Jos potilaalla on edelleen muita asteen 3 haittavaikutuksia sen jälkeen, kun hän on ottanut 3 mg vuorokaudessa, lopeta hoito pysyvästi. |
| Aste 4 | Lopeta hoito. Harkitse hoidon jatkamista pienemmällä annoksella taulukon 1 mukaisesti, jos toksisuus lievenee asteeseen 1 tai lähtötasolle ja mahdollinen potilaalle koituva hyöty on suurempi kuin riskit. | |
| 1NCI CTCAE -kriteerit (National Cancer Institute Common Terminology Criteria for Adverse Events), versio 5.0 (. | ||
Erityisryhmät
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä, keskivaikea tai vaikea munuaisten vajaatoiminta (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
FRUZAQLA-valmistetta ei suositella potilaille, joilla on vaikea maksan vajaatoiminta, koska valmistetta ei ole tutkittu tällä potilasryhmällä.
Iäkkäät
Annosta ei tarvitse muuttaa 65-vuotiaille tai sitä vanhemmille potilaille.
Pediatriset potilaat
Ei ole asianmukaista käyttää FRUZAQLA-valmistetta pediatrisille potilaille metastasoituneen kolorektaalisyövän hoitoon.
Antotapa
FRUZAQLA otetaan suun kautta.
Kapselit voidaan ottaa ruoan kanssa tai ilman ruokaa, ja ne on nieltävä kokonaisina.
Kapseleita ei saa pureskella, liuottaa tai avata, koska näiden muutosten aiheuttamia mahdollisia vaikutuksia ei tunneta.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Hypertensio
Hypertensiota, mukaan lukien hypertensiivistä kriisiä, on ilmoitettu frukintinibia saaneilla potilailla (ks. kohta Haittavaikutukset). Aiempi hypertensio on kontrolloitava riittävässä määrin vakiintuneen hoitokäytännön mukaisesti ennen frukintinibin aloittamista.
Hypertensiota on hoidettava lääketieteellisesti verenpainelääkkeillä ja tarvittaessa muuttamalla frukintinibiannosta (ks. kohta Annostus ja antotapa). Frukintinibi on lopetettava pysyvästi, jos hypertensiota ei saada hallintaan verenpainelääkityksellä tai jos potilaalla ilmenee hypertensiivinen kriisi.
Verenvuototapahtumat
Verenvuototapahtumia, mukaan lukien ruoansulatuskanavan tapahtumia, on ilmoitettu frukintinibihoitoa saaneilla potilailla (ks. kohta Haittavaikutukset). Potilailla on ilmoitettu vakavia ja joskus kuolemaan johtaneita verenvuototapahtumia frukintinibihoidon jälkeen.
Hematologista ja hyytymisprofiilia on seurattava vakiintuneiden hoitokäytäntöjen mukaisesti, jos potilaalla on verenvuodon riski, mukaan lukien potilaat, jotka saavat antikoagulaatiohoitoa tai samanaikaisesti muita verenvuotoriskiä suurentavia lääkevalmisteita Mikäli potilaalla ilmenee vaikeaa verenvuotoa, joka edellyttää välitöntä lääketieteellistä interventiota, frukintinibihoito on lopetettava pysyvästi (ks. kohta Annostus ja antotapa).
Ruoansulatuskanavan perforaatio
Ruoansulatuskanavan perforaatioita, mukaan lukien kuolemaan johtaneita tapahtumia, on ilmoitettu frukintinibia saaneilla potilailla (ks. kohta Haittavaikutukset).
Ruoansulatuskanavan perforaation oireita on seurattava säännöllisesti frukintinibin aikana.
Frukintinibi on lopetettava pysyvästi, jos potilaalle kehittyy ruoansulatuskanavan perforaatio.
Proteinuria
Proteinuriaa on esiintynyt potilailla, jotka ovat saaneet frukintinibia.
Proteinuriaa on seurattava ennen frukintinibin aloittamista ja sen aikana vakiintuneiden hoitokäytäntöjen mukaisesti. Jos virtsan liuskatestissä havaitaan proteinuriaa ≥ 2 g / 24 tuntia, hoidon keskeytys, muutos tai lopetus voi olla tarpeen. Frukintinibi on lopetettava pysyvästi, jos potilaalle kehittyy nefroottinen oireyhtymä (ks. kohta Annostus ja antotapa).
Käsi-jalkaoireyhtymä (PPE)
PPE on useimmin ilmoitettu dermatologinen haittavaikutus (ks. kohta Haittavaikutukset).
Mikäli asteen ≥ 2 ihoreaktioita havaitaan, hoidon keskeytys, muutos tai lopetus voi olla tarpeen (ks. kohta Annostus ja antotapa).
Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES)
PRES-oireyhtymää on kliinisissä tutkimuksissa raportoitu yhdellä potilaalla (0,1 %), joka sai frukintinibia (ks. myös kohta Haittavaikutukset). PRES-oireyhtymä on harvinainen neurologinen oireyhtymä, johon voi liittyä päänsärkyä, kohtauksia, letargiaa, sekavuutta, psyykkisten toimintojen muutoksia, sokeutta ja muita visuaalisia tai neurologisia häiriöitä, joihin voi mahdollisesti liittyä hypertensiota. PRES-diagnoosi on vahvistettava aivojen kuvantamistutkimuksella, ensisijaisesti magneettikuvauksella (MRI). Jos potilaalle kehittyy PRES, frukintinibin lopettaminen sekä hypertension hoito ja muiden oireiden tukihoito on suositeltavaa.
Heikentynyt haavan paraneminen
Heikentynyttä haavan paranemista on kliinisissä tutkimuksissa raportoitu yhdellä potilaalla (0,1 %), joka sai frukintinibia.
Frukintinibi suositellaan keskeytettäväksi vähintään 2 viikkoa ennen leikkausta. Frukintinibia ei saa jatkaa vähintään 2 viikkoon leikkauksen jälkeen, ennen kuin riittävästä haavan paranemisesta on kliinistä näyttöä.
Valtimon ja laskimon tromboemboliatapahtumat
On suositeltavaa välttää frukintinibin aloittamista potilaille, joilla on ollut tromboembolisia tapahtumia (mukaan lukien syvä laskimotromboosi ja keuhkoembolia) viimeisten 6 kuukauden aikana tai joilla on ollut aivoinfarkti ja/tai ohimenevä iskeeminen aivoverenkiertohäiriö (TIA) viimeisten 12 kuukauden aikana. Jos valtimotromboosia epäillään, frukintinibin käyttö on lopetettava välittömästi.
Apuaineet
Frukintinibin 1 mg:n kapselit sisältävät tartratsiinia (E102) ja paraoranssia (E110), jotka saattavat aiheuttaa allergisia reaktioita.
Frukintinibin 5 mg:n kapselit sisältävät alluranpunainen AC:tä (E129), joka saattaa aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutukset frukintinibin farmakokinetiikkaan
CYP3A-indusorit
Frukintinibin samanaikainen anto rifampisiinin (voimakas CYP3A-indusori) 600 mg kerran vuorokaudessa annoksen kanssa pienensi frukintinibin AUCinf-arvoa 65 % ja Cmax-arvoa 12 %. Samanaikaista frukintinibin käyttöä voimakkaiden ja kohtalaisen voimakkaiden CYP3A-indusorien kanssa on vältettävä.
CYP3A-estäjät
Frukintinibin samanaikainen anto itrakonatsolin (voimakas CYP3A-estäjä) 200 mg kaksi kertaa vuorokaudessa annoksen kanssa ei aiheuttanut kliinisesti merkittäviä muutoksia AUC-arvoon (pitoisuus-aikakäyrän alle jäävä pinta-ala) eikä frukintinibin Cmax-arvossa. Frukintinibin annosta ei tarvitse muuttaa, kun sitä käytetään samanaikaisesti CYP3A-estäjien kanssa.
Mahahappojen eritystä vähentävät aineet
Frukintinibin samanaikainen käyttö rabepratsolin (protonipumpun estäjä) 40 mg kerran vuorokaudessa annoksen kanssa ei aiheuttanut kliinisesti merkittäviä muutoksia frukintinibin AUC-arvoon. Frukintinibin annosta ei tarvitse muuttaa, kun sitä käytetään samanaikaisesti mahahappoja vähentävien aineiden kanssa.
Frukintinibin vaikutus muiden lääkevalmisteiden farmakokinetiikkaan
P-glykoproteiinin (P‑gp) substraatit
Kun dabigatraanieteksilaattia (P‑gp-substraatti) annettiin yksi 150 mg:n annos samanaikaisesti yhden 5 mg:n frukintinibiannoksen kanssa, dabigatraanin AUC-arvo pieneni 9 %. P‑gp-substraattien annoksia ei suositella muutettavan, kun niitä käytetään samanaikaisesti frukintinibin kanssa.
Rintasyövän resistanssiproteiinin (BCRP) substraatit
Kun rosuvastatiinia (BCRP-substraatti) annettiin yksi 10 mg:n annos samanaikaisesti yhden 5 mg:n frukintinibiannoksen kanssa, rosuvastatiinin AUC-arvo pieneni 19 %. BCRP-substraattien annoksia ei suositella muutettavan, kun niitä käytetään samanaikaisesti frukintinibin kanssa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / naisten ehkäisy
Naisten, jotka voivat tulla raskaaksi, on käytettävä hyvin tehokasta ehkäisyä frukintinibihoidon aikana ja vähintään 2 viikkoa viimeisen frukintinibiannoksen jälkeen.
Raskaus
Frukintinibin käytöstä raskaana oleville naisille ei ole olemassa tietoja.
Vaikutusmekanisminsa perusteella frukintinibi voi mahdollisesti aiheuttaa haitallisia vaikutuksia sikiölle. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta, kuten sikiöiden epämuodostumia (ks. kohta Prekliiniset tiedot turvallisuudesta). FRUZAQLA-valmistetta ei pidä käyttää raskauden aikana, ellei raskaana olevan potilaan kliininen tilanne edellytä hoitoa frukintinibilla.
Jos frukintinibia käytetään raskauden aikana tai jos potilas tulee raskaaksi kesken hoidon, potilaalle on kerrottava sikiölle aiheutuvasta mahdollisesta vaarasta.
Imetys
Frukintinibin turvallista käyttöä imetyksen aikana ei ole varmistettu. Ei tiedetä, erittyvätkö frukintinibi tai sen metaboliitit ihmisillä äidinmaitoon. Eläintutkimuksista ei ole saatavilla tietoja frukintinibin erittymisestä maitoon koe-eläimillä. Imetettävään vastasyntyneeseen/vauvaan kohdistuvia riskejä ei voida sulkea pois.
Imetys on lopetettava hoidon ajaksi ja 2 viikon ajaksi viimeisen annoksen jälkeen.
Hedelmällisyys
Tietoja frukintinibin vaikutuksista ihmisten hedelmällisyyteen ei ole. Eläimillä tehtyjen tutkimusten tulokset viittaavat siihen, että frukintinibi voi heikentää miesten tai naisten hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Frukintinibilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Frukintinibin annon jälkeen voi esiintyä väsymystä (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset ovat hypertensio (49,3 %), ruokahaluttomuus (35,6 %), proteinuria (35,5 %), PPE (34,6 %), hypotyreoosi (32,4 %), dysfonia (28,6 %), ripuli (26,3 %) ja astenia (24,5 %).
Yleisimmät asteen ≥ 3 haittavaikutukset ovat hypertensio (19,1 %) ja PPE (8,3 %).
Yleisimmät vakavat haittavaikutukset ovat ruoansulatuskanavan verenvuoto (1,5 %), pneumonia (1,5 %), hypertensio (1,5 %) ja ruoansulatuskanavan perforaatio (1,3 %).
Haittavaikutukset johtivat hoidon lopettamiseen 7,6%:lla potilaista. Yleisin hoidon lopetukseen johtava haittavaikutus on proteinuria (1,6 %).
Annosta on pienennettävä haittavaikutusten takia 20,5 %:lla potilaista. Yleisimmät annoksen pienentämiseen johtavat haittavaikutukset ovat PPE (6,4 %), hypertensio (3,7 %) ja proteinuria (3,4 %).
Haittavaikutustaulukko
Haittavaikutusten esiintymistiheydet perustuvat yhdistettyihin tietoihin kliinisistä tutkimuksista, joihin osallistui 911 potilasta, joiden metastasoitunutta kolorektaalisyöpää oli hoidettu aiemmin. Potilaat saivat vähintään 1 annoksen (5 mg) frukintinibimonoterapiaa (5 mg kerran vuorokaudessa 3 viikon ajan / 1 viikon tauko) 3,68 kuukauden ajan (mediaani).
Kliinisissä tutkimuksissa tai frukintinibin markkinoille tulon jälkeisessä käytössä raportoidut haittavaikutukset on lueteltu taulukossa 3 MedDRA-elinjärjestelmäluokan ja esiintymistiheyden mukaan. Kussakin elinjärjestelmäluokassa haittavaikutukset on järjestetty esiintymistiheyden mukaan niin, että yleisimmät haittavaikutukset ovat ensimmäisenä. Esiintymistiheydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa olevat markkinoille tulon jälkeiset tiedot eivät riitä esiintyvyyden arviointiin). Kussakin esiintymistiheysryhmässä haittavaikutukset on esitetty vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3: Metastasoitunutta kolorektaalisyöpää sairastavilla, frukintinibilla hoidetuilla potilailla raportoidut haittavaikutukset (N = 911)
| Elinjärjestelmäluokka | Esiintymistiheys- luokka | Haittavaikutukset Kaikki asteet |
| Infektiot | Yleinen | Pneumonia Ylähengitystieinfektio1 Bakteeri-infektiot2 |
| Veri ja imukudos | Hyvin yleinen | Trombosytopenia3 |
| Yleinen | Leukopenia4 Neutropenia5 | |
| Umpieritys | Hyvin yleinen | Hypotyreoosi6 |
| Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Ruokahaluttomuus7 |
| Yleinen | Hypokalemia | |
| Hermosto | Melko harvinainen | Posteriorinen reversiibeli enkefalopatiaoireyhtymä* |
| Verisuonisto | Hyvin yleinen | Hypertensio8 |
| Tuntematon | Aortan dissekaatio† | |
| Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Dysfonia9 |
| Yleinen | Nenäverenvuoto Kurkkukipu10 | |
| Ruoansulatuselimistö | Hyvin yleinen | Ripuli Stomatiitti11 |
| Yleinen | Ruoansulatuskanavan verenvuoto12 Ruoansulatuskanavan perforaatio13 Haimaentsyymien pitoisuuden suureneminen14 Suukipu15 | |
| Melko harvinainen | Haimatulehdus16 | |
| Maksa ja sappi | Hyvin yleinen | Suurentunut aspartaattiaminotransferaasiarvo Suurentunut kokonaisbilirubiiniarvo17 Suurentunut alaniiniaminotransferaasiarvo |
| Melko harvinainen | Sappirakkotulehdus18 | |
| Iho ja ihonalainen kudos | Hyvin yleinen | Käsi-jalkaoireyhtymä |
| Yleinen | Ihottuma19 | |
| Luusto, lihakset ja sidekudos | Hyvin yleinen | Luuston ja lihaksiston epämukavat tuntemukset20 Artralgia |
| Munuaiset ja virtsatiet | Hyvin yleinen | Proteinuria21 |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Astenia Väsymys |
| Yleinen | Limakalvotulehdus | |
| Melko harvinainen | Heikentynyt haavan paraneminen*, 22 |
Turvallisuustiedot perustuvat kaikkiin metastasoitunutta kolorektaalisyöpää sairastaviin potilaisiin, jotka saivat vähintään 1 annoksen (5 mg) frukintinibia monoterapiana (5 mg kerran vuorokaudessa 3 viikon ajan / 1 viikko taukoa) seuraavissa yhdistetyissä tutkimuksissa: 2012-013-00CH1; 2013-013-00CH1/FRESCO; 2019-013-GLOB1/FRESCO-2 mukaan lukien avoimen japanilaisen turvallisuustutkimuksen lead-in -kohortti; 2009-013-00CH1; 2012‑013-00CH3; 2015-013-00US1.
*Raportoitu kliinisissä tutkimuksissa ja markkinoille tulon jälkeisessä seurannassa.
†Raportoitu markkinoille tulon jälkeen.
Seuraavat termit edustavat samankaltaisten tapahtumien ryhmää ja kuvaavat ennemmin sairautta kuin yksittäistä tapahtumaa:
1Ylähengitysteiden infektio sisältää nasofaryngiitin, faryngiitin ja ylähengitystieinfektion
2Bakteeri-infektiot sisältää oireettoman bakteriurian, bakteeri-infektion, bakteriurian, selluliitin, clostridium difficile -koliitin, clostridium difficile -infektion, enterobakteerisepsiksen, escherichia-virtsatieinfektion, follikuliitin, furunkkelin, paronykian, streptokokkinielutulehduksen, streptokokin aiheuttaman bakteremian, virtsateiden bakteeri-infektion, virtsateiden stafylokokki-infektion
3Trombosytopenia sisältää verihiutalemäärän pienenemisen, trombosytopenian
4Leukopenia sisältää leukopenian, valkosolumäärän pienenemisen
5Neutropenia sisältää neutropenian, neutrofiilimäärän pienenemisen
6Hypotyreoosi sisältää veren tyreotropiinihormonipitoisuuden suurenemisen, hypotyreoosin
7Ruokahaluttomuus sisältää heikentyneen ruokahalun, painon laskun
8Hypertensio sisältää diastolisen verenpaineen nousun, kohonneen verenpaineen, diastolisen hypertension, hypertension ja hypertensiivisen kriisin
9Dysfonia sisältää afonian, dysfonian
10Kurkkukipu sisältää epämukavan tunteen nielussa, nielukivun, epämukavan tunteen suunielussa ja suunielun kivun
11Stomatiitti sisältää aftahaavaumat, ikenien haavaumat, suun haavaumat, stomatiitin ja kielen haavaumat
12Ruoansulatuskanavan verenvuoto sisältää verenvuodon peräaukosta, anastomoosiin liittyvän verenvuodon, mahaverenvuodon, ruoansulatuskanavan verenvuoron, veriulosteen, peräpukamien verenvuodon, suolistoverenvuodon, ruoansulatuskanavan alaosan verenvuodon, peräsuolen verenvuodon ja ruoansulatuskanavan yläosan verenvuodon
13Ruoansulatuskanavan perforaatio sisältää mahalaukun perforaation, mahahaavan perforaation, ruoansulatuskanavan perforaation, suoliston perforaation, paksusuolen perforaation, peräsuolen perforaation ja ohutsuolen perforaation
14Haimaentsyymipitoisuuden suureneminen sisältää amylaasipitoisuuden suurenemisen, hyperamylasemian, hyperlipasemian ja lipaasipitoisuuden suurenemisen
15Suukipu sisältää ienkivun, suukivun ja hammassäryn
16Haimatulehdus sisältää haimatulehduksen ja akuutin haimatulehduksen
17Suurentunut kokonaisbilirubiiniarvo sisältää suurentuneen konjugoidun bilirubiinin pitoisuuden, suurentuneen veren bilirubiinipitoisuuden, suurentuneen veren konjugoimattoman bilirubiinin pitoisuuden, hyperbilirubinemian, ikteruksen, kolestaattisen ikteruksen
18Sappirakkotulehdus sisältää sappirakkotulehduksen, akuutin sappirakkotulehduksen, sappirakkoinfektion
19Ihottuma sisältää ihottuman, punoittavan ihottuman, täplämäisen ihottuman, makulopapulaarisen ihottuman, papulaarisen ihottuman ja kutiavan ihottuman
20Luuston ja lihaksiston epämukavat tuntemukset sisältää luukivun, lihasspasmit, muskuloskeletaalisen rintakivun, muskuloskeletaalisen kivun, niskakivun ja raajakivun
21Proteinuria sisältää albuminurian, proteiinin virtsassa ja proteinurian
22Heikentynyt haavan paraneminen sisältää heikentyneen paranemisen, haavan avautumisen
Valikoitujen haittavaikutusten kuvaus
Seuraavien valikoitujen haittavaikutusten tiedot perustuvat potilaisiin, jotka saivat vähintään 1 annoksen (5 mg) frukintinibia (5 mg kerran vuorokaudessa 3 viikon ajan / 1 viikko taukoa) kolmessa satunnaistetussa lumelääkekontrolloidussa tutkimuksessa (2012-013-00CH1; 2013‑013‑00CH1/FRESCO; 2019-013-GLOB1/FRESCO‑2). Näiden haittavaikutusten hoito-ohjeet, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Hypertensio
Hypertensiota raportoitiin 47,4 %:lla frukintinibiryhmän potilaista. Noin puolet näistä tapauksista ilmeni ensimmäisten 2 viikon aikana frukintinibihoidon aloittamisen jälkeen. Asteen ≥ 3 hypertensiota raportoitiin 18,4 %:lla frukintinibiryhmän potilaista. Aika (mediaani) oireiden alkamiseen frukintinibilla hoidetuilla potilailla oli 15 vuorokautta (vaihteluväli: 1 päivä – 7,6 kuukautta). Kolmelle frukintinibilla hoidetulle potilaalle (0,4 %) kehittyi hypertensiivinen kriisi. Suurin osa tapauksista lievittyi tai korjaantui hoidon keskeytyksen (3,1 % potilaista) tai annoksen pienennyksen (3,7 % potilaista) jälkeen. 0,5 %:lla potilaista hypertensio johti pysyvään hoidon lopetukseen.
Verenvuototapahtumat
Verenvuototapahtumia raportoitiin 26,5 %:lla potilaista frukintinibiryhmässä ja 14,6 %:lla potilaista lumelääkeryhmässä. Useimmat verenvuototapahtumat frukintinibihoitoa saaneilla potilailla olivat vaikeusasteeltaan lieviä tai keskivaikeita (asteen ≥ 3 verenvuototapahtumien ilmaantuvuus oli frukintinibiryhmässä 2,0 %). Aika (mediaani) verenvuototapahtuman alkamiseen oli frukintinibia saaneilla potilailla 23 päivää (vaihteluväli: 1 päivä – 9,8 kuukautta). Kuolemaan johtaneita verenvuototapahtumia raportoitiin 0,5 %:lla frukintinibiryhmän potilaista. Hoidon keskeytykseen johtaneiden verenvuototapahtumien ilmaantuvuus oli 1,2 %. Yleisimmät verenvuototapahtumat olivat ruoansulatuskanavan verenvuoto (7 %) ja nenäverenvuoto (5,6 %). Useimmin raportoitu vakava verenvuototapahtuma oli ruoansulatuskanavan verenvuoto, jota raportoitiin 1,5 %:lla frukintinibiryhmän potilaista verrattuna lumelääkeryhmän 0,5 %:iin.
Ruoansulatuskanavan perforaatio
Ruoansulatuskanavan perforaatioita raportoitiin 1,5 %:lla frukintinibiryhmän potilaista. Kuolemaan johtaneita ruoansulatuskanavan perforaatioita raportoitiin 0,1 %:lla frukintinibiryhmän potilaista. Yleisin ruoansulatuskanavan perforaatio oli suolistoperforaatio (0,8 %). Hoidon keskeytykseen johtaneiden ruoansulatuskanavan perforaatioiden ilmaantuvuus oli 1,0 %.
Proteinuria
Proteinuriaa raportoitiin 32,9 %:lla frukintinibiryhmän potilaista. Frukintinibihoitoa saaneilla potilailla proteinuria oli vaikeusasteeltaan useimmiten lievää tai keskivaikeaa (asteen ≥ 3 proteinurian ilmaantuvuus oli frukintinibiryhmässä 2,8 %). Aika (mediaani) oireiden alkamiseen frukintinibilla hoidetuilla potilailla oli 28 vuorokautta (vaihteluväli: 6 päivää – 1,3 vuotta). Useimmat tapahtumat lievittyivät tai korjaantuivat hoidon keskeytyksen tai annoksen pienennyksen jälkeen. 1,8 %:lla frukintinibilla hoidetuista potilaista proteinuria johti pysyvään hoidon lopetukseen.
Käsi-jalkaoireyhtymä (PPE)
Käsi-jalkaoireyhtymää raportoitiin 32,7 %:lla frukintinibiryhmän potilaista. Asteen ≥ 3 PPE:n ilmaantuvuus frukintinibiryhmässä oli 8,5 %. Aika (mediaani) oireiden alkamiseen frukintinibilla hoidetuilla potilailla oli 20 vuorokautta (vaihteluväli: 1 päivä – 7,4 kuukautta). Suurin osa tapauksista lievittyi tai korjaantui hoidon keskeytyksen (6,4 % potilaista) tai annoksen pienennyksen (6,3 % potilaista) jälkeen. 0,5 %:lla PPE:hen hoitoa saaneista potilaista hoito lopetettiin pysyvästi.
Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES)
Yksi (0,1 %) PRES-tapaus (aste 4) raportoitiin potilailla, jotka saivat frukintinibimonoterapiaa kliinisissä tutkimuksissa. PRES-tapauksia on raportoitu myös markkinoille tulon jälkeisessä seurannassa. Kaikki tapaukset korjautuivat PRES:in hoidon ja frukintinibin lopettamisen jälkeen.
Hypotyreoosi
Hypotyreoosia raportoitiin 31,5 %:lla frukintinibiryhmän potilaista. Asteen ≥ 3 kilpirauhasen toimintahäiriön ilmaantuvuus frukintinibiryhmässä oli pieni (0,3 %). Aika (mediaani) oireiden alkamiseen frukintinibilla hoidetuilla potilailla oli 56 vuorokautta (vaihteluväli: 18 päivää – 1,4 vuotta). Mikään tapahtuma ei aiheuttanut annoksen pienennystä tai hoidon keskeytystä.
Infektiot
Infektioita raportoitiin 23,4 %:lla potilaista frukintinibiryhmässä ja 13,3 %:lla lumelääkeryhmässä. Frukintinibihoitoa saaneilla potilailla infektiotapahtumat olivat vaikeusasteeltaan useimmiten lieviä tai keskivaikeita (asteen ≥ 3 infektioiden ilmaantuvuus oli 6 % frukintinibiryhmässä). Vakavia infektioita raportoitiin 4,1 %:lla ja kuolemaan johtaneita infektiotapahtumia 1,0 %:lla potilaista frukintinibiryhmässä. Annoksen keskeyttämiseen johtaneiden infektioiden ilmaantuvuus oli 0,9 %. Yleisin infektioreaktio oli ylähengitystieinfektio (5,0 %). Yleisin raportoitu vakava infektio oli keuhkokuume (1,4 %).
Poikkeavuudet maksan toimintakokeissa
Maksan toimintakokeiden poikkeavuuksia raportoitiin 36,4 %:lla frukintinibiryhmän potilaista ja 23,5 %:lla lumelääkeryhmän potilaista. Frukintinibihoitoa saaneilla potilailla maksan ja sapen toimintahäiriöt olivat vaikeusasteeltaan useimmiten lieviä tai keskivaikeita (asteen ≥ 3 poikkeavuuksien ilmaantuvuus maksan toimintakokeissa oli 8,8 % frukintinibiryhmässa). Yleisimmät maksan toimintakokeiden poikkeavuudet olivat suurentunut ASAT-arvo (18,1 %), suurentunut kokonaisbilirubiiniarvo (18,3 %) ja suurentunut ALAT-arvo (15,5 %). Frukintinibihoitoa saaneilla potilailla aika (mediaani) poikkeavuuden ilmenemiseen oli 28 vuorokautta (vaihteluväli: 4 vuorokautta – 12 kuukautta). Vakavia maksan toimintakokeiden poikkeavuuksia raportoitiin 2,3 %:lla ja kuolemaan johtaneita maksan toimintahäiriöitä 0,3 %:lla frukintinibihoitoa saaneista potilaista. Maksan toimintakokeiden poikkeavuudet johtivat annoksen keskeyttämiseen 4,6 %:lla potilaista ja annoksen pienentämiseen 2,0 %:lla potilaista ja pysyvään lopettamiseen 1,5 %:lla potilaista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa tutkittu suurin frukintinibiannos oli 6 mg vuorokaudessa.
Frukintinibin yliannostuksen vaikutuksia ei tunneta, eikä frukintinibin yliannostukseen ole mitään tunnettua vasta-ainetta. Yliannostustapauksissa frukintinibin anto on keskeytettävä, yleisiin tukihoitotoimiin ryhdyttävä ja potilasta seurattava kliiniseen stabiloitumiseen asti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastiset lääkeaineet, verisuonten endoteelikasvutekijän reseptorin (VEGFR) tyrosiinikinaasin estäjät, ATC-koodi: L01EK04
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Frukintinibi on selektiivinen VEGFR‑1, -2 ja ‑3 tyrosiinikinaasin estäjä, jonka antituumorivaikutus perustuu kasvaimen angiogeneesin suppressioon.
Sydämen elektrofysiologia
Sykekorjatun QT-ajan (QTc) (> 10 millisekuntia) pitenemistä ei havaittu suositellulla frukintinibiannoksella. Pitoisuus-QT-analyysissä (N = 205) ei todettu merkkejä plasman frukintinibipitoisuuksien ja QTc-välin lähtötilanteesta muuttumisen välisestä yhteydestä.
Kliininen teho ja turvallisuus
Frukintinibin ja parhaan tukihoidon yhdistelmän tehoa ja turvallisuutta arvioitiin satunnaistetussa, lumelääkekontrolloidussa, kaksoissokkoutetussa vaiheen III tutkimuksessa (FRESCO‑2) potilailla, joiden metastasoitunutta kolorektaalisyöpää oli aiemmin hoidettu mm. oksaliplatiini- tai irinotekaanipohjaisilla solunsalpaajahoidoilla. Frukintinibin kliininen teho FRESCO‑2-tutkimuksessa on kuvattu alla.
FRESCO-2-tutkimus
Frukintinibin kliinistä tehoa ja turvallisuutta arvioitiin maailmanlaajuisessa, satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa vaiheen III monikeskustutkimuksessa (FRESCO‑2) 691 potilaalla, joilla oli metastasoitunut kolorektaalisyöpä ja joita oli aiemmin hoidettu hyväksytyillä vakiohoidoilla, kuten fluoropyrimidiini-, oksaliplatiini- ja irinotekaanipohjaisella solunsalpaajahoidolla; biologisella anti‑VEGF-hoidolla; anti‑EGFR-hoidolla, jos syöpä oli RAS‑villityyppiä, ja joiden tauti oli edennyt trifluridiini-tipirasiili- tai regorafenibihoidon aikana tai joille oli kehittynyt intoleranssi trifluridiinille/tipirasiilille ja/tai regorafenibille. Potilaat katsottiin intoleranteiksi trifluridiinille/tipirasiilille tai regorafenibille, jos he saivat ainakin yhden annoksen jompaakumpaa ainetta ja hoito keskeytettiin muusta syystä kuin taudin etenemisen vuoksi. Potilaita, joilla oli MSI‑H- tai dMMR-kasvaimia, oli aiemmin hoidettu immuuniaktivaation vapauttajilla, ja potilaita, joilla oli BRAF V600E ‑mutatoituneita kasvaimia, oli aiemmin hoidettu BRAF‑estäjällä, jos sellainen oli hyväksytty ja käytettävissä potilaiden asuinmaassa tai ‑alueella. Satunnaistus ositettiin aiemman hoidon (trifluridiini/tipirasiili vs. regorafenibi vs. sekä trifluridiini/tipirasiili että regorafenibi), RAS‑statuksen (villityyppi vs. mutantti) ja metastasoituneen taudin keston (≤ 18 kuukautta vs. > 18 kuukautta) mukaan.
Potilaat, joilla oli Eastern Cooperative Oncology Group (ECOG) -toimintakykyluokka ≥ 2, vasemman kammion fraktio ≤ 50 %, systolinen verenpaine > 140 mmHg tai diastolinen verenpaine > 90 mmHg, virtsan proteiini ≥ 1 g / 24 h tai paino < 40 kg, suljettiin pois tutkimuksesta. Ensisijainen tehon päätetapahtuma oli kokonaiselossaolo (overall survival, OS). Tärkein toissijainen tehon päätetapahtuma oli etenemättömyysaika (progression‑free survival, PFS; tutkijan arvioimana RECIST (Response Evaluation Criteria in Solid Tumours) -version 1.1 mukaan) ja muihin toissijaisiin päätetapahtumiin kuului taudin hallinta (disease control rate).
Yhteensä 691 potilasta satunnaistettiin (2:1) saamaan frukintinibia 5 mg suun kautta kerran vuorokaudessa (N = 461) ja parasta tukihoitoa tai lumelääkettä suun kautta kerran vuorokaudessa (N = 230) ja parasta tukihoitoa (tästä eteenpäin frukintinibi ja lumelääke). 21 vuorokauden hoitojaksoa seurasi 7 vuorokauden tauko, ja yhdessä nämä muodostivat 28 vuorokauden hoitojakson.
691 satunnaistetun potilaan iän mediaani oli 64 vuotta (vaihteluväli: 25–86), ja 47 % potilaista oli ≥ 65-vuotiaita. 55,7 % potilaista oli miehiä, 80,9 % oli valkoihoisia, ja potilaiden ECOG‑toimintakykyluokka oli 0 (43,1 %) tai 1 (56,9 %). Kasvaimen RAS‑villityyppiä raportoitiin 36,9 %:lla potilaista tutkimuksen alkamishetkellä. Metastasoituneen taudin keston mediaani oli 39 kuukautta (vaihteluväli: 6 kuukautta – 16,1 vuotta). Metastasoituneeseen tautiin saatujen aiempien hoitolinjojen lukumäärä (mediaani) oli 4 (vaihteluväli: 2–16).
Fluoropyrimidiini-, oksaliplatiini- ja irinotekaanipohjaisen solunsalpaajahoidon lisäksi 96,4 % potilaista sai aiemmin anti-VEGF-hoitoa, 38,8 % sai aiemmin anti-EGFR-hoitoa, 52,2 % sai trifluridiinia/tipirasiilia, 8,4 % sai regorafenibia, 39,4 % sai sekä trifluridiinia/tipirasiilia että regorafenibia, 4,6 % sai immunoterapiaa ja 2,3 % sai BRAF-estäjää.
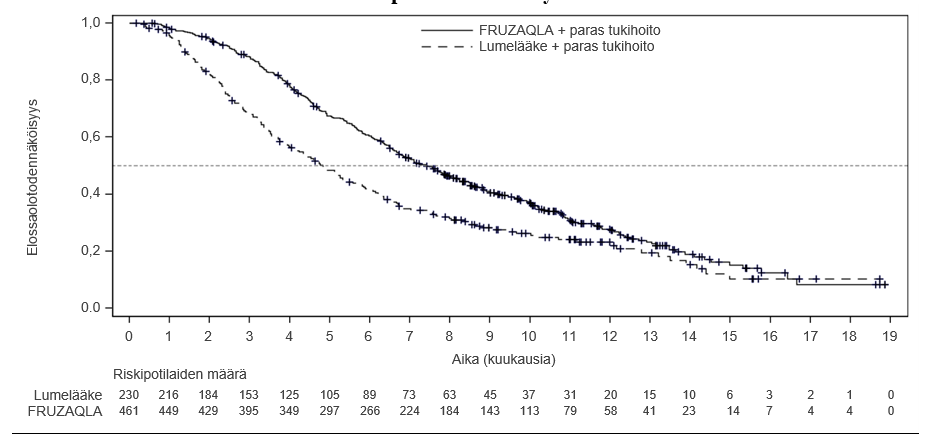
FRESCO‑2-tutkimuksessa frukintinibin lisäys parhaaseen tukihoitoon paransi tilastollisesti merkitsevästi kokonaiselossaoloa ja etenemättömyysaikaa verrattuna lumelääkkeen ja parhaan tukihoidon yhdistelmään (ks. taulukko 4 ja kuva 1).
Taulukko 4: Tehotulokset FRESCO-2 -tutkimuksesta
| Päätetapahtuma | Frukintinibi (N = 461) | Lumelääke (N = 230) |
| Kokonaiselossaolo | ||
| Mediaani kuukausina (95 %:n luottamusväli) | 7,4 (6,7; 8,2) | 4,8 (4,0; 5,8) |
| Hasardisuhde1 (95 %:n luottamusväli) | 0,66 (0,55; 0,80) | |
| p-arvo2 | < 0,001 | |
| Etenemättömyysaika3 | ||
| Mediaani kuukausina (95 %:n luottamusväli) | 3,7 (3,5; 3,8) | 1,8 (1,8; 1,9) |
| Hasardisuhde1 (95 %:n luottamusväli) | 0,32 (0,27–0,39) | |
| p-arvo2 | < 0,001 | |
Lyhenteet: N = potilasmäärä Kokonaiselossaolon ja etenemättömyysajan mediaanit laskettiin Kaplan-Meierin menetelmällä. 1Hasardisuhde ja sen 95 %:n luottamusväli arvioitiin käyttämällä ositettua Coxin suhteellisten hasardien mallia (joka ottaa huomioon osituskertoimet), jossa hoitoryhmä on mallin ainoa kovariaatti. 2p-arvo (kaksisuuntainen) laskettiin käyttämällä ositettua log-rank-testiä, jotta se huomioi ositustekijät. 3Tutkijan arvioima, RECIST-version 1.1 mukainen | ||
Kuva 1: Kokonaiselossaoloa koskeva Kaplan-Meierin käyrä FRESCO-2-tutkimuksessa
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset FRUZAQLA-valmisteen käytöstä metastasoituneen kolorektaalisyövän hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Frukintinibin suun kautta ottamisen jälkeen aika (mediaani) plasman frukintinibin huippupitoisuuden saavuttamiseen (Tmax) oli noin 2 tuntia. Frukintinibilla oli toinen imeytymishuippu noin 24 tuntia lääkkeen antamisen jälkeen. Toistuvan, kerran vuorokaudessa annetun annoksen jälkeen frukintinibialtistus (Cmax ja AUC0–24 h) suureni annokseen suhteutettuna annosalueella 1–6 mg (0,2–1,2 kertaa suositeltu annos). Kun frukintinibia annettiin potilaille, joilla oli edenneitä kiinteitä kasvaimia, 28 vuorokauden hoitojaksoissa niin, että 21 vuorokauden ajan annettiin 5 mg kerran vuorokaudessa ja sitten pidettiin 7 vuorokauden tauko, frukintinibin vakaa tila saavutettiin 14 vuorokauden jälkeen, ja keskimääräinen kertymä AUC0–24 h‑arvon perusteella oli nelinkertainen suhteessa yksittäiseen annokseen. Suositellulla 5 mg:n frukintinibiannoksella vakaassa tilassa frukintinibin Cmax-arvon geometrinen keskiarvo (%CV) oli 300 ng/ml (28 %) ja AUC0–24 h-arvon geometrinen keskiarvo (%CV) oli 5 880 ng*h/ml (29 %).
Ruoan vaikutus
Paastotilaan verrattuna runsasrasvaisella aterialla ei ollut kliinisesti merkittävää vaikutusta frukintinibin farmakokinetiikkaan terveillä tutkittavilla. Frukintinibi voidaan ottaa ruoan kanssa tai ilman ruokaa.
Jakautuminen
Frukintinibin näennäinen jakautumistilavuus on noin 48,5 l. Frukintinibi sitoutuu plasman proteiineihin noin 95-prosenttisesti in vitro, ja se sitoutuu pääasiassa ihmisen seerumin albumiiniin.
Biotransformaatio
Frukintinibia metaboloivat useat entsyymit, kuten CYP450 (CYP3A- ja CYP2C-alaperheet) sekä ei‑CYP450-entsyymijärjestelmät. [14C]-leimatun frukintinibin in vivo ‑metabolia- ja massatasapainotutkimus osoitti, että frukintinibi on ihmisen plasmassa pääasiassa muuttumattomassa muodossa, jonka osuus vastaa noin 72 %:a kokonaisaltistuksesta plasmassa, ja frukintinibin CYP3A4‑välitteisen N‑demetyylimetaboliitin osuus vastaa noin 17 %:a kokonaisaltistuksesta plasmassa. Muita metabolisia reittejä ovat monipaikkainen mono-oksidaatio, O‑demetylaatio, N‑demetylaatio, O‑dekinatsoliinirengas ja amidihydrolyysi. Vaiheen II metaboliitteja ovat pääasiassa glukuronihappo ja vaiheen I rikkihappokonjugaatit.
In vitro ‑tutkimukset
Sytokromi P450 ‑entsyymit
CYP3A4 oli pääasiallinen frukintinibin metaboliaan liittyvä CYP-isoformeihin kuuluva entsyymi. CYP2C8-, CYP2C9- ja CYP2C19-entsyymeillä oli vähäisempi merkitys. Frukintinibi ei ole CYP1A2:n, CYP2B6:n, CYP2C8:n, CYP2C9:n, CYP2C19:n, CYP2D6:n tai CYP3A:n estäjä eikä CYP1A2:n, CYP2B6:n tai CYP3A:n indusori terapeuttisesti merkityksellisillä pitoisuuksilla.
Transportterijärjestelmät
Frukintinibi ei ole P‑glykoproteiinin (P‑gp), orgaanisen anionitransportteriproteiinin (OATP)1B1:n tai OATP1B3:n substraatti. Frukintinibi esti P-glykoproteiinia (P gp) ja rintasyöpäresistenssiproteiinia (BCRP) annosriippuvaisella tavalla in vitro ja osoitti pH-riippuvaista vesiliukoisuutta. Frukintinibi ei ole OATP1B1:n, OATP1B3:n, orgaanisen anionitransportterin (OAT)1, OAT3:n, orgaanisen kationitransportterin (OCT)2, monilääke- ja toksiiniekstruusioproteiinin (MATE)1 tai MATE2‑K:n estäjä terapeuttisesti merkityksellisillä pitoisuuksilla.
Eliminaatio
Frukintinibin näennäinen poistuma (CL/F) on 14,8 ml/min vakaassa tilassa, kun valmistetta annetaan kerran vuorokaudessa potilaille, joilla on edenneitä kiinteitä kasvaimia. Frukintinibin keskimääräinen eliminaation puoliintumisaika on noin 42 tuntia.
Kun radioleimattua frukintinibia annettiin 5 mg:n kerta-annos terveille tutkittaville, 60 % annoksesta erittyi virtsaan (0,5 % annoksesta muuttumattomana frukintinibina) ja 30 % annoksesta ulosteeseen (5 % annoksesta muuttumattomana frukintinibina).
Erityisryhmät
Munuaisten vajaatoiminta
Populaatiofarmakokinetiikka-analyysien perusteella lievällä tai keskivaikealla munuaisten vajaatoiminnalla (kreatiniinipuhdistuma [CrCL] 30–89 ml/min) ei ollut kliinisesti merkittävää vaikutusta frukintinibin farmakokinetiikkaan. Farmakokineettisessä tutkimuksessa sitoutumattoman frukintinibin AUC0-inf- ja Cmax-arvot olivat samankaltaiset tutkittavilla, joilla oli keskivaikea (CrCL 30–59 ml/min, N = 8) tai vaikea (CrCL 15–29 ml/min, N = 8) munuaisten vajaatoiminta verrattuna tutkittaviin, joilla oli normaali munuaisten toiminta (CrCL ≥ 90 ml/min, N = 8).
Maksan vajaatoiminta
Populaatiofarmakokinetiikka-analyysien perusteella frukintinibin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja niiden potilaiden välillä, joiden maksa toimi normaalisti tai joilla oli lievä (kokonaisbilirubiini ≤ ULN ja ASAT suurempi kuin ULN tai kokonaisbilirubiini > 1–1,5 kertaa ULN ja ASAT mikä tahansa) maksan vajaatoiminta. Maksan vajaatoimintaa koskevassa farmakokinetiikkatutkimuksessa, jossa frukintinibia annettiin suun kautta 2 mg:n kerta-annos, ei havaittu kliinisesti merkittäviä eroja frukintinibin annosnormalisoidussa AUC-arvossa tutkittavilla, joilla oli keskivaikea (Child–Pugh B) maksan vajaatoiminta, verrattuna tutkittaviin, joiden maksa toimi normaalisti.
Ikä, paino, sukupuoli tai rotu
Populaatiofarmakokinetiikka-analyysit osoittivat, että iällä (18–82 vuotta), painolla (48–108 kg), sukupuolella tai rodulla ei ollut kliinisesti merkittävää vaikutusta frukintinibin farmakokinetiikkaan.
Pediatriset potilaat
Frukintinibilla ei tehty farmakokinetiikkatutkimuksia potilailla, jotka olivat alle 18-vuotiaita.
Prekliiniset tiedot turvallisuudesta
Toistuvaa altistusta ja lisääntymistoksisuutta koskevissa tutkimuksissa toksisuutta havaittiin plasman keskimääräisillä frukintinibipitoisuuksilla, jotka ovat pienempiä kuin ihmisellä oletettavat terapeuttiset pitoisuudet.
Toistuvan altistuksen toksisuus
Toistuvan altistuksen aiheuttamaa toksisuutta koskevissa eläinkokeissa pääasialliset kohde-elinvaikutukset havaittiin ruoansulatuskanavassa, maksassa ja sapessa, immuunijärjestelmässä, luustossa (reisiluu ja hampaat), munuaisissa, hematopoieettisessa järjestelmässä ja lisämunuaisessa, ja näyttävät liittyvän VEGFR:n eston farmakologiaan ja/tai VEGF-signalointireitin häirintään. Kaikki löydökset korjaantuivat 4 viikon hoidottoman jakson jälkeen, lukuun ottamatta luustoa (rikkinäiset/irronneet hampaat).
Hedelmällisyyden heikkeneminen
Rotilla tehdyssä hedelmällisyystutkimuksessa ja varhaisen alkionkehityksen tutkimuksessa urosten ja naaraiden lisääntymiskykyindeksit pienenivät altistuksilla, jotka olivat noin 3,2 ja 0,8 kertaiset ihmisen AUC-arvoon verrattuna.. Samassa tutkimuksessa havaittiin annoksesta riippuvaista implantaatiota edeltävien alkiokuolemien lisääntymistä.
Lisääntymistoksisuus
Rottien alkio-sikiökehitystutkimuksessa havaittiin alkiotoksisia ja teratogeenisiä vaikutuksia subkliinisillä altistustasoilla, vaikka liiallinen toksisuus emolle puuttui. Näitä vaikutuksia olivat sikiön ulkoiset, viskeraaliset ja luuston epämuodostumat. Epämuodostumat koskivat ensisijaisesti päätä, häntää, kieltä, verisuonia, sydäntä, kateenkorvaa ja kehittyvää luustoa (erityisesti nikamia).
Genotoksisuus
In vitro- ja in vivo ‑tutkimuksissa ei havaittu merkkejä genotoksisuudesta.
Karsinogeneesi
Frukintinibilla ei ole tehty karsinogeenisuustutkimuksia.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Maissitärkkelys
Mikrokiteinen selluloosa (E460)
Talkki (E553b)
Kapselin kuori (vain 1 mg:n kovat kapselit)
Liivate
Titaanidioksidi (E171)
Tartratsiini (E102)
Paraoranssi (E110)
Kapselin kuori (vain 5 mg:n kovat kapselit)
Liivate
Titaanidioksidi (E171)
Alluranpunainen AC (E129)
Briljanttisininen FCF (E133)
Painomuste
Sellakka (E904)
Propyleeniglykoli (E1520)
Kaliumhydroksidi
Musta rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pidä purkki tiiviisti suljettuna.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FRUZAQLA kapseli, kova
1 mg (L:ei) 21 kpl (1379,35 €)
5 mg (L:ei) 21 kpl (5099,46 €)
PF-selosteen tieto
Suurtiheyspolyetyleenistä (HDPE) valmistettu purkki (45 ml), jossa polypropeenista (PP) valmistettu turvasuljin ja silikageeliä sisältävä HDPE-kuivausainepatruuna. Kuivausaine on pidettävä purkissa.
Yksi purkki sisältää 21 kovaa kapselia. Jokainen purkki on pakattu pahvikoteloon.
Valmisteen kuvaus:
FRUZAQLA 1 mg kovat kapselit
Läpinäkymätön kova liivatekapseli, koko 3 (likimääräinen pituus 16 mm), jossa on keltainen kansiosa ja valkoinen runko-osa, johon on mustalla musteella painettu allekkain merkinnät ”HM013” ja ”1mg”.
FRUZAQLA 5 mg kovat kapselit
Läpinäkymätön kova liivatekapseli, koko 1 (likimääräinen pituus 19 mm), jossa on punainen kansiosa ja valkoinen runko-osa, johon on mustalla musteella painettu allekkain merkinnät ”HM013” ja ”5mg”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
FRUZAQLA kapseli, kova
1 mg 21 kpl
5 mg 21 kpl
- Ei korvausta.
ATC-koodi
L01EK04
Valmisteyhteenvedon muuttamispäivämäärä
20.06.2024
Yhteystiedot
 TAKEDA OY
TAKEDA OY PL 1406, Ilmalankuja 3
00101 Helsinki
0800 774 051
www.takeda.fi
etunimi.sukunimi@takeda.com
