AZEFLONE nenäsumute, suspensio 125/50 mikrog/annos
Vaikuttavat aineet ja niiden määrät
Yksi gramma suspensiota sisältää 1000 mikrogrammaa atselastiinihydrokloridia ja 365 mikrogrammaa flutikasonipropionaattia.
Yksi painallus (0,14 g) sisältää 137 mikrogrammaa atselastiinihydrokloridia (joka vastaa 125 mikrogrammaa atselastiinia) ja 50 mikrogrammaa flutikasonipropionaattia.
Apuaine, jonka vaikutus tunnetaan
Yksi painallus (0,14 g) sisältää 0,014 mg bentsalkoniumkloridia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet
Lääkemuoto
Nenäsumute, suspensio.
Kliiniset tiedot
Käyttöaiheet
Keskivaikean tai vaikean kausiluonteisen ja ympärivuotisen allergisen nuhan oireiden lievittäminen, kun hoito nenän kautta otettavalla antihistamiinilla tai glukokortikoidilla ei riitä.
Annostus ja antotapa
Annostus
Lääkettä on käytettävä säännöllisesti täyden terapeuttisen hyödyn saavuttamiseksi. Lääkkeen joutumista silmiin on vältettävä.
Aikuiset ja nuoret (12 vuotta täyttäneet)
Yksi suihke kumpaankin sieraimeen kahdesti vuorokaudessa (aamuin illoin).
Alle 12‑vuotiaat lapset
Azeflonea ei suositella alle 12‑vuotiaiden lasten hoitoon, koska turvallisuutta ja tehoa tämän ikäryhmän hoidossa ei ole varmistettu.
Iäkkäät potilaat
Annosta ei tarvitse muuttaa tässä potilasryhmässä.
Munuaisten ja maksan vajaatoiminta
Tietoa ei ole saatavana valmisteen käytöstä munuaisten ja maksan vajaatoimintaa sairastavien potilaiden hoidossa.
Hoidon kesto
Azeflone soveltuu pitkäaikaiseen käyttöön.
Hoidon keston tulee vastata allergeenialtistuksen kestoa.
Antotapa
Azeflone‑nenäsumutetta saa antaa vain nenään.
Käyttöohje
Nenäsumutteen valmistelu:
Pulloa on ravistettava varovasti ennen käyttöä noin 5 sekunnin ajan kääntelemällä sitä ylösalaisin.
Tämän jälkeen irrotetaan suojakorkki. Azeflone‑nenäsumute on valmisteltava ennen ensimmäistä käyttökertaa siten, että pumppu painetaan pohjaan ja vapautetaan 6 kertaa. Jos Azeflone‑nenäsumute on ollut käyttämättä yli 7 päivän ajan, se on valmisteltava uudelleen siten, että pumppu painetaan pohjaan ja vapautetaan yhden kerran.
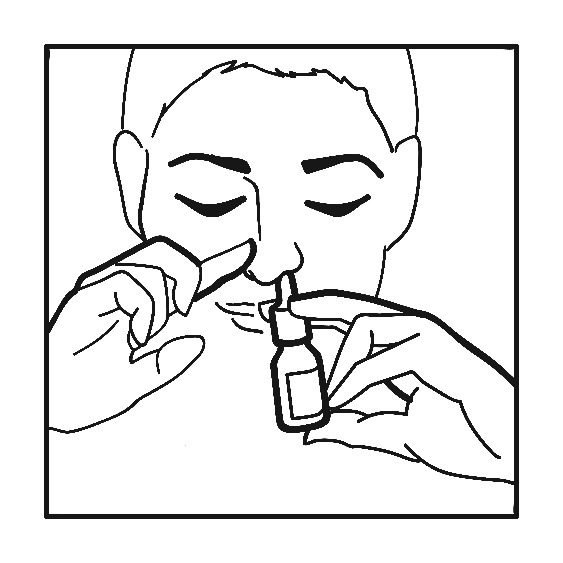
Nenäsumutteen käyttö:
Pulloa on ravistettava varovasti ennen käyttöä noin 5 sekunnin ajan kääntelemällä sitä ylösalaisin. Tämän jälkeen irrotetaan suojakorkki.
Nenä niistetään ja sen jälkeen päätä kallistetaan alas (ks. kuva). Kumpaankin sieraimeen suihkutetaan yksi suihke suspensiota. Käytön jälkeen pullon kärki pyyhitään ja suojakorkki pannaan takaisin paikalleen.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Valmisteen markkinoille tulon jälkeen flutikasonipropionaattia ja ritonaviiria käyttäneillä potilailla on ilmoitettu esiintyneen kliinisesti merkittäviä yhteisvaikutuksia, jotka ovat aiheuttaneet systeemisiä kortikosteroidivaikutuksia, kuten Cushingin oireyhtymää ja lisämunuaiskuoren lamaa. Siksi flutikasonipropionaatin ja ritonaviirin samanaikaista käyttöä on vältettävä, paitsi jos mahdollinen hyöty on kortikosteroidien systeemisten haittavaikutusten riskiä suurempi (ks. kohta Yhteisvaikutukset).
Nenän kautta otettavilla kortikosteroidivalmisteilla saattaa olla systeemisiä vaikutuksia, etenkin jos suuria annoksia käytetään pitkäaikaisesti. Näitä vaikutuksia esiintyy paljon epätodennäköisemmin kuin suun kautta otettavia kortikosteroideja käytettäessä, ja ne voivat olla erilaisia eri potilailla ja eri kortikosteroidivalmisteita käytettäessä. Mahdollisia systeemisiä vaikutuksia ovat mm. Cushingin oireyhtymä, Cushingin oireyhtymää muistuttavat piirteet, lisämunuaiskuoren lama, pituuskasvun hidastuminen lapsilla ja nuorilla, kaihi, glaukooma ja harvinaisemmissa tapauksissa erilaiset psykologiset vaikutukset tai käyttäytymisen muutokset, kuten psykomotorinen hyperaktiivisuus, univaikeudet, ahdistuneisuus, masentuneisuus ja aggressiivisuus (erityisesti lapsilla).
Jos potilaalla on vaikea maksasairaus, nenän kautta otetun flutikasonipropionaatin systeeminen altistus on todennäköisesti tavallista suurempi, koska atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutteen alkureitin metabolia on runsasta. Tällöin systeemiset haittatapahtumat voivat olla yleisempiä.
Näiden potilaiden hoidossa on noudatettava varovaisuutta.
Suositusannoksia suurempien nenän kautta otettavien kortikosteroidiannosten käyttö voi aiheuttaa kliinisesti merkittävää lisämunuaiskuoren lamaa. Jos on näyttöä suositusannoksia suurempien annosten käytöstä, systeemisen kortikosteroidin lisäämistä hoitoon stressitilanteissa tai elektiivisten leikkausten yhteydessä on harkittava.
Yleensä nenän kautta otettavien flutikasonivalmisteiden annosta tulee pienentää pienimpään annokseen, jolla nuhaoireet saadaan pysymään tehokkaasti hallinnassa. Suositusannosta (ks. kohta Annostus ja antotapa) suurempia atselastiinihydrokloridi/flutikasonipropionaatti-annoksia ei ole tutkittu. Kuten muitakin nenän kautta otettavia kortikosteroidivalmisteita käytettäessä, systeeminen kortikosteroidien kokonaisaltistus on otettava huomioon, jos potilaalle määrätään samanaikaisesti käytettäväksi muita kortikosteroidilääkemuotoja.
Nenän kautta otettavien kortikosteroidien myyntiluvan mukaisia annoksia saaneilla lapsilla on ilmoitettu esiintyneen pituuskasvun hidastumista. Myös nuorten kasvua on suositeltavaa seurata säännöllisesti, jos he käyttävät nenän kautta otettavia kortikosteroideja pitkäaikaisesti. Jos kasvu hidastuu, hoito on arvioitava uudelleen niin, että tavoitteena on nenän kautta otettavan kortikosteroidin annoksen pienentäminen pienimpään annokseen, jolla oireet saadaan pysymään tehokkaasti hallinnassa.
Systeemisesti tai topikaalisesti käytettävien kortikosteroidien käytön yhteydessä saatetaan ilmoittaa näköhäiriöistä. Jos potilaalla esiintyy oireita, kuten näön hämärtymistä tai muita näköhäiriöitä, potilas on ohjattava silmälääkärille, joka arvioi oireiden mahdolliset syyt. Niitä voivat olla kaihi, glaukooma tai harvinaiset sairaudet, kuten sentraalinen seroosi korioretinopatia, joista on ilmoitettu systeemisten tai topikaalisten kortikosteroidien käytön jälkeen.
Potilasta on seurattava tarkasti, jos hänellä ilmenee näköaistin muutoksia tai jos hänellä on aiemmin esiintynyt suurentunutta silmänpainetta, glaukoomaa ja/tai kaihia.
Jos on syytä epäillä lisämunuaistoiminnan heikentyneen, varovaisuus on tarpeen, kun potilas siirtyy systeemisestä steroidihoidosta Azeflone‑nenäsumutteen käyttöön.
Jos potilaalla on tuberkuloosi tai mikä tahansa hoitamaton infektio tai jos hän on toipumassa hiljattaisesta nenä- tai suuleikkauksesta tai -vammasta, Azeflone‑hoidon mahdollisia hyötyjä on arvioitava sen mahdolliseen riskiin nähden.
Nenän hengitystieinfektiot tulee hoitaa bakteeri- tai sienilääkkeillä, mutta ne eivät ole varsinainen vasta-aihe Azeflone‑hoidolle.
Apuaineet
Tämä lääkevalmiste sisältää 0,014 mg bentsalkoniumkloridia per suihke. Saattaa aiheuttaa pitkäaikaiskäytössä nenän limakalvon turvotusta.
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per suihke eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Flutikasonipropionaatti
Normaalitilanteissa plasman flutikasonipropionaattipitoisuus on pieni, kun valmiste otetaan nenän kautta, koska sytokromi P450 3A4:n välityksellä suolistossa ja maksassa tapahtuva alkureitin metabolia on runsasta ja systeeminen puhdistuma suurta. Siksi kliinisesti merkittävät, flutikasonipropionaattivälitteiset yhteisvaikutukset ovat epätodennäköisiä.
Terveillä vapaaehtoisilla tehty yhteisvaikutustutkimus osoitti, että ritonaviiri (hyvin voimakas sytokromi P450 3A4:n estäjä) voi suurentaa plasman flutikasonipropionaattipitoisuutta voimakkaasti, jolloin seerumin kortisolipitoisuus vastaavasti pienenee huomattavasti. Valmisteen markkinoille tulon jälkeen nenän kautta otettavaa tai inhaloitavaa flutikasonipropionaattia ja ritonaviiria käyttäneillä potilailla on ilmoitettu esiintyneen kliinisesti merkittäviä yhteisvaikutuksia, jotka ovat aiheuttaneet systeemisiä kortikosteroidivaikutuksia. Yhteiskäytön myös muiden CYP3A:n estäjien, kuten kobisistaattia sisältävien valmisteiden, kanssa odotetaan suurentavan systeemisten haittavaikutusten riskiä. Tämän yhdistelmän käyttöä on vältettävä, ellei hyöty ole suurempi kuin suurentunut systeemisten kortikosteroidihaittavaikutusten riski, jolloin potilaita on seurattava systeemisten kortikosteroidihaittavaikutusten varalta.
Tutkimukset ovat osoittaneet, että muut sytokromi P450 3A4:n estäjät suurentavat systeemistä flutikasonipropionaattialtistusta vain merkityksettömän vähän (erytromysiini) tai hyvin vähän (ketokonatsoli), eikä niihin liity merkittävää seerumin kortisolipitoisuuden pienenemistä. Varovaisuus on silti tarpeen, jos voimakkaita sytokromi P450 3A4:n estäjiä (esim. ketokonatsolia) käytetään samanaikaisesti, koska systeemisen flutikasonipropionaattialtistuksen suurenemisen mahdollisuus on olemassa.
Atselastiinihydrokloridi
Nimenomaan atselastiinihydrokloridinenäsumutetta koskevia yhteisvaikutustutkimuksia ei ole tehty. Yhteisvaikutustutkimuksissa on käytetty suuria suun kautta otettavia annoksia. Näiden tutkimusten tulokset eivät kuitenkaan ole olennaisia atselastiininenäsumutteen kannalta, koska nenän kautta otettavien suositusannosten käyttö aiheuttaa paljon pienemmän systeemisen altistuksen. Varovaisuus on silti tarpeen, kun atselastiinihydrokloridia annetaan samanaikaisesti sedatiiveja tai keskushermostoon vaikuttavia lääkkeitä käyttävälle potilaalle, koska sedatiivinen vaikutus voi tällöin voimistua. Myös alkoholi voi voimistaa tätä vaikutusta (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn).
Raskaus ja imetys
Hedelmällisyys
Hedelmällisyyttä koskevaa tietoa on saatavana vain vähän (ks. kohta Prekliiniset tiedot turvallisuudesta).
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja atselastiinihydrokloridin ja flutikasonipropionaatin käytöstä raskaana oleville naisille. Azeflone‑nenäsumutetta saa siksi käyttää raskauden aikana vain, jos odotettava hyöty on mahdollisia sikiöön kohdistuvia riskejä suurempi (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetys
Ei tiedetä, erittyvätkö nenän kautta otettu atselastiinihydrokloridi/metaboliitit ja flutikasonipropionaatti/metaboliitit rintamaitoon. Azeflone‑nenäsumutetta saa käyttää imetyksen aikana vain, jos siitä mahdollisesti saatava hyöty on suurempi kuin siitä mahdollisesti lapselle aiheutuva haitta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Azeflone‑nenäsumutteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Yksittäistapauksissa Azeflone‑nenäsumutteen käytön yhteydessä voi ilmetä väsymystä, uupumusta, voimakasta voipumusta, huimausta tai heikotusta, mutta ne voivat johtua myös hoidettavasta sairaudesta. Tällöin potilaan kyky ajaa autoa ja käyttää koneita voi heikentyä. Alkoholi voi voimistaa tätä vaikutusta.
Haittavaikutukset
Makuhäiriöt ovat yleisiä lääkkeen ottamisen jälkeen, koska lääke maistuu pahalta (tämä johtuu yleensä väärästä lääkkeenottotavasta eli pään kallistamisesta taaksepäin).
Haittavaikutukset on lueteltu seuraavassa elinjärjestelmien ja yleisyyden mukaan luokiteltuina. Haittavaikutusten yleisyys on määritelty seuraavasti:
Hyvin yleinen (≥1/10)
Yleinen (≥1/100, <1/10)
Melko harvinainen (≥1/1 000, <1/100)
Harvinainen (≥1/10 000, <1/1 000)
Hyvin harvinainen (<1/10 000)
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
Yleisyys Elinjärjestelmä | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon |
| Immuunijärjestelmä | Yliherkkyysreaktiot, mukaan lukien anafylaktiset reaktiot; angioedeema (kasvojen tai kielen turvotus ja ihottuma); bronkospasmi | |||||
| Hermosto | Päänsärky, makuhäiriö (paha maku), paha haju | Huimaus, uneliaisuus (tokkuraisuus, unisuus) | ||||
| Silmät* | Glaukooma, suurentunut silmänpaine, kaihi | Näön hämärtyminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet) | ||||
| Hengityselimet, rintakehä ja välikarsina | Nenäverenvuoto | Nenävaivat (kuten nenän ärsytys, pistely, kutina), aivastelu, nenän kuivuus, yskä, kurkun kuivuus, kurkun ärsytys | Nenän väliseinän perforaatio**, limakalvon rikkeymä | Nenän haavaumat | ||
| Ruoansulatuselimistö | Suun kuivuus | Pahoinvointi | ||||
| Iho ja ihonalainen kudos | Ihottuma, kutina, nokkosihottuma | |||||
| Yleisoireet ja antopaikassa todettavat haitat | Väsymys (uupumus, voimakas voipumus), heikotus (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn) |
* On löydetty hyvin pieni määrä spontaaneja raportteja silmähaitoista, jotka ovat ilmenneet nenän kautta otettavan flutikasonipropionaatin pitkäaikaisen käytön jälkeen.
** Nenän väliseinän perforaatiota on ilmoitettu esiintyneen nenän kautta otettavien kortikosteroidivalmisteiden käytön jälkeen.
Joillakin nenän kautta otettavilla kortikosteroidivalmisteilla saattaa olla systeemisiä vaikutuksia, etenkin jos suuria annoksia käytetään pitkäaikaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nenän kautta otettavia kortikosteroideja saaneilla lapsilla on ilmoitettu esiintyneen pituuskasvun hidastumista. Pituuskasvun hidastuminen on mahdollista myös nuorilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Osteoporoosia on havaittu harvinaisissa tapauksissa, joissa nenän kautta otettavia
kortikosteroidivalmisteita on käytetty pitkäaikaisesti.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‑sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostusreaktioita ei ole odotettavissa, jos lääkettä otetaan nenän kautta.
Nenän kautta käytettävän flutikasonipropionaatin aiheuttamista akuutin tai kroonisen yliannostuksen vaikutuksista potilaisiin ei ole tietoa.
Kun terveille vapaaehtoisille annettiin 2 mg flutikasonipropionaattia nenään (10 kertaa suositeltu vuorokausiannos) kahdesti vuorokaudessa seitsemän päivän ajan, sillä ei ollut vaikutusta hypotalamusaivolisäke-lisämunuaisakselin toimintaan.
Suositeltua suurempien annosten pitkäaikainen käyttö saattaa heikentää lisämunuaisten toimintaa väliaikaisesti.
Tällaisia annoksia käyttäneillä potilailla hoitoa Azeflone‑nenäsumutteella tulee jatkaa annoksella, joka on riittävän suuri pitääkseen oireet hallinnassa – lisämunuaisten toiminta palautuu muutamassa päivässä, mikä voidaan varmistaa määrittämällä plasman kortisolipitoisuus.
Jos lääkettä otetaan vahingossa yliannos suun kautta, eläinkokeiden tulosten perusteella on odotettavissa atselastiinihydrokloridista johtuvia keskushermoston häiriöitä (mm. uneliaisuus, sekavuus, kooma, takykardia ja verenpaineen lasku).
Näitä häiriöitä on hoidettava oireenmukaisesti. Mahahuuhtelun tekeminen voi olla suositeltavaa, ja sen tarpeellisuus riippuu siitä, paljonko lääkettä on nielty. Tunnettua vastalääkettä ei ole.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Nenän tukkoisuutta lievittävät paikallisvalmisteet; Kortikosteroidit / flutikasoni, yhdistelmävalmisteet, ATC-koodi: R01AD58.
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Azeflone‑nenäsumute sisältää atselastiinihydrokloridia ja flutikasonipropionaattia, joilla on erilaiset vaikutusmekanismit ja synergistisiä vaikutuksia allergisen nuhan ja rinokonjunktiviitin oireiden lievittämisessä.
Flutikasonipropionaatti
Flutikasonipropionaatti on synteettinen trifluorattu kortikosteroidi, joka sitoutuu hyvin voimakkaasti glukokortikoidireseptoriin ja jolla on voimakas anti-inflammatorinen vaikutus, mm. 3–5 kertaa voimakkaampi kuin deksametasonilla ihmisen kloonatun glukokortikoidireseptorin avulla tehdyissä sitoutumis- ja geeniekspressiomäärityksissä.
Atselastiinihydrokloridi
Atselastiini on pitkävaikutteinen voimakas antiallerginen ftalatsinonijohdannainen, jolla on selektiivisiä H1-reseptoriantagonistin ominaisuuksia sekä syöttösoluja stabiloivia ja antiinflammatorisia ominaisuuksia. In vivo- (prekliinisistä) ja in vitro -tutkimuksista saatujen tietojen perusteella atselastiini estää allergisten reaktioiden varhaisessa ja myöhäisessä vaiheessa esiintyvien kemiallisten mediaattoreiden, kuten leukotrieenien, histamiinin, verihiutaleita aktivoivan tekijän (PAF) ja serotoniinin, muodostumista ja vapautumista. Nenän allergiaoireet alkavat lievittyä 15 minuutin kuluessa lääkkeenotosta.
Atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumute
Atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta tutkittiin 4 kliinisessä tutkimuksessa, joihin osallistui allergista nuhaa sairastavia aikuisia ja nuoria. Atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta suihkutettiin yksi suihke kumpaankin sieraimeen kahdesti vuorokaudessa, ja sen todettiin lievittäneen nenäoireita (nuha, nenän tukkoisuus, aivastelu ja nenän kutina) merkitsevästi lumelääkkeeseen, pelkkään atselastiinihydrokloridiin ja pelkkään flutikasonipropionaattiin verrattuna. Se myös lievitti silmäoireita (silmien kutina, vuoto/vetistäminen ja punoitus) ja paransi potilaiden sairauteen liittyvää elämänlaatua (RQLQ-rinokonjuktiviittielämänlaatukysely) merkitsevästi kaikissa 4 tutkimuksessa.
Huomattava oireiden lievittyminen (nenäoireiden vaikeusasteen 50 %:n väheneminen) saavutettiin atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta käytettäessä merkitsevästi aiemmin (3 päivää tai enemmän) kuin markkinoilla olevaa flutikasonipropionaattinenäsumutetta käytettäessä. Atselastiinihydrokloridi/flutikasonipropionaatti-nenäsuihkeen tilastollisesti merkitsevä vaikutus flutikasonipropionaatti-nenäsuihkeeseen nähden säilyi läpi vuoden kestäneen tutkimuksen potilailla, joilla oli jatkuva krooninen allerginen nuha ja ei-allerginen/vasomotorinen nuha.
Tuoksukin siitepölyllä tehdyssä allergeenialtistuskammiotutkimuksessa havaittiin ensimmäinen tilastollisesti merkitsevä nenäoireiden lieventyminen 5 minuutin kuluttua atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutteen antamisesta (verrattuna plaseboon). 15 minuutin kuluttua atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutteen annosta 60 % potilaista raportoi oireiden pistemäärän vähentyneen kliinisesti merkittävästi, vähintään 30 %.
Farmakokinetiikka
Imeytyminen
Kun atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta suihkutettiin kahdesti kumpaankin sieraimeen (548 mikrog atselastiinihydrokloridia ja 200 mikrog flutikasonipropionaattia), huippupitoisuus plasmassa (Cmax) oli keskimäärin (± keskihajonta) 194,5 ± 74,4 pg/ml atselastiinin osalta ja 10,3 ± 3,9 pg/ml flutikasonipropionaatin osalta, ja keskimääräinen kokonaisaltistus (AUC) oli 4 217 ± 2 618 pg/ml*h atselastiinin osalta ja 97,7 ± 43,1 pg/ml*h flutikasonipropionaatin osalta. Kerta-annoksen ottamisen jälkeen huippupitoisuuden saavuttamiseen kuluvan ajan (tmax) mediaani oli 0,5 tuntia atselastiinin osalta ja 1,0 tuntia flutikasonipropionaatin osalta.
Systeeminen flutikasonipropionaattialtistus oli atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta käytettäessä noin 50 % suurempi kuin markkinoilla olevaa flutikasonipropionaattinenäsumutetta käytettäessä. Systeeminen atselastiinialtistus oli vastaava atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta ja markkinoilla olevaa atselastiininenäsumutetta käytettäessä. Näyttöä atselastiinihydrokloridin ja flutikasonipropionaatin farmakokineettisistä yhteisvaikutuksista ei todettu.
Jakautuminen
Flutikasonipropionaatin vakaan tilan jakautumistilavuus on suuri (noin 318 litraa). Lääkeaineesta 91 % sitoutuu plasman proteiineihin.
Atselastiinin jakautumistilavuus on suuri, mikä viittaa siihen, että se hakeutuu pääasiassa ääreiskudoksiin. 80–90 % lääkeaineesta sitoutuu proteiineihin. Lisäksi kummankin lääkkeen terapeuttinen ikkuna on leveä. Korvautumisreaktiot ovat siksi epätodennäköisiä.
Biotransformaatio
Flutikasonipropionaatti poistuu nopeasti isosta verenkierrosta, pääasiassa metaboloitumalla maksassa inaktiiviseksi karboksyylihappometaboliitiksi sytokromi P450:n CYP3A4-entsyymin välityksellä. Myös niellyn flutikasonipropionaatin alkureitin metabolia on runsasta. Atselastiini metaboloituu N-desmetyyliatselastiiniksi eri CYP-isoentsyymien, pääasiassa CYP3A4:n, CYP2D6:n ja CYP2C19:n kautta.
Eliminaatio
Laskimoon annetun flutikasonipropionaatin eliminaationopeus on lineaarinen 250–1 000 mikrogramman annosvälillä ja sen plasmapuhdistuma on suuri (CL = 1,1 l/min). Huippupitoisuus plasmassa pienenee noin 98 % 3–4 tunnin kuluessa, ja 7,8 tunnin terminaaliseen puoliintumisaikaan liittyy vain pieniä pitoisuuksia plasmassa. Flutikasonipropionaatin munuaispuhdistuma on hyvin vähäinen (< 0,2 %), ja alle 5 % poistuu karboksyylihappometaboliittina munuaisten kautta. Suurin osa annoksesta eliminoituu erittymällä sappeen flutikasonipropionaattina ja sen metaboliitteina.
Atselastiinin kerta-annoksen ottamisen jälkeen atselastiinin eliminaation puoliintumisaika plasmassa on noin 20–25 tuntia ja terapeuttisesti aktiivisen metaboliitin, N-desmetyyliatselastiinin, noin 45 tuntia. Erittyminen tapahtuu pääasiassa ulosteeseen. Pienten lääkemäärien viivästynyt erittyminen ulosteeseen viittaa siihen, että enterohepaattista kiertoa voi tapahtua jonkin verran.
Prekliiniset tiedot turvallisuudesta
Flutikasonipropionaatti
Yleistä toksisuutta koskevien tutkimusten löydökset olivat samankaltaisia kuin muiden glukokortikoidien yhteydessä havaitut, ja ne liittyivät suureen farmakologiseen aktiivisuuteen. Nämä löydökset eivät kuitenkaan todennäköisesti ole olennaisia, kun suositeltuja nenän kautta otettavia annoksia annetaan ihmisille, koska annokset aiheuttavat hyvin vähäisen systeemisen altistuksen. Konventionaalisissa genotoksisuuskokeissa flutikasonipropionaatilla ei ole havaittu olevan genotoksisia vaikutuksia. Kasvainten ilmaantuvuuden ei myöskään havaittu suurentuneen hoidon vuoksi kaksi vuotta kestäneissä inhalaatiomuotoa koskeneissa tutkimuksissa, jotka tehtiin rotilla ja hiirillä.
Eläinkokeissa glukokortikoidien on osoitettu aiheuttavan epämuodostumia, kuten suulakihalkioita ja sikiön kasvuhidastumia. Nämäkään löydökset eivät kuitenkaan ole todennäköisesti olennaisia, kun suositeltuja nenän kautta otettavia annoksia annetaan ihmisille, koska annokset aiheuttavat hyvin vähäisen systeemisen altistuksen (ks. kohta Farmakokinetiikka).
Atselastiinihydrokloridi
Atselastiinihydrokloridilla ei havaittu herkistäviä ominaisuuksia marsuilla tehdyissä kokeissa. Atselastiinilla ei havaittu genotoksisia ominaisuuksia in vitro- ja in vivo -kokeissa eikä karsinogeenisia ominaisuuksia rotilla ja hiirillä tehdyissä kokeissa. Kun atselastiinia annettiin koiras- ja naarasrotille suun kautta yli 3 mg/kg/vrk, niiden hedelmällisyysindeksi heikkeni annoksesta riippuvasti; koiraiden ja naaraiden sukupuolielimissä ei havaittu lääkeaineeseen liittyviä muutoksia pitkäaikaistoksisuutta koskeneissa tutkimuksissa. Rotilla, hiirillä ja kaniineilla ilmeni kuitenkin alkiotoksisuutta ja teratogeenisia vaikutuksia vain emoille toksisilla annoksilla (esim. luuston epämuodostumia havaittiin rotilla ja hiirillä, kun annos oli 68,6 mg/kg/vrk).
Atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumute
Kun atselastiinihydrokloridi/flutikasonipropionaatti ‑nenäsumutetta annettiin nenän kautta rotille enintään 90 vuorokauden ajan ja koirille 14 vuorokauden ajan toistuvan altistuksen toksisuutta koskeneissa tutkimuksissa, ei havaittu sellaisia haittavaikutuksia, joita ei olisi jo ilmennyt, kun valmisteen vaikuttavia aineita on käytetty erikseen.
Farmaseuttiset tiedot
Apuaineet
Glyseroli
Mikrokiteinen selluloosa (E460)
Karmelloosinatrium (E466)
Dinatriumedetaatti
Polysorbaatti 80 (E433)
Bentsalkoniumkloridi
Fenyylietyylialkoholi
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Avatun pullon kestoaika (ensimmäisen käyttökerran jälkeen): 6 kuukautta.
Säilytys
Älä säilytä kylmässä. Ei saa jäätyä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
AZEFLONE nenäsumute, suspensio
125/50 mikrog/annos (L:ei) 120 annosta (23 g) (4,13 €), 3 x 120 annosta (14,03 €)
PF-selosteen tieto
Tyypin I ruskeasta lasista valmistettu pullo, jossa on suihkepumppu, polypropeeninenäkappale (laukaisin) ja suojakorkki. Pullo sisältää 23 g (vähintään 120 annosta) suspensiota.
Pakkauskoot:
Yksi 25 ml:n pullo, joka sisältää 23 g (vähintään 120 annosta) suspensiota.
Monipakkaus, joka sisältää 69 g (3 pulloa, joissa 23 g) nenäsumute, suspensiota.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen, tasakoosteinen suspensio.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia hävittämisen suhteen.
Korvattavuus
AZEFLONE nenäsumute, suspensio
125/50 mikrog/annos 120 annosta, 3 x 120 annosta
- Peruskorvaus (40 %).
ATC-koodi
R01AD58
Valmisteyhteenvedon muuttamispäivämäärä
08.08.2023
Yhteystiedot
PL 1310, Puolikkotie 8, 02230 Espoo (käyntiosoite)
00101 Helsinki
0207 416 888
