XEMBIFY injektioneste, liuos 200 mg/ml
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Ihmisen normaali immunoglobuliini (SCIg)
Yksi millilitra sisältää:
Ihmisen normaalia immunoglobuliinia 200 mg
(puhtaus: vähintään 98-prosenttisesti tyypin G immunoglobuliinia (IgG))
Yksi 5 ml:n injektiopullo sisältää: 1 g ihmisen normaalia immunoglobuliinia
Yksi 10 ml:n injektiopullo sisältää: 2 g ihmisen normaalia immunoglobuliinia
Yksi 20 ml:n injektiopullo sisältää: 4 g ihmisen normaalia immunoglobuliinia
Yksi 50 ml:n injektiopullo sisältää: 10 g ihmisen normaalia immunoglobuliinia
IgG:n jakautuminen alaluokkiin (likimääräiset arvot):
IgG1 .............. 62 %
IgG2 ............. 30 %
IgG3 ............. 4,3 %
IgG4 ............. 3,2 %
Valmiste sisältää IgA:ta enintään 160 mikrogrammaa/ml.
Valmistettu ihmisluovuttajien plasmasta.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos, ihon alle.
Kliiniset tiedot
Käyttöaiheet
Korvaushoito aikuisille, lapsille ja nuorille (0–18-vuotiaille) seuraavissa käyttöaiheissa:
- Primaarinen immuunivajausoireyhtymä (PID) ja heikentynyt vasta-ainetuotanto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Hypogammaglobulinemia ja toistuvat bakteeri-infektiot kroonista lymfaattista leukemiaa (CLL) sairastavilla potilailla, joiden kohdalla antibioottiestohoito on epäonnistunut tai vasta-aiheista.
- Hypogammaglobulinemia ja toistuvat bakteeri-infektiot multippelia myeloomaa (MM) sairastavilla potilailla.
- Hypogammaglobulinemia ennen allogeenisten hematopoieettisten kantasolujen siirtoa (HSCT) tai sen jälkeen.
Ehto
Korvaushoito on aloitettava ja sitä on seurattava immuunipuutostilojen hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Korvaushoidon aloittaa ja sitä valvoo immuunipuutosten hoitoon perehtynyt lääkäri.
Annostus
Annostus ja annosohjelma riippuvat käyttöaiheesta.
Korvaushoito
Valmiste annetaan ihon alle.
Korvaushoidossa annos voidaan joutua sovittamaan yksilöllisesti potilaan farmakokineettisen ja kliinisen vasteen mukaan. Seuraavat annosohjeet ovat viitteellisiä.
Annostuksella tulisi saavuttaa IgG-minimipitoisuus, joka on vähintään 5–6 g/l (ennen seuraavaa infuusiota mitattuna), ja joka pyritään pitämään seerumin iänmukaisella IgG-viitealueella. Kyllästysannos, joka on vähintään 0,2–0,5 g/painokilo (1–2,5 ml/kg), voi olla tarpeen. Se täytyy ehkä jakaa useammalle päivälle siten, että enimmäisvuorokausiannos on 0,1–0,15 g/painokilo.
Kun IgG-pitoisuudet ovat saavuttaneet vakaan tilan, ylläpitoannoksia annetaan tasaisin välein (noin kerran viikossa) siten, että kumulatiivinen kuukausittainen annos on noin 0,4–0,8 g/painokilo. Jokainen kerta-annos on ehkä pistettävä eri anatomiselle alueelle.
Minimipitoisuudet on mitattava ja arvioitava, jos potilaalla ilmenee infektio. Infektioiden vähentämiseksi voi olla tarpeen suurentaa annosta ja tähdätä suurempiin minimipitoisuuksiin.
Iäkkäät
Annos perustuu kehon painoon, ja sitä säädetään yllä mainittujen tilojen kliinisen hoitotuloksen mukaan, joten iäkkäiden potilaiden annos on sama kuin 18–65-vuotiaiden potilaiden.
Kliinisissä tutkimuksissa Xembify-valmistetta arvioitiin viidellä yli 65-vuotiaalla PID-potilaalla, eikä annosta tarvinnut erityisesti säätää seerumin IgG-tavoitepitoisuuksien saavuttamiseksi.
Pediatriset potilaat
Lasten ja nuorten (0–18-vuotiaiden) annostus on sama kuin aikuisilla, sillä annostus perustuu kussakin käyttöaiheessa kehon painoon, ja sitä säädetään korvaushoidon käyttöaiheissa kliinisen hoitotuloksen mukaan.
Xembify-valmistetta arvioitiin 43:lla 2–16-vuotiaalla pediatrisella PID-potilaalla, joista 28 oli enintään 12-vuotiaita. Annoksen sovittaminen erityisesti pediatrisille potilaille ei ollut tarpeen seerumin IgG-tavoitepitoisuuksien saavuttamiseksi.
Antotapa
Vain ihon alle.
Hoidon kotona annettavilla ihonalaisilla infuusioilla aloittaa ja sitä seuraa terveydenhuollon ammattilainen, jolla on kokemusta potilaiden kotihoidon ohjaamisesta. Lääkkeenantoon voidaan käyttää immunoglobuliinien ihonalaiseen antoon soveltuvia infuusiopumppuja. Potilasta tai häntä hoitavaa henkilöä täytyy ohjeistaa infuusiopumpun käytöstä, infuusiotekniikoista, hoitopäiväkirjan pitämisestä sekä vaikeiden haittavaikutusten tunnistamisesta ja siitä, mitä niiden ilmaantuessa tulee tehdä.
Xembify voidaan pistää vatsan, reiden, olkavarren ja lantion sivun alueelle.
Suositeltu infuusion aloitusnopeus riippuu potilaan yksilöllisistä tarpeista. Infuusion antonopeus ja infuusion volyymi antokohtaa kohden riippuu potilaan sietokyvystä.
Aloitusnopeudeksi suositellaan antonopeutta 10 ml/h/infuusiokohta. Jos se on hyvin siedetty (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), antonopeutta voidaan lisätä vähintään 10 minuutin välein enintään tasolle 20 ml/h/infuusiokohta lapsipotilaille ja enintään 25 ml/h/infuusiokohta aikuisille kahden ensimmäisen infuusion aikana.
Jos potilas sietää kaksi infuusiota hyvin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), infuusionopeus voidaan vähitellen suurentaa tasolle 35 ml/h/infuusiokohta.
Samanaikaisesti voidaan käyttää useampaa kuin yhtä pumppua. Eri infuusiokohtiin infusoiduissa valmistemäärissä on vaihtelua. Vauvoilla ja lapsilla infuusiokohtaa voidaan vaihtaa 5–15 ml:n välein. Aikuisten kohdalla yli 30 ml:n annokset voidaan jakaa potilaan toiveiden mukaan. Infuusiokohtien enimmäismäärää ei ole rajoitettu. Infuusiokohtien on oltava vähintään 5 cm:n etäisyydellä toisistaan. Infuusiokohtia tulee vaihdella, ja luu-ulokkeita tulee välttää.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Xembify-valmistetta ei saa antaa verisuoneen eikä lihakseen.
Potilaat, joille on kehittynyt anafylaktinen tai vaikea systeeminen reaktio ihmisen immuuniglobuliinin annon yhteydessä.
Potilaat, joilla on IgA-puutos ja IgA-vasta-aineita ja anamneesissa yliherkkyys ihmisen immuuniglobuliinihoidolle.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Jos Xembify-valmistetta annetaan vahingossa verisuoneen, potilas voi joutua sokkiin.
Kohdassa Annostus ja antotapa mainittua suositeltua infuusionopeutta on noudatettava huolellisesti. Potilaita on seurattava tiiviisti ja tarkkailtava huolellisesti mahdollisten oireiden varalta koko infuusiojakson ajan.
Tiettyjä haittavaikutuksia voi esiintyä useammin potilailla, jotka saavat ihmisen normaalia immunoglobuliinia ensimmäistä kertaa, tai harvinaisissa tapauksissa ihmisen normaalia immunoglobuliinia sisältävää lääkettä vaihdettaessa tai kun edellisestä infuusiosta on pitkä aika.
Mahdolliset komplikaatiot voidaan usein välttää seuraavilla keinoilla:
- Valmiste infusoidaan aluksi hitaasti (enintään 25 ml/h/infuusiokohta).
-
Potilasta seurataan huolellisesti mahdollisten oireiden varalta koko infuusiojakson ajan.
Erityisesti potilaita, jotka eivät ole ennen saaneet ihmisen normaalia immunoglobuliinia tai jotka ovat aiemmin käyttäneet jotain toista immunoglobuliinivalmistetta, sekä potilaita, joiden edellisestä infuusiosta on kulunut pitkä aika, on tarkkailtava ensimmäisen infuusion ajan ja tunti ensimmäisen infuusion jälkeen mahdollisten haittavaikutusoireiden havaitsemiseksi.
Kaikkia muita potilaita on seurattava vähintään 20 minuutin ajan annon jälkeen.
Mikäli haittavaikutuksia ilmenee, on antonopeutta joko pienennettävä tai infuusio lopetettava. Tarvittava hoito määräytyy haittavaikutuksen luonteen ja vaikeusasteen perusteella. Allergiset tai anafylaktiset reaktiot vaativat infuusion välitöntä keskeytystä.
Sokkitilanteissa potilaalle annetaan tavanomaista lääketieteellistä hoitoa.
Yliherkkyys
Todelliset allergiset reaktiot ovat harvinaisia. Niitä voi ilmetä erityisesti potilailla, joilla on IgA-vasta-aineita, ja heitä on hoidettava erityistä varovaisuutta noudattaen. Potilaita, joilla on IgA-vasta-aineita ja joille hoito ihon alle annettavalla IgG-lääkkeellä on ainoa vaihtoehto, on seurattava tarkasti Xembify-hoidon aikana.
Ihmisen normaali immunoglobuliini voi harvoin aiheuttaa verenpaineen laskun ja anafylaktisen reaktion jopa potilaille, jotka sietivät aiempaa hoitoa ihmisen normaalilla immunoglobuliinilla.
Tromboembolia
Immunoglobuliinien käyttöön on liittynyt valtimoiden ja laskimoiden tromboembolisia tapahtumia, mukaan lukien sydäninfarkteja, aivohalvauksia, syviä laskimotukoksia ja keuhkoembolioita. Potilaiden riittävästä nesteytyksestä on huolehdittava ennen immunoglobuliinien käyttöä. Varovaisuutta on noudatettava sellaisten potilaiden kohdalla, joilla on tromboottisten tapahtumien riskitekijöitä (kuten estrogeenien käyttö, korkea ikä, hypertensio, diabetes mellitus tai aiempi verisuonisairaus tai tromboottisia episodeja, hankinnainen tai perinnöllinen trombofiliasairaus, pitkiä immobilisointijaksoja, vaikea hypovolemia, veren viskositeettiä lisäävä sairaus).
Potilaille on kerrottava tromboembolisten tapahtumien ensioireista, kuten hengenahdistuksesta, raajan kivusta ja turvotuksesta, fokaalisista neurologisista häiriöistä ja rintakivusta, ja heitä on neuvottava ottamaan välittömästi yhteyttä lääkäriin, jos oireita ilmenee.
Aseptinen meningiittioireyhtymä (AMS)
Aseptista meningiittioireyhtymää on ilmoitettu ihon alle annetun immunoglobuliinihoidon yhteydessä. Oireet alkavat yleensä useiden tuntien tai 2 päivän sisällä hoidon antamisesta. AMS voi olla naisilla yleisempi kuin miehillä. AMS:lle tyypillisiä merkkejä ja oireita ovat: voimakas päänsärky, niskajäykkyys, uneliaisuus, kuume, valonarkuus, pahoinvointi ja oksentelu. Potilaille, joilla esiintyy AMS:n merkkejä ja oireita, on tehtävä perusteellinen neurologinen tutkimus (mukaan lukien aivo-selkäydinnesteen tutkimus) meningiitin muiden syiden poissulkemiseksi. Immunoglobuliinihoidon keskeytys voi johtaa AMS:n remissioon useiden päivien kuluessa ilman jälkitiloja.
Potilaille on kerrottava AMS:n ensioireista. AMS:ää voi esiintyä useammin suuria annoksia ja/tai nopeaa infuusiota käytettäessä.
Munuaisten toimintahäiriö/vajaatoiminta
Vaikeita munuaisiin kohdistuvia haittavaikutuksia on raportoitu immunoglobuliinihoitoa saavilla potilailla, erityisesti sakkaroosia sisältäviä valmisteita käytettäessä (Xembify ei sisällä sakkaroosia). Näitä vaikutuksia ovat akuutti munuaisten vajaatoiminta, akuutti tubulusnekroosi, proksimaalinen tubulaarinen nefropatia ja osmoottinen nefroosi. Munuaiskomplikaatioiden riskiä suurentavia tekijöitä ovat esimerkiksi olemassa oleva munuaisten vajaatoiminta, diabetes mellitus, hypovolemia, munuaistoksisten lääkevalmisteiden samanaikainen käyttö, yli 65 vuoden ikä, sepsis, hyperviskositeetti ja paraproteinemia.
Myös potilaita, joilla on heikentynyt munuaisten toiminta, tulee seurata. Tämä koskee etenkin potilaita, joilla on munuaisten vajaatoiminta tai joilla on akuutin munuaisten vajaatoiminnan riski.
Vaikutus serologisiin testeihin
Immunoglobuliinin injektoinnin jälkeen useiden passiivisesti siirtyvien vasta-aineiden ohimenevä lisääntyminen potilaan veressä voi aiheuttaa harhaanjohtavia positiivisia tuloksia serologisissa testeissä.
Vasta-aineiden passiivinen siirtyminen erytrosyyttiantigeeneihin (kuten A:han, B:hen ja D:hen) voi aiheuttaa virheellisiä tuloksia joissakin serologisissa testeissä, joissa tutkitaan punasoluvasta-aineita, kuten suorassa antiglobuliinitestissä (DAT, suora Coombsin testi). Suuria annoksia käytettäessä tai muiden kuin O-veriryhmän kohdalla voi esiintyä hemolyysiä, joten seurantaa suositellaan.
Tarttuvat taudinaiheuttajat
Kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita, infektiot estetään vakiomenetelmillä. Luovuttajat valitaan tarkoin, yksittäisistä luovutuksista ja plasmapooleista seulotaan infektioiden erityiset tunnusmerkit, ja valmistuksessa käytetään tehokkaita virusten inaktivointi-/poistomenetelmiä. Varotoimista huolimatta ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita käytettäessä tarttuvien taudinaiheuttajien siirtymisriskiä ei voida täysin poissulkea. Tämä koskee myös tuntemattomia ja uusia viruksia sekä muita taudinaiheuttajia.
Käytetyt menetelmät tehoavat vaipallisiin viruksiin, kuten ihmisen immuunikatovirukseen (hiv), hepatiitti B -virukseen (HBV) ja hepatiitti C -virukseen (HCV), sekä vaipattomaan hepatiitti A -virukseen (HAV). Menetelmien teho vaipattomiin viruksiin, kuten parvovirus B19:ään, voi olla rajallinen.
On vakuuttavaa kliinistä näyttöä siitä, että hepatiitti A tai parvovirus B19 eivät siirry immunoglobuliinien mukana, ja voidaan myös olettaa, että vasta-ainesisältö vaikuttaa merkittävässä määrin virusturvallisuuteen.
On hyvin suositeltavaa merkitä valmisteen nimi ja eränumero muistiin joka kerta, kun Xembify-valmistetta annetaan potilaalle. Näin yhteys potilaan ja lääkkeen valmiste-erän välillä säilyy.
Pediatriset potilaat
Mainitut varoitukset ja varotoimet koskevat sekä aikuisia että lapsia.
Yhteisvaikutukset
Eläviä heikennettyjä viruksia sisältävät rokotteet
Immunoglobuliinin anto voi heikentää eläviä heikennettyjä viruksia sisältävien rokotteiden tehoa vähintään 6 viikon ja enintään 3 kuukauden pituisen jakson ajan. Tällaisia rokotteita ovat esimerkiksi tuhkarokko-, vihurirokko-, sikotauti- ja vesirokkorokote. Tämän lääkevalmisteen antamisen jälkeen on odotettava 3 kuukautta, ennen kuin potilaalle saa antaa eläviä heikennettyjä viruksia sisältäviä rokotteita. Tuhkarokkorokotteen osalta tämä tehon heikkeneminen voi koskea jopa 1 vuoden pituista jaksoa, minkä vuoksi tuhkarokkorokotteen saavien potilaiden on tarkistutettava vasta-ainetilansa.
Pediatriset potilaat
Mainitut yhteisvaikutukset koskevat sekä aikuis- että lapsipotilaita.
Iäkkäät
Mainitut yhteisvaikutukset koskevat myös iäkkäitä potilaita.
Raskaus ja imetys
Raskaus
Tämän lääkkeen turvallisuutta raskauden aikana ei ole vahvistettu kontrolloiduissa kliinisissä tutkimuksissa, minkä vuoksi valmistetta tulee antaa varoen raskaana oleville naisille ja imettäville äideille.
Immunoglobuliinivalmisteiden on osoitettu läpäisevän istukan; tätä tapahtuu enenevässä määrin viimeisen raskauskolmanneksen aikana. Immunoglobuliineista saadut kliiniset kokemukset viittaavat siihen, ettei haitallisia vaikutuksia raskauden kulkuun, sikiöön tai vastasyntyneeseen ole odotettavissa.
Imetys
Immunoglobuliinit erittyvät maitoon ja voivat osaltaan suojata vastasyntynyttä limakalvojen kautta saatavilta taudinaiheuttajilta.
Hedelmällisyys
Immunoglobuliineista saadun kliinisen kokemuksen perusteella hedelmällisyyteen kohdistuvia haitallisia vaikutuksia ei ole odotettavissa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Xembify-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn; esim. heitehuimausta voi esiintyä (ks. kohta Haittavaikutukset). Potilaiden, joilla esiintyy haittavaikutuksia hoidon aikana, on odotettava niiden häviämistä ennen autolla ajamista tai koneiden käyttöä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Haittavaikutuksia, kuten vilunväristyksiä, päänsärkyä, heitehuimausta, kuumetta, oksentelua, allergisia reaktioita, pahoinvointia, nivelkipua, matalaa verenpainetta ja keskivaikeaa alaselkäkipua, voi esiintyä ajoittain.
Ihmisen normaalit immunoglobuliinit voivat joskus harvoin aiheuttaa äkillistä verenpaineen laskua ja yksittäistapauksissa anafylaktisen sokin, vaikka potilaalla ei olisi ilmennyt mitään yliherkkyysreaktioita aiemmalla antokerralla.
Infuusiokohtien paikallisia reaktioita, kuten turvotusta, aristusta, punoitusta, kovettumia, paikallista kuumotusta, kutinaa, mustelmanmuodostusta ja ihottumaa voi esiintyä usein.
Tarttuvia taudinaiheuttajia koskevat turvallisuustiedot, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutustaulukko
Ihon alle annetun Xembify-valmisteen turvallisuutta arvioitiin kahdessa prospektiivisessa, avoimessa, kontrolloimattomassa vaiheen 3 monikeskustutkimuksessa 110:lla 2–72-vuotiaalla mies- tai naispuolisella tutkittavalla, joilla oli primaarinen immuunivajaus (PID) ja jotka olivat aiemmin saaneet IVIg/SCIg-hoitoa. Tutkittavista 49 osallistui pohjoisamerikkalaiseen ja 61 eurooppalaiseen tutkimukseen.
Molemmissa tutkimuksissa yhteensä 8 tutkittavaa lopetti Xembify-hoidon haittavaikutusten takia. Kaikki haittavaikutukset olivat vaikeusasteeltaan lieviä tai keskivaikeita synnynnäisestä poikkeavuudesta johtuvaa aorttaläpän vuotoa lukuun ottamatta.
Seuraavassa taulukossa noudatetaan MedDRAn elinjärjestelmäluokitusta (elinjärjestelmäluokitus ja suositellut termit).
Yleisyydet on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä (mikään haittavaikutuksista ei ollut vakava).
Xembify-valmisteen haittavaikutukset, joita esiintyi vähintään 1 %:lla tutkittavista infuusiota kohden kliinisissä tutkimuksissa
| MedDRA-elinjärjestelmäluokka (SOC) | Haittavaikutus | Yleisyys tutkittavaa kohdena (N = 110 tutkittavaa) | Yleisyys infuusiota kohdenb (N = 4 098 infuusiota) |
| Infektiot | Nuha | 3 (2,7 %) yleinen | 4 (0,0010) melko harvinainen |
| Hermosto | Päänsärky | 4 (3,6 %) yleinen | 4 (0,0010) melko harvinainen |
| Ruoansulatuselimistö | Ripuli | 3 (2,7 %) yleinen | 3 (0,0007) harvinainen |
| Pahoinvointi | 2 (1,8 %) yleinen | 2 (0,0005) harvinainen | |
| Iho ja ihonalainen kudos | Papula | 2 (1,8 %) yleinen | 2 (0,0005) harvinainen |
| Kutina | 2 (1,8 %) yleinen | 2 (0,0005) harvinainen | |
| Luusto, lihakset ja sidekudos | Nivelkipu | 3 (2,7 %) yleinen | 3 (0,0007) harvinainen |
| Selkäkipu | 3 (2,7 %) yleinen | 3 (0,0007) harvinainen | |
| Yleisoireet ja antopaikassa todettavat haitat | Infuusiokohdan paikallisreaktio | 35 (31,8 %) hyvin yleinen | 125 (0,0305) yleinen |
| Kuume | 2 (1,8 %) yleinen | 4 (0,0010) melko harvinainen | |
| Tutkimukset | Veren immunoglobuliini G -pitoisuuden lasku | 2 (1,8 %) yleinen | 2 (0,0005) harvinainen |
a Yleisyys tutkittavaa kohden on laskettu jakamalla niiden tutkittavien määrä, joiden saamilla haittavaikutuksilla (lukuun ottamatta infektioita) saattoi ainakin mahdollisesti olla syy-yhteys Xembify-valmisteeseen, tutkittavien kokonaismäärällä.
b Yleisyys infuusiota kohden on laskettu jakamalla niiden infuusioiden määrä, joihin liittyneillä haittavaikutuksilla (lukuun ottamatta infektioita) saattoi ainakin mahdollisesti olla syy-yhteys Xembify-valmisteeseen, infuusioiden kokonaismäärällä.
Myyntiluvan myöntämisen jälkeiset kokemukset
Seuraavia haittavaikutuksia on havaittu ja raportoitu Xembify-valmisteen myyntiluvan myöntämisen jälkeisessä käytössä: infuusiokohdan paikallisreaktiot, kuten punoitus ja turvotus, hengenahdistus, väsymys, kipu, pahoinvointi ja päänsärky. Näiden reaktioiden yleisyyttä ei aina voida arvioida luotettavasti.
Pediatriset potilaat
Pediatrisilla potilailla esiintyvien haittavaikutusten yleisyyden, tyypin ja vaikeusasteen odotetaan olevan samoja kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen seurauksia ei tunneta.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: immuuniseerumit ja immunoglobuliinit: immunoglobuliinit, ihmisen normaali immunoglobuliini ekstravaskulaariseen käyttöön, ATC-koodi: J06BA01
Vaikutusmekanismi
Xembify sisältää laajakirjoisesti opsonisoivia ja neutraloivia immunoglobuliini G (IgG) -vasta-aineita bakteereja, viruksia, loisia, mykoplasmoja sekä niiden toksiineja vastaan. Näiden vasta-aineiden roolia ja Xembify-valmisteen vaikutusmekanismia ei täysin ymmärretä.
Farmakodynaamiset vaikutukset
Ihmisen normaali immunoglobuliini sisältää enimmäkseen immunoglobuliini G:tä (IgG), ja siinä on laaja kirjo vasta-aineita taudinaiheuttajia vastaan.
Ihmisen normaali immunoglobuliini sisältää normaaliväestössä esiintyviä IgG-vasta-aineita. Se valmistetaan yleensä vähintään 1 000 luovuttajan yhdistetystä plasmasta. Sen immunoglobuliini G:n alaluokkien jakauma vastaa läheisesti vastaavaa jakaumaa ihmisen luonnollisessa plasmassa. Riittävät annokset tätä lääkevalmistetta voivat palauttaa poikkeuksellisen matalat immunoglobuliini G:n pitoisuudet normaalialueelle.
Kliininen teho PID:n hoidossa
Eurooppalaisessa tutkimuksessa yhteensä 61:lle primaarista immuunivajausoireyhtymää sairastavalle, iältään 2–69-vuotiaalle tutkittavalle annettiin Xembify-hoitoa enintään 52 viikon ajan. Viikoittain annettu keskimääräinen annos oli 125,5 mg/painokilo. Hoitovaiheen aikana saavutettu keskimääräinen, pitkäkestoinen IgG-minimipitoisuus oli 947,64 mg/dl. Tutkittaville annettiin yhteensä 3 045 viikoittaista Xembify-infuusiota. Vakavien bakteeri-infektioiden vuotuinen esiintyvyys oli 0,017 potilasvuotta kohden (1-puolisen 99 %:n luottamusvälin yläraja 0,036). Yhtä keuhkokuumeen saanutta tutkittavaa hoidettiin suun kautta annettavilla antibiooteilla avohoidossa, ja tila korjaantui 4 päivässä.
Pohjoisamerikkalaisessa tutkimuksessa yhteensä 49:lle primaarista immuunivajausoireyhtymää sairastavalle, iältään 2–72-vuotiaalle tutkittavalle annettiin Xembify-hoitoa enintään 24 viikon ajan. Viikoittain annettu keskimääräinen annos oli 178,9 mg/painokilo. Hoitovaiheen aikana saavutettu keskimääräinen, pitkäkestoinen IgG-minimipitoisuus oli 1 244,84 mg/dl. Tutkittaville annettiin yhteensä 1 053 viikoittaista Xembify-infuusiota. Vakavien bakteeri-infektioiden vuotuinen esiintyvyys Xembify-hoidon aikana oli 0,049 potilasvuotta kohden (1-puolisen 99 %:n luottamusvälin yläraja 0,110), minkä aiheutti yhden tutkittavan kissan puremasta saama sepsis.
Pediatriset potilaat
Xembify-valmisteen turvallisuus ja tehokkuus on varmistettu pediatrisilla tutkittavilla. Xembify-valmistetta arvioitiin 28:lla 2–12-vuotiaalla pediatrisella PID-potilaalla ja 15:llä yli 12-vuotiaalla mutta alle 17-vuotiaalla pediatrisella potilaalla. Farmakokinetiikassa, turvallisuudessa ja tehossa ei havaittu eroja pediatristen potilaiden ja aikuisten välillä. Annoksen räätälöiminen erityisesti pediatrisille potilaille ei ollut tarpeen seerumin IgG-tavoitepitoisuuksien saavuttamiseksi. Farmakodynaamisissa piirteissä ei havaittu eroja PID:tä sairastavien aikuisten ja pediatristen tutkimuspotilaiden välillä.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Xembify-valmisteen käytöstä primaarisen immuunivajauksen hoidossa kaikissa pediatrisissa potilasryhmissä keskosten ja/tai täysiaikaisten vastasyntyneiden (0–27 päivän ikäisten) sekä vauvojen ja leikki-ikäisten (28 päivän –23 kuukauden ikäisten) osalta. Ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa.
Iäkkäät
Turvallisuudessa tai tehossa ei havaittu eroja yli 65-vuotiaiden PID-potilaiden ja 18–65-vuotiaiden PID-potilaiden välillä. Kliinisissä tutkimuksissa Xembify-valmistetta arvioitiin viidellä yli 65‑vuotiaalla PID-potilaalla.
Farmakokinetiikka
Imeytyminen
Kun Xembify-valmistetta annetaan ihon alle, huippupitoisuudet seerumissa saavutetaan noin kolmen päivän kuluttua.
Jakautuminen
Viikoittainen annostelu
Xembify-valmisteella tehdyssä eurooppalaisessa kliinisessä tutkimuksessa (n = 61) tutkittavat saavuttivat pitkäkestoiset IgG-minimipitoisuudet (mediaani 909,10 mg/dl) 52 viikon pituisen jakson aikana, kun viikoittaisen annoksen mediaani oli 113,0 mg/painokilo. Xembify-valmisteella tehdystä kliinisestä tutkimuksesta saadut tiedot osoittavat, että seerumin IgG-minimipitoisuudet säilyvät annostuksella 400–848 mg/painokilo/4 viikkoa.
Yhteenveto kokonais-IgG:n minimipitoisuuksista vakaassa tilassa aiemman hoito-ohjelman ja ihon alle annettavan valmisteen käytön aikana (IgG-populaatio)
| Minimipitoisuus aiemman hoito-ohjelman aikana (mg/dl) | Minimipitoisuus ihon alle annettavan valmisteen käytön aikana (mg/dl) | ||
| Tilasto | Keskimääräinen minimipitoisuusa | Keskimääräinen minimipitoisuusb | Keskimääräisten minimipitoisuuksien suhde, ihon alle annettava hoito / aiempi hoito-ohjelma |
| n | 59 | 59 | 59 |
| Keskiarvo ± SD | 891,37 ± 165,943 | 947,64 ± 150,262 | 1,078 ± 0,1425 |
| CV % | 18,6 | 15,9 | 13,22 |
| Mediaani | 874,00 | 909,10 | 1,050 |
| min., maks. | 516,5; 1 255,0 | 629,2; 1 340,8 | 0,83; 1,54 |
| Geometrinen keskiarvo | 875,96 | 936,48 | 1,069 |
a Aiemman hoitovaiheen keskimääräinen minimipitoisuus on laskettu aiemmalla kaupallisesti saatavana olevalla IgG-korvaushoidolla saavutettujen minimipitoisuuksien keskiarvona. b Ihon alle (s.c.) annettavan valmisteen (Xembify-valmisteen) käytön aikainen keskimääräinen minimipitoisuus on laskettu käynneillä SC#17, SC#18, SC#20, SC#24, SC#28, SC#32, SC#36, SC#40, SC#44, SC#48, SC#52 ja SC#53 mitattujen minimipitoisuuksien keskiarvona. | |||
Xembify-valmisteen farmakokinetiikkaa arvioitiin 27 aikuisella PID-potilaalla vaiheen 3 teho- ja turvallisuustutkimuksessa. Farmakokineettiset tulokset on esitetty seuraavassa taulukossa.
Seerumin IgG-kokonaispitoisuuden farmakokineettiset parametrit Xembify-valmisteen osalta (farmakokineettinen populaatio)
| Tilasto | Farmakokineettiset parametrit | ||
AUC0-7 vrk (h*mg/dl) | Cmax (mg/dl) | Tmax (h) | |
| n | 27 | 27 | 27 |
| Keskiarvo (SD) | 177 445,7 (31 081,89) | 1 126,6 (190,11) | 50,78 (44,596) |
| CV % | 18 | 17 | 87,8 |
| Mediaani | 172 369,0 | 1 080,0 | 68,80 |
| min., maks. | 132 728; 250 410 | 828: 1 610 | 0,0; 166,8 |
| Geometrinen keskiarvo | 175 002,1 | 1 112,2 | |
| Geometrisen keskiarvon 90 %:n CI | 165 652,5; 184 879,5 | 1 055,1; 1 172,4 | |
| CI = luottamusväli; CV = variaatiokerroin; SD = keskihajonta | |||
Annostelu kerran viikossa, kahden viikon välein tai useammin (2–7 kertaa viikossa)
Xembify-valmisteen kahden viikon välein tai useammin tapahtuvan annostelun farmakokinetiikkaa luonnehdittiin populaatiofarmakokinetiikkaan perustuvan mallinnuksen ja simulaation avulla. Seerumin IgG-pitoisuuksia koskevat tiedot koostuivat 1 841 näytteestä, jotka olivat peräisin 95 yksittäiseltä PID:tä sairastavalta pediatriselta potilaalta ja aikuispotilaalta. Viikoittaiseen annosteluun verrattuna farmakokineettisen mallinnuksen ja simulaation pohjalta ennustettiin, että Xembify-valmisteen antaminen kahden viikon välein annoksena, joka on viikkoannokseen nähden kaksinkertainen, johtaa päällekkäiseen IgG-altistukseen koko kahden viikon jakson aikana. Lisäksi farmakokineettisen mallinnuksen ja simulaation pohjalta ennustettiin, että samaa viikoittaista kokonaisannosta käytettäessä Xembify-infuusioiden antaminen 2–7 kertaa viikossa (usein toistuva annostelu) johtaa myös päällekkäiseen IgG-altistukseen koko hoitovälin aikana.
Eliminaatio
IgG ja IgG-kompleksit pilkkoutuvat retikuloendoteliaalijärjestelmän soluissa.
Pediatriset potilaat
Immunoglobuliinien vaikutuksessa ei ole teoreettisia eikä todettuja eroja lasten ja aikuisten välillä.
Prekliiniset tiedot turvallisuudesta
Immunoglobuliinit ovat ihmisen elimistöön normaalisti kuuluvia aineita. Toksisuutta koskevien ei-kliinisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Glysiini (E 640)
Polysorbaatti 80 (E 433)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Liuos suositellaan käytettäväksi välittömästi, kun injektiopullo on avattu.
Säilytys
-
Säilytä jääkaapissa (2 °C – 8 °C).
- Xembify-valmistetta voidaan säilyttää enintään 25 °C:n lämpötilassa enintään 6 kuukauden ajan milloin tahansa ennen viimeistä käyttöpäivämäärää.
- Päivänä, jona lääke poistetaan jääkaapista, merkitse kotelossa olevaan kohtaan ”Käyt. viim.” joko 6 kuukauden kuluttua tuleva päivämäärä tai kotelon kanteen painettu viimeinen käyttöpäivämäärä (näistä kahdesta se, joka tulee ensin).
- Jos lääkettä säilytetään huoneenlämmössä, sitä ei saa laittaa takaisin jääkaappiin. Käytä lääke ennen ”Käyt. viim.” -kohtaan merkittyä päivämäärää tai hävitä se.
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
- Anna valmiste mahdollisimman pian sen jälkeen, kun Xembify on siirretty injektiopullosta ruiskuun.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
XEMBIFY injektioneste, liuos
200 mg/ml (L:ei) 5 ml (85,65 €), 10 ml (164,80 €), 20 ml (314,17 €), 50 ml (756,77 €)
PF-selosteen tieto
5, 10, 20 tai 50 ml liuosta kirkkaasta lasista valmistetussa injektiopullossa, jossa on klorobutyylitulppa, alumiinisinetti, muovikorkki ja pakkauksen avaamattomuuden osoittava sinetti.
Pakkauskoot:
1 injektiopullo, joka sisältää 1 g ihmisen normaalia immunoglobuliinia 5 ml:ssä liuosta ihonalaista injektiota varten
1 injektiopullo, joka sisältää 2 g ihmisen normaalia immunoglobuliinia 10 ml:ssä liuosta ihonalaista injektiota varten
1 injektiopullo, joka sisältää 4 g ihmisen normaalia immunoglobuliinia 20 ml:ssä liuosta ihonalaista injektiota varten
1 injektiopullo, jotka sisältää 10 g ihmisen normaalia immunoglobuliinia 50 ml:ssä liuosta ihonalaista injektiota varten
Yksi kotelo sisältää yhden Xembify-injektiopullon ja yhden pakkausselosteen.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas tai hieman opalisoiva, väritön tai vaaleankeltainen tai vaaleanruskea liuos.
Xembify-valmisteen osmolaliteetti on noin 280–404 mOsmol/kg, ja sen pH on 4,1–4,8.
Käyttö- ja käsittelyohjeet
Lääkevalmisteen on annettava lämmetä huoneen- tai ruumiinlämpöiseksi (20–37 °C) ennen käyttöä.
Ei saa ravistaa.
Valmisteet on tarkastettava silmämääräisesti ennen antoa. Jos liuos on sameaa tai siinä on värimuutoksia tai sakkaa, sitä ei pidä käyttää.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Käyttöohjeet
Vain infuusiona ihon alle.
Anna liuoksen lämmetä huoneen- tai ruumiinlämpöiseksi (20–37 °C) ennen käyttöä.
Ei saa ravistaa.
Xembify-valmistetta annettaessa on noudatettava seuraavia vaiheita ja käytettävä aseptista tekniikkaa.
1. Tarkista injektiopullot: tarkista kirkkaus, väri ja viimeinen käyttöpäivämäärä.
2. Infuusion valmistelu:
Kerää välineet: Xembify-injektiopullo(t), lisätarvikkeet, terävän jätteen säiliö, potilaan hoitopäiväkirja ja infuusiopumppu.
Valmistele puhdas työskentelyalue.
Pese kädet.
3. Paljasta tulpan keskusta poistamalla injektiopullon suojakorkki.
4. Pyyhi tulppa alkoholipyyhkeellä ja anna kuivua.
| 5. Valmistaudu vetämään Xembify-valmiste injektiopullosta injektoimalla ensin steriilillä ruiskulla ja neulalla injektiopulloon siitä vedettävää Xembify-määrää vastaava määrä ilmaa. Vedä sitten tarvittava määrä Xembify-valmistetta ruiskuun. Jos oikeaan annokseen tarvitaan useita injektiopulloja, toista tämä vaihe. (Kuva 1) | 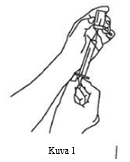 |
6. Käytä Xembify mahdollisimman pian, jotta vältetään silikonoiduista ruiskuista johtuva hiukkasten muodostuminen.
7. Noudata valmistajan ohjeita pumpun ja antoletkuston valmistelusta. Varmista, että olet valmistellut antoletkuston täyttämällä letkuston/neulan Xembify-valmisteella ja varmistanut, ettei letkustossa tai neulassa ole ilmaa.
8. Valitse pistoskohtien lukumäärä ja sijainti. Käytä jokaisen antokerran yhteydessä eri kohtaa. (Kuva 2) Anna Xembify-infuusio vatsan, reiden, olkavarren, kyljen, selän ja/tai lantion sivun alueelle. Vältä luisia alueita, arpia, verisuonia ja alueita, joissa on tulehdusta tai pinnallinen infektio. | 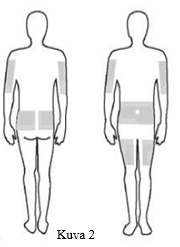 |
| 9. Puhdista pistoskohta tai -kohdat antiseptisellä liuoksella. Käytä pyörivää liikettä ja etene pistoskohdan keskustasta ulospäin. Pistoskohtien on oltava puhtaita, kuivia ja vähintään 5 cm:n etäisyydellä toisistaan. (Kuva 3) | 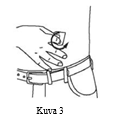 |
| 10. Purista iho (vähintään 2,5 cm ihoa) poimulle kahden sormen väliin ja työnnä neula 90 asteen kulmassa ihonalaiskudokseen. (Kuva 4) | 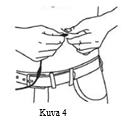 |
| 11. Työnnettyäsi neulan kudokseen varmista aina, ettei neula ole vahingossa päätynyt verisuoneen. Kiinnitä steriili ruisku esitäytetyn antoletkuston päähän ja vedä mäntää. Jos näet verta, poista neula ja hävitä se ja antoletkusto. (Kuva 5) | 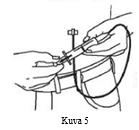 |
12. Toista esitäyttöä ja neulan kudokseen työntämistä koskevat vaiheet käyttämällä uutta neulaa, antoletkustoa ja infuusiokohtaa. Kiinnitä neula paikoilleen kiinnittämällä steriili harso tai läpinäkyvä sidos infuusiokohdan päälle.
13. Kahden ensimmäisen infuusion aikana infuusio aloitetaan nopeudella 10 ml/h/infuusiokohta. Jos se on hyvin siedetty eikä haittavaikutuksia esiinny (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), antonopeutta voi suurentaa 10 minuutin välein enintään tasolle 20 ml/h/infuusiokohta lapsille ja nuorille ja 25 ml/h/infuusiokohta aikuisille. Jos potilas sietää kaksi infuusiota hyvin, infuusionopeus voidaan vähitellen suurentaa tasolle 35 ml/h/infuusiokohta.
Varmista, että infuusiokohdat ovat vähintään 5 cm:n etäisyydellä toisistaan potilaan iästä riippumatta. Terveydenhuollon ammattilainen päättää käytettävien infuusiokohtien määrän. Aikuisten kohdalla yli 30 ml:n annokset voidaan jakaa potilaan toiveiden mukaan. Infuusiokohtien enimmäismäärää ei ole rajoitettu.
Lapset tarvitsevat tiettyyn Xembify-annokseen (mg/painokilo) pienemmän kokonaismäärän liuosta kuin aikuiset. Lapsen tarpeista riippuen terveydenhuollon ammattilainen voi valita lapselle pienemmän määrän liuosta/infuusiokohta ja/tai käyttää vähemmän infuusiokohtia kokonaistavoiteannoksen antoon.
Käytettävien infuusiokohtien määrä saadaan jakamalla Xembify-annoksen kokonaistilavuus halutulla tilavuudella (ml/infuusiokohta).
14. Infuusiota koskevat tiedot (esim. eränumero, viimeinen käyttöpäivämäärä, annos, päivämäärä, kellonaika, infuusiokohdan tai -kohtien sijainti, haittavaikutukset) kirjataan potilaan hoitotietoihin tai infuusiolokiin.
15. Hävitä neula(t) ja infuusioletku(t) asianmukaiseen jätesäiliöön. Noudata valmistajan ohjeita infuusiopumpun säilytyksestä.
16. Hävitä osittain käytetyt injektiopullot.
Korvattavuus
XEMBIFY injektioneste, liuos
200 mg/ml 5 ml, 10 ml, 20 ml, 50 ml
- Ylempi erityiskorvaus (100 %). Gammaglobuliinin puutostila (120).
- Peruskorvaus (40 %).
ATC-koodi
J06BA01
Valmisteyhteenvedon muuttamispäivämäärä
26.03.2024
Yhteystiedot
Sveavägen 166
SE-113 46 Stockholm
Sverige
+46 8 441 89 50
www.grifols.com
infonordic@grifols.com
