AZEFLONE nässpray, suspension 125/50 mikrog/annos
Kvalitativ och kvantitativ sammansättning
Varje gram suspension innehåller 1000 mikrogram azelastinhydroklorid och 365 mikrogram flutikasonpropionat.
1 sprayning (0,14 g) ger 137 mikrogram azelastinhydroklorid (= 125 mikrogram azelastin) och 50 mikrogram flutikasonpropionat.
Hjälpämnen med känd effekt:
1 sprayning (0,14 g) ger 0,014 mg bensalkoniumklorid.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Nässpray, suspension.
Kliniska uppgifter
Terapeutiska indikationer
Lindring av symtom vid måttlig till svår säsongsbunden och perenn allergisk rinit, om monoterapi med antingen intranasalt antihistamin eller glukokortikoid inte anses tillräcklig.
Dosering och administreringssätt
Dosering
Regelbunden användning är viktig för att uppnå full terapeutisk effekt. Kontakt med ögonen bör undvikas.
Vuxna och ungdomar (12 år och äldre)
En sprayning i varje näsborre två gånger dagligen (morgon och kväll).
Barn under 12 år
Azeflone rekommenderas inte till barn under 12 år eftersom säkerhet och effekt för denna åldersgrupp inte fastställts.
Äldre
Ingen dosjustering krävs för denna åldersgrupp.
Nedsatt njur- och leverfunktion
Data saknas för patienter med nedsatt njur- och leverfunktion.
Behandlingens längd
Azeflone kan användas för långvarig användning.
Behandlingens längd bör överensstämma med perioden av allergenexponering.
Administreringssätt
Azeflone är endast avsedd för nasal användning.
Instruktion för användning
Förberedelse av sprayen:
Skaka flaskan försiktigt i cirka fem sekunder före användning genom att vända den upp och ned, ta därefter bort skyddslocket. Innan Azeflone används första gången skall den aktiveras genom att pumpen trycks ned och släpps sex gånger. Om det har gått mer än sju dagar sedan Azeflone användes, skall den återaktiveras genom att trycka ned och släppa pumpen.
Användning av sprayen:
Skaka flaskan försiktigt i cirka fem sekunder före användning genom att vända den upp och ned några gånger. Ta därefter bort skyddslocket.
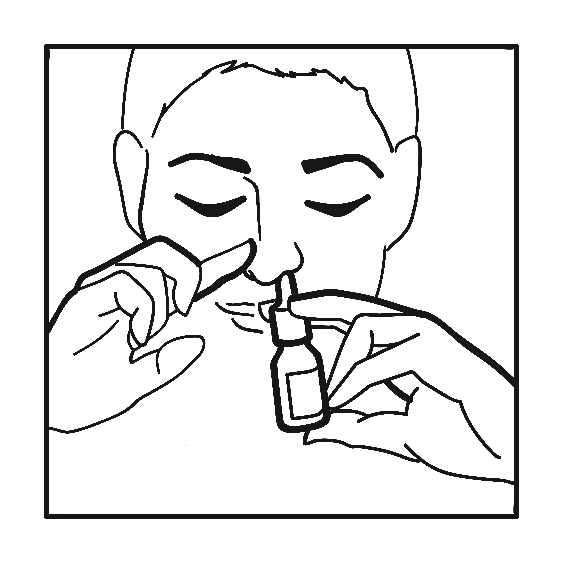
Snyt näsan och spraya en gång i vardera näsborre samtidigt som huvudet hålls lätt nedåtböjt (se figur). Torka av sprayspetsen efter användning och sätt tillbaka skyddslocket.
Kontraindikationer
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Efter marknadsföring har det förekommit rapporter om kliniskt signifikanta interaktioner hos patienter som behandlats med flutikasonpropionat och ritonavir, vilka resulterat i systemiska, kortikosteroida effekter inklusive Cushings syndrom och binjurebarksuppression. Samtidig användning av flutikasonpropionat och ritonavir ska därför undvikas, såvida inte nyttan för patienten överväger risken för systembiverkningar av kortikosteroiden (se avsnitt Interaktioner).
Systempåverkan kan förekomma med nasala kortikosteroider, särskilt vid höga doser under längre behandlingsperioder. Det är mindre troligt att denna påverkan uppkommer vid intranasal behandling jämfört med när kortikosteroider administreras peroralt och denna påverkan kan variera mellan patienter och för olika kortikosteroidpreparat. Eventuella systembiverkningar kan inkludera Cushings syndrom, Cushingliknande symtombild, binjurebarksuppression, tillväxthämning hos barn och ungdomar, katarakt, glaukom och i mer sällsynta fall en rad psykologiska störningar eller beteendestörningar innefattande psykomotorisk hyperaktivitet, sömnstörningar, oro, depression eller aggression (särskilt hos barn).
Azelastinhydroklorid/flutikasonpropionat nässpray genomgår omfattande förstapassagemetabolism. Den systemiska exponeringen av intranasalt flutikasonpropionat hos patienter med grav leversjukdom är således sannolikt högre. Detta kan leda till en högre frekvens av systembiverkningar.
Försiktighet rekommenderas vid behandling av dessa patienter.
Behandling med nasala kortikosteroider i doser som överstiger rekommenderade doser, kan leda till kliniskt signifikant binjurebarksuppression. Om det finns belägg för att högre doser än de rekommenderade har använts, bör tillägg av perorala kortikosteroider övervägas under perioder av stress eller vid planerad kirurgi.
I allmänhet ska dosen intranasalt flutikasonpreparat minskas till den lägsta dosen vid vilken effektiv symtomkontroll av rinit bibehålls. Högre doser än den rekommenderade (se avsnitt Dosering och administreringssätt) har inte testats för azelastinhydroklorid/flutikasonpropionat. I likhet med alla intranasala kortikosteroider ska den totala bördan av systemiska kortikosteroider beaktas när andra typer av kortikosteroider ordineras samtidigt.
Hämmad längdtillväxt har rapporterats hos barn som fått nasala kortikosteroider i rekommenderade doser. Regelbunden kontroll av längdtillväxt hos barn, och även ungdomar, som står på långtidsbehandling med nasala kortikosteroider rekommenderas. Om längdtillväxten hämmas bör behandlingen omprövas för att om möjligt minska dosen nasala kortikosteroider till den lägsta dos vid vilken effektiv symtomkontroll uppnås.
Synrubbning kan rapporteras vid systemisk och topisk användning av kortikosteroider. Om en patient inkommer med symtom såsom dimsyn eller andra synrubbningar bör man överväga att remittera patienten till en oftalmolog för utredning av möjliga orsaker. Dessa kan innefatta katarakt, glaukom eller sällsynta sjukdomar, såsom central serös korioretinopati (CSCR), som har rapporterats efter användning av systemiska och topiska kortikosteroider.
Noggrann kontroll krävs hos patienter med en synförändring eller en anamnes på ökat okulärt tryck, glaukom och/eller katarakt.
Försiktighet måste iakttas vid behandling av patienter som överförts från behandling med systemiskt verkande kortikosteroider till Azeflone nässpray, särskilt om det kan antas att binjurebarkfunktionen är störd.
Hos patienter som har tuberkulos, någon form av obehandlad infektion, eller som nyligen har genomgått en kirurgisk operation av näsan eller munnen eller som har skadat näsan eller munnen, bör de eventuella fördelarna av behandlingen med Azeflone vägas mot de eventuella riskerna.
Infektioner i näsans luftvägar ska behandlas med antibakteriella medel eller medel mot svamp, men de utgör ingen specifik kontraindikation för behandling med Azeflone.
Hjälpämnen
Detta läkemedel innehåller 0,014 mg bensalkoniumklorid per sprayning. Långtidsbruk kan orsaka ödem i nässlemhinnan.
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per sprayning, dvs. är näst intill ”natriumfritt”.
Interaktioner
Flutikasonpropionat
Under normala förhållanden uppnås låga plasmakoncentrationer efter intranasalt administrerat flutikasonpropionat på grund av höggradig förstapassagemetabolism och högt systemiskt clearance genom metabolism av cytokrom P450 3A4 i tarm och lever. Betydelsefulla kliniska interaktioner är därför osannolika.
En interaktionsstudie på friska individer med flutikasonpropionat visade att ritonavir (ett höggradigt potent cytokrom P450 3A4 hämmande läkemedel), ökade plasmakoncentrationen av flutikasonpropionat. Som en följd av detta minskade serumkortisolkoncentrationen markant. Under användning efter marknadsföring har det förekommit rapporter om kliniskt signifikanta läkemedelsinteraktioner hos patienter som fått intranasalt eller inhalerat flutikasonpropionat och ritonavir, vilket resulterat i systemiska kortikosteroideffekter. Samtidig behandling med CYP3A-hämmare, inklusive läkemedel som innehåller kobicistat, väntas öka risken för systemiska biverkningar. Kombinationen ska undvikas såvida inte nyttan uppväger den ökade risken för systemiska biverkningar av kortikosteroider, och om så är fallet ska patienter övervakas avseende systemiska biverkningar av kortikosteroider.
Studier har visat att andra cytokrom P450 3A4-hämmande läkemedel kan öka systemisk exponering försumbart (erytromycin) eller i liten utsträckning (ketokonazol) av flutikasonpropionat utan någon nämnvärd ökning av serumkortisolkoncentrationen. Försiktighet bör ändå iakttas vid samtidig administrering av potenta cytokrom P450 3A4-hämmare (t ex ketokonazol) eftersom det finns risk för ökad systemisk exponering av flutikasonpropionat.
Azelastinhydroklorid
Inga interaktionsstudier med azelastinhydroklorid nässpray har utförts. Interaktionsstudier med höga orala doser har utförts. Dessa är emellertid inte relevanta för azelastin nässpray eftersom rekommenderade nasala doser leder till en mycket lägre systemisk exponering. Försiktighet bör dock iakttagas vid administrering av azelastin hos patienter som samtidigt tar lugnande medel eller mediciner för centrala nervsystemet eftersom den lugnande effekten kan förstärkas. Alkohol kan också förstärka denna effekt (se avsnitt Effekter på förmågan att framföra fordon och använda maskiner).
Fertilitet, graviditet och amning
Fertilitet
Det finns begränsade data avseende fertilitet (se avsnitt Prekliniska säkerhetsuppgifter).
Graviditet
Det finns inga eller begränsad mängd data från användningen av azelastinhydroklorid och flutikasonpropionat hos gravida kvinnor. Azeflone nässpray ska således bara användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret (se avsnitt Prekliniska säkerhetsuppgifter).
Amning
Det är okänt om nasalt administrerat azelastinhydroklorid/metaboliter eller flutikasonpropionat/metaboliter utsöndras i bröstmjölk. Azeflone nässpray ska användas under amning enbart om den förväntade nyttan uppväger den potentiella risken för det ammade barnet.
Effekter på förmågan att framföra fordon och använda maskiner
Azeflone nässpray har liten påverkan på förmågan att framföra fordon och använda maskiner.
I enstaka fall kan trötthet, utmattning, yrsel eller svaghet, som också kan orsakas av själva sjukdomen,
uppkomma vid användning av Azeflone nässpray. I dessa fall kan förmågan att framföra fordon och använda maskiner vara nedsatt. Alkohol kan öka den här effekten.
Biverkningar
Vanligen kan dysgeusi, en substansspecifik obehaglig smak, upplevas efter administrering (ofta beroende på felaktig applicering, nämligen att huvudet böjts för mycket bakåt under administreringen).
Biverkningar anges nedan med organsystemklassificering och frekvens. Frekvenserna definieras som:
Mycket vanliga (≥1/10)
Vanliga (≥1/100 till <1/10)
Mindre vanliga (≥1/1 000 till <1/100)
Sällsynta (≥1/10 000 till <1/1 000)
Mycket sällsynta (<1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Frekvens Klassificering av organsystem | Mycket vanliga | Vanliga | Mindre vanliga | Sällsynta | Mycket sällsynta | Ingen känd frekvens |
| Immunsystemet | Överkäns-lighet inklusive anafylaktiska reaktioner, angioödem (ödem i ansikte eller på tungan och hudutslag), bronkospasm | |||||
| Centrala och perifera nervsystemet | Huvudvärk, dysgeusi (obehaglig smak), obehaglig lukt av läkemedlet | Yrsel, somnolens (dåsighet, sömnighet) | ||||
| Ögon* | Glaukom, ökat intraokulärt tryck, katarakt | Dimsyn (se även avsnitt Varningar och försiktighet) | ||||
| Andningsvägar, bröstkorg och mediastinum | Epistaxis | Obehag i näsan (inklusive irritation, sveda, klåda), nysning, torrhet i näsa/svalg, hosta, halsirritation | Perforation av nässeptum**, slemhinne-erosion | Sår i näsan | ||
| Magtarmkanalen | Muntorrhet | Illamående | ||||
| Hud och subkutan vävnad | Utslag, klåda, urtikaria | |||||
| Allmänna symtom och/eller symtom vid administrerings-stället | Trötthet (utmattning), svaghet (se avsnitt Effekter på förmågan att framföra fordon och använda maskiner) |
* Ett mycket litet antal spontana rapporter har identifierats efter långvarig behandling med intranasalt flutikasonpropionat.
** Nasal septal perforering har rapporterats efter användning av intranasala kortikosteroider.
Systemeffekter av vissa nasala kortikosteroider kan förekomma, särskilt vid administrering av höga doser under långa perioder (se avsnitt Varningar och försiktighet).
Tillväxthämning har rapporterats hos barn som får nasala kortikosteroider. Tillväxthämning kan även drabba ungdomar (se avsnitt Varningar och försiktighet).
I sällsynta fall har osteoporos observerats vid långvarig administrering av nasala glukokortikoider.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Vid nasal administrering förväntas inga överdoseringsreaktioner.
Det finns inga tillgängliga patientdata avseende effekterna av akut eller kronisk överdosering med intranasalt flutikasonpropionat.
Intranasal administrering av 2 mg flutikasonpropionat (10 gånger den rekommenderade dagliga dosen) 2 gånger dagligen i 7 dagar till friska frivilliga har ej visat effekt på HPA-axelns (hypotalamus-hypofysbinjurebarkaxeln) funktion.
Intag av högre doser än de som rekommenderas under en längre tid kan leda till tillfällig suppression av binjurebarkfunktionen.
Hos dessa patienter bör behandling med Azeflone nässpray fortsätta med en dos tillräcklig för att kontrollera symtomen. Binjurebarkfunktionen återhämtar sig inom några dagar och kan verifieras genom att mäta plasmakortisol.
I händelse av överdosering efter oavsiktligt peroralt intag, kan störningar på centrala nervsystemet (inklusive dåsighet, förvirring, koma, takykardi och hypotension) av azelastinhydroklorid förväntas baserat på resultaten av djurförsök.
Behandlingen av dessa tillstånd ska vara symtomatisk. Beroende på svald mängd rekommenderas ventrikelsköljning. Det finns ingen känd antidot.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Slemhinneavsvällande medel och andra nasala preparationer för lokal användning, kortikosteroider/flutikason, kombinationer, ATC-kod: R01AD58.
Verkningsmekanism och farmakodynamiska effekter
Azeflone nässpray innehåller azelastinhydroklorid och flutikasonpropionat, som har olika verkningsmekanismer och visar synergistiska effekter när det gäller förbättring av symtom på allergisk rinit och rinokonjunktivit.
Flutikasonpropionat
Flutikasonpropionat är en syntetisk trifluorinerad kortikosteroid som har en mycket hög affinitet för glukokortikoidreceptorn och har en potent antiinflammatorisk effekt, t.ex. 3–5 gånger mer potent än dexametason vid bindnings- och genexpressionsanalyser på klonad human glukokortikoidreceptor.
Azelastinhydroklorid
Azelastin, ett ftalazinonderivat, klassificeras som en potent långverkande antiallergen substans med selektiva H1-antagonistegenskaper samt mastcellsstabiliserande och antiinflammatoriska egenskaper. Data från studier in vivo (prekliniska) och in vitro visar att azelastin hämmar syntesen eller frisättningen av kemiska mediatorer som är kända för att vara inblandade i tidiga och sena stadier av allergiska reaktioner, t.ex. leukotriener, histamin, trombocytaktiverande faktor (PAF) och serotonin. Lindring av nasala allergisymtom observeras inom 15 minuter efter administrering.
Azelastinhydroklorid/flutikasonpropionat nässpray
I fyra kliniska studier hos vuxna och ungdomar med allergisk rinit förbättrade en sprayning med azelastinhydroklorid/flutikasonpropionat nässpray i varje näsborre två gånger dagligen signifikant de nasala symtomen (bestående av rinorré, nästäppa, nysning och näsklåda) jämfört med antingen placebo, azelastinhydroklorid eller flutikasonpropionat. Det visade en signifikant förbättring av okulära symtom (bestående av klåda, rinnande och röda ögon) och av patientens sjukdomsrelaterade livskvalitet (Rhinoconjunctivitis Quality of Life Questionnaire – RQLQ) i samtliga studier.
Jämfört med en godkänd nässpray med flutikasonpropionat uppnåddes substantiell symtomförbättring (50 % minskning av nässymtomens svårighetsgrad) signifikant tidigare (tre dagar eller mer) med azelastinhydroklorid/flutikasonpropionat nässpray. Den statistiskt signifikanta effekten av azelastinhydroklorid/flutikasonpropionat nässpray jämfört med flutikasonpropionat nässpray kvarstod under en ettårig studie hos patienter med kronisk allergisk rinit och icke-allergisk/vasomotorisk rinit.
En exponeringsstudie av allergener med ambrosiapollen visade första statistiskt signifikanta lindringen av nässymtom 5 minuter efter administration av azelastinhydroklorid/flutikasonpropionat nässpray (jämfört med placebo). Vid 15 minuter efter administration av azelastinhydroklorid/flutikasonpropionat nässpray rapporterade 60% av patienterna en kliniskt relevant minskning av symtompoäng på minst 30%.
Farmakokinetiska egenskaper
Absorption
Efter intranasal administrering av två sprayningar per näsborre (548 mikrogram azelastinhydroklorid och 200 mikrogram flutikasonpropionat) azelastinhydroklorid/flutikasonpropionat nässpray var den genomsnittliga (± standardavvikelse) maximala plasmaexponeringen (Cmax) 194,5 ± 74,4 pg/ml för azelastin och 10,3±3,9 pg/ml för flutikasonpropionat och den genomsnittliga totala exponeringen (AUC) 4 217 ± 2 618 pg/ml*timme för azelastin och 97,7 ± 43,1 pg/ml*timme för flutikasonpropionat. Mediantiden till maximal exponering (tmax) med en singeldos var 0,5 timme för azelastin och 1,0 timme för flutikasonpropionat.
Den systemiska exponeringen av flutikasonpropionat ökade med cirka 50 % vid jämförelse mellan azelastinhydroklorid/flutikasonpropionat nässpray och en godkänd nässpray med flutikasonpropionat. Azelastinhydroklorid/flutikasonpropionat nässpray var likvärdig med en godkänd nässpray med azelastin när det gäller systemisk exponering av azelastin. Det fanns inga belägg för farmakokinetiska interaktioner mellan azelastinhydroklorid och flutikasonpropionat.
Distribution
Flutikasonpropionat har en större distributionsvolym vid steady-state (cirka 318 liter). Plasmaproteinbindningen är 91 %.
Distributionsvolymen för azelastin är hög vilket indikerar distribution till i huvudsak perifer vävnad. Proteinbindningen är 80–90 %. Dessutom har båda läkemedlen ett brett terapeutisk fönster. Således är läkemedelsdisplacement reaktioner osannolika.
Metabolism
Flutikasonpropionat försvinner snabbt från den systemiska cirkulationen, främst via hepatisk metabolism till en inaktiv karboxylsyrametabolit, via cytokrom P450-enzymet CYP3A4. Nedsvalt flutikasonpropionat är också föremål för omfattande förstapassagemetabolism. Azelastin metaboliseras till N-desmetylazelastin via olika CYP-isoenzymer, i huvudsak CYP3A4, CYP2D6 och CYP2C19.
Eliminering
Elimineringshastigheten för intravenöst administrerat flutikasonpropionat är linjär över doseringsintervallet på 250–1000 mikrogram och kännetecknas av en hög plasmaclearance (CL=1,1 l/min). Maximala plasmakoncentrationer minskar med cirka 98 % inom 3–4 timmar och bara låga plasmakoncentrationer är kopplat till den terminala halveringstiden på 7,8 timmar. Renal clearance för flutikasonpropionat är försumbar (<0,2 %) och mindre än 5 % som karboxylsyrametaboliten. Den huvudsakliga elimineringsvägen är utsöndring av flutikasonpropionat och dess metaboliter via gallan.
Halveringstiden i plasma efter en singeldos azelastin är cirka 20–25 timmar för azelastin och cirka 45 timmar för den terapeutiskt aktiva metaboliten N-desmetylazelastin. Utsöndring sker i huvudsak via feces. Den fördröjda utsöndringen av små mängder av dosen i feces tyder på att viss enterohepatisk cirkulation kan förekomma.
Prekliniska säkerhetsuppgifter
Flutikasonpropionat
Resultaten från toxikologiska studier motsvarade de som observerats för andra glukokortikoider och förknippas med hög farmakologisk aktivitet. Dessa resultat är sannolikt inte relevanta för människa då rekommenderade nasala doser leder till minimal systemisk exponering. Inga genotoxiska effekter av flutikasonpropionat har observerats i vanliga genotoxicitetstester. Dessutom sågs inga behandlingsrelaterade ökningar av incidensen av tumörer vid 2-åriga inhalationsstudier på råtta och mus.
I djurstudier har glukokortikoider visat sig framkalla missbildningar så som gomspalt och intrauterin tillväxthämning. Dessa resultat är sannolikt inte relevanta för människa då rekommenderade nasala doser leder till minimal systemisk exponering (se avsnitt Farmakokinetiska egenskaper).
Azelastinhydroklorid
Azelastinhydroklorid visade ingen sensibiliserande potential hos marsvin. Azelastin visade ingen genotoxisk potential i ett flertal in vitro- och in vivo-tester, och inte heller någon karcinogenicitet hos råtta och mus. Hos råttor av båda könen orsakade orala doser av azelastin högre än 3,0 mg/kg/dag en dosrelaterad minskning av fertilitetsindex. I kroniska toxicitetsstudier kunde inga reproduktionseffekter relaterade till substansen hittas i något av könen. Hos råtta, mus och kanin uppträdde embryotoxiska och teratogena effekter endast efter doser som var toxiska för modern (till exempel skelettmissbildningar hos mus och råtta vid doser om 68,6 mg/kg/dag).
Azelastinhydroklorid/flutikasonpropionat nässpray
Upprepade toxicitetsstudier av intranasala doser azelastinhydroklorid/flutikasonpropionat nässpray på råtta under en period på upp till 90 dagar och på hund i 14 dagar visade inga nya biverkningar jämfört med de enskilda komponenterna.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Glycerol
Mikrokristallin cellulosa (E460)
Karmellosnatrium (E466)
Dinatriumedetat
Polysorbat 80 (E433)
Bensalkoniumklorid
Fenyletylalkohol
Renat vatten
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år.
Hållbarhet efter första användning: 6 månader.
Särskilda förvaringsanvisningar
Förvaras i skydd mot kyla. Får ej frysas.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
AZEFLONE nenäsumute, suspensio
125/50 mikrog/annos (L:ei) 120 annosta (23 g) (4,13 €), 3 x 120 annosta (14,03 €)
PF-selosteen tieto
Bärnstensfärgad glasflaska av typ I försedd med en spraypump, en nasal polypropenapplikator (spray) och ett skyddslock, innehållande 23 g (minst 120 sprayningar) suspension.
Förpackningsstorlekar:
1 flaska med 23 g suspension i en 25 ml flaskor (minst 120 sprayningar)
Flerpack med 69 g (3 flaskor med 23 g) nässpray, suspension
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit, homogen suspension.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar för destruktion.
Ersättning
AZEFLONE nenäsumute, suspensio
125/50 mikrog/annos 120 annosta, 3 x 120 annosta
- Peruskorvaus (40 %).
Atc-kod
R01AD58
Datum för översyn av produktresumén
08.08.2023
Yhteystiedot
PL 1310, Puolikkotie 8, 02230 Espoo (käyntiosoite)
00101 Helsinki
0207 416 888
