ZEQMELIT kalvo, suussa hajoava 4 mg, 6 mg, 8 mg
Vaikuttavat aineet ja niiden määrät
Zeqmelit 4 mg kalvo, suussa hajoava
Yksi suussa hajoava kalvo sisältää 4 mg deksametasonia.
Zeqmelit 6 mg kalvo, suussa hajoava
Yksi suussa hajoava kalvo sisältää 6 mg deksametasonia.
Zeqmelit 8 mg kalvo, suussa hajoava
Yksi suussa hajoava kalvo sisältää 8 mg deksametasonia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvo, suussa hajoava
Zeqmelit 4 mg kalvo, suussa hajoava
Zeqmelit 6 mg kalvo, suussa hajoava
Zeqmelit 8 mg kalvo, suussa hajoava
Kliiniset tiedot
Käyttöaiheet
Tilat, jotka edellyttävät anti-inflammatorista hoitoa ja immunosuppressanttihoitoa, kuten:
- aivokasvainten, aivoleikkauksen ja aivopaiseen aiheuttaman aivoturvotuksen hoito
- akuutin vaikea-asteisen astman hoito
- vaikea-asteisten akuuttien ihosairauksien alkuvaiheen hoito
- autoimmuunisairauksien alkuvaiheen hoito
- aktiivisen nivelreuman hoito
- sytostaattisten lääkeaineiden aiheuttaman pahoinvoinnin ja oksentelun ehkäisy ja hoito antiemeettisten hoito-ohjelmien osana
- ahtauttava kurkunpäätulehdus
- allergiset reaktiot, mukaan lukien akuutit allergiset reaktiot
- koronaviruksen aiheuttaman taudin (COVID-19) hoito aikuisilla ja nuorilla potilailla (vähintään 12-vuotiailla, joiden paino on vähintään 40 kg), jotka tarvitsevat lisähappihoitoa.
Annostus ja antotapa
Annostus
Tarvittava annos riippuu sairauden vaikeusasteesta ja potilaan yksilöllisestä hoitovasteesta. Aluksi annetaan yleensä suurempia annoksia. Annos on yleensä suurempi akuuttien vaikea-asteisten sairauksien hoidon aikana kuin kroonisten sairauksien hoidon aikana. Kun sairaus on hallinnassa, lääkärin on arvioitava potilas säännöllisesti ja annosta on vähennettävä asteittain pienimpään tehokkaaseen annokseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annosta valittaessa on myös huomioitava tämänhetkiset sairauden hoito-ohjeet.
Aikuiset
Suositeltu annos:
- aivoturvotus: aloitusannokseksi suositellaan 4–8 mg vuorokaudessa. Hätätilanteissa suositellaan suurempia 16–24 mg:n vuorokausiannoksia. Leikkaukseen soveltumattomien aivokasvainten standardihoidon lisänä annettavan sädehoidon aikana voidaan tarvita pieniä deksametasonin ylläpitoannoksia.
- akuutti vaikea-asteinen astma: 16 mg vuorokaudessa enintään kahden vuorokauden ajan
- vaikea-asteiset akuutit ihosairaudet: 8–40 mg vuorokaudessa riippuen sairauden tyypistä ja kestosta, minkä jälkeen annosta pienennetään asteittain
- aktiivisessa vaiheessa olevat autoimmuunisairaudet, esim. systeeminen lupus erythematosus: 6−16 mg vuorokaudessa
- nivelreuma: 4 mg deksametasonia voidaan antaa perinteisillä reumalääkkeillä (DMARD-lääkkeillä) toteutettavaa hoitoa aloitettaessa tai sitä muutettaessa. Oireiden äkillisen pahenemisen yhteydessä on käytettävä pienintä mahdollista annosta mahdollisimman lyhyen aikaa. Hoitoa jatketaan enintään kolme kuukautta.
- sytotoksisten lääkeaineiden aikaansaaman pahoinvoinnin ja oksentelun ehkäisy ja hoito: yksi 10–20 mg:n annos ennen solunsalpaajahoidon aloittamista. Akuutin pahoinvoinnin ja oksentelun yhteydessä: 4–20 mg, solunsalpaajahoidon emeettisestä riskistä riippuen. Viiveellä tulevan pahoinvoinnin ja oksentelun yhteydessä: 8 mg, 1–2 kertaa vuorokaudessa 2–4 vuorokauden ajan, riippuen käytettävän solunsalpaajahoidon emeettisestä riskistä.
- allergiset reaktiot, mukaan lukien akuutit allergiset reaktiot: alkuun 4–10 mg, minkä jälkeen annosta pienennetään asteittain. Enimmäiskerta-annos on 12 mg.
- Covid-19:n hoitoon: 6 mg kerran vuorokaudessa enintään 10 vuorokauden ajan.
Pediatriset potilaat
Zeqmelit-valmistetta suositellaan vain yli 3 kuukauden ikäisille ja yli 7 kg:n painoisille lapsille. Enimmäiskerta-annos on 16 mg.
- akuutti vaikea-asteinen astma: 0,6 mg/kg (enintään 16 mg vuorokaudessa) enintään kahden vuorokauden ajan
- ahtauttava kurkunpäätulehdus: lievä tai keskivaikea kurkunpäätulehdus: 0,15–0,6 mg/kg kerta-annoksena, joka voidaan tarvittaessa toistaa kertaalleen 24–48 tunnin jälkeen. Vaikea-asteisessa kurkunpäätulehduksessa suositellaan 0,6 mg/kg:n annosta yhdistelmähoitona muiden hoitovaihtoehtojen kanssa.
- allergiset reaktiot, mukaan lukien akuutit allergiset reaktiot: 0,15–0,6 mg/kg.

Covid-19:n hoito
Suositeltu annos pediatrisille potilaille (vähintään 12-vuotiaille nuorille) on 6 mg kerran vuorokaudessa enintään 10 vuorokauden ajan. Hoidon kesto määräytyy kliinisen vasteen ja potilaan yksilöllisten tarpeiden perusteella
Maksan vajaatoiminta
Annoksen muuttaminen voi olla tarpeen potilaille, joilla on vaikea maksan vajaatoiminta (ks. Kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on munuaisten vajaatoiminta (ks. kohta Farmakokinetiikka).
Antotapa
Zeqmelit suussa hajoava kalvo on otettava kustakin annospussista seuraavalla tavalla:
- Älä leikkaa annospussia.
- Avaa vain repimismerkin kohdalta.
- Revi auki hitaasti.
- Tarkista, että kalvo on vahingoittumaton.
- Älä leikkaa tai revi kalvoja pienempiin palasiin.
- Käytä vain vahingoittumattomia kalvoja.
Suun on oltava tyhjä Zeqmelit-valmistetta annettaessa. Aseta yksi kalvo kerrallaan kielen päälle kuivilla sormilla. Kalvo hajoaa nopeasti suussa ja se niellään sen jälkeen suoraan, ilman vettä. Jos potilaan suu on kuiva, ennen Zeqmelit-valmisteen antoa voidaan ottaa vesikulaus.
Jos tarvitaan suuria deksametasonin annoksia (yli 48 mg vuorokaudessa), tällöin on harkittava toista antomuotoa, esim. laskimoon antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Lisämunuaiskuoren vajaatoiminta
Jos tarvitaan pitkäaikaista kortikosteroidihoitoa, tilapäisen lisämunuaiskuoren vajaatoiminnan aikaansaamisen riski on otettava huomioon. Pitkäkestoisesta vaikutusajasta johtuen toistuva anto voi johtaa pysyvään lisämunuaiskuoren vajaatoimintaan ja lopulta atrofiaan.
Tietyissä fyysisen rasituksen tilanteissa (esim. kuumekohtaukset, onnettomuudet, leikkaukset, synnytykset) päivittäisen glukokortikoidiannoksen tilapäinen suurentaminen voi olla tarpeen.
Annoksesta ja hoidon kestosta riippuen glukokortikoidien aikaansaama lisämunuaiskuoren vajaatoiminta voi kestää muutamia kuukausia ja yksittäisissä tapauksissa yli yhden vuoden ajan hoidon lopettamisen jälkeen. Akuutti lisämunuaiskuoren vajaatoiminta voidaan minimoida asteittaisella, suunnitellulla annoksen pienentämisellä.
Infektiot ja rokotukset
Immunosuppressiosta johtuen deksametasonihoito voi lisätä bakteeri-, virus-, sieni- tai parasiitti-infektioiden sekä opportunististen infektioiden riskiä. Ilmeisten tai kehittymässä olevien infektioiden oireet voivat peittyä, mikä hankaloittaa diagnoosin tekemistä. Latentit infektiot, mukaan lukien tuberkuloosi tai B-hepatiitti, voivat aktivoitua uudelleen.
Seuraavissa tilanteissa on kiinnitettävä erityistä huomiota:
- akuutit ja krooniset bakteeri-infektiot: näissä käytetään spesifistä antibioottihoitoa
- potilaat, joilla on sairaushistoriassa tuberkuloosi - potilaalle annetaan deksametasonia vain yhdessä tuberkuloosilääkevalmisteiden kanssa
- BCG-rokotuksen jälkeinen lymfadeniitti
- HbsAg:n suhteen positiivinen krooninen hepatiitti
- akuutit virusinfektiot, esim. B-hepatiitti, varicella-zostervirus, herpes simplex, poliomyeliitti, herpeettinen keratiitti, tuhkarokko
- tuhkarokko tai vesirokko: Erityistä suojausta suositellaan immunosuppressoiduille potilaille ja potilaille, jotka eivät ole sairastaneet tuhkarokkoa tai vesirokkoa ja jotka ovat kontaktissa henkilöiden kanssa, joilla on tuhkarokko tai vesirokko. Nämä virustaudit voivat olla erityisen vaikea-asteisia glukokortikoideilla hoidetuilla henkilöillä.
- systeeminen parasitoosi ja mykoosi (esim. madot, ameebainfektio): Potilailla, joilla on merkittävä todettu tai epäilty strongyloidi-infestaatio, glukokortikoidien käyttö voi johtaa aktivoitumiseen ja leviämiseen.
- estorokotukset elävillä rokotteilla (8 viikkoa ennen rokotusta – 2 viikkoa rokotuksen jälkeen). Toisaalta on huomioitava, että inaktivoitujen rokotteiden anto on yleensä mahdollista. Immuunireaktio voi kuitenkin olla puutteellinen ja siten myös inaktivoiduilla rokotteilla toteutettavan rokotuksen hoitotulos voi heikentyä suuria glukokortikoidiannoksia annettaessa.
Feokromosytoomakriisi
Feokromosytoomakriisiä, joka voi johtaa kuolemaan, on raportoitu systeemisten kortikosteroidien annon jälkeen. Kortikosteroideja voidaan antaa potilaille, joilla on epäilty tai todettu feokromosytooma, vain asianmukaisen riski-hyöty-arvioinnin jälkeen.
Vaikeasti hallittavissa oleva diabetes mellitus
Potilaita, joilla on vaikeasti hallittavissa oleva diabetes, on seurattava kliinisesti. Diabeteslääkehoidon muuttaminen voi olla tarpeen.
Osteoporoosi
Deksametasonihoidon kestosta ja annostuksesta riippuen negatiivinen vaikutus kalsiummetaboliaan on odotettavissa. Samanaikaista kalsiumin, ja tarvittaessa D-vitamiinin, antoa suositellaan. Potilaiden kohdalla, joilla on olemassaolevaa osteoporoosia, on harkittava muun lisähoidon käyttöä. Vaikea-asteisen osteoporoosin tapauksissa deksametasonihoitoa on harkittava vain vaikea-asteisten sairauksien hoitoon tai lyhytkestoisena hoitona.
Vaikea-asteinen sydämen vajaatoiminta
Potilaita, joilla on vaikea-asteinen sydämen vajaatoiminta, on seurattava huolellisesti.
Vaikeasti hallittavissa oleva hypertensio
Potilaiden, joilla on vaikeasti hallittavissa oleva hypertensio, on saatava hypertension yhdistelmälääkehoitoa ja heitä on seurattava säännöllisin väliajoin.
Psyykkiset häiriöt, mukaan lukien itsemurhariski (myös potilaan psykiatrisessa historiassa oleva)
Neurologista ja psykiatrista seurantaa suositellaan.
Suolen perforaatio
Suolen perforaation riskistä johtuen deksametasonia voidaan antaa vain akuuttiin käyttöaiheeseen ja valvotusti seuraavanlaisten sairauksien hoidossa:
- vaikea-asteinen haavainen koliitti, jossa on perforaation riski ilman peritoneaalista ärsytystä
- divertikuliitti
- enteroanastomoosi (välittömästi leikkauksen jälkeen).
Ruoansulatuskanavan perforaation jälkeisen peritoneaalisen ärsytyksen merkkejä ei välttämättä ilmene potilailla, joita on hoidettu suurilla glukokortikoidiannoksilla.
Anafylaktiset reaktiot
Vaikea-asteisia anafylaktisia reaktioita voi ilmetä (ks. kohta Haittavaikutukset).
Myasthenia gravis
Samanaikainen myasthenia gravis voi alkuun pahentua deksametasonihoidon aikana.
Kilpirauhasen vajaatoiminta tai maksakirroosi
Kortikosteroidien vaikutus voimistuu potilailla, joilla on kilpirauhasen vajaatoiminta tai maksakirroosi.
Vaikutus kalium- ja natriumpitoisuuksiin
Suuret deksametasonin annokset edellyttävät sopivien kaliumlisien ja natriumrajoitusten käyttöä ruokavaliossa. Plasman kaliumpitoisuuksia on myös seurattava.
Bradykardia
Suurten deksametasonin annosten anto voi johtaa bradykardiaan.
Tuumorilyysioireyhtymä
Malignia hematologista tautiprosessia sairastavilla potilailla on markkinoille tulon jälkeen raportoitu tuumorilyysioireyhtymää (TLS) joko pelkän deksametasonin tai deksametasonin ja solunsalpaajien yhdistelmäkäytön jälkeen. Potilaita, joilla on suuri tuumorilyysioireyhtymän riski, kuten potilaita joilla on voimakas proliferaationopeus, suuri kasvainkuorma ja suuri sensitiivisyys sytotoksisille aineille, on seurattava huolellisesti. Asianmukaisia varotoimenpiteitä on myös noudatettava.
Mahahaava
Samanaikaista ulkuslääkehoitoa suositellaan.
Ahdaskulmaglaukooma, avokulmaglaukooma, sarveiskalvon haavaumat tai leesiot
Huolellinen silmätautien seuranta ja sopiva hoito on suositeltavaa.
Näköhäiriöt
Näköhäiriöitä on raportoitu kortikosteroidien systeemisen ja paikallisen käytön yhteydessä. Jos potilaalla ilmenee oireena esimerkiksi näön hämärtymistä tai muita näköhäiriöitä, tällöin on harkittava potilaan lähettämistä silmälääkärille mahdollisten syiden arvioimiseksi. Näitä voivat olla kaihi, glaukooma tai harvinaiset sairaudet kuten sentraalinen seroosi korioretinopatia (CSCR), jota on raportoitu systeemisen ja paikallisen kortikosteroidien käytön jälkeen.
Covid-19:n hoito
Systeemisten kortikosteroidien käyttöä ei pidä lopettaa potilailla, joita hoidetaan jo valmiiksi systeemisillä (suun kautta otettavilla) kortikosteroideilla muista syistä johtuen (esim. keuhkoahtaumatautia sairastavat potilaat), mutta jotka eivät tarvitse lisähappea.
Pitkäaikainen hoito
Pitkäaikainen deksametasonihoito edellyttää säännöllistä lääketieteellistä seurantaa (mukaan lukien silmätautien seuranta 3 kuukauden välein).
Kun pitkäaikainen glukokortikoidihoito lopetetaan, taustalla olevan sairauden pahenemisen tai relapsin, lisämunuaiskuoren vajaatoiminnan ja kortisonin vieroitusoireyhtymän riski on otettava huomioon.
Häiriöt laboratoriokokeiden tuloksiin
Immunomodulaatioon liittyvien tutkimusten (esim. allergiatestien) tulokset voivat inhiboitua.
Iäkkäät potilaat
Iäkkäät potilaat ovat yleensä herkempiä deksametasonihoidon riskeille, kuten osteoporoosille. Deksametasonia on näin ollen annettava vain siinä tapauksessa, että hoidon riski-hyöty-suhde on arvioitu huolellisesti.
Pediatriset potilaat
Deksametasonin käyttö pediatrisille potilaille on arvioitava siten, että keskitytään riski-hyöty-suhteeseen, koska deksametasoni voi viivästää kasvua (ks. kohta Haittavaikutukset).
Yhteisvaikutukset
Ei-steroidiset kipulääkkeet (NSAID-lääkkeet)
Samanaikainen tulehduslääkevalmisteiden tai reumalääkevalmisteiden (esim. indometasiini tai salisylaatit) käyttö lisää ruoansulatuskanavan haavaumien ja verenvuodon riskiä.
Suun kautta otettavat diabeteslääkkeet ja insuliini
Deksametasoni voi heikentää suun kautta otettavien diabeteslääkkeiden ja insuliinin hypoglykeemistä vaikutusta.
CYP3A4-entsyymin induktorit
CYP3A4-entsyymin induktorit kuten rifampisiini, fenytoiini, karbamatsepiini, barbituraatit ja primidoni voivat heikentää kortikosteroidien vaikutusta.
CYP3A-entsyymin estäjät
On odotettavissa, että samanaikainen hoito CYP3A-entsyymin estäjillä, kuten ketokonatsolilla ja itrakonatsolilla, mukaan lukien lääkevalmisteet jotka sisältävät kobisistaattia, lisää systeemisten haittavaikutusten riskiä. Tätä yhdistelmää on vältettävä, ellei hyöty ylitä kortikosteroidien käyttöön liittyvää kohonnutta systeemisten haittavaikutusten riskiä. Tässä tapauksessa potilaita on seurattava kortikosteroidien systeemisten reaktioiden varalta.
Efedriini
Efedriini voi kiihdyttää glukokortikoidin metaboliaa ja heikentää siten glukokortikosteroidien tehoa.
Kumariinijohdannaiset (suun kautta otettavat antikoagulantit)
Kumariiniantikoagulanttien teho voi muuttua (lähinnä heikentyä) samanaikaisen kortikosteroidihoidon myötä. Samanaikainen anto voi edellyttää antikoagulantin annoksen muuttamista.
Estrogeenit (esim. ehkäisykäyttöön)
Estrogeenit voivat pidentää glukokortikoidien puoliintumisaikaa. Tällöin glukokortikoidien kliininen teho voimistuu.
Atropiini ja muut antikolinergiset lääkevalmisteet
Atropiini ja muut antikolinergiset lääkevalmisteet voivat johtaa silmänpaineen lisääntymiseen deksametasonihoidon aikana.
Sydänglukosidit
Glukosidivaikutus voi voimistua deksametasonihoidosta johtuvan kaliumvajeen myötä.
Salureetit/laksatiivit
Salureettien/laksatiivien käyttö samanaikaisesti deksametasonin kanssa voi voimistaa kaliumin erittymistä.
Pratsikvanteli
Glukokortikoidit voivat vähentää pratsikvantelin pitoisuuksia veressä.
Klorokiini, hydroksiklorokiini, meflokiini
Deksametasonin ja klorokiinin, hydroksiklorokiinin tai meflokiinin samanaikaiseen käyttöön liittyy kohonnut myopatian ja kardiomyopatian riski.
Immunosuppressantit
Deksametasonin ja muiden immunosuppressanttien samanaikainen anto lisää alttiutta infektioille ja mahdolliselle latenttien infektioiden pahenemiselle tai ilmenemiselle (esim. virus-, bakteeri-, sieni-, parasiitti- ja opportunistiset infektiot).
Siklosporiini
Deksametasonin ja siklosporiinin samanaikainen anto voi johtaa siklosporiinin pitoisuuden lisääntymiseen veressä, mikä aiheuttaa suuren aivojen epileptisten kohtausten riskin.
Ei-depolarisoivat lihasrelaksantit (rokuroni, vekuroni)
Samanaikainen ei-depolarisoivien lihasrelaksanttien anto voi pidentää lihasrelaksaatiota.
Protireliini
Glukokortikoidien anto voi vähentää kilpirauhasta stimuloivan hormonin (TSH) lisääntymistä. Tämä voi häiritä kilpirauhasongelmien diagnostisiin tarkoituksiin käytettävien lääkkeiden vaikutusta.
Fluorokinolonit
Jänteisiin liittyvien poikkeavuuksien riski voi lisääntyä fluorokinolonien samanaikaisen käytön yhteydessä.
Somatropiini
Somatropiinin vaikutus voi heikentyä pitkäaikaisen kortikosteroidihoidon tapauksessa.
Antasidit
Antasidien (esim. magnesiumhydroksidi ja alumiinihydroksidi) samanaikainen käyttö deksametasonin kanssa voi vähentää glukokortikoidien imeytymistä ja aiheuttaa deksametasonin tehon heikentymistä. Tämän vuoksi näiden lääkevalmisteiden ottamisen välissä on oltava vähintään 2 tuntia.
Raskaus ja imetys
Raskaus
Deksametasoni läpäisee veri-istukkaesteen. Raskauden aikana, etenkin ensimmäisen raskauskolmanneksen aikana, hoito on aloitettava vain sen mahdollisten riskien ja hyötyjen arvioinnin jälkeen. Deksametasonin puoliintumisaika voi pidentyä.
Sikiön kasvun poikkeavuuksia ei voida poissulkea pitkäaikaisen kortikosteroidihoidon yhteydessä raskauden aikana. Kortikosteroidien anto tiineenä oleville eläimille voi aiheuttaa poikkeavuuksia sikiön kehityksessä, mukaan lukien suulakihalkio, sikiön kasvun estyminen ja aivojen kasvuun ja kehitykseen kohdistuvat vaikutukset. Ei ole näyttöä siitä, että kortikosteroidien käyttö johtaisi synnynnäisten poikkeavuuksien kuten suulakihalkion/huulihalkion insidenssin lisääntymiseen ihmisillä. Ks. myös kohta Prekliiniset tiedot turvallisuudesta.
Jos glukokortikoidihoito tapahtuu raskauden loppuvaiheessa, tällöin on olemassa sikiön lisämunuaiskuoren atrofian riski, joka voi edellyttää vähitellen vähennettävää korvaushoitoa vastasyntyneellä.
Imetys
Deksametasoni erittyy ihmisen rintamaitoon. Tällä hetkellä ei tiedetä, voiko deksametasonin käyttö aiheuttaa vahinkoa imetettäville lapsille. Deksametasonia on joka tapauksessa määrättävä imetyksen aikana vain silloin, kun se on ehdottoman välttämätöntä. Imettämisen lopettaminen on suositeltavaa, jos sairaus edellyttää suurten deksametasoniannosten käyttöä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Zeqmelit-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Deksametasonihoitoon liittyvien haittavaikutusten esiintyvyydet on lueteltu alla. Luettelo perustuu markkinoille tulon jälkeisen käytön myötä raportoituihin haittatapahtumiin.
Haittavaikutusten esiintyvyyttä ei voida määritellä, koska ne ovat peräisin spontaaneista ilmoituksista. Siksi kaikkien alla mainittujen haittatapahtumien esiintyvyydeksi on määritetty "tuntematon".
Annoksesta ja hoidon kestosta riippuen seuraavia haittavaikutuksia voi ilmetä MedDRA-luokituksen mukaisissa elimissä ja järjestelmissä:
| Elinjärjestelmäluokka | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
| Veri ja imukudos | Keskivaikea leukosytoosi, lymfopenia, eosinopenia ja polysytemia |
| Umpieritys | Lisämunuaisen vajaatoiminta Cushingin oireyhtymän syntyminen (kuukasvot, vartalon rasvaisuus) |
| Silmät | Glaukooma, kaihi (etenkin myöhemmän subkapsulaarisen sumenemisen yhteydessä), sarveiskalvon haavaumien, sieni-, virus- ja bakteeriperäisten silmän infektioiden oireiden paheneminen, sarveiskalvon bakteeri-infektioiden paheneminen, ptoosi, mydriaasi, kemoosi, skleroottinen iatrogeeninen perforaatio, korioretinopatia, näön hämärtyminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Ruoansulatuselimistö | Mahahaava, ruoansulatuskanavan verenvuoto, pankreatiitti, epämiellyttävä tunne mahassa |
| Yleisoireet ja antopaikassa todettavat haitat | Haavojen viiveellä tuleva arpeutuminen |
| Immuunijärjestelmä | Yliherkkyysreaktiot (esim. eksanteema), vaikea-asteiset anafylaktiset reaktiot kuten rytmihäiriö, bronkospasmi, verenpaineen lasku tai nousu, verenkiertovajaus, sydänpysähdys |
| Infektiot | Infektioiden peittyminen, manifestaatio, infektioiden paheneminen tai uudelleen aktivoituminen (bakteeri-, virus-, sieni- parasiitti- ja opportunistiset infektiot), strongiloidiaasin aktivoituminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Aineenvaihdunta ja ravitsemus | Natriumretentio ja turvotus, lisääntynyt kaliumin erittyminen (joka voi johtaa rytmihäiriöihin), painonnousu, glukoosinsiedon heikentyminen, diabetes mellitus, hyperkolesterolemia, hypertriglyseridemia, ruokahalun lisääntyminen |
| Luusto, lihakset ja sidekudos | Lihasatrofia, lihasheikkous, myopatia, jänteiden poikkeavuudet, tendiniitti, jänteen repeämät, osteoporoosi (annosriippuvaista, voi ilmetä jo lyhytkestoisen hoidon jälkeen), aseptinen osteonekroosi, kasvun viivästyminen lapsilla, epiduraalinen lipomatoosi, jänteen repeämät. Liian nopea annoksen pienentäminen pitkäkestoisen hoidon jälkeen voi aiheuttaa oireita kuten lihas- ja nivelkipua. |
| Hermosto | Aivojen pseudotuumori (erityisesti lapsilla), epilepsian manifestaatiot ja paheneminen (kouristuskohtaukset) |
| Psyykkiset häiriöt | Masennus, hallusinaatiot, emotionaalinen epävakaus, ärtyneisyys, lisääntynyt aktiivisuus, psykoosi, mania, euforia, ahdistuneisuus, unen poikkeavuudet, itsetuhoiset ajatukset |
| Sukupuolielimet ja rinnat | Poikkeava sukupuolihormonien erittyminen (amenorrea, hirsutismi, impotenssi) |
| Iho ja ihonalainen kudos | Steroidiakne, punaiset arpijuovat, ihon atrofia, petekia, telangiektasiat, ekkymoosi, hypertrikoosi, rosakeiforminen dermatiitti (perioraalinen), ihon pigmentaation muutokset |
| Verisuonisto | Hypertensio, arterioskleroosin ja tromboosin riskin lisääntyminen, vaskuliitti, kapillaarien hauraus |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Akuutteja deksametasoni-intoksikaatiota ei ole tiedossa. Kroonisen yliannostuksen tapauksessa raportoitujen haittavaikutusten voimistuminen on odotettavissa (ks. kohta Haittavaikutukset), etenkin umpieritykseen, metaboliaan ja elektrolyyttitasapainoon liittyvien haittavaikutusten osalta.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Glukokortikoidit.
Deksametasoni.
ATC-koodi: H02AB02
Deksametasoni on fluoroglukokortikoidi, jolla on erittäin voimakas anti-inflammatorinen ja immunosuppressiivinen vaikutus ja heikko mineralokortikoidinen vaikutus. Kortikosteroidit estävät prostaglandiinien ja leukotrieenien synteesin. Nämä aineet välittävät tulehduksen vaskulaarisia ja sellulaarisia prosesseja immunologisen vasteen lisäksi. Tämä ilmenee vasodilataation vähenemisenä, neste-eksudaatin vähenemisenä, vähentyneenä leukosyyttiaktiivisuutena, neutrofiilien aggregaationa ja degranulaationa, hydrolyyttisten lysosomaalisten entsyymien vapautumisena, superoksidin kaltaisten vapaiden radikaalien tuotantona ja fibroosia sisältävien verisuonten määränä pitkäkestoisten prosessien aikana. Molemmat vaikutukset vastaavat samaa mekanismia, joka koostuu fosfolipaasi A2:n synteesin estosta. Kyseessä on entsyymi, joka vapauttaa monityydyttymättömiä rasvahappoja, jotka ovat prostaglandiinien ja leukotrieenien esiasteita.
Deksametasonin vaikutus kestää pitkään (biologinen puoliintumisaika 36 tuntia). Glukokortikoidivaikutus on 7,5 kertaa voimakkaampi kuin prednisonilla tai prednisolonilla ja 30 kertaa voimakkaampi kuin hydrokortisonilla.
Covid-19:n hoito
RECOVERY-tutkimus (Randomised Evaluation of COVid-19 thERapY) on tutkijalähtöinen, yksilöllisesti satunnaistettu, kontrolloitu, avoin, adaptiivinen tutkimus mahdollisten hoitojen vaikutusten arvioimiseksi potilailla, jotka ovat joutuneet sairaalahoitoon COVID-19:n takia.
Tutkimus tehtiin 176 sairaalaorganisaatiossa Iso-Britanniassa.
Tutkimuksessa 6 425 potilasta satunnaistettiin joko saamaan deksametasonia (2 104 potilasta) tai pelkkää tavanomaista hoitoa (4 321 potilasta). 89 %:lla potilaista oli laboratoriossa vahvistettu SARS-CoV-2-infektio.
Satunnaistamisen kohdalla 16 % potilasta sai invasiivista mekaanista ventilaatiota tai veren kehonulkoista happeuttamista, 60 % sai pelkkää lisähappea (non-invasiivisen ventilaation kanssa tai ilman sitä) ja 24 % ei saanut kumpaakaan näistä.
Potilaiden ikä oli keskimäärin 66,1 +/- 15,7 vuotta. 36 % potilaista oli naisia. 24 %:lla potilaista oli sairaushistoriassa diabetes, 27 %:lla sydänsairaus ja 21 %:lla krooninen keuhkosairaus.
Ensisijainen päätetapahtuma
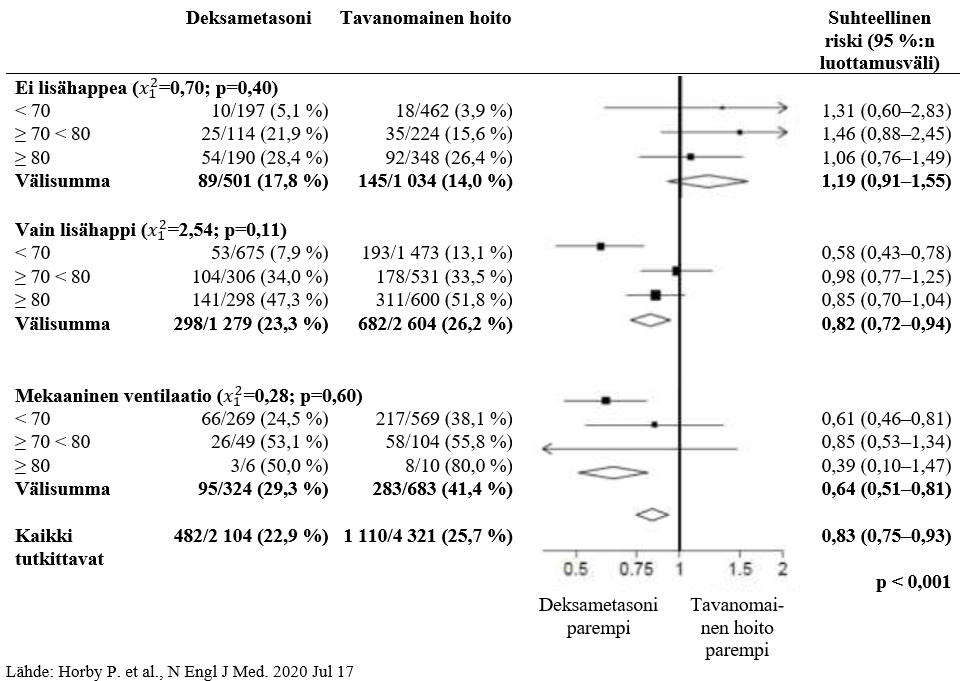
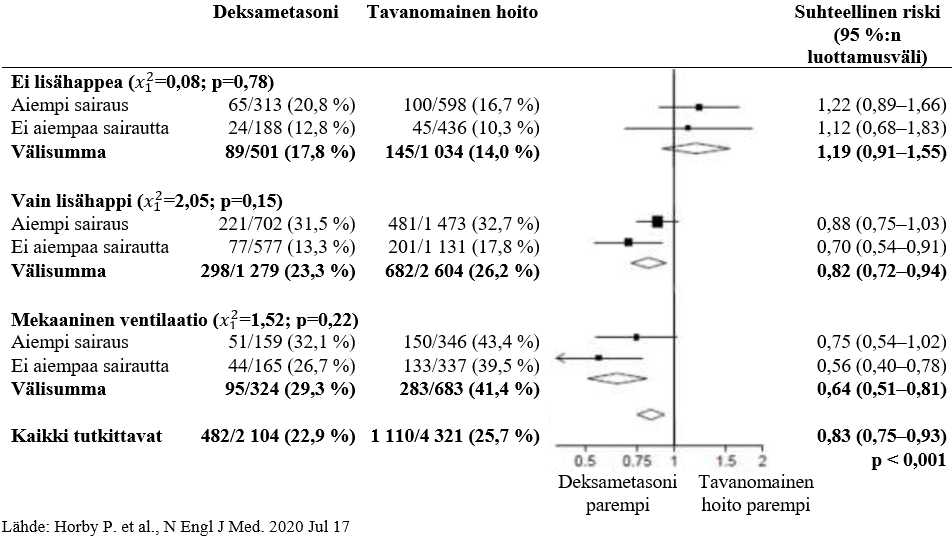
Kuolleisuus 28 vuorokauden kohdalla oli merkitsevästi vähäisempää deksametasoniryhmässä kuin tavanomaisen hoidon ryhmässä. Kuolemia raportoitiin 482/2 104 potilaalla deksametasoniryhmässä (22,9 %) ja 1 110/4 321 potilaalla tavanomaisen hoidon ryhmässä (25,7 %) (ilmaantuvuussuhde 0,83; 95 %:n luottamusväli 0,75–0,93; P < 0,001).
Deksametasoniryhmässä kuoleman insidenssi oli pienempi kuin tavanomaisen hoidon ryhmässä invasiivista mekaanista ventilaatiota saavilla potilailla (29,3 % deksametasoniryhmässä ja 41,4 % tavanomaisen hoidon ryhmässä; ilmaantuvuussuhde 0,64; 95 %:n luottamusväli 0,51–0,81) ja lisähappea ilman mekaanista ventilaatiota saavilla (23,3 % vs. 26,2 %; ilmaantuvuussuhde 0,82; 95 %:n luottamusväli 0,72–0,94).
Deksametasonilla ei ollut selkeää vaikutusta potilailla, jotka eivät saaneet hengityksen tukihoitoa satunnaistamisen kohdalla (17,8 % vs. 14,0 %; ilmaantuvuussuhde 1,19; 95 %:n luottamusväli 0,91–1,55).
Toissijaiset päätetapahtumat
Deksametasoniryhmässä olevilla potilailla sairaalahoidon kesto oli lyhempi kuin tavanomaista hoitoa saaneiden ryhmässä (mediaanikesto 12 vuorokautta vs. 13 vuorokautta) ja heillä oli suurempi todennäköisyys elossa kotiuttamiseen 28 vuorokauden sisällä (ilmaantuvuussuhde 1,10; 95 %:n luottamusväli 1,03–1,17).
Ensisijaisen päätetapahtuman mukaisesti suurin vaikutus 28 vuorokauden sisällä tapahtuvan kotiuttamisen osalta näkyi niillä potilailla, jotka saivat invasiivista mekaanista ventilaatiota satunnaistamisen kohdalla (ilmaantuvuussuhde 1,48; 95 %:n luottamusväli 1,16–1,90) ja sen jälkeen suurin vain lisähappea saaneilla (ilmaantuvuussuhde 1,15; 95 %:n luottamusväli 1,06–1,24). Potilailla, jotka eivät saaneet lisähappea, ei havaittu hyödyllistä vaikutusta (ilmaantuvuussuhde 0,96; 95 %:n luottamusväli 0,85–1,08).
| Hoitotulos | Deksametasoni (N = 2 104) | Tavanomainen hoito (N = 4 321) | Ilmaantuvuus- tai riskisuhde (95 %:n luottamusväli)* |
| määrä/potilaiden yhteismäärä (%) | |||
| Ensisijainen tulosmuuttuja | |||
| Kuolleisuus 28 vrk:n kohdalla | 482/2 104 (22,9) | 1 110/4 321 (25,7) | 0,83 (0,75–0,93) |
| Toissijainen tulosmuuttuja | |||
| Kotiuttaminen sairaalasta 28 vrk:n sisällä | 1 413/2 104 (67,2) | 2 745/4 321 (63,5) | 1,10 (1,03–1,17) |
| Invasiivinen mekaaninen ventilaatio tai kuolema† | 456/1 780 (25,6) | 994/3 638 (27,3) | 0,92 (0,84–1,01) |
| Invasiivinen mekaaninen ventilaatio | 102/1 780 (5,7) | 285/3 638 (7,8) | 0,77 (0,62–0,95) |
| Kuolema | 387/1 780 (21,7) | 827/3 638 (22,7) | 0,93 (0,84–1,03) |
* Ilmaantuvuussuhteet on korjattu iän suhteen koskien 28 vuorokauden kuolleisuuden ja sairaalasta kotiuttamisen hoitotuloksia. Riskisuhteet on korjattu iän suhteen koskien invasiivisen mekaanisen ventilaation saamisen tai kuoleman hoitotuloksia ja niiden osatekijöitä. † Tästä kategoriasta on poistettu potilaat, jotka saivat invasiivista mekaanista ventilaatiota satunnaistamisen kohdalla. | |||
Turvallisuus
Tutkimushoitoon liittyi neljä vakavaa haittatapahtumaa (SAE): kaksi koski hyperglykemiaa, yksi steroidien indusoimaa psykoosia ja yksi ylemmän ruoansulatuskanavan verenvuotoa. Kaikki tapahtumat korjautuivat.
Alaryhmäanalyysit
DEKSAMETASONI-hoitoon allokoinnin vaikutukset 28 vuorokauden aikaiseen kuolleisuuteen satunnaistamisen hetkellä olevan iän ja hengityksen tukihoidon perusteella jaoteltuna
DEKSAMETASONI-hoitoon allokoinnin vaikutukset 28 vuorokauden aikaiseen kuolleisuuteen satunnaistamisen hetkellä olevan hengityksen tukihoidon ja minkä tahansa kroonisen sairauden sairaushistorian perusteella jaoteltuna
Farmakokinetiikka
Imeytyminen
Deksametasoni imeytyy nopeasti ja lähes täydellisesti mahassa ja ohutsuolessa suun kautta annon jälkeen. Biologinen hyötyosuus suun kautta annon jälkeen on 80 %–90 %. Huippupitoisuus plasmassa saavutetaan 1–2 tunnin kuluttua annosta.
Jakautuminen
Deksametasoni sitoutuu plasman albumiiniin annosriippuvaisesti. Suurilla annoksilla suurin osa siitä kiertää vapaasti veren plasmassa, ja hypoalbuminemian tapauksissa proteiineihin sitoutumattoman kortikoidin osuus lisääntyy.
Metabolia ja eliminaatio
Deksametasonin puoliintumisaika aikuisilla on noin 3–6 tuntia.
Deksametasonin eliminaatio tapahtuu pääasiassa metabolian kautta. Deksametasoni metaboloituu pääasiallisesti CYP3A-välitteisen hydroksylaation kautta maksassa, mutta myös 11-beeta-hydroksisteroidi-dehydrogenaasi-isoentsyymivälitteisesti munuaisissa. Deksametasoni ja sen metaboliitit erittyvät virtsaan.
Munuaisten ja maksan vajaatoiminta
Munuaisten vajaatoiminta ei vaikuta deksametasonin farmakokinetiikkaan. Deksametasonin terminaalisen puoliintumisajan on todettu lisääntyvän potilailla, joilla on vaikea maksan vajaatoiminta.
Prekliiniset tiedot turvallisuudesta
Akuutti ja krooninen toksisuus
Glukokortikoideilla on hyvin vähän akuuttia toksisuutta. Ei ole olemassa tietoja eläinten altistuksesta krooniselle toksisuudelle.
Mutageenisuus ja teratogeenisuus
Glukokortikoideilla tehtyjen tutkimusten tulosten perusteella ei ole havaittu mitään kliinisesti merkityksellisiä genotoksisia ominaisuuksia.
Lisääntymistoksisuus
Eläinkokeissa suulakihalkiota havaittiin rotilla, hiirillä, hamstereilla, kaneilla, koirilla ja kädellisillä. Joissakin tapauksissa näiden löydösten kanssa esiintyi keskushermoston ja sydämen vikoja. Sikiön kasvun estymistä voi myös esiintyä. Kaikki nämä vaikutukset havaittiin suurilla annoksilla.
Farmaseuttiset tiedot
Apuaineet
Hypromelloosi
Glyseroli
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ZEQMELIT kalvo, suussa hajoava
4 mg (L:ei) 2 kpl (32,43 €)
6 mg (L:ei) 2 kpl (32,43 €)
8 mg (L:ei) 2 kpl (32,43 €)
PF-selosteen tieto
Suussa hajoava kalvo on pakattu annospussiin. Materiaalina on polyetyleeni-alumiini-polyetyleenitereftalaatti (PE-Al-PET).
Pakkauskoko: 2, 3 tai 5 annospussia
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
4 mg: Valkoinen tai vaaleankeltainen, läpikuultava, suorakulmion muotoinen kalvo, jonka mitat ovat 20 mm × 17 mm.
6 mg: Valkoinen tai vaaleankeltainen, läpikuultava, suorakulmion muotoinen kalvo, jonka mitat ovat 20 mm × 25 mm.
8 mg: Valkoinen tai vaaleankeltainen, läpikuultava, suorakulmion muotoinen kalvo, jonka mitat ovat 20 mm × 33 mm.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ZEQMELIT kalvo, suussa hajoava
4 mg 2 kpl
6 mg 2 kpl
8 mg 2 kpl
- Ei korvausta.
ATC-koodi
H02AB02
Valmisteyhteenvedon muuttamispäivämäärä
08.11.2023
Yhteystiedot
Box 6216
102 34 Stockholm
Sweden
+46 10 130 99 50
medinfo@unimedicpharma.se
