FINLEE dispergerbar tablett 10 mg
Kvalitativ och kvantitativ sammansättning
En dispergerbar tablett innehåller dabrafenibmesilat motsvarande 10 mg dabrafenib.
Hjälpämne med känd effekt
En dispergerbar tablett innehåller < 0,00078 mg bensylalkohol.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Dispergerbar tablett.
Kliniska uppgifter
Terapeutiska indikationer
Låggradigt gliom
Finlee i kombination med trametinib är avsett för behandling av pediatriska patienter från 1 års ålder med låggradigt gliom (LGG) med BRAF V600E-mutation, som kräver systemisk behandling.
Höggradigt gliom
Finlee i kombination med trametinib är avsett för behandling av pediatriska patienter från 1 års ålder med höggradigt gliom (HGG) med BRAF V600E-mutation, som tidigare har fått minst en behandling med radioterapi och/eller kemoterapi.
Villkor
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Dosering och administreringssätt
Behandling med Finlee ska inledas och övervakas av kvalificerad läkare med erfarenhet av användning av cancerläkemedel.
Innan patienterna tar Finlee måste de ha en bekräftelse på BRAF V600E-mutation bedömd med en CE-märkt medicinsk utrustning för in vitro-diagnostik (IVD) med motsvarande avsedda syfte. Om den CE-märkta IVD:n inte är tillgänglig, bör bekräftelsen på BRAF V600E bedömas med ett alternativt validerat test.
Finlee används i kombination med trametinib pulver till oral lösning. Se produktresumén angående dosering av trametinib pulver till oral lösning.
Finlee ska inte bytas ut mot andra beredningsformer av dabrafenib eftersom bioekvivalens inte har påvisats (se avsnitt Farmakokinetiska egenskaper).
Dosering
Rekommenderad dos Finlee två gånger dagligen är beroende av kroppsvikten (tabell 1).
Tabell 1 Dosregim baserad på kroppsvikt
| Kroppsvikt* | Rekommenderad dos (mg dabrafenib) två gånger dagligen | Rekommenderad dos (antal 10 mg-tabletter) två gånger dagligen |
| 8‑9 kg | 20 mg | 2 |
| 10‑13 kg | 30 mg | 3 |
| 14‑17 kg | 40 mg | 4 |
| 18‑21 kg | 50 mg | 5 |
| 22‑25 kg | 60 mg | 6 |
| 26‑29 kg | 70 mg | 7 |
| 30‑33 kg | 80 mg | 8 |
| 34‑37 kg | 90 mg | 9 |
| 38‑41 kg | 100 mg | 10 |
| 42‑45 kg | 110 mg | 11 |
| 46‑50 kg | 130 mg | 13 |
| ≥ 51 kg | 150 mg | 15 |
*Kroppsvikten avrundas vid behov till närmaste kg. Rekommenderad dos till patienter som väger under 8 kg har inte fastställts. Doseringsanvisningar för behandling med trametinib i kombination med Finlee finns i produktresumén för trametinib pulver till oral lösning, avsnitten ”Dosering” och ”Administreringssätt”. | ||
Behandlingstid
Behandling med Finlee ska pågå fram till sjukdomsprogression eller tills oacceptabel toxicitet uppträder. Data för patienter över 18 år med gliom är begränsade. Fortsatt behandling i vuxen ålder ska därför baseras på av läkaren utförd nytta-riskbedömning för varje enskild patient.
Missade eller försenade doser
Om en dos Finlee missas ska den inte tas om det är mindre än 6 timmar till nästa planerade dos. Om patienten kräks efter att ha tagit Finlee ska inte någon extra dos tas utan nästa dos ska tas vid den planerade tiden.
Dosjustering
För att hantera biverkningar kan dossänkning, behandlingsuppehåll eller utsättning av behandlingen bli nödvändigt (se tabell 2 och 3).
Om behandlingsrelaterade toxiciteter uppträder ska både dabrafenib och trametinib dossänkas, avbrytas eller sättas ut samtidigt. Undantag där dosjusteringar är nödvändiga för endast en av de två behandlingarna beskrivs nedan för uveit, RAS-mutationspositiva icke-kutana maligniteter (främst relaterat till dabrafenib), reducerad vänsterkammarejektionsfraktion (LVEF), retinalvensocklusion (RVO), näthinneavlossning (RPED) och interstitiell lungsjukdom (ILD)/pneumonit (främst relaterat till trametinib).
Dosjusteringar eller behandlingsuppehåll rekommenderas inte vid biverkningar i form av kutana maligniteter (se avsnitt Varningar och försiktighet).
Tabell 2 Dosjusteringsschema baserat på graden av eventuella biverkningar (exklusive feber)
| Grad (CTCAE)* | Rekommenderade justeringar av dabrafenibdosen |
| Grad 1 eller grad 2 (tolererbara) | Fortsätt behandlingen och följ upp efter kliniskt behov. |
| Grad 2 (ej tolererbara) eller grad 3 | Avbryt behandlingen tills biverkningarna avtagit till grad 0 till 1 och sänk dosen med ett steg när behandlingen återupptas. Doseringsriktlinjer finns i tabell 3. |
| Grad 4 | Avbryt behandlingen permanent, eller avbryt tills biverkningarna avtagit till grad 0 till 1 och sänk dosen med ett steg när behandlingen återupptas. Doseringsriktlinjer finns i tabell 3. |
| * Intensitet hos kliniska biverkningar graderade efter Common Terminology Criteria for Adverse Events (CTCAE) | |
Tabell 3 Rekommenderade dossänkningar på grund av biverkningar
| Kroppsvikt | Rekommenderad dos (mg dabrafenib) två gånger dagligen | Reducerad dos (antal 10 mg-tabletter) två gånger dagligen | ||
| Första dos-sänkning | Andra dos-sänkning | Tredje dos-sänkning | ||
| 8‑9 kg | 20 mg | 1 | N/A | N/A |
| 10‑13 kg | 30 mg | 2 | 1 | N/A |
| 14‑17 kg | 40 mg | 3 | 2 | 1 |
| 18‑21 kg | 50 mg | 3 | 2 | 1 |
| 22‑25 kg | 60 mg | 4 | 3 | 2 |
| 26‑29 kg | 70 mg | 5 | 4 | 2 |
| 30‑33 kg | 80 mg | 5 | 4 | 3 |
| 34‑37 kg | 90 mg | 6 | 5 | 3 |
| 38‑41 kg | 100 mg | 7 | 5 | 3 |
| 42‑45 kg | 110 mg | 7 | 6 | 4 |
| 46‑50 kg | 130 mg | 9 | 7 | 4 |
| ≥ 51 kg | 150 mg | 10 | 8 | 5 |
N/A = ej relevant Sätt ut behandlingen med Finlee permanent om patienten inte tolererar 10 mg två gånger dagligen, eller efter högst 3 dossänkningar. | ||||
När patientens biverkningar kan hanteras effektivt kan man överväga att åter öka dosen och därvid följa samma doseringssteg som användes vid dossänkningen. Dabrafenibdosen ska inte överstiga den rekommenderade dosen i tabell 1.
Dosjusteringar vid utvalda biverkningar
Feber
Om en patients kroppstemperatur är ≥ 38 °C ska behandlingen med dabrafenib och trametinib avbrytas. Vid återfall kan behandlingen också avbrytas vid det första symtomet på feber. Behandling med antipyretika såsom ibuprofen eller paracetamol ska inledas. Användning av orala kortikosteroider ska övervägas i de fall där antipyretika är otillräckliga. Patienterna ska utvärderas för tecken och symtom på infektion och vid behov behandlas i linje med lokal praxis (se avsnitt Varningar och försiktighet). Behandlingen ska återinsättas om patienten är symtomfri i minst 24 timmar antingen 1) på samma dosnivå eller 2) reducerad med en dosnivå om febern är återkommande och/eller åtföljs av andra allvarliga symtom såsom uttorkning, hypotoni eller njursvikt.
Undantag från dosjustering (där endast en av två behandlingar är dossänkt) för utvalda biverkningar
Uveit
Inga dosjusteringar krävs för uveit så länge effektiva lokala behandlingar kan kontrollera inflammation i ögonen. Vid uteblivet svar på lokal ögonbehandling ska uppehåll med dabrafenib göras tills ögoninflammationen läkt. Därefter kan dabrafenib återinsättas, reducerat med en dosnivå. Ingen dosjustering av trametinib krävs när det tas i kombination med dabrafenib (se avsnitt Varningar och försiktighet).
RAS‑mutationspositiva icke-kutana maligniteter
Nyttan och riskerna måste övervägas innan behandling med dabrafenib fortsätter hos patienter med icke-kutan malignitet som har en RAS-mutation. Ingen dosjustering av trametinib krävs när det tas i kombination med dabrafenib (se avsnitt Varningar och försiktighet).
Reducerad vänsterkammarejektionsfraktion (LVEF)/vänsterkammardysfunktion
Vid absolut minskning av LVEF på > 10 % jämfört med vid baslinjen och om ejektionsfraktionen ligger under institutionens lägsta normalvärde (LLN), se produktresumén för trametinib pulver till oral lösning (avsnitt Dosering och administreringssätt) för instruktioner om dosjustering för trametinib. Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib (se avsnitt Varningar och försiktighet).
Retinalvensocklusion (RVO) och näthinneavlossning (RPED)
Om patienterna rapporterar nya synstörningar, såsom centralt skotom, dimsyn eller synförlust någon gång under kombinationsbehandling med dabrafenib och trametinib, se produktresumén för trametinib pulver till oral lösning (avsnitt Dosering och administreringssätt) för instruktioner om dosjustering för trametinib. Ingen dosjutering av dabrafenib krävs när det tas i kombination med trametinib vid bekräftade fall av RVO eller RPED.
Interstitiell lungsjukdom (ILD)/pneumonit
Hos patienter behandlade med dabrafenib i kombination med trametinib med misstänkt ILD eller pneumonit, inklusive patienter med nya eller progressiva pulmonella symtom och symtom som hosta, dyspné, hypoxi, pleurautgjutning eller -infiltrat, i avvaktan på kliniska undersökningar, se produktresumén för trametinib pulver till oral lösning (avsnitt Dosering och administreringssätt) för instruktioner om dosjustering för trametinib. Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib vid fall av ILD eller pneumonit.
Särskilda populationer
Nedsatt leverfunktion
Ingen dosjustering krävs för patienter med lätt nedsatt leverfunktion. Det finns inga kliniska data för patienter med måttlig till kraftig leverfunktionsnedsättning och eventuellt behov av dosjustering kan inte fastställas (se avsnitt Farmakokinetiska egenskaper). Metabolism i levern och utsöndring via gallan är de primära elimineringsvägarna för dabrafenib och dess metaboliter och exponeringen kan vara förhöjd hos patienter med måttlig till kraftig leverfunktionsnedsättning. Dabrafenib ska användas med försiktighet till patienter med måttlig till kraftig leverfunktionsnedsättning.
Nedsatt njurfunktion
Ingen dosjustering krävs för patienter med lätt eller måttligt nedsatt njurfunktion. Det finns inga kliniska data för patienter med kraftig njurfunktionsnedsättning och eventuellt behov av dosjustering kan inte fastställas (se avsnitt Farmakokinetiska egenskaper). Dabrafenib ska användas med försiktighet till patienter med kraftig njurfunktionsnedsättning.
Pediatrisk population
Säkerhet och effekt för kombinationsbehandling med dabrafenib och trametinib för barn under 1 år har inte fastställts. Inga data finns tillgängliga. Studier på unga djur har visat på påverkan av dabrafenib som inte sågs hos vuxna djur (se avsnitt Prekliniska säkerhetsuppgifter). Data om långtidssäkerhet hos pediatriska patienter är för närvarande begränsade.
Administreringssätt
Finlee är avsedd för oral användning.
Finlee ska tas utan föda, minst en timme före eller två timmar efter måltid (se avsnitt Farmakokinetiska egenskaper). Bröstmjölk och/eller modersmjölksersättning kan ges vid behov om en patient inte tolererar fasta.
Det rekommenderas att doserna av Finlee tas vid ungefär samma tidpunkt varje dag, med ett mellanrum på cirka 12 timmar mellan doserna. Den dagliga engångsdosen av trametinib ska tas tillsammans med antingen morgon- eller kvällsdosen av Finlee, vid samma tidpunkt varje dag.
Om patienten inte kan svälja och har nasogastrisk sond kan en suspension av Finlee-tabletten ges via sonden.
Anvisningar för beredning och administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Finlee är avsett att användas i kombination med trametinib pulver till oral lösning då det finns begränsade effektdata för dabrafenib i monoterapi och för trametinib i monoterapi vid BRAF V600-mutationspositivt gliom. Produktresumén för trametinib pulver till oral lösning måste läsas innan behandling påbörjas. För ytterligare information om varningar och försiktighet associerat med behandling med trametinib, se produktresumén för trametinib pulver till oral lösning.
BRAF V600E-test
Effekt och säkerhet för dabrafenib har inte fastställts hos patienter med gliom av vildtyp-BRAF. Dabrafenib ska inte användas till patienter med gliom av vildtyp-BRAF (se avsnitt Farmakodynamiska egenskaper).
Nya maligniteter
Nya maligniteter, kutana och icke‑kutana, kan uppkomma när dabrafenib används i kombination med trametinib.
Kutana maligniteter
Kutana maligniteter som kutant skivepitelkarcinom (cuSCC), inklusive keratoakantom och nytt primärt melanom, har observerats hos vuxna patienter som behandlats med dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Undersökning av huden rekommenderas innan behandling med dabrafenib sätts in och varje månad under behandlingsperioden och i upp till sex månader efter behandling. Övervakningen ska fortsätta i 6 månader efter utsättning av dabrafenib eller fram tills annan cancerbehandling sätts in.
Misstänkta hudlesioner ska behandlas genom dermatologisk excision och ingen justering av behandlingen krävs. Patienterna ska instrueras att informera läkaren omedelbart om nya hudlesioner utvecklas.
Icke-kutana maligniteter
In vitro-experiment har visat paradoxal aktivering av mitogenaktiverade proteinkinassignaler (MAP-kinas) i vildtyp BRAF-celler med RAS-mutationer när dessa exponerades för BRAF-hämmare. Detta kan leda till ökad risk för icke‑kutana maligniteter vid dabrafenibexponering (se avsnitt Biverkningar) hos patienter med RAS‑mutationer. RAS‑associerade maligniteter har rapporterats i kliniska studier på vuxna, både med andra BRAF-hämmare (kronisk myelomonocytisk leukemi och icke‑kutant skivepitelkarcinom på huvud och hals) liksom med dabrafenib i monoterapi (pankreasadenokarcinom, gallgångsadenokarcinom) och med dabrafenib i kombination med trametinib (kolorektalcancer, pankreascancer).
Nyttan och riskerna ska övervägas innan dabrafenib administreras till patienter med en tidigare eller pågående cancer associerad med RAS-mutationer. Patienterna ska screenas för ockulta redan befintliga maligniteter.
Efter utsättning av dabrafenib ska övervakning av icke-kutana sekundära/recidiverande maligniteter utföras under upp till 6 månader eller tills annan cancerbehandling sätts in. Onormala fynd ska behandlas enligt klinisk praxis.
Blödning
Blödningar har rapporterats hos vuxna och pediatriska patienter som tagit dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Större blödningar och blödningar med dödlig utgång har förekommit hos vuxna patienter som behandlas med dabrafenib i kombination med trametinib. Risken för dessa händelser hos patienter med lågt antal trombocyter (< 75 000/mm3) har inte fastställts eftersom sådana patienter exkluderades från kliniska studier. Blödningsrisken kan öka vid samtidig användning av trombocythämmare eller vid antikoagulantiabehandling. Om blödningar uppstår ska patienten behandlas efter kliniskt behov.
Synnedsättning
Oftalmologiska reaktioner, såsom uveit och iridocyklit, har rapporterats hos pediatriska patienter som tar dabrafenib i kombination med trametinib (se avsnitt Biverkningar), som i vissa fall debuterade efter flera månader. I kliniska studier på vuxna patienter som behandlas med dabrafenib har oftalmologiska reaktioner, inklusive uveit, iridocyklit och irit, rapporterats. Patienterna ska regelbundet kontrolleras med avseende på synliga tecken och symtom (såsom synförändringar, fotofobi och ögonsmärta) medan de behandlas.
Inga dosjusteringar krävs så länge ögoninflammationen kan kontrolleras med effektiva lokala behandlingar. Om uveit inte svarar på lokal ögonbehandling ska uppehåll med dabrafenib göras tills ögoninflammationen läkt ut. Därefter kan dabrafenib återinsättas, reducerat med en dosnivå. Vid diagnostiserad uveit krävs inga dosjusteringar av trametinib när det tas i kombination med dabrafenib.
Fall av bilateral panuveit eller bilateral iridocyklit som tyder på Vogt-Koyanagi-Haradas syndrom har rapporterats hos patienter som behandlats med dabrafenib i kombination med trametinib. Pausa behandling med dabrafenib tills ögoninflammationen har försvunnit och överväg att konsultera en ögonläkare. Systemisk kortikosteroidbehandling kan vara nödvändig.
RPED och RVO kan uppträda med dabrafenib i kombination med trametinib. Se produktresumén för trametinib pulver till oral lösning (avsnitt Varningar och försiktighet). Vid diagnostiserad RVO eller PRED krävs ingen dosjustering av dabrafenib när det tas i kombination med trametinib.
Feber
Feber har rapporterats i kliniska studier med dabrafenib hos vuxna och pediatriska patienter (se avsnitt Biverkningar). Allvarliga, icke-infektiösa feberhändelser noterades (definierade som feber tillsammans med svåra frossbrytningar, uttorkning, hypotoni och/eller akut njurinsufficiens av pre-renalt ursprung, förekom hos patienter med normal njurfunktion innan behandling). Hos pediatriska patienter som fick dabrafenib i kombination med trametinib var mediantiden till feberdebut 1,5 månader. Hos vuxna patienter med icke-resekterbart eller metastaserat melanom som fick dabrafenib i kombination med trametinib och som fick feber, inträffade ungefär hälften av de första feberhändelserna under den första behandlingsmånaden och ungefär en tredjedel av patienterna fick feber tre eller fler gånger. Patienter med allvarliga, icke-infektiösa feberhändelser svarade väl på doseringsuppehåll och/eller dosreducering och understödjande behandling.
Behandling med dabrafenib och trametinib ska avbrytas om patientens kroppstemperatur är ≥ 38 ºC (se avsnitt Farmakodynamiska egenskaper). Vid återfall kan behandlingen också avbrytas vid det första symtomet på feber. Behandling med antipyretika såsom ibuprofen eller paracetamol ska inledas. Användning av orala kortikosteroider ska övervägas i de fall där antipyretika är otillräckliga. Patienterna ska utvärderas för tecken och symtom på infektion. Behandlingen kan återinsättas när febern försvinner. Om febern är förknippad med andra allvarliga symtom ska behandlingen återinsättas med reducerad dos när febern väl upphört och enligt vad som är kliniskt lämpligt (se avsnitt Dosering och administreringssätt).
Reducerad vänsterkammarejektionsfraktion LVEF/vänsterkammardysfunktion
Dabrafenib i kombination med trametinib har rapporterats reducera LVEF hos både vuxna och pediatriska patienter (se avsnitt Biverkningar). I kliniska studier på pediatriska patienter var mediantiden till debut av första förekomsten av LVEF-minskning cirka en månad. I kliniska studier på vuxna patienter var mediantiden till debut av första förekomsten av vänsterkammardysfunktion, hjärtsvikt och reducerad LVEF mellan 2 och 5 månader.
Hos patienter som behandlas med dabrafenib i kombination med trametinib har det förekommit enstaka rapporter om akut, svår vänsterkammardysfunktion på grund av myokardit. Fullständig återhämtning observerades vid avbrytande av behandlingen. Läkarna ska vara uppmärksamma på risken för myokardit hos patienter som utvecklar nya eller förvärrade tecken eller symtom på hjärtbesvär. Se produktresumén (avsnitt Varningar och försiktighet) för trametinib pulver till oral lösning för ytterligare information. Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib.
Njursvikt
Njursvikt har identifierats hos ≤ 1 % av de vuxna patienterna som behandlades med dabrafenib i kombination med trametinib. Observerade fall hos vuxna patienter förknippades i allmänhet med feber och dehydrering och svarade väl på doseringsavbrott och allmän stödjande behandling. Granulomatös nefrit har också rapporterats hos vuxna patienter. Patienternas serumkreatinin ska rutinmässigt övervakas då de är under behandling. Om kreatininet ökar kan det vara kliniskt lämpligt att avbryta behandlingen. Dabrafenib har inte studerats hos patienter med njurinsufficiens (definierat som kreatinin > 1,5 x ULN) och ska därför hanteras med stor försiktighet under dessa omständigheter (se avsnitt Farmakokinetiska egenskaper).
Leverpåverkan
Leverbiverkningar har rapporterats hos vuxna och pediatriska patienter i kliniska studier med dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Kontroll av leverfunktionen rekommenderas var fjärde vecka under 6 månader från behandlingsstarten. Därefter kan leverkontroller göras efter kliniskt behov.
Förändrat blodtryck
Såväl hypertoni som hypotoni har rapporterats hos patienter i kliniska studier med dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Blodtrycket ska mätas vid behandlingsstarten och övervakas under behandlingen och hypertoni åtgärdas vid behov med gängse behandling.
Interstitiell lungsjukdom(ILD)/pneumonit
Fall av pneumonit eller ILD har rapporterats hos vuxna patienter i kliniska studier med dabrafenib i kombination med trametinib. Se produktresumén för trametinib pulver till oral lösning för ytterligare information.
Hudutslag
Hudutslag har observerats hos 49 % av de pediatriska patienterna i kliniska studier när dabrafenib användes i kombination med trametinib (se avsnitt Biverkningar). Majoriteten av dessa fall var av grad 1 eller 2 och krävde inte behandlingsavbrott eller dossänkning.
Allvarliga hudbiverkningar
Fall av allvarliga hudbiverkningar (SCAR), inklusive Stevens-Johnsons syndrom och läkemedelsreaktion med eosinofili och systemiska symtom (DRESS), som kan vara livshotande eller ha dödlig utgång, har rapporterats hos vuxna patienter vid kombinationsbehandling med dabrafenib och trametinib. Innan behandling påbörjas ska patienterna informeras om tecken och symtom och övervakas noga för hudreaktioner. Om tecken och symtom som tyder på SCAR uppträder ska behandlingen sättas ut.
Rabdomyolys
Rabdomyolys har rapporterats hos vuxna patienter som tar dabrafenib i kombination med trametinib. Tecken och symtom på rabdomyolys ska utgöra grund för lämplig klinisk utredning och behandling enligt indikation. Se produktresumén för trametinib pulver till oral lösning för ytterligare information.
Pankreatit
Pankreatit har rapporterats hos vuxna och pediatriska patienter som behandlats med dabrafenib i kombination med trametinib i kliniska studier (se avsnitt Biverkningar). Oförklarliga buksmärtor ska utredas skyndsamt och inkludera mätning av serumamylas och -lipas. Patienterna ska följas noga när behandlingen återinsätts efter en pankreatitepisod.
Djup ventrombos (DVT)/lungemboli (PE)
Lungemboli eller djup ventrombos kan förekomma. Om patienterna utvecklar symtom på djup ventrombos eller lungemboli såsom andnöd, bröstsmärta eller arm‑ eller bensvullnad ska de omedelbart söka sjukvård. Behandlingen ska sättas ut permanent vid livshotande lungemboli.
Gastrointestinala störningar
Kolit och enterokolit har rapporterats hos pediatriska patienter som behandlats med dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Kolit och gastrointestinal perforation, inklusive fall med dödlig utgång, har rapporterats hos vuxna patienter som tar dabrafenib i kombination med trametinib. Se produktresumén för trametinib pulver till oral lösning för ytterligare information.
Sarkoidos
Fall av sarkoidos har rapporterats hos vuxna patienter som behandlats med dabrafenib i kombination med trametinib, oftast i hud, lungor, ögon och lymfkörtlar. I de flesta fallen fortsatte behandlingen med dabrafenib och trametinib. Om sarkoidos fastställs ska lämplig behandling övervägas. Det är viktigt att sarkoidos inte misstolkas som sjukdomsprogression.
Fertila kvinnor/fertilitet hos män
Innan behandling sätts in hos fertila kvinnor ska lämplig rådgivning om effektiva preventivmetoder ges. Fertila kvinnor måste använda effektiva preventivmetoder under behandlingen och 2 veckor efter avslutad behandling med dabrafenib och under 16 veckor efter avslutad behandling med trametinib. Manliga patienter som tar dabrafenib i kombination med trametinib ska informeras om den potentiella risken för försämrad spermatogenes, som kan vara irreversibel (se avsnitt Fertilitet, graviditet och amning).
Hemofagocyterande lymfohistiocytos
Efter godkännandet för försäljning har hemofagocyterande lymfohistiocytos (HLH) observerats hos vuxna patienter som behandlats med dabrafenib i kombination med trametinib. Försiktighet ska iakttas när dabrafenib administreras i kombination med trametinib. Om HLH bekräftas ska administreringen av dabrafenib och trametinib avbrytas och behandling av HLH inledas.
Tumörlyssyndrom (TLS)
Förekomsten av TLS, som kan vara dödlig, har associerats med användning av dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Riskfaktorer för TLS inkluderar hög tumörbörda, redan existerande kronisk njurinsufficiens, oliguri, uttorkning, hypotoni och sur urin. Patienter med riskfaktorer för TLS ska övervakas noggrant och profylaktisk hydrering ska övervägas. TLS ska behandlas omedelbart, enligt klinisk indikation.
Andra läkemedels effekt på dabrafenib
Dabrafenib är substrat till CYP2C8 och CYP3A4. Potenta inducerare av dessa enzymer ska undvikas när så är möjligt eftersom dessa substanser kan minska effekten av dabrafenib (se avsnitt Interaktioner).
Dabrafenibs effekter på andra läkemedel
Dabrafenib inducerar metaboliserande enzymer, vilket kan leda till försämrad effekt hos många vanliga läkemedel (se exempel i avsnitt Interaktioner). En genomgång av läkemedelsanvändningen är därför av största vikt när dabrafenibbehandling sätts in. Samtidig användning av dabrafenib och läkemedel som är känsliga substrat till vissa metaboliserande enzymer eller transportörer (se avsnitt Interaktioner) ska som regel undvikas om kontroll av effekten och dosjustering inte är möjligt.
Samtidig administrering av dabrafenib och warfarin resulterar i minskad exponering för warfarin. Försiktighet ska iakttas och ytterligare kontroller av International Normalised Ratio (INR) rekommenderas när dabrafenib används samtidigt med warfarin och vid utsättning av dabrafenib (se avsnitt Interaktioner).
Samtidig administrering av dabrafenib och digoxin kan resultera i minskad exponering för digoxin. Försiktighet ska iakttas och ytterligare övervakning av digoxin (ett transportproteinsubstrat) rekommenderas om dabrafenib används samtidigt med digoxin och vid utsättning av dabrafenib (se avsnitt Interaktioner).
Hjälpämnen
Kalium
Detta läkemedel innehåller mindre än 1 mmol (39 mg) kalium per maximal daglig dos, d.v.s. är näst intill ”kaliumfritt”.
Bensylalkohol
Detta läkemedel innehåller < 0,00078 mg bensylalkohol per dispergerbar tablett.
Bensylalkohol kan orsaka allergiska reaktioner.
Patienter under 3 år ska övervakas avseende symtom från andningsvägarna.
Patienter som är eller kan bli gravida ska informeras om den potentiella risken för fostret på grund av innehållsämnet bensylalkohol, vilket kan ansamlas över tid och orsaka metabol acidos.
Dabrafenib dispergerbara tabletter ska användas med försiktighet till patienter med nedsatt lever- eller njurfunktion eftersom bensylalkohol kan ansamlas över tid och orsaka metabol acidos.
Interaktioner
Interaktionsstudier har endast utförts på vuxna.
Andra läkemedels effekt på dabrafenib
Dabrafenib är substrat till de metaboliserande enzymerna CYP2C8 och CYP3A4, medan de aktiva metaboliterna hydroxidabrafenib och desmetyldabrafenib är CYP3A4‑substrat. Läkemedel som är starka hämmare eller inducerare av CYP2C8 eller CYP3A4 ökar respektive minskar sannolikt dabrafenibkoncentrationen. Alternativa läkemedel ska övervägas under administrering av dabrafenib när så är möjligt. Dabrafenib ska användas med försiktighet om starka hämmare (t.ex. ketokonazol, gemfibrozil, nefazodon, klaritromycin, ritonavir, sakvinavir, telitromycin, itrakonazol, vorikonazol, posakonazol och atazanavir) administreras samtidigt som dabrafenib. Samtidig administrering av dabrafenib och potenta inducerare av CYP2C8 eller CYP3A4 (t.ex. rifampicin, fenytoin, karbamazepin, fenobarbital eller johannesört (Hypericum perforatum)) ska undvikas.
Administrering av ketokonazol (en CYP3A4‑hämmare) 400 mg en gång dagligen med dabrafenib 75 mg två gånger dagligen resulterade i en ökning med 71 % av dabrafenibs AUC och en ökning med 33 % av dabrafenibs Cmax jämfört med administrering av enbart dabrafenib. Samtidig administrering resulterade i ökningar av AUC för hydroxi‑ och desmetyldabrafenib (ökningar om 82 % respektive 68 %). En minskning på 16 % i AUC sågs för karboxidabrafenib.
Administrering av gemfibrozil (en CYP2C8‑hämmare) 600 mg två gånger dagligen med dabrafenib 75 mg två gånger dagligen resulterade i en ökning på 47 % av AUC för dabrafenib men ändrade inte Cmax för dabrafenib jämfört med administrering av enbart dabrafenib. Gemfibrozil hade ingen kliniskt relevant effekt på den systemiska exponeringen för dabrafenibmetaboliter (< 13 %).
Administrering av rifampin (en CYP3A4-/CYP2C8‑inducerare) 600 mg dagligen med dabrafenib 150 mg två gånger dagligen resulterade i en minskning av dabrafenibs Cmax (27 %) och AUC (34 %) efter upprepad dosering. Det noterades ingen relevant skillnad i AUC för hydroxidabrafenib. AUC ökade med 73 % för karboxidabrafenib och minskade med 30 % för desmetyldabrafenib.
Samtidig administrering av upprepade doser av dabrafenib 150 mg två gånger dagligen och det pH‑höjande läkemedlet rabeprazol 40 mg dagligen resulterade i en ökning på 3 % av AUC och minskning på 12 % av dabrafenibs Cmax. Dessa förändringar av dabrafenibs AUC och Cmax anses inte ha någon klinisk betydelse. Läkemedel som påverkar pH i övre gastrointestinalkanalen (t.ex. protonpumpshämmare, H2‑receptorantagonister, antacida) förväntas inte påverka biotillgängligheten av dabrafenib.
Dabrafenibs effekt på andra läkemedel
Dabrafenib är en enzyminducerare som ökar syntesen av läkemedelsmetaboliserande enzymer som CYP3A4, CYP2C:er och CYP2B6 och kan öka syntesen av transportproteiner. Detta leder till sänkta plasmanivåer av läkemedel som metaboliseras av dessa enzymer och kan påverka vissa transporterade läkemedel. De sänkta plasmakoncentrationerna kan leda till utebliven eller försämrad klinisk effekt av dessa läkemedel. Det finns också en risk för att ökad mängd aktiva metaboliter av dessa läkemedel bildas. Enzymer som kan induceras är CYP3A i lever och tarmar, CYP2B6, CYP2C8, CYP2C9, CYP2C19 och UGT (glukuronidkonjugerande enzymer). Transportproteinet P‑gp kan också induceras, liksom andra transportörer, t.ex. MRP‑2. Induktion av OATP1B1/-1B3 och BCRP är inte sannolikt, vilket baseras på observationerna från en klinisk studie med rosuvastatin.
In vitro framkallar dabrafenib dosberoende ökningar av CYP2B6 och CYP3A4. I en klinisk studie av läkemedelsinteraktioner minskade Cmax och AUC för oralt midazolam (ett CYP3A4‑substrat) med 47 % respektive 65 % när det administrerades samtidigt som upprepade doser dabrafenib.
Administrering av dabrafenib och warfarin resulterade i en minskning av AUC för S‑ och R‑warfarin med 37 % respektive 33 % jämfört med administrering av enbart warfarin. Cmax för S‑ och R‑warfarin ökade med 18 % respektive 19 %.
Man kan förvänta sig interaktioner med många läkemedel som elimineras genom metabolism eller aktiv transport. Om den terapeutiska effekten av dessa är av stor vikt för patienten och dosjustering inte lätt kan göras grundat på kontroll av effekt eller plasmakoncentration, ska dessa läkemedel undvikas eller användas med försiktighet. Risken för leverskada efter administrering av paracetamol förväntas vara högre hos patienter som samtidigt behandlas med enzyminducerare.
Antalet berörda läkemedel förväntas vara högt, även om interaktionens omfattning kan variera. Läkemedelsgrupper som kan vara berörda är bland andra följande:
- analgetika (t.ex. fentanyl, metadon)
- antibiotika (t.ex. klaritromycin, doxycyklin)
- cancerläkemedel (t.ex. kabazitaxel)
- antikoagulantia (t.ex. acenokumarol, warfarin, se avsnitt Varningar och försiktighet)
- antiepileptika (t.ex. karbamazepin, fenytoin, primidon, valproinsyra)
- antipsykotika (t.ex. haloperidol)
- kalciumkanalblockerare (t.ex. diltiazem, felodipin, nikardipin, nifedipin, verapamil)
- hjärtglykosider (t.ex. digoxin, se avsnitt Varningar och försiktighet)
- kortikosteroider (t.ex. dexametason, metylprednisolon)
- antivirala hivläkemedel (t.ex. amprenavir, atazanavir, darunavir, delavirdin, efavirenz, fosamprenavir, indinavir, lopinavir, nelfinavir, sakvinavir, tipranavir)
- hormonella preventivmedel (se avsnitt Fertilitet, graviditet och amning)
- hypnotika (t.ex. diazepam, midazolam, zolpidem)
- immunsuppressiva (t.ex. ciklosporin, takrolimus, sirolimus)
- statiner metaboliserade av CYP3A4 (t.ex. atorvastatin, simvastatin).
Induktion inträder sannolikt efter 3 dagars upprepad dosering med dabrafenib. När dabrafenib sätts ut upphör induktionen successivt. Koncentrationerna av känsliga substrat till CYP3A4, CYP2B6, CYP2C8, CYP2C9 och CYP2C19, UDP glukuronosyltransferas (UGT) och transportörer (t.ex. P‑gp eller MRP‑2) kan öka och patienterna ska övervakas avseende toxicitet. Doserna av dessa läkemedel kan behöva justeras.
In vitro är dabrafenib en mekanismbaserad hämmare av CYP3A4. Övergående hämning av CYP3A4 kan därför eventuellt ses under de första behandlingsdagarna.
Dabrafenibs effekter på transportsystem för läkemedelssubstanser
In vitro hämmar dabrafenib human organisk anjontransportpolypeptid (OATP) 1B1 (OATP1B1), OATP1B3 och BCRP. Efter samtidig administrering av en enstaka dos av rosuvastatin (OATP1B1‑, OATP1B3‑ och BCRP‑substrat) med upprepad dos dabrafenib till vuxna patienter, ökade Cmax för rosuvastatin 2,6‑faldigt, medan AUC var endast minimalt förändrad (7 % ökning). Det är osannolikt att ökningen av Cmax för rosuvastatin har klinisk relevans.
Se även riktlinjerna för läkemedelsinteraktioner vid användning av trametinib i avsnitt Varningar och försiktighet och Interaktioner i produktresumén för trametinib pulver till oral lösning.
Fertilitet, graviditet och amning
Fertila kvinnor/preventivmedel för kvinnor
Fertila kvinnor måste använda effektiva preventivmetoder under behandlingen och i 2 veckor efter avslutad behandling av dabrafenib och i 16 veckor efter avslutad behandling av trametinib.
Dabrafenib kan minska effekten av orala eller andra systemiska, hormonella preventivmedel och en effektiv, alternativ preventivmetod, t.ex. en barriärmetod, ska användas (se avsnitt Interaktioner).
Graviditet
Det finns inga data gällande användning av dabrafenib till gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter och toxiska effekter på embryofetal utveckling, inklusive teratogena effekter (se avsnitt Prekliniska säkerhetsuppgifter). Dabrafenib ska inte ges till gravida kvinnor om inte den potentiella nyttan för modern överstiger den eventuella risken för fostret. Om patienten blir gravid under behandlingen med dabrafenib ska patienten informeras om den eventuella risken för fostret. Se även produktresumén för trametinib pulver till oral lösning (avsnitt Fertilitet, graviditet och amning) för ytterligare information om trametinib.
Amning
Det är okänt om dabrafenib utsöndras i bröstmjölk. En risk för det ammade barnet kan inte uteslutas. Ett beslut måste fattas om man ska avbryta amningen eller avbryta behandlingen med dabrafenib efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
Det finns inga data som gäller människa för dabrafenib i kombination med trametinib. Dabrafenib skulle kunna försämra manlig och kvinnlig fertilitet eftersom påverkan på reproduktionsorganen har observerats hos djur (se avsnitt Prekliniska säkerhetsuppgifter). Manliga patienter som tar dabrafenib i kombination med trametinib ska informeras om den potentiella risken för försämrad spermatogenes, som kan vara irreversibel. Se produktresumén för trametinib pulver till oral lösning för ytterligare information.
Effekter på förmågan att framföra fordon och använda maskiner
Dabrafenib har mindre effekt på förmågan att framföra fordon och använda maskiner. Patientens kliniska status och dabrafenibs biverkningsprofil ska beaktas vid bedömning av patientens förmåga att utföra uppgifter som kräver omdöme, motorisk eller kognitiv förmåga. Patienterna ska uppmärksammas på risken för att trötthet, yrsel och ögonproblem kan inverka på dessa aktiviteter.
Biverkningar
Sammanfattning av säkerhetsprofilen
I kliniska studier med pediatriska patienter som behandlades med dabrafenib i kombination med trametinib var de vanligaste biverkningarna (rapporterade med en frekvens på ≥ 20 %) feber (70 %), hudutslag (49 %), huvudvärk (47 %), kräkningar (40 %), trötthet (36 %), torr hud (35 %), diarré (34 %), blödningar (34 %), illamående (29 %), akneiform dermatit (29 %), buksmärtor (28 %), neutropeni (26 %), hosta (24 %) och förhöjda transaminaser (22 %). De vanligaste allvarliga biverkningarna (grad 3/4) var neutropeni (15 %), feber (11 %), förhöjda transaminaser (6 %) och viktökning (5 %). Långtidsdata vad gäller tillväxt och benmognad hos pediatriska patienter är för närvarande begränsade (se avsnitt Prekliniska säkerhetsuppgifter).
Säkerhetsprofilen för pediatriska patienter var i stort sett densamma som den som tidigare fastställts för vuxna patienter. Följande ytterligare biverkningar har hittills endast rapporterats hos vuxna patienter som behandlats med dabrafenibkapslar och trametinibtabletter: kutant skivepitelkarcinom, seborroisk keratos, perifer neuropati (inklusive sensorisk och motorisk neuropati), lymfödem, muntorrhet, aktinisk keratos, njursvikt (vanliga), melanom, akrokordon, sarkoidos, korioretinopati, pneumonit, akut njursvikt, nefrit, hjärtsvikt, vänsterkammardysfunktion, interstitiell lungsjukdom, rabdomyolys (mindre vanliga), gastrointestinal perforation, hemofagocytisk lymfohistiocytos (sällsynta), tumörlyssyndrom, myokardit, Stevens-Johnsons syndrom, läkemedelsreaktion med eosinofili och systemiska symtom, tatueringsrelaterade hudreaktioner (ingen känd frekvens). Dessutom har fall av bilateral panuveit eller bilateral iridocyklit som tyder på Vogt-Koyanagi-Haradas syndrom rapporterats hos vuxna patienter.
Tabell över biverkningar
Säkerheten för dabrafenib i kombination med trametinib har utvärderats i en poolad säkerhetspopulation bestående av 171 pediatriska patienter i två studier av patienter med avancerade solida tumörer med BRAF V600-mutation. Fyra patienter (2,3 %) var 1 till < 2 år gamla, 39 patienter (22,8 %) var 2 till < 6 år gamla, 54 patienter (31,6 %) var 6 till < 12 år gamla och 74 patienter (43,3 %) var 12 till < 18 år gamla vid rekryteringen. Genomsnittlig varaktighet var 2,3 år.
Biverkningar (tabell 4) redovisas nedan indelade efter MedDRA:s organsystem och efter frekvens enligt följande princip: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensgrupp presenteras biverkningarna i fallande allvarlighetsgrad.
Tabell 4 Biverkningar med dabrafenib i kombination med trametinib
| Infektioner och infestationer | |
| Mycket vanliga | Paronyki, nasofaryngit*1 |
| Vanliga | Urinvägsinfektion, cellulit |
| Neoplasier; benigna, maligna och ospecificerade (inkl. cystor och polyper) | |
| Mycket vanliga | Hudpapillom |
| Blodet och lymfsystemet | |
| Mycket vanliga | Neutropeni*2, anemi, leukopeni* |
| Vanliga | Trombocytopeni* |
| Immunsystemet | |
| Vanliga | Överkänslighet |
| Metabolism och nutrition | |
| Vanliga | Dehydrering, minskad aptit |
| Centrala och perifera nervsystemet | |
| Mycket vanliga | Huvudvärk, yrsel*3 |
| Ögon | |
| Vanliga | Dimsyn, synnedsättning, uveit*4 |
| Mindre vanliga | Näthinneavlossning, periorbitalt ödem |
| Hjärtat | |
| Vanliga | Minskad ejektionsfraktion, bradykardi* |
| Mindre vanliga | Atrioventrikulärt block5 |
| Blodkärl | |
| Mycket vanliga | Blödning*6 |
| Vanliga | Hypertoni, hypotoni |
| Andningsvägar, bröstkorg och mediastinum | |
| Mycket vanliga | Hosta* |
| Vanliga | Dyspné |
| Magtarmkanalen | |
| Mycket vanliga | Buksmärta*, förstoppning, diarré, illamående, kräkningar |
| Vanliga | Pankreatit, stomatit |
| Mindre vanliga | Kolit* |
| Hud och subkutan vävnad | |
| Mycket vanliga | Akneiform dermatit*7, torr hud*8, klåda, utslag*9, erytem |
| Vanliga | Generaliserad exfoliativ dermatit*10, alopeci, palmoplantar erytrodysestesi, follikulit, hudlesion, pannikulit, hyperkeratos, ljuskänslighet*11 |
| Mindre vanliga | Akut febril neutrofil dermatos12, hudfissurer, nattliga svettningar, hyperhidros |
| Muskuloskeletala systemet och bindväv | |
| Mycket vanliga | Artralgi, smärta i extremiteter |
| Vanliga | Myalgi*, muskelspasmer*13 |
| Allmänna symtom och/eller symtom vid administreringsstället | |
| Mycket vanliga | Feber*, trötthet*14, viktökning |
| Vanliga | Slemhinneinflammation, ansiktsödem*, frossa, perifert ödem, influensaliknande sjukdom |
| Undersökningar | |
| Mycket vanliga | Förhöjda transaminaser*15 |
| Vanliga | Hyponatremi, hypofosfatemi, hyperglykemi, förhöjt alkaliskt fosfatas i blodet, förhöjt gammaglutamyltransferas, förhöjt kreatinfosfokinas i blodet |
*Indikerar sammanslagning av två eller fler MedDRA-termer som bedömts som kliniskt likartade. 1 nasofaryngit inkluderar faryngit 2 neutropeni inkluderar minskat antal neutrofiler samt febril neutropen 3 yrsel inkluderar vertigo 4 uveit inkluderar iridocyklit 5 atrioventrikulärt block inkluderar atrioventrikulärt block, första graden 6 blödning inkluderar epistaxis, hematuri, kontusion, hematom, förhöjt INR (international normalised ratio), analblödning, blödning vid kateterställe, cerebral blödning, ekkymos, extraduralt hematom, gastrointestinal blödning, hematochezi, petekier, blödning efter ingrepp, rektalblödning, minskat antal röda blodkroppar, blödning i övre magtarmkanalen, uterin blödning, kraftiga menstruationsblödningar samt purpura 7 akneiform dermatit inkluderar akne och pustulös akne 8 torr hud inkluderar xeros och xeroderma 9 utslag inkluderar makulopapulöst, pustulöst, erytematöst, papulöst och makulärt utslag 10 generaliserad exfoliativ dermatit inkluderar hudexfoliering och exfoliativ dermatit 11 ljuskänslighet inkluderar ljuskänslighetsreaktion och solbränna 12 akut febril neutrofil dermatos är en biverkning som även ses vid monoterapi med dabrafenib (Tafinlar) 13 muskelspasmer inkluderar muskuloskeletal stelhet 14 trötthet inkluderar sjukdomskänsla och asteni 15 förhöjda transaminaser inkluderar förhöjt aspartataminotransferas (ASAT), förhöjt alaninaminotransferas (ALAT) och hypertransaminasemi | |
Beskrivning av utvalda biverkningar
Viktökning
Viktökning har endast rapporterats i den pediatriska populationen. Den rapporterades som en biverkning hos 16 % av de pediatriska patienterna, med svårighetsgrad 3 hos 5 % av patienterna, och med en utsättningsfrekvens på 0,6 % av patienterna. Mediantid till den första rapporterade viktökningen hos pediatriska patienter som fick dabrafenib i kombination med trametinib var 3,5 månader. Viktökning från baslinjen på ≥ 2 BMI (kroppsmasseindex) för ålderspercentilen observerades hos 36 % av patienterna.
Blödning
Blödningar har observerats hos 34 % av de pediatriska patienterna, med svårighetsgrad 3 hos 1,2 % av patienterna. Den vanligaste typen av blödning (epistaxis) rapporterades hos 18 % av de pediatriska patienterna. Mediantid till första blödningen hos pediatriska patienter var 2,6 månader. Blödningar, inklusive större blödningar och blödningar med dödlig utgång, har förekommit hos vuxna patienter som tar dabrafenib i kombination med trametinib.
Blödningsrisken kan vara förhöjd vid samtidig användning av trombocythämmare eller antikoagulantia. Vid blödning ska patienten behandlas enligt kliniska indikationer (se avsnitt Varningar och försiktighet).
Reducerad vänsterkammarejektionsfraktion (LVEF)/vänsterkammardysfunktion
Reducerad LVEF har rapporterats hos 5,3 % av de pediatriska patienterna, med svårighetsgrad 3 hos < 1 % av patienterna. Mediantiden till första LVEF-reduceringen var cirka en månad.
Patienter med LVEF som understeg institutionellt lägsta normalvärde inkluderades inte i kliniska studier med dabrafenib. Dabrafenib i kombination med trametinib ska användas med försiktighet till patienter med tillstånd som kan försämra vänsterkammarfunktionen (se avsnitt Dosering och administreringssätt och Varningar och försiktighet). Se produktresumén för trametinib pulver till oral lösning (avsnitt Varningar och försiktighet).
Feber
Feber har rapporterats i kliniska studier med dabrafenib i kombination med trametinib (se avsnitt Varningar och försiktighet). Feber rapporterades hos 70 % av de pediatriska patienterna, med svårighetsgrad 3 hos 11 % av patienterna. Ungefär hälften av de första feberepisoderna hos vuxna patienter inträffade under den första behandlingsmånaden, och cirka en tredjedel av patienterna hade 3 eller fler händelser. Hos 1 % av patienterna som fick dabrafenib som monoterapi i den integrerade vuxna säkerhetspopulationen noterades allvarliga icke-infektiösa biverkningar (definierade som feber åtföljt av svår frossa, uttorkning, hypotoni och/eller akut njurinsufficiens eller av pre-renalt ursprung hos patienter med normal njurfunktion före behandlingsstarten). Dessa allvarliga icke-infektiösa febrila händelser debuterade i typiska fall under den första behandlingsmånaden. Patienter med allvarliga icke-infektiösa febrila händelser svarade väl på dosavbrott och/eller dossänkning och understödjande behandling (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Leverpåverkan
Leverbiverkningar har rapporterats hos vuxna och pediatriska patienter i kliniska studier med dabrafenib i kombination med trametinib. I den pediatriska säkerhetspopulationen var förhöjt ALAT och ASAT mycket vanligt, rapporterat hos 13 respektive 16 % av patienterna (se avsnitt Varningar och försiktighet). Se produktresumén för trametinib pulver till oral lösning för ytterligare information.
Förändrat blodtryck
Hypertoni har rapporterats hos 2,3 % av de pediatriska patienterna, med svårighetsgrad 3 hos 1,2 % av patienterna. Mediantiden till första tillfället av hypertoni hos pediatriska patienter var 5,4 månader.
Hypotoni har rapporterats hos 4,1 % av de pediatriska patienterna, med svårighetsgrad ≥ 3 hos 2,3 % av patienterna. Mediantiden till första tillfället av hypotoni hos pediatriska patienter var 2,2 månader.
Blodtrycket ska mätas vid baslinjen och kontrolleras under behandling, med standardbehandling för att hålla hypertonin under kontroll efter behov (se avsnitt Varningar och försiktighet).
Artralgi
Artralgi rapporterades som en mycket vanlig biverkning i den integrerade säkerhetspopulationen med vuxna och pediatriska patienter som fick dabrafenib i kombination med trametinib. I den pediatriska säkerhetspopulationen rapporterades artralgi hos 13 % av patienterna, med svårighetsgrad 3 hos < 1 % av patienterna. Artralgi rapporterades hos 25 % av de vuxna patienterna, även om fallen oftast var av svårighetsgrad 1 eller 2. Grad 3 var mindre vanliga (< 1 %).
Hypofosfatemi
Hypofosfatemi rapporterades som en mycket vanlig biverkning i den integrerade säkerhetspopulationen med vuxna och pediatriska patienter som fick dabrafenib i kombination med trametinib, hos 4 % respektive 5,8 % av patienterna. Hos vuxna patienter var 1 % av fallen av svårighetsgrad 3, vilket bör noteras. Hos pediatriska patienter förekom hypofosfatemi endast med svårighetsgrad 1 eller 2.
Pankreatit
Pankreatit rapporterades hos 1,2 % av de pediatriska patienterna, med svårighetsgrad 3 hos < 1 % av patienterna. I kliniska studier på vuxna patienter inträffade ett fall av pankreatit på den första dagen med dabrafenibbehandling hos en patient med metastaserat melanom, och återkom vid förnyad behandling med lägre dos. Oförklarliga buksmärtor ska undersökas skyndsamt och omfatta mätning av serumamylas och -lipas. Patienterna ska följas upp noga när behandlingen återinsätts efter en pankreatitepisod (se avsnitt Varningar och försiktighet).
Kutana maligniteter
I den integrerade vuxna säkerhetspopulationen för dabrafenib i kombination med trametinib utvecklade 2 % av patienterna kutant skivepitelkarcinom (cuSCC) med en mediantid till debut på 18 till 31 veckor. Mediantiden till diagnos av första inträffade cuSCC var 223 dagar (intervall: 56 till 510 dagar). Alla vuxna patienter som utvecklat cuSCC eller nytt primärt melanom fortsatte med behandlingen utan dosjustering (se avsnitt Varningar och försiktighet).
Icke-kutana maligniteter
Aktivering av MAP‑kinassignalering hos BRAF‑vildtypceller som exponeras för BRAF‑hämmare kan leda till ökad risk för icke‑kutana maligniteter, även sådana med RAS‑mutationer (se avsnitt Varningar och försiktighet). Icke‑kutana maligniteter rapporterades hos < 1 % av patienterna i den integrerade vuxna säkerhetspopulationen som fick dabrafenib i kombination med trametinib. Fall av RAS‑inducerad malignitet har setts vid användning av dabrafenib i kombination med trametinib. Patienterna ska följas enligt klinisk bedömning.
Njursvikt
Njursvikt orsakad av feberorsakad prerenal azotemi eller granulomatös nefrit var mindre vanligt hos vuxna patienter. Dabrafenib har dock inte studerats hos patienter med nedsatt njurfunktion (definierad som kreatinin > 1,5 x ULN). Försiktighet ska iakttas under dessa förutsättningar (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Inga akuta symtom relaterade till överdosering har rapporterats hos pediatriska patienter som fått dabrafenib i kombination med trametinib i kliniska studier. Det finns ingen specifik behandling av överdosering. Vid överdosering ska patienten ges understödjande vård med lämplig övervakning efter behov.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antineoplastiska medel, proteinkinashämmare, B-Raf serin/treonin-kinas (BRAF) hämmare, ATC-kod: L01EC02
Verkningsmekanism
Dabrafenib hämmar RAF‑kinaser. Onkogena mutationer i BRAF leder till konstitutiv aktivering av RAS-/RAF-/MEK-/ERK‑signalvägen. Den vanligaste BRAF-mutationen är V600E, som identifierats i cirka 19 % av pediatriska LGG och cirka 5 % av pediatriska HGG.
Kombination med trametinib
Trametinib är en reversibel, starkt selektiv, alloster hämmare av aktiveringen av mitogenaktiverat extracellulärt signalreglerat kinas 1 (MEK1) och MEK2 och kinasaktivitet. MEK‑proteiner är komponenter i signalvägen för extracellulärt signalreglerat kinas (ERK). I humana cancerformer aktiveras denna väg ofta av muterade former av BRAF som aktiverar MEK. Trametinib hämmar aktivering av MEK av BRAF och hämmar MEK-kinasaktivitet.
Sålunda inhiberar trametinib och dabrafenib två kinaser i denna väg, MEK och RAF och därför ger kombinationen samtidig hämning av signalvägen. Kombinationen av dabrafenib och trametinib har visat antitumöraktivitet i BRAF V600‑mutationspositiva cancercellinjer in vitro och försenar uppkomsten av resistens in vivo i BRAF V600‑mutationspositiva xenografter.
Farmakodynamisk effekt
Prekliniska data från biokemiska analyser visade att dabrafenib hämmar BRAF‑kinaser med aktiverande mutationer i kodon 600 (tabell 5).
Tabell 5 Dabrafenibs kinashämmande effekt mot RAF-kinaser
| Kinas | Hämmande koncentration 50 (nM) |
| BRAF V600E | 0,65 |
| BRAF WT | 3,2 |
| CRAF WT | 5,0 |
Klinisk effekt och säkerhet
Pediatrisk population
Klinisk effekt och säkerhet för kombinationsbehandling med dabrafenib plus trametinib hos pediatriska patienter i åldern 1 till < 18 år med BRAF V600-mutationspositivt gliom har utvärderats i en öppen, klinisk multicenterstudie i fas 2 (EudraCT 2015-004015-20). Patienter med låggradigt gliom (grad 1 eller 2 enligt WHO 2016) som behövde en första systemisk behandling randomiserades i förhållandet 2:1 till dabrafenib plus trametinib eller karboplatin plus vinkristin, medan patienter med recidiverat eller refraktärt höggradigt gliom (grad 3 eller 4 enligt WHO 2016) placerades i en kohort med en singelarm som fick dabrafenib plus trametinib.
BRAF-mutationsstatus fastställdes prospektivt genom ett lokalt test eller, om lokalt test inte var möjligt, genom polymeraskedjereaktionstest (PCR-test) utfört av centrallaboratorium. Dessutom utfördes retrospektiva tester av tillgängliga tumörprover av centrallaboratorium för att bekräfta BRAF V600E-mutation.
Dosen av dabrafenib och trametinib i den kliniska studien var beroende av ålder och vikt. Dabrafenib gavs peroralt med en dos på 2,625 mg/kg två gånger dagligen till åldersgruppen < 12 år och med 2,25 mg/kg två gånger dagligen till åldersgruppen 12 år och äldre. Trametinib gavs peroralt med dosen 0,032 mg/kg en gång dagligen till åldersgruppen < 6 år och med 0,025 mg/kg en gång dagligen till åldersgruppen 6 år och äldre. Dabrafenibdoserna begränsades till 150 mg två gånger dagligen och trametinibdoserna till 2 mg en gång dagligen. Karboplatin och vinkristin doserades baserat på ålder och kroppsyta och gavs som veckovis infusion med dosen 175 mg/m2 respektive 1,5 mg/m2. Karboplatin och vinkristin administrerades som en 10-veckors induktionsbehandling med efterföljande underhållsbehandling i åtta 6-veckorscykler.
Primärt effektmått i båda kohorterna var total responsfrekvens (ORR, summan av bekräftad komplett respons [CR] och partiell respons [PR]), bedömt genom oberoende granskning baserat på RANO-kriterierna (2017) för LGG-kohorten och RANO-kriterierna (2010) för HGG-kohorten. Den primära analysen utfördes när samtliga patienter i båda kohorterna hade fått minst 32 veckors behandling. Den slutliga analysen utfördes 2 år efter avslutad registrering av deltagande i båda kohorterna.
BRAF-mutationspositivt pediatriskt låggradigt gliom (WHO grad 1 och 2)
I kohorten med låggradigt gliom randomiserades 110 patienter till dabrafenib plus trametinib (n = 73) eller karboplatin plus vinkristin (n = 37). Medianåldern var 9,5 år, med 34 patienter (30,9 %) i åldern 12 månader till < 6 år, 36 patienter (32,7 %) i åldern 6 till < 12 år och 40 patienter (36,4 %) i åldern 12 till < 18 år. 60 % var flickor. Majoriteten (80 %) hade gliom av grad 1 när första diagnosen ställdes. De vanligaste patologierna var astrocytom (30,9 %), gangliogliom (27,3 %) och LGG utan närmare specifikation (NOS) (18,2 %). Metastaser fanns hos 9 patienter (8,2 %). 91 patienter (82,7 %) hade tidigare opererats, hos 28 av dessa patienter (25,5 %) var den senaste operationen resektion. Systemiska kortikosteroider användes av 44 patienter (41,5 %).
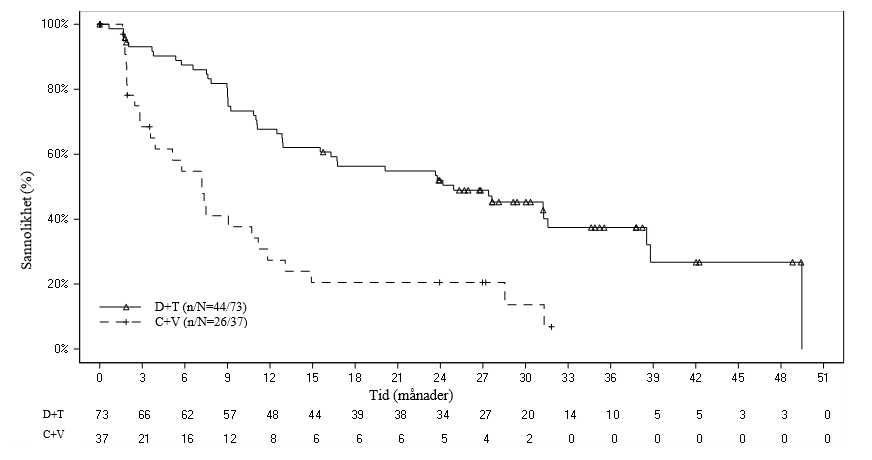
Vid tidpunkten för den primära analysen, visade ORR i dabrafenib- plus trametinib-armen en statistiskt signifikant förbättring som översteg karboplatin plus vinkristin. Efterföljande hierarkisk testning visade också på en statistiskt signifikant förbättring vad gällde progressionsfri överlevnad (PFS) jämfört med kemoterapi (tabell 6).
Vid tidpunkten för den primära analysen, som utfördes när samtliga patienter hade genomgått minst 32 veckors behandling eller hade avbrutit tidigare, var data för total överlevnad (OS) fortfarande inte mogna (ett dödsfall hade rapporterats i karboplatin- plus vinkristin-armen [C+V]).
Tabell 6 Respons och progressionsfri överlevnad baserat på oberoende granskning i den pivotala studien G2201 (LGG-kohort, primär analys)
Dabrafenib + trametinib (D+T) N = 73 | Karboplatin + vinkristin (C+V) N = 37 | |
| Bästa totala respons | ||
| Komplett respons (CR), n (%) | 2 (2,7) | 1 (2,7) |
| Partiell respons (PR), n (%) | 32 (43,8) | 3 (8,1) |
| Stabil sjukdom (SD), n (%) | 30 (41,1) | 15 (40,5) |
| Progressiv sjukdom (PD), n (%) | 8 (11,0) | 12 (32,4) |
| Okänd, n (%) | 1 (1,4) | 6 (16,2)1 |
| Total responsfrekvens | ||
| ORR (CR+PR), (95 % CI) | 46,6 % (34,8‑58,6 %) | 10,8 % (3,0‑25,4 %) |
| Oddskvot2, p-värde | 7,19 (2,3‑22,4); p < 0,001 | |
| Riskskillnad | 35,8 % (20,6‑51,0) | |
| Progressionsfri överlevnad (PFS) | ||
| Median (månader), (95 % CI) | 20,1 (12,8‑NE) | 7,4 (3,6‑11,8) |
| Riskkvot (95 % CI), p-värde | 0,31 (0,17‑0,55); p < 0,001 | |
NE = kan ej uppskattas 1 4 patienter randomiserade till C+V avbröt innan de fått behandling. 2 Oddskvot (D+T vs C+V) och 95 % CI beräknad genom logistisk regression med behandling som enda kovariat, dvs. oddsen för observation av respons i D+T-armen jämfört med oddsen för observation av respons i C+V-armen. Oddskvot > 1 innebär fördel för D+T. | ||
Vid tidpunkten för den slutliga analysen (medianlängd för uppföljning: 39,0 månader) var ORR baserad på oberoende granskning 54,8 % i D+T-armen och 16,2 % i C+V-armen med en oddskvot på 6,26. Analysen bekräftade också förbättrad PFS jämfört med kemoterapi baserat på oberoende granskning med en uppskattad 64 % riskreduktion i progression/död (riskkvot 0,36). Median PFS var 24,9 månader i D+T-armen och 7,2 månader i C+V-armen. Inga ytterligare dödsfall rapporterades i någon av armarna vid tidpunkten för den slutliga analysen.
Figur 1 Kaplan–Meier-kurvor för progressionsfri överlevnad baserade på oberoende granskning i den pivotala studien G2201 (LGG-kohort, slutlig analys)
BRAF-mutationspositivt pediatriskt höggradigt gliom (WHO grad 3 och 4)
Till kohorten med en singelarm med höggradigt gliom rekryterades 41 patienter med recidiverat eller refraktärt HGG och behandlades med dabrafenib plus trametinib. Medianåldern var 13,0 år, med 5 patienter (12,2 %) i åldern 12 månader till < 6 år, 10 patienter (24,4 %) i åldern 6 till < 12 år och 26 patienter (63,4 %) i åldern 12 till < 18 år. 56 % var flickor. Histologisk grad när diagnosen först ställdes var grad 4 hos 20 patienter (48,8 %), grad 3 hos 13 patienter (31,7 %), grad 2 hos 4 patienter (9,8 %), grad 1 hos 3 patienter (7,3 %) och saknades hos 1 patient (2,4 %). De vanligaste patologierna var glioblastoma multiforme (31, 7%), anaplastiskt pleomorft xantoastrocytom (14,6 %), HGG NOS (9,8 %) och pleomorft xantoastrocytom (9,8 %). Tidigare kirurgi rapporterades hos 40 patienter (97,6 %), hos 24 av dessa (58,5 %) var den senaste operationen resektion. 33 patienter (80,5 %) hade tidigare fått antineoplastisk kemoterapi och 37 patienter (90,2 %) hade tidigare strålbehandlats. Systemiska kortikosteroider under studiebehandlingen rapporterades för 24 patienter (58,5 %).
Vid tidpunkten för den slutliga analysen (medianlängd för uppföljning: 45,2 månader) var ORR baserat på oberoende granskning 56,1 % (23/41), (95 %CI: 39,7; 71,5): CR hos 14 patienter (34,1 %) och PR hos 9 patienter (22,0 %). Medianvärde för responsduration (DOR) var 27,4 månader (95 % CI: 9,2; NE).
Farmakokinetiska egenskaper
Dabrafenibs farmakokinetiska egenskaper har till största delen fastställt för vuxna patienter med användning av läkemedlet i fast form (kapslar). Dabrafenibs farmakokinetik efter viktanpassad engångs- eller upprepad dosering har dessutom utvärderats hos 243 pediatriska patienter. Den populationsfarmakokinetiska analysen omfattade 61 patienter i åldern 1 till < 6 år, 77 patienter i åldern 6 till < 12 år och 105 patienter i åldern 12 till < 18 år. Clearance var jämförbar med clearance hos vuxna patienter. Vikten identifierades som en betydande kovariat för clearance av dabrafenib. Ålder utgjorde inte någon signifikant kovariat. Farmakokinetisk exponering för dabrafenib vid den rekommenderade viktanpassade dosen till pediatriska patienter låg inom samma intervall som hos vuxna.
Absorption
Suspensionen av dabrafenib dispergerbar tablett absorberades snabbt med en mediantid till högsta plasmakoncentration på 1,5 timmar efter dosen. Genomsnittlig absolut oral biotillgänglighet för dabrafenibkapslar var 94,5 %. Suspensionen förväntas ha 20 % lägre biotillgänglighet. Baserat på data från vuxna patienter som fått kapslar sågs lägre exponering vid upprepad dosering, sannolikt på grund av induktion av metabolisering av läkemedlet. AUC-kvoten för genomsnittlig ackumulering dag 18/dag 1 var 0,73.
Dabrafenibexponeringen (Cmax och AUC) ökade dosproportionellt mellan 12 mg och 300 mg efter administrering av en engångsdos, men ökningen var mindre än dosproportionell efter upprepad dosering två gånger dagligen.
I den pivotala pediatriska studien var geometriskt medelvärde (% CV) för Cmax och AUCtau vid steady state 1 330 ng/ml (93,5 %) respektive 4 910 ng*h/ml (54,0 %) i LGG-kohorten och 1 520 ng/ml (65,9 %) respektive 4 300 ng*h/ml (44,7 %) i HGG-kohorten.
Effekt av föda
I en studie på friska frivilliga försökspersoner ledde administrering av en engångsdos på 150 mg av suspensionen av dispergerbara tabletter tillsammans med en måltid med låg fetthalt och lågt kaloriinnehåll till minskad biotillgänglighet (Cmax och AUC minskade med 35 % respektive 29 %) och fördröjd absorption av dabrafenib jämfört med vid fastande tillstånd.
Distribution
Dabrafenib är bundet till humana plasmaproteiner till 99,7 %. Distributionsvolym vid steady state efter intravenös administrering av en mikrodos till vuxna var 46 l.
Metabolism
Metabolismen av dabrafenib medieras främst av CYP2C8 och CYP3A4 varvid hydroxidabrafenib bildas, som sedan oxideras vidare via CYP3A4 och bildar karboxidabrafenib. Karboxidabrafenib kan dekarboxyleras via en icke‑enzymatisk process varvid desmetyldabrafenib bildas. Karboxidabrafenib utsöndras i galla och urin. Desmetyldabrafenib kan även bildas i tarmen och återabsorberas. Desmetyldabrafenib metaboliseras av CYP3A4 till oxidativa metaboliter. Terminal halveringstid för hydroxidabrafenib motsvarar modersubstansens med en halveringstid på 10 timmar, medan karboxi‑ och desmetylmetaboliterna har längre halveringstider (21 till 22 timmar). Hos pediatriska patienter var den genomsnittliga kvoten för AUC för metabolit/modersubstans (% CV) efter upprepad dosering av kapslar eller suspensionen av dispergerbara tabletter 0,64 (28 %), 15,6 (49 %) och 0,69 (62 %) för hydroxi-, karboxi- respektive desmetyldabrafenib. Baserat på exponering, relativ potens och farmakokinetiska egenskaper, bidrar sannolikt såväl hydroxidabrafenib som desmetyldabrafenib till dabrafenibs kliniska verkan, medan karboxidabrafenib troligen inte har någon signifikant aktivitet.
Eliminering
Den terminala halveringstiden för dabrafenib efter en intravenös engångsmikrodos var 2,6 timmar hos vuxna patienter. Terminal halveringstid för dabrafenib efter en oral engångsdos av den dispergerbara tabletten var 11,5 timmar (CV 67,7 %) i en studie på vuxna friska frivilliga forskningspersoner. Skenbar clearance av dabrafenib var hos pediatriska patienter (mediankroppsvikt: 38,7 kg) 11,8 l/h (CV 49 %).
Efter en peroral dos elimineras dabrafenib främst genom metabolism, medierad via CYP3A4 och CYP2C8. Dabrafenibrelaterat material utsöndrades främst i feces, där 71 % av en peroral dos återfanns i feces medan 23 % av dosen återfanns i urinen, enbart i form av metaboliter.
Läkemedelsinteraktioner
Andra läkemedels effekt på dabrafenib
Dabrafenib är ett substrat av humant P-glykoprotein (P-gp) och humant BCRP in vitro. Dessa transportörer har dock minimal inverkan på oral biotillgänglighet och eliminering av dabrafenib och risken för kliniskt relevanta läkemedelsinteraktioner med hämmare av P-gp eller BCRP är låg. Varken dabrafenib eller dess tre huvudmetaboliter har visats vara hämmare av P-gp in vitro.
Dabrafenibs effekt på andra läkemedel
Även om dabrafenib och dess metaboliter, hydroxi-dabrafenib, karboxi-dabrafenib och desmetyl-dabrafenib, var hämmare av human organisk anjontransportör 1 (OAT1) och OAT3 in vitro, och dabrafenib och dess desmetylmetabolit visade sig vara hämmare av organisk katjontransportör 2 (OCT2) in vitro är risken för en läkemedelsinteraktion med dessa transportörer minimal baserat på klinisk exponering av dabrafenib och dess metaboliter.
Särskilda patientpopulationer
Nedsatt leverfunktion
En populationsfarmakokinetisk analys på vuxna patienter visar att lätt förhöjda bilirubin‑ och/eller ASAT‑värden (baserat på National Cancer Institute [NCI] klassificering) inte signifikant påverkar oral clearance för dabrafenib. Inte heller hade lätt nedsatt leverfunktion, definierat med hjälp av bilirubin‑ och ASAT‑värden, någon signifikant effekt på plasmakoncentrationen av dabrafenibs metaboliter. Det finns inga data tillgängliga om patienter med måttligt till kraftigt nedsatt leverfunktion. Eftersom hepatisk metabolism och utsöndring via gallan är de primära elimineringsvägarna för dabrafenib och dess metaboliter ska administrering av dabrafenib ske med försiktighet till patienter med måttlig till kraftig leverfunktionsnedsättning (se avsnitt Dosering och administreringssätt).
Nedsatt njurfunktion
En populationsfarmakokinetisk analys på vuxna patienter tyder på att lätt nedsatt njurfunktion inte påverkar oral clearance av dabrafenib. Även om det endast finns begränsade data om måttlig njurfunktionsnedsättning kan detta tyda på att det inte föreligger någon kliniskt relevant effekt. Det finns inga data för patienter med kraftigt nedsatt njurfunktion (se avsnitt Dosering och administreringssätt).
Etnisk tillhörighet
En populationsfarmakokinetisk analys på vuxna patienter visade inga signifikanta skillnader i farmakokinetiken för dabrafenib mellan asiatiska och kaukasiska patienter. Data är otillräckliga för att den potentiella effekten av andra raser på farmakokinetiken för dabrafenib ska kunna utvärderas.
Kön
Baserat på populationsfarmakokinetiska analyser på vuxna och pediatriska patienter var beräknad clearance av dabrafenib något lägre hos kvinnliga patienter, men skillnaden ansågs inte vara kliniskt relevant.
Prekliniska säkerhetsuppgifter
Inga karcinogenicitetsstudier med dabrafenib har genomförts. Dabrafenib hade inga mutagena eller klastogena effekter vid in vitro‑tester av bakterier och odlade däggdjursceller, eller i en mikronukleusanalys på gnagare in vivo.
Vid kombinerade studier av honornas fertilitet samt tidig embryonal och embryofetal utveckling hos råtta minskade antalet gulkroppar i ovarierna hos dräktiga honor vid 300 mg/kg/dag (ungefär 3 gånger den kliniska exponeringen hos människa baserat på AUC), men man såg inga effekter på östruscykel, parning eller fertilitetsindex. Utvecklingstoxiska effekter, inkluderande embryoletalitet och kammarseptumdefekter och variation i form på tymus, sågs vid 300 mg/kg/dag. Försenad skelettutveckling och reducerad kroppsvikt hos fostret sågs vid ≥ 20 mg/kg/dag (≥ 0,5 gånger den kliniska exponeringen hos människa, baserat på AUC).
Inga studier av manlig fertilitet med dabrafenib har genomförts. I toxicitetsstudier med upprepad dosering har dock testikeldegeneration/‑depletion observerats hos råtta och hund (≥ 0,2 gånger den kliniska exponeringen hos människa, baserat på AUC). Testikelförändringar hos råtta och hund förelåg fortfarande efter en 4 veckor lång återhämtningsperiod (se avsnitt Fertilitet, graviditet och amning).
Kardiovaskulära effekter, däribland degeneration/nekros och/eller blödning i kransartärer, hypertrofi/blödning i atrioventrikulära klaffar samt atriell fibrovaskulär proliferation sågs hos hundar (≥ 2 gånger den kliniska exponeringen hos människa, baserat på AUC). Fokal arteriell/perivaskulär inflammation i olika vävnader observerades hos möss och en ökad incidens av degeneration av leverartärer och spontan kardiomyocytdegeneration med inflammation (spontan kardiomyopati) observerades hos råttor (≥ 0,5 och 0,6 gånger den kliniska exponeringen hos människa för råttor respektive möss). Effekter på levern, däribland hepatocellulär nekros och inflammation, observerades hos möss (≥ 0,6 gånger den kliniska exponeringen hos människa). Bronkoalveolär inflammation i lungorna observerades hos flera hundar vid ≥ 20 mg/kg/dag (≥ 9 gånger den kliniska exponeringen hos människa, baserat på AUC) och var kopplad till ytlig och/eller ansträngd andning.
Reversibla hematologiska effekter har observerats hos hund och råtta som givits dabrafenib. I studier som varat upp till 13 veckor sågs minskat antal retikulocyter och/eller röd blodkroppsmassa hos hund och råtta (≥ 10 respektive 1,4 gånger den kliniska exponeringen hos människa).
I toxicitetsstudier på juvenila råttor observerades effekter på tillväxten (kortare rörben), njurtoxicitet (tubulär inlagring, ökad incidens av kortikala cystor och tubulär basofili samt reversibla ökningar av urea‑ och/eller kreatininkoncentrationen) och testikeltoxicitet (degeneration och dilaterade tubuli) (≥ 0,2 gånger den kliniska exponeringen hos människa baserat på AUC).
Dabrafenib var fototoxiskt i en in vitro‑analys av upptaget av 3T3 neutralrött (NRU) i musfibroblaster och in vivo vid doser ≥ 100 mg/kg (> 44 gånger den kliniska exponeringen hos människa baserat på Cmax) i en oral fototoxicitetsstudie på hårlösa möss.
Kombination med trametinib
I en studie på hundar där dabrafenib och trametinib gavs i kombination under 4 veckor observerades tecken på gastrointestinal toxicitet samt minskad lymfoid cellularitet i tymus vid lägre exponeringsgrad än hos hundar som fått trametinib ensamt. I övrigt har liknande toxicitet observerats som i jämförbara monoterapi‑studier.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Mannitol (E 421)
Mikrokristallin cellulosa (E 460)
Krospovidon (E 1202)
Hypromellos (E 464)
Acesulfamkalium (E 950)
Magnesiumstearat (E 470b)
Artificiell bärsmak (maltodextrin, propylenglykol [E1520], artificiella smakämnen, trietylcitrat [E 1505], bensylalkohol [E 1519])
Kolloidal vattenfri kiseldioxid (E 551)
Inkompatibiliteter
Ej relevant.
Hållbarhet
Dispergerbar tablett
2 år.
Suspension av dispergerbar tablett
Använd inom 30 minuter efter beredning.
Särskilda förvaringsanvisningar
Inga särskilda temperaturanvisningar.
Förvaras i originalförpackningen. Fuktkänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
FINLEE dispergoituva tabletti
10 mg (L:ei) 420 kpl (2x210, 2 annosmittaa) (3590,69 €)
PF-selosteen tieto
Burk av ogenomskinligt vitt högdensitetspolyeten (HDPE) med barnskyddande skruvlock av polypropen och torkmedel av kiselgel.
En burk innehåller 210 dispergerbara tabletter och två 2 g-behållare med torkmedel. Patienterna ska instrueras att låta torkmedlet ligga kvar i burken och att inte svälja ner det.
Förpackningens innehåll:
- 1 burk (210 dispergerbara tabletter) och 2 dosbägare.
- 2 burkar (420 dispergerbara tabletter) och 2 dosbägare.
En dosbägare rymmer 30 ml och är graderad i 5 ml-steg.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit till ljust gul, rund, bikonvex tablett, storlek 6 mm, med ”D” präglat på ena sidan och ”NVR” på andra sidan.
Särskilda anvisningar för destruktion och övrig hantering
Beredning av suspension av den dispergerbara tabletten
- Den ordinerade dosen av Finlee dispergerbara tabletter läggs i dosbägaren som innehåller cirka 5 ml eller 10 ml vatten (icke kolsyrat).
- Mängden vatten beror på hur många dispergerbara tabletter som ordinerats. Om dosen är 1 till 4 dispergerbara tabletter ska cirka 5 ml vatten användas. Om dosen är 5 till 15 dispergerbara tabletter ska cirka 10 ml vatten användas.
- Det kan ta 3 minuter (eller mer) för tabletterna att lösas upp helt.
- Rör om innehållet försiktigt med skaftet till en rostfri tesked och ge det sedan omedelbart.
- Suspensionen ska inte ges senare än 30 minuter efter beredning (efter att tabletterna har lösts upp helt). Om det har gått mer än 30 minuter ska suspensionen inte användas.
- När patienten har tagit den färdigberedda suspensionen kommer det att finnas rester av tabletten kvar i dosbägaren. Dessa kan ibland vara svåra att se. För att lösa upp eventuella kvarstående partiklar i den tömda dosbägaren ska ungefär 5 ml vatten tillsättas och röras om med skaftet till den rostfria teskeden. Allt innehåll i dosbägaren ska administreras.
Administrering med en näringssond eller oral spruta
- När suspensionen är beredd dras all suspension i dosbägaren upp i en spruta som kan kopplas till en näringssond eller är avsedd för oral administrering.
- Om läkemedlet ska ges via näringssond ska näringssonden spolas igenom med vatten (icke kolsyrat) innan administrering, och därefter ges suspensionen via sonden i enlighet med anvisningarna från tillverkaren. Efter administrering ska näringssonden spolas igenom med vatten.
- Om läkemedlet ska ges med oral spruta placeras sprutan i munnen så att spetsen vidrör insidan av ena kinden. Tryck långsamt in kolven helt så att hela dosen avges.
Fullständig bruksanvisning med illustrationer finns i slutet av bipacksedeln under ”Bruksanvisning”.
Destruktion
Dosbägaren kan användas i upp till 4 månader efter det första användningstillfället. Efter 4 månader kan dosbägaren kastas bland hushållsavfall.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
FINLEE dispergoituva tabletti
10 mg 420 kpl
- Ylempi erityiskorvaus (100 %). Dabrafenibi ja trametinibi: Melanooman, gliooman ja keuhkosyövän hoito erityisin edellytyksin (1509).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dabrafenibi ja trametinibi: Dabrafenibin ja trametinibin yhdistelmähoito aikuisille, kun kyseessä BRAF V600 - mutaatiopositiivisen melanooman hoito erityisin edellytyksin (3024).
Atc-kod
L01EC02
Datum för översyn av produktresumén
21.01.2026
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
