BINOCRIT injektioneste, liuos, esitäytetty ruisku 1000 IU/0,5 ml, 3000 IU/0,3 ml, 4000 IU/0,4 ml, 5000 IU/0,5 ml, 6000 IU/0,6 ml, 8000 IU/0,8 ml, 20000 IU/0,5 ml, 30000 IU/0,75 ml, 2000 IU/ml, 10000 IU/ml, 40000 IU/ml
Vaikuttavat aineet ja niiden määrät
Binocrit 1 000 IU/0,5 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 2 000 IU epoetiini alfaa*, mikä vastaa 16,8 mikrogrammaa per millilitra
Esitäytetty 0,5 ml ruisku sisältää 1 000 kansainvälistä yksikköä (IU), mikä vastaa 8,4 mikrogrammaa epoetiini alfaa. *
Binocrit 2 000 IU/1 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 2 000 IU epoetiini alfaa*, mikä vastaa 16,8 mikrogrammaa per millilitra
Esitäytetty 1 ml ruisku sisältää 2 000 kansainvälistä yksikköä (IU), mikä vastaa 16,8 mikrogrammaa epoetiini alfaa. *
Binocrit 3 000 IU/0,3 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,3 ml ruisku sisältää 3 000 kansainvälistä yksikköä (IU), mikä vastaa 25,2 mikrogrammaa epoetiini alfaa. *
Binocrit 4 000 IU/0,4 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,4 ml ruisku sisältää 4 000 kansainvälistä yksikköä (IU), mikä vastaa 33,6 mikrogrammaa epoetiini alfaa. *
Binocrit 5 000 IU/0,5 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,5 ml ruisku sisältää 5 000 kansainvälistä yksikköä (IU), mikä vastaa 42,0 mikrogrammaa epoetiini alfaa. *
Binocrit 6 000 IU/0,6 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,6 ml ruisku sisältää 6 000 kansainvälistä yksikköä (IU), mikä vastaa 50,4 mikrogrammaa epoetiini alfaa. *
Binocrit 7 000 IU/0,7 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,7 ml ruisku sisältää 7 000 kansainvälistä yksikköä (IU), mikä vastaa 58,8 mikrogrammaa epoetiini alfaa. *
Binocrit 8 000 IU/0,8 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,8 ml ruisku sisältää 8 000 kansainvälistä yksikköä (IU), mikä vastaa 67,2 mikrogrammaa epoetiini alfaa. *
Binocrit 9 000 IU/0,9 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 0,9 ml ruisku sisältää 9 000 kansainvälistä yksikköä (IU), mikä vastaa 75,6 mikrogrammaa epoetiini alfaa. *
Binocrit 10 000 IU/1 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 10 000 IU epoetiini alfaa*, mikä vastaa 84,0 mikrogrammaa per millilitra
Esitäytetty 1 ml ruisku sisältää 10 000 kansainvälistä yksikköä (IU), mikä vastaa 84,0 mikrogrammaa epoetiini alfaa. *
Binocrit 20 000 IU/0,5 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 40 000 IU epoetiini alfaa*, mikä vastaa 336,0 mikrogrammaa per millilitra
Esitäytetty 0,5 ml ruisku sisältää 20 000 kansainvälistä yksikköä (IU), mikä vastaa 168,0 mikrogrammaa epoetiini alfaa. *
Binocrit 30 000 IU/0,75 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 40 000 IU epoetiini alfaa*, mikä vastaa 336,0 mikrogrammaa per millilitra
Esitäytetty 0,75 ml ruisku sisältää 30 000 kansainvälistä yksikköä (IU), mikä vastaa 252,0 mikrogrammaa epoetiini alfaa. *
Binocrit 40 000 IU/1 ml injektioneste, liuos, esitäytetty ruisku
Yksi millilitra liuosta sisältää 40 000 IU epoetiini alfaa*, mikä vastaa 336,0 mikrogrammaa per millilitra
Esitäytetty 1 ml ruisku sisältää 40 000 kansainvälistä yksikköä (IU), mikä vastaa 336,0 mikrogrammaa epoetiini alfaa. *
* Tuotettu kiinanhamsterin munasarjojen (CHO) soluissa yhdistelmä-DNA-tekniikalla
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos, esitäytetty ruisku (injektioneste)
Kliiniset tiedot
Käyttöaiheet
Binocrit on tarkoitettu krooniseen munuaisten vajaatoimintaan liittyvän oireisen anemian hoitoon:
- hemodialyysia saavilla aikuisilla ja 1–18-vuotiailla lapsilla ja peritoneaalidialyysia saavilla aikuispotilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- aikuisilla, joilla on munuaisten vajaatoiminta ja jotka eivät vielä saa dialyysihoitoa, vaikean munuaisperäisen kliinisesti oireilevan anemian hoitoon (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Binocrit on tarkoitettu anemian hoitoon ja verensiirron tarpeen vähentämiseen aikuisilla, joilla on solunsalpaajilla hoidettavia kiinteitä kasvaimia, pahanlaatuista lymfoomaa tai multippelimyeloomaa ja joilla verensiirron tarve on todennäköinen perustuen arviointiin potilaan yleistilasta (esim. kardiovaskulaaritilanne, ennen solunsalpaajahoitoa esiintynyt anemia).
Binocrit on tarkoitettu lisäämään autologisen veren tuottoa luovutettua autologista verta saavilla aikuispotilailla. Hoitoa tulee antaa vain kohtalaisen aneemisille potilaille, (hemoglobiinin [Hb] pitoisuuden vaihteluväli 10–13 g/dl [100–130 g/l, 6,2–8,1 mmol/l], ei raudanpuutosta), jos veren talteenottomenetelmiä ei ole käytettävissä tai jos ne ovat riittämättömiä, kun suunnitellussa suuressa elektiivisessä leikkauksessa vaaditaan suuri määrä verta (vähintään 4 veriyksikköä naisilla tai vähintään 5 veriyksikköä miehillä).
Binocrit on tarkoitettu vähentämään altistusta allogeeniselle verensiirrolle ennen suurta elektiivistä ortopedistä leikkausta aikuisilla, joilla ei ole raudanpuutosta ja joilla on odotettavissa suurentunut verensiirtokomplikaatioiden riski. Käyttö olisi rajattava vain kohtalaisen aneemisiin potilaisiin (hemoglobiinipitoisuuden vaihteluväli 10–13 g/dl (100–130 g/l) tai 6,2–8,1 mmol/l), joille ei ole tarjolla luovutetun autologisen veren siirtomahdollisuutta ja joilla on odotettavissa kohtalainen verenhukka (900–1 800 ml).
Binocrit on tarkoitettu oireisen anemian (hemoglobiinipitoisuus ≤ 10 g/dl [≤ 100 g/l]) hoitoon aikuisille, joilla on matalan tai kohtalaisen 1-riskin primaarinen myelodysplastinen oireyhtymä (MDS) ja joilla on alhainen erytropoietiinitaso seerumissa (< 200 mU/ml).
Ehto
Hoito tulee aloittaa sisätautien, lastentautien, kirurgian, anestesian ja syöpätauteihin perehtyneiden erikoislääkäreiden määräyksellä.
Annostus ja antotapa
Binocrit-hoito on aloitettava sellaisten lääkäreiden valvonnassa, joilla on kokemusta edellä mainittuja indikaatioita sairastavien potilaiden hoidosta.
Annostus
Kaikki muut anemiaa aiheuttavat tekijät (raudan, folaatin tai B12-vitamiinin puute, alumiinimyrkytys, infektio tai tulehdus, verenhukka, hemolyysi ja eri syistä johtuva luuydinfibroosi) tulisi arvioida ja hoitaa ennen epoetiini alfa -hoidon aloittamista ja päätettäessä annoksen suurentamisesta. Optimaalista epoetiini alfa -vastetta varten on varmistettava potilaan rautavarastojen riittävyys ja rautalisää on annettava tarvittaessa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kroonista munuaisten vajaatoimintaa sairastavien aikuispotilaiden oireisen anemian hoito
Anemiaoireet ja jälkitilat voivat vaihdella iän, sukupuolen ja samanaikaisten sairauksien mukaan. Lääkärin arvio yksittäisen potilaan kliinisestä hoidosta ja tilasta on välttämätön.
Suositeltu toivottu hemoglobiinipitoisuuden vaihteluväli on 10–12 g/dl (100–120 g/l) tai 6,2–7,5 mmol/l. Binocrit-valmistetta tulee antaa hemoglobiinin nostamiseksi korkeintaan arvoon 12 g/dl (120 g/l, 7,5 mmol/l). On vältettävä sitä, että hemoglobiiniarvo nousee yli 2 g/dl (20 g/l, 1,25 mmol/l) neljän viikon aikana. Jos näin pääsee tapahtumaan, annosta tulee säätää ohjeiden mukaan.
Hemoglobiiniarvon potilaskohtaisen vaihtelun vuoksi samalla potilaalla voi esiintyä satunnaisesti yksittäisiä tavoitepitoisuuden vaihteluvälin ylä- tai alapuolella olevia arvoja. Hemoglobiiniarvojen vaihtelua on säädeltävä muuttamalla annosta siten, että hemoglobiinipitoisuus olisi vaihteluvälillä 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l).
Jatkuvaa 12 g/dl (120 g/l, 7,5 mmol/l) ylittävää hemoglobiinitasoa tulee välttää. Jos hemoglobiiniarvo nousee yli 2 g/dl (20 g/l, 1,25 mmol/l) kuukaudessa tai jos hemoglobiiniarvo on jatkuvasti yli 12 g/dl (120 g/l, 7,5 mmol/l), pienennetään Binocrit-annosta 25 %. Jos hemoglobiini on yli 13 g/dl (130 g/l, 8,1 mmol/l), keskeytetään hoito, kunnes se laskee alle 12 g:aan/dl (120 g/l, 7,5 mmol/l), minkä jälkeen Binocrit-hoito aloitetaan uudelleen noin 25 % aiempaa annosta pienemmällä annoksella.
Potilaiden huolellisella tarkkailulla on varmistettava, että anemian ja sen oireiden tehokkaaseen hallintaan käytetään pienintä mahdollista tehoavaa Binocrit-annosta ja samalla hemoglobiinipitoisuus pidetään arvossa 12 g/dl (7,5 mmol/l) tai sen alapuolella.
Varovaisuutta on noudatettava suurennettaessa erytropoieesia stimuloivan aineen (ESA) annoksia kroonista munuaisten vajaatoimintaa sairastavilla potilailla. Hoidettaessa potilaita, joiden hemoglobiinivaste ESA-valmisteelle on heikko, on mietittävä, onko heikolle vasteelle muita vaihtoehtoisia selityksiä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Binocrit-hoito jakautuu kahteen vaiheeseen: korjausvaihe ja ylläpitovaihe.
Aikuiset hemodialyysipotilaat
Jos hemodialyysia saavalla potilaalla on helposti käytettävissä oleva laskimoyhteys, anto laskimoon on suositeltavaa.
Korjausvaihe
Aloitusannos on 50 IU/kg kolmesti viikossa.
Suurenna tai pienennä annosta tarvittaessa 25 IU/kg kerrallaan (kolmesti viikossa) kunnes toivottu hemoglobiinin pitoisuuden vaihteluväli 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l) saavutetaan (tämä on tehtävä vaiheittain niin, että väli on vähintään neljä viikkoa).
Ylläpitovaihe
Suositeltava kokonaisviikkoannos on 75–300 IU/kg.
Annostus on säädettävä oikein hemoglobiiniarvojen säilyttämiseksi halutulla vaihteluvälillä: 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l).
Potilaat, joiden hemoglobiinipitoisuus on alussa erittäin pieni (< 6 g/dl (< 60 g/l) tai < 3,75 mmol/l), saattavat tarvita suurempia ylläpitoannoksia kuin potilaat, joiden anemia on alussa lievempi (> 8 g/dl (> 80 g/l) tai > 5 mmol/l).
Munuaisten vajaatoimintaa sairastavat aikuispotilaat, jotka eivät vielä saa dialyysihoitoa
Jos helposti käytettävissä olevaa laskimoyhteyttä ei ole, Binocrit voidaan antaa ihonalaisesti.
Korjausvaihe
Aloitusannos on 50 IU/kg kolmesti viikossa, minkä jälkeen annostusta suurennetaan tarvittaessa 25 IU/kg kerrallaan (kolmesti viikossa), kunnes haluttu tavoite on saavutettu (tämä tulisi tehdä vaiheittain niin, että väli on vähintään neljä viikkoa).
Ylläpitovaihe
Ylläpitovaiheen aikana Binocrit‑valmistetta voidaan antaa joko kolmesti viikossa tai ihonalaisesti annettuna kerran viikossa tai joka toinen viikko.
Annos ja annosvälit on säädettävä oikein hemoglobiiniarvojen säilyttämiseksi halutulla tasolla: hemoglobiini välillä 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l). Annosvälin pidentäminen saattaa vaatia annoksen suurentamista.
Enimmäisannostus ei saa olla yli 150 IU/kg kolmesti viikossa, 240 IU/kg (20 000 IU:n enimmäismäärään asti) kerran viikossa tai 480 IU/kg (40 000 IU:n enimmäismäärään asti) joka toinen viikko.
Peritoneaalidialyysia saavat aikuispotilaat
Jos helposti käytettävissä olevaa laskimoyhteyttä ei ole, Binocrit voidaan antaa ihonalaisesti.
Korjausvaihe
Aloitusannos on 50 IU/kg kaksi kertaa viikossa.
Ylläpitovaihe
Suositeltu ylläpitoannos on 25–50 IU/kg kaksi kertaa viikossa jaettuna kahteen yhtä suureen injektioon.
Annostus on säädettävä oikein hemoglobiiniarvojen säilyttämiseksi halutulla tasolla: 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l).
Solunsalpaajahoidon aiheuttamaa anemiaa sairastavien aikuispotilaiden hoito
Anemian oireet ja jälkitilat saattavat vaihdella iästä, sukupuolesta ja yleisestä tautitaakasta riippuen. Lääkärin arvio yksittäisen potilaan kliinisestä hoidosta ja tilasta on välttämätön.
Binocrit-valmistetta tulee antaa anemiaa sairastaville potilaille (esim. hemoglobiinipitoisuus ≤ 10 g/dl [100 g/l, 6,2 mmol/l]).
Aloitusannos on 150 IU/kg ihonalaisesti kolmesti viikossa.
Binocrit-valmisteen aloitusannoksena voidaan vaihtoehtoisesti antaa 450 IU/kg ihonalaisesti kerran viikossa.
Annostus on säädettävä oikein hemoglobiiniarvojen säilyttämiseksi halutulla vaihteluvälillä 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l).
Hemoglobiinipitoisuuden potilaskohtaisen vaihtelun vuoksi samalla potilaalla voi esiintyä satunnaisesti yksittäisiä tavoitevaihteluvälin ylä- tai alapuolella olevia arvoja. Hemoglobiiniarvon vaihteluita tulee hoitaa annosta muuttamalla hemoglobiinipitoisuuden toivottu vaihteluväli 10 g/dl (100 g/l, 6,2 mmol/l) – 12 g/dl (120 g/l, 7,5 mmol/l) huomioiden. Jatkuvaa 12 g/dl (120 g/l, 7,5 mmol/l) ylittävää hemoglobiinipitoisuutta tulee välttää. Jäljempänä annetaan ohjeet asianmukaiseen annoksen muuttamiseen hemoglobiinipitoisuuksien ylittäessä 12 g/dl (120 g/l, 7,5 mmol/l).
- Jos hemoglobiinipitoisuus on noussut vähintään 1 g/dl (10 g/l, 0,62 mmol/l) tai retikulosyyttien määrä on lisääntynyt ≥ 40 000 solua/mikrol yli lähtötason neljän hoitoviikon jälkeen, annos tulisi pitää 150 IU/kg:nä kolmesti viikossa annettuna tai 450 IU/kg:nä kerran viikossa annettuna.
- Jos hemoglobiinipitoisuus on noussut < 1 g/dl (< 10 g/l, < 0,62 mmol/l) ja retikulosyyttien määrä on lisääntynyt < 40 000 solua/mikrol yli lähtötason, suurenna annos tasolle 300 IU/kg kolmesti viikossa. Jos 300 IU/kg:llä kolmesti viikossa toteutetun neljän lisähoitoviikon jälkeen hemoglobiinipitoisuus on noussut ≥ 1 g/dl (≥ 10 g/l, ≥ 0,62 mmol/l) tai retikulosyyttien määrä on lisääntynyt ≥ 40 000 solua/mikrol, annos tulisi pitää 300 IU/kg:nä kolmesti viikossa.
- Jos hemoglobiinipitoisuus on noussut < 1 g/dl (< 10 g/l, < 0,62 mmol/l) ja retikulosyyttien määrä on lisääntynyt < 40 000 solua/mikrol yli lähtötason, vastetta ei todennäköisesti saavuteta ja hoito tulisi lopettaa.
Annoksen sovittaminen hemoglobiinipitoisuuden ylläpitämiseksi alueella 10 g/dl –12 g/dl (100–120 g/l, 6,2–7,5 mmol/l)
Jos hemoglobiinipitoisuus nousee yli 2 g/dl (20 g/l, 1,25 mmol/l) kuukaudessa tai jos hemoglobiinipitoisuuden taso ylittää 12 g/dl (120 g/l, 7,5 mmol/l), pienennä Binocrit-annosta noin 25–50 %.
Jos hemoglobiinipitoisuuden taso ylittää 13 g/dl (130 g/l, 8,1 mmol/l), keskeytetään hoito, kunnes hemoglobiini on laskenut alle 12 g/dl (120 g/l, 7,5 mmol/l), minkä jälkeen Binocrit -hoito aloitetaan uudelleen 25 % aiempaa annosta pienemmällä annoksella.
Suositeltava annosteluohjelma on esitetty seuraavassa kaaviossa.
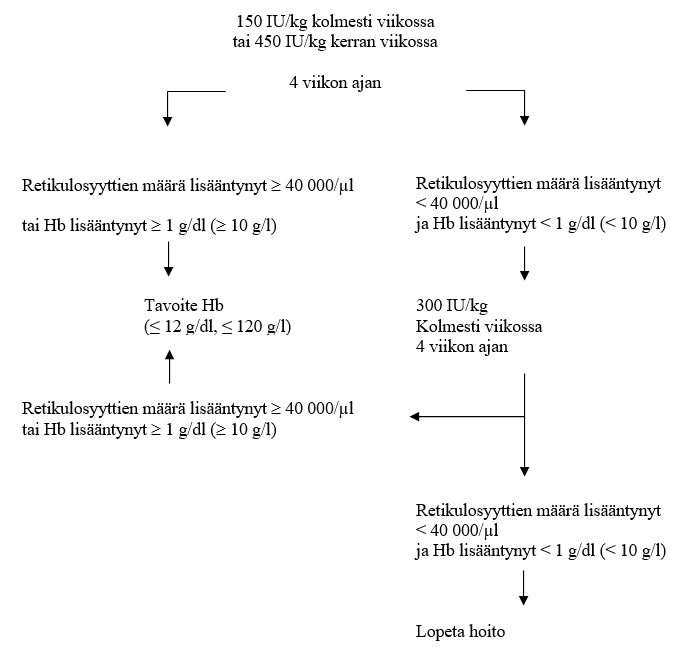
Potilaiden huolellisella tarkkailulla on varmistettava, että anemian oireiden tehokkaaseen hallintaan käytetään ESA:n pienintä mahdollista annosta.
Epoetiini alfa -hoitoa on jatkettava, kunnes solunsalpaajahoidon päättymisestä on kulunut yksi kuukausi.
Hoito aikuisilla leikkauspotilailla, joille siirretään luovutettua autologista verta
Lievästi aneemisia potilaita (hematokriitti 33–39 %), joille on varattava ≥ 4 veriyksikköä, tulee hoitaa Binocrit-valmisteen annoksella 600 IU/kg laskimonsisäisesti kaksi kertaa viikossa 3 viikkoa ennen leikkausta. Binocrit-valmistetta tulee antaa verenluovutuksen päätyttyä.
Hoito aikuispotilailla, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus
Suositeltu annos on 600 IU/kg Binocrit-valmistetta ihon alle annettuna viikoittain kolmen viikon ajan (päivät -21, -14 ja -7) ennen leikkausta sekä leikkauspäivänä (päivä 0).
Jos potilaan tila vaatii leikkausta aikaisemmin kuin kolmen viikon kuluttua, 300 IU/kg Binocrit-valmistetta annetaan ihon alle päivittäin kymmenenä perättäisenä päivänä ennen leikkausta, leikkauspäivänä sekä neljänä päivänä heti leikkauksen jälkeen.
Jos hemoglobiini nousee tasolle 15 g/dl (150 g/l, 9,38 mmol/l) tai korkeammalle leikkausta edeltävän jakson aikana, Binocrit-lääkitys lopetetaan eikä lisäannostuksia enää anneta.
Aikuispotilaiden hoito, kun potilaalla on matalan tai kohtalaisen 1-riskin MDS
Binocrit-valmistetta on annettava potilaille, joilla on oireinen anemia (esim. hemoglobiinipitoisuus ≤ 10 g/dl [≤ 100 g/l, 6,2 mmol/l]).
Suositeltu Binocrit-aloitusannos on 450 IU/kg (kokonaisenimmäisannos on 40 000 IU) annettuna ihon alle kerran viikossa niin, ettei annosten välillä ole alle viittä päivää.
Annosta on muutettava tarpeen mukaan, jotta hemoglobiinipitoisuus pysyy tavoitealueella 10–12 g/dl (100–120 g/l, 6,2–7,5 mmol/l). On suositeltavaa, että aloitusvaiheen erytroidivaste arvioidaan 8–12 viikon kuluttua hoidon aloittamisesta. Annosta on suurennettava ja pienennettävä yksi annostaso kerrallaan (ks. seuraava kaavio). Hemoglobiinipitoisuutta yli 12 g/dl (120 g/l, 7,5 mmol/l) on vältettävä.
Annoksen suurennus: Annosta ei pitäisi suurentaa enimmäisannosta 1 050 IU/kg viikossa (kokonaisannos 80 000 IU) suuremmaksi. Jos potilaan vaste lakkaa tai hemoglobiinipitoisuus putoaa ≥ 1 g/dl (≥ 10 g/l), kun annosta pienennetään, annosta on suurennettava yhdellä annostasolla. Annosten suurennusten välillä on odotettava vähintään 4 viikkoa.
Annoksen pito ja pienennys: Epoetiini alfan käyttö on lopetettava, kun hemoglobiinipitoisuus on yli 12 g/dl (120 g/l, 7,5 mmol/l). Kun hemoglobiiniarvo on < 11 g/dl (< 110 g/l), annostus voidaan käynnistää uudelleen samalla annostasolla tai yhtä pienemmällä annostasolla lääkärin harkinnan mukaan. Annoksen pienentämistä yhdellä annostasolla on harkittava, jos hemoglobiiniarvo nousee nopeasti (> 2 g/dl [> 20 g/l] neljän viikon aikana).
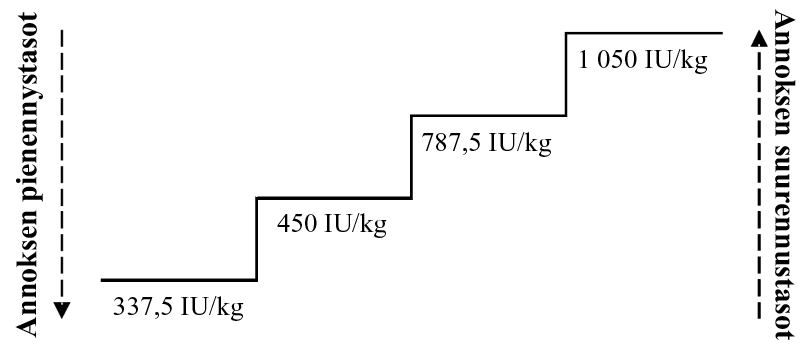
Anemiaoireet ja jälkitilat voivat vaihdella iän, sukupuolen ja samanaikaisten sairauksien mukaan. Lääkärin arvio yksittäisen potilaan kliinisestä hoidosta ja tilasta on välttämätön.
Pediatriset potilaat
Oireisen anemian hoito kroonista munuaisten vajaatoimintaa sairastavilla, hemodialyysia saavilla potilailla
Anemiaoireet ja jälkitilat voivat vaihdella iän, sukupuolen ja samanaikaisten sairauksien mukaan. Lääkärin arvio yksittäisen potilaan kliinisestä hoidosta ja tilasta on välttämätön.
Pediatrisilla potilailla suositeltu hemoglobiinipitoisuuden vaihteluväli on 9,5–11 g/dl (95–110 g/l, 5,9–6,8 mmol/l). Binocrit-valmistetta tulee antaa hemoglobiinin nostamiseksi korkeintaan arvoon 11 g/dl (110 g/l, 6,8 mmol/l). On vältettävä sitä, että hemoglobiiniarvo nousee yli 2 g/dl (20 g/l, 1,25 mmol/l) neljän viikon aikana. Jos näin pääsee tapahtumaan, annosta tulee säätää ohjeiden mukaan.
Potilaiden huolellisella tarkkailulla on varmistettava, että anemian ja sen oireiden tehokkaaseen hallintaan käytetään pienintä mahdollista Binocrit‑annosta.
Binocrit‑hoito jakautuu kahteen vaiheeseen: korjausvaihe ja ylläpitovaihe.
Jos hemodialyysia saavalla pediatrisilla potilaalla on helposti käytettävissä oleva laskimoyhteys, anto laskimoon on suositeltavaa.
Korjausvaihe
Aloitusannos on 50 IU/kg kolmesti viikossa laskimonsisäisesti.
Tämän jälkeen annosta suurennetaan tai pienennetään tarvittaessa 25 IU/kg (kolmesti viikossa) kunnes saavutetaan toivottu hemoglobiinin pitoisuuden vaihteluväli, 9,5–11 g/dl (95–110 g/l, 5,9–6,8 mmol/l) (tämä tulisi tehdä vaiheittain niin, että väli on vähintään neljä viikkoa).
Ylläpitovaihe
Annostus on säädettävä oikein hemoglobiinipitoisuuksien säilyttämiseksi halutun vaihteluvälin sisällä: 9,5–11 g/dl (95–110 g/l, 5,9–6,8 mmol/l).
Alle 30-kiloiset lapset tarvitsevat yleensä suurempia ylläpitoannoksia kuin yli 30-kiloiset lapset ja aikuiset.
Pediatriset potilaat, joiden hemoglobiinipitoisuus on alussa erittäin pieni (< 6,8 g/dl [68 g/l] tai < 4,25 mmol/l) saattavat tarvita suurempia ylläpitoannoksia kuin potilaat, joiden hemoglobiinipitoisuus on alussa suurempi (> 6,8 g/dl [68 g/l] tai > 4,25 mmol/l).
Anemia kroonista munuaisten vajaatoimintaa sairastavilla potilailla ennen dialyysin aloittamista tai peritoneaalidialyyshoidossa
Epoetiini alfan turvallisuutta ja tehoa anemiaa sairastavilla munuaisten vajaatoimintapotilailla ennen dialyysin aloittamista tai peritoneaalidialyysihoidossa ei ole varmistettu. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdassa Farmakodynamiikka, ei voida antaa suosituksia epoetiini alfan annostuksesta ihon alle näissä väestöryhmissä.
Solunsalpaajahoidon aiheuttamaa anemiaa sairastavien pediatristen potilaiden hoito
Epoetiini alfan turvallisuutta ja tehoa solunsalpaajahoitoa saavien pediatristen potilaiden hoidossa ei ole varmistettu (ks. kohta Farmakodynamiikka).
Hoito pediatrisilla leikkauspotilailla, joille siirretään luovutettua autologista verta
Epoetiini alfan turvallisuutta ja tehoa pediatristen potilaiden hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Hoito pediatrisilla potilailla, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus
Epoetiini alfan turvallisuutta ja tehoa pediatristen potilaiden hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet.
Anna Binocrit-ruiskun lämmetä huoneenlämpöiseksi ennen käyttöä. Tämä vie tavallisesti 15–30 minuuttia.
Kuten kaikkien pistoksena annettavien lääkkeiden kohdalla, tarkasta, ettei liuoksessa ole hiukkasia tai värin muutoksia. Binocrit on steriili, mutta säilöntäaineeton valmiste, joka on tarkoitettu ainoastaan kertakäyttöön. Anna tarvittava määrä.
Kroonista munuaisten vajaatoimintaa sairastavien aikuispotilaiden oireisen anemian hoito
Jos kroonista munuaisten vajaatoimintaa sairastavalla potilaalla on helposti käytettävissä oleva laskimoyhteys (hemodialyysipotilaat), Binocrit-valmisteen anto laskimoon on suositeltavaa.
Jos helposti käytettävissä olevaa laskimoyhteyttä ei ole (potilaat, jotka eivät vielä saa dialyysia ja peritoneaalidialyysia saavat potilaat), Binocrit voidaan antaa ihonalaisena injektiona.
Solunsalpaajahoidon aiheuttamaa anemiaa sairastavien aikuispotilaiden hoito
Binocrit tulee antaa ihonalaisena injektiona.
Hoito aikuisilla leikkauspotilailla, joille siirretään luovutettua autologista verta
Binocrit tulee antaa laskimoon.
Hoito aikuispotilailla, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus
Binocrit tulee antaa ihonalaisena injektiona.
Aikuispotilaiden hoito, kun potilaalla on matalan tai kohtalaisen 1-riskin MDS
Binocrit tulee antaa ihonalaisena injektiona.
Oireisen anemian hoito kroonista munuaisten vajaatoimintaa sairastavilla, hemodialyysihoitoa saavilla lapsipotilailla
Kroonista munuaisten vajaatoimintaa sairastavilla lapsipotilailla, joilla laskimoyhteys on rutiinisti käytettävissä (hemodialyysipotilaat), on suositeltavaa antaa Binocrit laskimoon.
Anto laskimoon
Annetaan vähintään 1–5 minuutin kuluessa kokonaisannoksesta riippuen. Hemodialyysipotilaille bolusinjektio voidaan antaa dialyysin aikana dialyysikatetrin laskimoportin kautta. Injektio voidaan vaihtoehtoisesti antaa dialyysikerran jälkeen valtimolaskimoavanteen kestokanyylin kautta, minkä jälkeen letku huuhdellaan 10 ml:lla isotonista keittosuolaliuosta, jotta injisoitu lääke siirtyy tyydyttävällä tavalla verenkiertoon (ks. Annostus, ”Aikuiset hemodialyysipotilaat”).
Hitaampaa antamista suositellaan potilaille, joille hoito aiheuttaa flunssaa muistuttavia oireita (ks. kohta Haittavaikutukset).
Älä anna Binocrit-valmistetta laskimonsisäisenä infuusiona tai yhdessä muiden lääkevalmisteliuosten kanssa (ks. lisätietoja kohdasta Käyttö- ja käsittelyohjeet).
Anto ihon alle
1 ml:n enimmäismäärää yhtä pistokohtaa kohti ei pitäisi yleensä ylittää. Suurempia tilavuuksia käytettäessä injektio tulisi pistää useaan eri kohtaan.
Injektiot pistetään raajoihin tai vatsaontelon etuseinämään.
Niissä tilanteissa, joissa lääkäri arvelee, että potilas tai hänestä huolehtiva henkilö voi pistää Binocrit-valmistetta ihon alle turvallisesti ja tehokkaasti itse, on annettava oikeaa annosta ja antamista koskevaa opastusta.
Asteikkorenkaat
Ruiskussa on asteikkorenkaat, jotka mahdollistavat osittaisen annoksen ottamisen (ks. kohta Käyttö- ja käsittelyohjeet). Valmiste on kuitenkin tarkoitettu ainoastaan kertakäyttöön. Yhdestä ruiskusta saa ottaa vain yhden Binocrit-annoksen.
”Ohjeet itsesi pistämiseen” ovat pakkausselosteen lopussa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Jos potilaalle on kehittynyt puhdas punasoluaplasia (pure red cell aplasia, PRCA) minkä tahansa erytropoietiinivalmisteen käytön yhteydessä, häntä ei tule hoitaa Binocrit-valmisteella tai millään muulla erytropoietiinivalmisteella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Hallitsematon hypertensio.
- Kaikki autologisen veren verensiirto-ohjelmiin liittyvät vasta-aiheet on otettava huomioon potilailla, jotka saavat Binocrit-valmistetta.
Binocrit-hoito on kontraindisoitu vakavasta sepelvaltimon, ääreisvaltimoiden, kaulavaltimon tai aivoverisuoniston sairaudesta kärsivän sekä äskettäin sydäninfarktin tai aivoinfarktin saaneen potilaan suuressa elektiivisessä ortopedisessa leikkaushoidossa, jossa ei tehdä autologista verensiirtoa.
- Leikkauspotilaat, joille jostakin syystä ei voi antaa asiaankuuluvaa tromboosiprofylaksia.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Erytropoietiinia stimuloivien aineiden (ESA) jäljitettävyyden parantamiseksi on annetun ESA-valmisteen kauppanimi ja eränumero dokumentoitava selkeästi potilastietoihin (tai ilmoitettava niissä).
Potilaiden vaihtamisen yhden erytropoietiinia stimuloivan aineen käytöstä toisen vastaavan aineen käyttöön on tapahduttava asianmukaisessa valvonnassa.
Yleistä
Jokaisen epoetiini alfa -hoitoa saavan potilaan verenpainetta on seurattava tarkoin ja sitä on hoidettava tarvittaessa. Varovaisuutta on noudatettava epoetiini alfan käytössä, jos potilaalla on hoitamaton, riittämättömästi hoidettu tai huonosti hallittava verenpainetauti. Potilaalle on ehkä aloitettava verenpainetaudin hoito tai hoitoa on lisättävä. Jos verenpainetta ei saada hallintaan, epoetiini alfa ‑hoito on lopetettava.
Hypertensiivisiä kriisejä, joihin liittyy enkefalopatiaa muistuttavia oireita ja kouristuskohtauksia, jotka vaativat välitöntä lääkärinhoitoa ja tehohoitoa, on myöskin ilmennyt epoetiini alfa -hoidon aikana potilailla, joilla oli aikaisemmin normaali tai alhainen verenpaine. Erityistä huomiota on kiinnitettävä äkillisiin migreeniä muistuttaviin viiltäviin päänsärkykohtauksiin mahdollisena varoitusmerkkinä (ks. kohta Haittavaikutukset).
Varovaisuutta on noudatettava epoetiini alfan käytössä potilailla, joilla on epilepsia, anamneesissa kouristuskohtauksia tai joilla on sairauksia, jotka liitetään kouristelutaipumukseen, kuten esimerkiksi keskushermoston infektiot ja aivojen metastaasit.
Varovaisuutta on noudatettava epoetiini alfan käytössä potilailla, joilla on krooninen maksan vajaatoiminta. Epoetiini alfan turvallisuutta ei ole varmistettu potilailla, joilla on maksan toimintahäiriö.
ESA-aineita saavilla syöpäpotilailla on havaittu tromboottisten verisuonitapahtumien (thrombotic vascular events, TVEs) esiintyvyyden lisääntyneen (ks. kohta Haittavaikutukset). Näihin kuuluvat laskimo- ja valtimotromboosit ja embolia (joista jotkut johtavat kuolemaan), kuten syvä laskimotukos, keuhkoembolia, verkkokalvon verisuonitukos ja sydäinfarkti. Lisäksi aivoverisuonitapahtumia (mukaan lukien aivoinfarkti ja aivoverenvuoto ja ohimenevät aivoverenkiertohäiriöt) on raportoitu.
Näiden tromboottisten verisuonitapahtumien raportoitua riskiä on punnittava huolellisesti epoetiini alfa -hoidosta saataviin hyötyihin nähden erityisesti potilailla, joilla on ennestään tromboottisille tapahtumille altistavia riskitekijöitä, mukaan lukien lihavuus ja aiemmat tromboottiset verisuonitapahtumat (esim. syvä laskimotukos, keuhkoembolia ja aivoverenkiertohäiriö).
Kaikkien potilaiden hemoglobiinitasoja on seurattava tarkoin tromboembolisten tapahtumien ja kuolemantapausten mahdollisen lisääntyneen riskin johdosta, kun potilaita hoidetaan käyttöaiheen edellyttämiä hemoglobiinipitoisuuksien vaihteluvälejä suuremmilla tasoilla.
Verihiutaleiden määrä saattaa nousta kohtalaisesti normaalin vaihteluvälin rajoissa annoksesta riippuvaisesti epoetiini alfa -hoidon aikana. Verihiutaleiden määrä palautuu ennalleen jatkohoidon aikana. Lisäksi on raportoitu normaalin vaihteluvälin yläpuolella olevaa trombosytemiaa. Verihiutaleiden määrää suositellaan seurattavaksi säännöllisesti kahdeksan ensimmäisen hoitoviikon aikana.
Kaikki muut anemiaa aiheuttavat tekijät (raudan, folaatin tai B12-vitamiinin puute, alumiinimyrkytys, infektio tai tulehdus, verenhukka, hemolyysi ja eri syistä johtuva luuydinfibroosi) tulisi arvioida ja hoitaa ennen epoetiini alfa -hoidon aloittamista ja päätettäessä annoksen suurentamisesta. Seerumin ferritiiniarvot pienenevät useimmiten samaan aikaan, kun hematokriittiarvo suurenee. Optimaalista epoetiini alfa -vastetta varten on varmistettava potilaan rautavarastojen riittävyys ja rautalisää on annettava tarvittaessa (ks. kohta Annostus ja antotapa). Potilaan tarpeita parhaiten vastaavaa hoitovaihtoehtoa valittaessa on noudatettava rautalisän käyttöä koskevia voimassa olevia hoitosuosituksia sekä hyväksyttyjä ja rautalääkkeen valmisteyhteenvedossa annettuja annostusohjeita:
- kroonista munuaisten vajaatoimintaa sairastaville potilaille suositellaan rautalisää, jos seerumin ferritiinitaso on alle 100 ng/ml
- syöpäpotilaille suositellaan rautalisää, jos transferriinisaturaatio on alle 20 %
- potilaille, joille siirretään luovutettua autologista verta, on annettava lisärautaa useiden viikkojen ajan ennen autologisen veren keräystä, jotta ennen epoetiini alfa -hoidon aloittamista saavutetaan suuret rautavarastot, ja koko epoetiini alfa -hoitojakson ajan
- potilaille, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus, on annettava lisärautaa koko epoetiini alfa -hoitojakson ajan. Jos mahdollista, lisärautahoito on aloitettava ennen epoetiini alfa -hoitoa, jotta elimistön rautavarastot täyttyvät riittävästi.
Hyvin harvoin on havaittu porfyrian kehittymistä tai pahenemista epoetiini alfalla hoidetuilla potilailla. Epoetiini alfaa on käytettävä porfyriapotilailla varoen.
Epoetiinihoidon yhteydessä on ilmoitettu vakavia ihoon kohdistuvia haittavaikutuksia, mukaan lukien Stevens-Johnsonin oireyhtymää ja toksista epidermaalista nekrolyysiä, jotka voivat olla hengenvaarallisia tai kuolemaan johtavia. Vakavampia tapauksia on havaittu pitkävaikutteisten epoetiinien yhteydessä.
Lääkettä määrättäessä potilaille on kerrottava merkeistä ja oireista ja ihoreaktioita on seurattava tarkasti. Jos näihin reaktioihin viittaavia merkkejä ja oireita ilmenee, Binocrit-valmisteen käyttö on lopetettava heti ja vaihtoehtoista hoitoa on harkittava.
Jos potilaalla on vakava ihoon kohdistuva reaktio, kuten Binocrit-valmisteen käytöstä johtuva Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi, hoitoa Binocrit-valmisteella ei saa aloittaa kyseisellä potilaalla uudelleen missään vaiheessa.
Puhdas punasoluaplasia (Pure Red Cell Aplasia PRCA)
Vasta-ainevälitteistä PRCA:ta on raportoitu kuukausien tai vuosien epoetiini alfa -hoidon jälkeen. Tapauksia on ilmoitettu myös C-hepatiittia sairastavilla potilailla, joita on hoidettu interferonilla ja ribaviriinilla, kun ESA-aineita on käytetty samanaikaisesti. Epoetiini alfaa ei ole hyväksytty C-hepatiittiin liittyvän anemian hoitoon.
Potilailta, joille on äkillisesti kehittynyt hemoglobiinin vähenemisellä määritetty (1–2 g/dl/kk [10–20 g/l/kk] tai 0,62–1,25 mmol/l/kk) lääkkeen vaikutuksen puutos, johon liittyy verensiirtojen lisääntynyt tarve, on tutkittava retikulosyyttien määrä ja vasteen puuttumisen tavallisimmat syyt (esimerkiksi raudan, folaatin ja B12-vitamiinin puutos, alumiinimyrkytys, infektio tai tulehdus, verenhukka, hemolyysi ja eri syistä johtuva luuydinfibroosi).
Alhaisiin retikulosyyttimääriin liittyvän vaikean anemian kehittymisen ja hemoglobiinin paradoksisen vähenemisen tulisi antaa aihe epoetiini alfa -hoidon keskeyttämiseen ja erytropoietiinin vasta-ainetestien suorittamiseen. Luuydintutkimusta on myös harkittava PRCA:n toteamiseksi.
Ristireaktion riskin vuoksi muita hoitoja erytropoietiinia stimuloivilla aineilla ei pidä aloittaa.
Oireisen anemian hoito kroonista munuaisten vajaatoimintaa sairastavilla aikuis- ja lapsipotilailla
Jos epoetiini alfa -hoitoa saavilla potilailla on krooninen munuaisten vajaatoiminta, hemoglobiinitasot on mitattava säännöllisesti kunnes vakaa taso on saavutettu, sekä sen jälkeen määräajoin.
Kroonista munuaisten vajaatoimintaa sairastavilla potilailla hemoglobiinipitoisuuden nousunopeuden tulisi olla noin 1 g/dl (10 g/l, 0,62 mmol/l) kuukautta kohti eikä se saisi ylittää 2 g/dl (20 g/l, 1,25 mmol/l) kuukautta kohti hypertension pahenemisriskin minimoimiseksi.
Kroonista munuaisten vajaatoimintaa sairastavilla potilailla ylläpidettävä hemoglobiinipitoisuus ei saa ylittää kohdassa Annostus ja antotapa suositeltua hemoglobiinipitoisuuden vaihteluvälin ylärajaa. Kliinisissä tutkimuksissa havaittiin kuoleman ja vakavien sydän- ja verisuonitapahtumien riskin lisääntyneen käytettäessä ESA-aineita yli 12 g/dl:n (120 g/l, 7,5 mmol/l) hemoglobiinipitoisuuden saavuttamiseksi.
Kontrolloiduissa kliinisissä tutkimuksissa epoetiineilla ei ole saavutettu merkittävää lisähyötyä, kun hemoglobiinipitoisuus on nostettu yli minimitason, jolla anemiaoireet pysyvät hallinnassa ja verensiirrot vältetään.
Varovaisuutta on noudatettava suurennettaessa Binocrit -annoksia kroonista munuaisten vajaatoimintaa sairastavilla potilailla, sillä suuret kumulatiiviset epoetiiniannokset saattavat liittyä lisääntyneeseen kuolleisuusriskiin, vakaviin kardiovaskulaarisiin tapahtumiin ja aivoverisuonitapahtumiin. Hoidettaessa potilaita, joiden hemoglobiinivaste epoetiineille on heikko, on mietittävä, onko heikolle vasteelle muita vaihtoehtoisia selityksiä (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Epoetiini alfa -hoitoa ihonalaisesti saavia, kroonista munuaisten vajaatoimintaa sairastavia potilaita on seurattava säännöllisesti tehon häviämisen varalta. Tämä määritellään olemattomaksi tai heikentyneeksi vasteeksi epoetiini alfa -hoidolle, kun potilas on aiemmin reagoinut kyseiseen hoitoon. Sille on ominaista hemoglobiinin jatkuva väheneminen epoetiini alfa -annoksen suurentamisesta huolimatta (ks. kohta Haittavaikutukset).
Jotkut potilaat, joilla epoetiini alfan annosväli on pitkä (pidempi kuin kerran viikossa), eivät välttämättä saavuta riittäviä hemoglobiiniarvoja (ks. kohta Farmakodynamiikka) ja saattavat tarvita suuremman epoetiini alfa -annoksen. Hemoglobiiniarvot on mitattava säännöllisesti.
Sunttitrombooseja on ilmennyt etenkin niillä hemodialyysipotilailla, joilla on taipumusta alhaiseen verenpaineeseen tai joiden AV-avanteessa ilmenee komplikaatioita (esim. stenoosit, aneurysmat jne.). Näille potilaille suositellaan suntin varhaista korjaamista ja tromboosin estohoitoa esimerkiksi asetyylisalisyylihapolla.
Hyperkalemiaa on havaittu yksittäistapauksissa, joskaan syy-yhteyttä hoitoon ei ole osoitettu. Seerumin elektrolyyttitasoja on seurattava potilailla, joilla on krooninen munuaisten vajaatoiminta. Jos seerumin kaliumtason todetaan nousseen tai olevan nousussa, hyperkalemian asianmukaisen hoidon lisäksi on harkittava epoetiini alfa -hoidon keskeyttämistä siihen asti, kunnes seerumin kaliumtaso on korjaantunut.
Hemodialyysin aikana hepariiniannosta on usein suurennettava epoetiini alfa -hoitojakson aikana kohonneen hematokriitin vuoksi. Dialyysilaitteisto voi tukkeutua, jos hepariinihoito ei ole optimaalinen.
Tähänastisten saatavilla olevien tutkimustietojen perusteella anemian korjaaminen epoetiini alfalla munuaisten vajaatoimintaa sairastavilla aikuispotilailla, jotka eivät vielä saa dialyysihoitoa, ei nopeuta munuaisten vajaatoiminnan pahenemista.
Solunsalpaajahoidon aiheuttamaa anemiaa sairastavien potilaiden hoito
Jos epoetiini alfa -hoitoa saavilla potilailla on syöpä, hemoglobiinitasot on mitattava säännöllisesti kunnes vakaa taso on saavutettu, sekä sen jälkeen määräajoin.
Epoetiinit ovat kasvutekijöitä, jotka stimuloivat ensisijaisesti punasolujen (RBC) tuotantoa. Erytropoietiinireseptoreja voidaan todeta myös erilaisten kasvainsolujen pinnalla. Kaikkien kasvutekijöiden tapaan on olemassa mahdollisuus, että epoetiinit voivat stimuloida kasvainten kasvua. ESA-aineiden roolia syövän etenemisen tai lyhentyneen etenemisvapaan elinajan suhteen ei voida sulkea pois. Kontrolloiduissa kliinisissä tutkimuksissa epoetiini alfan ja muiden ESA-aineiden käyttö on liitetty paikalliseen kasvaimen kontrollin vähenemiseen tai kokonaiselinajan lyhentymiseen seuraavasti:
- taudin etenemisajan lyhentyminen levinnyttä pään ja kaulan alueen syöpää sairastavilla potilailla, jotka saavat sädehoitoa, kun niitä annetaan yli 14 g/dl:n (140 g/l, 8,7 mmol/l) hemoglobiinipitoisuuden saavuttamiseksi
- kokonaiselinajan lyhentyminen ja neljän kuukauden kohdalla sairauden etenemisestä johtuvien kuolemien lisääntyminen solunsalpaajahoitoa saavilla metastasoitunutta rintasyöpää sairastavilla potilailla, kun niitä annetaan 12–14 g/dl:n (120–140 g/l, 7,5–8,7 mmol/l) hemoglobiinipitoisuuden saavuttamiseksi
- kuoleman riskin lisääntyminen syöpää sairastavilla potilailla, jotka eivät saaneet solunsalpaajia eivätkä sädehoitoa, kun niitä annetaan yli 12 g/dl:n (120 g/l, 7,5 mmol/l) hemoglobiinipitoisuuden saavuttamiseksi. Erytropoietiinia stimuloivia aineita ei ole tarkoitettu käytettäväksi tässä potilasryhmässä
- sairauden etenemisen tai kuoleman riskin 9 %:n nousu epoetiini alfaa ja tavanomaista hoitoa saaneiden ryhmässä ensimmäisen analyysin jälkeen ja 15 %:n lisääntynyt riski, jota ei voida tilastollisesti sulkea pois, solunsalpaajahoitoa saavilla metastasoitunutta rintasyöpää sairastavilla potilailla, kun niitä annetaan 10–12 g/dl (6,2–7,5 mmol/l) hemoglobiinipitoisuuden saavuttamiseksi.
Edellä mainitut seikat huomioiden tulisi verensiirron olla joissakin kliinisissä tilanteissa ensisijainen anemian hoitomuoto syöpäpotilailla. Päätöksen antaa yhdistelmä-DNA-tekniikalla valmistettua erytropoietiinia tulisi perustua potilaskohtaiseen hyöty-riski-analyysiin, jossa tulee huomioida erityiset kliiniset puitteet. Tässä arvioinnissa huomioitaviin tekijöihin tulee kuulua kasvaimen tyyppi ja vaihe; anemia-aste; odotettavissa oleva elinaika; potilaan hoitoympäristö; ja potilaan toiveet (ks. kohta Farmakodynamiikka).
Solunsalpaajahoitoa saavilla syöpäpotilailla tulisi huomioida 2–3 viikon viive ESA-aineiden annon ja erytropoietiini-indusoitujen punasolujen ilmaantumisen välillä arvioitaessa epoetiini alfa -hoidon sopivuutta (verensiirtoa todennäköisesti tarvitseva potilas).
Leikkauspotilaat, joille siirretään luovutettua autologista verta
Kaikkia erityisiä varoituksia ja erityisiä varotoimenpiteitä, jotka liittyvät luovutetun autologisen veren siirtoon, erityisesti rutiininomainen volyymikorjaus, tulee noudattaa.
Potilaat, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus
Leikkauspotilaiden sairaalahoidon yhteydessä on aina noudatettava asianmukaisia ohjeita verensiirroista.
Suureen elektiiviseen ortopediseen leikkaukseen tuleville potilaille tulisi antaa riittävä antitromboottinen profylaksi, koska tromboottiset ja vaskulaariset tapahtumat ovat mahdollisia leikkauspotilailla erityisesti silloin, kun potilaalla on ennestään kardiovaskulaarinen sairaus. Lisäksi on noudatettava erityistä varovaisuutta, kun potilaalla on taipumus syvien laskimotukosten (SLT) muodostumiseen. Ei voida myöskään poissulkea mahdollisuutta, että epoetiini alfa -hoitoon liittyisi lisääntynyt riski postoperatiivisten tromboottisten tai vaskulaaristen tapahtumien esiintymiseen, kun potilaan hemoglobiinin taso on hoidon alussa > 13 g/dl (> 130 g/l, > 8,1 mmol/l). Siksi epoetiini alfaa ei tule käyttää potilaille, joiden hemoglobiinin lähtötaso on > 13 g/dl (> 130 g/l, > 8,1 mmol/l).
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Ei ole näyttöä, joka osoittaisi, että epoetiini alfa -hoito muuttaisi muiden lääkevalmisteiden metaboliaa.
Erytropoieesia vähentävät lääkevalmisteet saattavat vähentää vastetta epoetiini alfalle.
Koska siklosporiini sitoutuu punasoluihin, lääkevalmisteiden yhteisvaikutuksen mahdollisuus on olemassa. Jos epoetiini alfaa annetaan samanaikaisesti siklosporiinin kanssa, veren siklosporiinitasoa on seurattava ja siklosporiiniannosta on sovitettava hematokriittiarvon noustessa.
Tuumorinäytteiden hematologisen in vitro differentiaation tai proliferaation yhteydessä ei ole esiintynyt näyttöä yhteisvaikutuksesta epoetiini alfan ja G‑CSF:n (granulocyte colony‑stimulating factor) tai GM‑CSF:n (granulocyte macrophage colony‑stimulating factor) välillä.
Metastasoitunutta rintasyöpää sairastavilla aikuisilla naisilla ei havaittu vaikutusta trastutsumabin farmakokinetiikkaan, kun heille annettiin ihon alle samanaikaisesti 40 000 IU/ml epoetiini alfaa ja 6 mg/kg trastutsumabia.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja epoetiini alfan käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Sen seurauksena epoetiini alfa ‑valmistetta tulisi käyttää raskausaikana vain, jos mahdollinen hyöty on suurempi kuin sikiölle mahdollisesti aiheutuva riski. Epoetiini alfan käyttöä ei suositella raskaana oleville leikkauspotilaille, joille siirretään luovutettua autologista verta.
Imetys
Ei tiedetä, erittyykö eksogeeninen epoetiini alfa ihmisen rintamaitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois.
Epoetiini alfan käytössä imettäville naisille on noudatettava varovaisuutta. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko epoteiini alfa ‑hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja epoetiini alfa -hoidosta koituvat hyödyt äidille.
Epoetiini alfan käyttöä ei suositella imettäville leikkauspotilaille, joille siirretään autologista verta.
Hedelmällisyys
Tutkimuksia, joissa selvitettäisiin epoetiini alfan mahdollista vaikutusta miesten tai naisten hedelmällisyyteen, ei ole.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia vaikutuksesta ajokykyyn ja koneidenkäyttökykyyn ei ole tehty. Binocrit-valmisteella ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisin lääkkeen haittavaikutus epoetiini alfa -hoidon aikana on annostuksesta riippuva verenpaineen nousu tai jo olemassa olevan verenpainetaudin paheneminen. Verenpainetta on tarkkailtava erityisesti hoidon alussa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yleisimmin esiintyviä epoetiini alfan kliinisissä tutkimuksissa havaittuja lääkkeen haittavaikutuksia ovat ripuli, pahoinvointi, oksentelu, kuume ja päänsärky. Flunssaa muistuttavaa sairautta voi esiintyä erityisesti hoidon alussa.
Hengitysteiden kongestiota, mukaan lukien ylähengitysteiden kongestio, nenän kongestio ja nenänielun tulehdus, on raportoitu tutkimuksissa, joissa tutkittiin pidemmän annosvälin käyttöä munuaisten vajaatoimintaa sairastavilla aikuispotilailla, jotka eivät vielä saa dialyysihoitoa.
ESA-aineita saavilla potilailla on havaittu tromboottisten verisuonitapahtumien (thrombotic vascular events, TVEs) esiintyvyyden lisääntyneen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukkomuotoinen luettelo haittavaikutuksista
Kaikkiaan 3 417 koehenkilöä osallistui 25 satunnaistettuun, kaksoissokkoutettuun, lume- tai tavanomaisella hoidolla kontrolloituun tutkimukseen. Epoetiini alfan yleinen turvallisuusprofiili arvioitiin 2 094 aneemisella koehenkilöllä. Tutkimukset ja niihin osallistuneet koehenkilöt olivat seuraavat: 228 epoetiini alfa -hoitoa saanutta, kroonista munuaisten vajaatoimintaa sairastavaa potilasta 4:ssä kroonisen munuaisten vajaatoiminnan tutkimuksessa (2 dialyysia edeltäneen ajan tutkimuksessa [N = 131 altistunutta kroonista munuaisten vajaatoimintaa sairastavaa potilasta] ja 2 dialyysitutkimuksessa [N = 97 altistunutta kroonista munuaisten vajaatoimintaa sairastavaa potilasta]); 1 404 altistunutta syöpäpotilasta 16 tutkimuksessa, joissa tutkittiin solunsalpaajahoidon aiheuttamaa anemiaa; 147 altistunutta koehenkilöä kahdessa tutkimuksessa, joissa tutkittiin autologisia verenluovutuksia, 213 altistunutta koehenkilöä yhdessä leikkausjakson aikana tehdyssä tutkimuksessa ja 102 altistunutta koehenkilöä kahdessa MDS-tutkimuksessa. Näissä tutkimuksissa epoeteeni alfa ‑hoitoa saaneista koehenkilöistä ≥ 1 % raportoi haittavaikutuksia, jotka esitetään alla olevassa taulukossa.
Esiintymistiheyksien arviointi: Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
MedDRA-elinjärjestelmäluokitus (SOC) | Haittavaikutus (suositeltu termi) | Esiintymistiheys |
Veri ja imukudos | Puhdas punasoluaplasia3, Trombosytemia | Harvinainen |
Aineenvaihdunta ja ravitsemus | Hyperkalemia1 | Melko harvinainen |
Immuunijärjestelmä | Yliherkkyys3 | Melko harvinainen |
Anafylaktinen reaktio3 | Harvinainen | |
Hermosto | Päänsärky | Yleinen |
Kouristukset | Melko harvinainen | |
Verisuonisto | Hypertensio, laskimo- ja valtimotromboosit2 | Yleinen |
Verenpainekriisi3 | Tuntematon | |
Hengityselimet, rintakehä ja välikarsina | Yskä | Yleinen |
Hengitysteiden tukkeutuminen | Melko harvinainen | |
Ruoansulatuselimistö | Ripuli, pahoinvointi, oksentelu | Hyvin yleinen |
Iho ja ihonalainen kudos | Ihottuma | Yleinen |
Urtikaria3 | Melko harvinainen | |
Angioneuroottinen edeema3 | Tuntematon | |
Luusto, lihakset ja sidekudos | Nivelkipu, luukipu, lihaskipu, raajakipu | Yleinen |
Synnynnäiset ja perinnölliset/geneettiset häiriöt | Akuutti porfyria3 | Harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Kuume | Hyvin yleinen |
Vilunväristykset, influenssan kaltainen sairaus, reaktio injektiopaikassa, perifeerinen turvotus | Yleinen | |
Lääkevalmisteen tehottomuus3 | Tuntematon | |
Tutkimukset | Positiivinen tulos antierytropoietiinin vasta-ainetestissä | Harvinainen |
1 Yleistä dialyysissä 2 Sisältää seuraavat: valtimo- ja laskimo-, kuolemaan johtaneet ja ei-fataalit tapahtumat, kuten syvä laskimotukos, keuhkoembolia, verkkokalvon tromboosi, valtimotromboosi (mukaan lukien sydäninfarkti), aivoverenkiertotapahtumat (mukaan lukien aivohalvaus ja aivoverenvuoto), ohimenevät aivoverenkiertohäiriöt ja sunttitromboosit (mukaan lukien dialyysilaitteet) ja AV-sunttianeurysmissa olevat tromboosit 3 Käsitellään alla olevassa alakohdassa ja/tai kohdassa Varoitukset ja käyttöön liittyvät varotoimet | ||
Valikoitujen haittavaikutusten kuvaus
Yliherkkyysreaktioita, mukaan lukien ihottumaa (myös urtikariaa), anafylaktisia reaktioita ja angioneuroottista turvotusta on ilmoitettu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epoetiinihoidon yhteydessä on ilmoitettu vakavia ihoon kohdistuvia haittavaikutuksia, mukaan lukien Stevens-Johnsonin oireyhtymää ja toksista epidermaalista nekrolyysiä, jotka voivat olla hengenvaarallisia tai kuolemaan johtavia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hypertensiivisiä kriisejä, joihin liittyy enkefalopatiaa muistuttavia oireita ja yleistyneitä kouristuskohtauksia, jotka vaativat välitöntä lääkärinhoitoa ja tehohoitoa, on myöskin ilmennyt epoetiini alfa -hoidon aikana potilailla, joilla oli aikaisemmin normaali tai alhainen verenpaine. Erityistä huomiota on kiinnitettävä äkillisiin migreeniä muistuttaviin viiltäviin päänsärkykohtauksiin mahdollisena varoitusmerkkinä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-ainevälitteistä puhdasta punasoluaplasiaa (PRCA) on raportoitu hyvin harvoin (< 1/10 000 tapausta potilasvuotta kohti) kuukausien tai vuosien epoetiini alfa -hoidon jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Ihonalaisen annostelun yhteydessä on raportoitu enemmän tapauksia kuin laskimonsisäisen annostelun yhteydessä.
Aikuispotilaat, joilla on matalan tai kohtalaisen 1-riskin MDS
Satunnaistetussa, kaksoissokkoutetussa lumelääkekontrolloidussa monikeskustutkimuksessa 4 (4,7 %) tutkittavaa sai tromboottisia verisuonitapahtumia (äkkikuolema, iskeeminen aivohalvaus, embolia ja flebiitti). Kaikki tromboottiset verisuonitapahtumat ilmenivät epoetiini alfa ‑ryhmässä ja tutkimuksen ensimmäisten 24 viikon aikana. Kolme tapausta vahvistettiin ja neljännessä (äkkikuolema) tromboembolista tapahtumaa ei vahvistettu. Kahdella tutkittavalla oli merkittäviä riskitekijöitä (eteisvärinää, sydämen vajaatoimintaa ja tromboflebiittiä).
Kroonista munuaisten vajaatoimintaa sairastavat, hemodialyysia saavat pediatriset potilaat
Kroonista munuaisten vajaatoimintaa sairastavien, hemodialyysia saavien lapsipotilaiden altistuminen kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä raporteissa on vähäistä. Tästä väestöryhmästä ei ole raportoitu mitään erityisesti lapsia koskevia haittavaikutuksia, joita ei olisi mainittu aiemmin edellä olevassa taulukossa, tai jotka eivät olisi yhdenmukaisia potilaan taustasairauden kanssa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Epoetiini alfan terapeuttinen alue on erittäin laaja. Epoetiini alfan yliannostus saattaa tuottaa vaikutuksia, jotka ovat hormonin korostuneita farmakologisia vaikutuksia. Flebotomia voidaan tehdä, jos potilaan hemoglobiinitasot ovat erityisen korkeat. Potilaalle tulee antaa tarvittaessa myös muuta supportiivista hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: anemialääkkeet, erytropoietiini, ATC-koodi: B03XA01
Binocrit on ns. biosimilaari lääkevalmiste. Yksityiskohtaisempaa tietoa on saatavilla Euroopan lääkeviraston verkkosivulta: http://www.ema.europa.eu .
Vaikutusmekanismi
Erytropoietiini (EPO) on glykoproteiinihormoni, jota muodostuu pääasiassa munuaisissa vasteena hypoksiaan. EPO on keskeinen säätelijä punasolujen tuotannossa. EPO osallistuu erytroidisen kehityksen kaikkiin vaiheisiin ja vaikuttaa eniten erytroidisiin kantasoluihin. Sitouduttuaan solun pintareseptoriin EPO aktivoi signaalitransduktioreittejä, jotka häiritsevät apoptoosia ja stimuloivat erytroidisten solujen proliferaatiota.
Kiinanhamsterin munasarjasoluissa yhdistelmä-DNA-tekniikalla tuotetussa ihmisen EPO:ssa (epoetiini alfassa) on 165 aminohapon sekvenssi, joka on identtinen ihmisen virtsan EPO:n aminohappoketjun kanssa; toiminnallisten määritysten perusteella näitä kahta ei pystytä erottamaan toisistaan. Erytropoietiinin näennäinen molekyylipaino on 32 000–40 000 daltonia.
Erytropoietiini on kasvutekijä, joka stimuloi ensisijaisesti punasolutuotantoa. Erytropoietiinireseptoreja voidaan todeta myös erilaisten kasvainsolujen pinnalla.
Farmakodynaamiset vaikutukset
Terveet vapaaehtoiset
Kun epoetiini alfaa oli annettu kerta-annoksina (20 000–160 000 IU ihon alle), tutkituille farmakodynaamisille merkkiaineille, joita olivat mm. retikulosyytit, punasolut ja hemoglobiini, havaittiin annosriippuvainen vaste. Selkeä pitoisuus-aika-profiili, johon sisältyi huippupitoisuus ja palautuminen lähtötasolle, havaittiin retikulosyyttien prosenttiosuuksien muutoksissa. Punasolujen ja hemoglobiinin profiili ei ollut yhtä selkeä. Yleisesti ottaen kaikki farmakodynaamiset merkkiaineet lisääntyivät lineaarisesti annoksen kanssa saavuttaen maksimivasteen suurimmilla annoksilla.
Farmakodynaamisissa lisätutkimuksissa tarkastelun kohteena oli 40 000 IU kerran viikossa vs. 150 IU/kg kolmesti viikossa. Pitoisuus-aika-profiileissa olevista eroista huolimatta farmakodynaaminen vaste (mitattuna retikulosyyttien, hemoglobiinin ja punasolujen kokonaismäärän prosenttiosuuden muutosten perusteella) oli samanlainen molemmissa tutkimusohjelmissa. Lisätutkimuksissa verrattiin ihon alle kerran viikossa annettua 40 000 IU:n epoetiini alfa -annosta joka toinen viikko annettuihin annoksiin, jotka vaihtelivat välillä 80 000–120 000 IU. Kaiken kaikkiaan näillä terveillä koehenkilöillä tehtyjen farmakodynaamisten tutkimusten tulosten perusteella se hoito-ohjelma, jossa annettiin kerran viikossa 40 000 IU, näyttää tuottavan punasoluja tehokkaammin kuin ohjelmat, jossa hoitoa annetaan joka toinen viikko, huolimatta näiden kahden hoito-ohjelman retikulosyyttien tuotannossa havaitusta samankaltaisuudesta.
Krooninen munuaisten vajaatoiminta
Epoetiini alfan on osoitettu stimuloivan erytropoieesia aneemisilla, kroonista munuaisten vajaatoimintaa sairastavilla potilailla, myös dialyysi- ja predialyysipotilailla. Ensimmäinen viite vasteesta epoetiini alfalle on retikulosyyttimäärän lisääntyminen 10 vuorokauden sisällä, mitä seuraa punasolu-, hemoglobiini ja hematokriittimäärien lisääntyminen yleensä 2–6 viikon sisällä. Hemoglobiinivaste vaihtelee potilaasta toiseen; siihen saattavat vaikuttaa rautavarastot ja muut samanaikaiset sairaudet.
Solunsalpaajahoidon aiheuttama anemia
Kolmesti viikossa tai kerran viikossa annetun epoetiini alfan on osoitettu lisäävän hemoglobiinia ja vähentävän verensiirron tarvetta ensimmäisen hoitokuukauden jälkeen aneemisilla, solunsalpaajahoitoa saavilla syöpäpotilailla.
Tutkimuksessa, jossa vertailtiin kahta hoito-ohjelmaa (150 IU/kg kolmesti viikossa ja 40 000 IU kerran viikossa) terveillä koehenkilöillä ja aneemisilla syöpäpotilailla, retikulosyyttien, hemoglobiinin sekä punasolujen kokonaismäärän prosenttiosuuksissa tapahtuneiden muutosten aikaprofiilit olivat molemmissa annostusohjelmissa samanlaisia sekä terveillä henkilöillä että aneemisilla syöpäpotilailla. Vastaavien farmakodynaamisten parametrien AUC-arvot olivat samanlaiset molemmissa annostusohjelmissa (150 IU/kg kolmesti viikossa ja 40 000 IU kerran viikossa) terveillä koehenkilöillä ja myös aneemisilla syöpäpotilailla.
Aikuiset leikkauspotilaat, joille siirretään luovutettua autologista verta
Epoetiini alfan on osoitettu stimuloivan punasolujen tuotantoa, jolloin autologisen veren keräystä voidaan lisätä, ja rajoittavan hemoglobiinin vähenemistä suureen elektiiviseen leikkaukseen menossa olevilla aikuispotilailla, joiden ei odoteta luovuttavan ennalta kaikkea sitä verta, jota he tulevat tarvitsemaan leikkauksen yhteydessä. Suurimmat vaikutukset havaitaan potilailla, joiden hemoglobiiniarvo on matala (≤ 13 g/dl, [≤ 130 g/l ]).
Hoito aikuispotilailla, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus
Potilailla, joille on suunniteltu suuri elektiivinen ortopedinen leikkaus ja joilla hemoglobiinipitoisuus ennen hoitoa on > 10 – ≤ 13 g/dl (> 100 – ≤ 130 g/l), epoetiini alfan on osoitettu pienentävän allogeenisten verensiirtojen saamisen riskiä ja jouduttavan erytroidista palautumista (suurentuneet hemoglobiinipitoisuudet, hematokriittipitoisuudet ja retikulosyyttimäärät).
Kliininen teho ja turvallisuus
Krooninen munuaisten vajaatoiminta
Epoetiini alfaa on tutkittu kliinisissä tutkimuksissa aneemisilla, kroonista munuaisten vajaatoimintaa sairastavilla aikuispotilailla, mukaan lukien hemodialyysi- ja predialyysipotilaat, anemian hoitamiseksi ja hematokriittipitoisuuden säilyttämiseksi tavoitevälillä 30–36 %.
Kliinisissä tutkimuksissa, joissa aloitusannokset olivat 50–150 IU/kg kolmesti viikossa, noin 95 prosentilla kaikista potilaista hematokriittipitoisuus lisääntyi kliinisesti merkittävästi. Noin kahden kuukauden hoidon jälkeen käytännössä kaikki potilaat olivat verensiirroista riippumattomia. Kun tavoitehematokriittiarvo oli saavutettu, jokaiselle potilaalle määritettiin ylläpitoannos yksilöllisesti.
Dialyysihoitoa saaneilla aikuispotilailla tehdyissä kolmessa laajimmassa tutkimuksessa mediaani ylläpitoannos, jota käytettäessä hematokriitti säilyi välillä 30–36 %, oli noin 75 IU/kg annettuna kolmesti viikossa.
Kaksoissokkoutetussa, lumekontrolloidussa monen keskuksen elämänlaatututkimuksessa, johon osallistui kroonista munuaisten vajaatoimintaa sairastavia, hemodialyysihoitoa saavia potilaita, havaittiin kliinisesti merkittävää ja tilastollisesti merkitsevää paranemista epoetiini alfa -hoitoa saaneilla potilailla verrattuna lumelääkeryhmään mitattaessa väsymystä, fyysisiä oireita, sosiaalisia suhteita ja masennusta (Kidney Disease Questionnaire) kuuden kuukauden kuluttua hoidosta. Epoetiini alfa -hoitoa saaneen ryhmän potilaita otettiin myös mukaan avoimeen jatkotutkimukseen, jossa osoitettiin heidän elämänlaadussaan paranemista, joka säilyi seuraavien 12 kuukauden ajan.
Munuaisten vajaatoimintaa sairastavat aikuispotilaat, jotka eivät vielä saa dialyysihoitoa
Epoetiini alfa -hoitoa saavilla, kroonista munuaisten vajaatoimintaa sairastavilla potilailla, jotka eivät vielä saaneet dialyysihoitoa, tehdyissä kliinisissä tutkimuksissa hoito kesti keskimäärin lähes viisi kuukautta. Nämä potilaat reagoivat epoetiini alfa -hoitoon havaintojen mukaan samalla tavalla kuin dialyysipotilaat. Kroonista munuaisten vajaatoimintaa sairastavilla potilailla, jotka eivät vielä saaneet dialyysihoitoa, ilmeni hematokriitin annosriippuvaista ja pysyvää lisääntymistä, kun epoetiini alfaa annettiin joko laskimoon tai ihon alle. Samanlaisia hematokriitin nousun määriä havaittiin annettaessa epoetiini alfaa kumpaa tahansa reittiä. Lisäksi on osoitettu, että kerran viikossa annetut 75–150 IU/kg:n epoetiini alfa -annokset säilyttävät hematokriittipitoisuuden välillä 36–38 % ainakin kuusi kuukautta.
Kahdessa tutkimuksessa, jossa tutkittiin pidennetyin välein annosteltua epoetiini alfaa (anto kolmesti viikossa, kerran viikossa, joka toinen viikko ja kerran neljässä viikossa), joillakin pitemmän annosvälin potilailla riittävät hemoglobiinipitoisuudet eivät säilyneet ja he saavuttivat tutkimussuunnitelmassa hemoglobiinille määritellyn tutkimuksen lopettamisen kriteerit (0 % valmistetta kerran viikossa saaneiden ryhmästä, 3,7 % valmistetta joka toinen viikko saaneiden ryhmästä ja 3,3 % valmistetta kerran neljässä viikossa saaneiden ryhmästä).
Eräässä satunnaistetussa prospektiivisessa tutkimuksessa arvioitiin 1 432 aneemista, kroonista munuaisten vajaatoimintaa sairastavaa potilasta, jotka eivät saaneet dialyysihoitoa. Potilaille määrättiin epoetiini alfa -hoitoa, jonka tavoitteena oli ylläpitää hemoglobiini tasolla 13,5 g/dl (135 g/l) (korkeampi kuin suositeltu hemoglobiinipitoisuus) tai 11,3 g/dl (113 g/l). Suuri sydän- tai verisuonitapahtuma (kuolema, sydäninfarkti, aivohalvaus tai sairaalahoitoon joutuminen kongestiivisen sydämen vajaatoiminnan vuoksi) ilmeni 125:lla (18 %:lla) niistä 715 potilaasta, jotka olivat korkeamman hemoglobiinin ryhmässä, kun matalamman hemoglobiinin ryhmässä vastaava tapahtuma ilmeni 97:lla (14 %:lla) potilaalla 717 potilaasta (riskisuhde [HR] 1,3; 95 % CI: 1,0; 1,7, p = 0,03).
Kroonista munuaisten vajaatoimintaa sairastavilla potilailla (potilaat, jotka ovat dialyysihoidossa, jotka eivät ole dialyysihoidossa, diabeetikot ja ei-diabeetikot) on tehty ESA-aineiden kliinisten tutkimusten yhdistettyjä post-hoc-analyysejä. Niissä havaittiin, että kaikista syistä johtuvan kuolleisuuden, kardiovaskulaaristen tapahtumien ja aivoverisuonitapahtumien, joihin liittyivät suuremmat kumulatiiviset ESA-aineiden annokset, riskiestimaatit osoittivat lisääntyvää suuntausta riippumatta siitä, sairastiko potilas diabetesta tai saiko hän dialyysihoitoa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Solunsalpaajahoidon aiheuttamaa anemiaa sairastavien potilaiden hoito
Epoetiini alfaa on tutkittu kliinisissä tutkimuksissa aikuisilla aneemisilla syöpäpotilailla, joilla on lymfaattisia ja kiinteitä kasvaimia, ja potilailla, jotka saavat erilaisia solunsalpaajahoitoja, mukaan lukien platinapohjaiset ja muut kuin platinapohjaiset hoidot. Näissä tutkimuksissa kolmesti viikossa ja kerran viikossa annetun epoetiini alfan on osoitettu lisäävän hemoglobiinia ja vähentävän verensiirron tarvetta ensimmäisen hoitokuukauden jälkeen aneemisilla syöpäpotilailla. Joissakin tutkimuksissa kaksoissokkoutettua vaihetta seurasi avoin vaihe, jonka aikana kaikki potilaat saivat epoetiini alfaa ja vaikutuksen pysyvyyttä havainnoitiin.
Saatavissa oleva näyttö viittaa siihen, että potilaat, joilla on hematologisia maligniteetteja ja kiinteitä kasvaimia, vastaavat samalla tavalla epoetiini alfa -hoitoon, ja että potilaat, joilla on tai ei ole kasvaininfiltraatteja luuytimessä, vastaavat samalla tavalla epoetiini alfa -hoitoon. Osoituksena solunsalpaajahoidon vertailukelpoisesta voimakkuudesta epoetiini alfa -ja lumelääkeryhmissä solunsalpaajahoidon tutkimuksissa oli samanlainen alue neutrofiilien aikakäyrän alapuolella epoetiini alfa -hoitoa saaneilla ja lumelääkehoitoa saaneilla potilailla, samoin kuin niiden potilaiden, joiden neutrofiilien absoluuttinen määrä oli alle 1 000–500 solua/µl, samanlainen osuus epoetiini alfa -hoitoa saaneiden ryhmissä ja lumelääkettä saaneiden ryhmissä.
Prospektiivisessa satunnaistetussa lumelääkekontrolloidussa kaksoissokkotutkimuksessa, johon osallistui 375 anemiapotilasta, joilla oli erilaisia ei-myeloidisia kasvaimia ja jotka saivat muuta kuin platinapohjaista solunsalpaajahoitoa, nähtiin merkittävä lasku anemiaan liittyvien jälkitilojen (esim. väsymys, alhainen energia- ja aktiivisuustaso) esiintyvyydessä seuraavilla mittareilla ja asteikoilla mitattuna: Functional Assessment of Cancer Therapy-Anemia (FACT‑An) -yleisasteikko, FACT‑An‑väsymysasteikko ja Cancer Linear Analogue Scale (CLAS) -asteikko. Kahdessa muussa pienemmässä satunnaistetussa lumelääkekontrolloidussa tutkimuksessa ei voitu osoittaa merkittävää paranemista elämänlaatuparametreissa EORTC‑QLQ‑C30 -asteikolla eikä CLAS-asteikolla.
Elinaikaa ja kasvaimen etenemistä on tutkittu viidessä laajassa kontrolloidussa tutkimuksessa, joihin osallistui yhteensä 2 833 potilasta. Tutkimuksista neljä oli kaksoissokkoutettuja lumelääkekontrolloituja tutkimuksia ja yksi oli avoin tutkimus. Tutkimuksiin joko otettiin potilaita, joita hoidettiin solunsalpaajilla (kaksi tutkimusta), tai niissä tutkittiin potilasryhmiä, joissa ESA-aineet eivät ole indikoituja: anemiaa sairastavat syöpäpotilaat, jotka eivät saa solunsalpaajahoitoa, ja pään ja kaulan alueen syöpää sairastavat potilaat, jotka saavat sädehoitoa. Kahdessa tutkimuksessa hemoglobiinipitoisuuden toivottu taso oli > 13 g/dl (130 g/l, 8,1 mmol/l). Kolmessa muussa tutkimuksessa se oli 12–14 g/dl (120–140 g/l, 7,5–8,7 mmol/l). Avoimessa tutkimuksessa ei todettu eroa kokonaiselinajassa ihmisen yhdistelmä-DNA-tekniikalla valmistetulla erytropoietiinilla hoidettujen potilaiden ja vertailuryhmän potilaiden välillä. Neljässä lumelääkekontrolloidussa tutkimuksessa kokonaiselinajan riskisuhteet sijoittuivat välille 1,25–2,47 vertailuryhmän potilaiden eduksi. Näissä tutkimuksissa on todettu yhdenmukainen selittämätön tilastollisesti merkitsevä kuolleisuuden lisääntyminen erilaisiin yleisiin syöpätauteihin liittyvää anemiaa sairastavilla ja ihmisen yhdistelmä-DNA-tekniikalla valmistettua erytropoietiinia saaneilla potilailla vertailuryhmän potilaisiin verrattuna. Tutkimusten kokonaiselinaikaa koskevaa tulosta ei voitu tyydyttävästi selittää eroavaisuuksilla tromboosin ja siihen liittyvien komplikaatioiden esiintyvyydessä ihmisen yhdistelmä-DNA-tekniikalla valmistettua erytropoietiinia saaneilla potilailla ja vertailuryhmän potilailla.
Lisäksi on tehty potilastason data-analyysi 53 kontrolloituun kliiniseen tutkimukseen, joissa tutkittiin useita epoteiineja, osallistuneista yli 13 900 syöpäpotilaasta (solunsalpaajahoito, sädehoito, kemosädehoito tai ei hoitoa). Kokonaiselinaikatietojen meta-analyysilla riskisuhteen pistearvioksi saatiin 1,06 verrokkien eduksi (95 % CI: 1,00, 1,12; 53 tutkimusta ja 13 933 potilasta) ja solunsalpaajahoitoa saavien syöpäpotilaiden osalta kokonaiselinajan riskisuhde oli 1,04 (95 % CI: 0,97, 1,11; 38 tutkimusta ja 10 441 potilasta). Meta-analyysit osoittavat poikkeuksetta myös tromboembolisten tapahtumien merkittävästi suurentunutta suhteellista riskiä yhdistelmä-DNA-tekniikalla valmistettua erytropoietiinia saavilla syöpäpotilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Satunnaistettuun, avoimeen monikeskustutkimukseen osallistui 2 098 metastasoitunutta rintasyöpää sairastavaa aneemista naista, jotka saivat ensilinjan tai toisen linjan solunsalpaajahoitoa. Kyseessä oli non-inferiority-tutkimus, jossa oli tarkoitus sulkea pois kasvaimen etenemisen tai kuoleman riskin lisääntyminen 15 %:lla annettaessa epoetiini alfaa ja tavanomaista hoitoa verrattuna pelkkään tavanomaiseen hoitoon. Kliinisen arviointiaikapisteen kohdalla tutkijoiden arvioima etenemisvapaan elinajan (PFS) mediaani oli 7,4 kuukautta kummassakin tutkimushaarassa (HR 1,09; 95 % CI: 0,99; 1,20), mikä osoitti, ettei tutkimuksen tavoitetta saavutettu. Epoetiini alfaa ja tavanomaista hoitoa saaneiden tutkimushaarassa tehtiin punasolujen siirtoja merkittävästi pienemmälle määrälle potilaita (5,8 % vs. 11,4 %). Epoetiini alfaa ja tavanomaista hoitoa saaneiden tutkimushaarassa tromboottisia vaskulaarisia tapahtumia esiintyi kuitenkin merkittävästi suuremmalla määrällä potilaita (2,8 % vs. 1,4 %). Lopullisessa analyysissa raportoitiin 1 653 kuolemaa. Eloonjäämisajan mediaani epoetiini alfaa ja tavanomaista hoitoa saaneiden ryhmässä oli 17,8 kuukautta verrattuna 18,0 kuukauteen pelkkää tavanomaista hoitoa saaneiden ryhmässä (HR 1,07; 95 % CI: 0,97; 1,18). Tutkijan määrittämään etenevään tautiin (PD) perustuva taudin etenemiseen kuluvan ajan (TTP) mediaani epoetiini alfaa ja tavanomaista hoitoa saaneiden ryhmässä oli 7,5 kuukautta ja tavanomaista hoitoa saaneiden ryhmässä 7,5 kuukautta (HR 1,099, 95 % CI: 0,998, 1,210). Riippumattoman arviointikomitean (IRC) määrittämään etenevään tautiin perustuva taudin etenemiseen kuluvan ajan mediaani epoetiini alfaa ja tavanomaista hoitoa saaneiden ryhmässä oli 8,0 kuukautta ja tavanomaista hoitoa saaneiden ryhmässä 8,3 kuukautta (HR 1,033, 95 % CI: 0,924, 1,156).
Luovutetun autologisen veren siirto-ohjelma
Epoetiini alfan vaikutusta autologisen verenluovutuksen helpottamiseen potilailla, joilla hematokriittiarvot ovat matalia (≤ 39 % eikä taustalla ole raudanpuutteesta johtuvaa anemiaa) ja jotka odottavat pääsyä suunniteltuun suureen ortopediseen leikkaukseen, arvioitiin kaksoissokkoutetussa lumelääkekontrolloidussa tutkimuksessa, johon osallistui 204 potilasta, ja yksöissokkoutetussa lumekontrolloidussa tutkimuksessa, johon osallistui 55 potilasta.
Kaksoissokkotutkimuksessa potilaat saivat epoetiini alfa 600 IU/kg -hoitoa tai lumelääkettä laskimoon kerran vuorokaudessa 3–4 päivän välein kolmen viikon ajan (kaikkiaan 6 annosta). Keskimäärin epoetiini alfalla hoidetuilta potilailta pystyttiin keräämään ennalta talteen merkitsevästi useampia yksikköjä verta (4,5 yksikköä) kuin lumelääkkeellä hoidetuilta potilailta (3,0 yksikköä).
Yksöissokkotutkimuksessa potilaat saivat epoetiini alfa 300 IU/kg- tai 600 IU/kg -hoitoa tai lumelääkettä laskimoon kerran vuorokaudessa 3–4 päivän välein kolmen viikon ajan (kaikkiaan 6 annosta). Epoetiini alfa -hoitoa saaneilta potilailta pystyttiin myös keräämään ennalta talteen merkitsevästi useampia yksikköjä verta (epoetiini alfa 300 IU/kg = 4,4 yksikköä; epoetiini alfa 600 IU/kg = 4,7 yksikköä) kuin lumelääkkeellä hoidetuilta potilailta (2,9 yksikköä).
Epoetiini alfa -hoito vähensi allogeeniselle verelle altistumisen riskiä 50 % verrattuna potilaisiin, jotka eivät saaneet epoetiini alfaa.
Suuri elektiivinen ortopedinen leikkaus
Epoetiini alfan (300 IU/kg tai 100 IU/kg) vaikutusta allogeenisiin verensiirtoihin altistumiselle on arvioitu lumelääkekontrolloidussa kaksoissokkoutetussa kliinisessä tutkimuksessa aikuisilla potilailla, joilla ei ollut raudanpuutetta ja jotka olivat menossa suureen suunniteltuun elektiiviseen ortopediseen lonkka- tai polvileikkaukseen. Epoetiini alfaa annettiin ihon alle 10 vuorokauden ajan ennen leikkausta, leikkauspäivänä ja neljän päivän ajan leikkauksen jälkeen. Potilaat stratifioitiin lähtötilanteen hemoglobiiniarvon mukaan (≤ 10 g/dl, > 10 – ≤ 13 g/dl ja > 13 g/dl [(≤ 100 g/l, > 100 – ≤ 130 g/l ja > 130 g/l]).
Epoetiini alfa 300 IU/kg vähensi merkitsevästi allogeenisen verensiirron riskiä potilailla, joiden hemoglobiini oli ennen hoitoa ollut > 10 – ≤ 13 g/dl (> 100 – ≤ 130 g/l). Kuusitoista prosenttia epoetiini alfa 300 IU/kg:aa saaneista, 23 % epoetiini alfa 100 IU/kg:aa saaneista ja 45 % lumelääkettä saaneista potilaista tarvitsi verensiirtoa.
Aikuisilla koehenkilöillä, joilla ei ollut raudanpuutosta, joiden hemoglobiiniarvo ennen hoitoa oli ≥ 10 – ≤ 13 g/dl (≥ 100 – ≤ 130 g/l) ja joille oli suunniteltu suuri ortopedinen lonkka- tai polvileikkaus, tehdyssä avoimessa rinnakkaisryhmätutkimuksessa verrattiin epoetiini alfa 300 IU/kg -hoitoa, jota annettiin ihon alle päivittäin 10 vuorokauden ajan ennen leikkausta, leikkauspäivänä ja neljänä päivänä leikkauksen jälkeen, epoetiini alfa 600 IU/kg -hoitoon, jota annettiin ihon alle kerran viikossa 3 viikon ajan ennen leikkausta ja leikkauspäivänä.
Hoitoa edeltävän ajankohdan ja leikkausta edeltävän ajankohdan välisenä aikana hemoglobiini lisääntyi keskimäärin kaksinkertaisesti ryhmässä, joka sai 600 IU/kg (1,44 g/dl [14,4 g/l]) viikottain verrattuna päivittäin 300 IU/kg (0,73 g/dl [7,3 g/l]) saaneiden ryhmässä havaittuun lisääntymiseen. Keskimääräiset hemoglobiinitasot olivat samanlaiset molemmissa hoitoryhmissä koko leikkauksen jälkeisen jakson ajan.
Molemmissa hoitoryhmissä havaittu erytropoieettinen vaste johti samanlaisiin verensiirron osuuksiin (16 % ryhmässä, joka sai 600 IU/kg viikottain ja 20 % ryhmässä, joka sai 300 IU/kg päivittäin).
Aikuispotilaiden hoito, kun potilaalla on matalan tai kohtalaisen 1-riskin MDS
Satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa monikeskustutkimuksessa arvioitiin epoetiini alfan tehoa ja turvallisuutta aikuisilla aneemisilla tutkittavilla, joilla oli matalan tai kohtalaisen 1-riskin MDS.
Tutkittavat jaettiin ryhmiin seerumin erytropoietiinitason (sEPO) ja aiempien verensiirtojen perusteella seulonnan yhteydessä. Tärkeimmät lähtötilanteen ominaisuudet < 200 mU/ml:n ryhmästä on esitetty seuraavassa taulukossa.
Niiden tutkittavien lähtötilanteen ominaisuudet, joilla sEPO oli < 200 mU/ml seulonnassa

a yhdestä tutkittavasta ei ollut sEPO-tietoja
b ≥ 200 mU/ml:n ryhmässä oli 13 tutkittavaa epoetiini alfa ‑ryhmässä ja 6 tutkittavaa lumelääkeryhmässä
Erytroidivaste määritettiin International Working Groupin (IWG) vuoden 2006 kriteerien mukaisesti hemoglobiiniarvon nousuksi ≥ 1,5 g/dl lähtötilanteesta tai verensiirtona annettujen punasoluyksiköiden absoluuttisen määrän pienenemiseksi vähintään 4 yksiköllä 8 viikon välein verrattuna 8 viikkoon ennen lähtötilannetta sekä vähintään 8 viikkoa kestäväksi vasteeksi.
Erytroidivaste tutkimuksen ensimmäisten 24 viikon aikana osoitettiin 27:llä 85:stä (31,8 %) tutkittavasta epoetiini alfa ‑ryhmässä verrattuna lumelääkeryhmän kahteen 45:stä (4,4 %) tutkittavasta (p < 0,001). Kaikki hoitoon vastanneet tutkittavat olivat ryhmässä, jossa seulontavaiheen sEPO oli < 200 mU/ml. Kyseisessä ryhmässä 20:llä 40:stä (50 %) tutkittavasta, jotka eivät olleet aiemmin saaneet verensiirtoja, ilmeni erytroidivaste ensimmäisten 24 viikon aikana verrattuna seitsemään 31:stä (22,6 %) tutkittavasta, jotka olivat saaneet verensiirtoja aiemmin (kaksi tutkittavaa, jotka olivat aiemmin saaneet verensiirtoja, saavutti ensisijaisen päätetapahtuman eli annettujen punasoluyksiköiden määrän pienenemisen neljällä yksiköllä 8 viikon välein verrattuna 8 viikkoon ennen lähtötilannetta).
Mediaaniaika lähtötilanteesta ensimmäiseen verensiirtoon oli tilastollisesti merkitsevästi pidempi epoetiini alfa ‑ryhmässä verrattuna lumelääkkeeseen (49 vs. 37 vuorokautta; p = 0,046). Neljän viikon hoidon jälkeen aika ensimmäiseen verensiirtoon piteni entisestään epoetiini alfa ‑ryhmässä (142 vs. 50 vuorokautta; p = 0,007). Niiden tutkittavien prosenttiosuus, jotka saivat verensiirron epoetiini alfa ‑ryhmässä, pieneni 51,8 %:sta 8 viikon aikana ennen lähtötilannetta 24,7 %:iin viikkojen 16–24 aikana verrattuna lumelääkeryhmään, jossa verensiirtoaste suureni 48,9 %:sta 54,1 %:iin samalla ajanjaksolla.
Pediatriset potilaat
Krooninen munuaisten vajaatoiminta
Epoetiini alfaa arvioitiin avoimessa, ei-satunnaistetussa 52 viikkoa kestäneessä avoimen annosvälin kliinisessä tutkimuksessa, johon otettiin kroonista munuaisten vajaatoimintaa sairastavia ja dialyysihoitoa saavia pediatrisia potilaita. Tutkimukseen osallistuneiden potilaiden keski-ikä oli 11,6 vuotta (vaihteluväli 0,5–20,1 vuotta).
Epoetiini alfaa annettiin 75 IU/kg/viikko laskimoon jaettuna 2 tai 3 annokseen dialyysin jälkeen, titrattuna annoksella 75 IU/kg/viikko 4 viikon välein (siten, että annos oli korkeintaan 300 IU/kg/viikko). Tavoitteena oli nostaa hemoglobiinipitoisuutta 1 g/dl/kk (10 g/l/kk). Toivottu hemoglobiinipitoisuuden vaihteluväli oli 9,6–11,2 g/dl (96–112 g/l). Potilaista 81 % saavutti tämän hemoglobiinipitoisuuden tason. Mediaaniaika tavoitteeseen oli 11 viikkoa ja mediaaniannos tavoitteessa oli 150 IU/kg/viikko. Tavoitteen saavuttaneista potilaista 90 % pääsi tavoitteeseen kolmesti viikossa -annostusohjelmaa käyttäen.
52 viikon jälkeen 57 % potilaista jatkoi tutkimuksessa ja heidän saamansa mediaaniannos oli 200 IU/kg/viikko.
Kliinisiä tietoja tutkimuksista, joissa valmistetta on annettu lapsille ihon alle, on vain vähän. 5 pienessä, avoimessa, kontrolloimattomassa tutkimuksessa (potilaiden lukumäärä vaihteli välillä 9–22 potilasta, kokonaismäärä N = 72) epoetiini alfaa on annettu ihon alle lapsille aloitusannoksilla 100–150 IU/kg/viikko ja annosta on voitu nostaa enintään annokseen 300 IU/kg/viikko. Näissä tutkimuksissa useimmat olivat predialyysipotilaita (N = 44), 27 potilasta sai peritoneaalidialyysia ja 2 sai hemodialyysia ja potilaiden ikä vaihteli 4 kuukaudesta 17 vuoteen. Kaiken kaikkiaan näissä tutkimuksissa on tutkimusmenetelmiä koskevia puutteita, mutta hoidon katsottiin olevan yhteydessä korkeampiin hemoglobiinipitoisuuksiin. Odottamattomista haittavaikutuksista ei raportoitu (ks. kohta Annostus ja antotapa).
Solunsalpaajahoidon aiheuttama anemia
Epoetiini alfaa 600 IU/kg (annettuna laskimoon tai ihon alle kerran viikossa) on arvioitu satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, 16 viikkoa kestäneessä tutkimuksessa ja satunnaistetussa, kontrolloidussa, avoimessa, 20 viikkoa kestäneessä tutkimuksessa aneemisilla lapsipotilailla, jotka saivat myelosuppressiivista solunsalpaajahoitoa lasten erilaisiin ei-myelooisiin maligniteetteihin.
16 viikkoa kestäneessä tutkimuksessa (n = 222) epoetiini alfalla hoidetuilla potilailla ei havaittu tilastollisesti merkitsevää vaikutusta potilaiden raportoimiin tai vanhempien raportoimiin, lasten elämänlaatuasteikon (Paediatric Quality of Life Inventory) tai syöpämoduulin mukaisiin pistemääriin verrattuna lumeeseen (ensisijainen tehokkuuteen liittyvä päätetapahtuma). Punasolusiirtoja tarvinneiden potilaiden osuuksien välillä ei ollut myöskään tilastollista eroa epoetiini alfa -ryhmän ja lumeryhmän välillä.
20 viikkoa kestäneessä tutkimuksessa (n = 225) ei havaittu merkittävää eroa ensisijaisessa tehon päätetapahtumassa, ts. niiden potilaiden osuudessa, jotka tarvitsivat punasolusiirron päivän 28 jälkeen (62 % epoetiini alfaa saaneista potilaista vs. 69 % tavanomaista hoitoa saaneista potilaista).
Farmakokinetiikka
Imeytyminen
Ihonalaisesti annetun injektion jälkeen epoetiini alfa saavuttaa huippupitoisuuden seerumissa 12–18 tunnin kuluttua annoksen antamisesta. Kertymistä ei havaittu sen jälkeen, kun 600 IU/kg:n toistuvia annoksia annettiin ihon alle viikottain.
Ihonalaisesti pistetyn epoetiini alfan absoluuttinen hyötyosuus on noin 20 % terveillä koehenkilöillä.
Jakautuminen
Laskimoon annettujen 50 ja 100 IU/kg:n annosten jälkeen keskimääräinen jakautumistilavuus terveillä koehenkilöillä oli 49,3 ml/kg. Sen jälkeen, kun epoetiini alfaa oli annettu laskimoon kroonista munuaisten vajaatoimintaa sairastavilla potilailla, jakautumistilavuus oli kerta-annoksen jälkeen 57–107 ml/kg (12 IU/kg) ja toistuvan annostelun jälkeen vastaavasti 42–64 ml/kg (48–192 IU/kg). Näin ollen jakautumistilavuus on hieman suurempi kuin plasman tila.
Eliminaatio
Epoetiini alfan puoliintumisaika toistuvassa laskimonsisäisessä annostelussa on noin 4 tuntia terveillä koehenkilöillä.
Ihonalaisessa annostelussa puoliintumisajan arvellaan olevan noin 24 tuntia terveillä koehenkilöillä.
Terveillä koehenkilöillä keskimääräinen puhdistuma/biologinen hyötyosuus (CL/F) annettaessa 150 IU/kg kolme kertaa viikossa oli 31,2 ml/h/kg ja annettaessa 40 000 IU kerran viikossa vastaavasti 12,6 ml/h/kg. Aneemisilla syöpäpotilailla keskimääräinen puhdistuma/biologinen hyötyosuus (CL/F) annettaessa 150 IU/kg kolme kertaa viikossa oli 45,8 ml/h/kg ja annettaessa 40 000 IU kerran viikossa vastaavasti 11,3 ml/h/kg. Useimmilla aneemisilla syöpäpotilailla, jotka saivat jaksottaista solunsalpaajahoitoa, CL/F oli alhaisempi ihon alle kerran viikossa annettujen 40 000 IU -annosten ja kolmesti viikossa annettujen 150 IU/kg-annosten jälkeen verrattuna terveiden koehenkilöiden arvoihin.
Lineaarisuus/ei-lineaarisuus
Terveillä koehenkilöillä havaittiin epoetiini alfan pitoisuuksien nousua seerumissa suhteessa annokseen sen jälkeen, kun heille oli annettu 150 ja 300 IU/kg kolmesti viikossa. Kun epoetiini alfaa annettiin ihon alle 300–2 400 IU/kg kerta-annoksina, seurauksena oli lineaarinen suhde keskimääräisen Cmax-arvon ja annoksen sekä keskimääräisen AUC-arvon ja annoksen välillä. Terveillä koehenkilöillä havaittiin käänteinen suhde näennäisen puhdistuman ja annoksen välillä.
Tutkimuksissa, joissa tarkasteltiin annosvälin pidentämistä (40 000 IU kerran viikossa ja 80 000, 100 000 ja 120 000 IU joka toinen viikko) havaittiin lineaarinen mutta annoksesta riippumaton suhde keskimääräisen Cmax-arvon ja annoksen välillä sekä keskimääräisen AUC-arvon ja annoksen välillä vakaassa tilassa.
Farmakokineettiset/farmakodynaamiset suhteet
Epoetiini alfalla on annosriippuvainen mutta antoreitistä riippumaton vaikutus hematologisiin parametreihin.
Pediatriset potilaat
Noin 6,2–8,7 tunnin puoliintumisaikoja on ilmoitettu kroonista munuaisten vajaatoimintaa sairastavilla pediatrisilla potilailla sen jälkeen kun epoetiini alfaa on annettu laskimoon toistuvina annoksina. Epoetiini alfan farmakokineettinen profiili lapsilla ja nuorilla vaikuttaa olevan samankaltainen kuin aikuisilla.
Farmakokineettisiä tietoja vastasyntyneistä on vain vähän.
Seitsemällä ennenaikaisesti syntyneellä vastasyntyneellä, joiden syntymäpaino oli hyvin alhainen, ja 10 terveellä aikuisella tehty tutkimus, jossa tutkittaville annettiin erytropoietiinia laskimoon, viittasi siihen, että jakaantumistilavuus oli noin 1,5–2-kertaa suurempi ennenaikaisesti syntyneillä vastasyntyneillä kuin terveillä aikuisilla ja puhdistuma oli noin kolme kertaa suurempi ennenaikaisesti syntyneillä vastasyntyneillä kuin terveillä aikuisilla.
Munuaisten vajaatoiminta
Kroonista munuaisten vajaatoimintaa sairastavilla potilailla laskimoon annetun epoetiini alfan puoliintumisaika on 5 tuntia eli se on hieman pidentynyt verrattuna terveisiin koehenkilöihin.
Prekliiniset tiedot turvallisuudesta
Koirilla ja rotilla, muttei apinoilla, tehdyissä toistuvan annoksen toksisuustutkimuksissa epoetiini alfa -hoitoon liittyi subkliinistä luuydinfibroosia. Luuydinfibroosi on kroonisen munuaisten vajaatoiminnan tunnettu komplikaatio ihmisellä ja saattaa liittyä sekundaariseen lisäkilpirauhasten liikatoimintaan tai tuntemattomiin tekijöihin. Luuydinfibroosin esiintyvyys ei lisääntynyt tutkimuksessa, jossa hemodialyysipotilaita hoidettiin epoetiini alfalla kolme vuotta verrattuna vakioituun dialyysipotilaiden verrokkiryhmään, joita ei hoidettu epoetiini alfalla.
Epoetiini alfa ei aiheuta geenimutaatioita bakteerisoluissa (Amesin testi), kromosomipoikkeavuuksia nisäkässoluissa, mikrotumien ilmaantumista hiirellä eikä geenimutaatioita HGPRT:n lokuksessa.
Pitkäkestoisia karsinogeenisuustutkimuksia ei ole tehty. Kirjallisuuden ristiriitaiset raportit, jotka perustuvat ihmisen kasvainnäytteistä saatuihin in vitro -löydöksiin, viittaavat siihen, että erytropoietiineilla saattaa olla kasvainten kasvua edistäviä vaikutuksia. Näiden merkitys kliiniseltä kannalta ei ole selvä.
Ihmisen luuydinsoluviljelmissä epoetiini alfa stimuloi erytropoieesia spesifisesti eikä vaikuta leukopoieesiin. Epoetiini alfalla ei havaittu sytotoksisia vaikutuksia luuydinsoluihin.
Koe-eläintutkimuksissa epoetiini alfan on osoitettu alentavan sikiön ruumiinpainoa, hidastavan luutumista ja lisäävän sikiökuolleisuutta noin 20-kertaisina viikkoannoksina verrattuna ihmiselle suositeltavaan viikkoannokseen. Näiden muutosten katsotaan olevan sekundaarisia äidin painon nousun vähenemiselle ja terapeuttisten annosten tasot huomioon ottaen niiden merkitystä ihmisen kannalta ei tiedetä.
Farmaseuttiset tiedot
Apuaineet
Natriumdivetyfosfaattidihydraatti
Dinatriumfosfaattidihydraatti
Natriumkloridi
Glysiini
Polysorbaatti 80
Injektionesteisiin käytettävä vesi
Kloorivetyhappo (pH:n säätöön)
Natriumhydroksidi (pH:n säätöön)
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Säilytys
Säilytä ja kuljeta kylmässä (2 °C–8 °C). Tätä lämpötilaväliä on noudatettava, kunnes lääke annetaan.
Avohoitokäytössä valmiste voidaan ottaa jääkaapista enintään kolmen vuorokauden ajaksi, kunhan sitä ei enää laiteta takaisin eikä säilytetä yli 25 °C:n lämpötilassa. Jos lääkettä ei tämän jakson loppuun mennessä ole käytetty, se on hävitettävä.
Ei saa jäätyä. Älä ravista.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BINOCRIT injektioneste, liuos, esitäytetty ruisku
1000 IU/0,5 ml (L:ei) 6 x 0,5 ml (neulansuojus) (50,62 €)
3000 IU/0,3 ml (L:ei) 6 x 0,3 ml (neulansuojus) (142,57 €)
4000 IU/0,4 ml (L:ei) 6 x 0,4 ml (neulansuojus) (169,64 €)
5000 IU/0,5 ml (L:ei) 6 x 0,5 ml (neulansuojus) (227,83 €)
6000 IU/0,6 ml (L:ei) 6 x 0,6 ml (neulansuojus) (175,97 €)
8000 IU/0,8 ml (L:ei) 6 x 0,8 ml (neulansuojus) (337,89 €)
20000 IU/0,5 ml (L:ei) 0,5 ml (neulansuojus) (126,81 €)
30000 IU/0,75 ml (L:ei) 0,75 ml (neulansuojus) (159,52 €)
2000 IU/ml (L:ei) 6 x 1 ml (neulansuojus) (92,98 €)
10000 IU/ml (L:ei) 6 x 1 ml (neulansuojus) (305,00 €)
40000 IU/ml (L:ei) 1 ml (neulansuojus) (189,88 €)
PF-selosteen tieto
Esitäytetyissä ruiskuissa (lasia, tyyppi I), neulansuojuksella varustettuna tai ilman, joissa on männän tulppa (teflonoitua kumia) ja jotka on pakattu läpipainopakkaukseen.
Binocrit 1 000 IU/0,5 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,5 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 2 000 IU/1 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 1 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 3 000 IU/0,3 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,3 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 4 000 IU/0,4 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,4 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 5 000 IU/0,5 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,5 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 6 000 IU/0,6 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,6 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 7 000 IU/0,7 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,7 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 8 000 IU/0,8 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,8 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 9 000 IU/0,9 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,9 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 10 000 IU/1 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 1 ml liuosta.
Pakkauskoot: 1 tai 6 ruiskua.
Binocrit 20 000 IU/0,5 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,5 ml liuosta.
Pakkauskoot: 1, 4 tai 6 ruiskua.
Binocrit 30 000 IU/0,75 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 0,75 ml liuosta.
Pakkauskoot: 1, 4 tai 6 ruiskua.
Binocrit 40 000 IU/1 ml injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 1 ml liuosta.
Pakkauskoot: 1, 4 tai 6 ruiskua.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön liuos
Käyttö- ja käsittelyohjeet
Binocrit-valmistetta ei pidä käyttää ja se on hävitettävä
- jos neste on värjäytynyt tai siinä näkyy kelluvia hiukkasia
- jos sinetti on rikki
- jos tiedät tai epäilet sen vahingossa jäätyneen tai
- jos jääkaapissa on ollut toimintahäiriö.
Esitäytetyt ruiskut ovat käyttövalmiit (ks. kohta Annostus ja antotapa). Esitäytettyä ruiskua ei saa ravistaa. Ruiskuissa on kohomerkityt asteikkorenkaat, jotta osittainen käyttö on tarvittaessa mahdollista. Jokainen asteikkorengas vastaa 0,1 ml tilavuutta. Valmiste on tarkoitettu vain yhtä käyttökertaa varten. Jokaisesta ruiskusta otetaan ainoastaan yksi Binocrit-annos, ja jäljelle jäänyt liuos hävitetään ennen injektiota.
Neulansuojuksella varustetun esitäytetyn ruiskun käyttäminen
Neulansuojus suojaa neulan injektion jälkeen ja estää neulanpistot. Tämä ei vaikuta ruiskun normaaliin toimintaan. Paina mäntää hitaasti ja tasaisesti, kunnes koko annos on annettu eikä mäntä enää painu edemmäs. Pidä mäntää painettuna ja poista ruisku potilaasta. Neulansuojus suojaa neulan, kun mäntä päästetään irti.
Neulansuojuksettoman esitäytetyn ruiskun käyttäminen
Anna annos vakiintuneiden käytäntöjen mukaan.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BINOCRIT injektioneste, liuos, esitäytetty ruisku
1000 IU/0,5 ml 6 x 0,5 ml
3000 IU/0,3 ml 6 x 0,3 ml
4000 IU/0,4 ml 6 x 0,4 ml
5000 IU/0,5 ml 6 x 0,5 ml
6000 IU/0,6 ml 6 x 0,6 ml
8000 IU/0,8 ml 6 x 0,8 ml
20000 IU/0,5 ml 0,5 ml
30000 IU/0,75 ml 0,75 ml
2000 IU/ml 6 x 1 ml
10000 IU/ml 6 x 1 ml
40000 IU/ml 1 ml
- Ylempi erityiskorvaus (100 %). Rintasyöpä (115), Eturauhassyöpä (116), Leukemiat, muut pahanlaatuiset veri- ja luuydintaudit sekä pahanlaatuiset imukudostaudit (117), Gynekologiset syövät (128), Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130), Munuaisten vajaatoimintaan liittyvä vaikea anemia (138).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Epoetiini, darbepoetiini alfa ja metoksipolyetyleeniglykoliepoetiini beeta: Krooniseen munuaissairauteen liittyvän anemian hoito erityisin edellytyksin / Epoetiini ja darbepoetiini alfa: Syöpäsairauteen tai solunsalpaajahoitoihin liittyvän anemian hoito sekä valmistauduttaessa autologiseen verensiirtoon (306).
ATC-koodi
B03XA01
Valmisteyhteenvedon muuttamispäivämäärä
01.11.2023
Yhteystiedot
Edvard Thomsens Vej 14
København S København
Danmark
010 6133 415
info.suomi@sandoz.com
