MOUNJARO KWIKPEN injektioneste, liuos, esitäytetty kynä 2,5 mg/annos, 5 mg/annos, 7,5 mg/annos, 10 mg/annos, 12,5 mg/annos, 15 mg/annos
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Esitäytetty kynä (KwikPen), moniannos
Mounjaro 2,5 mg/annos KwikPen, injektioneste, liuos, esitäytetty kynä
Yksi annos sisältää 2,5 mg tirtsepatidia 0,6 millilitrassa liuosta. Yksi esitäytetty moniannoskynä sisältää 10 mg tirtsepatidia 2,4 millilitrassa liuosta (4,17 mg/ml). Yhdessä kynässä on 4 annosta ja yksi annos on 2,5 mg.
Mounjaro 5 mg/annos KwikPen, injektioneste, liuos, esitäytetty kynä
Yksi annos sisältää 5 mg tirtsepatidia 0,6 millilitrassa liuosta. Yksi esitäytetty moniannoskynä sisältää 20 mg tirtsepatidia 2,4 millilitrassa liuosta (8,33 mg/ml). Yhdessä kynässä on 4 annosta ja yksi annos on 5 mg.
Mounjaro 7,5 mg/annos KwikPen, injektioneste, liuos, esitäytetty kynä
Yksi annos sisältää 7,5 mg tirtsepatidia 0,6 millilitrassa liuosta. Yksi esitäytetty moniannoskynä sisältää 30 mg tirtsepatidia 2,4 millilitrassa liuosta (12,5 mg/ml). Yhdessä kynässä on 4 annosta ja yksi annos on 7,5 mg.
Mounjaro 10 mg/annos KwikPen, injektioneste, liuos, esitäytetty kynä
Yksi annos sisältää 10 mg tirtsepatidia 0,6 millilitrassa liuosta. Yksi esitäytetty moniannoskynä sisältää 40 mg tirtsepatidia 2,4 millilitrassa liuosta (16,7 mg/ml). Yhdessä kynässä on 4 annosta ja yksi annos on 10 mg.
Mounjaro 12,5 mg/annos KwikPen, injektioneste, liuos, esitäytetty kynä
Yksi annos sisältää 12,5 mg tirtsepatidia 0,6 millilitrassa liuosta. Yksi esitäytetty moniannoskynä sisältää 50 mg tirtsepatidia 2,4 millilitrassa liuosta (20,8 mg/ml). Yhdessä kynässä on 4 annosta ja yksi annos on 12,5 mg.
Mounjaro 15 mg/annos KwikPen, injektioneste, liuos, esitäytetty kynä
Yksi annos sisältää 15 mg tirtsepatidia 0,6 millilitrassa liuosta. Yksi esitäytetty moniannoskynä sisältää 60 mg tirtsepatidia 2,4 millilitrassa liuosta (25 mg/ml). Yhdessä kynässä on 4 annosta ja yksi annos on 15 mg.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Tyypin 2 diabetes
Mounjaro on tarkoitettu aikuisille, nuorille ja vähintään 10-vuotiaille lapsille riittämättömässä hoitotasapainossa olevan tyypin 2 diabeteksen hoitoon ruokavaliohoidon ja liikunnan lisänä
- monoterapiana, kun metformiinin käyttöä ei pidetä tarkoituksenmukaisena intoleranssin tai vasta-aiheiden vuoksi
- yhdistettynä muihin diabeteksen hoitoon käytettäviin lääkevalmisteisiin.
Tutkimustulokset eri yhdistelmähoidoista, vaikutuksista glukoositasapainoon ja tiedot tutkituista potilasryhmistä ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka.
Painonhallinta
Mounjaro on tarkoitettu painonhallinnan avuksi vähäenergiaisen ruokavalion ja fyysisen aktiivisuuden lisäämisen rinnalla. Se on tarkoitettu aikuisten painonpudotukseen ja painon ylläpitoon tapauksissa, joissa painoindeksi (BMI) on hoitoa aloitettaessa
- ≥ 30 kg/m2 (lihavuus) tai
- ≥ 27 kg/m2 ja < 30 kg/m2 (ylipaino), kun potilaalla on lisäksi vähintään yksi painoon liittyvä sairaus (esim. kohonnut verenpaine, dyslipidemia, obstruktiivinen uniapnea, sydän‑ ja verisuonitauti, diabeteksen esiaste tai tyypin 2 diabetes).
Obstruktiivista uniapneaa koskevat tutkimustulokset ovat luettavissa kohdasta Farmakodynamiikka.
Annostus ja antotapa
Annostus
Tirtsepatidin aloitusannos on 2,5 mg kerran viikossa. Neljän viikon kuluttua annos suurennetaan 5 mg:aan kerran viikossa. Tarvittaessa annosta voidaan suurentaa 2,5 mg kerrallaan, kun käytössä olevaa annosta on käytetty vähintään 4 viikkoa.
Aikuiset
Suositellut ylläpitoannokset ovat 5 mg, 10 mg ja 15 mg.
Enimmäisannos on 15 mg kerran viikossa.
Pediatriset potilaat, vähintään 10-vuotiaat (tyypin 2 diabeteksen hoito)
Suositellut ylläpitoannokset ovat 5 mg ja 10 mg.
Enimmäisannos on 10 mg kerran viikossa.
Yhdistelmähoito
Kun tirtsepatidia käytetään aiemman sulfonyyliurea‑ ja/tai insuliinihoidon lisänä, sulfonyyliurea‑ tai insuliiniannoksen pienentämistä voidaan harkita hypoglykemiariskin pienentämiseksi. Verenglukoosin omaseuranta on välttämätöntä sulfonyyliurea‑ ja insuliiniannoksen muuttamista varten. Insuliiniannosta on suositeltavaa pienentää vähitellen. (Ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset.)
Unohtuneet annokset
Jos annos unohtuu, se on otettava mahdollisimman pian 4 vuorokauden kuluessa unohtuneesta annoksesta. Jos annoksen unohtumisesta on kulunut yli 4 vuorokautta, unohtunut annos jätetään väliin ja seuraava annos pistetään tavanomaisena hoitoaikataulun mukaisena päivänä. Kummassakin tapauksessa potilas voi tämän jälkeen jatkaa hoitoaan normaalisti kerran viikossa.
Annosaikataulun muuttaminen
Viikoittaista lääkkeenottopäivää voidaan muuttaa tarvittaessa, kunhan kahden annoksen väliin jäävä aika on vähintään 3 vuorokautta.
Erityisryhmät
Ikä, sukupuoli, etninen tausta ja paino
Annosta ei tarvitse muuttaa iän, sukupuolen, rodun, etnisen taustan eikä painon perusteella (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka). ≥ 85‑vuotiaista potilaista on vain hyvin vähän tietoa.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on munuaisten vajaatoiminta, mukaan lukien loppuvaiheen munuaisten vajaatoiminta. Kokemusta tirtsepatidin käytöstä vaikeaa munuaisten vajaatoimintaa ja loppuvaiheen munuaisten vajaatoimintaa sairastavilla potilailla on vähän. Varovaisuutta on noudatettava, jos tirtsepatidia annetaan kyseisille potilaille (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on maksan vajaatoiminta. Kokemusta tirtsepatidin käytöstä vaikeaa maksan vajaatoimintaa sairastavilla potilailla on vähän. Varovaisuutta on noudatettava, jos tirtsepatidia annetaan kyseisille potilaille (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Annosta ei tarvitse muuttaa iän, sukupuolen, rodun, etnisen taustan tai painon perusteella vähintään 10-vuotiailla lapsilla tai alle 18-vuotiailla nuorilla, joita hoidetaan tyypin 2 diabeteksen vuoksi. Tietoja ei ole saatavilla lapsista ja nuorista, joilla on tyypin 2 diabetes ja jotka painavat alle 50 kg tai joiden BMI on alle 85. prosenttipisteen hoidon aloitushetkellä. Varovaisuutta on noudatettava alle 60 kg painavilla lapsilla suurennettaessa annosta 10 mg:aan, koska turvallisuustietoa on rajallisesti.
Tirtsepatidin turvallisuutta ja tehoa ei ole varmistettu alle 10-vuotiailla lapsilla tyypin 2 diabeteksen hoidossa eikä alle 18-vuotiailla lapsilla ja nuorilla painonhallinnassa.
Antotapa
Mounjaro pistetään ihon alle vatsaan, reiteen tai toinen henkilö voi pistää olkavarren takaosaan.
Annos voidaan pistää mihin vuorokauden aikaan tahansa riippumatta aterioista.
Pistoskohtaa on vaihdeltava joka annoksen yhteydessä. Jos potilas pistää myös insuliinia, Mounjaro on pistettävä eri kohtaan.
Potilaita ja huoltajia on kehotettava lukemaan huolellisesti käyttöohjeet pakkausselosteesta ennen lääkevalmisteen pistämistä. Pediatrisille potilaille huoltaja voi antaa pistokset tai potilas voi pistää itse, jos terveydenhuollon ammattilainen katsoo sen sopivaksi.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Akuutti haimatulehdus
Tirtsepatidia ei ole tutkittu potilailla, joilla on aiemmin ollut haimatulehdus. Tirtsepatidin käytössä on noudatettava varovaisuutta näiden potilaiden kohdalla.
Tirtsepatidia saaneilla potilailla on ilmoitettu akuuttia haimatulehdusta.
Potilaille on kerrottava akuutin haimatulehduksen oireista. Jos haimatulehdusta epäillään, tirtsepatidin käyttö on lopetettava. Jos haimatulehduksen diagnoosi varmistuu, tirtsepatidihoitoa ei saa aloittaa uudelleen. Jos muita akuutin haimatulehduksen oireita ja löydöksiä ei ole, haimaentsyymiarvojen kohoaminen ei yksinään ennusta akuuttia haimatulehdusta (ks. kohta Haittavaikutukset).
Hypoglykemia
Hypoglykemian riski voi olla suurentunut, jos potilas käyttää tirtsepatidia yhdessä insuliinieritystä lisäävän valmisteen (esim. sulfonyyliurean) tai insuliinin kanssa. Hypoglykemian riskiä voidaan pienentää insuliinieritystä lisäävän valmisteen tai insuliinin annosta pienentämällä (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Vaikutukset ruoansulatuselimistöön
Tirtsepatidiin on liittynyt ruoansulatuskanavan haittavaikutuksia, kuten pahoinvointia, oksentelua ja ripulia (ks. kohta Haittavaikutukset). Nämä haittavaikutukset voivat johtaa nestehukkaan, joka voi johtaa munuaistoiminnan heikentymiseen, mukaan lukien akuuttiin munuaisten vajaatoimintaan. Tirtsepatidia käyttäville potilaille on kerrottava etenkin ruoansulatuskanavan haittavaikutuksiin liittyvästä nestehukkariskistä, ja potilaita on kehotettava ryhtymään varotoimiin nestehukan ja elektrolyyttihäiriön välttämiseksi. Tämä on otettava huomioon erityisesti vanhuksilla, jotka voivat olla alttiimpia tällaisille komplikaatioille.
Vaikea ruoansulatuskanavan sairaus
Tirtsepatidia ei ole tutkittu potilailla, joilla on vaikea ruoansulatuskanavan sairaus (mukaan lukien vaikea gastropareesi). Tirtsepatidin käytössä on noudatettava varovaisuutta näiden potilaiden kohdalla.
Diabeettinen retinopatia
Tirtsepatidia ei ole tutkittu potilailla, joilla on akuuttia hoitoa vaativa ei‑proliferatiivinen diabeettinen retinopatia, proliferatiivinen diabeettinen retinopatia tai diabeettinen makulaturvotus. Tirtsepatidin käytössä on noudatettava varovaisuutta näiden potilaiden kohdalla, ja potilaita on seurattava asianmukaisesti.
Aspiraatio yleisanestesian tai syvän sedaation yhteydessä
Aspiraatiopneumoniatapauksia on ilmoitettu anestesian tai syvän sedaation yhteydessä potilailla, jotka ovat saaneet GLP-1-reseptoriagonisteja. Siksi on otettava huomioon lisääntynyt riski mahaan jääneestä sisällöstä hidastuneen tyhjentymisen takia (ks. kohta Haittavaikutukset) ennen yleisanestesian tai syvän sedaation aikana suoritettavia toimenpiteitä.
Natriumpitoisuus
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Bentsyylialkoholi
Tämä lääkevalmiste sisältää 5,4 mg bentsyylialkoholia yhdessä Mounjaro KwikPen ‑kynän 0,6 millilitran annoksessa.
Yhteisvaikutukset
Tirtsepatidi hidastaa mahalaukun tyhjenemistä ja voi täten vaikuttaa samanaikaisesti suun kautta otettavien lääkevalmisteiden imeytymisnopeuteen. Tämä vaikutus, joka pienentää Cmax‑arvoa ja pidentää tmax‑aikaa, on voimakkaimmillaan tirtsepatidihoidon alussa.
Yhdessä tutkimuksessa arvioitiin tirtsepatidin vaikutusta mahalaukun tyhjenemiseen käyttämällä mallilääkkeenä parasetamolia, ja tämän tutkimuksen tulosten perusteella useimpien samanaikaisesti suun kautta otettavien lääkevalmisteiden annosta ei todennäköisesti tarvitse muuttaa. On kuitenkin suositeltavaa seurata potilaita, jotka käyttävät suun kautta otettavia lääkevalmisteita, joiden terapeuttinen leveys on kapea (esim. varfariini, digoksiini), erityisesti tirtsepatidihoidon alussa ja annoksen suurentamisen jälkeen. Sellaisten suun kautta otettavien lääkevalmisteiden kohdalla, joiden nopeavaikutteisuus on tärkeää, myös vaikutuksen viivästymisriski on otettava huomioon.
Parasetamoli
Tirtsepatidikerta‑annoksen 5 mg jälkeen parasetamolin enimmäispitoisuus plasmassa (Cmax) pieneni 50 % ja tmax-ajan mediaani viivästyi 1 tunnilla. Tirtsepatidin vaikutus suun kautta otetun parasetamolin imeytymisnopeuteen on annos- ja aikariippuvainen. Pienillä annoksilla (0,5 mg ja 1,5 mg) parasetamolialtistus muuttui vain vähän. Neljän peräkkäisen viikoittaisen tirtsepatidiannoksen (5/5/8/10 mg) jälkeen ei havaittu vaikutusta parasetamolin Cmax‑ ja tmax‑arvoihin. Kokonaisaltistukseen (AUC) ei ollut vaikutusta. Parasetamoliannosta ei tarvitse muuttaa, kun sitä annetaan samanaikaisesti tirtsepatidin kanssa.
Ehkäisytabletit
Kun yhdistelmäehkäisytabletin (0,035 mg etinyyliestradiolia + 0,25 mg norgestimaattia, norelgestromiinin aihiolääke) kanssa annettiin samanaikaisesti kerta‑annos tirtsepatidia (5 mg), ehkäisytabletin Cmax‑ ja AUC‑arvot pienenivät. Etinyyliestradiolin Cmax‑pitoisuus pieneni 59 % ja AUC 20 % ja tmax‑aika piteni 4 tunnilla. Norelgestromiinin Cmax‑pitoisuus pieneni 55 % ja AUC 23 % ja tmax‑aika viivästyi 4,5 tunnilla. Norgestimaatin Cmax‑pitoisuus pieneni 66 % ja AUC 20 % ja tmax‑aika viivästyi 2,5 tunnilla. Tirtsepatidikerta‑annoksen jälkeistä altistuksen vähenemistä ei pidetä kliinisesti merkittävänä. Ehkäisytablettien annosta ei tarvitse muuttaa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on suositeltavaa käyttää ehkäisyä tirtsepatidihoidon aikana.
Raskaus
Tirtsepatidin käytöstä raskaana oleville naisille ei ole olemassa tietoja tai on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Tirtsepatidin käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi mutta eivät käytä ehkäisyä. Jos potilas haluaa tulla raskaaksi tai tulee raskaaksi, tirtsepatidihoito on lopetettava. Tirtsepatidin käyttö on lopetettava vähintään kuukautta ennen suunniteltua raskautta, koska sen puoliintumisaika on pitkä (ks. kohta Farmakokinetiikka).
Imetys
Ei tiedetä, erittyykö tirtsepatidi ihmisillä äidinmaitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois.
On päätettävä, lopetetaanko imetys vai pidättäydytäänkö tirtsepatidihoidosta ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Tirtsepatidin vaikutusta ihmisen hedelmällisyyteen ei tunneta.
Eläimillä tehdyissä tutkimuksissa ei ole havaittu tirtsepatidin aiheuttaneen suoria hedelmällisyyteen kohdistuvia haittavaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tirtsepatidilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Jos tirtsepatidia käytetään yhdessä sulfonyyliurean tai insuliinin kanssa, potilaita on neuvottava noudattamaan varotoimia hypoglykemian välttämiseksi ajaessaan autoa ja käyttäessään koneita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kahdessatoista päättyneessä vaiheen 3 tutkimuksessa 8 158 aikuispotilasta altistettiin pelkälle tirtsepatidille tai tirtsepatidin ja muiden glukoosipitoisuutta pienentävien lääkevalmisteiden yhdistelmälle. Yleisimmin ilmoitettuja haittavaikutuksia olivat maha-suolikanavan haitat, ja ne olivat vaikeusasteeltaan pääosin lieviä tai keskivaikeita. Pahoinvoinnin, ripulin ja oksentelun ilmaantuvuus oli suurempi annoksen suurentamisvaiheessa ja pieneni ajan myötä (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Seuraavat kliinisissä tutkimuksissa esiintyneet, hoitoon liittyneet haittavaikutukset luetellaan jäljempänä elinjärjestelmäluokittain ja ilmaantuvuuden mukaan alenevassa järjestyksessä yleisimmästä alkaen (hyvin yleinen: ≥ 1/10; yleinen: ≥ 1/100, < 1/10; melko harvinainen: ≥ 1/1 000, < 1/100; harvinainen: ≥ 1/10 000, < 1/1 000; hyvin harvinainen: < 1/10 000). Kunkin ilmaantuvuusluokan haittavaikutukset esitetään yleisimmästä alkaen.
Taulukko 1. Haittavaikutukset
| Elinjärjestelmäluokka | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen |
| Immuunijärjestelmä | Yliherkkyysreaktiot | Anafylaktinen reaktio#, angioedeema# | ||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia1* yhdessä sulfonyyliurean tai insuliinin kanssa käytettäessä | Hypoglykemia1* yhdessä metformiinin ja SGLT2:n estäjän kanssa käytettäessä, ruokahalun heikentyminen1 | Hypoglykemia1* yhdessä metformiinin kanssa käytettäessä6, painonlasku1 | |
| Hermosto | Huimaus2 | Makuhäiriö, tuntohäiriö | ||
| Verisuonisto | Hypotensio2 | |||
| Ruoansulatuselimistö | Pahoinvointi, ripuli, oksentelu3, vatsakipu3, ummetus4 | Dyspepsia, vatsan pullotus, röyhtäily, ilmavaivat, ruokatorven refluksitauti | Sappikivet, sappirakkotulehdus, akuutti haimatulehdus, hidastunut mahalaukun tyhjeneminen | |
| Iho ja ihonalainen kudos | Hiustenlähtö2 | |||
| Yleisoireet ja antopaikassa todettavat haitat | Väsymys†, injektiokohdan reaktiot | Injektiokohdan kipu | ||
| Tutkimukset | Syketiheyden suureneminen, lipaasipitoisuuden suureneminen, amylaasipitoisuuden suureneminen, veren kalsitoniinipitoisuuden suureneminen5 |
#Markkinoille tulon jälkeisistä ilmoituksista.
*Hypoglykemia määritellään jäljempänä.
† Väsymys kattaa termit ”väsymys”, ”astenia”, ”huonovointisuus” ja ”letargia”.
1 Haittavaikutus, joka koskee vain potilaita, joilla on tyypin 2 diabetes.
2 Haittavaikutus, joka koskee pääosin potilaita, joilla on ylipaino tai lihavuus ja joista osalla on tyypin 2 diabetes.
3 Esiintyvyys oli ”hyvin yleinen” painonhallintaa, obstruktiivista uniapneaa ja pediatrista tyypin 2 diabetesta koskeneissa tutkimuksissa ja ”yleinen” aikuisten tyypin 2 diabetesta koskeneissa tutkimuksissa.
4 Esiintyvyys oli ”hyvin yleinen” painonhallintaa ja obstruktiivista uniapneaa koskeneissa tutkimuksissa, ja ”yleinen” aikuisten ja pediatristen potilaiden tyypin 2 diabetesta koskeneissa tutkimuksissa.
5 Esiintyvyys oli ”yleinen” painonhallintaa koskeneissa tutkimuksissa, ”melko harvinainen” aikuisten tyypin 2 diabetesta ja obstruktiivista uniapneaa koskeneissa tutkimuksissa, ja ”hyvin harvinainen” pediatrisissa tyypin 2 diabetesta koskeneissa tutkimuksissa.
6 Esiintyvyys oli ”yleinen” pediatrista tyypin 2 diabetesta koskeneissa tutkimuksissa.
Tiettyjen haittavaikutusten kuvaus
Yliherkkyysreaktiot
Yhdistetyissä lumekontrolloiduissa aikuisten tyypin 2 diabetesta koskeneissa tutkimuksissa yliherkkyysreaktioita ilmoitettiin 3,2 %:lla tirtsepatidihoitoa saaneista potilaista ja 1,7 %:lla lumehoitoa saaneista potilaista. Yhdistetyissä lumekontrolloiduissa painonhallintatutkimuksissa yliherkkyysreaktioita ilmoitettiin 5,0 %:lla tirtsepatidihoitoa saaneista potilaista ja 3,8 %:lla lumehoitoa saaneista potilaista. Yhdistetyissä lumekontrolloiduissa obstruktiivisen uniapnean tutkimuksissa yliherkkyysreaktioita ilmoitettiin 3,0 %:lla tirtsepatidihoitoa saaneista potilaista ja 2,1 %:lla lumehoitoa saaneista potilaista. Yliherkkyysreaktiot olivat ajoittain vaikeita (esim. nokkosihottuma, ekseema, ihottuma, dermatiitti).
Anafylaktisia reaktioita ja angioedeemaa on ilmoitettu harvoin tirtsepatidin markkinoille tulon jälkeisen käytön yhteydessä.
Hypoglykemia tyypin 2 diabetesta sairastavilla potilailla
Aikuisten tyypin 2 diabetesta koskeneet tutkimukset
Kliinisesti merkittävää hypoglykemiaa (verensokeri < 3,0 mmol/l [< 54 mg/dl]) tai vaikeaa hypoglykemiaa (toisen apua vaativaa) esiintyi 10–14 %:lla potilaista (0,14–0,16 tapahtumaa/potilasvuosi), kun tirtsepatidia käytettiin sulfonyyliurean lisänä, ja 14–19 %:lla potilaista (0,43–0,64 tapahtumaa/potilasvuosi), kun tirtsepatidia käytettiin perusinsuliinin lisänä.
Kun tirtsepatidia käytettiin ainoana lääkkeenä tai muiden, suun kautta otettavien diabeteslääkkeiden lisänä, kliinisesti merkittävän hypoglykemian esiintymistiheys oli enimmillään 0,04 tapahtumaa/potilasvuosi (ks. taulukko 1 ja kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Vaiheen 3 kliinisissä tutkimuksissa 10 potilaalla (0,2 %) ilmoitettiin 12 vaikeaa hypoglykemiaepisodia. Näistä 10 potilaasta 5:llä (0,1 %) oli taustahoitona glargininsuliini tai sulfonyyliurea ja kullakin ilmoitettiin 1 tapahtuma.
Painonhallintatutkimus
Lumekontrolloidussa painonhallintaa koskeneessa vaiheen 3 tutkimuksessa tyypin 2 diabetesta sairastavilla potilailla hypoglykemiaa (veren glukoosi < 3,0 mmol/l [< 54 mg/dl]) ilmoitettiin 4,2 %:lla tirtsepatidia saaneista potilaista ja 1,3 %:lla lumehoitoa saaneista potilaista. Tässä tutkimuksessa potilailla, jotka käyttivät tirtsepatidia yhdistelmänä insuliinin eritystä lisäävien lääkkeiden (esim. sulfonyyliurea) kanssa, oli suurempi hypoglykemioiden ilmaantuvuus (10,3 %) verrattuna potilaisiin, jotka käyttivät tirtsepatidia ilman sulfonyyliureaa (2,1 %). Vaikeita hypoglykemiaepisodeja ei ilmoitettu.
Maha-suolikanavan haittavaikutukset
Yhdistetyissä lumekontrolloiduissa aikuisten tyypin 2 diabetesta koskeneissa vaiheen 3 tutkimuksissa maha-suolikanavan haittavaikutukset yleistyivät annosriippuvaisesti tirtsepatidin annoksilla 5 mg (37,1 %), 10 mg (39,6 %) ja 15 mg (43,6 %) verrattuna lumelääkkeeseen (20,4 %). Pahoinvointia esiintyi 12,2 %:lla 5 mg:n tirtsepatidiannosta saaneista, 15,4 %:lla 10 mg:n annosta saaneista, 18,3 %:lla 15 mg:n annosta saaneista ja 4,3 %:lla lumelääkettä saaneista. Ripulia esiintyi 11,8 %:lla 5 mg:n tirtsepatidiannosta saaneista, 13,3 %:lla 10 mg:n annosta saaneista, 16,2 %:lla 15 mg:n annosta saaneista ja 8,9 %:lla lumelääkettä saaneista. Maha-suolikanavan haittavaikutukset olivat vaikeusasteeltaan yleensä lieviä (74 %) tai keskivaikeita (23,3 %). Pahoinvoinnin, oksentelun ja ripulin ilmaantuvuus oli suurempi annoksen suurentamisvaiheen aikana ja pieneni ajan myötä.
Tutkimushoidon lopettaminen pysyvästi maha-suolikanavan haittavaikutusten takia oli yleisempää tirtsepatidi 5 mg ‑ryhmässä (3,0 %), 10 mg ‑ryhmässä (5,4 %) ja 15 mg ‑ryhmässä (6,6 %) kuin lumeryhmässä (0,4 %).
Lumekontrolloidussa painonhallintaa koskeneessa vaiheen 3 tutkimuksessa potilailla, joilla ei ollut tyypin 2 diabetesta, maha‑suolikanavan häiriöitä esiintyi enemmän tirtsepatidin annoksilla 5 mg (55,6 %), 10 mg (60,8 %) ja 15 mg (59,2 %) verrattuna lumelääkkeeseen (30,3 %). Pahoinvointia esiintyi 24,6 %:lla 5 mg:n tirtsepatidiannosta saaneista, 33,3 %:lla 10 mg:n annosta saaneista, 31,0 %:lla 15 mg:n annosta saaneista ja 9,5 %:lla lumelääkettä saaneista. Ripulia esiintyi 18,7 %:lla 5 mg:n tirtsepatidiannosta saaneista, 21,2 %:lla 10 mg:n annosta saaneista, 23,0 %:lla 15 mg:n annosta saaneista ja 7,3 %:lla lumelääkettä saaneista. Maha‑suolikanavan haittavaikutukset olivat vaikeusasteeltaan yleensä lieviä (60,8 %) tai keskivaikeita (34,6 %). Pahoinvoinnin, oksentelun ja ripulin ilmaantuvuus oli suurempi annoksen suurentamisvaiheen aikana ja pieneni ajan myötä.
Tirtsepatidiryhmissä suurempi osa potilaista lopetti tutkimushoidon pysyvästi maha‑suolikanavan tapahtuman takia (5 mg: 1,9 %, 10 mg: 4,4 % ja 15 mg: 4,1 %) verrattuna lumeryhmään (0,5 %).
Sappirakkoon liittyvät tapahtumat
Yhdistetyissä lumekontrolloidussa vaiheen 3 painonhallintatutkimuksessa sappirakkotulehduksen ja äkillisen sappirakkotulehduksen kokonaisilmaantuvuus oli tirtsepatidihoitoa saaneilla potilailla 0,6 % ja lumelääkehoitoa saaneilla potilailla 0,2 %.
Yhdistetyissä lumekontrolloiduissa painonhallintaa koskeneissa vaiheen 3 tutkimuksissa äkillistä sappirakon sairautta ilmoitettiin 2,0 %:lla tirtsepatidihoitoa saaneista potilaista ja 1,6 %:lla lumelääkehoitoa saaneista potilaista. Yhdistetyissä lumekontrolloiduissa obstruktiivista uniapneaa koskeneissa vaiheen 3 tutkimuksissa äkillistä sappirakon sairautta ilmoitettiin 0,9 %:lla tirtsepatidihoitoa saaneista potilaista ja 0,9 %:lla lumelääkehoitoa saaneista potilaista.
Painonhallintaa koskeneissa vaiheen 3 tutkimuksissa äkillisillä sappirakkotapahtumilla oli positiivinen yhteys painon laskuun.
Immunogeenisuus
Vaiheen 3 kliinisissä tutkimuksissa yhteensä 8 735 tirtsepatidia saanutta potilasta arvioitiin lääkevasta‑aineiden varalta. Näissä tutkimuksissa 51,1-65,1 %:lle kehittyi hoidon aikana ilmenneitä lääkevasta‑aineita. Hoidon aikana ilmenneitä lääkevasta-aineita esiintyi jatkuvana (vähintään 16 viikon ajan) 38,3-51,3 %:lla arvioiduista potilaista. Enimmillään 2,3 %:lle kehittyi neutraloivia vasta‑aineita tirtsepatidin toiminnalle GIP‑reseptoreissa (GIP: glukoosista riippuvainen insulinotrooppinen polypeptidi), 2,3 %:lle kehittyi neutraloivia vasta‑aineita tirtsepatidin toiminnalle GLP‑1‑reseptoreissa (GLP‑1: glukagonin kaltainen peptidi‑1), enimmillään 0,9 %:lle kehittyi neutraloivia vasta‑aineita elimistön omia GIP‑peptidejä vastaan ja 0,4 %:lle elimistön omia GLP‑1‑peptidejä vastaan.
Näyttöä ei ole ollut siitä, että lääkevasta-aineiden tai neutraloivien vasta-aineiden kehittyminen muuttaisi tirtsepatidin farmakokineettistä profiilia tai vaikuttaisi sen tehoon.
Syketiheys
Yhdistetyissä lumekontrolloiduissa aikuisten tyypin 2 diabetesta koskeneissa vaiheen 3 tutkimuksissa tirtsepatidihoitoa saaneilla syketiheys suureni kaikissa annosryhmissä keskimäärin enintään 3–5 lyönnillä minuutissa. Lumelääkettä saaneilla potilailla syketiheys suureni keskimäärin enintään 1 lyönnin minuutissa.
Niiden potilaiden prosenttiosuus, joiden syketiheys oli muuttunut lähtötilanteesta > 20 lyöntiä minuutissa vähintään kahdella peräkkäisellä käynnillä, oli tirtsepatidi 5 mg ‑ryhmässä 2,1 %, 10 mg ‑ryhmässä 3,8 %, 15 mg ‑ryhmässä 2,9 % ja lumelääkeryhmässä 2,1 %.
Vähäistä keskimääräisen PR-ajan pitenemistä havaittiin tirtsepatidilla (keskimäärin 1,4–3,2 ms), verrattuna lumelääkkeeseen (keskimääräinen lasku 1,4 ms). Rytmihäiriöihin ja sydämen johtumishäiriöihin liittyvissä tapahtumissa ei havaittu eroa tirtsepatidiannosten 5 mg (3,8 %), 10 mg (2,1 %), 15 mg (3,7 %) ja lumelääkkeen (3 %) välillä.
Yhdistetyissä lumekontrolloidussa painonhallintaa koskeneessa vaiheen 3 tutkimuksessa tirtsepatidihoitoa saaneilla potilailla syketiheys suureni keskimäärin 3 lyönnillä minuutissa. Lumelääkettä saaneilla potilailla havaittiin keskimäärin < 1 lyönnin minuutissa syketiheyden suurenemista.
Lumekontrolloidussa painonhallintaa koskeneessa tutkimuksessa potilailla, joilla ei ollut tyypin 2 diabetesta, niiden potilaiden prosenttiosuus, joiden syketiheys oli muuttunut lähtötilanteesta > 20 lyöntiä minuutissa vähintään kahdella peräkkäisellä käynnillä, oli tirtsepatidi 5 mg ‑ryhmässä 2,4 %, 10 mg ‑ryhmässä 4,9 %, 15 mg ‑ryhmässä 6,3 % ja lumeryhmässä 1,2 %.
Vähäistä keskimääräisen PR-ajan pitenemistä havaittiin tirtsepatidilla (keskimäärin 0,3–1,4 ms) ja lumelääkkeellä (keskimäärin 0,5 ms). Rytmihäiriöihin ja sydämen johtumishäiriöihin liittyvissä tapahtumissa ei havaittu eroa tirtsepatidiannosten 5 mg (3,7 %), 10 mg (3,3 %), 15 mg (3,3 %) ja lumelääkkeen (3,6 %) välillä.
Injektiokohdan reaktiot
Yhdistetyissä lumekontrolloiduissa aikuisten tyypin 2 diabetesta koskeneissa vaiheen 3 tutkimuksissa injektiokohdan reaktiot olivat yleisempiä tirtsepatidia saaneilla potilailla (3,2 %) kuin lumelääkettä saaneilla (0,4 %). Yhdistetyssä lumekontrolloidussa painonhallinnan vaiheen 3 tutkimuksissa injektiokohdan reaktiot olivat yleisempiä tirtsepatidia saaneilla potilailla (8,0 %) kuin lumelääkettä saaneilla (1,8 %). Yhdistetyssä lumekontrolloidussa obstruktiivisen uniapnean vaiheen 3 tutkimuksissa injektiokohdan reaktiot olivat yleisempiä tirtsepatidia saaneilla potilailla (8,2 %) kuin lumelääkettä saaneilla (2,6 %).
Kaiken kaikkiaan vaiheen 3 tutkimuksissa injektiokohdan reaktioiden yleisimpiä oireita ja löydöksiä olivat punoitus ja kutina. Potilailla injektiokohdan reaktiot olivat vaikeusasteeltaan enimmillään lieviä (91 %) tai keskivaikeita (9 %). Yksikään injektiokohdan reaktioista ei ollut vakava.
Haimaentsyymit
Yhdistetyissä lumekontrolloiduissa aikuispotilaiden tyypin 2 diabetesta koskeneissa vaiheen 3 tutkimuksissa haimaperäisen amylaasin pitoisuus suureni tirtsepatidihoidon yhteydessä lähtötasosta keskimäärin 33–38 % ja lipaasin pitoisuus keskimäärin 31–42 % kaikissa annosryhmissä. Lumelääkettä saaneilla potilailla amylaasipitoisuus suureni lähtötasosta 4 %, mutta lipaasipitoisuuksissa ei havaittu muutoksia.
Yhdistetyissä lumekontrolloidussa painonhallintaa koskeneessa vaiheen 3 tutkimuksessa ja yhdistetyissä lumekontrolloidussa obstruktiivista uniapneaa koskeneessa vaiheen 3 tutkimuksessa haimaperäisen amylaasin pitoisuus suureni tirtsepatidihoidon yhteydessä lähtötasosta keskimäärin 23 % ja 25 % ja lipaasin pitoisuus keskimäärin 34 % ja 39 %. Lumelääkettä saaneilla potilailla amylaasipitoisuus suureni lähtötasosta 2 % ja 1 % –1,8 % ja lipaasipitoisuus 6 % ja 4 %.
Pediatriset potilaat
Vähintään 10-vuotiaiden lasten ja alle 18-vuotiaiden nuorten, joiden tyypin 2 diabetesta hoidettiin tirtsepatidilla (5 mg ja 10 mg kerran viikossa), turvallisuus- ja immunogeenisuusprofiilit olivat yhdenmukaiset edellä kuvattujen tyypin 2 diabeteksen aikuispotilaiden kanssa, poikkeuksena suurempi oksentelun, vatsakivun ja hypoglykemian esiintyvyys, kun tirtsepatidi lisättiin pelkkään metformiiniin.
Pediatrisessa tyypin 2 diabeteksen tutkimuksessa ei esiintynyt vakavia hypoglykemiajaksoja. Lumekontrolloidun tutkimusjakson aikana kliinisesti merkittävää hypoglykemiaa (veren glukoosi < 3,0 mmol/l (< 54 mg/dl)) esiintyi 28,6 %:lla (1,98 tapahtumaa/potilasvuosi) tirtsepatidia saaneista potilaista ja 10,0 %:lla (0,35 tapahtumaa/potilasvuosi) lumelääkettä saaneista potilaista, kun hoito lisättiin perusinsuliiniin metformiinin kanssa tai ilman. Esiintyvyys oli 9,1 % (0,28 tapahtumaa/potilasvuosi) tirtsepatidilla hoidetuilla potilailla ja 4,2 % (0,07 tapahtumaa/potilasvuosi) lumelääkettä saaneilla potilailla) pelkkään metformiiniin lisättynä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksissa on aloitettava asianmukainen tukihoito potilaan kliinisten oireiden ja löydösten perusteella. Potilailla voi esiintyä ruoansulatuskanavan haittavaikutuksia, mm. pahoinvointia. Tirtsepatidin yliannokseen ei ole spesifistä vastalääkettä. Oireiden pitkäaikainen tarkkailu ja hoito saattaa olla tarpeen, kun otetaan huomioon tirtsepatidin puoliintumisaika (noin 5 vuorokautta).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: diabeteslääkkeet, veren glukoosipitoisuutta pienentävät lääkkeet, lukuun ottamatta insuliineja, ATC‑koodi: A10BX16
Vaikutusmekanismi
Tirtsepatidi on pitkävaikutteinen GIP‑ ja GLP‑1‑reseptoriagonisti, joka on erittäin selektiivinen ihmisen GIP‑ ja GLP‑1‑reseptoreihin. Tirtsepatidilla on suuri affiniteetti sekä GIP- että GLP‑1-reseptoreihin. Tirtsepatidin vaikutus GIP‑reseptoriin on samaa luokkaa kuin elimistön oman GIP‑hormonin. Tirtsepatidin vaikutus GLP‑1‑reseptoriin on heikompi kuin elimistön oman GLP‑1‑hormonin. Molempia reseptoreita on haiman endokriinisissa alfa‑ ja beetasoluissa, sydämessä, verisuonistossa, immuunisoluissa (leukosyyteissä), suolistossa ja munuaisissa. GIP‑reseptoreita on myös adiposyyteissä.
GIP‑ ja GLP‑1‑reseptoreita ilmentyy myös aivoalueilla, jotka ovat tärkeitä ruokahalun säätelyn kannalta. Eläimillä tehdyissä tutkimuksissa on todettu, että tirtsepatidi jakaantuu aivojen ruokahalun ja syömisen säätelyyn osallistuvien alueiden hermosoluihin ja aktivoi niitä. Eläimillä tehdyt tutkimukset osoittavat, että tirtsepatidi voi vaikuttaa rasvan hyödyntämiseen GIP-reseptorivaikutuksen kautta. In vitro ‑viljellyissä ihmisen rasvasoluissa tirtsepatidi vaikutti GIP-reseptoreiden välityksellä glukoosin sisäänoton säätelyyn sekä rasvojen sisäänottoon ja lipolyysiin.
Glukoositasapaino
Tirtsepatidi parantaa glukoositasapainoa pienentämällä tyypin 2 diabetespotilaiden paastoglukoosipitoisuuksia ja aterianjälkeisiä glukoosipitoisuuksia useiden mekanismien kautta.
Ruokahalun säätely ja energia‑aineenvaihdunta
Tirtsepatidi laskee painoa ja pienentää elimistön rasvamassaa. Painon aleneminen johtuu pääasiassa rasvamassan pienenemisestä. Painon laskuun ja rasvamassan pienenemiseen johtavia mekanismeja ovat mm. ruoankulutuksen väheneminen ruokahalun säätelyn seurauksena. Kliiniset tutkimukset osoittavat, että tirtsepatidi vähentää energiansaantia ja ruokahalua lisäämällä kylläisyyden ja täysinäisyyden tunnetta ja vähentämällä näläntunnetta. Tirtsepatidi heikentää myös mielitekojen voimakkuutta ja mieltymystä runsaasti sokeria ja rasvaa sisältäviin ruokiin. Tirtsepatidi vaikuttaa rasvan hyödyntämiseen elimistössä.
Farmakodynaamiset vaikutukset
Insuliinieritys
Tirtsepatidi lisää haiman beetasolujen glukoosiherkkyyttä. Se lisää ensimmäisen ja toisen vaiheen insuliinieritystä glukoosiriippuvaisesti.
Hyperglykeemisessä clamp‑tutkimuksessa aikuisilla tyypin 2 diabetespotilailla tirtsepatidia verrattiin lumelääkkeeseen ja selektiiviseen GLP‑1‑reseptoriagonisti semaglutidiin (1 mg) insuliinierityksen suhteen. Tirtsepatidi 15 mg paransi ensimmäisen vaiheen insuliinieritystä 466 % ja toisen vaiheen insuliinieritystä 302 % lähtötilanteesta. Lumelääke ei muuttanut ensimmäisen eikä toisen vaiheen insuliinieritystä.
Insuliiniherkkyys
Tirtsepatidi parantaa insuliiniherkkyyttä.
Aikuisilla tirtsepatidi 15 mg paransi koko elimistön insuliiniherkkyyttä 63 % mitattuna M‑arvolla, jolla mitataan kudosten glukoosinottoa hyperinsulineemisellä euglykeemisellä clamp‑menetelmällä. M‑arvo pysyi lumelääkettä saaneilla muuttumattomana.
Tirtsepatidi laskee painoa potilailla, joilla on lihavuus tai ylipaino, ja tyypin 2 diabetespotilailla (painosta riippumatta), mikä voi myötävaikuttaa insuliiniherkkyyden paranemiseen.
Glukagonipitoisuus
Tirtsepatidi pienensi paasto‑ ja aterianjälkeisiä glukagonipitoisuuksia glukoosiriippuvaisesti. Aikuisilla tirtsepatidi 15 mg pienensi glukagonin paastoarvoa 28 % ja glukagonin AUC‑arvoa seka‑aterian jälkeen 43 %. Lumelääke ei muuttanut kyseisiä arvoja.
Mahalaukun tyhjeneminen
Tirtsepatidi hidastaa mahalaukun tyhjenemistä, mikä voi hidastaa aterianjälkeistä glukoosin imeytymistä ja vaikuttaa suotuisasti aterianjälkeiseen glukoosipitoisuuteen. Tirtsepatidin indusoima mahalaukun tyhjenemisen hidastuminen vähenee ajan myötä.
Kliininen teho ja turvallisuus
Aikuisten tyypin 2 diabetes
Tirtsepatidin tehoa ja turvallisuutta arvioitiin viidessä maailmanlaajuisessa, satunnaistetussa, kontrolloidussa vaiheen 3 tutkimuksessa (SURPASS-1–5), joissa glykeemisen tasapainon arviointi oli ensisijainen tavoite. Tutkimuksiin osallistui 6 263 hoitoa saavaa potilasta, joilla oli tyypin 2 diabetes (4 199 sai tirtsepatidihoitoa). Toissijaisia tavoitteita olivat paino, painonlaskutavoitteen saavuttaneiden potilaiden prosenttiosuus, seerumin paastoglukoosi ja HbA1c‑tavoitearvon saavuttaneiden potilaiden prosenttiosuus. Kaikissa viidessä vaiheen 3 tutkimuksessa arvioitiin 5 mg:n, 10 mg:n ja 15 mg:n tirtsepatidiannoksia. Kaikkien tirtsepatidia saaneiden potilaiden aloitusannos oli 2,5 mg 4 viikon ajan. Tämän jälkeen tirtsepatidiannosta suurennettiin 2,5 mg 4 viikon välein, kunnes määrätty annos saavutettiin.
Kaikissa tutkimuksissa tirtsepatidihoito pienensi pitkäkestoisesti, tilastollisesti merkitsevästi ja kliinisesti merkittävästi HbA1c‑arvoa (ensisijainen tavoite) lähtötilanteesta yhteen vuoteen asti verrattuna lumelääkkeeseen tai aktiiviseen vertailuvalmisteeseen (semaglutidi, degludekinsuliini ja glargininsuliini). Yhdessä tutkimuksessa vaikutukset säilyivät kahteen vuoteen asti. Myös tutkittavien paino pieneni lähtötilanteesta tilastollisesti merkitsevästi ja kliinisesti merkittävästi. Tulokset kyseisistä vaiheen 3 tutkimuksista esitetään jäljempänä muokatun hoitoaikeen mukaisen (mITT) populaation hoitotietojen perusteella (ilman varahoitoa). mITT‑populaation muodostivat kaikki satunnaistetut potilaat, jotka altistuivat vähintään yhdelle tutkimushoitoannokselle. Populaatioon eivät sisältyneet potilaat, jotka lopettivat tutkimushoidon tahattoman tutkimukseenoton takia.
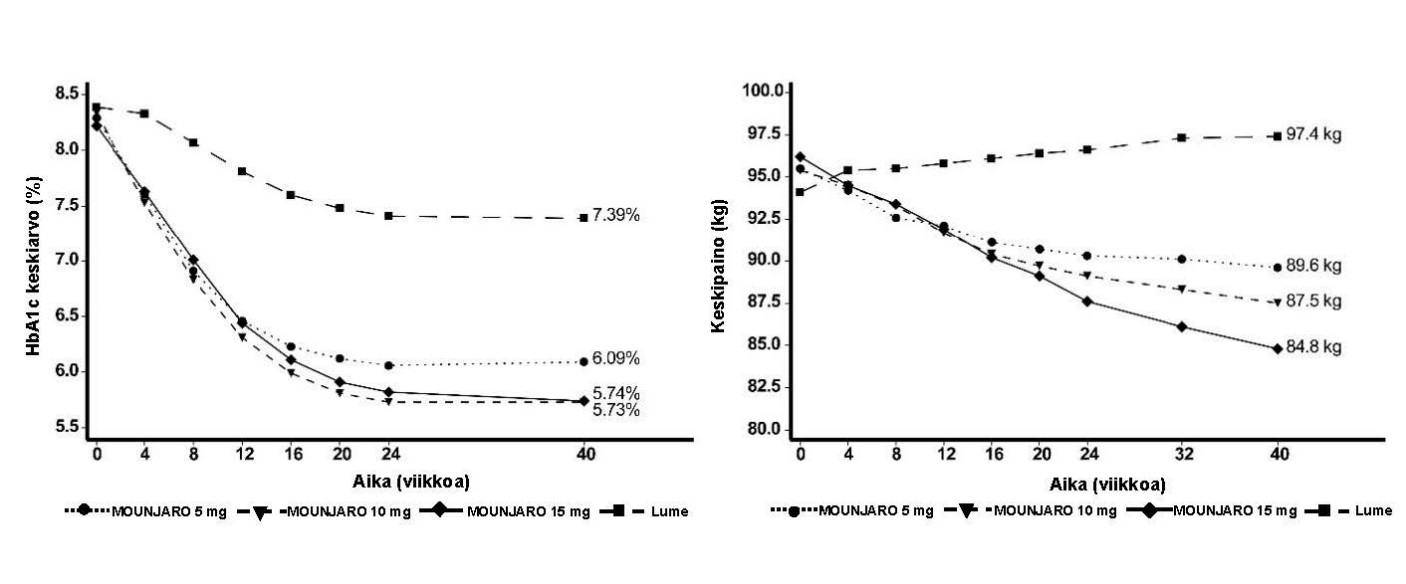
SURPASS‑1 – monoterapia
40 viikkoa kestäneessä, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 478 potilasta, joilla ruokavaliohoidolla ja liikunnalla ei ollut saavutettu riittävää glukoositasapainoa, satunnaistettiin saamaan 5 mg, 10 mg tai 15 mg tirtsepatidia kerran viikossa tai lumelääkettä. Potilaiden keskimääräinen ikä oli 54 vuotta, ja 52 % oli miehiä. Lähtötilanteessa potilaiden diabeteksen keskimääräinen kesto oli 5 vuotta ja BMI:n keskiarvo 32 kg/m2.
Taulukko 2. SURPASS‑1: Tulokset viikolla 40
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Lumelääke | ||
| mITT‑populaatio (n) | 121 | 121 | 120 | 113 | |
| HbA1c (%) | Lähtötilanne (keskiarvo) | 7,97 | 7,88 | 7,88 | 8,08 |
| Muutos lähtötilanteesta | –1,87## | –1,89## | –2,07## | +0,04 | |
| Ero lumelääkkeeseen nähden [95 % lv] | –1,91** [–2,18; –1,63] | –1,93** [–2,21; –1,65] | –2,11** [–2,39; –1,83] | ‑ | |
| HbA1c (mmol/mol) | Lähtötilanne (keskiarvo) | 63,6 | 62,6 | 62,6 | 64,8 |
| Muutos lähtötilanteesta | –20,4## | –20,7## | –22,7## | 0,4 | |
| Ero lumelääkkeeseen nähden [95 % lv] | –20,8** [–23,9; –17,8] | –21,1** [–24,1; –18,0] | –23,1** [–26,2; –20,0] | ‑ | |
| HbA1c‑tavoitearvon saavuttaneita potilaita (%) | < 7 % | 86,8** | 91,5** | 87,9** | 19,6 |
| ≤ 6,5 % | 81,8†† | 81,4†† | 86,2†† | 9,8 | |
| < 5,7 % | 33,9** | 30,5** | 51,7** | 0,9 | |
| Seerumin paastoglukoosi (mmol/l) | Lähtötilanne (keskiarvo) | 8,5 | 8,5 | 8,6 | 8,6 |
| Muutos lähtötilanteesta | –2,4## | –2,6## | –2,7## | +0,7# | |
| Ero lumelääkkeeseen nähden [95 % lv] | –3,13** [–3,71; –2,56] | –3,26** [–3,84; –2,69] | –3,45** [–4,04; –2,86] | ‑ | |
| Seerumin paastoglukoosi (mg/dl) | Lähtötilanne (keskiarvo) | 153,7 | 152,6 | 154,6 | 155,2 |
| Muutos lähtötilanteesta | –43,6## | –45,9## | –49,3## | +12,9# | |
| Ero lumelääkkeeseen nähden [95 % lv] | –56,5** [–66,8; –46,1] | –58,8** [–69,2; –48,4] | –62,1** [–72,7; –51,5] | ‑ | |
| Paino (kg) | Lähtötilanne (keskiarvo) | 87,0 | 85,7 | 85,9 | 84,4 |
| Muutos lähtötilanteesta | –7,0## | –7,8## | –9,5## | –0,7 | |
| Ero lumelääkkeeseen nähden [95 % lv] | –6,3** [–7,8; –4,7] | –7,1** [–8,6; –5,5] | –8,8** [–10,3; –7,2] | ‑ | |
| Potilaita, joiden paino laski (%) | ≥ 5 % | 66,9†† | 78,0†† | 76,7†† | 14,3 |
| ≥ 10 % | 30,6†† | 39,8†† | 47,4†† | 0,9 | |
| ≥ 15 % | 13,2† | 17,0† | 26,7† | 0,0 | |
* p < 0,05, ** p < 0,001 paremmuudelle, korjattu multiplisiteetin suhteen.
† p < 0,05, †† p < 0,001 verrattuna lumelääkkeeseen, ei korjattu multiplisiteetin suhteen.
# p < 0,05, ## p < 0,001 verrattuna lähtötilanteeseen, ei korjattu multiplisiteetin suhteen.
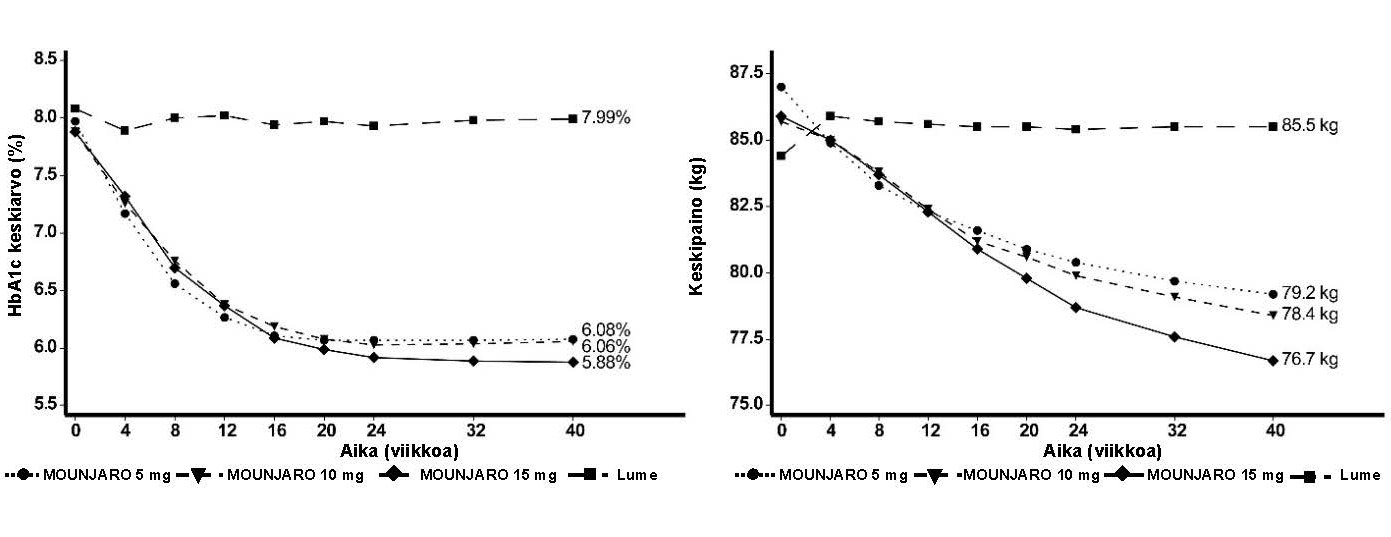
Kuva 1.Keskimääräinen HbA1c‑arvo (%) ja keskimääräinen paino (kg) lähtötilanteesta viikolle 40
SURPASS‑2 – yhdistelmähoito metformiinin kanssa
40 viikkoa kestäneessä, aktiivikontrolloidussa, avoimessa tutkimuksessa (kaksoissokkoutettu tirtsepatidiannoksen suhteen) 1 879 potilasta satunnaistettiin saamaan 5 mg, 10 mg tai 15 mg tirtsepatidia kerran viikossa yhdessä metformiinin kanssa tai 1 mg semaglutidia kerran viikossa yhdessä metformiinin kanssa. Potilaiden keskimääräinen ikä oli 57 vuotta, ja 47 % oli miehiä. Lähtötilanteessa potilaiden diabeteksen keskimääräinen kesto oli 9 vuotta ja BMI:n keskiarvo 34 kg/m2.
Taulukko 3. SURPASS‑2: Tulokset viikolla 40
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Semaglutidi 1 mg | ||
| mITT‑populaatio (n) | 470 | 469 | 469 | 468 | |
| HbA1c (%) | Lähtötilanne (keskiarvo) | 8,33 | 8,31 | 8,25 | 8,24 |
| Muutos lähtötilanteesta | –2,09## | –2,37## | –2,46## | –1,86## | |
| Ero semaglutidiin nähden [95 % lv] | –0,23** [–0,36; –0,10] | –0,51** [–0,64; –0,38] | –0,60** [–0,73; –0,47] | ‑ | |
| HbA1c (mmol/mol) | Lähtötilanne (keskiarvo) | 67,5 | 67,3 | 66,7 | 66,6 |
| Muutos lähtötilanteesta | –22,8## | –25,9## | –26,9## | –20,3 | |
| Ero semaglutidiin nähden [95 % lv] | –2,5** [–3,9; –1,1] | –5,6** [–7,0; –4,1] | –6,6** [–8,0; –5,1] | Ei saatavilla | |
| HbA1c‑tavoitearvon saavuttaneita potilaita (%) | < 7 % | 85,5* | 88,9** | 92,2** | 81,1 |
| ≤ 6,5 % | 74,0† | 82,1†† | 87,1†† | 66,2 | |
| < 5,7 % | 29,3†† | 44,7** | 50,9** | 19,7 | |
| Seerumin paastoglukoosi (mmol/l) | Lähtötilanne (keskiarvo) | 9,67 | 9,69 | 9,56 | 9,49 |
| Muutos lähtötilanteesta | –3,11## | –3,42## | –3,52## | –2,70## | |
| Ero semaglutidiin nähden [95 % lv] | –0,41† [–0,65; –0,16] | –0,72†† [–0,97; –0,48] | –0,82†† [–1,06; –0,57] | ‑ | |
| Seerumin paastoglukoosi (mg/dl) | Lähtötilanne (keskiarvo) | 174,2 | 174,6 | 172,3 | 170,9 |
| Muutos lähtötilanteesta | –56,0## | –61,6## | –63,4## | –48,6## | |
| Ero semaglutidiin nähden [95 % lv] | –7,3† [–11,7; –3,0] | –13,0†† [–17,4; –8,6] | –14,7†† [–19,1; –10,3] | ‑ | |
| Paino (kg) | Lähtötilanne (keskiarvo) | 92,6 | 94,9 | 93,9 | 93,8 |
| Muutos lähtötilanteesta | –7,8## | –10,3## | –12,4## | –6,2## | |
| Ero semaglutidiin nähden [95 % lv] | –1,7** [–2,6; –0,7] | –4,1** [–5,0; –3,2] | –6,2** [–7,1; –5,3] | ‑ | |
| Potilaita, joiden paino laski (%) | ≥ 5 % | 68,6† | 82,4†† | 86,2†† | 58,4 |
| ≥ 10 % | 35,8†† | 52,9†† | 64,9†† | 25,3 | |
| ≥ 15 % | 15,2† | 27,7†† | 39,9†† | 8,7 | |
* p < 0,05, ** p < 0,001 paremmuudelle, korjattu multiplisiteetin suhteen.
† p < 0,05, †† p < 0,001 verrattuna semaglutidi 1 mg ‑hoitoon, ei korjattu multiplisiteetin suhteen.
# p < 0,05, ## p < 0,001 verrattuna lähtötilanteeseen, ei korjattu multiplisiteetin suhteen.
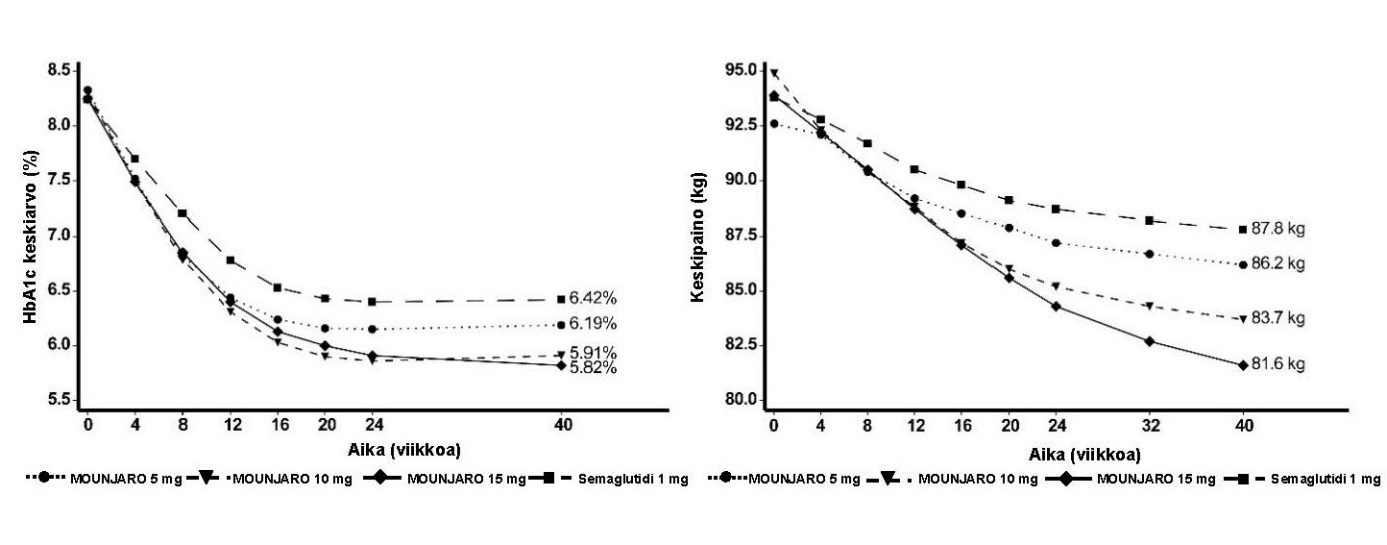
Kuva 2. Keskimääräinen HbA1c‑arvo (%) ja keskimääräinen paino (kg) lähtötilanteesta viikolle 40
SURPASS‑3 – yhdistelmähoito metformiinin kanssa, joko SGLT2:n estäjän kanssa tai ilman
52 viikkoa kestäneessä, aktiivikontrolloidussa, avoimessa tutkimuksessa 1 444 potilasta satunnaistettiin saamaan 5 mg, 10 mg tai 15 mg tirtsepatidia kerran viikossa tai degludekinsuliinia. Kaikilla oli käytössä metformiini joko SGLT2:n estäjän kanssa tai ilman. Potilaista 32 % käytti SGLT2:n estäjää lähtötilanteessa. Lähtötilanteessa potilaiden diabeteksen keskimääräinen kesto oli 8 vuotta ja BMI:n keskiarvo 34 kg/m2; keskimääräinen ikä oli 57 vuotta ja 56 % oli miehiä.
Degludekinsuliinia käyttäneillä potilailla aloitusannos oli 10 yksikköä/vrk, jota muutettiin algoritmilla, jossa veren paastoglukoosin tavoitearvo oli < 5 mmol/l. Degludekinsuliiniannoksen keskiarvo viikolla 52 oli 49 yksikköä/vrk.
Taulukko 4. SURPASS‑3: Tulokset viikolla 52
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Titrattu degludekinsuliini | ||
| mITT‑populaatio (n) | 358 | 360 | 358 | 359 | |
| HbA1c (%) | Lähtötilanne (keskiarvo) | 8,17 | 8,19 | 8,21 | 8,13 |
| Muutos lähtötilanteesta | –1,93## | –2,20## | –2,37## | –1,34## | |
Ero degludekinsuliiniin nähden [95 % lv] | –0,59** [–0,73; –0,45] | –0,86** [–1,00; –0,72] | –1,04** [–1,17; –0,90] | ‑ | |
| HbA1c (mmol/mol) | Lähtötilanne (keskiarvo) | 65,8 | 66,0 | 66,3 | 65,4 |
| Muutos lähtötilanteesta | –21,1## | –24,0## | –26,0## | –14,6## | |
Ero degludekinsuliiniin nähden [95 % lv] | –6,4** [–7,9; –4,9] | –9,4** [–10,9; –7,9] | –11,3** [–12,8; –9,8] | ‑ | |
| HbA1c‑tavoitearvon saavuttaneita potilaita (%) | < 7 % | 82,4** | 89,7** | 92,6** | 61,3 |
| ≤ 6,5 % | 71,4†† | 80,3†† | 85,3†† | 44,4 | |
| < 5,7 % | 25,8†† | 38,6†† | 48,4†† | 5,4 | |
| Seerumin paastoglukoosi (mmol/l) | Lähtötilanne (keskiarvo) | 9,54 | 9,48 | 9,35 | 9,24 |
| Muutos lähtötilanteesta | –2,68## | –3,04## | –3,29## | –3,09## | |
Ero degludekinsuliiniin nähden [95 % lv] | 0,41† [0,14; 0,69] | 0,05 [–0,24; 0,33] | –0,20 [–0,48; 0,08] | ‑ | |
| Seerumin paastoglukoosi (mg/dl) | Lähtötilanne (keskiarvo) | 171,8 | 170,7 | 168,4 | 166,4 |
| Muutos lähtötilanteesta | –48,2## | –54,8## | –59,2## | –55,7## | |
Ero degludekinsuliiniin nähden [95 % lv] | 7,5† [2,4; 12,5] | 0,8 [–4,3; 5,9] | –3,6 [–8,7; 1,5] | ‑ | |
| Paino (kg) | Lähtötilanne (keskiarvo) | 94,5 | 94,3 | 94,9 | 94,2 |
| Muutos lähtötilanteesta | –7,5## | –10,7## | –12,9## | +2,3## | |
Ero degludekinsuliiniin nähden [95 % lv] | –9,8** [–10,8; –8,8] | –13,0** [–14,0; –11,9] | –15,2** [–16,2; –14,2] | ‑ | |
| Potilaita, joiden paino laski (%) | ≥ 5 % | 66,0†† | 83,7†† | 87,8†† | 6,3 |
| ≥ 10 % | 37,4†† | 55,7†† | 69,4†† | 2,9 | |
| ≥ 15 % | 12,5†† | 28,3†† | 42,5†† | 0,0 | |
* p < 0,05, ** p < 0,001 paremmuudelle, korjattu multiplisiteetin suhteen.
† p < 0,05, †† p < 0,001 verrattuna degludekinsuliiniin, ei korjattu multiplisiteetin suhteen.
# p < 0,05, ## p < 0,001 verrattuna lähtötilanteeseen, ei korjattu multiplisiteetin suhteen.
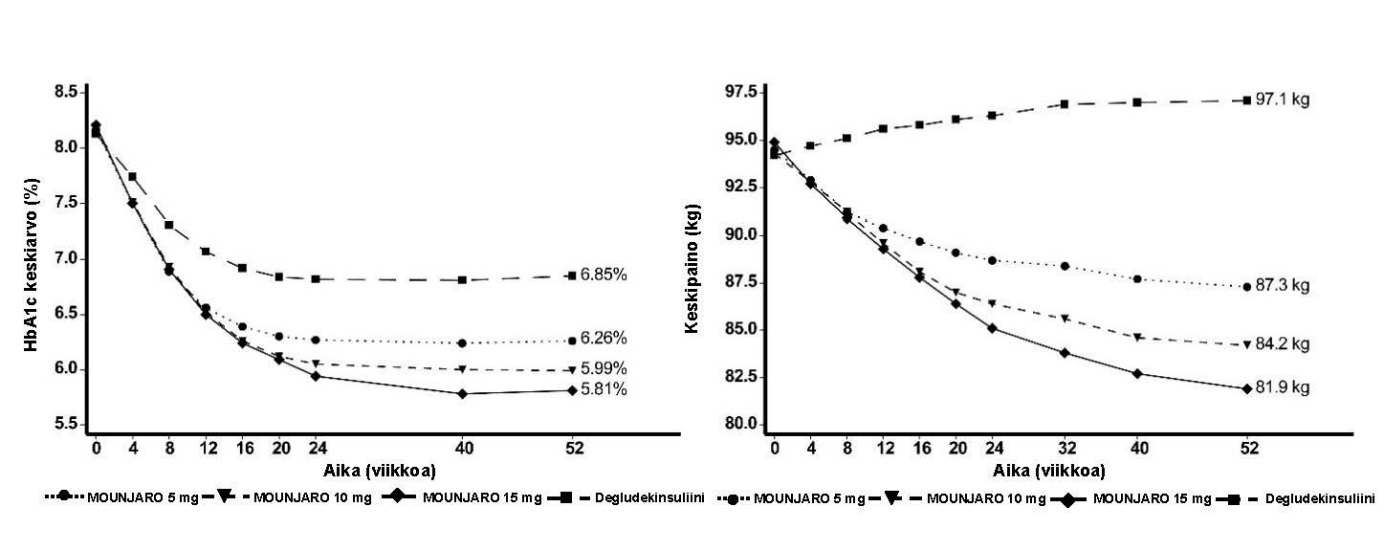
Kuva 3. Keskimääräinen HbA1c‑arvo (%) ja keskimääräinen paino (kg) lähtötilanteesta viikolle 52
Jatkuva glukoosinseuranta (CGM)
Potilaiden alajoukko (N = 243) osallistui sokkoutetulla jatkuvalla glukoosinseurannalla saatujen 24 tunnin glukoosiprofiilien arviointiin. Viikolla 52 tirtsepatidihoitoa (yhdistetyt tiedot 10 mg ja 15 mg) saaneiden potilaiden glukoosiarvot olivat merkitsevästi kauemmin (73 % ajasta) euglykeemisellä vaihtelualueella
(3,9–7,8 mmol/l [71–140 mg/dl]) verrattuna degludekinsuliinihoitoa saaneisiin potilaisiin (48 % ajasta).
SURPASS‑4 – yhdistelmähoito 1–3 suun kautta otettavan diabeteslääkkeen kanssa (metformiini, sulfonyyliurea tai SGLT2:n estäjä)
Enintään 104 viikkoa kestäneessä (ensisijainen päätetapahtuma 52 viikon kohdalla) aktiivikontrolloidussa, avoimessa tutkimuksessa 2 002 potilasta, joilla oli tyypin 2 diabetes ja suurentunut kardiovaskulaarinen riski, satunnaistettiin saamaan 5 mg, 10 mg tai 15 mg tirtsepatidia kerran viikossa tai glargininsuliinia kerran vuorokaudessa, kun taustahoitona oli metformiini (95 %) ja/tai sulfonyyliurea (54 %) ja/tai SGLT2:n estäjä (25 %). Lähtötilanteessa potilaiden diabeteksen keskimääräinen kesto oli 12 vuotta ja BMI:n keskiarvo 33 kg/m2; keskimääräinen ikä oli 64 vuotta ja 63 % oli miehiä. Glargininsuliinia käyttäneillä potilailla aloitusannos oli 10 yksikköä/vrk, jota muutettiin algoritmilla, jossa veren paastoglukoosin tavoitearvo oli < 5,6 mmol/l. Glargininsuliiniannoksen keskiarvo viikolla 52 oli 44 yksikköä/vrk.
Taulukko 5. SURPASS‑4: Tulokset viikolla 52
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Titrattu glargininsuliini | ||
| mITT‑populaatio (n) | 328 | 326 | 337 | 998 | |
| 52 viikkoa | |||||
| HbA1c (%) | Lähtötilanne (keskiarvo) | 8,52 | 8,60 | 8,52 | 8,51 |
| Muutos lähtötilanteesta | –2,24## | –2,43## | –2,58## | –1,44## | |
Ero glargininsuliiniin nähden [95 % lv] | –0,80** [–0,92; –0,68] | –0,99** [–1,11; –0,87] | –1,14** [–1,26; –1,02] | ‑ | |
| HbA1c (mmol/mol) | Lähtötilanne (keskiarvo) | 69,6 | 70,5 | 69,6 | 69,5 |
| Muutos lähtötilanteesta | –24,5## | –26,6## | –28,2## | –15,7## | |
Ero glargininsuliiniin nähden [95 % lv] | –8,8** [–10,1; –7,4] | –10,9** [–12,3; –9,6] | –12,5** [–13,8; –11,2] | ‑ | |
| HbA1c‑tavoitearvon saavuttaneita potilaita (%) | < 7 % | 81,0** | 88,2** | 90,7** | 50,7 |
| ≤ 6,5 % | 66,0†† | 76,0†† | 81,1†† | 31,7 | |
| < 5,7 % | 23,0†† | 32,7†† | 43,1†† | 3,4 | |
| Seerumin paastoglukoosi (mmol/l) | Lähtötilanne (keskiarvo) | 9,57 | 9,75 | 9,67 | 9,37 |
| Muutos lähtötilanteesta | –2,80## | –3,06## | –3,29## | –2,84## | |
Ero glargininsuliiniin nähden [95 % lv] | 0,04 [‑0,22; 0,30] | –0,21 [–0,48; 0,05] | –0,44†† [–0,71; –0,18] | ‑ | |
| Seerumin paastoglukoosi (mg/dl) | Lähtötilanne (keskiarvo) | 172,3 | 175,7 | 174,2 | 168,7 |
| Muutos lähtötilanteesta | –50,4## | –54,9## | –59,3## | –51,4## | |
Ero glargininsuliiniin nähden [95 % lv] | 1,0 [–3,7; 5,7] | –3,6 [–8,2; 1,1] | –8,0†† [–12,6; –3,4] | ‑ | |
| Paino (kg) | Lähtötilanne (keskiarvo) | 90,3 | 90,7 | 90,0 | 90,3 |
| Muutos lähtötilanteesta | –7,1## | –9,5## | –11,7## | +1,9## | |
Ero glargininsuliiniin nähden [95 % lv] | –9,0** [–9,8; –8,3] | –11,4** [–12,1; –10,6] | –13,5** [–14,3; –12,8] | ‑ | |
| Potilaita, joiden paino laski (%) | ≥ 5 % | 62,9†† | 77,6†† | 85,3†† | 8,0 |
| ≥ 10 % | 35,9†† | 53,0†† | 65,6†† | 1,5 | |
| ≥ 15 % | 13,8†† | 24,0†† | 36,5†† | 0,5 | |
* p < 0,05, ** p < 0,001 paremmuudelle, korjattu multiplisiteetin suhteen.
† p < 0,05, †† p < 0,001 verrattuna glargininsuliiniin, ei korjattu multiplisiteetin suhteen.
# p < 0,05, ## p < 0,001 verrattuna lähtötilanteeseen, ei korjattu multiplisiteetin suhteen.
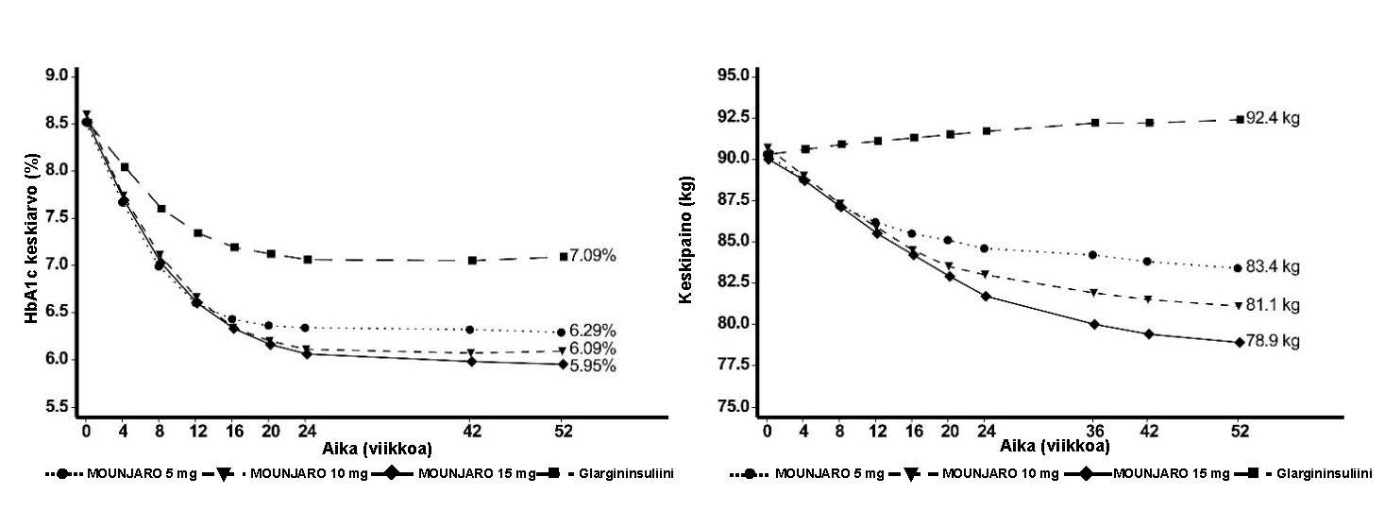
Kuva 4. Keskimääräinen HbA1c‑arvo (%) ja keskimääräinen paino (kg) lähtötilanteesta viikolle 52
SURPASS‑5 – yhdistelmähoito titratun perusinsuliinin kanssa, joko metformiinin kanssa tai ilman
40 viikkoa kestäneessä, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 475 potilasta, joilla glargininsuliinilla metformiinin kanssa tai ilman ei ollut saavutettu riittävää glukoositasapainoa, satunnaistettiin saamaan 5 mg, 10 mg tai 15 mg tirtsepatidia kerran viikossa tai lumelääkettä. Glargininsuliiniannoksia muutettiin algoritmilla, jossa veren paastoglukoosin tavoitearvo oli < 5,6 mmol/l. Lähtötilanteessa potilaiden diabeteksen keskimääräinen kesto oli 13 vuotta ja BMI:n keskiarvo 33 kg/m2; keskimääräinen ikä oli 61 vuotta ja 56 % oli miehiä. Glargininsuliinin arvioitu keskimääräinen kokonaisannos oli lähtötilanteessa 34 yksikköä/vrk. Viikolla 40 glargininsuliinin mediaaniannos oli tirtsepatidi 5 mg ‑hoitoa saaneilla 38 yksikköä/vrk, tirtsepatidi 10 mg ‑hoitoa saaneilla 36 yksikköä/vrk, tirtsepatidi 15 mg ‑hoitoa saaneilla 29 yksikköä/vrk ja lumelääkettä saaneilla 59 yksikköä/vrk.
Taulukko 6. SURPASS‑5: Tulokset viikolla 40
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Lumelääke | ||
| mITT‑populaatio (n) | 116 | 118 | 118 | 119 | |
| HbA1c (%) | Lähtötilanne (keskiarvo) | 8,29 | 8,34 | 8,22 | 8,39 |
| Muutos lähtötilanteesta | –2,23## | –2,59## | –2,59## | –0,93## | |
| Ero lumelääkkeeseen nähden [95 % lv] | –1,30** [–1,52; –1,07] | –1,66** [–1,88; –1,43] | –1,65** [–1,88; –1,43] | ‑ | |
| HbA1c (mmol/mol) | Lähtötilanne (keskiarvo) | 67,1 | 67,7 | 66,4 | 68,2 |
| Muutos lähtötilanteesta | –24,4## | –28,3## | –28,3## | –10,2## | |
| Ero lumelääkkeeseen nähden [95 % lv] | –14,2** [–16,6; –11,7] | –18,1** [–20,6; –15,7] | –18,1** [–20,5; –15,6] | ‑ | |
| HbA1c‑tavoitearvon saavuttaneita potilaita (%) | < 7 % | 93,0** | 97,4** | 94,0** | 33,9 |
| ≤ 6,5 % | 80,0†† | 94,7†† | 92,3†† | 17,0 | |
| < 5,7 % | 26,1†† | 47,8†† | 62,4†† | 2,5 | |
| Seerumin paastoglukoosi (mmol/l) | Lähtötilanne (keskiarvo) | 9,00 | 9,04 | 8,91 | 9,13 |
| Muutos lähtötilanteesta | –3,41## | –3,77## | –3,76## | –2,16## | |
| Ero lumelääkkeeseen nähden [95 % lv] | –1,25** [–1,64; –0,86] | –1,61** [–2,00; –1,22] | –1,60** [–1,99; –1,20] | ‑ | |
| Seerumin paastoglukoosi (mg/dl) | Lähtötilanne (keskiarvo) | 162,2 | 162,9 | 160,4 | 164,4 |
| Muutos lähtötilanteesta | –61,4## | –67,9## | –67,7## | –38,9## | |
| Ero lumelääkkeeseen nähden [95 % lv] | –22,5** [–29,5; –15,4] | –29,0** [–36,0; –22,0] | –28,8** [–35,9; –21,6] | ‑ | |
| Paino (kg) | Lähtötilanne (keskiarvo) | 95,5 | 95,4 | 96,2 | 94,1 |
| Muutos lähtötilanteesta | –6,2## | –8,2## | –10,9## | +1,7# | |
| Ero lumelääkkeeseen nähden [95 % lv] | –7,8** [–9,4; –6,3] | –9,9** [–11,5; –8,3] | –12,6** [–14,2; –11,0] | ‑ | |
| Potilaita, joiden paino laski (%) | ≥ 5 % | 53,9†† | 64,6†† | 84,6†† | 5,9 |
| ≥ 10 % | 22,6†† | 46,9†† | 51,3†† | 0,9 | |
| ≥ 15 % | 7,0† | 26,6† | 31,6†† | 0,0 | |
* p < 0,05, ** p < 0,001 paremmuudelle, korjattu multiplisiteetin suhteen.
† p < 0,05, †† p < 0,001 verrattuna lumelääkkeeseen, ei korjattu multiplisiteetin suhteen.
# p < 0,05, ## p < 0,001 verrattuna lähtötilanteeseen, ei korjattu multiplisiteetin suhteen.
Kuva 5. Keskimääräinen HbA1c‑arvo (%) ja keskimääräinen paino (kg) lähtötilanteesta viikolle 40
Tyypin 2 diabetes vähintään 10-vuotiailla lapsilla ja alle 18-vuotiailla nuorilla
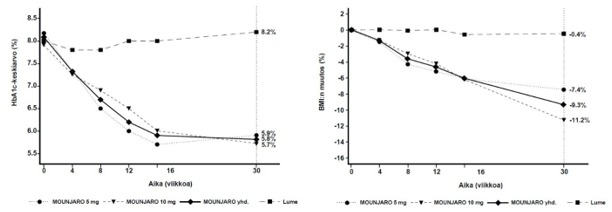
Tirtsepatidin (5 mg ja 10 mg kerran viikossa) turvallisuutta ja tehoa arvioitiin 99:lla vähintään 10-vuotiailla ja alle 18-vuotiailla potilailla, joilla oli tyypin 2 diabetes. Potilaat käyttivät metformiinia (68,7 %) tai perusinsuliinia (8,1 %) tai molempia (23,2 %) 30 viikon kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 tutkimuksessa, jota seurasi 22 viikon avoin jatkovaihe (SURPASS-PEDS). Avoimen vaiheen aikana kaikki lumeryhmän osallistujat siirrettiin tirtsepatidin 5 mg ylläpitoannokselle, kun taas tirtsepatidille satunnaistetut osallistujat jatkoivat hoitoa samalla 5 mg tai 10 mg annoksella.
Lähtötilanteessa potilaiden keski-ikä oli 14,7 vuotta ja 61 % oli naisia. Tyypin 2 diabeteksen keskimääräinen kesto oli 2,4 vuotta. Kaikilla osallistujilla oli ylipaino tai lihavuus, sillä sisäänottokriteerinä oli painoindeksi yli 85. prosenttipisteen verrattuna samanikäiseen ja sukupuoleen sovitettuun väestöön kyseisessä maassa tai alueella. Viikon 30 kohdalla tirtsepatidi 5 mg ja 10 mg, sekä yhdistettynä että erikseen, olivat lumelääkettä parempia laskemaan HbA1c-, seerumin paastoglukoosi- ja BMI-arvoja. Glykeeminen teho säilyi ja BMI:n lasku jatkui viikolle 52 asti.
Taulukko 7. SURPASS‑PEDS: Tulokset viikolla 30
| Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi yhdistetty | Lume-lääke | ||
| mITT-populaatio (n) | 32 | 33 | 65 | 34 | |
| HbA1c (%) | Lähtötilanne (keskiarvo) | 8,22 | 7,92 | 8,07 | 8,02 |
| Muutos lähtötilanteesta | –2,16 | –2,30 | –2,23 | 0,049 | |
| Ero lumelääkkeeseen nähden [95 % lv] | –2,21** [–2,89; –1,53] | –2,35** [–3,03; –1,66] | –2,28** [–2,87; –1,69] | - | |
| HbA1c (mmol/mol) | Lähtötilanne (keskiarvo) | 66,3 | 63,1 | 64,7 | 64,2 |
| Muutos lähtötilanteesta | –23,6 | –25,1 | –24,4 | 0,53 | |
| Ero lumelääkkeeseen nähden [95 % lv] | –24,2** [–31,6; –16,8] | –25,6** [–33,1; –18,2] | –24,9** [–31,4; –18,4] | - | |
| HbA1c‑tavoitearvon saavuttaneita potilaita (%) | < 7 % | 84,2 | 91,5 | 87,9 | 34,3 |
| ≤ 6,5 % | 70,8** | 86,1** | 78,6** | 27,8 | |
| < 5,7 % | 46,9 | 59,6 | 53,4 | 14,4 | |
| BMI (kg/m2) | Lähtötilanne (keskiarvo) | 33,9 | 37,3 | 35,6 | 34,7 |
| Muutos lähtötilanteesta (%) | –7,4 | –11,2 | –9,3 | –0,4 | |
| Ero lumelääkkeeseen nähden [95 % lv] | –7,0** [–10,48; –3,60] | –10,8** [–14,25; –7,39] | –8,9** [–11,91; –5,95] | - | |
*p < 0,05, ** p < 0,001 paremmuudelle, korjattu multiplisiteetin suhteen.
yhd. = yhdistetty
Kuva 6. Keskimääräinen HbA1c-arvo (%) ja BMI:n muutos (%) lähtötilanteesta viikolle 30
Painonhallinta
Tirtsepatidin tehoa ja turvallisuutta painonhallinnassa yhdistettynä energiansaannin vähentämiseen ja fyysisen aktiivisuuden lisäämiseen arvioitiin kolmessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 tutkimuksessa (SURMOUNT‑1, SURMOUNT‑3 ja SURMOUNT‑4) potilailla, joilla oli lihavuus (BMI ≥ 30 kg/m2) tai ylipaino (BMI ≥ 27 kg/m2 ja < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus (kuten hoidettu tai hoitamaton dyslipidemia, kohonnut verenpaine, obstruktiivinen uniapnea tai sydän- ja verisuonitauti) sekä diabeteksen esiaste tai normoglykemia, mutta ei tyypin 2 diabetesta. Näihin tutkimuksiin otettiin mukaan yhteensä 3 900 aikuispotilasta (joista 2 518 satunnaistettiin saamaan tirtsepatidia).
Tirtsepatidihoidolla osoitettiin kliinisesti merkittävä ja pitkäkestoinen painonlasku verrattuna lumelääkkeeseen. Lisäksi suurempi prosenttiosuus tirtsepatidia saaneista potilaista saavutti ≥ 5 %:n, ≥ 10 %:n, ≥ 15 %:n ja ≥ 20 %:n painonlaskun verrattuna lumelääkettä saaneisiin.
Tirtsepatidin tehoa ja turvallisuutta painonhallinnassa tyypin 2 diabetesta sairastavilla potilailla arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 tutkimuksessa (SURMOUNT‑2) ja viiden satunnaistetun vaiheen 3 tutkimuksen (SURPASS‑1–5) alaryhmässä, jonka potilaiden BMI oli ≥ 27 kg/m2. Tutkimuksiin otettiin mukaan yhteensä 6 330 potilasta, joiden BMI oli ≥ 27 kg/m2 (4 249 potilasta satunnaistettiin saamaan tirtsepatidia). SURMOUNT‑2-tutkimuksessa tirtsepatidihoidolla saavutettiin kliinisesti merkittävä ja pitkäkestoinen painonlasku lumelääkkeeseen verrattuna. Lisäksi suurempi osuus tirtsepatidihoitoa saaneista potilaista saavutti ≥ 5 %:n, ≥ 10 %:n, ≥ 15 %:n ja ≥ 20 %:n painonlaskun verrattuna lumelääkettä saaneisiin. SURPASS‑tutkimusten alaryhmäanalyyseissä potilailla, joilla oli lihavuus tai ylipaino (86 % SURPASS‑1–5‑tutkimusten yhteenlasketusta populaatiosta) todettiin pitkäkestoinen painonlasku. Myös suurempi prosenttiosuus potilaista saavutti painonlaskutavoitteen verrattuna vertailuvalmisteeseen/lumelääkkeeseen.
Kaikissa SURMOUNT-tutkimuksissa tirtsepatidiannoksen nosto toteutettiin samalla tavalla kuin SURPASS-ohjelmassa (alkaen 2,5 mg:lla 4 viikon ajan, minkä jälkeen annosta suurennettiin 2,5 mg:n lisäyksin 4 viikon välein, kunnes määrätty annos saavutettiin).
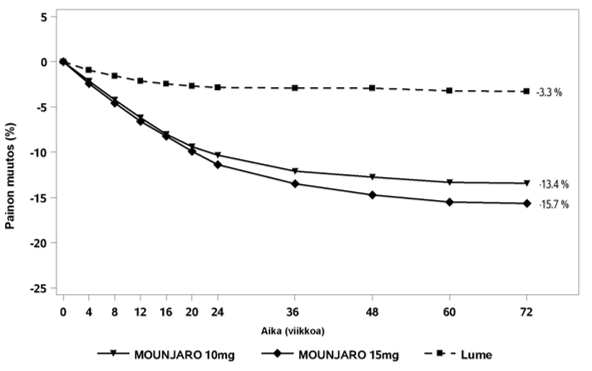
SURMOUNT‑1
72 viikkoa kestäneessä, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 2 539 aikuispotilasta satunnaistettiin saamaan 5 mg, 10 mg tai 15 mg tirtsepatidia kerran viikossa tai lumelääkettä. Potilailla oli lihavuus (BMI ≥ 30 kg/m2) tai ylipaino (BMI ≥ 27 kg/m2 ja < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus. Kaikkia potilaita ohjattiin noudattamaan vähäkalorista ruokavaliota ja lisäämään fyysistä aktiivisuutta koko tutkimuksen ajan. Lähtötilanteessa potilaiden keskimääräinen ikä oli 45 vuotta, 67,5 % potilaista oli naisia ja 40,6 %:lla potilaista oli diabeteksen esiaste. Lähtötilanteen keskimääräinen BMI oli 38 kg/m2.
Taulukko 8. SURMOUNT‑1: Tulokset viikolla 72
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Lumelääke | |
| mITT‑populaatio (n) | 630 | 636 | 630 | 643 |
| Paino | ||||
| Lähtötilanne (kg) | 102,9 | 105,9 | 105,5 | 104,8 |
| Muutos (%) lähtötilanteesta | –16,0†† | –21,4†† | –22,5†† | –2,4 |
Ero (%) lumelääkkeeseen nähden [95 % lv] | –13,5** [–14,6; –12,5] | –18,9** [–20,0; –17,8] | –20,1** [–21,2; –19,0] | ‑ |
| Muutos (kg) lähtötilanteesta | –16,1†† | –22,2†† | –23,6†† | –2,4†† |
Ero (kg) lumelääkkeeseen nähden [95 % lv] | –13,8## [–15,0; –12,6] | –19,8## [–21,0; –18,6] | –21,2## [–22,4; –20,0] | ‑ |
| Potilaita, joiden paino laski (%) | ||||
| ≥ 5 % | 89,4** | 96,2** | 96,3** | 27,9 |
| ≥ 10 % | 73,4## | 85,9** | 90,1** | 13,5 |
| ≥ 15 % | 50,2## | 73,6** | 78,2** | 6,0 |
| ≥ 20 % | 31,6## | 55,5** | 62,9** | 1,3 |
| Vyötärönympärys (cm) | ||||
| Lähtötilanne | 113,2 | 114,9 | 114,4 | 114,0 |
| Muutos lähtötilanteesta | –14,6†† | –19,4†† | –19,9†† | –3,4†† |
Ero lumelääkkeeseen nähden [95 % lv] | –11,2## [–12,3; –10,0] | –16,0** [–17,2; –14,9] | –16,5** [–17,7; –15,4] | ‑ |
††p < 0,001 verrattuna lähtötilanteeseen.
**p < 0,001 verrattuna lumelääkkeeseen; korjattu multiplisiteetin suhteen.
##p < 0,001 verrattuna lumelääkkeeseen, ei korjattu multiplisiteetin suhteen.
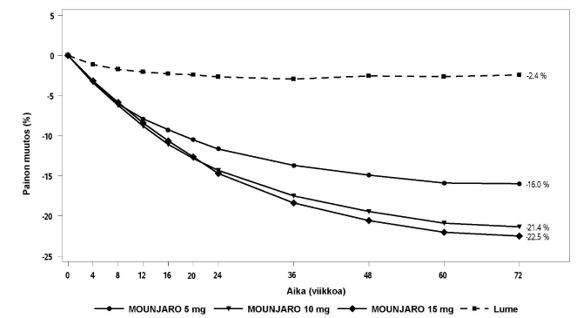
Kuva 7. Keskimääräinen painon muutos (%) lähtötilanteesta viikolle 72
SURMOUNT‑1‑tutkimuksesssa yhdistetyt 5 mg:n, 10 mg:n ja 15 mg:n tirtsepatidiannokset paransivat lumelääkkeeseen verrattuna merkitsevästi systolista verenpainetta (–8,1 mmHg vs. –1,3 mmHg), triglyseridipitoisuutta (–27,6 % vs. –6,3 %), ei‑HDL‑kolesterolipitoisuutta (–11,3 % vs. –1,8 %), HDL‑kolesterolipitoisuutta (7,9 % vs. 0,3 %) ja paastoinsuliinipitoisuutta (–46,9 % vs. –9,7 %).
Esidiabetesta sairastavat potilaat jatkoivat hoitoa 176 viikon ajan painon ja tyypin 2 diabeteksen puhkeamisen pitkäaikaisvaikutusten arvioimiseksi.
Taulukko 9. SURMOUNT-1: Tulokset viikolla 176 (potilaat, joilla oli diabeteksen esiaste lähtötilanteessa)
Tirtsepatidi 5 mg | Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Lumelääke
| |
| mITT-populaatio (n) | 247 | 262 | 253 | 270 |
| Paino | ||||
| Lähtötilanne (kg) | 104,6 | 108,9 | 108,5 | 107,4 |
| Muutos (%) lähtötilanteesta | -15,4†† | -19,9†† | -22,9†† | -2,1† |
Ero (%) lumelääkkeeseen nähden [95 % lv] | -13,2## [-15,3; -11,1] | -17,7** [-19,8; -15,7] | -20,7** [-22,8; -18,6] | - |
| Muutos (kg) lähtötilanteesta | -15,7†† | -21,4†† | -24,6†† | -2,3† |
Ero (kg) lumelääkkeeseen nähden [95 % lv] | -13,4## [-15,9; -11,0] | -19,1## [-21,5; -16,7] | -22,3## [-24,7; -19,9] | - |
†p < 0,05 ††p < 0,001 verrattuna lähtötilanteeseen.
**p < 0,001 verrattuna lumelääkkeeseen; korjattu multiplisiteetin suhteen.
##p < 0,001 verrattuna lumelääkkeeseen; ei korjattu multiplisiteetin suhteen.
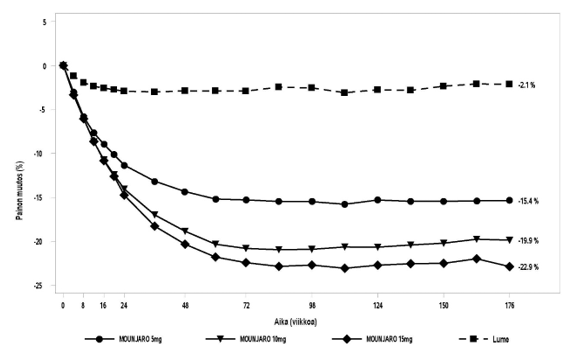
Kuva 8. Keskimääräinen painon muutos (%) lähtötilanteesta viikolle 176 (potilaat, joilla oli diabeteksen esiaste lähtötilanteessa)
SURMOUNT-1-tutkimukseen osallistuneista potilaista, joilla oli lähtötilanteessa esidiabetes (N = 1032), 95,3 %:lla tirtsepatidihoitoa saaneista potilaista tila palautui normoglykemiaan viikolla 72 verrattuna lumeryhmän potilaisiin, joiden osuus oli 61,9 %. 176 hoitoviikon jälkeen potilailla, joilla oli lähtötilanteessa diabeteksen esiaste, 94,5 %:lla tirtsepatidia saaneista potilaista tila palautui normoglykemiaksi verrattuna lumelääkeryhmään, jossa osuus oli 60,4 %. Tirtsepatidia saaneista potilaista 1,2 %:lla diabeteksen esiaste eteni tyypin 2 diabetekseen, ja lumelääkeryhmässä osuus oli 12,6 %.
SURMOUNT‑2
72 viikkoa kestäneessä, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 938 aikuispotilasta satunnaistettiin saamaan 10 mg tai 15 mg tirtsepatidia kerran viikossa tai lumelääkettä. Potilailla oli lihavuus (BMI ≥ 30 kg/m2) tai ylipaino (BMI ≥ 27 kg/m2 ja < 30 kg/m2) ja tyypin 2 diabetes. Tutkimukseen otettujen potilaiden HbA1c oli 7–10 %, ja heillä oli hoitona joko pelkästään ruokavalio ja liikunta tai vähintään yksi suun kautta otettava verensokeria alentava lääke. Kaikkia potilaita ohjattiin noudattamaan vähäkalorista ruokavaliota ja lisäämään fyysistä aktiivisuutta koko tutkimuksen ajan. Potilaiden keskimääräinen ikä oli 54 vuotta, ja 51 % potilaista oli naisia. Lähtötilanteen keskimääräinen BMI oli 36,1 kg/m2.
Taulukko 10. SURMOUNT-2: Tulokset viikolla 72
Tirtsepatidi 10 mg | Tirtsepatidi 15 mg | Lumelääke | |
| mITT-populaatio (n) | 312 | 311 | 315 |
| Paino | |||
| Lähtötilanne (kg) | 101,1 | 99,5 | 101,7 |
| Muutos (%) lähtötilanteesta | –13,4†† | –15,7†† | –3,3†† |
Ero (%) lumelääkkeeseen nähden [95 % lv] | –10,1** [–11,5; –8,8] | –12,4** [–13,7; –11,0] | - |
| Muutos (kg) lähtötilanteesta | –13,5†† | –15,6†† | –3,2 |
Ero (kg) lumelääkkeeseen nähden [95 % lv] | –10,3## [–11,7; –8,8] | –12,4## [–13,8; –11,0] | - |
| Potilaita, joiden paino laski (%) | |||
| ≥ 5 % | 81,6** | 86,4** | 30,5 |
| ≥ 10 % | 63,4** | 69,6** | 8,7 |
| ≥ 15 % | 41,4** | 51,8** | 2,6 |
| ≥ 20 % | 23,0** | 34,0** | 1,0 |
| Vyötärönympärys (cm) | |||
| Lähtötilanne | 114,3 | 114,6 | 116,1 |
| Muutos lähtötilanteesta | –11,2†† | –13,8†† | –3,4†† |
Ero lumelääkkeeseen nähden [95 % lv] | –7,8** [–9,2; –6,4] | –10,4** [–11,8; –8,9] | - |
| HbA1c (mmol/mol) | |||
| Lähtötilanne | 64,1 | 64,7 | 63,4 |
| Muutos lähtötilanteesta | –23,4†† | –24,3†† | –1,8† |
Ero lumelääkkeeseen nähden [95 % lv] | –21,6** [–23,5; –19,6] | –22,5** [–24,4; –20,6] | - |
| HbA1c (%) | |||
| Lähtötilanne | 8,0 | 8,1 | 8,0 |
| Muutos lähtötilanteesta | –2,1†† | –2,2†† | –0,2† |
Ero lumelääkkeeseen nähden [95 % lv] | –2,0** [–2,2; –1,8] | –2,1** [–2,2; –1,9] | - |
| Potilaita, joiden HbA1c oli (%) | |||
| < 7 % | 90,0** | 90,7** | 29,3 |
| ≤ 6,5 % | 84,1** | 86,7** | 15,5 |
| < 5,7 % | 50,2** | 55,3** | 2,8 |
| fS-Gluk (mmol/l) | |||
| Lähtötilanne | 8,8 | 9,0 | 8,7 |
| Muutos lähtötilanteesta | –2,7†† | –2,9†† | –0,1 |
Ero lumelääkkeeseen nähden [95 % lv] | –2,6** [–2,9; –2,3] | –2,7** [–3,1; –2,4] | - |
| fS-Gluk (mg/dl) | |||
| Lähtötilanne | 157,8 | 161,5 | 156,7 |
| Muutos lähtötilanteesta | –49,2†† | –51,7†† | –2,4 |
Ero lumelääkkeeseen nähden [95 % lv] | –46,8** [–52,7; –40,9] | –49,3** [–55,2; –43,3] | - |
†p < 0,05 verrattuna lähtötilanteeseen.
††p < 0,001 verrattuna lähtötilanteeseen.
**p < 0,001 verrattuna lumelääkkeeseen; korjattu multiplisiteetin suhteen.
##p < 0,001 verrattuna lumelääkkeeseen; ei korjattu multiplisiteetin suhteen.
Kuva 9. Keskimääräinen painon muutos (%) lähtötilanteesta viikolle 72
SURMOUNT‑2‑tutkimuksen yhdistetyt 10 mg:n ja 15 mg:n tirtsepatidiannokset paransivat lumelääkkeeseen verrattuna merkitsevästi systolista verenpainetta
(–7,2 mmHg vs. –1,0 mmHg), triglyseridipitoisuutta (–28,6 % vs. –5,8 %), ei‑HDL‑kolesterolipitoisuutta (–6,6 % vs. 2,3 %) ja HDL‑kolesterolipitoisuutta (8,2 % vs. 1,1 %).
SURMOUNT‑3
84 viikkoa kestäneessä tutkimuksessa 806 aikuispotilasta, joilla oli lihavuus (BMI ≥ 30 kg/m2) tai ylipaino (BMI ≥ 27 kg/m2 – < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus, osallistui aloitusvaiheen 12 viikkoa kestäneeseen intensiiviseen elämäntapainterventioon, johon sisältyi niukkaenerginen ruokavalio (1 200–1 500 kcal/vrk), fyysisen aktiivisuuden lisääminen ja säännöllinen elintapaohjaus. 12 viikkoa kestäneen aloitusvaiheen jälkeen 579 potilasta, jotka olivat saavuttaneet ≥ 5,0 %:n painonlaskun, satunnaistettiin saamaan 72 viikon ajan joko tirtsepatidia suurimmalla siedetyllä annoksella 10 mg tai 15 mg kerran viikossa tai lumelääkettä (kaksoissokkoutettu vaihe). Potilaat jatkoivat vähäkalorista ruokavaliota ja lisättyä fyysistä aktiivisuutta koko kaksoissokkoutetun vaiheen ajan. Satunnaistamishetkellä potilaiden keskimääräinen ikä oli 46 vuotta ja 63 % potilaista oli naisia. Satunnaistamishetkellä keskimääräinen BMI oli 35,9 kg/m2.
Taulukko 11. SURMOUNT-3: Tulokset viikolla 72
Tirtsepatidi Suurin siedetty annos | Lumelääke | |
| mITT-populaatio (n) | 287 | 292 |
| Paino | ||
| Lähtötilanne1 (kg) | 102,3 | 101,3 |
| Muutos (%) lähtötilanteesta1 | –21,1†† | 3,3†† |
Ero (%) lumelääkkeeseen nähden [95 % lv] | –24,5** [–26,1; –22,8] | - |
| Muutos (kg) lähtötilanteesta1 | –21,5†† | 3,5†† |
Ero (kg) lumelääkkeeseen nähden [95 % lv] | –25,0## [–26,9; –23,2] | - |
| Potilaita, joiden paino laski (%) | ||
| ≥ 5 % | 94,4** | 10,7 |
| ≥ 10 % | 88,0** | 4,8 |
| ≥ 15 % | 73,9** | 2,1 |
| ≥ 20 % | 54,9** | 1,0 |
Potilaita, jotka saivat ylläpidettyä ≥ 80 % 12 viikkoa kestäneen aloitusvaiheen aikana saavutetusta painonlaskusta (%) | 98,6** | 37,8 |
| Vyötärönympärys (cm) | ||
| Lähtötilanne1 | 109,2 | 109,6 |
| Muutos lähtötilanteesta1 | –16,8†† | 1,1 |
Ero lumelääkkeeseen nähden [95 % lv] | –17,9** [–19,5; –16,3] | - |
1Satunnaistaminen (viikko 0)
††p < 0,001 verrattuna lähtötilanteeseen1.
**p < 0,001 verrattuna lumelääkkeeseen; korjattu multiplisiteetin suhteen.
##p < 0,001 verrattuna lumelääkkeeseen; ei korjattu multiplisiteetin suhteen.
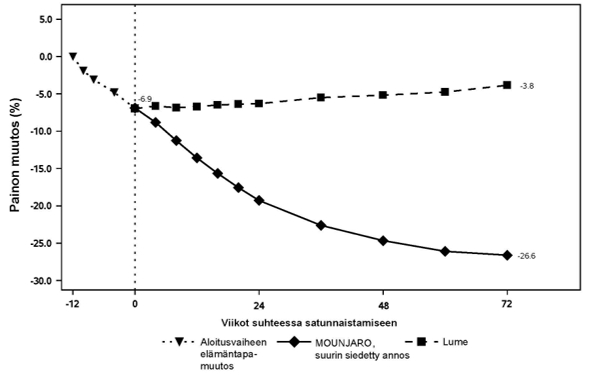
Kuva 10. Keskimääräinen painon muutos (%) viikolta 12 viikolle 72
SURMOUNT‑4
88 viikkoa kestäneessä tutkimuksessa 783 aikuispotilasta, joilla oli lihavuus (BMI ≥ 30 kg/m2) tai ylipaino (BMI ≥ 27 kg/m2 – < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus, otettiin 36 viikkoa kestäneeseen avoimeen aloitusvaiheeseen, jossa he kaikki saivat tirtsepatidia. Aloitusvaiheen alkaessa tutkimukseen otettujen potilaiden keskimääräinen paino oli 107,0 kg ja keskimääräinen BMI oli 38,3 kg/m2. Aloitusvaiheen lopussa 670 potilasta, jotka olivat saavuttaneet tirtsepatidin suurimman siedetyn annoksen 10 mg tai 15 mg, satunnaistettiin 52 viikon ajaksi joko jatkamaan tirtsepatidihoitoa kerran viikossa tai vaihtamaan lumelääkkeeseen (kaksoissokkoutettu vaihe). Potilaita ohjattiin noudattamaan vähäkalorista ruokavaliota ja lisäämään fyysistä aktiivisuutta koko tutkimuksen ajan. Satunnaistamishetkellä (viikko 36), potilaiden keskimääräinen ikä oli 49 vuotta ja 71 % potilaista oli naisia. Satunnaistamishetkellä potilaiden keskimääräinen paino oli 85,2 kg ja keskimääräinen BMI oli 30,5 kg/m2.
Potilaat, jotka jatkoivat tirtsepatidihoitoa vielä 52 viikkoa (eli yhteensä 88 viikkoa), säilyttivät 36 viikkoa kestäneen aloitusvaiheen aikana saavutetun painonlaskun ja heidän painonsa laski vielä lisää. Painonlasku oli suurempaa ja kliinisesti merkitsevää verrattuna lumeryhmään, jossa havaittiin huomattavaa aloitusvaiheessa laskeneen painon palautumista (ks. taulukko 12 ja kuva 11). Lumeryhmän potilailla havaittu keskimääräinen paino oli kuitenkin viikolla 88 pienempi kuin aloitusvaiheen alussa (ks. kuva 11).
Taulukko 12. SURMOUNT-4: Tulokset viikolla 88
Tirtsepatidi Suurin siedetty annos | Lumelääke | |
| mITT-populaatio (n) vain viikolle 36 mukana olleet potilaat | 335 | 335 |
| Paino | ||
| Paino (kg) viikolla 0 (lähtötilanne) | 106,7 | 107,8 |
| Paino (kg) viikolla 36 (satunnaistaminen) | 84,5 | 85,9 |
| Muutos (%) viikolta 36 viikolle 88 | –6,7†† | 14,8†† |
Ero (%) lumelääkkeeseen nähden viikolla 88 [95 % lv] | –21,4** [–22,9; –20,0] | - |
| Muutos (kg) viikolta 36 viikolle 88 | –5,7†† | 11,9†† |
Ero (kg) lumelääkkeeseen nähden viikolla 88 [95 % lv] | –17,6## [–18,8; –16,4] | - |
| Potilaita, joiden paino laski viikolta 0 viikolle 88 (%) | ||
| ≥ 5 % | 98,5** | 69,0 |
| ≥ 10 % | 94,0** | 44,4 |
| ≥ 15 % | 87,1** | 24,0 |
| ≥ 20 % | 72,6** | 11,6 |
Potilaita, jotka saivat ylläpidettyä ≥ 80 % 36 viikkoa kestäneen aloitusvaiheen aikana saavutetusta painonlaskusta viikolle 88 (%) | 93,4** | 13,5 |
| Vyötärönympärys (cm) | ||
| Lähtötilanne (viikko 0) | 114,9 | 115,6 |
| Satunnaistaminen (viikko 36) | 96,7 | 98,2 |
| Muutos satunnaistamisesta (viikko 36) | –4,6†† | 8,3†† |
Ero lumelääkkeeseen nähden [95 % lv] | –12,9** [–14,1; –11,7] | - |
††p < 0,001 verrattuna lähtötilanteeseen.
**p < 0,001 verrattuna lumelääkkeeseen; korjattu multiplisiteetin suhteen.
##p < 0,001 verrattuna lumelääkkeeseen; ei korjattu multiplisiteetin suhteen.
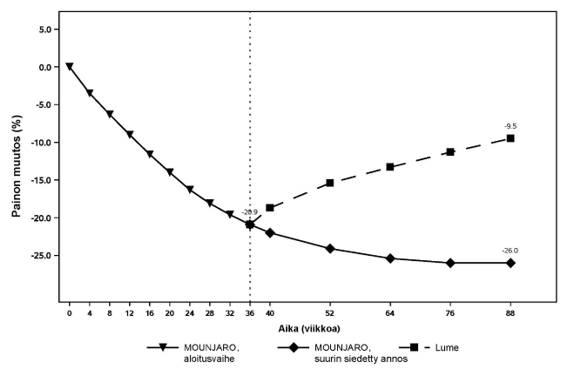
Kuva 11. Keskimääräinen painon muutos (%) lähtötilanteesta (viikko 0) viikolle 88
Riski painon palautumiseen tasolle > 95 % painosta lähtötilanteessa (viikko 0) viikkoon 88 mennessä
Time to event ‑analyysin perusteella niiden potilaiden, jotka pudottivat vähintään 5 % painostaan viikon 0 jälkeen, painon riski palata yli 95 %:iin viikon 0 aloituspainosta pieneni 99 %:lla tirtsepatidihoidolla kaksoissokkoutetussa vaiheessa verrattuna lumehoitoon (riskitiheyssuhde 0,013 [95 % lv, 0,004–0,046]; p < 0,001).
SURMOUNT 5 -tutkimus
72 viikkoa kestäneessä tutkimuksessa 751 aikuispotilasta, joilla oli lihavuus (BMI ≥ 30 kg/m²) tai ylipaino (BMI ≥ 27 kg/m² – < 30 kg/m²) ja vähintään yksi painoon liittyvä sairaus, satunnaistettiin saamaan 15 mg tirtsepatidia tai 2,4 mg semaglutidia kerran viikossa. Jos potilaat eivät sietäneet tätä annosta, vähennettiin annos 10 mg:aan tirtsepatidia tai 1,7 mg:aan semaglutidia kerran viikossa. Potilaita ohjattiin noudattamaan vähäkalorista ruokavaliota ja lisäämään fyysistä aktiivisuutta koko tutkimuksen ajan. Osallistujien keski-ikä oli 44,7 vuotta ja keskimääräinen BMI 39,4 kg/m². Kaikista osallistujista 64,7 % oli naisia.
Tirtsepatidihoito 72 viikon ajan johti suurempaan ja kliinisesti merkittävään painonlaskuun semaglutidiin verrattuna. Painon prosentuaalinen muutos lähtötasosta viikolla 72 (ensisijainen päätetapahtuma) oli -21,6 % tirtsepatidilla ja -15,4 % semaglutidilla (ero semaglutidiin: -6,2 %; 95 % lv [-7,8; -4,6]; p < 0,001). Tirtsepatidi osoitti myös paremmuuden semaglutidiin verrattuna keskeisissä toissijaisissa päätetapahtumissa, kuten ≥ 10 %, ≥ 15 %, ≥ 20 % ja ≥ 25 % painonlaskun saavuttaneiden potilaiden osuus viikolla 72 sekä vyötärönympäryksen pieneneminen viikolla 72.
Vaikutus kehon koostumukseen
SURMOUNT‑1‑tutkimuksen osatutkimuksessa arvioitiin kehon koostumuksen muutoksia kaksienergisellä röntgenabsorptiometrialla (DEXA). DEXA‑arvioinnin tulokset osoittivat, että tirtsepatidihoitoa saaneilla rasvamassa väheni enemmän kuin rasvaton massa, mikä paransi kehon koostumusta lumelääkkeeseen verrattuna 72 viikon jälkeen. Lisäksi rasvamassan kokonaismäärän pienenemiseen liittyi viskeraalirasvan väheneminen. Nämä tulokset viittaavat siihen, että suurin osa kokonaispainonlaskusta johtui rasvakudoksen, mukaan lukien viskeraalirasvan, vähenemisestä.
Fyysisen toimintakyvyn paraneminen
Tirtsepatidia saaneilla potilailla, joilla oli lihavuus tai ylipaino, ja joilla ei ollut diabetesta, havaittiin pieniä parannuksia terveyteen liittyvässä elämänlaadussa, mukaan lukien fyysinen toimintakyky. Parannukset olivat suurempia tirtsepatidihoitoa saaneilla potilailla kuin lumelääkettä saaneilla. Terveyteen liittyvä elämänlaatu arvioitiin yleisellä kyselylomakkeella Short Form‑36v2 Health Survey Acute, Version (SF‑36v2).
Obstruktiivinen uniapnea
Tirtsepatidin tehoa ja turvallisuutta keskivaikean tai vaikean (apnea-hypopneaindeksi, AHI > 15) obstruktiivisen uniapnean hoidossa yhdessä ruokavalion ja liikunnan kanssa potilailla, joilla oli lihavuus, arvioitiin kahdessa satunnaistetussa kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 tutkimuksessa (SURMOUNT-OSA-tutkimus 1 ja -tutkimus 2). Näihin tutkimuksiin osallistui yhteensä 469 aikuispotilasta, joilla oli keskivaikea tai vaikea obstruktiivinen uniapnea ja lihavuus (234 satunnaistettiin saamaan tirtsepatidihoitoa). Potilaat, joilla oli tyypin 2 diabetes, suljettiin pois. Tutkimukseen 1 osallistui potilaita, jotka eivät kyenneet tai halunneet käyttää ylipainehengityshoitoa (Positive Airway Pressure, PAP). Tutkimukseen 2 osallistui PAP-hoitoa saavia potilaita. Tutkimuksesta 2 ei voida tehdä johtopäätöksiä tirtsepatidin mahdollisesta lisähyödystä PAP-hoidon tueksi, koska PAP-hoito keskeytettiin 7 päivää ennen päätetapahtuman mittausta. Kaikkia potilaita hoidettiin suurimmalla siedetyllä annoksella (10 mg tai 15 mg) tirtsepatidia tai lumelääkettä kerran viikossa 52 viikon ajan.
Molemmissa tutkimuksissa tirtsepatidihoito osoitti tilastollisesti merkitsevän ja kliinisesti merkittävän apnea-hypopneaindeksin (AHI) laskun lumelääkkeeseen verrattuna (ks. taulukko 13). Tirtsepatidihoitoa saaneista potilaista suuremmalla osalla AHI-indeksi laski vähintään 50 % lumelääkkeeseen verrattuna.
SURMOUNT-OSA, tutkimus 1 ja tutkimus 2
Kahdessa 52 viikkoa kestäneessä kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa 469 aikuispotilasta, joilla oli keskivaikea tai vaikea obstruktiivinen uniapnea ja lihavuus, satunnaistettiin saamaan kerran viikossa tirtsepatidia suurimmalla siedetyllä annoksella (10 mg tai 15 mg) tai lumelääkettä. Tutkimuksessa 1 potilaiden keskimääräinen ikä oli 48 vuotta, ja 33 % potilaista oli naisia. Potilaista 35 %:lla oli keskivaikea obstruktiivinen uniapnea, 63 %:lla vaikea obstruktiivinen uniapnea, 65 %:lla diabeteksen esiaste, 76 %:lla kohonnut verenpaine, 10 %:lla sydänsairauksia ja 81 %:lla dyslipidemia. Potilaiden keskimääräinen Epworthin uneliaisuusasteikon (Epworth Sleepiness Scale, ESS) arvo oli 10,5. Tutkimuksessa 2 potilaiden keskimääräinen ikä oli 52 vuotta, ja 28 % potilaista oli naisia. Potilaista 31 %:lla oli keskivaikea obstruktiivinen uniapnea, 68 %:lla vaikea obstruktiivinen uniapnea, 57 %:lla diabeteksen esiaste, 77 %:lla kohonnut verenpaine, 11 %:lla sydänsairauksia ja 84 %:lla dyslipidemia. Potilaiden keskimääräinen ESS-arvo oli 10,0.
Taulukko 13. SURMOUNT-OSA, tutkimus 1 ja tutkimus 2: Tulokset viikolla 52
| SURMOUNT-OSA: tutkimus 1 | SURMOUNT-OSA: tutkimus 2 | ||
| Tirtsepatidi Suurin siedetty annos | Lumelääke | Tirtsepatidi Suurin siedetty annos | Lumelääke |
mITT-populaatio (n) | 114 | 120 | 119 | 114 |
AHI (katkoksia/h) | ||||
Lähtötilanteen keskiarvo | 54,3 | 50,9 | 45,8 | 53,1 |
Muutos lähtötilanteesta | –27,4†† | –4,8† | –30,4†† | –6,0† |
Ero lumelääkkeeseen nähden [95 % lv] | –22,5** [–28,7; –16,4] | - | –24,4** [–30,3; –18,6] | - |
Muutos AHI-arvossa (%) | ||||
Muutos (%) lähtötilanteesta | –55,0†† | –5,0 | –62,8†† | –6,4 |
Ero (%) lumelääkkeeseen nähden [95 % lv] | –49,9** [–62,8; –37,0] | - | –56,4** [–70,7; –42,2] | - |
Potilaat (%), jotka saavuttivat AHI-arvon laskun | ||||
≥ 50% | 62,3 | 19,2 | 74,3 | 22,9 |
Ero (%) lumelääkkeeseen nähden [95 % lv] | 43,6** [31,1; 56,2] | - | 50,8** [38,6; 62,9] | - |
Uniapneaspesifinen hypoksinen taakka (% min/h)a | ||||
Lähtötilanteen geometrinen keskiarvo | 156,6 | 148,2 | 129,9 | 139,1 |
Muutos lähtötilanteesta | –103,1†† | –21,1 | –103,0†† | –40,7† |
Ero lumelääkkeeseen nähden [95 % lv] | –82,0** [–107,0; –57,1] | - | –62,4** [–87,1; –37,6] | - |
Paino (kg) | ||||
Lähtötilanteen keskiarvo | 117,0 | 112,7 | 115,8 | 115,0 |
Muutos (%) lähtötilanteesta | –18,1†† | –1,3 | –20,1†† | –2,3† |
Ero (%) lumelääkkeeseen nähden [95 % lv] | –16,8** [–18,8; –14,7] | - | –17,8** [–19,9; –15,7] | - |
Systolinen verenpaine (mmHg)b | ||||
Lähtötilanteen keskiarvo | 128,2 | 130,3 | 130,7 | 130,5 |
Muutos lähtötilanteesta | –9,6†† | –1,7 | –7,6†† | –3,3† |
Ero lumelääkkeeseen nähden [95 % lv] | –7,9** [–11,0; –4,9] | - | –4,3* [–7,3; –1,2] | - |
hsCRP (mg/l)a |
|
|
|
|
Lähtötilanteen geometrinen keskiarvo | 3,6 | 3,8 | 3,0 | 2,7 |
Muutos lähtötilanteesta | –1,6†† | –0,8† | –1,4†† | –0,3 |
Ero lumelääkkeeseen nähden [95 % lv] | –0,8* [–1,4; –0,3] | - | –1,1** [–1,7; –0,5] | - |
† p < 0,05, ††p < 0,001 verrattuna lähtötilanteeseen.
* p < 0,05, **p < 0,001 verrattuna lumelääkkeeseen; korjattu multiplisiteetin suhteen.
a Analysoitu käyttäen logaritmimuunnettua aineistoa.
b Verenpaine arvioitiin viikolla 48, koska PAP-hoidon lopettaminen viikolla 52 voi sekoittaa verenpaineen arvioinnin.
Sydän- ja verisuonivaikutusten arviointi
Kardiovaskulaarista riskiä arvioitiin meta‑analyysillä potilailla, joilla oli vähintään yksi vahvistettu merkittävä sydän‑ ja verisuonihaittatapahtuma (major adverse cardiovascular event, MACE). Yhdistetty päätetapahtuma MACE‑4 sisälsi sydän‑ ja verisuoniperäisen kuoleman, ei‑fataalin sydäninfarktin, ei‑fataalin aivohalvauksen ja sairaalahoidon epästabiilin angina pectoriksen takia.
Vaiheen 2 ja 3 myyntilupatutkimusten ensisijaisessa meta‑analyysissa yhteensä 116 tyypin 2 diabetespotilasta (tirtsepatidi: 60 [n = 4 410]; kaikki vertailuhoidot: 56 [n = 2 169]) koki vähintään yhden vahvistetun sydän- ja verisuonitapahtuman (MACE-4): tulokset osoittivat, että tirtsepatidiin ei liittynyt sydän‑ ja verisuonitapahtumien riskin suurenemista verrattuna yhdistettyihin vertailuhoitoihin (riskitiheyssuhde [HR]: 0,81; lv: 0,52–1,26).
SURPASS‑4‑tutkimuksesta tehtiin erikseen lisäanalyysi. Kyseiseen tutkimukseen otettiin potilaita, joilla oli aiemmin todettu sydän‑ ja verisuonitauti. Yhteensä 109 potilasta (tirtsepatidi: 47 [n = 995]; glargininsuliini: 62 [n = 1 000]) koki vähintään yhden vahvistetun sydän- ja verisuonitapahtuman (MACE‑4): tulokset osoittivat, että tirtsepatidiin ei liittynyt sydän‑ ja verisuonitapahtumien riskin suurenemista verrattuna glargininsuliiniin (HR: 0,74; lv: 0,51–1,08).
Kolmessa lumekontrolloidussa painonhallintaa koskevassa vaiheen 3 tutkimuksessa (SURMOUNT 1–3) yhteensä 27 potilasta koki vähintään yhden vahvistetun MACE-tapahtuman (tirtsepatidi: 17 (n = 2 806); lumelääke: 10 (n = 1 250); tapahtumien määrät olivat samankaltaiset lume- ja tirtsepatidiryhmissä.
Verenpaine
Lumekontrolloiduissa vaiheen 3 tutkimuksissa aikuisten tyypin 2 diabetespotilailla tirtsepatidihoito alensi systolista verenpainetta keskimäärin 6–9 mmHg ja diastolista verenpainetta keskimäärin 3–4 mmHg. Lumelääkettä saaneilla potilailla sekä systolisen että diastolisen verenpaineen keskimääräinen lasku oli 2 mmHg.
Kolmessa lumekontrolloidussa painonhallintaa koskevassa vaiheen 3 tutkimuksessa (SURMOUNT 1–3) tirtsepatidihoito alensi systolista verenpainetta keskimäärin 7 mmHg ja diastolista verenpainetta keskimäärin 4 mmHg. Lumelääkettä saaneilla potilailla sekä systolisen että diastolisen verenpaineen keskimääräinen lasku oli < 1 mmHg.
Kahdessa lumekontrolloidussa obstruktiivista uniapneaa koskevassa vaiheen 3 tutkimuksessa, joissa tehtiin yhdistetty turvallisuusanalyysi, tirtsepatidihoitoa saaneilla potilailla systolinen verenpaine laski keskimäärin 9,0 mmHg ja diastolinen verenpaine keskimäärin 3,8 mmHg viikolla 52. Lumelääkettä saaneilla potilailla systolinen verenpaine laski keskimäärin 2,5 mmHg ja diastolinen verenpaine keskimäärin 1,0 mmHg viikolla 52.
Muut tiedot
Seerumin paastoglukoosi
SURPASS‑1–5-tutkimuksissa tirtsepatidihoito pienensi seerumin paastoglukoosiarvoa lähtötilanteesta merkitsevästi (muutokset lähtötilanteesta ensisijaiseen päätetapahtumaan olivat –2,4 mmol/l – –3,8 mmol/l). Seerumin paastoglukoosiarvon merkitsevää pienenemistä lähtötilanteesta havaittiin jo 2 viikon kohdalla. Seerumin paastoglukoosiarvo parani entisestään viikolle 42 asti, ja vaikutus säilyi pisimmän tutkimuksen keston ajan (104 viikkoa).
Aterianjälkeinen glukoosipitoisuus
SURPASS‑1–5-tutkimuksissa tirtsepatidihoito pienensi merkitsevästi 2 tunnin kuluttua ateriasta mitattujen glukoosipitoisuuksien keskiarvoa (keskiarvo 3 pääateriasta vuorokaudessa) lähtötilanteesta (muutokset lähtötilanteesta ensisijaiseen päätetapahtumaan olivat –3,35 mmol/l – –4,85 mmol/l).
Triglyseridit
SURPASS‑1–5‑tutkimuksissa tirtsepatidi pienensi seerumin triglyseridipitoisuuksia 15–19 % (5 mg), 18–27 % (10 mg) ja 21–25 % (15 mg).
40 viikkoa kestäneessä tutkimuksessa, jossa verrokkina oli semaglutidi 1 mg, tirtsepatidi pienensi seerumin triglyseridipitoisuuksia 19 % (5 mg), 24 % (10 mg) ja 25 % (15 mg) ja semaglutidi 12 % (1 mg).
72 viikkoa kestäneessä lumekontrolloidussa vaiheen 3 tutkimuksessa (SURMOUNT‑1) tirtsepatidi pienensi seerumin triglyseridipitoisuuksia 24 % (5 mg), 27 % (10 mg) ja 31 % (15 mg) ja lumelääke 6 % potilailla, joilla oli lihavuus tai ylipaino, ja joilla ei ollut tyypin 2 diabetesta.
72 viikkoa kestäneessä lumekontrolloidussa vaiheen 3 tutkimuksessa (SURMOUNT‑2) tirtsepatidi pienensi seerumin triglyseridipitoisuuksia 27 % (10 mg) ja 31 % (15 mg) ja lumelääke 6 % potilailla, joilla oli lihavuus tai ylipaino ja tyypin 2 diabetes.
Niiden potilaiden osuus, jotka saavuttivat HbA1c‑arvon < 5,7 % ilman kliinisesti merkittävää hypoglykemiaa
Neljässä tutkimuksessa, joissa tirtsepatidia ei käytetty yhdessä perusinsuliinin kanssa (SURPASS‑1–4), 93,6–100 %:lla potilaista, jotka saavuttivat tirtsepatidihoidon ensisijaisen päätetapahtuman käynnillä normoglykemian eli HbA1c‑arvon < 5,7 % (≤ 39 mmol/mol), arvon saavuttamiseen ei liittynyt kliinisesti merkittävää hypoglykemiaa. SURPASS‑5‑tutkimuksessa 85,9 %:lla tirtsepatidia saaneista potilaista, jotka saavuttivat HbA1c‑arvon < 5,7 % (≤ 39 mmol/mol), arvon saavuttamiseen ei liittynyt kliinisesti merkittävää hypoglykemiaa.
Erityisryhmät
Ikä, sukupuoli, etninen tausta, alue tai lähtötilanteen BMI, HbA1c‑arvo, diabeteksen kesto tai munuaisten vajaatoiminnan aste eivät vaikuttaneet tirtsepatidin tehoon tyypin 2 diabeteksen hoidossa.
Ikä, sukupuoli, etninen tausta, alue, lähtötilanteen BMI tai diabeteksen esiaste tai sen puuttuminen eivät vaikuttaneet tirtsepatidin tehoon painonhallinnassa.
Ikä, sukupuoli, etninen tausta, lähtötilanteen BMI tai obstruktiivisen uniapnean vaikeusaste lähtötilanteessa eivät vaikuttaneet tirtsepatidin tehoon keskivaikean tai vaikean obstruktiivisen uniapnean hoidossa potilailla, joilla oli lihavuus.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Mounjaro‑valmisteen käytöstä tyypin 2 diabeteksen hoidossa ja painonhallinnassa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdat Annostus ja antotapa, Haittavaikutukset ja Farmakodynamiikka ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Tirtsepatidi koostuu 39 aminohaposta. Siihen on kiinnittyneenä C20‑dirasvahappo‑osa, joka mahdollistaa albumiiniin sitoutumisen ja pidentää puoliintumisaikaa.
Imeytyminen
Tirtsepatidin enimmäispitoisuus saavutetaan 8–72 tunnissa annoksen ottamisesta. Vakaan tilan altistus saavutetaan 4 viikon kuluttua kerran viikossa tapahtuvalla annolla. Tirtsepatidialtistus suurenee suhteessa annokseen.
Kun tirtsepatidi annettiin vatsan, reiden tai olkavarren ihon alle, altistus oli samaa luokkaa.
Ihon alle annetun tirtsepatidin absoluuttinen biologinen hyötyosuus oli 80 %.
Jakautuminen
Ihon alle annetun tirtsepatidin näennäinen keskimääräinen vakaan tilan jakautumistilavuus on noin 10,3 l potilailla, joilla on tyypin 2 diabetes, ja noin 9,7 l potilailla, joilla on lihavuus.
Suuri osa tirtsepatidista (99 %) sitoutuu plasman albumiiniin.
Biotransformaatio
Tirtsepatidi metaboloituu peptidirungon proteolyysin, C20‑dirasvahappo‑osan beetaoksidaation ja amidihydrolyysin kautta.
Eliminaatio
Tirtsepatidin näennäisen puhdistuman keskiarvo populaatiossa on noin 0,06 l/h ja eliminaation puoliintumisaika noin 5 vuorokautta, mikä mahdollistaa annon kerran viikossa.
Tirtsepatidi eliminoituu metaboloitumalla. Tirtsepatidin metaboliitit erittyvät pääasiallisesti virtsan ja ulosteen kautta. Muuttumatonta tirtsepatidia ei ole havaittu virtsassa eikä ulosteessa.
Erityisryhmät
Ikä, sukupuoli, etninen tausta ja paino
Ikä, sukupuoli, etninen tausta tai paino eivät vaikuta kliinisesti merkittävästi tirtsepatidin farmakokinetiikkaan. Populaatiofarmakokinetiikan analyysin perusteella tirtsepatidialtistus lisääntyy painon laskiessa. Painon vaikutus tirtsepatidin farmakokinetiikkaan ei kuitenkaan vaikuta olevan kliinisesti merkittävää.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta ei vaikuta tirtsepatidin farmakokinetiikkaan. Tirtsepatidin farmakokinetiikkaa arvioitiin 5 mg:n kerta‑annoksen jälkeen eriasteisen munuaisten vajaatoiminnan yhteydessä (lievä, keskivaikea, vaikea, loppuvaiheen munuaisten vajaatoiminta) verrattuna tutkittaviin, joiden munuaistoiminta oli normaalia. Kliinisesti merkittäviä eroja ei havaittu. Tämä on osoitettu myös sekä tyypin 2 diabetesta että munuaisten vajaatoimintaa sairastavilla potilailla kliinisistä tutkimuksista saatujen tietojen perusteella.
Maksan vajaatoiminta
Maksan vajaatoiminta ei vaikuta tirtsepatidin farmakokinetiikkaan. Tirtsepatidin farmakokinetiikkaa arvioitiin 5 mg:n kerta‑annoksen jälkeen eriasteisen maksan vajaatoiminnan yhteydessä (lievä, keskivaikea, vaikea) verrattuna tutkittaviin, joiden maksatoiminta oli normaalia. Kliinisesti merkittäviä eroja ei havaittu.
Pediatriset potilaat
Tirtsepatidia (5 mg ja 10 mg) saaneiden tyypin 2 diabetesta sairastavien 10–18 -vuotiaiden lasten ja nuorten altistus oli verrattavissa aikuisilla havaittuun altistukseen suositelluilla annoksilla.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta tai genotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Tirtsepatidia koskeva kahden vuoden pituinen karsinogeenisuustutkimus toteutettiin uros‑ ja naarasrotilla, joille annettiin 0,15 mg/kg, 0,50 mg/kg ja 1,5 mg/kg annoksia (0,12, 0,36 ja 1,02 kertaa ihmisen suurin suositusannos [MRHD] AUC‑arvon perusteella) injektiona ihon alle kahdesti viikossa. Tirtsepatidi lisäsi kilpirauhasen C‑solukasvaimia (adenoomia ja karsinoomia) kaikilla annoksilla verrokkeihin verrattuna. Löydösten kliinistä merkitystä ihmisellä ei tunneta.
Kun kuuden kuukauden pituisessa karsinogeenisuustutkimuksessa rasH2‑siirtogeenisille hiirille annettiin 1 mg/kg, 3 mg/kg ja 10 mg/kg tirtsepatidiannoksia injektiona ihon alle kahdesti viikossa, kilpirauhasen C‑soluhyperplasian tai ‑neoplasian ilmaantuvuus ei suurentunut millään annoksella.
Eläinkokeissa ei ole havaittu tirtsepatidin aiheuttaneen suoria hedelmällisyyteen kohdistuvia haittavaikutuksia.
Nuorilla rotilla tirtsepatidi aiheutti viivästynyttä sukupuolista kypsymistä sekä uroksilla että naarailla, mikä johtui kehonpainoon liittyvistä toissijaisista farmakologisista vaikutuksista. Havainnot eivät viitanneet erityiseen riskiin pediatrisilla potilailla.
Lisääntymistutkimuksissa eläimillä tirtsepatidi aiheutti sikiön kasvun hidastumista ja sikiöpoikkeavuuksia AUC‑arvon perusteella MRHD‑altistuksia pienemmillä altistuksilla. Rotilla havaittiin ulkoisten, sisäelinten ja luuston epämuodostumien ja sisäelinten ja luuston kehitysvariaatioiden ilmaantuvuuden lisääntymistä. Rotilla ja kaniineilla havaittiin sikiön kasvun hidastumista. Kaikki kehityshäiriöt ilmaantuivat emolle toksisilla annoksilla.
Farmaseuttiset tiedot
Apuaineet
Esitäytetty kynä (KwikPen), moni-annos
dinatriumvetyfosfaatti (heptahydraatti) (E339)
bentsyylialkoholi (E1519)
glyseroli
fenoli
natriumkloridi
väkevä kloorivetyhappo (pH:n säätäminen)
natriumhydroksidi (pH:n säätäminen)
injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Esitäytetty kynä (KwikPen), moniannos
Ennen käyttöä
2 vuotta
Ensimmäisen käyttökerran jälkeen
30 vuorokautta. Säilytä huoneenlämmössä (muualla kuin jääkaapissa) alle 30 °C:ssa. Esitäytetty KwikPen-kynä on hävitettävä 30 vuorokauden kuluttua ensimmäisestä käyttökerrasta.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Esitäytetty kynä (KwikPen), moniannos
Säilytysolosuhteet lääkevalmisteen ensimmäisen käyttökerran jälkeen, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
MOUNJARO KWIKPEN injektioneste, liuos, esitäytetty kynä
2,5 mg/annos (L:ei) 1 kpl (4 annosta (4,17 mg/ml)) (213,54 €)
5 mg/annos (L:ei) 1 kpl (4 annosta (8,33 mg/ml)) (285,36 €)
7,5 mg/annos (L:ei) 1 kpl (4 annosta (12,5 mg/ml)) (393,10 €)
10 mg/annos (L:ei) 1 kpl (4 annosta (16,7 mg/ml)) (393,10 €)
12,5 mg/annos (L:ei) 1 kpl (4 annosta (20,8 mg/ml)) (500,83 €)
15 mg/annos (L:ei) 1 kpl (4 annosta (25 mg/ml)) (500,83 €)
PF-selosteen tieto
Esitäytetty kynä (KwikPen), moniannos
Kirkas lasinen sylinteriampulli esitäytetyssä moniannoskynässä.
Yksi esitäytetty KwikPen-kynä sisältää 2,4 millilitraa injektionestettä (4 annosta, à 0,6 ml). Jokaisessa kynässä on ylimäärä injektionestettä kynän käyttövalmiuden tarkistamista varten. Tämän ylimääräisen lääkevalmisteen pistäminen johtaa epätäydelliseen annokseen, vaikka kynässä olisi vielä lääkevalmistetta jäljellä. Neulat eivät sisälly pakkaukseen.
Pakkauskoot: 1 ja 3 esitäytettyä KwikPen-kynää. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön tai hiukan kellertävä liuos.
Käyttö- ja käsittelyohjeet
Käyttöohjeet
Mounjaro‑valmiste on tarkastettava silmämääräisesti ennen käyttöä ja hävitettävä, jos siinä on hiukkasia tai värivirheitä.
Jäätynyttä Mounjaro‑valmistetta ei saa käyttää.
Esitäytetty kynä (KwikPen), moniannos
Esitäytetty KwikPen-kynä on moniannoskynä. Yksi KwikPen-kynä sisältää 4 annosta. Kynä on hävitettävä neljän viikoittaisen annoksen jälkeen.
Pakkausselosteen mukana olevia KwikPen-kynän käyttöohjeita on noudatettava huolellisesti.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
MOUNJARO KWIKPEN injektioneste, liuos, esitäytetty kynä
2,5 mg/annos 1 kpl
5 mg/annos 1 kpl
7,5 mg/annos 1 kpl
10 mg/annos 1 kpl
12,5 mg/annos 1 kpl
15 mg/annos 1 kpl
- Ei korvausta.
ATC-koodi
A10BX16
Valmisteyhteenvedon muuttamispäivämäärä
22.01.2026
Yhteystiedot
 OY ELI LILLY FINLAND AB
OY ELI LILLY FINLAND AB Mannerheimintie 117
00280 Helsinki
09 854 5250
www.lilly.com/fi
medinfo_finland@lilly.com
Lääketietopalvelu puh. 0800-140 240
