CAMZYOS kapseli, kova 2,5 mg, 5 mg, 10 mg, 15 mg
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
CAMZYOS 2,5 mg kovat kapselit
Yksi kova kapseli sisältää 2,5 mg mavakamteenia (mavacamten).
CAMZYOS 5 mg kovat kapselit
Yksi kova kapseli sisältää 5 mg mavakamteenia (mavacamten).
CAMZYOS 10 mg kovat kapselit
Yksi kova kapseli sisältää 10 mg mavakamteenia (mavacamten).
CAMZYOS 15 mg kovat kapselit
Yksi kova kapseli sisältää 15 mg mavakamteenia (mavacamten).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova kapseli (kapseli)
Kliiniset tiedot
Käyttöaiheet
CAMZYOS on tarkoitettu aikuisille oireisen obstruktiivisen hypertrofisen kardiomyopatian (New York Heart Association, NYHA-luokka II–III) hoitoon (ks. kohta Farmakodynamiikka).
Ehto
Hoito on aloitettava valmisteen käyttöaiheissa mainittujen sairauksien hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito on aloitettava kardiomyopatiapotilaiden hoitoon perehtyneen lääkärin valvonnassa.
Potilaan vasemman kammion ejektiofraktio (LVEF) on arvioitava sydämen ultraäänitutkimuksella ennen hoidon aloittamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos LVEF on < 55 %, hoitoa ei pidä aloittaa.
Ennen hoidon aloittamista naisille, jotka voivat tulla raskaaksi, on tehtävä raskaustesti, jonka tuloksen on oltava negatiivinen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys).
Potilaille on tehtävä sytokromi P450 (CYP) 2C19:n (CYP 2C19:n) genotyypitys, jotta voidaan määrittää sopiva mavakamteeniannos. Potilailla, jotka ovat fenotyypiltään hitaita CYP 2C19:n metaboloijia, mavakamteenialtistus voi olla suurentunut (jopa 3‑kertaisesti), mikä voi suurentaa systolisen toimintahäiriön riskiä verrattuna normaaleihin metaboloijiin (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Jos hoito aloitetaan ennen CYP 2C19:n fenotyypin määrittämistä, potilaiden on noudatettava hitaiden metaboloijien annostusohjeita (ks. kuvat 1 ja 3 ja taulukko 1), kunnes CYP 2C19:n fenotyyppi on määritetty.
Annostus
Annos voi olla 2,5–15 mg (eli joko 2,5 mg, 5 mg, 10 mg tai 15 mg).
Fenotyypiltään hidas CYP 2C19:n metaboloija
Suositeltu aloitusannos on 2,5 mg suun kautta kerran vuorokaudessa. Enimmäisannos on 5 mg kerran vuorokaudessa. Potilaan varhainen kliininen vaste arvioidaan Valsalvan kokeen aikana mitatulla vasemman kammion ulosvirtauskanavan (LVOT) gradientilla 4 ja 8 viikon kuluttua hoidon aloittamisesta (ks. kuva 1).
Fenotyypiltään normaalia hitaampi, normaali, normaalia nopeampi tai erittäin nopea CYP 2C19:n metaboloija
Suositeltu aloitusannos on 5 mg suun kautta kerran vuorokaudessa. Enimmäisannos on 15 mg kerran vuorokaudessa. Potilaan varhainen kliininen vaste arvioidaan Valsalvan kokeen aikana mitatulla LVOT:n gradientilla 4 ja 8 viikon kuluttua hoidon aloittamisesta (ks. kuva 2).
Kun yksilöllinen ylläpitoannos on saavutettu ja LVEF on ≥ 55 %, potilaan tila on arvioitava 6 kuukauden välein. Jos potilaan LVEF on 50–< 55 % Valsalvan kokeen LVOT:n gradientista riippumatta, potilaan tila on arvioitava 3 kuukauden välein (ks. kuva 3). Jos potilaan LVEF on yhdelläkin käynnillä < 50 %, hoito on keskeytettävä 4 viikon ajaksi ja kunnes LVEF on jälleen ≥ 50 % (ks. kuva 4).
Jos potilaalla on samanaikaisesti jokin muu sairaus, kuten vakava infektio tai rytmihäiriö (mukaan lukien eteisvärinä tai muu hoitamaton takyarytmia), joka voi heikentää systolista toimintaa, suositellaan LVEF:n arviointia. Annoksen suurentamista ei suositella ennen kuin muu samanaikainen sairaus on parantunut (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoidon lopettamista on harkittava, jos vastetta ei ole todettu (esimerkiksi oireet eivät ole lievittyneet eivätkä elämänlaatu, fyysinen suorituskyky tai LVOT:n gradientti ole parantuneet) sen jälkeen, kun potilas on saanut suurinta siedettyä annosta 4–6 kuukautta.
Kuva 1. Hoidon aloittaminen fenotyypiltään hitaalle CYP 2C19:n metaboloijalle
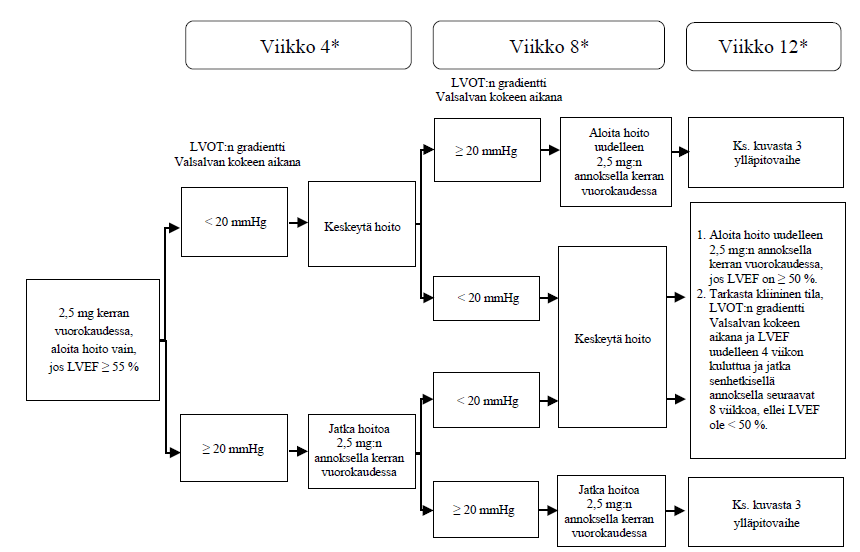
* Keskeytä hoito, jos LVEF on < 50 % millä tahansa vastaanottokäynnillä; aloita hoito uudelleen 4 viikon kuluttua, jos LVEF on ≥ 50 % (ks. kuva 4).
LVEF = vasemman kammion ejektiofraktio; LVOT = vasemman kammion ulosvirtauskanava
Kuva 2. Hoidon aloittaminen fenotyypiltään normaalia hitaammalle, normaalille, normaalia nopeammalle tai erittäin nopealle CYP 2C19:n metaboloijalle
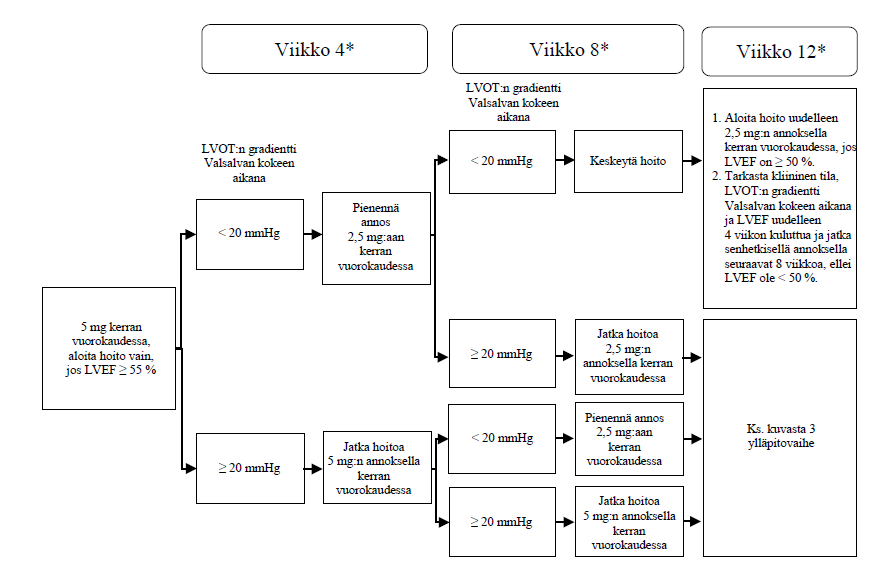
* Keskeytä hoito, jos LVEF on < 50 % millä tahansa vastaanottokäynnillä; aloita hoito uudelleen 4 viikon kuluttua, jos LVEF on ≥ 50 % (ks. kuva 4).
LVEF = vasemman kammion ejektiofraktio; LVOT = vasemman kammion ulosvirtauskanava
Kuva 3. Ylläpitovaihe
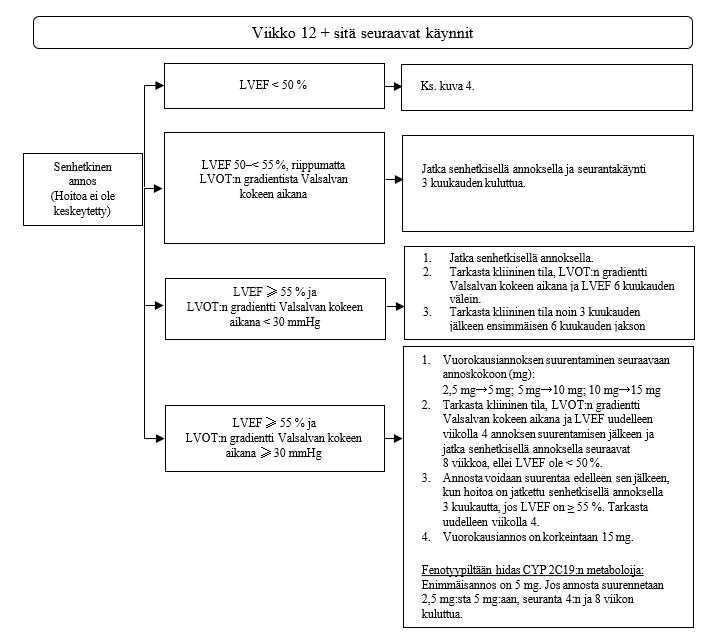
LVEF = vasemman kammion ejektiofraktio; LVOT = vasemman kammion ulosvirtauskanava
Kuva 4. Hoidon keskeyttäminen millä tahansa vastaanottokäynnillä, jos LVEF < 50 %
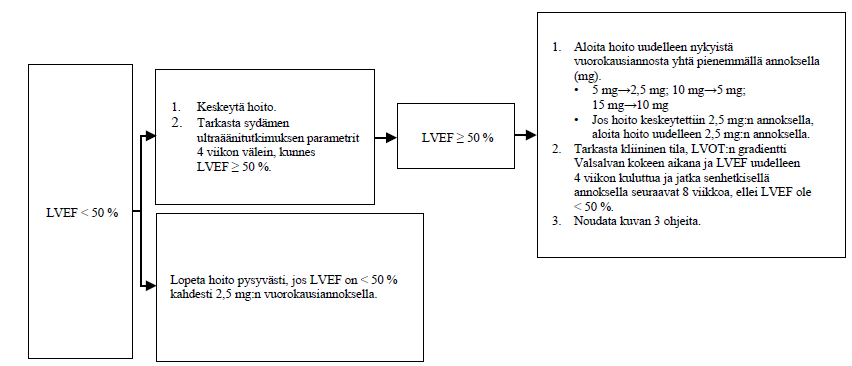
LVEF = vasemman kammion ejektiofraktio; LVOT = vasemman kammion ulosvirtauskanava
Annoksen säätäminen käytettäessä samanaikaisesti muita lääkkeitä
Jos potilaan hoidossa käytetään samanaikaisesti CYP 2C19:n tai CYP 3A4:n estäjiä tai indusoreita, on noudatettava taulukon 1 vaiheita (ks. myös kohta Yhteisvaikutukset).
Taulukko 1. Mavakamteeniannoksen säätäminen käytettäessä samanaikaisesti muita lääkkeitä
| Muu samanaikaisesti käytettävä lääke | Fenotyypiltään hidas CYP 2C19:n metaboloija* | Fenotyypiltään normaalia hitaampi, normaali, normaalia nopeampi tai erittäin nopea CYP 2C19:n metaboloija |
|---|---|---|
| Estäjät | ||
| Voimakkaan CYP 2C19:n estäjän ja voimakkaan CYP 3A4:n estäjän yhdistelmäkäyttö | Käyttö vasta-aiheista (ks. kohta Vasta-aiheet) | Käyttö vasta-aiheista (ks. kohta Vasta-aiheet) |
| Voimakas CYP 2C19:n estäjä | Annosta ei tarvitse muuttaa (ks. kohta Yhteisvaikutukset).
Jos CYP 2C19:n fenotyyppiä ei ole vielä määritetty: Aloitusannosta 2,5 mg ei tarvitse muuttaa. Annos on pienennettävä 5 mg:sta 2,5 mg:aan, tai hoito on keskeytettävä, jos annos on 2,5 mg (ks. kohta Yhteisvaikutukset). | Aloita mavakamteeni 2,5 mg:n annoksella.
Annos on pienennettävä 15 mg:sta 5 mg:aan ja 10 mg:sta ja 5 mg:sta 2,5 mg:aan tai hoito on keskeytettävä, jos annos on 2,5 mg (ks. kohta Yhteisvaikutukset). |
| Voimakas CYP 3A4:n estäjä | Käyttö vasta-aiheista (ks. kohta Vasta-aiheet) | Annosta ei tarvitse muuttaa (ks. kohta Yhteisvaikutukset). |
| Keskivahva CYP 2C19:n estäjä | Annosta ei tarvitse muuttaa.
Jos CYP 2C19:n fenotyyppiä ei ole vielä määritetty: Aloitusannosta 2,5 mg ei tarvitse muuttaa. Annos on pienennettävä 5 mg:sta 2,5 mg:aan, tai hoito on keskeytettävä, jos annos on 2,5 mg (ks. kohta Yhteisvaikutukset). | Aloitusannosta 5 mg ei tarvitse muuttaa. Annosta on pienennettävä yhdellä annoskoolla tai hoito on keskeytettävä, jos annos on 2,5 mg (ks. kohta Yhteisvaikutukset). |
| Keskivahva tai heikko CYP 3A4:n estäjä | Aloitusannosta 2,5 mg ei tarvitse muuttaa. Jos potilaan mavakamteeniannos on 5 mg, annos on pienennettävä 2,5 mg:aan (ks. kohta Yhteisvaikutukset). | Annosta ei tarvitse muuttaa (ks. kohta Yhteisvaikutukset). |
| Indusorit | ||
| Voimakkaan CYP 2C19:n indusorin ja voimakkaan CYP 3A4:n indusorin lopettaminen tai annoksen pienentäminen | Annos on pienennettävä 5 mg:sta 2,5 mg:aan, tai hoito on keskeytettävä, jos annos on 2,5 mg (ks. kohta Yhteisvaikutukset). | Annosta on pienennettävä yhdellä annostasolla, jos annos on 5 mg tai suurempi, kun vahvojen indusoreiden hoito keskeytetään tai annosta pienennetään mavakamteenihoidon aikana (ks. kohta Yhteisvaikutukset). Annosta ei tarvitse muuttaa, jos annoskoko on 2,5 mg. |
| Keskivahvan tai heikon CYP 3A4:n indusorin lopettaminen tai annoksen pienentäminen | Mavakamteeniannos on pienennettävä 2,5 mg:aan, tai hoito on keskeytettävä, jos annoskoko on 2,5 mg (ks. kohta Yhteisvaikutukset). | Annosta ei tarvitse muuttaa (ks. kohta Yhteisvaikutukset). |
* sisältää potilaat, joiden CYP 2C19:n fenotyyppiä ei ole vielä määritetty.
Annoksen ottaminen unohtuu tai viivästyy
Jos annos unohtuu, se on otettava mahdollisimman pian ja seuraava annos on otettava seuraavana päivänä totutun aikataulun mukaisesti. Saman vuorokauden aikana ei pidä ottaa kahta annosta.
Erityisryhmät
Iäkkäät
Annosta ja titrausaikataulua ei tarvitse muuttaa 65 vuotta täyttäneille potilaille (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Lievää (arvioitu glomerulusten suodatusnopeus [eGFR] 60–89 ml/min/1,73 m2) tai keskivaikeaa (eGFR 30–59 ml/min/1,73 m2) munuaisten vajaatoimintaa sairastavien potilaiden annosta ja titrausaikataulua ei tarvitse muuttaa. Annossuositusta ei voida antaa vaikeaa (eGFR < 30 ml/min/1,73 m2) munuaisten vajaatoimintaa sairastaville potilaille, koska mavakamteenia ei ole tutkittu vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Mavakamteenin aloitusannos on 2,5 mg kaikille lievää (Child-Pughin luokka A) tai keskivaikeaa (Child-Pughin luokka B) maksan vajaatoimintaa sairastaville potilaille, sillä mavakamteenialtistus todennäköisesti suurenee (ks. kohta Farmakokinetiikka). Annossuosituksia ei voida antaa vaikeaa (Child-Pughin luokka C) maksan vajaatoimintaa sairastaville potilaille, koska mavakamteenia ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavilla potilailla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Mavakamteenin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Turvallisuussyistä mavakamteenia ei pidä antaa alle 12-vuotiaille lapsille.
Antotapa
Suun kautta.
Hoito otetaan kerran vuorokaudessa suunnilleen samaan kellonaikaan joko aterian yhteydessä tai tyhjään mahaan. Kapseli on nielaistava kokonaisena veden kanssa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Raskauden aikana ja käyttö naisille, jotka voivat tulla raskaaksi eivätkä käytä tehokasta ehkäisyä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys).
- Voimakkaiden CYP 3A4:n estäjien samanaikainen käyttö potilaille, jotka ovat fenotyypiltään hitaita CYP 2C19:n metaboloijia tai joiden CYP 2C19:n fenotyyppiä ei ole määritetty (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
- Samanaikainen hoito voimakkaan CYP 2C19:n estäjän ja voimakkaan CYP 3A4:n estäjän yhdistelmän kanssa (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Systolinen toimintahäiriö, jonka määritelmänä on oireinen LVEF < 50 %
Mavakamteeni pienentää vasemman kammion ejektiofraktiota (LVEF) ja saattaa aiheuttaa sydämen vajaatoimintaa systolisen toimintahäiriön seurauksena, jonka määritelmänä on oireinen LVEF < 50 %. Systolisen toimintahäiriön riski ja riski sen etenemiselle sydämen vajaatoiminnaksi saattaa olla suurentunut potilailla, joilla on samanaikaisesti jokin vakava sairaus, kuten infektio tai rytmihäiriö (mukaan lukien eteisvärinä tai muu hoitamaton takyarytmia) tai joille tehdään vaativa sydänleikkaus (ks. kohta Haittavaikutukset). Seuraavat oireet ja löydökset voivat viitata systoliseen toimintahäiriöön ja edellyttävät sydäntoiminnan välitöntä arviointia: hengenahdistuksen alkaminen tai paheneminen, rintakipu, uupumus, sydämentykytykset, jalkojen turvotus ja B‑tyypin natriureettisen N‑terminaalisen propeptidin (NT‑proBNP) pitoisuuden suureneminen. LVEF on mitattava ennen hoidon aloittamista, ja sitä on seurattava tarkasti myös hoidon aikana. Hoidon keskeyttäminen voi olla tarpeen, jotta voidaan varmistaa, että LVEF pysyy ≥ 50 % (ks. kohta Annostus ja antotapa).
Yhteisvaikutuksista johtuva sydämen vajaatoiminnan riski tai mavakamteenivasteen häviäminen
Mavakamteeni metaboloituu pääasiassa CYP 2C19:n ja vähäisemmässä määrin CYP 3A4:n välityksellä sekä enimmäkseen CYP 3A4:n välityksellä hitailla CYP 2C19:n metaboloijilla, mikä saattaa johtaa seuraaviin yhteisvaikutuksiin (ks. kohta Yhteisvaikutukset):
- Voimakkaan tai keskivahvan CYP 3A4:n estäjän tai minkä tahansa CYP 2C19:n estäjän aloittaminen tai annoksen suurentaminen saattaa suurentaa systolisen toimintahäiriön aiheuttaman sydämen vajaatoiminnan riskiä.
- Minkä tahansa CYP 3A4:n tai CYP 2C19:n estäjän lopettamisen tai annoksen pienentämisen seurauksena hoitovaste mavakamteenille voi hävitä.
- Voimakkaan CYP 3A4:n tai voimakkaan CYP 2C19:n indusorin aloittamisen seurauksena hoitovaste mavakamteenille voi hävitä.
- Voimakkaan CYP 3A4:n tai voimakkaan CYP 2C19:n indusorin lopettaminen saattaa suurentaa systolisen toimintahäiriön aiheuttaman sydämen vajaatoiminnan riskiä.
Sekä ennen mavakamteenihoidon aloittamista että hoidon aikana on huomioitava mahdolliset yhteisvaikutukset muiden lääkevalmisteiden, myös itsehoitolääkkeiden (kuten omepratsolin ja esomepratsolin) kanssa.
- Samanaikainen hoito voimakkaiden CYP 3A4:n estäjien kanssa on vasta-aiheista potilaille, jotka ovat fenotyypiltään hitaita CYP 2C19:n metaboloijia tai joiden CYP 2C19:n fenotyyppiä ei ole määritetty (ks. kohta Vasta-aiheet).
- Samanaikainen hoito voimakkaan CYP 2C19:n estäjän ja voimakkaan CYP 3A4:n estäjän yhdistelmän kanssa on vasta-aiheista (ks. kohta Vasta-aiheet)
- Mavakamteenin annosta on mahdollisesti säädettävä ja/tai potilasta seurattava tarkasti, jos samanaikainen hoito lääkevalmisteilla, jotka ovat CYP 2C19:n tai CYP 3A4:n estäjiä tai indusoreita, aloitetaan tai lopetetaan tai näiden annosta muutetaan (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset). Näiden lääkevalmisteiden antoa jaksoittaisesti ei suositella (ks. kohta Yhteisvaikutukset).
Samanaikainen käyttö negatiivisten inotrooppien kanssa
Mavakamteenin ja disopyramidin samanaikaisen käytön turvallisuutta tai mavakamteenin käytön turvallisuutta potilailla, jotka ottavat beetasalpaajia yhdessä verapamiilin tai diltiatseemin kanssa, ei ole varmistettu. Siksi näitä lääkevalmisteita samanaikaisesti käyttäviä potilaita on seurattava tarkasti (ks. kohta Yhteisvaikutukset).
Alkio- ja sikiötoksisuus
Eläinkokeiden perusteella mavakamteenin epäillään aiheuttavan alkio- ja sikiötoksisuutta, jos sitä annetaan raskaana oleville naisille (ks. kohta Prekliiniset tiedot turvallisuudesta). Sikiöön kohdistuvan riskin takia CAMZYOS on vasta-aiheista raskauden aikana sekä naisille, jotka voivat tulla raskaaksi eivätkä käytä tehokasta ehkäisyä. Ennen hoidon aloittamista naisille, jotka voivat tulla raskaaksi, on kerrottava sikiöön kohdistuvasta riskistä ja tehtävä raskaustesti, jonka tuloksen on oltava negatiivinen. Lisäksi naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 6 kuukauden ajan hoidon päättymisen jälkeen (ks. kohdat Vasta-aiheet ja Raskaus ja imetys).
Natriumpitoisuus
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per kapseli eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Farmakodynaamiset yhteisvaikutukset
Jos mavakamteenihoitoa saavalle potilaalle aloitetaan hoito uudella negatiivisella inotroopilla tai jos negatiivisen inotroopin annosta suurennetaan, tarvitaan tarkkaa lääketieteellistä valvontaa LVEF-seurantoineen, kunnes annos on vakiintunut ja kliininen vaste on saavutettu (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus mavakamteeniin
Normaalia hitaammilla, normaaleilla, normaalia nopeammilla tai erittäin nopeilla CYP 2C19:n metaboloijilla mavakamteeni metaboloituu pääasiassa CYP 2C19:n välityksellä ja vähäisemmässä määrin CYP 3A4:n välityksellä. Hitailla CYP 2C19:n metaboloijilla metaboloituminen tapahtuu enimmäkseen CYP 3A4:n välityksellä (ks. kohta Farmakokinetiikka). Siksi CYP 2C19:n estäjät tai indusorit ja CYP 3A4:n estäjät tai indusorit voivat vaikuttaa mavakamteenin puhdistumaan ja joko suurentaa tai pienentää mavakamteenin pitoisuutta plasmassa; tämä riippuu CYP 2C19:n fenotyypistä.
Kaikissa kliinisissä lääkkeiden yhteisvaikutustutkimuksissa oli mukana pääasiassa normaaleja CYP 2C19:n metaboloijia eikä hitaita CYP 2C19:n metaboloijia otettu mukaan lääkkeiden yhteisvaikutusten arviointiin. Siksi ei ole täysin varmaa, miten CYP 2C19:n ja CYP 3A4:n estäjien samanaikainen anto mavakamteenin kanssa vaikuttaa hitailla CYP 2C19:n metaboloijilla.
Taulukossa 2 on suositukset annoksen säätämiseen ja/tai lisäseurantaan potilaille, jotka aloittavat tai lopettavat samanaikaisen hoidon lääkevalmisteella, joka on CYP 2C19:n tai CYP 3A4:n estäjä tai CYP 2C19:n tai CYP 3A4:n indusori, tai joilla näiden annosta muutetaan.
Voimakas CYP 2C19:n estäjä yhdessä voimakkaan CYP 3A4:n estäjän kanssa
Mavakamteenin samanaikainen anto voimakkaan CYP 2C19:n estäjän ja voimakkaan CYP 3A4:n estäjän yhdistelmän kanssa on vasta-aiheista (ks. kohta Vasta-aiheet).
CYP 2C19:n estäjät
Keskivahvan ja voimakkaan CYP 2C19:n estäjän vaikutusta mavakamteenin farmakokinetiikkaan ei ole tutkittu kliinisissä lääkkeiden yhteisvaikutustutkimuksissa. Voimakkaan CYP 2C19:n estäjän (esim. tiklopidiinin) vaikutus on samankaltainen kuin hitaan CYP 2C19:n metaboloijan vaikutus (ks. taulukko 1).
Kun mavakamteenia annettiin yhdessä heikon CYP 2C19:n estäjän (omepratsolin) kanssa, mavakamteenin AUCinf-arvo suureni 48 %, mutta Cmax-arvoon tällä ei ollut vaikutusta normaaleilla CYP 2C19:n metaboloijilla.
CYP 2C19:n estäjän (kuten omepratsolin tai esomepratsolin) jaksoittaista antoa ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
CYP 3A4:n estäjät
Voimakkaan CYP 3A4:n estäjän vaikutusta mavakamteenin farmakokinetiikkaan ei ole tutkittu kliinisissä lääkkeiden yhteisvaikutustutkimuksissa. Kun mavakamteenia annetaan yhdessä voimakkaan CYP 3A4:n estäjän (itrakonatsolin) kanssa normaaleille CYP 2C19:n metaboloijille, mavakamteenin pitoisuus plasmassa odotettavasti suurenee: AUC0‑24 suurenee enimmillään 59 % ja Cmax enimmillään 40 %.
Kun mavakamteenia annettiin yhdessä kohtalaisen CYP 3A4:n estäjän (verapamiilin) kanssa normaaleille CYP 2C19:n metaboloijille, mavakamteenin pitoisuus plasmassa suureni siten, että AUCinf oli 16 % ja Cmax oli 52 % suurempi. Tätä muutosta ei pidetty kliinisesti merkittävänä.
CYP 2C19:n ja CYP 3A4:n indusorit
Kliinisiä yhteisvaikutustutkimuksia ei ole tehty voimakkaan CYP 3A4:n ja CYP 2C19:n indusoreiden samanaikaisen annon vaikutuksen tutkimiseksi. Mavakamteenin samanaikainen käyttö sekä voimakkaan CYP 2C19:n että CYP 3A4:n indusorin (esim. rifampisiinin) kanssa oletettavasti vaikuttaa mavakamteenin farmakokinetiikkaan merkittävästi ja heikentää sen tehoa. Siksi voimakkaiden sekä CYP 2C19:n että CYP 3A4:n indusoreiden samanaikaista antoa ei suositella. Jos voimakkaan CYP 2C19:n tai CYP 3A4:n indusorin samanaikainen käyttö lopetetaan, potilaan kliinistä arviointia on lisättävä ja mavakamteeniannosta on pienennettävä (ks. kohta Annostus ja antotapa).
Taulukko 2. Mavakamteeniannoksen säätäminen/seuranta käytettäessä samanaikaisesti muita lääkkeitä
| Muu samanaikaisesti käytettävä lääke | Fenotyypiltään hidas CYP 2C19:n metaboloija* | Fenotyypiltään normaalia hitaampi, normaali, normaalia nopeampi tai erittäin nopea CYP 2C19:n metaboloija |
|---|---|---|
| Estäjät | ||
| Voimakkaan CYP 2C19:n estäjän ja voimakkaan CYP 3A4:n estäjän yhdistelmäkäyttö | Käyttö vasta-aiheista (ks. kohta Vasta-aiheet) | Käyttö vasta-aiheista (ks. kohta Vasta-aiheet) |
| Voimakas CYP 2C19:n estäjä (esim. tiklopidiini, flukonatsoli, fluvoksamiini) | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa).
Jos CYP 2C19:n fenotyyppiä ei ole vielä määritetty: Aloitusannosta 2,5 mg ei tarvitse muuttaa. Annos on pienennettävä 5 mg:sta 2,5 mg:aan, tai hoito on keskeytettävä, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). | Aloita mavakamteeni 2,5 mg:n annoksella. Annos on pienennettävä 15 mg:sta 5 mg:aan ja 10 mg:sta ja 5 mg:sta 2,5 mg:aan tai hoito on keskeytettävä, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). |
| Voimakas CYP 3A4:n estäjä (esim. klaritromysiini, itrakonatsoli, ketokonatsoli, vorikonatsoli, ritonaviiri, kobisistaatti, seritinibi, idelalisibi tai tukatinibi) | Käyttö vasta-aiheista (ks. kohta Vasta-aiheet) | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). |
| Keskivahva CYP 2C19:n estäjä (esim. flukonatsoli, fluoksetiini tai omepratsolia) | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa).
Jos CYP 2C19:n fenotyyppiä ei ole vielä määritetty: Aloitusannosta 2,5 mg ei tarvitse muuttaa. Annos on pienennettävä 5 mg:sta 2,5 mg:aan, tai hoito on keskeytettävä, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). | Aloitusannosta 5 mg ei tarvitse muuttaa. Keskivahvan estäjän aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Annosta on pienennettävä yhdellä annostasolla tai hoito on keskeytettävä, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). |
| Keskivahva CYP 3A4:n estäjä (esim. erytromysiini, greippimehu, verapamiili tai diltiatseemi) | Jos potilaalla on jo lääkitys, kun mavakamteenihoito aloitetaan, aloitusannosta 2,5 mg ei tarvitse muuttaa.
Keskivahvan estäjän aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Jos potilaan mavakamteeniannos on 5 mg, annos on pienennettävä 2,5 mg:aan, tai jos annos on 2,5 mg, hoito on keskeytettävä 4 viikoksi. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). |
| Heikko CYP 2C19:n estäjä (esim. simetidiini, sitalopraami, omepratsolia tai esomepratsoli) | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). | Heikon estäjän aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). |
| Heikko CYP 3A4:n estäjä (esim. simetidiini, esomepratsoli, omepratsoli tai pantopratsoli) | Jos potilaalla on jo lääkitys, kun mavakamteenihoito aloitetaan, aloitusannosta 2,5 mg ei tarvitse muuttaa.
Heikon estäjän aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Jos potilaan mavakamteeniannos on 5 mg, annos on pienennettävä 2,5 mg:aan, tai jos annos on 2,5 mg, hoito on keskeytettävä 4 viikoksi. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). | Heikon estäjän aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). |
| Indusorit | ||
| Voimakas CYP 2C19:n indusori ja voimakas CYP 3A4:n indusori (esim. rifampisiini, apalutamidi, entsalutamidi, mitotaani, fenytoiini, karbamatsepiini, efavirentsi tai mäkikuisma) | Voimakkaan indusorin aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Arvioi LVOT:n gradientti ja LVEF 4 viikon kuluttua. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). Enimmäisannos on 5 mg.
Voimakkaan indusorin lopettaminen tai annoksen pienentäminen mavakamteenihoidon aikana: Pienennä mavakamteeniannos 5 mg:sta 2,5 mg:aan tai keskeytä hoito, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). | Voimakkaan indusorin aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Arvioi LVOT:n gradientti ja LVEF 4 viikon kuluttua. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa).
Voimakkaan indusorin lopettaminen tai annoksen pienentäminen mavakamteenihoidon aikana: Pienennä mavakamteeniannosta yhdellä annostasolla, jos annos on 5 mg tai suurempi. Jatka samalla mavakamteeniannoksella, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). |
| Keskivahva tai heikko CYP 2C19:n indusori (esim. letermoviiri, noretindroni tai prednisoni) | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). | Keskivahvan tai heikon indusorin aloittaminen mavakamteenihoidon aikana: Arvioi LVOT:n gradientti ja LVEF 4 viikon kuluttua. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa).
Keskivahvan tai heikon indusorin lopettaminen mavakamteenihoidon aikana: Pienennä mavakamteeniannosta yhdellä annostasolla, jos annos on 5 mg tai suurempi. Jatka samalla mavakamteeniannoksella, jos annos on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). |
| Keskivahva tai heikko CYP 3A4:n indusori (esim. fenobarbitaali, primidoni) | Keskivahvan tai heikon indusorin aloittaminen tai annoksen suurentaminen mavakamteenihoidon aikana: Arvioi LVOT:n gradientti ja LVEF 4 viikon kuluttua. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa).
Keskivahvan tai heikon indusorin lopettaminen tai annoksen pienentäminen mavakamteenihoidon aikana: Pienennä mavakamteeniannos 2,5 mg:aan tai keskeytä hoito, jos annoskoko on 2,5 mg. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti (ks. kohta Annostus ja antotapa). | Annosta ei tarvitse muuttaa. Arvioi LVEF 4 viikon kuluttua ja jatka sitten potilaan seurantaa ja annostitrausta aikataulun mukaisesti. Säädä mavakamteeniannosta kliinisen arvioinnin perusteella (ks. kohta Annostus ja antotapa). |
* Sisältää potilaat, joiden CYP 2C19:n fenotyyppiä ei ole vielä määritetty.
a Omepratsolin katsotaan olevan heikko CYP 2C19:n estäjä annoksella 20 mg kerran vuorokaudessa ja keskivahva CYP 2C19:n estäjä 40 mg:n kokonaisvuorokausiannoksella.
Mavakamteenin vaikutus muihin lääkevalmisteisiin
In vitro -tutkimusten perusteella mavakamteeni saattaa olla CYP 3A4:n indusori. 17 vuorokauden mavakamteenihoito kliinisesti merkityksellisillä altistuksilla normaaleilla, normaalia nopeammilla tai erittäin nopeilla CYP 2C19:n metaboloijilla ei pienentänyt altistusta samanaikaisesti annetuille etinyyliestradiolille ja noretindronille (suun kautta otettavien tavanomaisten ehkäisyvalmisteiden aineosille, jotka ovat CYP 3A4:n substraatteja). Lisäksi 16 vuorokauden mavakamteenihoito kliinisesti merkityksellisillä altistuksilla normaaleilla CYP 2C19:n metaboloijilla pienensi samanaikaisesti annetun midatsolaamin pitoisuutta plasmassa 13 %. Tätä muutosta ei pidetty kliinisesti merkittävänä.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / naisten ehkäisy
CAMZYOS on vasta-aiheinen naisille, jotka voivat tulla raskaaksi eivätkä käytä tehokasta ehkäisyä (ks. kohta Vasta-aiheet). Siksi ennen hoidon aloittamista naisille, jotka voivat tulla raskaaksi, on tehtävä raskaustesti, jonka tuloksen on oltava negatiivinen, ja heille on kerrottava sikiöön kohdistuvasta vakavasta riskistä. Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 6 kuukauden ajan CAMZYOS‑hoidon päättymisen jälkeen, koska mavakamteenin poistuminen elimistöstä kestää noin 5 puoliintumisaikaa (noin 45 vuorokautta normaaleilla CYP 2C19:n metaboloijilla ja 115 vuorokautta hitailla CYP 2C19:n metaboloijilla) sen jälkeen, kun hoito on päättynyt (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Jos mavakamteenihoito lopetetaan raskauden suunnittelemisen takia, on otettava huomioon, että LVOT:n ahtauma ja oiretaakka saattavat palata (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus
Ei ole olemassa tietoja mavakamteenin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mavakamteenin oletetaan aiheuttavan alkio- ja sikiötoksisuutta, jos sitä annetaan raskauden aikana. Siksi CAMZYOS on vasta-aiheista raskauden aikana (ks. kohta Vasta-aiheet). CAMZYOS-hoito on lopetettava 6 kuukautta ennen raskauden suunnittelemista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos potilas tulee raskaaksi, mavakamteenihoito on lopetettava. Potilaalle on kerrottava hoitoon liittyvistä sikiöön kohdistuvien haitallisten vaikutusten riskistä, ja potilaalle on tehtävä ultraäänitutkimuksia.
Imetys
Ei tiedetä, erittyykö mavakamteeni tai sen metaboliitit ihmisen rintamaitoon. Ei ole tietoa mavakamteenin tai sen metaboliittien erittymisestä koe-eläinten rintamaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Koska mavakamteenin aiheuttamia haittavaikutuksia rintaruokituissa lapsissa ei tunneta, rintaruokinta ei ole sallittua mavakamteenihoidon aikana.
Hedelmällisyys
Mavakamteenin vaikutusta hedelmällisyyteen ei ole tutkittu ihmisillä. Eläinkokeet eivät riitä sen selvittämiseksi, miten mavakamteeni vaikuttaa miesten tai naisten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Mavakamteenilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Mavakamteenin käytön aikana saattaa esiintyä huimausta. Potilaita on neuvottava olemaan ajamatta tai käyttämättä koneita, jos heillä esiintyy huimausta.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Yleisimmin ilmoitetut mavakamteenin haittavaikutukset olivat huimaus (17 %), hengenahdistus (12 %), systolinen toimintahäiriö (5 %) ja pyörtyminen (5 %).
Haittavaikutustaulukko
Mavakamteenihoitoa saaneilla potilailla kahdessa vaiheen 3 tutkimuksessa (EXPLORER-HCM ja VALOR-HCM) ilmoitetut haittavaikutukset on esitetty seuraavassa taulukossa. Yhteensä 179 potilasta sai mavakamteenia 2,5 mg, 5 mg, 10 mg tai 15 mg vuorokaudessa. Potilaiden mavakamteenihoidon keston mediaani oli 30,1 viikkoa (vaihteluväli: 1,6–40,3 viikkoa).
Haittavaikutukset on lueteltu taulukossa 3 MedDRA-elinjärjestelmäluokituksen mukaisesti. Kunkin elinjärjestelmäluokan haittavaikutukset on esitetty haittavaikutuksen yleisyyden ja vakavuuden mukaan alenevassa järjestyksessä. Lisäksi jokaiselle haittavaikutukselle on määritelty yleisyysluokka seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000).
Taulukko 3. Haittavaikutukset
| Elinjärjestelmäluokka | Haittavaikutus | Yleisyys |
|---|---|---|
| Hermosto | Huimaus | Hyvin yleinen |
| Pyörtyminen | Yleinen | |
| Sydän | Systolinen toimintahäiriöa | Yleinen |
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | Hyvin yleinen |
aMääritelmä: LVEF < 50 %, oireinen tai oireeton
Valikoitujen haittavaikutusten kuvaus
Systolinen toimintahäiriö
Vaiheen 3 kliinisissä tutkimuksissa mavakamteeniryhmän potilaista 5 %:lla (9/179) esiintyi hoidon aikana palautuva vasemman kammion ejektiofraktion pienentyminen < 50 %:iin (mediaani 45 %; vaihteluväli 35–49 %). Näistä potilaista 56 %:lla (5/9) ei esiintynyt ejektiofraktion pienentymisen lisäksi muita kliinisiä ilmentymiä. Kaikilla mavakamteenihoitoa saaneilla potilailla LVEF korjaantui mavakamteenihoidon keskeyttämisen jälkeen, ja he saivat hoitoa tutkimuksessa sen loppuun saakka (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hengenahdistus
Vaiheen 3 kliinisissä tutkimuksissa hengenahdistusta ilmoitettiin mavakamteenihoitoa saaneista potilaista 12,3 %:lla ja lumelääkeryhmässä 8,7 %:lla. EXPLORER‑HCM-tutkimuksessa suurin osa hengenahdistustapahtumista (67 %) ilmoitettiin mavakamteenin keskeyttämisen jälkeen; mediaaniaika hengenahdistuksen alkamiseen oli 2 viikkoa (vaihteluväli: 0,1–4,9 viikkoa) viimeisen annoksen jälkeen.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Tietoa mavakamteenin yliannostuksesta ihmisillä on vähän. Mavakamteenia on annettu hypertrofista kardiomyopatiaa (HCM) sairastaville potilaille enintään 144 mg:n kerta-annoksena. Kyseisellä annoksella ilmoitettiin yksi vakava haittavaikutus, jossa vasovagaalinen reaktio, hypotensio ja asystolia kestivät 38 sekuntia. Terveille tutkittaville on annettu enintään 25 mg:n annoksia enintään 25 vuorokauden ajan. Kolmella kahdeksasta tutkittavasta, jotka saivat hoitoa 25 mg:n mavakamteeniannoksella, LVEF heikkeni vähintään 20 %. Mavakamteenin yliannostuksen todennäköisin seuraus on systolinen toimintahäiriö. Mavakamteenin yliannostusta hoidetaan tarvittaessa keskeyttämällä mavakamteenihoito ja ylläpitämällä hemodynaamista tilaa lääketieteellisin tukitoimin (esimerkiksi aloittamalla inotrooppinen tuki adrenergisillä aineilla), seuraamalla tarkasti peruselintoimintoja ja vasemman kammion ejektiofraktiota (LVEF) sekä huolehtimalla potilaan kliinisestä tilasta.
Kun yön yli paastonneet terveet tutkittavat saivat ensin suun kautta 15 mg kerta-annoksena mavakamteenia ja sitten aktiivihiiltä 2 tunnin (noin tmax) kuluttua, mavakamteenin imeytyminen väheni 20 %:lla AUC-arvon (AUC0–72) perusteella. Aktiivihiilen anto 6 tunnin kuluttua mavakamteeniannoksesta ei vaikuttanut imeytymiseen. Aktiivihiilen varhaista antoa (ennen tmax:n saavuttamista tai mahdollisimman pian sen jälkeen) voidaan siten harkita mavakamteenin yliannostuksen tai tahattoman nielemisen hoidossa. Ravitulle potilaalle aktiivihiili saattaa silti tehota vielä 2 tunnin jälkeenkin mavakamteeniannoksesta enimmäispitoisuuden (tmax) saavuttamisen hidastumisen vuoksi (ks. kohta Farmakokinetiikka).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Sydänlääkkeet, muut sydänlääkkeet, ATC-koodi: C01EB24
Vaikutusmekanismi
Mavakamteeni on selektiivinen, allosteerinen ja reversiibeli sydämen myosiiniestäjä. Mavakamteeni muuttaa niiden myosiinipäiden lukumäärää, jotka voivat siirtyä voimaa tuottavaan tilaan, mikä vähentää (tai HCM:ssä normalisoi) todennäköisyyttä voimaa tuottavien systolisten ja jäännösdiastolisten ristisiltojen muodostumiselle. Mavakamteeni myös siirtää koko myosiinikannan energiaa säästävään, mutta aktivoitavissa olevaan täysin relaksoituneeseen tilaan (super relaksoitunut tila, SRX). Hypertrofisen kardiomyopatian mekanistisia tunnusmerkkejä ovat ristisiltojen liiallinen muodostuminen ja myosiinin SRX-tilan säätelyhäiriö, joiden seurauksena voi ilmetä liiallista supistumisvireyttä, relaksoitumisen häiriöitä, ylenmääräistä energiankulutusta ja sydänlihaksen seinämään kohdistuvaa rasitusta. HCM-potilailla sydämen myosiinin esto mavakamteenilla normalisoi supistumista, vähentää dynaamista LVOT:n ahtaumaa ja parantaa sydämen täyttöpaineita.
Farmakodynaamiset vaikutukset
LVEF
EXPLORER-HCM-tutkimuksessa lähtötason keskimääräinen (SD) LVEF lepotilassa oli 74 % (6) molemmissa hoitohaaroissa ja LVEF:n keskimääräisen absoluuttisen muutoksen pieneneminen lähtötasosta oli mavakamteenihaarassa ‑4 % (95 %:n luottamusväli ‑5,3– ‑2,5) ja lumehaarassa 0 % (95 %:n luottamusväli ‑1,2–1,0) 30 viikon hoitojaksolla. Kahdeksan viikon kuluttua mavakamteenihoidon keskeyttämisestä eli viikolla 38 keskimääräinen LVEF vastasi lähtötasoa molemmissa hoitohaaroissa.
Vasemman kammion ulosvirtauskanavan (LVOT) ahtauma
EXPLORER-HCM-tutkimuksessa keskimääräinen LVOT:n gradientti lepotilassa ja Valsalvan kokeen aikana pieneni viikkoon 4 mennessä ja säilyi koko tutkimuksen keston ajan (30 viikkoa). Viikolla 30 LVOT:n gradienttien keskimääräinen muutos lähtötasosta oli mavakamteenihaarassa lepotilassa ‑39 mmHg (95 %:n luottamusväli ‑44,0 – ‑33,2 mmHg) ja Valsalvan kokeen aikana ‑49 mmHg (95 %:n luottamusväli ‑55,4 – ‑43,0 mmHg). Lumehaarassa vastaavat arvot olivat ‑6 mmHg (95 %:n luottamusväli ‑10,5 – ‑0,5 mmHg) ja ‑12 mmHg (95 %:n luottamusväli ‑17,6 – ‑6,6 mmHg). Kahdeksan viikon kuluttua mavakamteenihoidon keskeyttämisestä eli viikolla 38 keskimääräinen LVEF ja keskimääräiset LVOT:n gradientit vastasivat lähtötasoa molemmissa hoitohaaroissa.
Sydämen elektrofysiologia
Hypertrofisessa kardiomyopatiassa QT-väli saattaa olla luontaisesti pidentynyt perussairauden vuoksi, kammiotahdistuksen yhteydessä tai HCM-potilaiden hoidossa yleisesti käytettyjen QT-väliä mahdollisesti pidentävien lääkkeiden takia. Yhdistetyssä HCM-potilaiden kaikkien kliinisten tutkimusten altistus-vasteanalyysissä mavakamteenilla on osoitettu pitoisuudesta riippuvainen QTcF-välin lyheneminen. Keskimääräinen lumekorjattu muutos lähtötasosta oli oHCM-potilailla ‑8,7 ms (90 %:n luottamusvälin yläraja ‑6,7 ms ja alaraja ‑10,8 ms)vakaan tilan huippupitoisuuden (Cmax) mediaanissa (452 ng/ml). QTcF-väli pyrki lyhenemään eniten potilailla, joilla QTcF-väli oli lähtötasolla pidempi.
Yhdessä terveille tutkittaville tehdyssä kliinisessä tutkimuksessa pitkä altistus terapeuttisia mavakamteenipitoisuuksia suuremmille pitoisuuksille heikensi systolista toimintaa merkittävästi ja tähän liittyi QTc-välin pidentyminen (< 20 ms). Tämä on yhdenmukaista normaalien sydänten prekliinisten löydösten kanssa. Akuutteja QTc-välin muutoksia ei ole havaittu vastaavilla (tai suuremmilla) altistuksilla kerta-annoksen jälkeen. Löydökset terveillä sydämillä selittyvät sydämen mukautumisella mekaanisiin tai toiminnallisiin muutoksiin (vasemman kammion merkittävä mekaaninen heikkeneminen), joita ilmenee vasteena myosiiniin estoon sydämessä, jonka fysiologia ja vasemman kammion supistumisvireys ovat normaalit.
Kliininen teho ja turvallisuus
EXPLORER-HCM
Mavakamteenin tehoa arvioitiin vaiheen 3 kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa, kansainvälisessä, rinnakkaisryhmillä tehdyssä monikeskustutkimuksessa. Tutkimukseen osallistui 251 aikuispotilasta, joilla oli NYHA-luokan II tai III oHCM, LVEF ≥ 55 % ja LVOT:n huippugradientti ≥ 50 mmHg levossa tai provosoitaessa oHCM:n diagnosointihetkellä, ja Valsalvan kokeen aikana LVOT:n gradientti ≥ 30 mmHg seulonnassa. Suurin osa potilaista sai muuta hoitoa hypertrofiseen kardiomyopatiaan (HCM): mavakamteenihaarassa yhteensä 96 % (beetasalpaajia 76 %, kalsiuminestäjiä 20 %) ja lumehaarassa 87 % (beetasalpaajia 74 %, kalsiuminestäjiä 13 %).
Potilaat satunnaistettiin suhteessa 1:1 saamaan joko 5 mg:n aloitusannos mavakamteenia (123 potilasta) tai samannäköistä lumelääkettä (128 potilasta) kerran vuorokaudessa 30 viikon ajan. Annosta säädettiin säännöllisin väliajoin, jotta voitiin optimoida potilaan vaste hoitoon (LVOT:n gradientin pienentyminen Valsalvan kokeen aikana) ja säilyttää LVEF tasolla ≥ 50 %. Annoksen säätämisessä huomioitiin myös mavakamteenin pitoisuus plasmassa. Annos oli 2,5–15 mg, ja yhteensä 60 potilaalla annos oli 5 mg ja 40 potilaalla 10 mg. Tutkimuksen aikana kolmella seitsemästä mavakamteenia saaneesta potilaasta LVEF oli < 50 % ennen viikon 30 käyntiä, ja heidän hoitonsa keskeytettiin tilapäisesti. Näistä potilaista kaksi jatkoi hoitoa samalla annoksella ja yhden potilaan annos pienennettiin 10 mg:sta 5 mg:aan.
Hoidon määräytyminen ositettiin lähtötason NYHA-luokan (II tai III), senhetkisen beetasalpaajahoidon (kyllä tai ei) ja hapen huippukulutuksen (pVO2) arvioinnissa käytetyn ergometrin tyypin (juoksumatto tai kuntopyörä) perusteella. Tutkimuksesta poissuljettiin potilaat, jotka saivat jatkuvana kaksoishoitona beetasalpaajaa yhdistettynä kalsiuminestäjään, disopyramidia tai ranolatsiinia. Tutkimuksesta poissuljettiin myös potilaat, joilla oli infiltroiva tai kertymäsairauden aiheuttama, oHCM:ää muistuttava sydämen hypertrofia, kuten Fabryn tauti, amyloidoosi tai Noonanin oireyhtymä, johon liittyy vasemman kammion hypertrofia.
Lähtötason demografiset ominaisuudet ja taudin ominaisuudet olivat samankaltaiset mavakamteeni- ja lumehaarassa. Keski-ikä oli 59 vuotta, mavakamteenihaarassa miehiä oli 54 % ja lumehaarassa 65 %, keskimääräinen painoindeksi (BMI) oli 30 kg/m2, keskimääräinen syke 63 lyöntiä/min, keskimääräinen verenpaine 128/76 mmHg, ja 90 % tutkittavista oli valkoihoisia. Satunnaistetuista tutkittavista 73 % kuului lähtötasolla NYHA-luokkaan II ja 27 % NYHA-luokkaan III. Keskimääräinen LVEF oli 74 %, ja keskimääräinen LVOT:n gradientti Valsalvan kokeen aikana oli 73 mmHg. 8 % oli saanut septumin reduktiohoitoa, 75 % käytti beetasalpaajia, 17 % kalsiuminestäjiä, 14 %:lla oli todettu eteisvärinä ja 23 %:lla oli rytmihäiriötahdistin. EXPLORER-HCM-tutkimuksen potilasta 85 oli täyttänyt 65 vuotta, ja heistä 45 potilasta sai mavakamteenia.
Ensisijaiseen tulosmittariin kuuluivat fyysisen suorituskyvyn muutos hapen huippukulutuksen (pVO2) mukaan arvioituna ja NYHA-luokituksen perusteella arvioitujen oireiden muutos viikolla 30. Muutokseksi määritettiin hapen huippukulutuksen (pVO2) paraneminen ≥ 1,5 ml/kg/min ja NYHA-luokan paraneminen vähintään yhden luokan verran TAI hapen huippukulutuksen (pVO2) paraneminen ≥ 3,0 ml/kg/min ja NYHA-luokan säilyminen ennallaan.
Lumehaaraan verrattuna suurempi osuus mavakamteenihoitoa saaneista potilasta saavutti ensisijaisen ja toissijaisen päätetapahtuman viikolla 30 (ks. taulukko 4).
Taulukko 4. EXPLORER‑HCM-tutkimuksen ensisijaisten yhdistelmäpäätetapahtumien ja toissijaisten päätetapahtumien analyysi
Mavakamteeni N = 123 | Lumelääke N = 128 | ||
|---|---|---|---|
| Ensisijaisen päätetapahtuman viikolla 30 saavuttaneet potilaat, n (%) | 45 (37 %) | 22 (17 %) | |
| Ero hoidossa (95 %:n luottamusväli) | 19,4 (8,67–30,13) | ||
| p-arvo | 0,0005 | ||
| Muutos lähtötasosta viikolle 30: rasituksen jälkeinen LVOT:n huippugradientti (mmHg) | N = 123 | N = 128 | |
| Keskiarvo (keskihajonta) | −47 (40) | −10 (30) | |
| Ero hoidossa* (95 %:n luottamusväli) | −35 (−43 – −28) | ||
| p-arvo | < 0,0001 | ||
| Muutos lähtötasosta viikolle 30: pVO2 (ml/kg/min) | N = 123 | N = 128 | |
| Keskiarvo (keskihajonta) | 1,4 (3) | −0,05 (3) | |
| Ero hoidossa* (95 %:n luottamusväli) | 1,4 (0,6–2) | ||
| p-arvo | < 0,0006 | ||
| Muutos lähtötasosta viikolle 30: potilaat, joiden NYHA-luokka parani ≥ 1 luokalla | N = 123 | N = 128 | |
| N (%) | 80 (65 %) | 40 (31 %) | |
| Ero hoidossa (95 %:n luottamusväli) | 34 (22–45) | ||
| p-arvo | < 0,0001 | ||
| Muutos lähtötasosta viikolle 30: KCCQ‑23 CSS† | N = 92 | N = 88 | |
| Keskiarvo (keskihajonta) | 14 (14) | 4 (14) | |
| Ero hoidossa* (95 %:n luottamusväli) | 9 (5–13) | ||
| p-arvo | < 0,0001 | ||
| Lähtötaso | N = 99 | N = 97 | |
| Keskiarvo (keskihajonta) | 71 (16) | 71 (19) | |
| Muutos lähtötasosta viikolle 30: HCMSQ SoB -pisteet‡ | N = 85 | N = 86 | |
| Keskiarvo (keskihajonta) | −2,8 (2,7) | −0,9 (2,4) | |
| Ero hoidossa* (95 %:n luottamusväli) | −1,8 (−2,4 – −1,2) | ||
| p-arvo | < 0,0001 | ||
| Lähtötaso | N = 108 | N = 109 | |
| Keskiarvo (keskihajonta) | 4,9 (2,5) | 4,5 (3,2) | |
* pienimmän neliösumman keskimääräinen ero
† KCCQ‑23 CSS = Kansas City Cardiomyopathy Questionnaire‑23 Clinical Summary Score. KCCQ‑23 CSS saadaan oireiden kokonaispistemäärästä (Total Symptoms Score, TSS) ja KCCQ‑23:n fyysisten rajoitusten (Physical Limitations, PL) pisteistä. CSS-pistemäärä voi olla 0–100. Mitä suurempi pistemäärä, sitä parempi terveydentila. KCCQ‑23 CSS -pisteissä havaittiin merkitsevä ero hoidossa mavakamteenin eduksi ensimmäisen kerran viikolla 6, ja ero säilyi johdonmukaisesti viikon 30 loppuun saakka.
‡ HCMSQ SoB = Hypertrophic Cardiomyopathy Symptom Questionnaire Shortness of Breath. HCMSQ SoB ‑asteikolla mitataan hengenahdistuksen esiintymistiheyttä ja vaikeusastetta. HCMSQ SoB ‑pistemäärä voi olla 0–18. Mitä pienempi pistemäärä, sitä vähemmän hengenahdistusta. HCMSQ SoB ‑asteikolla havaittiin merkitsevä ero hoidossa mavakamteenin eduksi ensimmäisen kerran viikolla 4, ja ero säilyi johdonmukaisesti viikon 30 loppuun saakka.
Demografisten ominaisuuksien, sairauden lähtötason ominaisuuksien ja lähtötasolla samanaikaisesti käytettyjen lääkevalmisteiden vaikutusta lopputuloksiin tutkittiin. Ensisijaisen analyysin tuloksissa mavakamteeni oli yhdenmukaisesti parempi kaikissa analysoiduissa alaryhmissä.
VALOR-HCM
Mavakamteenin tehoa arvioitiin vaiheen 3 kaksoissokkoutetussa, satunnaistetussa, 16 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa. Tutkimukseen osallistui 112 potilasta, joilla oli oireinen oHCM ja jotka soveltuivat sydämen väliseinää ohentavaan toimenpiteeseen (Septal Reduction Therapy, SRT). Tutkimukseen otettiin mukaan potilaita, joilla oli vaikeasti oireileva ja lääkehoitoon vastaamaton oHCM, NYHA-luokan III tai IV oHCM tai NYHA-luokan II oHCM ja joilla oli ollut rasitukseen liittyvä pyörtyminen tai lähes pyörtyminen. Vaatimuksena oli LVOT:n huippugradientti ≥ 50 mmHg levossa tai provosoitaessa ja LVEF ≥ 60 %. Potilailla täytyi olla viimeisen 12 kuukauden aikana tehty lähete SRT-toimenpiteeseen tai se oli ollut suunnitteilla viimeisen 12 kuukauden aikana ja ajan varaaminen toimenpiteeseen oli suunnitelmissa.
Potilaat satunnaistettiin 1:1 saamaan mavakamteenia tai lumelääkettä kerran vuorokaudessa. Annosta säädettiin säännöllisin väliajoin annosvälillä 2,5–15 mg, jotta voitiin optimoida potilaan vaste hoitoon.
Lähtötason demografiset ominaisuudet ja taudin piirteet olivat samankaltaiset mavakamteeni- ja lumehaarassa. Keski-ikä oli 60,3 vuotta, miehiä oli 51 %, keskimääräinen painoindeksi (BMI) oli 31 kg/m2, keskimääräinen syke oli 64 lyöntiä/min, keskimääräinen verenpaine oli 131/74 mmHg ja 89 % tutkittavista oli valkoihoisia. Satunnaistetuista tutkittavista 7 % kuului lähtötasolla NYHA-luokkaan II ja 92 % NYHA-luokkaan III. Beetasalpaajia monoterapiana käytti 46 %, kalsiuminestäjiä monoterapiana käytti 15 %, beetasalpaajien ja kalsiuminestäjien yhdistelmähoitoa sai 33 % ja 20 % käytti disopyramidia monoterapiana tai yhdessä muiden hoitojen kanssa. VALOR-HCM-tutkimuksen potilaista 45 oli täyttänyt 65 vuotta ja heistä 24 potilasta sai mavakamteenia.
Mavakamteeni täytti lumelääkettä paremmin ensisijaisen yhdistelmäpäätetapahtuman ehdot viikolla 16 (ks. taulukko 5). Ensisijainen yhdistelmäpäätetapahtuma oli
- potilaan päätös toteuttaa SRT-hoito viikolla 16 tai sitä ennen tai
- potilaiden soveltuminen edelleen SRT-hoitoon (eli LVOT:n gradientti ≥ 50 mmHg ja NYHA-luokka III tai IV, tai NYHA-luokka II ja rasitukseen liittyvä pyörtyminen tai lähes pyörtyminen) viikolla 16.
Mavakamteenihoidon vaikutusta vasemman kammion ulosvirtauskanavan (LVOT) ahtaumaan, toimintakykyyn, terveydentilaan ja sydämen biomarkkereihin arvioitiin vertaamalla lähtötason ja viikon 16 välistä muutosta rasituksen jälkeisessä LVOT:n gradientissa, niiden potilaiden määrässä, joiden NYHA-luokka parani, KCCQ‑23 CSS -pisteissä, sekä NT‑proBNP:n ja sydämen troponiini I:n pitoisuuksissa. VALOR-HCM-tutkimuksessa toissijaisten tehon päätetapahtumien hierarkkisessa testauksessa havaittiin merkitsevä paraneminen mavakamteeniryhmässä lumeryhmään verrattuna (ks. taulukko 5).
Taulukko 5. VALOR-HCM-tutkimuksen esisijaisen yhdistelmäpäätetapahtuman ja toissijaisten päätetapahtumien analyysi
Mavakamteeni N = 56 | Lumelääke N = 56 | |
|---|---|---|
| Ensisijaisen yhdistelmäpäätetapahtuman viikolla 16 saavuttaneet potilaat, n (%) | 10 (17,9) | 43 (76,8) |
| Ero hoidossa (95 %:n luottamusväli) | 58,9 (44,0–73,9) | |
| p‑arvo | < 0,0001 | |
| Potilaan päätös toteuttaa SRT-hoito | 2 (3,6) | 2 (3,6) |
| Potilaan soveltuminen SRT-hoitoon ohjeiden kriteerien perusteella | 8 (14,3) | 39 (69,6) |
| SRT-hoidon tilaa ei voitu arvioida (imputoitu vastaamaan ensisijaista päätetapahtumaa) | 0 (0,0) | 2 (3,6) |
| Muutos lähtötasosta viikolle 16: rasituksen jälkeinen LVOT:n huippugradientti (mmHg) | N = 55 | N = 53 |
| Keskiarvo (keskihajonta) | −39,1 (36,5) | −1,8 (28,8) |
| Ero hoidossa* (95 %:n luottamusväli) | −37,2 (−48,1 – −26,2) | |
| p‑arvo | < 0,0001 | |
| Muutos lähtötasosta viikolle 16: potilaat, joiden NYHA-luokka parani ≥ 1 luokalla | N = 55 | N = 53 |
| N (%) | 35 (62,5 %) | 12 (21,4 %) |
| Ero hoidossa (95 %:n luottamusväli) | 41,1 (24,5–57,7) | |
| p‑arvo | < 0,0001 | |
| Muutos lähtötasosta viikolle 16: KCCQ-23 CSS† | N = 55 | N = 53 |
| Keskiarvo (keskihajonta) | 10,4 (16,1) | 1,8 (12,0) |
| Ero hoidossa* (95 %:n luottamusväli) | 9,5 (4,9–14,0) | |
| p‑arvo | < 0,0001 | |
| Lähtötaso | N = 56 | N = 56 |
| Keskiarvo (keskihajonta) | 69,5 (16,3) | 65,6 (19,9) |
| Muutos lähtötasosta viikolle 16: NT-proBNP | N = 55 | N = 53 |
| ng/l geometristen keskiarvojen suhde | 0,35 | 1,13 |
| Mavakamteenin ja lumelääkkeen geometristen keskiarvojen suhde (95 %:n luottamusväli) | 0,33 (0,27–0,42) | |
| p‑arvo | < 0,0001 | |
| Muutos lähtötasosta viikolle 16: sydämen troponiini I | N = 55 | N = 53 |
| ng/l geometristen keskiarvojen suhde | 0,50 | 1,03 |
| Mavakamteenin ja lumelääkkeen geometristen keskiarvojen suhde (95 %:n luottamusväli) | 0,53 (0,41–0,70) | |
| p‑arvo | < 0,0001 | |
* pienimmän neliösumman keskimääräinen ero
† KCCQ‑23 CSS = Kansas City Cardiomyopathy Questionnaire‑23 Clinical Summary Score. KCCQ‑23 CSS saadaan oireiden kokonaispistemäärästä (Total Symptoms Score, TSS) ja KCCQ‑23:n fyysisten rajoitusten (Physical Limitations, PL) pisteistä. CSS-pistemäärä voi olla 0–100. Mitä suurempi pistemäärä, sitä parempi terveydentila.
VALOR‑HCM-tutkimuksessa todettiin viikolla 16, että toissijainen päätetapahtuma NT-proBNP oli pitkäaikaisesti pienentynyt lähtötasosta mavakamteenihoidon yhteydessä lumeryhmään verrattuna (ks. taulukko 5), mikä vastasi EXPLORER‑HCM-tutkimuksen havaintoa viikolla 30.
Vasemman kammion massaindeksin (LVMI) ja vasemman eteisen tilavuusindeksin (LAVI) eksploratiivisessa analyysissä todettiin pienenemistä mavakamteenihoitoa saaneilla potilailla lumehaaraan verrattuna sekä EXPLORER-HCM-tutkimuksessa että VALOR-HCM-tutkimuksessa.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset CAMZYOS-valmisteen käytöstä hypertrofisen kardiomyopatian hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Suun kautta otettu mavakamteeni imeytyy nopeasti: tmax-arvon mediaani on 1 tunti (vaihteluväli: 0,5–3 tuntia). Suun kautta otetun mavakamteenin arvioitu biologinen hyötyosuus on noin 85 % kliinisellä annosalueella. Mavakamteenialtistus tavallisesti suurenee suhteessa kerran vuorokaudessa otettavan annoksen suuruuteen (2–48 mg).
Kun mavakamteenia annetaan kerta-annoksena 15 mg, Cmax on 47 % ja AUCinf 241 % suurempi CYP 2C19:n hitailla metaboloijilla verrattuna normaaleihin metaboloijiin. Keskimääräinen puoliintumisaika on pitkittynyt CYP 2C19:n hitailla metaboloijilla (23 vuorokautta) verrattuna normaaleihin metaboloijiin (6–9 vuorokautta).
Yksilöiden välinen farmakokineettinen vaihtelu on kohtalaista; altistumisen variaatiokerroin on Cmax‑ ja AUC-arvoille noin 30–50 %.
Runsaasti rasvaa ja kaloreita sisältävä ateria viivästytti mavakamteenin imeytymistä siten, että tmax-arvon mediaani oli 4 tuntia (vaihteluväli: 0,5–8 tuntia) aterian yhteydessä, verrattuna tyhjään mahaan otettuna 1 tunti. Kun mavakamteeni otettiin aterian yhteydessä, AUC0-inf pieneni 12 %. Tätä pienenemistä ei kuitenkaan pidetä kliinisesti merkittävänä. Mavakamteenin voi ottaa joko aterian yhteydessä tai tyhjään mahaan.
Koska mavakamteeni titrataan kliinisen vasteen perusteella (ks. kohta Annostus ja antotapa), simuloiduista vakaan tilan altistuksista on tehty yhteenveto käyttäen fenotyyppiin perustuvaa yksilöllistä annostelua (ks. taulukko 6).
Taulukko 6. Simuloitu keskimääräinen vakaan tilan pitoisuus annoksen ja CYP 2C19:n fenotyypin mukaan potilailla, joiden annos on titrattu Valsalvan kokeen aikana mitatun LVOT:n gradientin ja LVEF:n perusteella
| Annos | Pitoisuuden mediaani (ng/ml) | ||||
|---|---|---|---|---|---|
| Hitaat metaboloijat | Normaalia hitaammat metaboloijat | Normaalit metaboloijat | Normaalia nopeammat metaboloijat | Erittäin nopeat metaboloijat | |
| 2,5 mg | 451,9 | 274,0 | 204,9 | 211,3 | 188,3 |
| 5 mg | 664,9 | 397,8 | 295,4 | 311,5 | 300,5 |
Jakautuminen
Kliinisissä tutkimuksissa 97–98 % mavakamteenista on sitoutunut plasman proteiineihin. Veri–plasmapitoisuuksien suhde on 0,79. Näennäinen jakautumistilavuus (Vd/F) oli 114–206 l. Mavakamteenin jakautumista ei ole tutkittu erikseen ihmisille tehdyissä tutkimuksissa. Tietojen perusteella jakautumistilavuus on kuitenkin suuri.
Mavakamteenin jakautuminen siemennesteeseen arvioitiin vähäiseksi 10 miehellä, jotka saivat mavakamteenia pisimmillään 28 vuorokautta.
Biotransformaatio
Mavakamteeni metaboloituu laajasti, ensisijaisesti CYP 2C19:n (74 %), CYP 3A4:n (18 %) ja CYP 2C9:n (7,6 %) välityksellä in vitro -reaktioon perustuvan fenotyypityksen mukaan. Metabolian oletetaan tapahtuvan kaikkien kolmen reitin kautta, mutta ensisijaisesti CYP 2C19:n välityksellä normaalia hitaammilla, normaaleilla, normaalia nopeammilla ja erittäin nopeilla CYP 2C19:n metaboloijilla. Ihmisen plasmasta on todettu kolme metaboliittia. Runsaimmin esiintyvä metaboliitti on MYK‑1078, jota on ihmisen plasmassa alle 4 % mavakamteenialtistuksesta. Kahta muuta metaboliittia on alle 3 % mavakamteenialtistuksesta. Metaboliittien vaikutus mavakamteenin kokonaisaktiivisuuteen on siten vähäinen tai olematon. Hitailla CYP 2C19:n metaboloijilla mavakamteeni metaboloituu ensisijaisesti CYP 3A4:n välityksellä. Tietoja ei ole saatavilla hitaiden CYP 2C19:n metaboloijien metaboliittiprofiilista.
Mavakamteenin vaikutus muihin CYP-entsyymeihin
Prekliinisten tietojen perusteella enintään 5 mg:n mavakamteeniannos hitailla CYP 2C19:n metaboloijilla ja enintään 15 mg:n annos normaalia hitaammista erittäin nopeisiin metaboloijilla ei estä kliinisesti merkittävillä pitoisuuksilla seuraavia CYP-entsyymejä: CYP 1A2, CYP 2B6, CYP 2C8, CYP 2D6, CYP 2C9, CYP 2C19 ja CYP 3A4.
Mavakamteenin vaikutus kuljettajaproteiineihin
In vitro -tutkimusten mukaan mavakamteeni ei estä hoitopitoisuuksilla tärkeitä effluksikuljettajaproteiineja (P‑gp, BCRP, BSEP, MATE1 tai MATE2‑K) eikä merkittäviä sisäänkuljettajaproteiineja (orgaaniset anioninkuljettajapolypeptidit [OATP], orgaaniset kationinkuljettajaproteiinit [OCT] ja orgaaniset anioninkuljettajaproteiinit [OAT]) annoksen ollessa enintään 5 mg hitailla CYP 2C19:n metaboloijilla ja enintään 15 mg normaalia hitaammista erittäin nopeisiin CYP 2C19:n metaboloijilla.
Eliminaatio
Mavakamteeni eliminoituu plasmasta ensisijaisesti metaboloitumalla sytokromi P450 -entsyymien välityksellä. Terminaalinen puoliintumisaika on 6–9 vuorokautta normaaleilla CYP 2C19:n metaboloijilla ja 23 vuorokautta hitailla CYP 2C19:n metaboloijilla.
Puoliintumisajan arvioidaan olevan 6 vuorokautta erittäin nopeilla CYP 2C19:n metaboloijilla, 8 vuorokautta normaalia nopeammilla CYP 2C19:n metaboloijilla ja 10 vuorokautta normaalia hitaammilla CYP 2C19:n metaboloijilla.
Lääkeaine kertyy elimistöön: Cmax:n akkumulaatiokerroin on noin kaksi ja AUC:n akkumulaatiokerroin noin 7 normaaleilla CYP 2C19:n metaboloijilla. Kertyminen riippuu CYP 2C19 -fenotyypistä; havaintojen mukaan kertyminen on suurinta hitailla CYP 2C19:n metaboloijilla. Plasman suurimman ja pienimmän pitoisuuden suhde on vakaassa tilassa noin 1,5, kun lääkettä otetaan kerran vuorokaudessa.
Kun radiohiilellä (14C) leimattua mavakamteenia annettiin yksi 25 mg:n annos normaaleille CYP 2C19:n metaboloijille, 7 % kokonaisradioaktiivisuudesta havaittiin ulosteesta ja 85 % virtsasta normaaleilla CYP 2C19:n metaboloijilla. Muuttumatonta vaikuttavaa ainetta löytyi noin 1 % annetusta annoksesta ulosteesta ja 3 % virtsasta.
CYP 2C19:n fenotyyppi
Tärkein entsyymi mavakamteenin metaboliassa on polymorfinen CYP 2C19. Henkilö, jolla on kaksi normaalisti toimivaa alleelia, on normaali CYP 2C19:n metaboloija (esim. *1/*1). Henkilö, jolla on kaksi toimimatonta alleelia, on hidas CYP 2C19:n metaboloija (esim. *2/*2, *2/*3, *3/*3).
Noin 2 % valkoihoisista ja 18 % aasialaisista on CYP 2C19:n hitaita metaboloijia.
Lineaarisuus/ei-lineaarisuus
Altistuminen mavakamteenille suureni suunnilleen annoksen mukaisesti annosvälillä 2–48 mg, joten altistuksen odotetaan suurenevan annoksen mukaisesti hitailla CYP 2C19:n metaboloijilla hoitoannoksella 2,5–5 mg ja normaalia hitaammista erittäin nopeisiin CYP 2C19:n metaboloijilla hoitoannoksella 2,5–15 mg.
Erityisryhmät
Farmakokineettisessä populaatiomallinnuksessa mavakamteenin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja iän, sukupuolen, rodun tai etnisyyden perusteella.
Maksan vajaatoiminta
Farmakokineettinen kerta-annostutkimus tehtiin potilaille, joilla oli lievä (Child-Pughin luokka A) tai keskivaikea (Child-Pughin luokka B) maksan vajaatoiminta. Verrokeilla maksan toiminta oli normaalia. Altistus mavakamteenille (AUC) suureni 3,2-kertaiseksi lievää maksan vajaatoimintaa sairastaneilla potilailla ja 1,8-kertaiseksi keskivaikeaa maksan vajaatoimintaa sairastaneilla potilailla verrattuna potilaisiin, joiden maksan toiminta oli normaalia. Maksan toiminta ei vaikuttanut Cmax-arvoon, mikä on yhdenmukaista sen kanssa, ettei imeytymisnopeus ja/tai jakautumistilavuus muuttunut. Mavakamteenia erittyi virtsaan 3 % kaikissa kolmessa tutkittavien ryhmässä. Erillistä farmakokineettistä tutkimusta ei ole tehty potilaille, joilla maksan vajaatoiminta on vaikea (Child-Pughin luokka C).
Munuaisten vajaatoiminta
Noin 3 % mavakamteeniannoksesta erittyy virtsaan kanta-aineena. Populaatiofarmakokineettisessä tutkimuksessa, jossa eGFR oli pienimmillään 29,5 ml/min/1,73 m2, ei todettu korrelaatiota munuaistoiminnan ja altistuksen välillä. Erillistä farmakokineettistä tutkimusta ei ole tehty potilaille, joilla munuaisten vajaatoiminta on vaikea (eGFR < 30 ml/min/1,73 m2).
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Toksikologiset löydökset liittyivät yleensä sydämen toiminnan haitalliseen heikentymiseen, mikä on yhdenmukaista terveissä eläimissä ilmenevän ylenmääräisen ensisijaisen farmakologian kanssa. Nämä vaikutukset ilmenivät kliinisesti merkityksellisillä altistuksilla.
Lisääntymistoksisuus ja hedelmällisyys
Lisääntymistoksisuustutkimuksissa ei ilmennyt viitteitä siitä, että mavakamteeni vaikuttaisi millään tutkitulla annoksella uros- tai naarasrottien paritteluun tai hedelmällisyyteen tai emojen jälkeläisten elinkykyisyyteen ja hedelmällisyyteen. Suurimpien tutkittujen annosten aiheuttama mavakamteenialtistus plasmassa (AUC) jäi kuitenkin pienemmäksi kuin ihmisillä, jotka saavat ihmiselle suositeltua enimmäisannosta (MRHD).
Alkion- ja sikiönkehitys ja kehitys syntymän jälkeen
Mavakamteeni vaikutti haitallisesti rotan ja kanin alkion- ja sikiönkehitykseen. Tiineille rotille organogeneesin aikana suun kautta annettu mavakamteeni pienensi keskimääräistä sikiöpainoa, lisäsi implantaation jälkeisiä menetyksiä ja sikiöiden epämuodostumia (sisäelimissä ja luustossa), kun altistus oli kliinisesti merkityksellistä. Sisäelinten epämuodostumia ilmeni sikiöiden sydämessä, mukaan lukien yksi sydämen täydellinen peilikuvasijainti. Luuston epämuodostumat ilmenivät enimmäkseen rintalastan yhteensulautumien tavanomaista suurempana ilmaantuvuutena.
Tiineille kaneille organogeneesin aikana suun kautta annettu mavakamteeni aiheutti sisäelinten ja luuston epämuodostumia. Epämuodostumat ilmenivät esimerkiksi suurissa verisuonissa (keuhkovaltimorungon ja/tai aortankaaren laajentuma), suulakihalkioina ja rintalastan yhteensulautumien tavanomaista suurempana ilmaantuvuutena. Kummallakin eläinlajilla emon altistus (plasman AUC) annoksella, joka ei vaikuta alkion- ja sikiönkehitykseen, oli pienempi kuin ihmisillä, jotka saavat ihmiselle suositeltua enimmäisannosta (MRHD).
Syntymää edeltävää ja sen jälkeistä kehitystä selvittäneessä tutkimuksessa mavakamteenin anto tiineille rotille tiineyspäivästä 6 imetykseen tai synnytyksen jälkeiseen päivään 20 saakka ei aiheuttanut haittavaikutuksia emoille eikä jälkeläisille, joilla altistus oli päivittäistä jo ennen syntymää (kohdussa) ja imetysaikana. Emon altistus oli pienempi kuin ihmiselle suositeltu enimmäisannos (MRHD). Ei ole tietoa siitä, erittyykö mavakamteeni eläinten maitoon.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Kolloidinen, hydratoitu piidioksidi
Mannitoli (E421)
Hypromelloosi (E464)
Kroskarmelloosinatrium (E468)
Magnesiumstearaatti
Kapselin kuori
Kaikki vahvuudet
Liivate
Titaanidioksidi (E171)
CAMZYOS 2,5 mg kovat kapselit
Musta rautaoksidi (E172)
Punainen rautaoksidi (E172)
CAMZYOS 5 mg kovat kapselit
Keltainen rautaoksidi (E172)
CAMZYOS 10 mg kovat kapselit
Punainen rautaoksidi (E172)
CAMZYOS 15 mg kovat kapselit
Musta rautaoksidi (E172)
Painomuste
Musta rautaoksidi (E172)
Sellakka (E904)
Propyleeniglykoli (E1520)
Väkevä ammoniakki (E527)
Kaliumhydroksidi (E525)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CAMZYOS kapseli, kova
2,5 mg (L:ei) 28 fol (1657,09 €)
5 mg (L:ei) 28 fol (1657,09 €)
10 mg (L:ei) 28 fol (1657,09 €)
15 mg (L:ei) 28 fol (1657,09 €)
PF-selosteen tieto
Läpipainopakkaus (polyvinyylikloridi [PVC], polyklooritrifluorieteeni [PCTFE], alumiini), joka sisältää 14 kovaa kapselia.
Pakkauskoot: 14, 28 tai 98 kovaa kapselia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
CAMZYOS 2,5 mg kovat kapselit
Vaaleanliila läpinäkymätön kansiosa, johon on painettu mustalla merkintä ”2.5 mg”, ja valkoinen läpinäkymätön runko-osa, johon on painettu mustalla merkintä ”Mava”. Molemmat merkinnät kulkevat poikittain. Kapselin pituus on noin 18,0 mm.
CAMZYOS 5 mg kovat kapselit
Keltainen läpinäkymätön kansiosa, johon on painettu mustalla merkintä ”5 mg”, ja valkoinen läpinäkymätön runko-osa, johon on painettu mustalla merkintä ”Mava”. Molemmat merkinnät kulkevat poikittain. Kapselin pituus on noin 18,0 mm.
CAMZYOS 10 mg kovat kapselit
Vaaleanpunainen läpinäkymätön kansiosa, johon on painettu mustalla merkintä ”10 mg”, ja valkoinen läpinäkymätön runko-osa, johon on painettu mustalla merkintä ”Mava”. Molemmat merkinnät kulkevat poikittain. Kapselin pituus on noin 18,0 mm.
CAMZYOS 15 mg kovat kapselit
Harmaa läpinäkymätön kansiosa, johon on painettu mustalla merkintä ”15 mg”, ja valkoinen läpinäkymätön runko-osa, johon on painettu mustalla merkintä ”Mava”. Molemmat merkinnät kulkevat poikittain. Kapselin pituus on noin 18,0 mm.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
CAMZYOS kapseli, kova
2,5 mg 28 fol
5 mg 28 fol
10 mg 28 fol
15 mg 28 fol
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Mavakamteeni: Aikuisten NYHA II–III-luokan obstruktiivisen hypertrofisen kardiomyopatian hoito erityisin edellytyksin (3091).
ATC-koodi
C01EB24
Valmisteyhteenvedon muuttamispäivämäärä
30.05.2025
Yhteystiedot
09 2512 1244
www.bms.com/fi
medinfo.finland@bms.com
