PIXUVRI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 29 mg
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää piksantronidimaleaattia, joka vastaa 29 mg:aa piksantronia.
Käyttökuntoon saattamisen jälkeen yhdessä millilitrassa konsentraattia on piksantronidimaleaattia määrä, joka vastaa 5,8 mg:aa piksantronia.
Apuaine, jonka vaikutus tunnetaan:
Yksi injektiopullo sisältää 39 mg natriumia.
Käyttökuntoon saattamisen ja laimentamisen jälkeen tämä lääkevalmiste sisältää noin 1 g:n (43 mmol) natriumia per annos, joka vastaa 50 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos.
Kliiniset tiedot
Käyttöaiheet
Pixuvri on tarkoitettu aikuispotilaiden useaan kertaan uusiutuneiden tai refraktoristen, aggressiivisten Non-Hodgkin-B-solulymfoomien (NHL) monoterapiahoitoon. Piksantronihoidon hyötyä ei ole varmistettu viidennen tai myöhemmän linjan kemoterapiana potilailla, jotka ovat olleet refraktorisia edelliselle hoidolle.
Ehto
Lääkevalmiste tulee annostella syöpälääkkeiden käyttöön perehtyneen lääkärin valvonnassa, jolla on mahdollisuus seurata kliinisiä, hematologisia ja biokemiallisia parametrejä hoidon kuluessa ja sen jälkeen.
Annostus ja antotapa
Pixuvri tulee annostella syöpälääkkeiden käyttöön perehtyneen lääkärin valvonnassa, jolla on mahdollisuus seurata kliinisiä, hematologisia ja biokemiallisia parametrejä hoidon kuluessa ja sen jälkeen (ks. kohta Käyttö- ja käsittelyohjeet).
Annostus
Piksantronin suositeltu annos on 50 mg/m2, joka annetaan 28‑päiväisen hoitojakson päivinä 1, 8, ja 15 enintään 6 hoitojakson ajan.
Huomaa:
EU-maissa suositellulla annoksella viitataan vaikuttavan aineen kantamuotoon (piksantroni). Potilaalle annettavan yksilöllisen annoksen on perustuttava käyttövalmiiksi saatetun liuoksen vahvuuteen, joka on 5,8 mg/ml piksantronia, sekä 50 mg/m2 :n annossuositukseen. Joissakin tutkimuksissa ja julkaisuissa suositeltu annos perustuu suolamuotoon (piksantronidimaleaatti). Annosta tulee kuitenkin säätää ennen kunkin hoitojakson alkua edellisellä hoitojaksolla havaittujen hematologisten pohjalukemien tai suurimman toksisuuden pohjalta. Potilaalle annettava Pixuvrin milligrammamäärä on määritettävä potilaan kehon pinta-alan (BSA, body surface area) perusteella. Kehon pinta-ala määritetään käyttäen vakiintunutta kehon pinta-alan laskemiseen tarkoitettua käytäntöä, ja siinä tulee käyttää potilaan kunkin hoitojakson 1. päivän painoa.
Varovaisuuteen kehotetaan liikalihavien potilaiden kohdalla, sillä ryhmän osalta kehon pinta-alaan perustuvasta annostuksesta on erittäin vähän tietoa.
Annoksen muuttamisohjeet
Annoksen muuttaminen ja seuraavien annosten ajoitus tulee määrittää kliinisesti arvioiden ja ottaen huomioon myelosuppression aste ja kesto. Myöhempiin kuureihin sopii yleensä edellisen jakson annos, jos veren valkosolu- ja verihiutalemäärät ovat palautuneet hyväksyttävälle tasolle.
Jos hoitojakson 1. päivänä neutrofiilien absoluuttinen määrä (ANC) on < 1,0 x 109/l tai verihiutaleiden määrä on < 75 x 109/l, hoitoa suositellaan lykättäväksi, kunnes ANC on ≥ 1,0 x 109/l ja verihiutaleiden määrä ≥ 75 x 109/l.
Taulukoita 1 ja 2 suositellaan ohjeiksi 28 päivän hoitojakson 8:nnen ja 15:nnen päivän annosten mukauttamiseen.
Taulukko 1 Päivien 8 ja 15 annoksen muuttaminen hematologisen toksisuuden vuoksi katsomatta siihen, monesko hoitojakso on kyseessä | |||
Aste | Verihiutaleiden määrä | ANC | Annoksen muutos |
1–2 | LLN* – 50 x 109/l | LLN – 1,0 x 109/l | Ei muutosta annostuksessa tai annosaikataulussa |
3 | < 50 – 25 x 109/l | < 1,0 – 0,5 x 109/l | Hoitoa lykätään, kunnes verihiutalemäärä on palautunut arvoon ≥ 50 x 109/l ja ANC** arvoon ≥ 1,0 x 109/l. |
4 | < 25 x 109/l | < 0,5 x 109/l | Hoitoa lykätään, kunnes verihiutalemäärä on palautunut arvoon ≥ 50 x 109/l ja ANC** arvoon ≥ 1,0 x 109/l. Annosta pienennetään 20 %. |
* LLN: Viitearvojen alaraja (Lower Limit of the Normal range) ** ANC: Absoluuttinen neutrofiilimäärä (Absolute Neutrophil Count) | |||
Taulukko 2 Ei-hematologisista toksisuuksista johtuvat muutokset hoidossa | |
Toksisuus | Muutos |
Mikä tahansa 3. tai 4. asteen, lääkevalmisteesta johtuva muu kuin kardiologinen toksisuus, mutta ei pahoinvointi tai oksentelu | Hoitoa lykätään, kunnes palautuminen asteelle 1. Annosta pienennetään 20 %. |
Mikä tahansa 3. Tai 4. asteen (NYHA*) kardiovaskulaarinen toksisuus tai jatkuvan alhainen LVEF** | Hoitoa lykätään ja tilannetta seurataan, kunnes tilanne palautunut. Harkittava hoidon lopettamista, jos LVEF:n** alentuminen on jatkuvasti ≥ 15 % lähtötasosta. |
* NYHA: New York Heart Association ** LVEF: Vasemman kammion ejektiofraktio (Left Ventricular Ejection Fraction) | |
Erityisryhmät
Pediatriset potilaat
Pixuvri-lääkevalmisteen turvallisuutta ja tehoa alle 18‑vuotiailla ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Iäkkäät potilaat
Iäkkäiden (≥ 65‑vuotiaiden) potilaiden annosta ei tarvitse säätää erikseen.
Munuaisten vajaatoiminta
Pixuvrin turvallisuutta ja tehoa ei ole varmistettu munuaisten vajaatoimintaa sairastavilla potilailla. Satunnaistetuista tutkimuksista jätettiin pois potilaat, joiden seerumin kreatiniini oli > 2 x viitearvojen yläraja (ULN, Upper Limit of the Normal Range). Näin ollen Pixuvria tulee käyttää varoen potilailla, joilla on munuaisten vajaatoiminta.
Maksan vajaatoimintaa sairastavat potilaat
Pixuvri-lääkevalmisteen tehoa ja turvallisuutta ei ole varmistettu maksan vajaatoimintaa sairastavilla potilailla. Pixuvria tulee käyttää varoen potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. Pixuvria ei suositella hoidoksi potilaille, joilla on vaikea eritykseen liittyvä maksan vajaatoiminta (ks. kohta Vasta-aiheet).
Potilaat, joiden toimintakyky on heikentynyt
Tällä hetkellä ei ole heikentyneestä toimintakyvystä (ECOG-toimintakykyluokka > 2) kärsiviä potilaita koskevaa tietoa turvallisuudesta ja tehosta. Tällaisia potilaita hoidettaessa on noudatettava varovaisuutta.
Antotapa
Tämä lääkevalmiste on tarkoitettu ainoastaan laskimonsisäiseen käyttöön. Intratekaalihoidon turvallisuutta ei ole varmistettu.
Pixuvri on tarkoitettu annettavaksi hitaana laskimoinfuusiona käyttäen in-line-suodatinta (tiputuksen kesto vähintään 60 min). Injektioliuos valmistetaan saattamalla Pixuvri ensin käyttökuntoon 5 ml:lla 9 mg/ml:n (0,9 %) natriumkloridi-injektioliuosta ja laimentamalla kantaliuos 250 ml:n lopputilavuuteen 9 mg/ml:n (0,9 %) natriumkloridi-injektioliuoksella.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ja laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
- Yliherkkyys piksantronidimaleaatille tai kohdassa Apuaineet mainituille apuaineille
- Immunisaatio eläviä viruksia sisältävällä rokotteella
- Vaikea-asteinen luuydinsuppressio
- Maksan vaikea vajaatoiminta.
Varoitukset ja käyttöön liittyvät varotoimet
Ennen ensimmäisen Pixuvri-hoitojakson aloittamista tulee aina määrittää huolella verenkuvan lähtöarvot sekä lähtötasoarvot seerumin kokonaisbilirubiinille, seerumin kokonaiskreatiniinille sekä vasemman kammion ejektiofraktiolle (LVEF) sydämen toiminnan arvioimiseksi.
Myelosuppressio
Vaikeaa myelosuppressiota voi esiintyä. Pixuvri-hoidossa olevat potilaat kokevat todennäköisesti myelosuppressiota (neutropenia, leukopenia, anemia, trombosytopenia ja lymfopenia), joka ilmenee erityisesti neutropeniana. Kun suositellut annosmäärät ja annostusajat ovat käytössä, neutropenia on yleensä väliaikaista. Sen nadiiri saavutetaan tavallisesti päivinä 15‑22, kun valmistetta annetaan päivinä 1, 8 ja 15. Neutrofiiliarvot palautuvat yleensä päivään 28 mennessä.
Verenkuvan, mukaan lukien leukosyyttien määrän, punasolujen määrän, verihiutaleiden määrän ja absoluuttisen neutrofiilimäärän huolellinen seuraaminen on välttämätöntä. Rekombinanttia hematopoieettista kasvutekijää voidaan käyttää vakiintuneiden tai ESMO:n (European Society for Medical Oncology) suositusten mukaisesti. Annostuksen muuttamista tulee harkita (ks. kohta Annostus ja antotapa).
Kardiotoksisuus
Pixuvri-hoidon kuluessa tai sen päätyttyä voi esiintyä sydämen toiminnanmuutoksia, kuten LVEF:n alentumista tai kuolemaan johtavaa kongestiivista sydämen vajaatoimintaa.
Pixuvrin kardiotoksisuutta saattavat lisätä aktiivinen tai piilevä sydän- ja verisuonisairaus, aiempi hoito antrasykliineillä tai antraseenidioneilla, aiempi tai samanaikainen välikarsina-alueen sädehoito tai muiden kardiotoksisten lääkevalmisteiden samanaikainen käyttö. Pixuvrin kardiotoksisuutta voi esiintyä riippumatta siitä, onko potilaalla kardiologisia riskitekijöitä.
Sellaisten potilaiden kohdalla, joilla on sydänsairaus tai kardiologisia riskitekijöitä, kuten isotooppiventrikulografialla (MUGA) määritetty lähtötilanteen LVEF arvo < 45 %, kliinisesti merkitseviä kardiovaskulaarisia poikkeavuuksia (jotka vastaavat NYHA-asteikolla [New York Heart Association] astetta 3 tai 4), sydäninfarkti viimeisten 6 kuukauden aikana, vakava arytmia, kontrolloimaton korkea verenpaine, kontrolloimaton angina pectoris tai kun doksorubisiinin tai vastaavan aiempi kumulatiivinen annos on ylittänyt 450 mg/m2, on ennen hoidon aloittamista punnittava huolellisesti Pixuvri-hoitoon liittyvä hyöty sen riskejä vastaan.
Sydämen toimintaa tulee seurata ennen Pixuvri-hoidon aloittamista ja hoidon aikana. Jos kardiotoksisuutta ilmenee hoidon aikana, Pixuvri-hoidon jatkamiseen liittyvä hyöty ja riskit tulee arvioida.
Sekundaariset maligniteetit
Hematologisten maligniteettien, kuten sekundaarisen akuutin myelooisen leukemian (AML) tai myelodysplastisen oireyhtymän (MDS), kehittyminen on tunnistettu riski, joka liittyy antrasykliinihoitoon ja muihin topoisomeraasi II:n estäjiin. Sekundaarisia syöpiä, mukaan lukien AML ja MDS, saattaa ilmetä Pixuvri-hoidon aikana tai sen jälkeen.
Infektio
Kliinisten tutkimusten yhteydessä on raportoitu infektioista, kuten keuhkokuumeesta, selluliitista, keuhkoputkentulehduksesta ja sepsiksestä. Infektioihin on liittynyt sairaalaan joutumista, septistä shokkia ja kuolemaa (ks. kohta Haittavaikutukset). Neutropeniasta kärsivät potilaat ovat alttiimpia infektioille, vaikka kliinisissä tutkimuksissa ei havaittukaan epätyypillisten, vaikeasti hoidettavien infektioiden, kuten systeemisten sieni-infektioiden tai opportunististen organismien, kuten Pneumocystis jiroveci, aiheuttamien infektioiden ilmaantuvuuden kasvua.
Pixuvria ei saa antaa potilaille, joilla on aktiivinen, vakava infektio, eikä potilaille, joilla on tai on ollut uusiutuvia tai kroonisia infektioita tai joilla on jokin taustalla oleva sairaustila, joka saattaa edistää alttiutta vakaville infektioille.
Tuumorilyysioireyhtymä
Seurauksena laajasta puriinikataboliasta, mikä puolestaan johtuu lääkevalmisteen aiheuttamasta syöpäsolujen nopeasta hajoamisesta (tuumorilyysioireyhtymä), piksantroni saattaa aiheuttaa hyperurikemiaa, joka voi johtaa elektrolyyttien epätasapainoon ja edelleen munuaisvaurioihin. Veren virtsahappo-, kalium-, kalsiumfosfaatti- ja kreatiniinipitoisuudet tulee määrittää hoidon jälkeen potilailla, joilla on suuri tuumorilyysiriski (kohonnut LDH, suuri kasvaimen tilavuus, korkea lähtötason virtsahappopitoisuus tai seerumin fosfaattipitoisuus). Nesteytys, virtsan alkalisointi ja ehkäisevä hoito allopurinolilla tai muilla hyperurikemiaa ehkäisevillä lääkkeillä voivat minimoida mahdolliset tuumorilyysioireyhtymän aiheuttamat komplikaatiot.
Rokotukset
Rokotus voi olla tehoton, jos se annetaan Pixuvri-hoidon aikana. Rokotus eläviä viruksia sisältävällä rokotteella on vasta-aiheinen Pixuvri-hoitoon liittyvän immunosuppression vuoksi (ks. kohta Vasta-aiheet).
Ekstravasaatio
Jos ekstravasaatiota esiintyy, lääkkeen anto tulee lopettaa välittömästi ja antoa tulee jatkaa toisen laskimon kautta. Pixuvrin rakkulamuodostusta ehkäisevien ominaisuuksien vuoksi ekstravasaation jälkeisen paikallisen reaktion riski on hyvin pieni.
Valoherkistyneisyysreaktioiden estäminen
Valoherkistyneisyys on potentiaalinen riski, joka perustuu in vitro- ja ei-kliinisiin in vivo -tietoihin. Kliinisessä tutkimusohjelmassa on raportoitu yksi valoherkistyneisyystapaus, jota ei katsottu vakavaksi ja josta potilas toipui. Potilaita tulee neuvoa noudattamaan varmuuden vuoksi auringolta suojautumisstrategioita, kuten auringolta suojaava vaatetuksen ja aurinkosuojavoiteen käyttö. Koska suurin osa lääkevalmisteiden synnyttämistä valoherkistyneisyysreaktioista on UVA-alueen aallonpituuksien aiheuttamaa, suositellaan käytettäväksi aurinkosuojaa, joka absorboi vahvasti UVA-alueella.
Potilaat, joiden ruokavaliossa on natriumrajoitus
Tämä lääkevalmiste sisältää natriumia noin 1000 mg (43 mmol) per annos laimennuksen jälkeen. Potilaiden, joilla on ruokavalion natriumrajoitus, tulee ottaa tämä huomioon.
Yhteisvaikutukset
Yhteisvaikutuksia ei ole havaittu ihmisillä tehdyissä tutkimuksissa, ja yhteisvaikutustutkimuksia ei ole tehty ihmisillä.
In vitro - inhibitiotutkimukset
In vitro -tutkimukset yleisimmillä ihmisen sytokromi P450-isoentsyymeillä (mukana CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 ja 3A4) viittasivat mahdolliseen kliinisesti merkittävään, sekatyyppiseen CYP1A2:n ja CYP2C8:n inhibitioon. Muita kliinisesti merkitseviä CYP-P450-vuorovaikutuksia ei havaittu.
Teofylliini: Kun teofylliinilääkevalmistetta, jolla on kapea terapeuttinen indeksi ja joka metaboloituu pääasiassa CYP1A2:n kautta, annetaan yhdessä Pixuvrin kanssa, on olemassa teoreettinen huolenaihe, että tämän substraatin pitoisuus saattaa kasvaa, mikä johtaisi teofylliinitoksisuuteen. Teofylliinipitoisuuksia tulee seurata huolellisesti samanaikaisen Pixuvri-hoidon aloitusta välittömästi seuraavien viikkojen aikana.
Varfariini metaboloituu osittain CYP1A2:n kautta. Siksi on olemassa teoreettinen huolenaihe, joka koskee tämän lääkevalmisteen samanaikaista käyttöä ja metaboloitumisen estymisen vaikutusta sen tarkoitettuun toimintaan. Koagulaatioparametreja, erityisesti INR-arvoja, tulee seurata samanaikaisen Pixuvri-hoidon aloitusta välittömästi seuraavien päivien aikana.
Amitriptyliini, haloperidoli, klotsapiini, ondansetroni ja propanololi metaboloituvat CYP1A2:n kautta. Siksi on olemassa teoreettinen huolenaihe, että niiden samanaikainen käyttö Pixuvrin kanssa voi lisätä tämän lääkevalmisteen pitoisuuksia veressä.
Vaikka piksantronin CYP2C8:aa estävän vaikutuksen riskiä ei voitu varmistaa, ensisijaisesti CYP2C8:n kautta metaboloituvia aineita, kuten repaglinidia, rosiglitatsonia tai paklitakselia, samanaikaisesti annettaessa tulee noudattaa varovaisuutta esimerkiksi huolellisella seurannalla mahdollisten haittavaikutusten varalta.
In vitro -tutkimusten perusteella piksantronin havaittiin olevan membraanikuljetusproteiinien P‑pg/BRCP ja OCT1 substraatti, ja aineet, joka estävät näitä kuljetusproteiineja, voivat mahdollisesti hidastaa piksantronin kulkeutumista maksaan ja sen poistumista elimistöstä. Verenkuvaa tulee seurata tarkasti, kun piksantronia annetaan samanaikaisesti aineiden kanssa, jotka estävät tällaisia kuljetusproteiineja. Näitä ovat esimerkiksi syklosporiini A tai takrolimuusi, joita käytetään yleisesti kontrolloimaan kroonista käänteishyljintäreaktiota, sekä HIV-lääkkeet ritonaviiri, sakinaviiri tai nelfinaviiri.
Lisäksi on oltava varovainen, kun piksantronia annetaan jatkuvasti samaan aikaan effluksikuljetusta indusoivien aineiden, kuten rifampisiinin, karbamatsepiinin ja glukokortikoidien kanssa, sillä piksantronin poistuminen elimistöstä saattaa lisääntyä, mikä johtaisi systeemisen altistuksen pienenemiseen.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Hedelmällisessä iässä olevia naisia kumppaneineen tulee neuvoa välttämään raskautta.
Naisten ja miesten on käytettävä tehokasta ehkäisyä hoidon aikana ja 6 kuukautta hoidon päättymisen jälkeen.
Raskaus
Ei ole olemassa tietoja piksantronin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Pixuvrin käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö/erittyvätkö Pixuvri/metaboliitit ihmisen rintamaitoon.
Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea.
Rintaruokinta on lopetettava Pixuvri-hoidon ajaksi.
Hedelmällisyys
Kun Pixuvria annettiin toistuvina annoksina koirille, vähimmillään 0,1 mg/kg/päivä, havaittiin annosriippuvaista kivesatrofiaa. Vaikutusta ei ole tutkittu ihmisillä. Muiden deoksiribonukleiinihappoa (DNA:ta) vahingoittavien aineiden tavoin Pixuvrin käyttöön voi liittyä hedelmällisyyden heikkenemistä. Vaikka vaikutusta hedelmällisyyteen ei ole varmennettu, miespotilaita on hyvä neuvoa varmuuden vuoksi käyttämään ehkäisymenetelmää (mieluiten mekaanista) hoidon aikana ja kuusi kuukautta hoidon jälkeen, jotta uudet siittiöt ehtivät kypsyä. Pitkään kestävän hedelmättömyyden riskin varalta sperman varastointia tulee harkita.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisin toksinen vaikutus oli luuydinsuppressio, erityisesti neutropenia. Vaikka kliinisiä seurauksia aiheuttavien, vakavien luuydinsuppressioiden ilmaantuvuus on suhteellisen alhainen, Pixuvri-hoitoa saaneita potilaita seurattiin tiiviisti usein teetetyllä verenkuvalla erityisesti neutropenian varalta. Vakavien infektioiden ilmaantuvuus oli alhainen, eikä immuunivajaukseen liittyviä opportunistisia infektioita havaittu. Vaikka kongestiivisena sydämen vajaatoimintana ilmeneviä kardiotoksisuustapauksia näytti olevan odotettua vähemmän verrattaessa muihin samantapaisiin lääkkeisiin, kuten antrasykliineihin, subkliinisen kardiotoksisuuden arvioimiseksi suositellaan LVEF:n seuraamista joko isotooppiventrikulografialla (MUGA) tai kaikukardiografialla (ECHO). Piksantroni-hoidosta on kokemusta vain potilailla, joiden LVEF on ≥ 45 %, ja useimpien potilaiden LVEF oli ≥ 50 %. Kokemus Pixuvrin antamisesta potilaille, joilla on huomattavampaa sydämen vajaatoimintaa, on vähäistä, ja hoitoon tulisi ryhtyä vain kliinisen tutkimuksen puitteissa. Muut toksisuudet, kuten pahoinvointi, oksentelu ja ripuli, olivat yleensä harvinaisia, lieviä, ohimeneviä, hallittavissa sekä odotettuja potilailla, joita hoidetaan sytotoksisilla aineilla. Vaikutukset maksan tai munuaisten toimintaan olivat pieniä tai olemattomia.
Haittavaikutustaulukko
Pixuvrille esitetyt haittavaikutukset ovat peräisin kaikkien päätökseen saatujen monoterapiatutkimusten (n = 197) lopullisista tiedoista. Haittavaikutukset on lueteltu alla olevassa taulukossa 3 MeDRA-elinjärjestelmäluokituksen sekä esiintyvyyden mukaisesti. Esiintyvyysluokitus: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3 Pixuvrin käyttöön liittyvät haittavaikutukset päättyneistä Pixuvri-monoterapiaa koskeneistatutkimuksista yleisyyden mukaisesti | ||
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Infektiot | Yleiset | Neutropeeninen infektio, hengitystieinfektio, infektio, sepsis |
Melko harvinaiset | Keuhkoputkentulehdus, kandidiaasi, selluliitti, vyöruusu, meningiitti, kynsi-infektio, suun sieni-infektio, huuliherpes, keuhkokuume, salmonella- gastroenteriitti, septinen shokki | |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Melko harvinaiset | Kasvaimen eteneminen |
Veri ja imukudos* | Hyvin yleiset | Neutropenia, leukopenia, lymfopenia, anemia, trombosytopenia |
Yleiset | Kuumeinen neutropenia, veren häiriöt | |
Melko harvinaiset | Luuytimen vajaatoiminta, eosinofilia | |
Immuunijärjestelmä | Melko harvinaiset | Yliherkkyys lääkevalmisteelle |
Aineenvaihdunta ja ravitsemus | Yleiset | Anoreksia, hypofosfatemia |
Melko harvinaiset | Hyperurikemia, hypokalsemia, hyponatremia | |
Psyykkiset häiriöt | Melko harvinaiset | Ahdistuneisuus, unettomuus, unihäiriöt |
Hermosto | Yleiset | Makuaistin häiriöt, parestesia, päänsärky, uneliaisuus |
Melko harvinaiset | Heitehuimaus, letargia | |
Silmät | Yleiset | Konjunktiviitti |
Melko harvinaiset | Silmien kuivuminen, keratiitti | |
Kuulo ja tasapainoelin | Melko harvinaiset | Kiertohuimaus |
Sydän* | Yleiset | Vasemman kammion toimintahäiriö, sydänsairaus, kongestiivinen sydämen vajaatoiminta, haarakatkos, takykardia |
Melko harvinaiset | Arytmia | |
Verisuonisto | Yleiset | Kalpeus, verisuonen värimuutos, hypotensio |
Melko harvinaiset | Laskimosairaus | |
Hengityselimet, rintakehä ja välikarsina | Yleiset | Hengenahdistus, yskä |
Melko harvinaiset | Keuhkopussieffuusio, pneumoniitti, rinorrea | |
Ruoansulatuselimistö | Hyvin yleiset | Pahoinvointi, oksentelu |
Yleiset | Suutulehdus, ripuli, ummetus, vatsakipu, suun kuivuminen, dyspepsia | |
Melko harvinaiset | Ruokatorvitulehdus, suun tuntoharhat, veristä vuotoa peräaukosta | |
Maksa ja sappi | Melko harvinaiset | Hyperbilirubinemia |
Iho ja ihonalainen kudos* | Hyvin yleiset | Ihon värimuutokset, hiustenlähtö |
Yleiset | Punoitus, kynsisairaus, kutina | |
Melko harvinaiset | Yöhikoilu, petekiat, makulaarinen ihottuma, ihon haavauma | |
Luusto, lihakset ja sidekudos | Yleiset | Luusärky |
Melko harvinaiset | Nivelkipu, niveltulehdus, selkäsärky, lihasheikkous, luu-lihaskipu rinnassa, luuston ja lihaksiston jäykkyys, niskakipu, raajakipu | |
Munuaiset ja virtsatiet | Hyvin yleiset | Kromaturia |
Yleiset | Proteinuria, hematuria | |
Melko harvinaiset | Oliguria | |
Sukupuolielimet ja rinnat | Melko harvinaiset | Spontaani erektio |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset | Voimattomuus |
Yleiset | Väsymys, limakalvotulehdus, kuume, rintakipu, turvotus | |
Melko harvinaiset | Vilunväreet, injektiokohdan kylmyys, paikallinen reaktio | |
Tutkimukset | Yleiset | Alaniiniaminotransferaasi koholla, aspartaattiaminotransferaasi koholla, veren alkalinen fosfataasi koholla, veren kreatiniini koholla |
Melko harvinaiset | Bilirubiinia virtsassa, veren fosfori koholla, veren urea koholla, gammaglutamyylitransferaasi koholla, neutrofiilimäärä koholla, painon aleneminen | |
* Alla lisätietoja haittavaikutuksesta
Valikoitujen haittavaikutusten kuvaus
Hematologinen toksisuus ja neutropenian komplikaatiot
Hematologinen toksisuus oli useimmin havaittu toksisuus, mutta se on ollut yleensä helppo hallita tarpeen mukaan granulosyyttiryhmiä stimuloivalla kasvutekijällä (G-CSF) ja verensiirroilla. Vaikka 3. ja 4. asteen neutropeniaa tavattiin satunnaistetuissa tutkimuksissa useammin Pixuvria saaneilla, se oli useimmissa tapauksissa komplisoitumatonta eikä kumulatiivista, ja siihen liittyvän kuumeisen neutropenian tai infektioiden ilmaantuvuus oli pieni, eikä yksikään tapaus johtanut kuolemaan. Mikä tärkeää, kasvutekijätukea ei tarvittu rutiininomaisesti, ja punasolujen ja verihiutaleiden transfuusiot olivat harvinaisia. (katso kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kardiotoksisuus
PIX 301 -tutkimuksessa alentunut ejektiofraktio havaittiin 13 potilaalla (19,1 %) Pixuvri-ryhmässä. Yhdellätoista Pixuvri-valmisteella hoidetuista potilaista nämä olivat 1. tai 2. asteen tapahtumia, kahdella potilaalla astetta 3. Tapahtumat olivat ohimeneviä eivätkä riippuneet Pixuvri-annoksesta. Sydämen vajaatoimintatapahtumia (MedDRA-termit sydämen vajaatoiminta, akuutti sydämen vajaatoiminta ja kongestiivinen sydämen vajaatoiminta) havaittiin kuudella (8,8 %) Pixuvri-hoitoa saaneella potilaalla (1. tai 2. astetta kahdella potilaalla, 3. astetta yhdellä potilaalla ja 5. astetta kolmella potilaalla, joista kahdella se katsottiin hoitoon liittymättömäksi). Kolmella Pixuvri- potilaalla (4,4 %) oli takykardia, arytmia, sinustakykardia, supraventrikulaarinen takykardia tai bradykardia. Valtaosa potilaista oli saanut aiemmin doksorubisiinia tai vastaavaa enintään annoksina 450 mg/m2.
Sydämen lähtötason toiminnan arviointia isotooppiventrikulografialla (MUGA) tai kaikukardiografialla (ECHO) suositellaan, erityisesti, jos potilaalla on kasvaneen sydäntoksisuuden riskitekijöitä. Toistuvia LVEF:n isotooppiventrikulografia- tai kaikukardiografiamäärityksiä on harkittava potilailla, joilla on sellaisia riskitekijöitä kuin aiempi suuri altistuminen antrasykliineille tai merkitsevä ennalta esiintyvä sydäntauti. (katso kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muita yleisiä toksisuuksia
Ihon värimuutokset ja kromaturia ovat tunnettuja Pixuvrin antamiseen liittyviä vaikutuksia, jotka johtuvat yhdisteen väristä (sininen). Ihon värimuutokset häviävät yleensä muutaman päivän kuluessa, kun lääkevalmiste poistuu kehosta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisessä tutkimusohjelmassa on raportoitu yksi Pixuvri-yliannostapaus, johon ei raportoitu liittyneen samanaikaisia haittavaikutuksia.
Yksittäisiä piksantroniannoksia aina 158 mg:aan/m2 asti annettiin suurenevin annoksin tehdyissä kliinisissä tutkimuksissa ilman, että havaittiin annoksesta riippuvaa toksisuutta.
Yliannostustapauksessa suositellaan tukihoitotoimenpiteitä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Syöpälääkkeet, antrasykliinit ja vastaavat aineet
ATC-koodi L01DB11
Vaikutusmekanismi
Pixuvrin vaikuttava aine on piksantroni, joka on sytotoksinen atsa-antraseenidioni.
Toisin kuin hyväksytyt antrasykliinit (doksorubisiini ym.) ja antraseenidionit (mitoksantroni), piksantroni on vain heikko topoisomeraasi II:n estäjä. Myös toisin kuin antrasykliinit tai antraseenidionit, piksantroni alkyloi DNA:ta suoraan muodostaen stabiileja DNA-addukteja ja aiheuttaen kaksoissäikeen katkeamia. Lisäksi, koska piksantronin rengasrakenteessa on mukana typpiheteroatomi eikä siinä ole ketoniryhmiä, piksantronilla on vähemmän taipumusta tuottaa reaktiivisia happilajeja, sitoa rautaa ja muodostaa alkoholimetaboliitteja, joiden ajatellaan olevan antrasykliinien sydäntoksisuuden syy. Ainutlaatuisen rakenteensa vuoksi piksantroni aiheutti erittäin vähän sydäntoksisuutta doksorubisiiniin tai mitoksantroniin verrattuna koe-eläinmalleissa.
Vaiheen 1 tutkimusten ja yhdistelmähoitojen (vaihe 1/2) kattava retrospektiivinen farmakokineettinen/farmakodynaaminen populaatioanalyysi osoitti, että aika ilman taudin etenemistä ja 2. tai 3. asteen neutropenia liittyivät Pixuvri-altistukseen.
Kliininen teho ja turvallisuus
Pixuvrin turvallisuutta ja tehoa yksittäishoitona arvioitiin satunnaistetussa, aktiivikontrolloidussa monikeskustutkimuksessa, johon osallistuneilla potilailla oli uusiutunut tai refraktorinen, aggressiivinen NHL. Nämä potilaat olivat saaneet hoitoja aiemmin ainakin kahdesti (PIX 301). Tutkimuksessa satunnaistettiin 140 potilasta (1:1) saamaan joko Pixuvri-hoitoa tai tutkijan valitsemaa yksittäistä kemoterapia-ainetta verrokkihaarassa. Potilaiden demografia ja lähtötilanteen tautiominaisuudet olivat hoitoryhmien välillä hyvin tasapainossa, eikä tilastollisesti merkitseviä eroja havaittu. Tutkimukseen osallistuneiden mediaani-ikä oli 59 vuotta, heistä 61 % oli miehiä, 64 % valkoihoisia, 76 %:lla oli lähtötilanteessa Ann Arbor -luokituksen vaiheen III/IV NHL, 74 %:lla oli IPI-pisteet ≥ 2 (IPI: International Prognostic Index) ja 60 % oli saanut ≥ 3 aiempaa kemoterapiaa. Avaintutkimukseen ei otettu mukaan manttelisolulymfoomaa sairastavia potilaita. PIX 301 ‑tutkimukseen osallistuvien potilaiden oli täytynyt olla herkkiä aiemmalle antrasykliinihoidolle (varmistettu tai varmistamaton täydellinen vaste [CR] tai osittainen vaste [PR]).
Aiemmin rituksimabilla hoidetuista potilaista on rajoitetusti tietoa (38 potilasta Pixuvri-haarassa ja 39 potilasta verrokkihaarassa).
Tuumorivasteen arvioi sokkoutettu, keskitetty, itsenäinen arviointiryhmä niiden standardoitujen kriteerien mukaisesti, joista oli päätetty NHL:lle kansainvälisessä työryhmässä. Pixuvrilla hoidetuilla potilailla havaittiin verrokkiryhmään nähden merkitsevästi enemmän täydellisiä vasteita ja varmistamattomia täydellisiä vasteita (CR/CRu) ja korkeampi objektiivisten vasteiden määrä (ORR) (ks. taulukko 4).
Taulukko 4 Yhteenveto itsenäisen arviointiryhmän määrittämistä hoitovasteista (Intend-to-treat-populaatio) | ||||||
Hoidon lopussa | Tutkimuksen lopussa | |||||
Pixuvri (n=70) | Verrokki (n=70) | p-arvo | Pixuvri (n = 70) | Verrokki (n = 70) | p-arvo | |
CR/CRu | 14 (20,0 %) | 4 (5,7 %) | 0,021 | 17 (24,3 %) | 5 (7,1 %) | 0,009 |
CR | 8 (11,4 %) | 0 (0 %) | 11 (15,7 %) | 0 (0,0 %) | ||
CRu | 6 (8,6 %) | 4 (5,7 %) | 6 (8,6 %) | 5 (7,1 %) | ||
ORR (CR, CRu ja PR) | 26 (37,1 %) | 10 (14,3 %) | 0,003 | 28 (40,0 %) | 10 (14,3 %) | 0,001 |
Fisherin testiä käytettiin vertaamaan osuuksia Pixuvri- ja verrokkikemoterapiaryhmissä. | ||||||
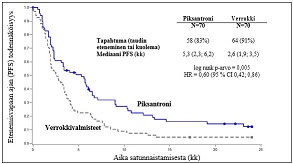
Pixuvri-valmisteella hoidetuilla potilailla osoitettiin verrokkivalmisteilla hoidettuihin potilaisiin verrattuna 40 %:n paraneminen taudin etenemisvapaassa ajassa (PFS); mediaaniaika taudin etenemiseen oli 2,7 kuukautta pitempi (riskitiheyssuhde (HR) = 0,60; log-rank p-arvo = 0,005) (ks. kuva 1 alla).
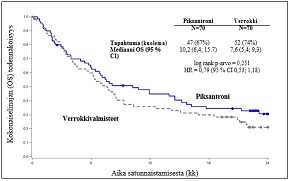
Kokonaiselinajan (OS) mediaani oli Pixuvri-hoitoa saaneilla 2,6 kuukautta pitempi kuin verrokkihoitoa saaneilla (HR = 0,79; log-rank p = 0,25) (ks. kuva 2 alla).
Kuva 1
PIX 301 NHL:n etenemisvapaa aika – tutkimuksen loppu
Kuva 2
PIX 301 Kokonaiselinaika – tutkimuksen loppu
Rituksimabilla esihoidetuilla potilailla oli Pixuvrilla hoidettaessa edelleen verrokkivalmisteeseen nähden parempi kokonaishoitovaste (31,6 % Pixuvrilla vs. 17,9 % verrokilla) ja mediaaniaika taudin etenemiseen (3,3 kuukautta Pixuvrilla vs. 2,5 kuukautta verrokilla). Pixuvrin hyötyä ei kuitenkaan ole varmistettu käytettäessä 5:nen tai myöhemmän linjan hoitona potilaille, joiden edellinen hoito ei ole tehonnut, ja tästä potilasryhmästä on hyvin vähän tietoa.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Pixuvri- valmisteen käytöstä kaikkien pediatristen potilasryhmien non-Hodgkin-lymfooman hoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Laskimonsisäisen annon jälkeen piksantronin plasmakonsentraatiot olivat korkeimmillaan infuusion lopussa ja laskivat sitten polyeksponentiaalisesti. Pixuvrin farmakokinetiikka oli annoksesta riippumatonta välillä 3 mg/m2 - 105 mg/m2, eikä siinä havaittu oleellisia muutoksia, annettiinpa lääke monoterapiana tai yhdistelmähoitotutkimuksissa. Keskimääräiset altistukset yksittäishoitona olivat seuraavanlaiset:
Pixuvri-annos (mg/m2) | Potilasmäärä | AUC (0-24h) (ng.h/ml ) |
33 | 3 | 982 ± 115 |
49 | 6 | 1727 ± 474 |
88 | 2 | 3811 |
Farmakokineettisten tietojen populaatioanalyysissä kohdeannokselle 50 mg/m2 piksantronia saatiin 28 päivän hoitojakson mediaanialtistukseksi 6320 ng.h/ml (90 %:n luottamusväli, 5990–6800 ng.h/ml), kun potilaat saivat 3 annosta 4 viikon jakson aikana.
Jakautuminen
Pixuvrilla on suuri jakautumistilavuus, 25,8 l, ja se sitoutuu plasmaproteiineihin noin 50-prosenttisesti.
Biotransformaatio
Asetyloidut metaboliitit ovat piksantronin pääasiallisia biotransformaatiotuotteita. Piksantronin konversio asetyloiduiksi metaboliiteiksi joko NAT1- tai NAT2-entsyymin kautta oli kuitenkin hyvin vähäistä in vitro. Yhdiste erittyi ihmisen virtsaan etupäässä muuttumattomana. Virtsasta löydettiin vain hyvin pieniä määriä faasin I ja faasin II asetyloituja metaboliitteja. Näin ollen metaboloituminen ei näytä olevan tärkeä eliminaatioreitti piksantronille. Asetyloidut metaboliitit olivat farmakologisesti epäaktiivisia ja metabolisesti stabiileja.
Eliminaatio
Piksantronin kokonaispuhdistuma plasmasta, 72,7 l/h, on kohtalainen tai nopea. Hidas munuaiseritys vastasi vain kymmentä prosenttia annetusta annoksesta 0–24 tunnissa. Terminaalinen puoliintumisaika vaihteli 14,5 tunnista 44,8 tuntiin, ja keskiarvo oli 23,3 ± 8,0 (n = 14, CV = 34 %) ja mediaani 21,2 tuntia. Munuaispuhdistuman vähäisestä osuudesta johtuen puhdistuma plasmasta tapahtuu etupäässä munuaisten ulkopuolella. Pixuvri saattaa metaboloitua maksassa ja/tai erittyä sappeen. Koska piksantronin metabolia vaikuttaa olevan vähäistä, muuttumattoman piksantronin sappieritys saattaa olla pääasiallinen eliminoitumisreitti. Maksapuhdistuma on suunnilleen samaa luokkaa kuin maksan plasmavirtaus, mikä viittaa korkeaan ekstrahointisuhteeseen maksassa ja siten tehokkaaseen kanta-aineen (vaikuttavan aineen) eliminointiin. Piksantronin aktiivinen soluunotto maksassa välittyy mahdollisesti OCT1-kuljettimien kautta, ja eritystä sappeen välittävät mahdollisesti P‑pg ja BCRP.
Piksantronilla on vain heikko tai olematon kyky inhiboida P‑gp:n, BCRP:n ja BSEP:n kuljetusmekanismeja in vitro.
Piksantroni inhiboi OCT1-välitteistä metformiinikuljetusta in vitro, mutta sen ei uskota inhiboivan OCT1:a in vivo kliinisesti merkittävillä pitoisuuksilla.
Piksantroni oli huono OATP1B1:n ja OATP1B3:n soluunottokuljettimien estäjä in vitro.
Lineaarisuus/ei-lineaarisuus
Piksantronin farmakokinetiikka osoittautui lineaariseksi laajalla annosalueella, 3 mg/m2 ‑ 105 mg/m2.
Farmakokineettiset/farmakodynaamiset suhteet
Plasman piksantronialtistuksen ja neutrofiilimäärien välillä on havaittu yhteys.
Prekliiniset tiedot turvallisuudesta
Kun hiirille annettiin laskimonsisäisesti 29 mg/kg ja 38 mg/kg Pixuvria yksittäisannoksena, seurasi välitön kuolema (114 mg/m2, LD10). Veren valko- ja punasolujen määrissä havaittiin laskua, ja luuytimessä, pernassa, munuaisissa ja kiveksissä havaittiin muutoksia. Samantapaisia tuloksia saatiin rotilla, sekä koirilla 116 mg/m2:n annoksilla. Koirilla havaittiin takykardiaa ja EKG- muutoksia heti hoidon jälkeen.
Hiirien, rottien ja koirien toistetuilla annoksilla suoritetuissa tutkimuksissa päälöydökset olivat myelotoksisuus, munuaistoksisuus (paitsi koirilla) ja kivesvauriot.
Kun Pixuvria annettiin koirille 0,5–0,9 mg/kg kuuden hoitosyklin ajan, se ei aiheuttanut kuolemaa eikä vakavia kliinisiä löydöksiä, mukaan lukien EKG-muutokset tai muutokset kehon painossa. Urokset olivat herkempiä hoidolle mitä tuli veren valkosolu- ja verihiutalemäärien pienemiseen (ohimenevä) ja imusoluvajeeseen (pernassa ja kateenkorvassa) sekä sytotoksiselta aineelta odotettavaan ilmeiseen toksisuuteen lisääntymiselimissä. Farmakokineettisissä parametreissa ei havaittu huomattavia eroja urosten ja naaraiden välillä lukuun ottamatta naaraiden ohimenevää kasvanutta altistumista kolmannen hoitosyklin jälkeen. Uroksilla altistuminen oli kuitenkin jonkin verran suurempaa kuin naarailla.
Koirilla hoito ei vaikuttanut sydämeen; EKG-muutoksia ei havaittu hoidon missään vaiheessa, eikä makropatologiassa tai histopatologiassa havaittu muutoksia sydämessä. Munuaisten toiminta ja histologia eivät myöskään muuttuneet 4 viikon tai 26 viikon tutkimuksissa.
Pixuvrin sydäntoksisuutta verrattiin aktiivisuudeltaan vastaaviin doksorubisiini- ja mitoksantroniannoksiin ennalta hoitamattomissa ja aikaisemmin doksorubisiinillä hoidetuissa hiirissä. Piksantronidimaleaatin anto korkeintaan 27 mg/kg:n annoksena kahdesti viikossa neljän viikon ajan ei aiheuttanut sydäntoksisia vaikutuksia, kun mitoksantroni taas oli odotetusti sydäntoksinen kaikilla testatuilla annoksilla (0,6, 1,6 ja 1,5 mg/kg). Pixuvri aiheutti vähäistä nefropatiaa. Pixuvrin havaittiin myös olevan hyvin lievästi sydäntoksinen käytettäessä toistuvia hoitosyklejä samoilla annoksilla.
Genotoksisuustutkimukset vahvistivat klastogeenisten vaikutusten mahdollisuuden nisäkässoluissa in vitro ja in vivo. Pixuvri oli mutageeninen Amesin testissä, lisäsi kromosomipoikkeavuuksien määrää ihmisen lymfosyyteissä ja lisäsi mikrotumia sisältävien solujen esiintymistaajuutta in vivo.
Rotilla ja kaneilla Pixuvri aiheutti toksisuutta emolle ja sikiölle niinkin alhaisilla pitoisuuksilla kuin 1,8 mg/kg, joka annettiin tiineyden päivinä 9–11; suuremmat annokset johtivat raskauden keskeytymiseen ja alkion täydelliseen resorptioon. Alkiotoksisuuden piirteitä olivat sikiön alentunut paino, sikiön epämuodostumat ja epätäydellinen tai viivästynyt sikiön luutuminen. Pixuvrilla ei suoritettu pitkäkestoisia eläintutkimuksia valmisteen karsinogeenisen potentiaalin määrittämiseksi. Paikallista siedettävyyttä ei tutkittu.
Pixuvrin on osoitettu aiheuttavan fototoksisia vaikutuksia 3T3-soluissa in vitro.
Hiirillä tehdyssä kantasoluryhmien muodostumisen yksiköitä mittaavassa tutkimuksessa Pixuvrin ja mitoksantronin myelotoksisuudet olivat samankaltaiset, kun niitä annettiin LD10-annoksina (piksantronidimaleaatti 38 mg/kg ja mitoksantroni 6,1 mg/kg).
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Laktoosimonohydraatti
Natriumhydroksidi (pH:n säätämiseen)
Suolahappo (pH:n säätämiseen)
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamaton injektiopullo
5 vuotta
Käyttökuntoon saatettu ja laimennettu liuos
Käytönaikainen kemiallinen ja fysikaalinen säilyvyys on osoitettu 24 tunnin ajalle huoneenlämmössä (15 °C - 25°C) alttiina päivänvalolle, polyeteenistä (PE) valmistetuissa, infuusionesteille tarkoitetuissa standardipusseissa.
Mikrobiologiselta kannalta liuos tulisi käyttää välittömästi. Jos sitä ei käytetä välittömästi, käyttöliuoksen säilytysajat ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla eikä niiden tule normaalisti ylittää 24 tuntia 2 °C - 8 °C:ssa, paitsi jos käyttökuntoon saattaminen ja laimentaminen on tehty kontrolloiduissa ja validoiduissa aseptisissa oloissa.
Säilytys
Säilytä jääkaapissa (2°C - 8°C).
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun ja laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PIXUVRI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
29 mg 1 kpl (889,61 €)
PF-selosteen tieto
I-tyypin lasista valmistettu injektiopullo, jossa on harmaa butyylikumitulppa, alumiinisinetti ja punainen muovikorkki ja joka sisältää 50 mg piksantronidimaleaattia vastaten 29 mg:aa piksantronia.
Pakkauskoko: 1 injektiopullo.
Valmisteen kuvaus:
Tummansininen kylmäkuivattu jauhe.
Käyttö- ja käsittelyohjeet
Käyttökuntoon saattaminen ja laimentaminen
Saata kukin 29 mg:n injektiopullo käyttökuntoon aseptisesti 5 ml:lla injektointiin tarkoitettua 9 mg/ml:n (0,9 %) natriumkloridiliuosta. Kylmäkuivatun jauheen pitäisi liueta täysin 60 sekunnissa, kun pulloa ravistetaan. Tuloksena on tummansininen kantaliuos, jossa piksantronin pitoisuus on 5,8 mg/ml.
Vedä injektiopullosta aseptisesti tarvitsemasi tilavuus (eli tilavuus, jolla saat annosta vastaavan milligrammamäärän 5,8 mg/ml:n liuoksesta) ja siirrä vetämäsi kantaliuos infuusiopussiin, joka sisältää 250 ml injektointiin tarkoitettua 9 mg/ml:n (0,9 %) natriumkloridiliuosta. Piksantronin lopullisen pitoisuuden infuusiopussissa tulee olla alle 580 mikrogrammaa/ml, mikä lasketaan pussiin lisätyn käyttökuntoon saatetun lääkevalmisteen määrän pohjalta. Yhteensopivuutta muiden laimentimien kanssa ei ole määritetty. Sekoita infuusiopussin sisältö huolellisesti kantaliuoksen siirron jälkeen. Laimennetun liuoksen tulisi olla kirkas ja tummansininen.
Kun laimennettua Pixuvri-liuosta annetaan potilaalle, tulee laskimolinjaan laittaa huokoskooltaan 0,2 µm:n polyeetterisulfonisuodatin.
Pixuvri on sytotoksinen aine. Vältä sen joutumista silmiin ja iholle. Käytä käsineitä, kasvosuojainta ja suojalaseja, kun käsittelet Pixuvria ja kun suoritat dekontaminaatiotoimenpiteitä.
Erityiset varotoimet hävittämiselle
Pixuvri on kertakäyttöinen. Käyttämätön lääkevalmiste tai jäte, kuten käyttökuntoon saattamisessa, laimentamisessa ja lääkkeen antamisessa käytetyt tarvikkeet, on hävitettävä paikallisten, sytotoksisille aineille tarkoitettujen vaatimusten mukaisesti.
Korvattavuus
PIXUVRI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
29 mg 1 kpl
- Ei korvausta.
ATC-koodi
L01DB11
Valmisteyhteenvedon muuttamispäivämäärä
08.10.2019
Yhteystiedot
Äyritie 22
01510 Vantaa
09 279 8080
www.servierfinland.fi
info.finland@servier.com
