TIBSOVO tabletti, kalvopäällysteinen 250 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää 250 mg ivosidenibia.
Apuaine(et), joiden vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää laktoosimonohydraattia, joka vastaa 9,5 mg laktoosia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Tibsovo on tarkoitettu yhdistelmänä atsasitidiinin kanssa sellaisten aikuispotilaiden hoitoon, joilla on hiljattain todettu akuutti myelooinen leukemia (AML), jossa on isositraattidehydrogenaasi-1 (IDH1) R132 -mutaatio, ja joille tavanomainen induktiosolunsalpaajahoito ei sovellu (ks. kohta Farmakodynamiikka).
Tibsovo on tarkoitettu monoterapiana sellaisten aikuispotilaiden hoitoon, joilla on paikallisesti edennyt tai metastaattinen kolangiokarsinooma, jossa on IDH1 R132 -mutaatio, ja joita on aikaisemmin hoidettu ainakin yhdellä systeemisellä hoitolinjalla (ks. kohta Farmakodynamiikka).
Ehto
Hoito tulee aloittaa syövän hoitoon tarkoitettujen lääkevalmisteiden antamiseen perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito on aloitettava sellaisten lääkärien valvonnassa, jotka ovat perehtyneitä syöpälääkkeiden käyttöön.
Ennen Tibsovo-valmisteen käyttämistä potilailta täytyy olla vahvistettu IDH1 R132 -mutaatio, joka on todettu asianmukaisella diagnostisella testillä.
Annostus
Akuutti myelooinen leukemia
Suositeltu annos on 500 mg ivosidenibia (2 x 250 mg tablettia) suun kautta otettuna kerran vuorokaudessa.
Ivosidenibi on aloitettava syklin 1 päivänä 1, yhdessä atsasitidiinin kanssa annoksella 75 mg/m2 kehon pinta-alaa kohden, laskimoon tai ihon alle, kerran vuorokaudessa jokaisen 28 päivän syklin päivinä 1‑7. Atsasitidiinin ensimmäisessä hoitosyklissä annoksen on oltava 100-prosenttinen. Suositellaan, että potilaita hoidetaan vähintään 6 syklin ajan.
Katso atsasitidiinin annostus ja antotapa atsasitidiinin täydellisistä valmistetiedoista.
Hoitoa on jatkettava, kunnes sairaus etenee tai potilas ei enää siedä hoitoa.
Kolangiokarsinooma
Suositeltu annos on 500 mg ivosidenibia (2 x 250 mg tablettia) suun kautta otettuna kerran vuorokaudessa.
Hoitoa on jatkettava, kunnes sairaus etenee tai potilas ei enää siedä hoitoa.
Väliin jääneet tai viivästyneet annokset
Jos annos jää väliin tai sitä ei oteta tavalliseen aikaan, tabletit on otettava mahdollisimman pian 12 tunnin sisällä väliin jääneen annoksen jälkeen. Kahta annosta ei saa ottaa 12 tunnin sisällä. Tabletit on otettava tavalliseen tapaan seuraavana päivänä.
Jos potilas oksentaa annoksen, korvaavia tabletteja ei pidä ottaa. Tabletit on otettava tavalliseen tapaan seuraavana päivänä.
Varotoimet ennen antoa ja seuranta
Ennen hoidon aloittamista on otettava sydänsähkökäyrä (EKG). Sykkeeseen suhteutetun QT:n (QTc) on oltava alle 450 millisekuntia ennen hoidon aloittamista, ja jos epänormaali QT-aika havaitaan, lääkäreiden on arvioitava tarkasti ivosidenibihoidon aloittamisen hyöty ja riski. Jos QTc-aika on pidentynyt välille 480 millisekuntia ja 500 millisekuntia, ivosidenibihoito tulee aloittaa vain poikkeuksellisissa tilanteissa ja siihen tulee liittyä tarkka seuranta.
EKG on otettava ennen hoidon aloittamista, vähintään viikoittain hoidon ensimmäisten 3 viikon aikana ja tämän jälkeen kuukausittain, jos QTc-aika pysyy arvossa ≤ 480 millisekuntia. Epänormaalit QTc-ajat on hoidettava viipymättä (ks. taulukko 1 ja kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos oireet viittaavat pidentyneeseen QTc aikaan, EKG on otettava kliinisen tarpeen mukaan.
Sellaisten lääkevalmisteiden, joiden tiedetään pidentävän QTc-aikaa, tai kohtalaisten tai voimakkaiden CYP3A4:n estäjien samanaikainen anto voi suurentaa QTc-ajan pidentymisen riskiä, ja niitä on vältettävä mahdollisuuksien mukaan Tibsovo-hoidon aikana. Potilaita on hoidettava varovaisuutta noudattaen ja QTc-ajan mahdollista pitenemistä tarkasti seuraten, mikäli muu sopiva hoitovaihtoehto ei ole mahdollinen. EKG on otettava ennen samanaikaista antoa, sitä on seurattava viikoittain vähintään 3 viikon ajan ja tämän jälkeen kliinisen tarpeen mukaan (ks. alla ja kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Haittavaikutukset).
Täydellinen verenkuva ja veren kemialliset arvot on arvioitava ennen Tibsovo-valmisteen käytön aloittamista, sekä ainakin kerran viikossa ensimmäisen hoitokuukauden aikana ja joka toinen viikko toisen kuukauden aikana, ja jokaisella käynnillä hoidon keston ajan kliinisen tarpeen mukaan.
Annosmuutokset, jos samanaikaisesti annetaan kohtalaisia tai voimakkaita CYP3A4:n estäjiä
Jos kohtalaisten tai voimakkaiden CYP3A4:n estäjien käyttöä ei voida välttää, ivosidenibin suositeltu annos on pienennettävä 250 mg:aan (1 x 250 mg:n tabletti) kerran vuorokaudessa. Jos kohtalaisen tai voimakkaan CYP3A4:n estäjän käyttö keskeytetään, ivosidenibin annos on nostettava 500 mg:aan, kun on kulunut vähintään 5 CYP3A4:n estäjän puoliintumisaikaa (ks. alla ja kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Annosmuutokset ja haittavaikutusten hoitosuositukset
Taulukko 1 - Suositellut annosmuutokset haittavaikutusten ilmaantuessa
Haittavaikutus | Suositeltu toimenpide |
Erilaistumisoireyhtymä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) |
|
Leukosytoosi (valkosolut > 25 x 109/l tai valkosolujen kokonaismäärän absoluuttinen lisäys > 15 x 109/l lähtötilanteesta, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) |
|
QTc-ajan pidentyminen ˃ 480–500 millisekuntia (aste 2, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Haittavaikutukset) |
|
QTc-ajan pidentyminen arvoon ˃ 500 millisekuntia (aste 3, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Haittavaikutukset) |
|
QTc-arvon pidentyminen, johon liittyy hengenvaarallisen kammioarytmian merkkejä/oireita (aste 4, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Haittavaikutukset) |
|
Muut asteen ≥ 3 haittavaikutukset |
|
Aste 1 on lievä, aste 2 on kohtalainen, aste 3 on vaikea, aste 4 on hengenvaarallinen.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäillä potilailla (≥ 65-vuotiaat, ks. kohdat Haittavaikutukset ja Farmakokinetiikka). Yli 85-vuotiaista potilaista ei ole saatavilla tietoja.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä (eGFR ≥ 60 – ˂ 90 ml/min/1,73 m2) tai kohtalainen (eGFR ≥ 30 – ˂ 60 ml/min/1,73 m2) munuaisten vajaatoiminta. Suositeltua annosta ei ole määritelty potilaille, joilla on vaikea munuaisten vajaatoiminta (eGFR ˂ 30 ml/min/1,73 m2). Tibsovo-valmistetta on käytettävä varoen potilaille, joilla on vaikea munuaisten vajaatoiminta, ja tätä potilasryhmää on seurattava tarkasti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä maksan vajaatoiminta (Child–Pugh-luokka A). Suositeltua annosta ei ole määritelty potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta (Child–Pugh-luokat B ja C). Tibsovo-valmistetta on käytettävä varoen potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta, ja tätä potilasryhmää on seurattava tarkasti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Tibsovo-valmisteen turvallisuutta ja tehoa < 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Tibsovo otetaan suun kautta.
Tabletit otetaan kerran vuorokaudessa suurin piirtein samaan aikaan joka päivä. Potilaiden ei tule syödä mitään 2 tuntiin ennen tablettien ottamista eikä 1 tuntiin tablettien ottamisen jälkeen (ks. kohta Farmakokinetiikka). Tabletit tulee niellä kokonaisina veden kanssa.
Potilaita on neuvottava välttämään greippiä ja greippimehua hoidon aikana (ks. kohta Yhteisvaikutukset). Potilaita on myös neuvottava olemaan nielemättä tablettipullossa olevaa piidioksidigeelikuivausainetta (ks. kohta Pakkaukset ja valmisteen kuvaus).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Voimakkaiden CYP3A4:n indusoijien tai dabigatraanin samanaikainen anto (ks. kohta Yhteisvaikutukset).
Synnynnäinen pitkä QT -oireyhtymä.
Sukuhistoria, jossa on äkkikuolemia tai polymorfinen kammioarytmia.
QT/QTc-aika > 500 millisekuntia, suhteutusmenetelmästä riippumatta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Erilaistumisoireyhtymä potilailla, joilla on akuutti myelooinen leukemia
Erilaistumisoireyhtymää on raportoitu ivosidenibihoidon jälkeen (ks. kohta Haittavaikutukset). Erilaistumisoireyhtymä voi olla hengenvaarallinen tai kuolemaan johtava, jos sitä ei hoideta (ks. jäljempänä ja kohta Annostus ja antotapa). Erilaistumisoireyhtymään liittyy myelooisten solujen nopea proliferaatio ja erilaistuminen. Oireita ovat mm. ei-infektioosi leukosytoosi, perifeerinen ödeema, kuume, dyspnea, pleuraeffuusio, hypotensio, hypoksia, keuhkoödeema, pneumoniitti, perikardiaalinen effuusio, ihottuma, nesteylimäärä, tuumorilyysioireyhtymä ja kohonnut kreatiniinipitoisuus. Potilaille on kerrottava erilaistumisoireyhtymän merkeistä ja oireista, heitä on neuvottava ottamaan heti yhteyttä lääkäriin, jos niitä ilmenee, ja muistutettava potilaan hälytyskortin pitämisestä aina mukana.
Jos erilaistumisoireyhtymää epäillään, anna systeemisiä kortikosteroideja ja aloita hemodynaaminen seuranta, kunnes oireet poistuvat, mutta jatka sitä kuitenkin vähintään 3 vuorokauden ajan.
Jos havaitaan leukosytoosia, aloita hoito hydroksikarbamidilla hoitoyksikön hoitokäytäntöjen mukaisesti ja aloita leukafereesi kliinisen tarpeen mukaan (ks. kohta Yhteisvaikutukset).
Pienennä kortikosteroidien ja hydroksikarbamidin annosta vasta sen jälkeen kun oireet ovat poistuneet. Erilaistumisoireyhtymän oireet voivat palata, jos kortikosteroidi- ja/tai hydroksikarbamidihoito keskeytetään liian aikaisin. Keskeytä Tibsovo-hoito, jos vaikeat merkit/oireet jatkuvat yli 48 tuntia systeemisten kortikosteroidien aloittamisen jälkeen, ja jatka hoitoa 500 mg:lla ivosidenibia kerran vuorokaudessa, kun merkit/oireet ovat kohtalaisia tai vähäisempiä ja kun potilaan tila on kohentunut.
QTc-ajan pidentyminen
QTc-ajan pidentymistä on raportoitu ivosidenibihoidon jälkeen (ks. kohta Haittavaikutukset).
EKG tulee ottaa ennen hoidon aloittamista, vähintään viikoittain hoidon ensimmäisten 3 viikon aikana ja tämän jälkeen kuukausittain, jos QTc-aika pysyy arvossa ≤ 480 millisekuntia (ks. kohta Annostus ja antotapa). Kaikki epänormaalit arvot on hoidettava välittömästi (ks. kohta Annostus ja antotapa). Jos oireet viittaavat niihin, EKG on otettava kliinisen tarpeen mukaan. Mikäli potilaalla on voimakasta oksentelua ja/tai ripulia, potilaalta tulee arvioida mahdolliset poikkeavuudet seerumin elektrolyyteissä, erityisesti hypokalemia ja magnesium.
Potilaille on kerrottava QT-ajan pidentymisen riskistä, sen merkeistä ja oireista (sydämentykytys, heitehuimaus, pyörtyminen tai jopa sydämenpysähdys), ja heitä on neuvottava ottamaan heti yhteyttä lääkäriin, jos näitä ilmenee.
Sellaisten lääkevalmisteiden, joiden tiedetään pidentävän QTc-aikaa, tai kohtalaisten tai voimakkaiden CYP3A4:n estäjien samanaikainen anto voi suurentaa QTc-ajan pidentymisen riskiä, ja niitä on vältettävä mahdollisuuksien mukaan Tibsovo-hoidon aikana. Potilaita on hoidettava varovaisuutta noudattaen ja QTc-ajan mahdollista pitenemistä on seurattava tarkasti, jos muun sopivan vaihtoehdon käyttäminen ei ole mahdollista. EKG on otettava ennen samanaikaista antoa, sitä on seurattava viikoittain vähintään 3 viikon ajan ja tämän jälkeen kliinisen tarpeen mukaan. Ivosidenibin suositeltua annosta on pienennettävä 250 mg:aan kerran vuorokaudessa, jos kohtalaisten tai voimakkaiden CYP3A4:n estäjien käyttöä ei voida välttää (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset).
Jos furosemidin (OAT3:n substraatti) anto on kliinisesti tarpeellista erilaistumisoireyhtymän merkkien/oireiden hoitamiseksi, potilaita on seurattava tarkasti elektrolyyttien epätasapainon ja QTc-ajan pidentymisen varalta.
Potilaita, joilla on kongestiivinen sydämen vajaatoiminta tai epänormaaleja elektrolyyttiarvoja, on seurattava tarkasti ja EKG:tä ja elektrolyyttejä on tarkkailtava säännöllisesti ivosidenibihoidon aikana.
Tibsovo-hoito on lopetettava pysyvästi, jos potilaille kehittyy QTc-ajan pidentyminen, johon liittyy hengenvaarallisen arytmian merkkejä tai oireita (ks. kohta Annostus ja antotapa).
Ivosidenibia on käytettävä varoen potilaille, joiden albumiinitasot ovat alle normaalin viitealueen tai jotka ovat alipainoisia.
Vaikea munuaisten vajaatoiminta
Ivosidenibin turvallisuutta ja tehoa ei ole varmistettu potilailla, joilla on vaikea munuaisten vajaatoiminta (eGFR ˂ 30 ml/min/1,73 m2). Tibsovo-valmistetta on käytettävä varoen potilaille, joilla on vaikea munuaisten vajaatoiminta, ja tätä potilasryhmää on seurattava tarkasti (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Maksan vajaatoiminta
Ivosidenibin turvallisuutta ja tehoa ei ole varmistettu potilailla, joilla on kohtalainen tai vaikea-asteinen maksan vajaatoiminta (Child–Pugh-luokat B ja C). Tibsovo-valmistetta on käytettävä varoen potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta, ja tätä potilasryhmää on seurattava tarkasti (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Tibsovo-valmistetta on käytettävä varoen potilaille, joilla on lievä maksan vajaatoiminta (Child–Pugh-luokka A) ks. kohta Haittavaikutukset).
CYP3A4:n substraatit
Ivosidenibi indusoi CYP3A4:ää ja voi siten alentaa systeemistä altistumista CYP3A4:n substraateille.
Potilaita on seurattava sienilääkkeen tehon menetyksen varalta, jos itrakonatsolin tai ketokonatsolin käyttöä ei voida välttää (ks. kohta Yhteisvaikutukset).
Naiset, jotka voivat tulla raskaaksi / ehkäisy
Naisille, jotka voivat tulla raskaaksi, on tehtävä raskaustesti ennen Tibsovo-hoidon aloittamista, ja heidän tulee välttää raskaaksi tulemista hoidon aikana (ks. kohta Raskaus ja imetys).
Naisten, jotka voivat tulla raskaaksi, ja miesten, joilla on naispuolisia kumppaneita, jotka voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä Tibsovo-hoidon aikana ja vähintään 1 kuukauden ajan viimeisen annoksen jälkeen.
Ivosidenibi voi pienentää hormonaalisten ehkäisyvalmisteiden systeemisiä pitoisuuksia, ja näin ollen suositellaan samanaikaista estemenetelmän käyttöä (ks. kohdat Yhteisvaikutukset ja Raskaus ja imetys).
Laktoosi-intoleranssi
Tibsovo sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Natriumin määrä
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus ivosidenibiin
Voimakkaat CYP3A4:n indusoijat
Ivosidenibi on CYP3A4:n substraatti. Voimakkaiden CYP3A4:n indusoijien (esim. karbamatsepiini, fenobarbitaali, fenytoiini, rifampisiini, mäkikuisma (Hypericum perforatum)) samanaikaisen annon odotetaan alentavan ivosidenibin plasmapitoisuuksia, ja niiden antaminen on vasta-aiheista Tibsovo-hoidon aikana (ks. kohta Vasta-aiheet). Kliinisiä tutkimuksia, joissa arvioitaisiin ivosidenibin farmakokinetiikkaa CYP3A4:n indusoijan kanssa, ei ole tehty.
Kohtalaiset tai voimakkaat CYP3A4:n estäjät
Terveillä tutkittavilla yksittäisen 250 mg:n ivosidenibiannoksen ja 200 mg:n itrakonatsoliannoksen anto kerran vuorokaudessa 18 vuorokauden ajan suurensi ivosidenibin AUC:ta 169 %:lla (90 %:n luottamusväli: 145, 195) ilman Cmax-muutosta. Kohtalaisten tai voimakkaiden CYP3A4:n estäjien samanaikainen anto lisää ivosidenibin plasmapitoisuuksia. Tämä voi suurentaa QTc-ajan pitenemisen riskiä, ja sopivia vaihtoehtoja, jotka eivät ole kohtalaisia tai voimakkaita CYP3A4:n estäjiä, on harkittava aina kun se on mahdollista Tibsovo-hoidon aikana. Potilaita on hoidettava varovaisuutta noudattaen ja QTc-ajan mahdollista pitenemistä on seurattava tarkasti, jos muun sopivan vaihtoehdon käyttäminen ei ole mahdollista. Jos kohtalaisten tai voimakkaiden CYP3A4:n estäjien käyttöä ei voida välttää, ivosidenibin suositeltu annos on pienennettävä 250 mg:aan kerran vuorokaudessa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
- Kohtalaisia CYP3A4:n estäjiä ovat muun muassa: aprepitantti, siklosporiini, diltiatseemi, erytromysiini, flukonatsoli, greippi ja greippimehu, isavukonatsoli, verapamiili.
- Voimakkaita CYP3A4:n estäjiä ovat muun muassa: klaritromysiini, itrakonatsoli, ketokonatsoli, posakonatsoli, ritonaviiri, vorikonatsoli.
Lääkevalmisteita, joiden tiedetään pitkittävän QTc-aikaa
Sellaisten lääkevalmisteiden samanaikainen anto, joiden tiedetään pidentävän QTc-aikaa (esim. rytmihäiriölääkkeet, fluorokinolonit, 5-HT3-reseptorin antagonistit, triatsoli-sienilääkkeet), voi suurentaa QTc-ajan pidentymisen riskiä, ja niitä on vältettävä mahdollisuuksien mukaan Tibsovo-hoidon aikana. Potilaita on hoidettava varovaisuutta noudattaen, ja QTc-ajan mahdollista pitenemistä on seurattava tarkasti, jos muun sopivan vaihtoehdon käyttäminen ei ole mahdollista (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Ivosidenibin vaikutus muihin lääkevalmisteisiin
Yhteisvaikutukset kuljetusproteiinien kanssa
Ivosidenibi estää P-gp:tä, ja sillä on potentiaalia indusoida P-gp:tä. Näin ollen se voi muuttaa systeemistä altistumista vaikuttaville aineille, jotka ovat pääasiallisesti P-gp:n kuljettamia (esim. dabigatraani). Dabigatraanin samanaikainen anto on vasta-aiheista (ks. kohta Vasta-aiheet).
Ivosidenibi estää OAT3:a, orgaanista anionia kuljettavaa polypeptidi 1B1:tä (OATP1B1) ja orgaanista anionia kuljettavaa polypeptidi 1B3:a (OATP1B3). Näin ollen se voi lisätä systeemistä altistumista OAT3:n tai OATP1B1/-1B3:n substraateille. OAT3:n substraattien (esim. bentsyylipenisilliini, furosemidi) tai herkkien OATP1B1/1B3:n substraattien (esim. atorvastatiini, pravastatiini, rosuvastatiini) samanaikaista antoa on vältettävä aina kun se on mahdollista Tibsovo-hoidon aikana (ks. kohta Farmakokinetiikka). Potilaita on hoidettava varovaisuutta noudattaen, jos muun sopivan vaihtoehdon käyttäminen ei ole mahdollista. Jos furosemidin anto on kliinisesti tarpeellista erilaistumisoireyhtymän merkkien/oireiden hoitamiseksi, potilaita on seurattava tarkasti elektrolyyttien epätasapainon ja QTc-ajan pidentymisen varalta.
Entsyymin induktio
Sytokromi P450 (CYP) -entsyymit
Ivosidenibi indusoi seuraavia: CYP3A4, CYP2B6, CYP2C8, CYP2C9 ja saattaa indusoida CYP2C19:ää. Näin ollen se voi alentaa systeemistä altistumista näiden entsyymien substraateille. Sopivia vaihtoehtoja, jotka eivät ole kapean terapeuttisen indeksin omaavia CYP3A4:n, CYP2B6:n, CYP2C8:n tai CYP2C9:n substraatteja, tai CYP2C19:n substraatteja, tulee harkita Tibsovo-hoidon aikana. Potilaita on seurattava substraatin tehon menetyksen varalta, jos sellaisten lääkevalmisteiden käyttöä ei voida välttää (ks. kohta Farmakokinetiikka).
- CYP3A4:n substraatteja, joilla on kapea terapeuttinen indeksi, ovat muun muassa: alfentaniili, siklosporiini, everolimuusi, fentanyyli, pimotsidi, kinidiini, sirolimuusi, takrolimuusi.
- CYP2B6:n substraatteja, joilla on kapea terapeuttinen indeksi, ovat muun muassa: syklofosfamidi, ifosfamidi, metadoni.
- CYP2C8:n substraatteja, joilla on kapea terapeuttinen indeksi, ovat muun muassa: paklitakseli, pioglitatsoni, repaglinidi.
- CYP2C9:n substraatteja, joilla on kapea terapeuttinen indeksi, ovat muun muassa: fenytoiini, varfariini.
- CYP2C19:n substraatteja ovat muun muassa: omepratsoli.
Itrakonatsolia tai ketokonatsolia ei tule käyttää samanaikaisesti Tibsovo-valmisteen kanssa, koska sienilääkkeen tehon odotetaan vähenevän.
Ivosidenibi voi pienentää hormonaalisten ehkäisyvalmisteiden systeemisiä pitoisuuksia, ja näin ollen suositellaan samanaikaista estemenetelmän käyttöä vähintään 1 kuukauden ajan viimeisen annoksen jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys).
Uridiinidifosfaattiglukuronosyylitransferaasit (UGT:t)
Ivosidenibilla on potentiaalia indusoida UGT-entsyymejä, ja se voi näin ollen alentaa systeemistä altistumista näiden entsyymien substraateille (esim. lamotrigiini, raltegraviiri). Sopivia vaihtoehtoja, jotka eivät ole UGT:n substraatteja, on harkittava Tibsovo-hoidon aikana. Potilaita on seurattava UGT:n substraatin tehon katoamisen varalta, jos sellaisten lääkevalmisteiden käyttöä ei voida välttää (katso kohta Farmakokinetiikka).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy
Naisille, jotka voivat tulla raskaaksi, on tehtävä raskaustesti ennen Tibsovo-hoidon aloittamista, ja heidän tulee välttää raskaaksi tulemista hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Naisten, jotka voivat tulla raskaaksi, ja miesten, joilla on naispuolisia kumppaneita, jotka voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä Tibsovo-hoidon aikana ja vähintään 1 kuukauden ajan viimeisen annoksen jälkeen.
Ivosidenibi voi pienentää hormonaalisten ehkäisyvalmisteiden systeemisiä pitoisuuksia, ja näin ollen suositellaan samanaikaista vaihtoehtoisen ehkäisymenetelmän, kuten estemenetelmän, käyttöä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Raskaus
Ei ole olemassa riittävästi tietoja ivosidenibin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Tibsovo-valmisteen käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä tehokasta ehkäisyä. Potilaille on kerrottava sikiöön kohdistuvasta mahdollisesta riskistä, jos sitä käytetään raskauden aikana tai jos potilas (tai hoidetun miespotilaan naiskumppani) tulee raskaaksi hoidon aikana tai yhden kuukauden aikana viimeisen annoksen jälkeen.
Imetys
Ei tiedetä, erittyvätkö ivosidenibi tai sen metaboliitit ihmisen rintamaitoon. Eläimillä ei ole tehty tutkimuksia, jotta voitaisiin arvioida ivosidenibin ja sen metaboliittien erittymistä koe-eläinten rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea.
Rintaruokinta on lopetettava Tibsovo-hoidon ajaksi ja vähintään 1 kuukauden ajaksi viimeisen annoksen jälkeen.
Hedelmällisyys
Ivosidenibin mahdollisia vaikutuksia hedelmällisyyteen ei tunneta. Eläimillä ei ole tehty hedelmällisyystutkimuksia ivosidenibin vaikutusten arvioimiseksi. Lisääntymiselimiin kohdistuvia haittavaikutuksia havaittiin 28 vuorokauden toistuvan toksisuuden tutkimuksessa (ks. kohta Prekliiniset tiedot turvallisuudesta). Näiden vaikutusten kliinistä merkitystä ei tunneta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ivosidenibilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Joillakin ivosidenibia käyttävillä potilailla on raportoitu väsymystä ja heitehuimausta (ks. kohta Haittavaikutukset), ja tämä on otettava huomioon, kun arvioidaan potilaan kykyä ajaa autoa tai käyttää koneita.
Haittavaikutukset
Hiljattain todettu akuutti myelooinen leukemia yhdessä atsasitidiinin kanssa
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset olivat oksentelu (40 %), neutropenia (31 %), trombosytopenia (28 %), sydänsähkökäyrän pidentynyt QT-aika (21 %) ja unettomuus (19 %).
Yleisimmät vakavat haittavaikutukset olivat erilaistumisoireyhtymä (8 %) ja trombosytopenia (3 %).
Potilailla, joita hoidettiin ivosidenibilla yhdistelmänä atsasitidiinin kanssa, haittavaikutuksista johtuvan ivosidenibin käytön lopettamisen yleisyys oli 6 %. Hoidon lopettamiseen johtaneet haittavaikutukset olivat sydänsähkökäyrässä pidentynyt QT-aika (1 %), unettomuus (1 %), neutropenia (1 %) ja trombosytopenia (1 %).
Haittavaikutuksista johtuvan ivosidenibin hoidon keskeyttämisen yleisyys oli 35 %. Yleisimmät hoidon keskeyttämiseen johtaneet haittavaikutukset olivat neutropenia (24 %), sydänsähkökäyrässä pidentynyt QT-aika (7 %), trombosytopenia (7 %), leukopenia (4 %) ja erilaistumisoireyhtymä (3 %).
Haittavaikutuksista johtuvan ivosidenibin annoksen pienentämisen yleisyys oli 19 %. Annoksen pienentämiseen johtaneet haittavaikutukset olivat sydänsähkökäyrässä pidentynyt QT-aika (10 %), neutropenia (8 %) ja trombosytopenia (1 %).
Haittavaikutustaulukko
Haittavaikutusten yleisyydet perustuvat tutkimukseen AG120-C-009, jossa 72 potilasta, joilla oli hiljattain todettu AML satunnaistettiin saamaan ivosidenibiä ja joita hoidettiin ivosidenibilla (500 mg vuorokaudessa) yhdistelmänä atsasitidiinin kanssa. Tibsovo-hoidon keston mediaani oli 8 kuukautta (vaihteluväli 0,1–40,0 kuukautta). Haittavaikutusten yleisyydet perustuvat kaikista syistä johtuvien haittatapahtumien yleisyyksiin, jolloin osa haittavaikutukseen liittyvistä tapahtumista voi johtua muista syistä kuin ivosidenibista, kuten sairaudesta, muista lääkevalmisteista tai näihin liittymättömistä syistä.
Haittavaikutukset määritellään seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 2 - Haittavaikutukset, jotka on raportoitu kliinisessä tutkimuksessa AG120-C-009 potilailla, joilla on hiljattain todettu AML ja joita hoidettiin ivosidenibilla yhdistelmänä atsasitidiinin kanssa (N = 72)
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Veri ja imukudos | Hyvin yleinen | Erilaistumisoireyhtymä, leukosytoosi, trombosytopenia, neutropenia |
Yleinen | Leukopenia | |
Psyykkiset häiriöt | Hyvin yleinen | Unettomuus |
Hermosto | Hyvin yleinen | Päänsärky, huimaus |
Yleinen | Perifeerinen neuropatia | |
Ruoansulatuselimistö | Hyvin yleinen | Oksentelu1 |
Yleinen | Suunielun kipu | |
Luusto, lihakset ja sidekudos | Hyvin yleinen | Kipu raajassa, artralgia, selkäkipu |
Tutkimukset | Hyvin yleinen | Sydänsähkökäyrässä pidentynyt QT |
1 sisältää oksentelun ja yökkäilyn.
Aikaisemmin hoidettu, paikallisesti edennyt tai metastasoitunut kolangiokarsinooma
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset olivat väsymys (43 %), pahoinvointi (42 %), vatsakipu (35 %), ripuli (35 %), vähentynyt ruokahalu (24 %), askites (23 %), oksentelu (23 %), anemia (19 %) ja ihottuma (15 %).
Yleisimmät vakavat haittavaikutukset olivat askites (2 %), hyperbilirubinemia (2 %) ja kolestaattinen keltaisuus (2 %).
Potilailla, joita hoidettiin ivosidenibilla, haittavaikutuksista johtuvan hoidon lopettamisen yleisyys oli 2 %. Hoidon lopettamiseen johtaneet haittavaikutukset olivat askites (1 %) ja hyperbilirubinemia (1 %).
Haittavaikutuksista johtuvan ivosidenibin hoidon keskeyttämisen yleisyys oli 16 %. Yleisimmät hoidon keskeyttämiseen johtaneet haittavaikutukset olivat hyperbilirubinemia (3 %), kohonnut alaniiniaminotransferaasi (3 %), kohonnut aspartaattiaminotransferaasi (3 %), askites (2 %) ja väsymys (2 %).
Haittavaikutuksista johtuvan ivosidenibin annoksen pienentämisen yleisyys oli 4 %. Annoksen pienentämiseen johtaneet haittavaikutukset olivat sydänsähkökäyrässä pidentynyt QT-aika (3 %) ja perifeerinen neutropenia (1 %).
Haittavaikutustaulukko
Haittavaikutusten yleisyydet perustuvat tutkimukseen AG120-C-005, jossa 123 potilasta, joilla oli aikaisemmin hoidettu, paikallisesti edennyt tai metastasoitunut kolangiokarsinooma satunnaistettiin saamaan ivosidenibiä ja joita hoidettiin ivosidenibilla (500 mg) kerran vuorokaudessa. Tibsovo-hoidon keston mediaani oli 2,8 kuukautta (vaihteluväli 0,1–45,1 kuukautta; keskiarvo (keskihajonta [SD]) 6,7 (8,2) kuukautta).
Haittavaikutusten yleisyydet perustuvat kaikista syistä johtuvien tapahtumien yleisyyksiin, jolloin osa haittavaikutukseen liittyvistä tapahtumista voi johtua muista syistä kuin ivosidenibista, kuten sairaudesta, muista lääkevalmisteista tai näihin liittymättömistä syistä.
Haittavaikutukset määritellään seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3 - Haittavaikutukset, jotka on raportoitu kliinisessä tutkimuksessa AG120-C-005 potilailla, joilla on paikallisesti edennyt tai metastasoitunut kolangiokarsinooma, ja joita hoidettiin ivosidenibilla (N = 123)
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Veri ja imukudos | Hyvin yleinen | Anemia |
Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Heikentynyt ruokahalu |
Hermosto | Hyvin yleinen | Perifeerinen neuropatia, päänsärky |
Ruoansulatuselimistö | Hyvin yleinen | Askites, ripuli, oksentelu, pahoinvointi, vatsakipu |
Maksa ja sappi | Yleinen | Kolestaattinen keltaisuus, hyperbilirubinemia |
Iho ja ihonalainen kudos | Hyvin yleinen | Ihottuma1 |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Väsymys |
Yleinen | Kaatuminen | |
Tutkimukset | Hyvin yleinen | Kohonnut aspartaattiaminotransferaasi, kohonnut veren bilirubiiniarvo |
Yleinen | Sydänsähkökäyrässä pidentynyt QT-aika, kohonnut alaniiniaminotransferaasi, alentunut valkosolumäärä, alentunut verihiutalemäärä |
1 sisältää ihottuman, makulopapulaarisen ihottuman, eryteeman, makulaarisen ihottuman, yleistyneen kesivän punaihon, toistopunoittuman ja lääkeyliherkkyyden.
Valittujen haittavaikutusten kuvaus
Erilaistumisoireyhtymä potilailla, joilla on akuutti myelooinen leukemia (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet)
Tutkimuksessa AG120-C-009 72 potilaalla, joilla oli hiljattain todettu AML ja joita hoidettiin Tibsovo-valmisteella yhdistelmänä atsasitidiinin kanssa, 14 %:lla ilmeni erilaistumisoireyhtymä. Yksikään potilas ei keskeyttänyt ivosidenibihoitoa erilaistumisoireyhtymän vuoksi, ja annoksen keskeyttämistä (3 %) merkkien/oireiden hoitamiseksi tarvittiin vain pienellä osalla potilaista. Kaikki 10 potilasta, joilla ilmeni erilaistumisoireyhtymä, toipuivat hoidon jälkeen tai Tibsovo-annoksen keskeyttämisen jälkeen. Erilaistumisoireyhtymä alkamiseen kulunut mediaaniaika oli 20 vuorokautta. Erilaistumisoireyhtymä ilmeni niinkin varhain kuin 3 vuorokauden kuluttua ja enintään 46 vuorokauden kuluttua hoidon aloittamisesta yhdistelmähoidon aikana.
QTc-ajan piteneminen (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset)
Tutkimuksessa AG120-C-009 72 potilaalla, joilla oli hiljattain todettu AML ja joita hoidettiin ivosidenibilla yhdistelmänä atsasitidiinin kanssa, sydänsähkökäyrässä pidentynyt QT-aika raportoitiin 21 %:lla; 11 %:lla ilmeni asteen ≥ 3 reaktioita. EKG-analyysien perusteella 15 %:lla potilaista, joita hoidettiin ivosidenibilla yhdistelmänä atsasitidiinin kanssa ja joilla oli ainakin yksi lähtötilanteen jälkeinen EKG-arviointi, havaittiin QTc-aika ˃ 500 millisekuntia, 24 %:lla lähtötilanteen QTc-aika oli pidentynyt ˃ 60 millisekuntia. Yksi prosentti (1 %) potilaista keskeytti ivosidenibihoidon, koska QT-aika oli pidentynyt sydänsähkökäyrässä, annoksen keskeyttäminen oli tarpeen 7 %:lla ja annoksen pienentäminen oli tarpeen 10 %:lla potilaista. Mediaaniaika QT-ajan pidentymisen alkamiseen ivosidenibilla hoidetuilla potilailla oli 29 vuorokautta. Sydänsähkökäyrässä pidentynyt QT ilmeni niinkin varhain kuin 1 vuorokauden kuluttua ja enintään 18 kuukauden kuluttua hoidon aloittamisesta.
Tutkimuksessa AG120-C-005 123 potilaalla, joilla oli paikallisesti edennyt tai metastasoitunut kolangiokarsinooma, jota hoidettiin ivosidenibimonoterapialla, sydänsähkökäyrässä pidentynyt QT raportoitiin 10 %:lla; 2 %:lla ilmeni asteen 3 tai sitä korkeampia reaktioita. EKG-analyysien perusteella 2 %:lla potilaista QTc-aika oli ˃ 500 millisekuntia ja 5 %:lla QTc-aika oli pidentynyt ˃ 60 millisekuntia lähtötilanteesta. Annoksen pienentämistä merkkien/oireiden hoitamiseksi tarvittiin 3 %:lla potilaista. Mediaaniaika QT-ajan pidentymisen alkamiseen ivosidenibimonoterapialla hoidetuilla potilailla oli 28 vuorokautta. Sydänsähkökäyrässä pidentynyt QT-aika ilmeni niinkin varhain kuin 1 vuorokauden kuluttua ja enintään 23 kuukauden kuluttua hoidon aloittamisesta.
Erityisryhmät
Maksan vajaatoiminta
Ivosidenibin turvallisuutta ja tehoa ei ole varmistettu potilailla, joilla on kohtalainen tai vaikea-asteinen maksan vajaatoiminta (Child–Pugh-luokat B ja C). Haittavaikutusten suuremman ilmaantuvuuden trendi havaittiin potilailla, joilla oli lievä maksan vajaatoiminta (Child–Pugh-luokka A) (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka.).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannoksen yhteydessä toksisuus todennäköisesti ilmenee ivosidenibiin liittyvien haittavaikutusten pahenemisena (ks. kohta Haittavaikutukset). Potilaita on seurattava tarkasti, ja heille on annettava sopivaa tukihoitoa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Ivosidenibin yliannostukselle ei ole erityistä vastalääkettä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: antineoplastiset lääkeaineet; muut antineoplastiset lääkeaineet
ATC-koodi: L01XX62
Vaikutusmekanismi
Ivosidenibi on mutantin IDH1-entsyymin estäjä. Mutantti IDH1 muuttaa alfa-ketoglutaraatin (α-KG) 2-hydroksiglutaraatiksi (2-HG), joka estää solun erilaistumista ja edistää tuumorigeneesiä sekä hematologisissa että ei-hematologisissa syövissä. Ivosidenibin vaikutusmekanismia, paitsi sen kykyä vähentää 2-HG:tä ja palauttaa solun erilaistumista, ei täysin ymmärretä eri indikaatioiden suhteen.
Farmakodynaamiset vaikutukset
Useat ivosidenibin 500 mg:n vuorokausiannokset alensivat 2-HG:n plasmapitoisuuksia potilailla, joilla oli hematologisia syöpiä ja kolangiokarsinoomia, joissa oli mutatoitunut IDH1, pitoisuuksiksi, jotka olivat lähellä terveillä tutkittavilla havaittuja pitoisuuksia. Sellaisten potilaiden luuytimessä, joilla oli hematologisia syöpiä, ja kolangiokarsinoomapotilaiden tuumorien biopsiassa 2-HG-pitoisuuksien keskimääräinen (variaatiokerroin-% [CV-%]) aleneminen oli vastaavasti 93,1 % (11,1 %) ja 82,2 % (32,4 %).
Ivosidenibipitoisuuden QTc-mallin mukaan pitoisuudesta riippuvainen QTc-ajan pidentyminen noin 17,2 millisekuntia (90 %:n luottamusväli: 14,7, 19,7) ennustettiin vakaan tilan Cmax-arvolla. Tämä perustui analyysiin, joka tehtiin 173 AML-potilaalla, jotka saivat 500 mg ivosidenibia kerran vuorokaudessa. Pitoisuudesta riippuvainen QTc-ajan pidentyminen noin 17,2 millisekuntia (90 %:n luottamusväli: 14,3, 20,2) havaittiin vakaan tilan Cmax-arvolla 500 mg:n vuorokausiannoksen jälkeen. Tämä perustui analyysiin, joka tehtiin 101 kolangiokarsinoomapotilaalla, jotka saivat 500 mg ivosidenibia vuorokaudessa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Kliininen teho
Hiljattain todettu akuutti myelooinen leukemia yhdessä atsasitidiinin kanssa
Tibsovo-valmisteen teho ja turvallisuus arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä monikeskustutkimuksessa (AG120-C-009), jossa oli 146 aikuispotilasta, joilla oli aikaisemmin hoitamaton AML, jossa oli IDH1-mutaatio, ja joille intensiivinen induktiosolunsalpaajahoito ei soveltunut, perustuen ainakin yhteen seuraavista kriteereistä: 75 vuotta tai tätä vanhempi, Eastern Cooperative Oncology Group (ECOG) -suorituskykystatus 2, vaikea sydän- tai keuhkosairaus, maksan vajaatoiminta, jossa bilirubiini > 1,5 kertaa normaalin yläraja, kreatiniinipuhdistuma < 45 ml/min, tai muu komorbiditeetti. IDH-1-mutaatio vahvistettiin kaikilta tutkittavilta keskitetysti luuytimestä ja/tai perifeerisestä verestä otetun näytteen geenimutaatioanalyysillä käyttäen Abbott RealTime™ IDH1 Assay. Potilaat satunnaistettiin saamaan joko Tibsovo-valmistetta 500 mg tai vastaavaa lumelääkettä suun kautta kerran vuorokaudessa sekä atsasitidiinia 75 mg/m2/vuorokausi ihon alle tai laskimoon 1 viikon ajan 4 viikon välein, kunnes tutkimus oli päättynyt, sairaus oli edennyt tai toksisuutta ei voitu hyväksyä.
Tibsovo-valmisteella hoidettujen potilaiden mediaani-ikä oli 76 vuotta (vaihteluväli: 58–84); 58 % oli miespuolisia; 21 % aasialaisia, 17 % oli valkoihoisia, 61 prosentilla ei raportoitu; ja heillä oli ECOG-suorituskykyluokka 0 (19 %), 1 (44 %) tai 2 (36 %). 75 %:lla potilaista oli de novo AML. Yleisesti ottaen potilailla oli dokumentoitu suotuisa (4 %), kohtalainen (67 %) tai huono/muu (26 %) sytogeneettinen riski, jonka tutkijat arvioivat National Comprehensive Cancer Network (NCCN) ‑liiton määrittämien onkologian kliinisen hoidon suositusten (2017) perusteella.
Teho perustui ensisijaiseen tehon päätetapahtumaan, tapahtumavapaaseen elossaoloon (EFS), joka mitattiin satunnaistamispäivästä hoidon epäonnistumiseen, remissiosta relapsiin tai mistä tahansa syystä johtuvan kuoleman perusteella. Hoidon epäonnistuminen määritettiin epäonnistumisena saavuttaa täydellinen remissio (CR) viikkoon 24 mennessä. Kokonaiselossaolo (OS), CR-osuus, CR + CRh-osuus (CRh = osittainen hematologinen toipuminen) ja objektiivisen vasteen saaneiden osuus (ORR) olivat tärkeimpiä sekundaarisia tehon päätetapahtumia (taulukko 4 ja kuva 1).
Taulukko 4 - Tehotulokset potilailla, joilla oli hiljattain todettu AML, yhdistelmänä atsasitidiinin kanssa
Päätetapahtuma | Ivosidenibi (500 mg vuorokaudessa) + atsasitidiini N = 72 | Lumelääke + atsasitidiini N = 74 |
Tapahtumavapaa elossaolo, tapahtumat (%) Hoidon epäonnistuminen Relapsi Kuolema | 46 (63,9) 42 (58,3) 3 (4,2) 1 (1,4) | 62 (83,8) 59 (79,7) 2 (2,7) 1 (1,4) |
Hasardisuhde1 (95 %:n luottamusväli) | 0,33 (0,16, 0,69) | |
OS-tapahtumat (%) | 28 (38,9) | 46 (62,2) |
Mediaani-OS (95 %:n luottamusväli), kuukausia | 24,0 (11,3, 34,1) | 7,9 (4,1, 11,3) |
Hasardisuhde1 (95 %:n luottamusväli) | 0,44 (0,27, 0,73) | |
CR, n (%) | 34 (47,2) | 11 (14,9) |
95 %:n luottamusväli2 | (35,3, 59,3) | (7,7, 25,0) |
Ristitulosuhde3 (95 %:n luottamusväli) | 4,76 (2,15, 10,50) | |
CR + CRh -osuus, n (%) | 38 (52,8) | 13 (17,6) |
95 %:n luottamusväli2 | (40,7, 64,7) | (9,7, 28,2) |
Ristitulosuhde3 (95 %:n luottamusväli) | 5,01 (2,32, 10,81) | |
CR + CRi -osuus, n (%) | 39 (54,2) | 12 (16,2) |
95 %:n luottamusväli2 | (42,0, 66,0) | (8,7, 26,6) |
Ristitulosuhde3 (95 %:n luottamusväli) | 5,90 (2,69, 12,97) | |
CR = täydellinen remissio; CRh = täydellinen remissio, jossa osittainen hematologinen toipuminen; CRi = täydellinen remissio, jossa epätäydellinen hematologinen toipuminen; OS = kokonaiselossaolo; PR = osittainen vaste.
1 Riskitiheyssuhde (Hasardisuhde, HR) arvioidaan käyttämällä Coxin suhteellista hasardimallia, joka on ositettu satunnaistamisen ositustekijöillä (AML-status ja maantieteellinen alue) ja jossa nimittäjänä on PBO+AZA.
2 Prosenttiosuuden luottamusväli lasketaan Clopperin ja Pearsonin (eksakti binomiaalinen) menetelmällä.
3 Cochran-Mantel-Haenszel (CMH) -estimaatti ristitulosuhteelle (Odds ratio) lasketaan niin, että PBO+AZA on nimittäjä.
Kuva 1: Kokonaiselossaolon (OS) Kaplan-Meierin käyrä
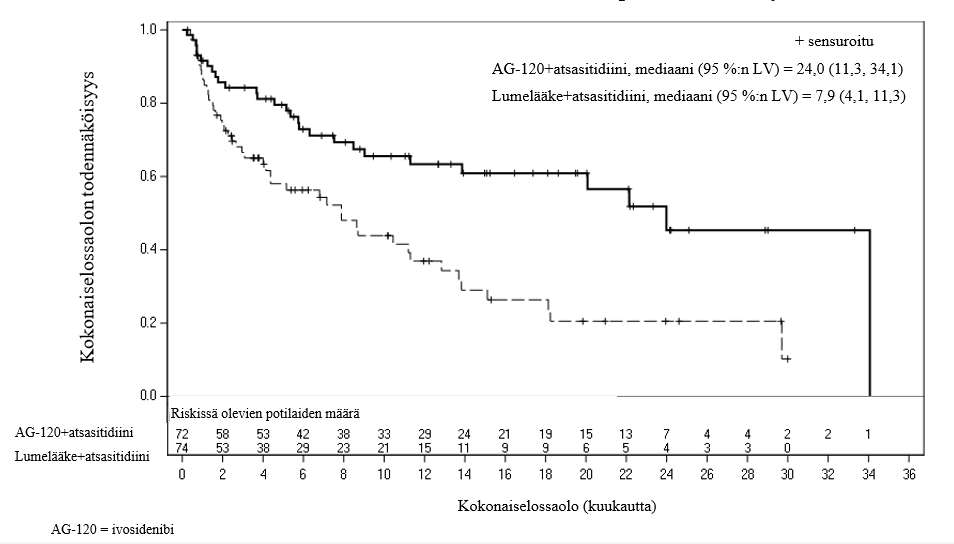
Päivitetty kokonaiselossaolon analyysi, joka tehtiin, kun 64,2 % (N = 95) kuolemista oli tapahtunut, vahvisti, että Tibsovo-valmisteella atsasitidiinin kanssa saavutettiin hyöty kokonaiselossaoloajassa verrattuna lumelääkkeeseen atsasitidiinin kanssa. Kokonaiselossaolon mediaani Tibsovo-valmisteella atsasitidiinin kanssa oli 29,3 kuukautta ja lumelääkkeellä atsasitidiinin kanssa 7,9 kuukautta (HR = 0,42; 95 %:n luottamusväli: 0,27–0,65).
Aikaisemmin hoidettu, paikallisesti edennyt tai metastasoitunut kolangiokarsinooma
Tibsovo-valmisteen teho arvioitiin satunnaistetussa (2:1), kaksoissokkoutetussa, lumekontrolloidussa, vaiheen 3 kliinisessä monikeskustutkimuksessa (tutkimus AG120-005), johon osallistui 185 aikuispotilasta, joilla oli paikallisesti edennyt tai metastasoitunut kolangiokarsinooma, jossa oli IDH1 R132 ‑mutaatio, ja joiden sairaus oli edennyt vähintään yhden mutta enintään kahden aikaisemman hoidon jälkeen, mukaan lukien vähintään yksi gemsitabiinia tai 5-FU:ta sisältävä hoito, ja joiden odotettu elossaoloaika oli ≥ 3 kuukautta.
Potilaat satunnaistettiin saamaan joko Tibsovo-valmistetta 500 mg suun kautta kerran vuorokaudessa tai vastaavaa lumelääkettä, kunnes sairaus eteni tai kehittyi toksisuus, jota ei voitu hyväksyä. Satunnaistaminen ositettiin aikaisempien hoitojen määrällä (1 tai 2). Soveltuvat potilaat, jotka satunnaistettiin saamaan lumelääkettä, saivat siirtyä saamaan Tibsovo-valmistetta sen jälkeen kun sairauden eteneminen oli dokumentoitu radiologisesti tutkijan arvion mukaan. IDH-1-mutaatio vahvistettiin kaikilta tutkittavilta keskitetysti geenimutaatioanalyysillä kasvainkudosbiopsiasta käyttäen OncomineTM Dx Target Test.
Mediaani-ikä oli 62 vuotta (vaihteluväli: 33–83). Suurin osa potilaista oli naispuolisia (63 %), 57 % oli valkoihoisia ja 37 %:lla oli ECOG-suorituskykyluokka 0 (37 %) tai 1 (62 %). Kaikki potilaat olivat saaneet ainakin yhden aikaisemman hoitolinjan, ja 47 % oli saanut kaksi aikaisempaa linjaa. Useimmilla potilailla oli todettu maksansisäinen kolangiokarsinooma (91 %), ja 92 %:lla sairaus oli metastasoitunut. Kummassakin tutkimushaarassa 70 %:lla potilaista oli R132C-mutaatio, 15 %:lla oli R132L-mutaatio, 12 %:lla oli R132G-mutaatio, 1,6 %:lla oli R132S-mutaatio ja 1,1 %:lla oli R132H-mutaatio.
Ensisijainen tehon päätetapahtuma oli sairauden etenemättömyysaika (PFS), jonka määritti riippumaton radiologinen keskus (IRC, Independent Radiology Centre) Response Evaluation Criteria in Solid Tumors (RECIST) v1.1 ‑kriteerien mukaisesti ja jonka määritettiin olevan aika satunnaistamisesta sairauden etenemiseen tai mistä tahansa syystä johtuvaan kuolemaan.
Kokonaiselossaolo (OS) oli toissijainen tehon päätetapahtuma. Suuri osa (70,5 %) lumehaaran potilaista siirtyi saamaan Tibsovo-valmistetta tutkijan arvioiman radiologisesti todetun sairauden etenemisen jälkeen tutkimussuunnitelmassa sallitun mukaisesti.
Tehotulokset esitetään yhteenvetona taulukossa 5.
Taulukko 5 - Tehotulokset potilailla, joilla on paikallisesti edennyt tai metastasoitunut kolangiokarsinooma
Päätetapahtuma | Ivosidenibi (500 mg vuorokaudessa) | Lumelääke |
Sairauden etenemättömyysaika(PFS) IRC:n arvioinnin perusteella | N = 124 | N = 61 |
Tapahtumat, n (%) Etenevä sairaus Kuolema | 76 (61) 64 (52) 12 (10) | 50 (82) 44 (72) 6 (10) |
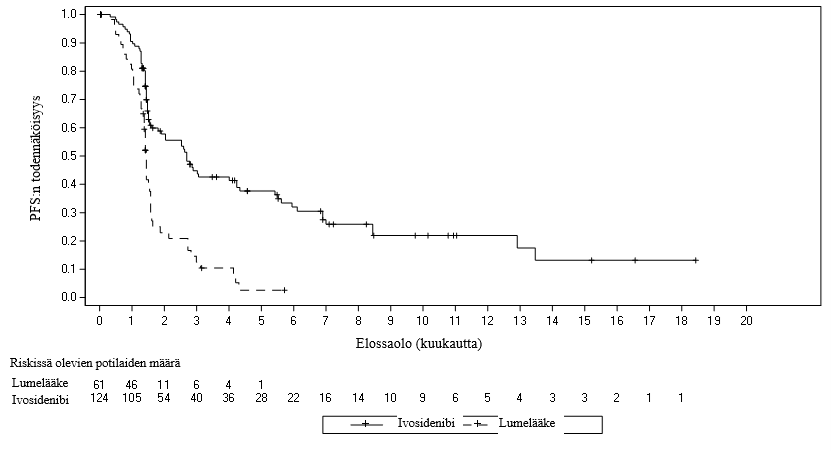
Mediaani-PFS, kuukausia (95 %:n luottamusväli) | 2,7 (1,6, 4,2) | 1,4 (1,4, 1,6) |
Hasardisuhde (95 %:n luottamusväli)1 p-arvo2 | 0,37 (0,25, 0,54) < 0,0001 | |
PFS-osuus (%)3 6 kuukautta 12 kuukautta | 32,0 21,9 | NE NE |
Kokonaiselossaolo4 | N = 126 | N = 61 |
Kuolemat, n (%) | 100 (79) | 50 (82) |
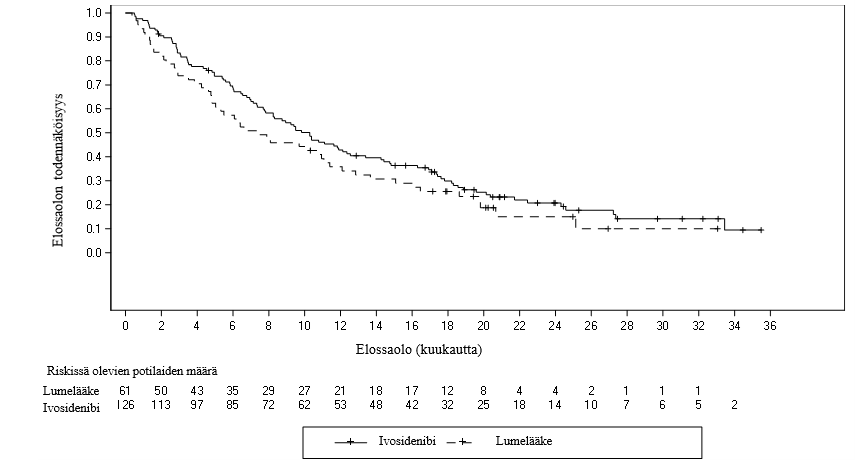
Mediaani-OS (kuukausia, 95 %:n luottamusväli) | 10,3 (7,8, 12,4) | 7,5 (4,8, 11,1) |
Hasardisuhde (95 %:n luottamusväli)1 p-arvo2 | 0,79 (0,56, 1,12) 0,093 | |
IRC: riippumaton radiologinen keskus; NE = ei arvioitavissa.
1 Hasardisuhde lasketaan ositetusta Coxin regressiomallista. Ositustekijä on aikaisempien hoitolinjojen määrä satunnaistamishetkellä.
2 P-arvo lasketaan yksisuuntaisesta ositetusta log-rank-testistä ilman säätämistä vaihtovuoroisuuden suhteen. Ositustekijä on aikaisempien hoitolinjojen määrä satunnaistamishetkellä.
3 Perustuu Kaplan-Meierin estimaattiin. Yksikään lumelääkeryhmään satunnaistettu potilas ei saavuttanut 6 kuukauden tai sitä pitempää PFS:ää.
4 OS-tulokset perustuvat OS:n lopulliseen analyysiin (perustuen 150 kuolemaan; tietojen katkaisupäivä: 30. toukokuuta 2020), joka tehtiin 16 kuukauden kuluttua PFS:n lopullisesta analyysistä (tietojen katkaisupäivä: 31. tammikuuta 2019).
Kuva 2: Kaplan-Meierin käyrä sairauden etenemättömyysajasta (PFS) IRC:n perusteella
Kuva 3: Kokonaiselossaolon Kaplan-Meierin käyrä
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Tibsovo-valmisteen käytöstä kaikissa pediatrisissa potilasryhmissä kaikkien sairauksien hoidossa, jotka sisältyvät kategoriaan pahanlaatuiset kasvaimet (paitsi keskushermoston tuumorit, hematopoieettiset ja imukudoksen kasvaimet), ja keskushermoston pahanlaatuisten kasvainten hoidossa.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Tibsovo-valmisteen käytöstä akuutin myelooisen leukemian hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Yhteensä kymmenen kliinistä tutkimusta on myötävaikuttanut ivosidenibin kliinisen farmakologian karakterisointiin. Viisi tutkimusta on suoritettu terveillä tutkittavilla, ja kolme tutkimusta on suoritettu potilailla, joilla on edenneitä syöpiä, mukaan lukien kaksi tutkimusta kolangiokarsinoomapotilailla. Kaksi tutkimusta on tehty potilailla, joilla oli hiljattain todettu AML ja jotka saivat ivosidenibia yhdistelmänä atsasitidiinin kanssa. Farmakokineettiset päätetapahtumat on arvioitu plasmasta ja virtsasta. Farmakodynaamiset päätetapahtumat on arvioitu plasmasta, virtsasta, kasvainbiopsiasta ja luuytimestä (vain tutkimuksissa, joihin osallistui potilaita, joilla oli edenneitä syöpiä).
Ivosidenibin 500 mg:n annoksen vakaan tilan farmakokinetiikka oli samankaltainen kolangiokarsinoomapotilaiden ja niiden potilaiden välillä, joilla oli hiljattain todettu AML.
Imeytyminen
Yksittäisen suun kautta annetun 500 mg:n annoksen jälkeen mediaaniaika Cmax-arvoon (Tmax) oli noin 2 tuntia sekä potilailla, joilla oli hiljattain todettu AML ja joita hoidettiin ivosidenibin ja atsasitidiinin yhdistelmällä, että kolangiokarsinoomapotilailla.
Potilailla, joilla oli hiljattain todettu AML ja joita hoidettiin ivosidenibin (500 mg:n vuorokausiannos) ja atsasitidiinin yhdistelmällä, keskimääräinen vakaan tilan Cmax oli 6 145 ng/ml (CV-%: 34) ja keskimääräinen vakaan tilan AUC oli 106 326 ng h/ml (CV-%: 41).
Kolangiokarsinoomapotilailla keskimääräinen Cmax oli 4 060 ng/ml (CV-%: 45) yksittäisen 500 mg:n annoksen jälkeen ja 4 799 ng/ml (CV-%: 33) vakaassa tilassa annoksen ollessa 500 mg vuorokaudessa. AUC oli 86 382 ng h/ml (CV-%: 34).
Akkumulaatiosuhteet olivat noin 1,6 AUC:n ja 1,2 Cmax:n osalta potilailla, joilla oli hiljattain todettu AML ja joita hoidettiin ivosidenibin ja atsasitidiinin yhdistelmällä, ja noin 1,5 AUC:n ja 1,2 Cmax:n osalta kolangiokarsinoomapotilailla yhden kuukauden aikana, kun ivosidenibia annettiin 500 mg vuorokaudessa. Vakaan tilan plasma-arvot saavutettiin 14 vuorokaudessa annettaessa yksi annos vuorokaudessa.
Terveillä tutkittavilla havaittiin huomattavat nousut ivosidenibin Cmax-arvoissa (noin 98 %:lla; 90 % luottamusväli: 79, 119) ja AUCinf:ssa (noin 25 %:lla) sen jälkeen kun yksittäinen annos oli annettu rasvapitoisen aterian yhteydessä (noin 900 – 1 000 kaloria, 56–60 % rasvaa) (ks. kohta Annostus ja antotapa).
Jakautuminen
Populaatiofarmakokineettisen analyysin perusteella ivosidenibin keskimääräinen näennäinen jakautumistilavuus vakaassa tilassa (Vc/F) on 3,20 l/kg (CV-%: 47,8) potilailla, joilla on hiljattain todettu AML ja joita hoidetaan ivosidenibin ja atsasitidiinin yhdistelmällä, ja 2,97 l/kg (CV-%: 25,9) kolangiokarsinoomapotilailla, joita hoidetaan ivosidenibimonoterapialla.
Biotransformaatio
Ivosidenibi oli vallitseva komponentti (> 92 %) kokonaisradioaktiivisuudessa terveiltä tutkittavilta otetussa plasmassa. Se metaboloituu ensisijaisesti oksidatiivisilla reiteillä, joita välittää etupäässä CYP3A4, ja metaboloitumiseen vaikuttavat vähäisessä määrin N‑dealkylaatio- ja hydrolyyttiset reitit.
Ivosidenibi indusoi seuraavia: CYP3A4 (mukaan lukien sen oma metabolia), CYP2B6, CYP2C8 ja CYP2C9, ja se voi indusoida seuraavia: CYP2C19 ja UGT:t. Näin ollen se voi alentaa systeemistä altistumista näiden entsyymien substraateille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Raskaus ja imetys).
Ivosidenibi estää P-gp:tä in vitro, ja sillä on potentiaalia indusoida P-gp:tä. Näin ollen se voi muuttaa systeemistä altistumista vaikuttaville aineille, jotka pääasiallisesti ovat P-gp:n kuljettamia (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
In vitro -tiedot viittaavat siihen, että ivosidenibilla on kliinisesti relevanteilla pitoisuuksilla potentiaalia estää seuraavia: OAT3, OATP1B1 ja OATP1B3, ja se voi näin ollen suurentaa systeemistä altistumista OAT3:n, OATP1B1:n tai OATP1B3:n substraateille (ks. kohta Yhteisvaikutukset).
Eliminaatio
Potilailla, joilla oli hiljattain todettu AML ja joita hoidettiin ivosidenibilla ja atsasitidiinilla, ivosidenibin keskimääräinen näennäinen puhdistuma vakaassa tilassa oli 4,6 l/tunti (35 %) ja keskimääräinen terminaalinen puoliintumisaika oli 98 tuntia (42 %).
Kolangiokarsinoomapotilailla ivosidenibin keskimääräinen näennäinen puhdistuma vakaassa tilassa oli 6,1 l/tunti (31 %) ja keskimääräinen terminaalinen puoliintumisaika oli 129 tuntia (102 %).
Terveillä tutkittavilla 77 % ivosidenibin yksittäisestä suun kautta annetusta annoksesta löytyi ulosteesta, ja 67 % siitä saatiin talteen muuttumattomana. Noin 17 % ivosidenibin yksittäisestä suun kautta annetusta annoksesta löytyi virtsasta, ja 10 % siitä saatiin talteen muuttumattomana.
Lineaarisuus/ei-lineaarisuus
Ivosidenibin AUC ja Cmax suurenivat vähemmän kuin annosriippuvaisella tavalla 200 mg:sta 1200 mg:aan kerran päivässä (0,4–2,4 kertaa suositeltu annos).
Erityisryhmät
Iäkkäät
Mitään kliinisesti merkityksellisiä vaikutuksia ivosidenibin farmakokinetiikkaan ei havaittu iäkkäämmillä, enintään 84-vuotiailla potilailla. Ivosidenibin farmakokinetiikkaa ei tunneta yli 85-vuotiailla potilailla (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Mitään kliinisesti merkityksellisiä vaikutuksia ivosidenibin farmakokinetiikkaan ei havaittu potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta (eGFR ≥ 30 ml/min/1,73 m2). Ivosidenibin farmakokinetiikkaa ei tunneta potilailla, joilla oli vaikea munuaisten vajaatoiminta (eGFR < 30 ml/min/1,73 m2) tai dialyysiä edellyttävä munuaisten vajaatoiminta (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
NCI-luokittelun perusteella mitään kliinisesti merkityksellisiä vaikutuksia ivosidenibin farmakokinetiikkaan ei havaittu potilailla, joilla oli lievä maksan vajaatoiminta. Ivosidenibin farmakokinetiikkaa ei tunneta potilailla, joilla on kohtalainen tai vaikea maksan vajaatoiminta sekä hiljattain todettu AML tai kolangiokarsinooma (ks. kohta Annostus ja antotapa). Farmakokineettisiä tietoja ei ole saatavilla potilailta, joilla on Child–Pugh-luokittelun mukaan ryhmitelty maksan vajaatoiminta.
Muut erityisryhmät
Mitään kliinisesti merkityksellisiä vaikutuksia ivosidenibin farmakokinetiikkaan ei havaittu sukupuolen, rodun, painon tai ECOG-suorituskykystatuksen perusteella.
Prekliiniset tiedot turvallisuudesta
Farmakologinen turvallisuus
Ivosidenibin mahdollinen QT-aikaa pidentävä vaikutus todettiin prekliinisissä in vitro- ja in vivo ‑tutkimuksissa kliinisesti relevanteilla plasmapitoisuuksilla.
Toistuvan altistuksen aiheuttama toksisuus
Eläinkokeissa, joissa käytettiin kliinisesti relevantteja altistuksia, ivosidenibi sai aikaan epänormaaleja hematologisia vaikutuksia (luuytimen hyposellulaarisuus, imukudoksen depleetio, alentunut punasolumassa ja ekstramedullaarista hematopoieesia pernassa), maha-suolikanavaan kohdistuvaa toksisuutta, kilpirauhaslöydöksiä (epiteelisolujen hypertrofia/hyperplasia rotilla), maksatoksisuutta (kohonneet transaminaasit, kohonneet painot, maksasolujen hypertrofia ja nekroosi rotilla ja maksan kohonneeseen painoon liittyvä maksasolujen hypertrofia apinoilla) ja munuaislöydöksiä (munuaistiehyen vakuolisaatio ja nekroosi rotilla). Hematologisessa järjestelmässä, maha-suolikanavassa ja munuaisissa havaitut toksiset vaikutukset olivat palautuvia, kun taas maksassa, pernassa ja kilpirauhasessa havaitut toksiset vaikutukset olivat yhä havaittavissa toipumisjakson lopussa.
Genotoksisuus ja karsinogeenisuus
Ivosidenibi ei ollut mutageeninen tai klastogeeninen konventionaalisissa in vitro- ja in vivo ‑genotoksisuusmäärityksissä. Ivosidenibilla ei ole tehty karsinogeenisuustutkimuksia.
Lisääntymis- ja kehitystoksisuus
Ivosidenibilla ei ole tehty hedelmällisyystutkimuksia. 28 vuorokauden pituisessa, toistuvan altistuksen aiheuttamaa toksisuutta koskevassa rottatutkimuksessa, kohdun atrofiaa havaittiin naarailla ei-siedettävissä olevilla annostasoilla, jotka olivat noin 1,7 -kertaisia kliiniseen altistukseen verrattaessa (AUC:n perusteella), ja se palautui 14 vuorokauden toipumisjakson jälkeen. Kivesten rappeutumista havaittiin ennenaikaisesti lopetetuilla koirailla ei-siedettävissä olevilla annostasoilla, jotka olivat noin 1,2 kertaisia kliiniseen altistukseen verrattaessa (AUC:n perusteella).
Embryofetaalisissa kehitystutkimuksissa rotilla ilmeni sikiön painon alenemista ja luuston viivästynyttä luutumista ilman emoon kohdistuvaa toksisuutta. Kaneilla havaittiin emoon kohdistuvaa toksisuutta, spontaaneja keskenmenoja, sikiöiden painon alenemista, lisääntynyttä implantaation jälkeistä alkioiden menetystä, luuston viivästynyttä luutumista ja sisäelinten kehityksen vaihtelua (pieni perna). Eläintutkimukset viittaavat siihen, että ivosidenibi läpäisee istukan ja että sitä löytyy sikiön plasmasta. Rotilla ja kaneilla NOAEL-arvot (haitaton vaikutustaso) embryofetaalisen kehityksen kannalta olivat vastaavasti 0,4 -kertaisia ja 1,4 -kertaisia kliiniseen altistukseen verrattaessa (AUC:n perusteella).
Farmaseuttiset tiedot
Apuaineet
Tablettiydin
Mikrokiteinen selluloosa
Kroskarmelloosinatrium
Hypromelloosiasetaattisukkinaatti
Vedetön kolloidinen piidioksidi
Magnesiumstearaatti
Natriumlauryylisulfaatti (E487)
Kalvopäällyste
Hypromelloosi
Titaanidioksidi (E171)
Laktoosimonohydraatti
Triasetiini
Indigokarmiinialumiinilakka (E132)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita. Pidä tablettipurkki tiiviisti suljettuna. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TIBSOVO tabletti, kalvopäällysteinen
250 mg (L:kyllä) 60 kpl (17432,60 €)
PF-selosteen tieto
Suuritiheyksinen polyeteeni (HDPE) -purkki, jossa on polypropeenista (PP) valmistettu lapsiturvallinen suljin ja polyeteeni (PE) -pintainen induktiolämpösinetti. Yksi purkki sisältää 60 kalvopäällysteistä tablettia ja piidioksidigeelikuivausainetta HDPE-säiliössä.
Valmisteen kuvaus:
Sininen, soikionmuotoinen, kalvopäällysteinen tabletti, noin 18 mm pitkä, jonka toiselle puolelle on painettu ”IVO” ja toiselle puolelle ”250”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TIBSOVO tabletti, kalvopäällysteinen
250 mg 60 kpl
- Ei korvausta.
ATC-koodi
L01XM02
Valmisteyhteenvedon muuttamispäivämäärä
22.12.2023
Yhteystiedot
Äyritie 22
01510 Vantaa
09 279 8080
www.servierfinland.fi
info.finland@servier.com
