RESPREEZA infuusiokuiva-aine ja liuotin, liuosta varten 1000 mg, 4000 mg, 5000 mg
Vaikuttavat aineet ja niiden määrät
Respreeza 1000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää noin 1000 mg ihmisen alfa1-proteinaasinestäjää*, määritettynä sen kykynä neutraloida ihmisen neutrofiilielastaasia.
Kun se on saatettu käyttövalmiiksi 20 ml:lla liuotinta, liuos sisältää noin 50 mg/ml ihmisen alfa1-proteinaasinestäjää.
Proteiinin kokonaismäärä on noin 1 100 mg per injektiopullo.
Respreeza 4000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää noin 4000 mg ihmisen alfa1-proteinaasinestäjää*, määritettynä sen kykynä neutraloida ihmisen neutrofiilielastaasia.
Kun se on saatettu käyttövalmiiksi 76 ml:lla liuotinta, liuos sisältää noin 50 mg/ml ihmisen alfa1-proteinaasinestäjää.
Proteiinin kokonaismäärä on noin 4 400 mg per injektiopullo.
Respreeza 5000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää noin 5000 mg ihmisen alfa1-proteinaasinestäjää*, määritettynä sen kykynä neutraloida ihmisen neutrofiilielastaasia.
Kun se on saatettu käyttövalmiiksi 95 ml:lla liuotinta, liuos sisältää noin 50 mg/ml ihmisen alfa1-proteinaasinestäjää.
Proteiinin kokonaismäärä on noin 5 500 mg per injektiopullo.
*Tuotettu ihmisluovuttajien plasmasta.
Apuaine(et), joiden vaikutus tunnetaan
Respreeza sisältää noin 1,9 mg natriumia per ml käyttövalmista liuosta (81 mmol/l).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokuiva-aine ja liuotin, liuosta varten.
Käyttövalmiilla liuoksella on osmolaalisuus likimäärin 279 mOsmol/kg ja pH 7,0.
Kliiniset tiedot
Käyttöaiheet
Respreeza on tarkoitettu ylläpitohoitoon, hidastamaan emfyseeman etenemistä aikuisille, joilla on dokumentoitu vakava alfa1-proteinaasinestäjän puutos (esim. genotyypit PiZZ, PiZ(null), Pi(null,null), PiSZ). Potilaiden lääkkeellisen ja ei-lääkkeellisen hoidon pitää olla optimaalinen ja on oltava näyttöä etenevästä keuhkosairaudesta (esim. odotettua matalampi uloshengityksen sekuntitilavuus (FEV1), alentunut kävelykyky tai lisääntynyt pahenemisjaksojen määrä), jonka on arvioinut terveydenhuollon ammattilainen, jolla on kokemusta alfa1-proteinaasinestäjän puutoksen hoidosta.
Ehto
Ensimmäiset infuusiot on annettava sellaisen terveydenhuollon ammattilaisen ohjauksessa, jolla on kokemusta alfa1-proteinaasinestäjän puutoksen hoidosta.
Annostus ja antotapa
Ensimmäiset infuusiot on annettava sellaisen terveydenhuollon ammattilaisen ohjauksessa, jolla on kokemusta alfa1-proteinaasinestäjän puutoksen hoidosta. Myöhemmät infuusiot voi antaa hoitaja tai potilas (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annostus
Respreeza-valmisteen suositeltu annos on 60 mg/painokilo, annettuna kerran viikossa.
Iäkkäät potilaat
Respreeza-valmisteen turvallisuutta ja tehoa iäkkäillä potilailla (65-vuotiailla tai tätä vanhemmilla) ei ole varmistettu spesifisissä kliinisissä tutkimuksissa.
Potilaat, joilla on munuaisten tai maksan vajaatoiminta
Mitään erityisiä tutkimuksia ei ole suoritettu. Mitään vaihtoehtoista annostelua ei voida suositella näille potilaille.
Pediatriset potilaat
Respreeza-valmisteen turvallisuutta ja tehoa alle 18-vuotiaiden lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Respreeza-valmisteen saa antaa ainoastaan infuusiona laskimoon käyttövalmiiksi saattamisen jälkeen.
Kuiva-aine on saatettava käyttövalmiiksi injektionesteisiin käytettävällä vedellä (ks. käyttövalmiiksi saattamista koskevat ohjeet kohdassa Käyttö- ja käsittelyohjeet) ja annettava käyttämällä laskimoon antoa varten tarkoitettua settiä (sisältyy 4000 mg:n ja 5000 mg:n pakkauksiin).
Käyttövalmis liuos on annettava infuusiona laskimoon infuusionopeudella noin 0,08 ml/painokilo/min. Tätä infuusionopeutta voidaan säätää potilaan sietokyvyn mukaisesti. Suositellun annoksen, 60 mg/painokilo, antaminen infuusiona vie noin 15 minuuttia.
Yksi Respreeza-injektiopullo on kertakäyttöinen.
Käyttövalmiin liuoksen antoa koskevia tarkkoja tietoja annetaan kohdan Käyttö- ja käsittelyohjeet lopussa olevissa ohjeissa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Potilaat, joilla on IgA-puutos ja joilla tiedetään olevan IgA:han kohdistuvia vasta-aineita, koska on olemassa vakavan yliherkkyyden ja anafylaktisten reaktioiden riski.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Kohdassa Annostus ja antotapa annettua suositeltua infuusionopeutta on noudatettava. Ensimmäisten infuusioiden aikana potilaan vointia, mukaan lukien elintoiminnot, on seurattava tarkasti koko infuusiojakson ajan. Jos ilmenee mikään reaktio, joka saattaisi liittyä Respreeza-valmisteen antoon, infuusionopeutta on pienennettävä tai anto on keskeytettävä, potilaan voinnin mukaisesti. Jos oireet lievenevät heti keskeyttämisen jälkeen, infuusiota voidaan jatkaa pienemmällä nopeudella, joka on potilaalle turvallinen.
Yliherkkyys
Yliherkkyysreaktioita voi ilmetä myös niillä potilailla, jotka ovat sietäneet aikaisempaa hoitoa ihmisen alfa1-proteinaasinestäjällä.
Respreeza saattaa sisältää pieniä määriä immunoglobuliini A:ta (IgA). Potilaat, joilla on selektiivinen tai vaikea IgA-puutos, saattavat muodostaa vasta-aineita IgA:ta kohtaan. Siten heidän riskinsä saada mahdollisesti vaikea yliherkkyysreaktio tai anafylaktinen reaktio on suurentunut.
Epäillyt allergiset tai anafylaktisen tyyppiset reaktiot voivat edellyttää välitöntä infuusion keskeyttämistä, reaktion luonteesta ja vaikeusasteesta riippuen. Shokin tapauksessa on annettava ensihoitoa.
Kotihoito / itselääkitys
On vain vähän tietoja tämän lääkevalmisteen käytöstä kotihoidossa / itselääkityksessä.
Mahdolliset kotihoitoon / itselääkitykseen liittyvät riskit liittyvät lääkevalmisteen käsittelyyn ja antoon sekä haittavaikutusten, erityisesti yliherkkyyden, hoitoon. Potilaille on kerrottava yliherkkyysreaktioiden oireista.
Päätöksen siitä, sopiiko potilas kotihoitoon / itselääkitykseen, tekee hoitava lääkäri, jonka on varmistettava asianmukainen koulutus (esim. koskien käyttövalmiiksi saattamista, Mix2Vial®-laitetta, i.v.-letkujen kokoamista, infuusiotekniikoita, hoitopäiväkirjan pitämistä, haittavaikutusten tunnistamista ja tällaisissa tapauksissa suoritettavista toimenpiteistä) ja että valmisteen käyttöä arvioidaan säännöllisin väliajoin.
Tartunnanaiheuttajat
Tavanomaisia toimenpiteitä sellaisten infektioiden estämiseksi, jotka johtuvat ihmisverestä tai -plasmasta valmistettujen lääkevalmisteiden käytöstä, ovat mm. infektiomerkkiaineiden seulonta yksittäisistä luovutuseristä ja plasmapooleista, ja tehokkaiden valmistusvaiheiden käyttö virusten inaktivoimiseksi/poistamiseksi. Tästä huolimatta, kun annetaan lääkevalmisteita, jotka on valmistettu ihmisverestä tai -plasmasta, tartunnanaiheuttajien siirtymisen mahdollisuutta ei voida kokonaan pois sulkea. Tämä koskee myös tuntemattomia tai vastikään havaittuja viruksia ja muita patogeeneja.
Käytettäviä toimenpiteitä pidetään tehokkaina vaipallisten virusten tapauksessa, kuten ihmisen immuunikatovirus (HIV), B-hepatiittivirus (HBV) ja C-hepatiittivirus (HCV), ja vaipattomalle A-hepatiittivirukselle (HAV) ja parvovirus B19 -virukselle.
Asianmukaista rokotusta (A- ja B-hepatiitti) on harkittava potilaille, jotka saavat säännöllisesti/toistuvasti ihmisen plasmasta peräisin olevia proteinaasinestäjiä.
Tupakointi
Tupakansavu on tärkeä riskitekijä emfyseeman kehittymiseen ja etenemiseen. Näin ollen tupakoinnin lopettaminen ja ympäristön tupakansavun välttäminen on hyvin suositeltavaa.
Natriumpitoisuus
Respreeza 1000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Tämä lääkevalmiste sisältää noin 37 mg (1,6 mmol) natriumia per 1000 mg:n Respreeza-injektiopullo. Tämä vastaa 1,9 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Respreeza 4000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Tämä lääkevalmiste sisältää noin 149 mg (6,5 mmol) natriumia per 4000 mg:n Respreeza-injektiopullo. Tämä vastaa 7,4 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Respreeza 5000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Tämä lääkevalmiste sisältää noin 186 mg (8,1 mmol) natriumia per 5000 mg:n Respreeza-injektiopullo. Tämä vastaa 9,3 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Tämä on otettava huomioon potilailla, joilla on ruokavalion natriumrajoitus.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Raskaus ja imetys
Raskaus
Respreeza-valmisteella ei ole suoritettu lisääntymiseen liittyviä eläinkokeita eikä sen turvallisuutta ihmisen raskauden aikana ole osoitettu kontrolloiduissa kliinisissä tutkimuksissa. Koska alfa1-proteinaasinestäjä on endogeeninen ihmisen proteiini, pidetään epätodennäköisenä, että Respreeza aiheuttaisi haittaa sikiölle, kun sitä annetaan suositeltavina annoksina. Respreeza-valmistetta on kuitenkin annettava varoen raskaana oleville naisille.
Imetys
Ei tiedetä, erittyykö Respreeza tai erittyvätkö sen metaboliitit ihmisen rintamaitoon. Ihmisen alfa1-proteinaasinestäjän erittymistä rintamaitoon ei ole tutkittu eläimillä. On päätettävä jatketaanko rintaruokintaa / lopetetaanko rintaruokinta vai jatketaanko Respreeza-hoitoa / lopetetaanko Respreeza-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja ihmisen alfa1-proteinaasinestäjä -hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Respreeza-valmisteella ei ole suoritettu hedelmällisyyteen liittyviä eläinkokeita eikä sen vaikutusta ihmisen hedelmällisyyteen ole osoitettu kontrolloiduissa kliinisissä tutkimuksissa. Koska ihmisen alfa1-proteinaasinestäjä on endogeeninen ihmisen proteiini, mitään haitallisia vaikutuksia hedelmällisyyteen ei ole odotettavissa, kun sitä annetaan suositeltuina annoksina.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Respreeza-valmisteen annon jälkeen voi ilmetä huimausta (ks. kohta Haittavaikutukset). Näin ollen Respreeza-valmisteella voi olla vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Hoidon aikana on havaittu yliherkkyyttä tai allergisia reaktioita. Vakavimmissa tapauksissa allergiset reaktiot voivat edetä vakaviksi anafylaktisiksi reaktioiksi, silloinkin kun potilaalla ei ole ilmennyt yliherkkyyttä aikaisempien antojen suhteen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tartunnanaiheuttajia koskevat turvallisuustiedot, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutustaulukko
Haittavaikutukset, jotka on kerätty kuudesta kliinisestä tutkimuksesta 221 potilaalta ja markkinoille tulon jälkeen, esitetään alla olevassa taulukossa MedDRA-elinjärjestelmäluokituksen mukaisesti (elinjärjestelmäluokitus ja suositeltu termi). Esiintymistiheys per potilas (perustuu kuuden kuukauden pituiseen altistukseen kliinisten tutkimusten aikana) on arvioitu seuraavan käytännön mukaisesti: yleinen (≥1/100, <1/10), melko harvinainen (≥1/1000, <1/100), harvinainen (≥1/10 000, <1/1 000) ja hyvin harvinainen (<1/10 000). Pelkästään markkinoille tulon jälkeen raportoitujen haittavaikutusten esiintymistiheys ilmaistaan ”tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)”.
Jokaisessa esiintymistiheysryhmässä haittavaikutukset esitetään alenevassa vakavuusjärjestyksessä.
Haittavaikutusten esiintymistiheys kliinisissä tutkimuksissa ja markkinoille tulon jälkeen Respreeza-valmisteella
Elinjärjestelmäluokitus (SOC) | Haittavaikutusten esiintymistiheys | |||
Yleinen (≥1/100, <1/10) | Melko harvinainen (≥1/1000, <1/100) | Hyvin harvinainen (<1/10 000) | Tuntematon | |
Veri ja imukudos | Kipu imusolmukkeessa | |||
Immuunijärjestelmä | Yliherkkyysreaktiot (mukaan lukien takykardia, hypotensio, sekavuus, pyörtyminen, alentunut hapen kulutus ja kurkunpään turvotus) | Anafylaktiset reaktiot | ||
Hermosto | Heitehuimaus, päänsärky | Parestesia | Hypoestesia | |
Silmät | Silmän turpoaminen | |||
Verisuonisto | Punoitus | |||
Hengityselimet, rintakehä ja välikarsina | Dyspnea | |||
Ruoansulatuselimistö | Pahoinvointi | Huulien turpoaminen | ||
Iho ja ihonalainen kudos | Nokkosihottuma, ihottuma (mukaan lukien hilseilevä ja yleinen) | Liikahikoilu, kutina | Kasvojen turvotus | |
Yleisoireet ja antopaikassa todettavat haitat | Astenia, infuusiokohdan reaktiot (mukaan lukien infuusiokohdan hematooma) | Rintakipu, vilunväristykset, kuume | ||
Pediatriset potilaat
Valmisteen turvallisuutta ja vaikuttavuutta pediatrisilla potilailla ei ole varmistettu. Tietoja ei ole saatavilla.
Iäkkäät potilaat
Respreeza-valmisteen turvallisuutta ja tehoa iäkkäillä (vähintään 65-vuotiailla) potilailla ei ole tutkittu kliinisissä tutkimuksissa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen seurauksia ei tunneta.
Yliannostuksen tapauksessa potilasta on tarkkailtava huolellisesti haittavaikutusten ilmaantumisen varalta ja tukevien toimenpiteiden on oltava tarvittaessa käytettävissä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Hemostaatit, proteinaasinestäjät, ATC-koodi: B02AB02
Ihmisen alfa1-proteinaasinestäjä on normaali ihmisen veren ainesosa. Ihmisen alfa1-proteinaasinestäjän molekyylipaino on 51 kD ja se kuuluu seriiniproteaasin estäjien perheeseen.
Vaikutusmekanismi
Ihmisen alfa1-proteinaasinestäjän ymmärretään olevan tärkein antiproteaasi alemmissa hengitysteissä, joissa se estää neutrofiilielastaasia (NE). Normaalit terveet henkilöt tuottavat riittävästi alfa1-proteinaasinestäjää hallitakseen aktivoitujen neutrofiilien tuottamaa NE:tä, ja täten he pystyvät estämään NE:n aiheuttaman keuhkokudoksen epäsopivan proteolyysin. Olosuhteet, jotka lisäävät neutrofiilien kerääntymistä ja aktivoitumista keuhkossa, kuten hengitystieinfektio ja tupakointi, puolestaan lisäävät NE:n määrää. Ihmiset, joilla on endogeenisen alfa1-proteinaasinestäjän puutos, eivät kuitenkaan pysty pitämään yllä asianmukaista antiproteaasipuolustusta, ja heillä ilmenee alveolien seinämien nopeampi proteolyysi ennen kuin kliinisesti selvä keuhkoahtaumatauti kehittyy kolmannen tai neljännen vuosikymmenen aikana.
Farmakodynaamiset vaikutukset
Respreeza-valmisteen antaminen lisää ja ylläpitää alfa1-proteinaasinestäjän määrää seerumissa ja keuhkoepiteelin päällysnesteessä (ELF), mikä johtaa emfyseeman etenemisen hidastumiseen.
Kliininen teho ja turvallisuus
RAPID-tutkimukset
Respreeza-valmisteen tehoa ja turvallisuutta arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa monikeskustutkimuksessa (RAPID), jota seurasi 2 vuotta kestänyt avoin jatkotutkimus (RAPID-jatkotutkimus). Kaikkiaan 180 tutkimushenkilöä, joilla oli alfa1-proteinaasinestäjän puutos, jolle oli luonteenomaista seerumin alfa1-proteinaasinestäjän taso < 11 µM (ts. < 50 mg/dl nefelometrialla määritettynä) ja kliinistä näyttöä emfyseemasta, satunnaistettiin saamaan viikoittainen laskimonsisäinen annos 60 mg/painokilo joko Respreeza-valmistetta (93 tutkimushenkilöä) tai lumelääkettä (87 tutkimushenkilöä) korkeintaan 24 kuukauden ajan. Tutkimushenkilöt olivat iältään 31–67 vuotta (mediaani-ikä 54 vuotta), ja heidän keskimääräinen alfa1-proteinaasinestäjän lähtötasonsa oli noin 6,15 µM. Keskimääräinen tietokonetomografialla mitattu, tilavuuskorjattu keuhkojen tiheys oli Respreeza-tutkimushenkilöillä 47 g/l ja lumelääketutkimushenkilöillä 50 g/l.
RAPID-tutkimuksesta 140 tutkimushenkilöä (76 Respreeza-valmisteella ja 64 lumelääkkeellä hoidettua tutkimushenkilöä) jatkoi RAPID-jatkotutkimukseen. He saivat viikoittain 60 mg/kg Respreeza-valmistetta laskimoon korkeintaan 24 kuukauden ajan.
Tutkimuksissa arvioitiin Respreeza-valmisteen vaikutusta emfyseeman etenemiseen. Tätä arvioitiin keuhkojen tiheyden alenemisen perusteella, joka mitattiin tietokonetomografialla (TT).
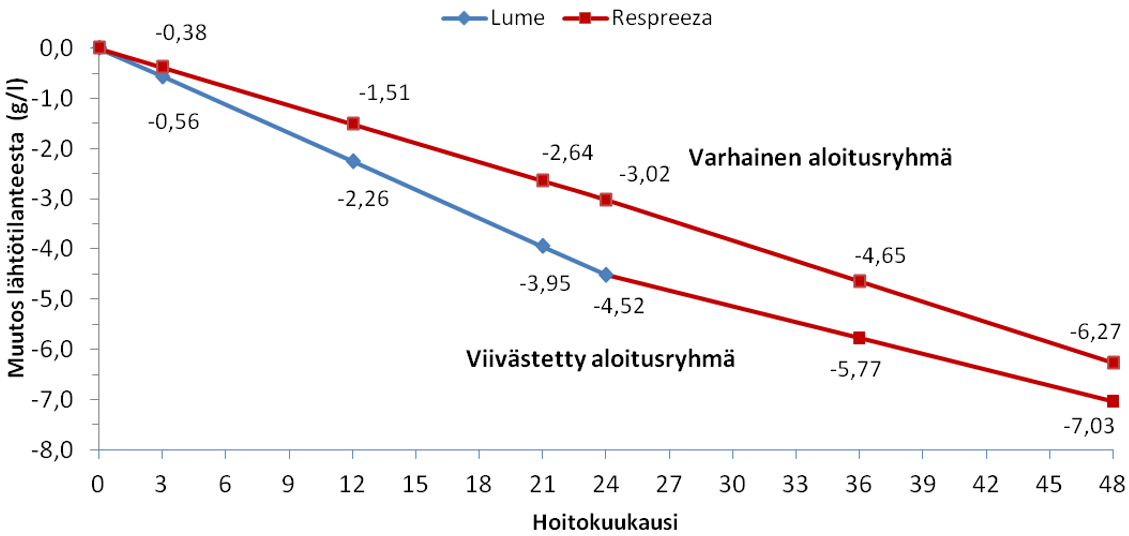
Respreeza-valmisteella hoidetuilla tutkimushenkilöillä keuhkojen tiheyden aleneminen oli yhdenmukaisesti hitaampaa kuin lumelääkettä saaneilla (ks. Kuva 1). Keuhkojen tiheyden vuosittainen alenemisnopeus, mitattuna TT-kuvauksella keuhkojen kokonaiskapasiteetilla (TLC) 2 vuoden aikana oli alhaisempi Respreeza-valmisteella (-1,45 g/l) kuin lumelääkkeellä (-2,19 g/l), mikä kuvasti 34 % alenemista (p = 0,017, 1-suuntainen).
RAPID-jatkotutkimus osoitti, että keuhkojen tiheyden hitaampi alenemisnopeus oli pitkäkestoista tutkimushenkilöillä, jotka saivat Respreeza-hoitoa yhtäjaksoisesti 4 vuoden ajan (ks. Kuva 1).
Kuva 1:Muutokset keuhkojen tiheydessä (TLC) lähtötilanteesta RAPID-tutkimuksessa ja ‑jatkotutkimuksessa
137 tutkimushenkilölle annettiin Respreezaa 120 mg/kg kerta-annoksina.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Respreeza-valmisteen käytöstä kaikkien pediatristen potilasryhmien hoidossa keuhkoahtaumataudissa (COPD), joka johtuu alfa1-proteinaasinestäjän puutoksesta (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Respreeza-valmisteella suoritettiin neljä kliinistä tutkimusta, joihin otti osaa 89 tutkittavaa (59 miestä ja 30 naista). Tutkimuksissa arvioitiin Respreeza-valmisteen vaikutus alfa1-proteinaasiestäjän määriin seerumissa. Tutkimushenkilöt olivat 29–68-vuotiaita (mediaani-ikä 49 vuotta). Seulontavaiheessa seerumin alfa1-proteinaasiestäjän määrät olivat välillä 3,2–10,1 μM (keskiarvo 5,6 μM).
Kaksoissokkoutettu, satunnaistettu, aktiiviainekontrolloitu farmakokineettinen ristikkäisasetelmallinen tutkimus suoritettiin 13 miehellä ja 5 naisella, joilla oli alfa1-proteinaasinestäjän puutos. He olivat 36–66-vuotiaita. Yhdeksän tutkittavaa sai yksittäisen annoksen (60 mg/painokilo) Respreeza-valmistetta, jota seurasi vertailuvalmiste, ja 9 tutkittavaa sai vertailuvalmistetta, jota seurasi yksittäinen Respreeza-annos (60 mg/painokilo). Annosten välillä oli 35 päivän pituinen puhdistumisjakso. Kaikkiaan 13 infuusion jälkeistä seeruminäytettä otettiin eri ajankohtina päivään 21 asti. Taulukko 1 esittää Respreeza-valmisteen farmakokineettisten parametrien keskimääräiset tulokset.
Taulukko 1:Farmakokineettiset parametrit alfa1-proteinaasinestäjälle yksittäisen Respreeza-annoksen jälkeen (60 mg/painokilo)
Farmakokineettinen parametri | Keskiarvo (keskihajonta)* |
Käyrän alle jäävä alue (AUC0-∞) | 144 (±27) µM x päivä |
Enimmäispitoisuus (Cmax) | 44,1 (±10,8) µM |
Terminaalinen puoliintumisaika (t1/2ß) | 5,1 (±2,4) päivää |
Kokonaispuhdistuma | 603 (±129) ml/päivä |
Vakaan tilan jakautumistilavuus | 3,8 (±1,3) l |
* n=18 tutkimushenkilöä.
Populaatiofarmakokineettinen analyysi suoritettiin käyttämällä tietoja 90 Respreeza-valmisteella hoidetusta tutkimushenkilöstä RAPID-tutkimuksesta. Arvio keskimääräisestä puoliintumisajasta populaatiossa oli 6,8 päivää. Malli ennusti keskimääräisen vakaan tilan pitoisuuden olevan 21,8 µM 60 mg/painokilo/viikko -annoksen jälkeen. Populaatiofarmakokineettinen analyysi ei viitannut siihen, että ikä, sukupuoli, paino tai lähtötilanteen seerumin antigeenisen alfa1-proteinaasinestäjän pitoisuus merkittävästi vaikuttaisivat Respreeza-valmisteen puhdistumiseen.
Farmakokineettinen/farmakodynaaminen suhde
Kaksoissokkoutetussa, kontrolloidussa kliinisessä tutkimuksessa, jossa arvioitiin Respreeza-valmisteen turvallisuutta ja biokemiallista tehoa, 44 tutkimushenkilöä satunnaistettiin saamaan Respreeza-valmistetta laskimoon annoksella 60 mg/painokilo kerran viikossa 24 viikon ajan. Keskimääräiset alimmat seerumin alfa1-proteinaasinestäjän pitoisuudet vakaassa tilassa (viikot 7–11) pysyivät arvossa yli 11 μM. Vakaan tilan pienimpien seerumin alfa1-proteinaasinestäjän pitoisuuksien keskiarvo (keskihajonta) Respreeza-valmisteella hoidetuilla tutkimushenkilöillä oli 17,7 μM (2,5).
Tähän tutkimukseen rekrytoitujen tutkimushenkilöiden alajoukossa (10 Respreeza-valmisteella hoidettavaa tutkimushenkilöä) on suoritettu bronkoalveolaarinen huuhtelu. Epiteeliä ympäröivän nesteen (ELF) alfa1-proteinaasinestäjän määrien mittaukset osoittivat, että määrät nousivat yhdenmukaisesti hoidon jälkeen. Antigeenisen alfa1-proteinaasinestäjän ja alfa1-proteinaasinestäjän ELF-määrät: NE-kompleksit lisääntyivät lähtötasosta. Vapaan elastaasin määrä oli niin pieni kaikissa näytteissä, ettei sitä voitu mitata.
RAPID-tutkimuksen loppuun saattamisen jälkeen saavutetut alfa1-proteinaasinestäjän mediaaniarvot ja keuhkojen tiheyden aleneminen arvioitiin. Tässä analyysissä tuli ilmi käänteinen lineaarinen suhde seerumin alfa1-proteinaasinestäjän pienimpien pitoisuuksien ja keuhkojen tiheyden vuosittaisen alenemisen välillä. Keuhkojen tiheys mitattiin tilavuuden mukaan sovitetuilla TT-kuvauksilla tutkittavilla, jotka saivat Respreeza-valmistetta laskimoon (annos 60 mg/painokilo).
Prekliiniset tiedot turvallisuudesta
Respreeza-valmisteen turvallisuus on arvioitu useissa prekliinisissä tutkimuksissa. Farmakologista turvallisuutta ja lyhytaikaista toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Toistuvan altistuksen aiheuttavaa toksisuutta koskevia tutkimuksia, jotka olisivat 5 päivää pitempiä, lisääntymistoksisuutta ja karsinogeenisuutta koskevia tutkimuksia ei ole tehty. Sellaisia tutkimuksia ei pidetä järkevinä, johtuen vasta-aineiden tuotannosta heterologista ihmisproteiinia vastaan eläimissä. Koska ihmisen alfa1-proteinaasinestäjä on proteiini ja ihmisen veren fysiologinen ainesosa, sillä ei odoteta olevan karsinogeenisia, genotoksisia tai teratogeenisia vaikutuksia.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine:
Natriumkloridi
Natriumdivetyfosfaattimonohydraatti
Mannitoli
Liuotin:
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Respreeza 1000 mg infuusiokuiva-aine ja liuotin, liuosta varten
3 vuotta
Respreeza 4000 mg infuusiokuiva-aine ja liuotin, liuosta varten
3 vuotta
Respreeza 5000 mg infuusiokuiva-aine ja liuotin, liuosta varten
3 vuotta
Mikrobiologiselta kannalta katsoen tuote on käytettävä heti käyttövalmiiksi saattamisen jälkeen. Kemiallinen ja fysikaalinen käyttöstabiilius on kuitenkin osoitettu 3 tunnin ajan huoneenlämpötilassa (korkeintaan 25 °C). Käyttövalmista liuosta ei saa jäädyttää.
Säilytys
Säilytä alle 25 °C. Ei saa jäätyä.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
RESPREEZA infuusiokuiva-aine ja liuotin, liuosta varten
1000 mg (L:ei) 1 kpl (1000 mg+20 ml, Mix2Vial-laite) (434,14 €)
4000 mg (L:ei) 1 kpl (4000 mg+76 ml, Mix2Vial-laite) (1642,84 €)
5000 mg (L:ei) 1 kpl (5000 mg+95 ml, Mix2Vial-laite) (2030,65 €)
PF-selosteen tieto
Respreeza 1000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Respreeza 1000 mg kuiva-aine lasisessa injektiopullossa (tyyppi I), joka on suljettu kumisella (butyyli) tulpalla ja alumiinisinetillä, jossa on muovinen repäisykorkki.
20 ml injektionesteisiin käytettävää vettä lasisessa injektiopullossa (tyyppi I), joka on suljettu kumisella (butyyli) tulpalla ja alumiinisinetillä, jossa on muovinen repäisykorkki.
Respreeza 4000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Respreeza 4000 mg kuiva-aine lasisessa injektiopullossa (tyyppi I), joka on suljettu kumisella (butyyli) tulpalla ja alumiinisinetillä, jossa on muovinen repäisykorkki.
76 ml injektionesteisiin käytettävää vettä lasisessa injektiopullossa (tyyppi I), joka on suljettu kumisella (butyyli) tulpalla ja alumiinisinetillä, jossa on muovinen repäisykorkki.
Respreeza 5000 mg infuusiokuiva-aine ja liuotin, liuosta varten
Respreeza 5000 mg kuiva-aine lasisessa injektiopullossa (tyyppi I), joka on suljettu kumisella (butyyli) tulpalla ja alumiinisinetillä, jossa on muovinen repäisykorkki.
95 ml injektionesteisiin käytettävää vettä lasisessa injektiopullossa (tyyppi I), joka on suljettu kumisella (butyyli) tulpalla ja alumiinisinetillä, jossa on muovinen repäisykorkki.
Pakkaukset
Jokainen pakkaus sisältää:
Respreeza 1000 mg infuusiokuiva-aine ja liuotin, liuosta varten:
Yhden kuiva-ainetta sisältävän injektiopullon yhtä käyttökertaa varten
Yhden liuotinta sisältävän injektiopullon, jossa on 20 ml injektionesteisiin käytettävää vettä
Yhden siirtolaitteen 20/20 (Mix2Vial-laite), käyttövalmiiksi saattamista varten
Respreeza 4000 mg infuusiokuiva-aine ja liuotin, liuosta varten:
Yhden kuiva-ainetta sisältävän injektiopullon yhtä käyttökertaa varten
Yhden liuotinta sisältävän injektiopullon, jossa on 76 ml injektionesteisiin käytettävää vettä
Yhden siirtolaitteen 20/20 (Mix2Vial-laite), käyttövalmiiksi saattamista varten
Antovälineet (sisäpakkaus):
Yksi i.v. infuusiosetti
Yksi siipineulapakkaus
Kolme desinfektiopyyhettä
Respreeza 5000 mg infuusiokuiva-aine ja liuotin, liuosta varten:
Yhden kuiva-ainetta sisältävän injektiopullon yhtä käyttökertaa varten
Yhden liuotinta sisältävän injektiopullon, jossa on 95 ml injektionesteisiin käytettävää vettä
Yhden siirtolaitteen 20/20 (Mix2Vial-laite), käyttövalmiiksi saattamista varten
Antovälineet (sisäpakkaus):
Yksi i.v. infuusiosetti
Yksi siipineulapakkaus
Kolme desinfektiopyyhettä
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kuiva-aine on valkoista tai luonnonvalkoista. Liuotin on kirkas ja väritön liuos.
Käyttö- ja käsittelyohjeet
Yleiset ohjeet
- Käyttövalmiiksi saattamisessa on noudatettava alla mainittuja ohjeita.
- Tuote on saatettava käyttövalmiiksi, annettava ja käsiteltävä varovasti, aseptisia menetelmiä käyttäen, jotta tuote pysyy steriilinä.
- Älä käytä mukana toimitettuja steriilejä apuvälineitä käyttövalmiiksi saattamisessa tai annossa, jos niiden pakkaus on avattu tai ne ovat vaurioituneet.
- Kuiva-aine on saatettava käyttövalmiiksi liuottimella (injektionesteisiin käytettävä vesi).
- Liuoksen pitäisi sekoittua käyttövalmiiksi 5 minuutin kuluessa (1000 mg:n pakkaus) tai 10 minuutin kuluessa (4000 mg:n ja 5000 mg:n pakkaukset).
- Tarkista käyttövalmis liuos hiukkasten tai värinmuutosten varalta ennen antoa.
- Käyttövalmiin liuoksen tulee olla kirkas, väritön tai hieman kellertävä, eikä siinä saa olla näkyviä hiukkasia.
Noudata Respreeza-liuoksen valmistamisessa ja käyttövalmiiksi saattamisessa seuraavia vaiheita:
| 1. Varmista, että Respreeza-injektiopullo ja injektionesteisiin käytettävää vettä sisältävä pullo ovat huoneenlämpöisiä (enintään 25 °C). | |
| 2. Poista muovinen repäisykorkki injektionesteisiin käytettävää vettä sisältävästä pullosta. | |
| 3. Desinfioi injektionesteisiin käytettävää vettä sisältävän pullon kumitulppa, esim. desinfektiopyyhkeellä, ja anna kuivua. | |
4. Avaa Mix2Vial-läpipainopakkaus vetämällä suojakansi pois (Kuva 1). Älä ota Mix2Vial-laitetta pois läpipainopakkauksesta. |
Kuva 1 |
| 5. Aseta injektionesteisiin käytettävää vettä sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial-laite sekä läpipainopakkaus ja paina Mix2Vial-laitteen sininen pää suoraan injektionesteisiin käytettävää vettä sisältävän injektiopullon kumitulpan läpi (Kuva 2). |
Kuva 2 |
| 6. Poista läpipainopakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain läpipainopakkauksen etkä Mix2Vial-laitetta (Kuva 3). |
Kuva 3 |
| 7. Poista muovinen repäisykorkki Respreeza-injektiopullosta. | |
| 8. Desinfioi Respreeza-injektiopullon kumitulppa, esim. desinfektiopyyhkeellä, ja anna kuivua. | |
9. Aseta Respreeza-injektiopullo tasaiselle ja tukevalle alustalle. Käännä injektionesteisiin käytettävää vettä sisältävä pullo ja siihen kiinnitetty Mix2Vial-laite ylösalaisin ja paina Mix2Vial-laitteen kirkas pää suoraan Respreeza-injektiopullon tulpan läpi (Kuva 4). Vesi valuu automaattisesti Respreeza-injektiopulloon. HUOM: Varmista, että vesi siirtyy kokonaan Respreeza-injektiopulloon. |
Kuva 4 |
10. Irrota Mix2Vial-laite Respreeza-injektiopullosta seuraavasti:
Hävitä injektionesteisiin käytettävää vettä sisältävä pullo ja Mix2Vial-laite. |
Kuva 5 |
| 11. Pyörittele varovasti Respreeza-injektiopulloa, kunnes kuiva-aine on liuennut kokonaan (Kuva 6). ÄLÄ RAVISTA. Varo koskemasta injektiopullon kumitulppaa. |
Kuva 6 |
| 12. Tarkista käyttövalmis liuos silmämääräisesti. Liuoksen tulee olla kirkas, väritön tai hieman kellertävä, eikä siinä saa olla näkyviä hiukkasia. Älä käytä liuoksia, joissa on värivirhe, jotka ovat sameita tai joissa on hiukkasia. | |
13. Jos tarvittavan annoksen saamiseksi tarvitaan useampi kuin 1 Respreeza-injektiopullo, toista ohjeet 1–12 edellä ja ota käyttöön uusi käyttämätön Mix2Vial-laitepakkaus. Käytä erillistä käyttämätöntä Mix2Vial-laitetta ja injektionesteisiin käytettävää vettä sisältävää pulloa kutakin Respreeza-injektiopulloa kohden. | |
| 14. Käyttövalmiit liuokset voidaan antaa peräkkäin suoraan injektiopullosta tai vaihtoehtoisesti ne voidaan siirtää infuusiosäiliöön (esim. tyhjä i.v.-pussi tai lasipullo; ei toimitettu) kaupallisesti saatavilla olevan i.v.-letkusetin avulla (ei toimiteta valmisteen mukana) ennen antoa. Käytä aseptista menetelmää käyttövalmiin liuoksen siirtämiseksi infuusiosäiliöön. | |
Anto
Käyttövalmis liuos on annettava käyttämällä i.v. infuusiosettiä.
| 1. Varmista, että ilmausventtiilin korkki ja infuusiosetin rullasuljin ovat suljetut. Lävistä Respreeza-injektiopullon tulppa infuusiosetin piikillä KOHTISUORASSA asennossa pienellä kiertävällä liikkeellä tai yhdistä se infuusiosäiliöön. |
| 2. Kohota Respreeza-injektiopulloa/‑infuusiosäiliötä tai ripusta se tippatelineeseen. |
| 3. Esitäytä tippakammio puristamalla sitä, kunnes kammio on suurin piirtein puolillaan Respreeza-liuosta. |
| 4. Avaa infuusiosetin ilmaventtiilin korkki. |
| 5. Avaa infuusiosetin rullasuljin hitaasti ja anna Respreeza-liuoksen virrata, kunnes se saavuttaa letkun pään eikä ilmakuplia näy. |
| 6. Sulje rullasuljin. |
| 7. Desinfioi pistoskohta, esim. desinfektiopyyhkeellä, ja työnnä sitten neula varovasti suoneen. Varmista, että siipineulan letkussa ei ole enää ilmaa. |
| 8. Liitä infuusiosetin toinen pää siipineulaan ja avaa rullasuljin uudelleen. |
| 9. Infusoi käyttövalmis liuos laskimoon. Liuos on infusoitava potilaan vasteen ja mukavuuden mukaan nopeudella, joka on noin 0,08 ml/painokilo/min. Suositellun annoksen (60 mg/painokilo) antaminen infuusiona vie noin 15 minuuttia. |
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
RESPREEZA infuusiokuiva-aine ja liuotin, liuosta varten
1000 mg 1 kpl
4000 mg 1 kpl
5000 mg 1 kpl
- Ei korvausta.
ATC-koodi
B02AB02
Valmisteyhteenvedon muuttamispäivämäärä
31.05.2024
Yhteystiedot
 CSL BEHRING AB
CSL BEHRING AB Box 712
182 17 Danderyd
Ruotsi
+46 (0) 8 544 966 70
www.cslbehring.fi
info@cslbehring.se