IMJUDO infuusiokonsentraatti, liuosta varten 20 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi millilitra infuusiokonsentraattia liuosta varten sisältää 20 mg tremelimumabia.
Yksi 1,25 millilitran injektiopullo konsentraattia sisältää 25 mg tremelimumabia.
Yksi 15 millilitran injektiopullo konsentraattia sisältää 300 mg tremelimumabia.
Tremelimumabi on sytotoksisiin T‑lymfosyytteihin liittyvää antigeenia 4 (CTLA‑4) vastaan kohdennettu IgG2a-tyyppinen humaani, monoklonaalinen immunoglobuliini G2 ‑vasta-aine, jota tuotetaan hiiren myeloomasoluissa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten (steriili konsentraatti).
Kliiniset tiedot
Käyttöaiheet
IMJUDO on tarkoitettu yhdistelmänä durvalumabin kanssa ensilinjan hoitoon aikuisille, joilla on pitkälle edennyt tai leikkaushoitoon soveltumaton maksasolusyöpä.
IMJUDO on tarkoitettu yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa ensilinjan hoitoon aikuisilla, joilla on metastasoitunut ei-pienisoluinen keuhkosyöpä ilman herkistäviä epidermaalisen kasvutekijän reseptorin (EGFR) mutaatioita tai anaplastisen lymfoomakinaasin (ALK) -positiivisia mutaatioita.
Ehto
Hoito tulee aloittaa ja hoitoa tulee jatkaa syöpähoitoihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Syövän hoitoon perehtyneen lääkärin on aloitettava hoito ja valvottava sen toteuttamista.
Annostus
Suositeltu IMJUDO-annos on esitetty taulukossa 1. IMJUDO annetaan infuusiona laskimoon 1 tunnin aikana.
Kun IMJUDO annetaan yhdistelmänä muiden lääkeaineiden kanssa, katso lisätietoja näiden lääkeaineiden valmisteyhteenvedoista.
Taulukko 1. Suositeltu IMJUDO-annos
| Käyttöaihe | Suositeltu IMJUDO-annostus | Hoidon kesto |
| Pitkälle edennyt tai leikkaushoitoon soveltumaton maksasolusyöpä | IMJUDO 300 mga annetaan kerta-annoksena yhdistelmänä durvalumabin 1 500 mga:n annoksen kanssa hoitosyklin 1 päivänä 1, minkä jälkeen annetaan durvalumabia monoterapiana 4 viikon välein. | Kunnes tauti etenee tai ilmenee toksisia vaikutuksia, joita ei voida hyväksyä. |
| Metastasoitunut ei-pienisoluinen keuhkosyöpä | Platinapohjaisen solunsalpaajahoidon aikana: Platinapohjaisen solunsalpaajahoidon jälkeen: IMJUDO-valmistetta annetaan viides 75 mg:n annosd,e viikolla 16 durvalumabiannoksen 6 kanssa. | Enintään 5 annosta. Potilas voi saada vähemmän kuin viisi annosta IMJUDOvalmistetta yhdistelmänä durvalumabin 1 500 mg:n annoksen ja platinapohjaisen solunsalpaajahoidon kanssa, jos tauti etenee tai ilmenee toksisia vaikutuksia, joita ei voida hyväksyä. |
a Jos maksasolusyöpää sairastava potilas painaa enintään 40 kg, IMJUDO-annostuksen on perustuttava painoon. Tällöin annostus on 4 mg/kg IMJUDO-valmistetta, kunnes paino on yli 40 kg. Jos potilas painaa enintään 30 kg, durvalumabin annostuksen on perustuttava painoon. Tällöin annostus on 20 mg/kg durvalumabia, kunnes paino on yli 30 kg.
b Jos metastasoitunutta ei-pienisoluista keuhkosyöpää sairastava potilas painaa enintään 34 kg, IMJUDO-annostuksen on perustuttava painoon. Tällöin annostus on 1 mg/kg IMJUDOvalmistetta, kunnes paino on noussut yli 34 kg:aan. Jos potilas painaa enintään 30 kg, durvalumabin annostuksen on perustuttava painoon. Tällöin annostus on 20 mg/kg durvalumabia, kunnes paino on noussut yli 30 kg:aan.
c Harkitse pemetreksedi-ylläpitohoitoa potilaille, joiden kasvaimet eivät ole levyepiteeliperäisiä ja jotka ovat saaneet pemetreksedi- ja karboplatiini-/sisplatiinihoitoa platinapohjaisen solunsalpaajahoidon vaiheen aikana.
d Jos annoksen (annosten) antaminen viivästyy, IMJUDOvalmisteen viides annos voidaan antaa viikon 16 jälkeen durvalumabin kanssa.
e Jos potilaat saavat platinapohjaista solunsalpaajahoitoa vähemmän kuin 4 hoitosykliä, jäljellä olevat IMJUDOhoitosyklit (yhteensä enintään 5) annetaan platinapohjaisen solunsalpaajahoidon jälkeen durvalumabin kanssa.
Kun IMJUDO-valmistetta annetaan yhdistelmänä durvalumabin kanssa, annoksen suurentaminen tai pienentäminen hoidon aikana ei ole suositeltavaa. Yksilöllinen turvallisuus ja siedettävyys saattavat edellyttää hoidosta pidättäytymistä tai hoidon lopettamista.
Immuunivälitteisten haittavaikutusten hoito-ohjeet on kuvattu taulukossa 2 (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet, jossa on lisätietoa hoitoa koskevista suosituksista, seurannasta ja haittavaikutusten arvioinnista). Tutustu myös durvalumabin valmisteyhteenvetoon.
Taulukko 2. Muutokset hoidossa IMJUDO-valmisteelle yhdistelmänä durvalumabin kanssa
| Haittavaikutukset | Vaikeusastea | Muutos hoidossa |
| Immuunivälitteinen pneumoniitti / interstitiaalinen keuhkosairaus | Aste 2 | Hoidosta pidättäytyminenb |
| Aste 3 tai 4 | Hoidon pysyvä lopettaminen | |
| Immuunivälitteinen maksatulehdus | ALAT tai ASAT > 3 – ≤ 5 x ULN tai kokonaisbilirubiini > 1,5 – ≤ 3 x ULN | Hoidosta pidättäytyminenb |
| ALAT tai ASAT > 5 – ≤ 10 x ULN | Durvalumabin annosta pidättäytyminen ja IMJUDO-hoidon pysyvä lopettaminen (tarvittaessa) | |
| Samanaikaisesti ALAT tai ASAT > 3 x ULN ja kokonaisbilirubiini > 2 x ULNc | Hoidon pysyvä lopettaminen | |
| ALAT tai ASAT > 10 x ULN tai kokonaisbilirubiini > 3 x ULN | ||
| Immuunivälitteinen maksatulehdus maksasolusyövän yhteydessä (tai maksaa sekundaarisesti affisioiva kasvain ja poikkeavat lähtöarvot)e | ALAT tai ASAT > 2,5 – ≤ 5 x lähtöarvo ja ≤ 20 x ULN | Hoidosta pidättäytyminenb |
ALAT tai ASAT > 5 – 7 x lähtöarvo ja ≤ 20 x ULN tai samanaikaisesti ALAT tai ASAT 2,5 – 5 x lähtöarvo ja ≤ 20 x ULN ja kokonaisbilirubiini > 1,5 – < 2 x ULNc | Durvalumabin annosta pidättäytyminen ja IMJUDO-hoidon pysyvä lopettaminen (tarvittaessa) | |
ALAT tai ASAT > 7 x lähtöarvo tai > 20 x ULN sen mukaan, mikä tapahtuu ensin tai kokonaisbilirubiini > 3 x ULN | Hoidon pysyvä lopettaminen | |
| Immuunivälitteinen paksusuolitulehdus tai ripuli | Aste 2 | Hoidosta pidättäytyminenb |
| Aste 3 tai 4 | Hoidon pysyvä lopettaminene | |
| Suolen puhkeama | MIKÄ TAHANSA vaikeusaste | Hoidon pysyvä lopettaminen |
| Immuunivälitteinen hypertyreoosi, tyreoidiitti | Asteet 2–4 | Hoidosta pidättäytyminen, kunnes potilaan kliininen tila on vakaa |
| Immuunivälitteinen hypotyreoosi | Asteet 2–4 | Ei muutoksia |
| Immuunivälitteinen lisämunuaisten vajaatoiminta, hypofysiitti/hypopituitarismi | Asteet 2–4 | Hoidosta pidättäytyminen, kunnes potilaan kliininen tila on vakaa |
| Immuunivälitteinen tyypin 1 diabetes | Asteet 2–4 | Ei muutoksia |
| Immuunivälitteinen munuaistulehdus | Aste 2, seerumin kreatiniini > 1,5 – 3 x (ULN tai lähtöarvo) | Hoidosta pidättäytyminenb |
| Aste 3, seerumin kreatiniini > 3 x lähtöarvo tai > 3 – 6 x ULN; aste 4, seerumin kreatiniini > 6 x ULN | Hoidon pysyvä lopettaminen | |
| Immuunivälitteinen ihottuma tai dermatiitti (pemfigoidi mukaan lukien) | Aste 2 yli 1 viikon ajan tai aste 3 | Hoidosta pidättäytyminenb |
| Aste 4 | Hoidon pysyvä lopettaminen | |
| Immuunivälitteinen sydänlihastulehdus | Asteet 2–4 | Hoidon pysyvä lopettaminen |
| Immuunivälitteinen myosiitti/polymyosiitti/ rabdomyolyysi | Aste 2 tai 3 | Hoidosta pidättäytyminenb,f |
| Aste 4 | Hoidon pysyvä lopettaminen | |
| Infuusioon liittyvät reaktiot | Aste 1 tai 2 | Infuusion keskeyttäminen tai infuusionopeuden pienentäminen |
| Aste 3 tai 4 | Hoidon pysyvä lopettaminen | |
| Immuunivälitteinen myasthenia gravis | Asteet 2–4 | Hoidon pysyvä lopettaminen |
| Immuunivälitteinen transversaalimyeliitti | Mikä tahansa vaikeusaste | Hoidon pysyvä lopettaminen |
| Immuunivälitteinen meningiitti | Aste 2 | Hoidosta pidättäytyminenb |
| Aste 3 tai 4 | Hoidon pysyvä lopettaminen | |
| Immuunivälitteinen enkefaliitti | Asteet 2–4 | Hoidon pysyvä lopettaminen |
| Immuunivälitteinen Guillain–Barrén oireyhtymä | Asteet 2–4 | Hoidon pysyvä lopettaminen |
| Muut immuunivälitteiset haittavaikutuksetg | Aste 2 tai 3 | Hoidosta pidättäytyminenb |
| Aste 4 | Hoidon pysyvä lopettaminen | |
| Muut kuin immuunivälitteiset haittavaikutukset | Asteet 2 ja 3 | Hoidosta pidättäytyminen, kunnes aste on ≤ 1 tai palaa lähtötasolle |
| Aste 4 | Hoidon pysyvä lopettaminenh |
a CTCAE-luokitus (Common Terminology Criteria for Adverse Events), versio 4.03. ALAT: alaniiniaminotransferaasi; ASAT: aspartaattiaminotransferaasi; ULN: viitealueen yläraja.
b Hoidosta pidättäytymisen jälkeen hoitoa IMJUDO-valmisteella ja/tai durvalumabilla voidaan jatkaa 12 viikon kuluessa, jos haittavaikutukset ovat lievittyneet niin, että niiden vaikeusaste on enintään 1, ja kortikosteroidiannos on pienennetty korkeintaan 10 mg:aan prednisonia vuorokaudessa tai vastaavalle tasolle. Hoito IMJUDO-valmisteella ja durvalumabilla on tarvittaessa lopetettava pysyvästi, jos vaikeusasteen 3 haittavaikutukset uusiutuvat.
c Potilailla, joilla on todettu jokin vaihtoehtoinen syy, noudatetaan samoja suosituksia kuin tilanteessa, jossa ASAT- ja ALAT-arvot ovat suurentuneet ilman samanaikaista bilirubiiniarvojen suurenemista.
d Jos ASAT- ja ALAT-arvot ovat lähtötilanteessa korkeintaan viitealueen ylärajalla ja potilaalla on maksa-affisiota, durvalumabin antamisesta on pidättäydyttävä tai se on lopetettava pysyvästi noudattaen samoja suosituksia kuin tilanteessa, jossa potilaalla on maksatulehdus mutta ei maksa-affisiota.
e IMJUDO-hoito on lopetettava pysyvästi asteen 3 haittavaikutuksen ilmetessä. Durvalumabihoitoa voidaan kuitenkin jatkaa, kun haittavaikutus on hävinnyt.
f Hoito IMJUDO-valmisteella ja durvalumabilla lopetetaan pysyvästi, jos haittavaikutus ei lievity 30 päivän kuluessa niin, että vaikeusaste on enintään 1, tai jos potilaalla ilmenee hengitysvajauksen merkkejä.
g Sisältää immuunitrombosytopenian, haimatulehduksen, ei-infektiivisen virtsarakkotulehduksen, immuunivälitteisen niveltulehduksen, uveiitin ja polymyalgia rheumatican.
h Lukuun ottamatta vaikeusastetta 4 olevia laboratorioarvojen poikkeavuuksia, joiden kohdalla päätös hoidon keskeyttämisestä perustuu muihin kliinisiin löydöksiin ja oireisiin sekä kliiniseen arvioon.
Erityisryhmät
Iäkkäät
Annoksen muuttaminen ei ole tarpeen iäkkäillä (vähintään 65-vuotiailla) potilailla (ks. kohta Farmakokinetiikka). Tietoja 75-vuotiaista ja tätä vanhemmista metastasoitunutta ei-pienisoluista keuhkosyöpää sairastavista potilaista on vain vähän (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
IMJUDO-annoksen muuttamista ei suositella potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Vaikeaa munuaisten vajaatoimintaa sairastavista potilaista on niin vähän tietoja, että tästä potilasryhmästä ei voida tehdä johtopäätöksiä (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
IMJUDO-annoksen muuttamista ei suositella potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. IMJUDO-valmistetta ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavilla potilailla (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
IMJUDO-valmisteen turvallisuutta ja tehoa lasten ja alle 18 vuoden ikäisten nuorten hoidossa ei ole varmistettu maksasolusyövän ja ei-pienisoluisen keuhkosyövän kohdalla. Tietoja ei ole saatavilla. Hyväksyttyjen käyttöaiheiden lisäksi IMJUDO-valmistetta yhdistelmänä durvalumabin kanssa on tutkittu 1–17-vuotiailla lapsilla, joilla on neuroblastooma, kiinteä kasvain tai sarkooma, mutta tutkimuksen tulosten perusteella ei voitu tehdä johtopäätöstä, että tällaisen käytön hyödyt olisivat suurempia kuin sen riskit. Saatavissa oleva tieto on kuvattu kohdissa Farmakodynamiikka ja Farmakokinetiikka.
Antotapa
IMJUDO annetaan laskimoon. Se annetaan laimentamisen jälkeen infuusiona laskimoon 1 tunnin aikana (ks. kohta Käyttö- ja käsittelyohjeet).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ennen lääkkeen antoa.
IMJUDO yhdistelmänä durvalumabin kanssa
Kun IMJUDO-valmistetta annetaan yhdistelmänä durvalumabin kanssa pitkälle edenneen tai leikkaushoitoon soveltumattoman maksasolusyövän hoitoon, IMJUDO annetaan erillisenä infuusiona laskimoon ennen durvalumabia samana päivänä. Katso valmisteyhteenvedosta durvalumabin antamista koskevat tiedot.
IMJUDO yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa
Kun IMJUDO-valmistetta annetaan yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa ei-pienisoluisen keuhkosyövän hoitoon, IMJUDO annetaan ensin, sen jälkeen durvalumabi ja sitten platinapohjainen solunsalpaajahoito, kaikki samana antopäivänä.
Kun viides IMJUDO‑annos annetaan yhdistelmänä durvalumabin ja pemetreksedi-ylläpitohoidon kanssa viikolla 16, IMJUDO annetaan ensin, sen jälkeen durvalumabi ja sitten pemetreksedi-ylläpitohoito, kaikki samana antopäivänä.
IMJUDO, durvalumabi ja platinapohjainen solunsalpaajahoito annetaan erillisinä infuusioina laskimoon. Sekä IMJUDO että durvalumabi annetaan kumpikin 1 tunnin infuusioina. Katso valmisteyhteenvedosta platinapohjaisen solunsalpaajahoidon antamista koskevat tiedot. Katso valmisteyhteenvedosta pemetreksedi-ylläpitohoidon antamista koskevat tiedot. Jokaiseen infuusioon on käytettävä eri infuusiopusseja ja suodattimia.
Hoitosyklin 1 aikana durvalumabin antaminen IMJUDO‑valmisteen jälkeen aloitetaan noin 1 tunnin (enintään 2 tunnin) kuluttua IMJUDO‑infuusion päättymisestä. Platinapohjaisen solunsalpaajahoidon infusointi aloitetaan noin 1 tunnin (enintään 2 tunnin) kuluttua durvalumabi-infuusion päättymisestä. Jos hoitosyklin 1 aikana ei ilmene kliinisesti merkittäviä huolenaiheita, seuraavien hoitosyklien yhteydessä durvalumabi voidaan lääkärin harkinnan mukaan antaa välittömästi IMJUDO‑valmisteen jälkeen, ja durvalumabi-infuusion päättymisen ja solunsalpaajahoidon aloittamisen välinen aika voidaan lyhentää 30 minuuttiin.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Suositellut hoidon muutokset, ks. kohta Annostus ja antotapa, taulukko 2. Epäillyt immuunivälitteiset haittavaikutukset on tutkittava asianmukaisesti niiden etiologian varmistamiseksi tai muiden syiden poissulkemiseksi. Haittavaikutuksen vaikeusasteen mukaan IMJUDO-valmisteen ja durvalumabin yhdistelmän antamisesta on pidättäydyttävä ja potilaalle on annettava kortikosteroideja. Kun tapahtuman oireet ovat lievittyneet niin, että niiden vaikeusaste on enintään 1, aloitetaan kortikosteroidiannoksen asteittainen pienentäminen, jota jatketaan vähintään 1 kuukauden ajan. Jos potilaan tila pahenee tai ei parane, on harkittava kortikosteroidiannoksen suurentamista ja/tai muiden systeemisten immuunisalpaajien lisäämistä hoitoon.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen kauppanimi ja eränumero dokumentoitava selkeästi.
Immuunivälitteinen pneumoniitti
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä pneumoniittia ja interstitiaalista keuhkosairautta, jotka määriteltiin niin, että systeemisten kortikosteroidien käyttö oli tarpeen eikä muita selviä syitä ollut (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava pneumoniittiin viittaavien oireiden ja löydösten varalta. Pneumoniittiepäily on varmistettava kuvantamistutkimuksella ja muut tulehdukselliset ja sairauteen liittyvät etiologiat on suljettava pois. Hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteen 2 tapahtumien hoitoon aloitetaan prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito. Annosta pienennetään asteittain. Vaikeusasteiden 3 ja 4 tapahtumien hoitoon aloitetaan metyyliprednisoloni aloitusannoksella 2–4 mg/kg vuorokaudessa tai vastaava hoito. Annosta pienennetään asteittain.
Immuunivälitteinen maksatulehdus
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä maksatulehdusta, joka määriteltiin niin, että systeemisten kortikosteroidien käyttö oli tarpeen eikä muita selviä syitä ollut (ks. kohta Haittavaikutukset). Alaniiniaminotransferaasi- ja aspartaattiaminotransferaasiarvo sekä kokonaisbilirubiini ja alkalisen fosfataasin pitoisuus on tutkittava ennen hoidon aloittamista ja hoidon aikana ennen jokaista infuusiota. Lisäseurantaa on harkittava kliinisen arvioinnin perusteella. Immuunivälitteisen maksatulehduksen hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Kaikkien vaikeusasteiden tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain.
Immuunivälitteinen paksusuolitulehdus
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä paksusuolitulehdusta ja ripulia, jotka määriteltiin niin, että systeemisten kortikosteroidien käyttö oli tarpeen eikä muita selviä syitä ollut (ks. kohta Haittavaikutukset). Tremelimumabia yhdistelmänä durvalumabin kanssa saaneilla potilailla on raportoitu suolen puhkeamia ja paksusuolen puhkeamia. Potilaita on tarkkailtava paksusuolitulehdukseen, ripuliin ja suolen puhkeamaan viittaavien oireiden ja löydösten varalta, ja hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain. Kirurgia on konsultoitava välittömästi, jos epäillään suolen puhkeamaa, olipa tilan vaikeusaste MIKÄ TAHANSA.
Immuunivälitteiset umpierityssairaudet
Immuunivälitteinen hypotyreoosi, hypertyreoosi ja tyreoidiitti
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä hypotyreoosia, hypertyreoosia ja tyreoidiittia, ja hypertyreoosin jälkeen saattaa ilmetä hypotyreoosia (ks. kohta Haittavaikutukset). Potilaiden kilpirauhasen toimintaa on seurattava poikkeavuuksien varalta ennen hoitoa, säännöllisesti hoidon aikana ja kliiniseen arvioon perustuvan tarpeen mukaan. Immuunivälitteisen hypotyreoosin, hypertyreoosin ja tyreoidiitin hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 immuunivälitteisen hypotyreoosin hoitoon aloitetaan kilpirauhashormonikorvaushoito kliinisen tarpeen mukaan. Vaikeusasteiden 2–4 immuunivälitteisen hypertyreoosin tai tyreoidiitin hoitoon voidaan antaa oireenmukaista hoitoa.
Immuunivälitteinen lisämunuaisten vajaatoiminta
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä lisämunuaisten vajaatoimintaa (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava lisämunuaisten vajaatoimintaan viittaavien kliinisten oireiden ja löydösten varalta. Oireisen lisämunuaisten vajaatoiminnan hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain. Lisäksi annetaan hormonikorvaushoitoa kliinisen tarpeen mukaan.
Immuunivälitteinen tyypin 1 diabetes
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä tyypin 1 diabetesta. Tauti voi ensin ilmetä diabeettisena ketoasidoosina, joka voi johtaa kuolemaan, ellei sitä todeta varhain (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava tyypin 1 diabetekseen viittaavien kliinisten oireiden ja löydösten varalta. Oireisen tyypin 1 diabeteksen hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon voidaan aloittaa insuliinihoito kliinisen tarpeen mukaan.
Immuunivälitteinen hypofysiitti/hypopituitarismi
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä hypofysiittia ja hypopituitarismia (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava hypofysiittiin tai hypopituitarismiin viittaavien kliinisten oireiden ja löydösten varalta. Oireisen hypofysiitin ja hypopituitarismin hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain. Lisäksi annetaan hormonikorvaushoitoa kliinisen tarpeen mukaan.
Immuunivälitteinen munuaistulehdus
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä munuaistulehdusta, joka määriteltiin niin, että systeemisten kortikosteroidien käyttö oli tarpeen eikä muita selviä syitä ollut (ks. kohta Haittavaikutukset). Potilaiden munuaisten toimintaa on seurattava poikkeavuuksien varalta ennen hoitoa ja säännöllisesti hoidon aikana, ja hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain.
Immuunivälitteinen ihottuma
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä ihottumaa ja dermatiittia (pemfigoidi mukaan lukien), jotka määriteltiin niin, että systeemisten kortikosteroidien käyttö oli tarpeen eikä muita selviä syitä ollut (ks. kohta Haittavaikutukset). PD‑1:n ja CTLA‑4:n estäjiä saaneilla potilailla on raportoitu Stevens–Johnsonin oireyhtymän ja toksisen epidermaalisen nekrolyysin tapauksia. Potilaita on tarkkailtava ihottumaan tai dermatiittiin viittaavien oireiden ja löydösten varalta, ja hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Yli viikon kestäneiden vaikeusasteen 2 tapahtumien sekä vaikeusasteiden 3 ja 4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain.
Immuunivälitteinen sydänlihastulehdus
Tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä sydänlihastulehdusta, joka voi johtaa kuolemaan (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava immuunivälitteiseen sydänlihastulehdukseen viittaavien oireiden ja löydösten varalta, ja hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 2–4 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain. Jos potilaan tila ei parane 2–3 vuorokauden kuluessa kortikosteroidihoidosta huolimatta, on viipymättä aloitettava lisäksi toinen immunosuppressiivinen hoito. Kun haittavaikutus on hävinnyt (vaikeusaste 0), aloitetaan kortikosteroidiannoksen asteittainen pienentäminen, jota jatketaan vähintään 1 kuukauden ajan.
Immuunivälitteinen haimatulehdus
Tremelimumabia yhdistelmänä durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla on ilmennyt immuunivälitteistä haimatulehdusta (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava immuunivälitteiseen haimatulehdukseen viittaavien oireiden ja merkkien varalta, ja hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia.
Muut immuunivälitteiset haittavaikutukset
Yhdistelmänä durvalumabin kanssa käytetyn tremelimumabin vaikutusmekanismin vuoksi muita mahdollisia immuunivälitteisiä haittavaikutuksia saattaa ilmetä. Seuraavia immuunivälitteisiä haittavaikutuksia on havaittu tremelimumabia yhdistelmänä durvalumabin tai durvalumabin ja solunsalpaajahoidon kanssa saaneilla potilailla: myasthenia gravis, transversaalimyeliitti, myosiitti, polymyosiitti, rabdomyolyysi, meningiitti, enkefaliitti, Guillain–Barrén oireyhtymä, immuunitrombosytopenia, ei-infektiivinen virtsarakkotulehdus, immuunivälitteinen niveltulehdus, uveiitti ja polymyalgia rheumatica (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava oireiden ja löydösten varalta, ja hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 2–4 tapahtumien hoitoon annetaan kortikosteroideja (prednisoni aloitusannoksella 1–2 mg/kg vuorokaudessa tai vastaava hoito). Annosta pienennetään asteittain.
Infuusioon liittyvät reaktiot
Potilaita on tarkkailtava infuusioon liittyvien reaktioiden oireiden ja löydösten varalta. Tremelimumabia yhdistelmänä durvalumabin kanssa saaneilla potilailla on raportoitu vakavia infuusioon liittyviä reaktioita (ks. kohta Haittavaikutukset). Infuusioon liittyvien reaktioiden hoidossa on noudatettava kohdan Annostus ja antotapa suosituksia. Vaikeusasteiden 1 ja 2 tapahtumien kohdalla voidaan harkita infuusioreaktioita ennaltaehkäisevää esilääkitystä. Vaikeusasteiden 3 ja 4 vaikeat infuusioon liittyvät reaktiot hoidetaan hoitoyksikön vakiokäytäntöjen, asianmukaisten kliinisten hoitosuositusten ja/tai lääketieteen alan seurojen hoitosuositusten mukaisesti.
Tautikohtainen varotoimi
Metastasoitunut ei-pienisoluinen keuhkosyöpä
Iäkkäistä (vähintään 75-vuotiaista) potilaista, jotka saavat tremelimumabia yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa, on vain vähän tietoja (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). Tähän hoito-ohjelmaan liittyvien mahdollisten hyötyjen ja riskien huolellista potilaskohtaista arviointia suositellaan.
Kliinisistä tutkimuksista pois suljetut potilaat
Pitkälle edennyt tai leikkaushoitoon soveltumaton maksasolusyöpä
Kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli jokin seuraavista: Child–Pugh-luokka B tai C, porttilaskimon päärungon tromboosi, maksasiirre, huonossa hoitotasapainossa oleva hypertensio, aiempia tai nykyisiä aivometastaaseja, medullakompressio, samanaikaisesti sekä hepatiitti B- että hepatiitti C ‑virusinfektio, aktiivinen tai aiemmin dokumentoitu maha-suolikanavan verenvuoto 12 kuukauden sisällä, ei-lääkkeellistä hoitointerventiota edellyttänyt askites 6 kuukauden sisällä, maksaenkefalopatia 12 kuukauden sisällä ennen hoidon aloittamista tai aktiivinen tai aiemmin dokumentoitu autoimmuuni- tai tulehdussairaus. Koska tremelimumabin käytöstä näille potilasryhmille ei ole tietoja, sen käytössä on noudatettava varovaisuutta, ja käytön on perustuttava mahdollisten hyötyjen ja riskien huolelliseen potilaskohtaiseen arviointiin.
Metastasoitunut ei-pienisoluinen keuhkosyöpä
Kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli jokin seuraavista: aktiivinen tai aiemmin dokumentoitu autoimmuunisairaus; aktiivisia ja/tai hoitamattomia aivometastaaseja; aiempi immuunipuutos; systeemisten immuunisalpaajien käyttö 14 päivän sisällä ennen tremelimumabi- tai durvalumabihoidon aloittamista, lukuun ottamatta systeemistä kortikosteroidihoitoa fysiologisella annoksella (prednisonia ≤ 10 mg vuorokaudessa tai vastaava hoito); kontrolloimaton samanaikainen sairaus; aktiivinen tuberkuloosi tai hepatiitti B- tai hepatiitti C ‑infektio tai HIV-infektio; sekä potilaat, jotka olivat saaneet eläviä heikennettyjä taudinaiheuttajia sisältävän rokotteen 30 päivän kuluessa ennen tremelimumabi- tai durvalumabihoidon aloittamista tai sen jälkeen. Koska tremelimumabin käytöstä näille potilasryhmille ei ole tietoja, sen käytössä on noudatettava varovaisuutta, ja käytön on perustuttava mahdollisten hyötyjen ja riskien huolelliseen potilaskohtaiseen arviointiin.
Natriumin määrä
Tämä lääkevalmiste sisältää natriumia alle 1 mmol (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Systeemisten kortikosteroidien tai immuunisalpaajien käyttöä ei suositella ennen tremelimumabihoidon aloittamista, koska ne saattavat huonontaa tremelimumabin farmakodynaamista vaikutusta ja tehoa. Poikkeuksena on systeemisten kortikosteroidien käyttö fysiologisina annoksina (prednisonia ≤ 10 mg vuorokaudessa tai vastaava hoito). Systeemisiä kortikosteroideja tai muita immuunisalpaajia voidaan kuitenkin käyttää tremelimumabihoidon aloittamisen jälkeen immunijärjestelmään liittyvien haittavaikutusten hoitoon (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tremelimumabilla ei ole tehty varsinaisia farmakokineettisiä yhteisvaikutustutkimuksia. Tremelimumabin pääasialliset eliminaatioreitit ovat proteiinikatabolia retikuloendoteliaalijärjestelmän kautta ja kohdevälitteinen jakautuminen, joten metabolisia yhteisvaikutuksia ei ole odotettavissa. POSEIDON-tutkimuksessa arvioitiin tremelimumabin farmakokineettisiä yhteisvaikutuksia sen kanssa yhdistelmänä käytetyn durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa. Tutkimuksessa osoitettiin, ettei tremelimumabilla, durvalumabilla, nab-paklitakselilla, gemsitabiinilla, pemetreksedilla, karboplatiinilla tai sisplatiinilla ole kliinisesti merkittäviä farmakokineettisiä yhteisvaikutuksia samanaikaisessa käytössä.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / raskauden ehkäisy
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä tremelimumabihoidon aikana ja vähintään 3 kuukauden ajan viimeisen tremelimumabiannoksen saamisen jälkeen.
Raskaus
Ei ole olemassa tietoja tremelimumabin käytöstä raskaana oleville naisille. Tremelimumabin vaikutusmekanismin perusteella ja sen vuoksi, että ihmisen IgG2 läpäisee istukan, tremelimumabi saattaa vaikuttaa raskauden jatkumiseen ja saattaa vahingoittaa sikiötä, jos sitä annetaan raskaana olevalle naiselle. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). IMJUDO-valmisteen käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä tehokasta ehkäisyä hoidon aikana ja vähintään 3 kuukauden ajan viimeisen annoksen saamisen jälkeen.
Imetys
Ei ole tietoa tremelimumabin esiintymisestä ihmisen äidinmaidossa, sen imeytymisestä tai vaikutuksista imetettävään vauvaan eikä sen vaikutuksista maidon tuotantoon. Ihmisen IgG2:n tiedetään erittyvän ihmisillä äidinmaitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Imetys on lopetettava IMJUDO-hoidon ajaksi ja vähintään 3 kuukaudeksi viimeisen annoksen saamisen jälkeen.
Hedelmällisyys
Ei ole olemassa tietoja tremelimumabin mahdollisista vaikutuksista ihmisten tai eläinten hedelmällisyyteen. Toistuvan altistuksen aiheuttamaa toksisuutta arvioineissa tutkimuksissa todettiin kuitenkin mononukleaaristen solujen infiltraatiota eturauhasessa ja kohdussa (ks. kohta Prekliiniset tiedot turvallisuudesta). Näiden havaintojen kliinistä merkitystä hedelmällisyyden kannalta ei tiedetä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tremelimumabilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
IMJUDO yhdistelmänä durvalumabin kanssa
Tiedot tremelimumabin turvallisuudesta, kun sitä annetaan 300 mg:n kerta-annoksena yhdistelmänä durvalumabin kanssa, perustuvat yhdistettyihin tietoihin 462 potilaasta, joilla oli maksasolusyöpä (maksasolusyöpää koskeva yhdistetty tietoaineisto) ja jotka osallistuivat HIMALAYA-tutkimukseen tai toiseen maksasolusyöpää sairastavilla potilailla tehtyyn tutkimukseen eli tutkimukseen 22. Yleisimpiä (> 10 %) haittavaikutuksia olivat ihottuma (32,5 %), kutina (25,5 %), ripuli (25,3 %), vatsakipu (19,7 %), kohonnut aspartaattiaminotransferaasiarvo tai kohonnut alaniiniaminotransferaasiarvo (18,0 %), kuume (13,9 %), hypotyreoosi (13,0 %), yskä / limaa tuottava yskä (10,8 %) ja perifeerinen turvotus (10,4 %) (ks. taulukko 3).
Yleisimpiä (> 3 %) vaikeita (NCI:n CTCAE-luokituksen mukainen vaikeusaste ≥ 3) haittavaikutuksia olivat kohonnut aspartaattiaminotransferaasiarvo tai kohonnut alaniiniaminotransferaasiarvo (8,9 %), suurentunut lipaasipitoisuus (7,1 %), suurentunut amylaasipitoisuus (4,3 %) ja ripuli (3,9 %).
Yleisimpiä (> 2 %) vakavia haittavaikutuksia olivat paksusuolitulehdus (2,6 %), ripuli (2,4 %) ja keuhkokuume (2,2 %).
Haittavaikutuksista johtuvan hoidon lopettamisen yleisyys on 6,5 %. Yleisimpiä hoidon lopettamiseen johtaneita haittavaikutuksia olivat maksatulehdus (1,5 %) ja kohonnut aspartaattiaminotransferaasiarvo tai kohonnut alaniiniaminotransferaasiarvo (1,3 %).
IMJUDO yhdistelmänä durvalumabin ja solunsalpaajahoidon kanssa
Tiedot tremelimumabin turvallisuudesta, kun sitä annetaan yhdistelmänä durvalumabin ja solunsalpaajahoidon kanssa, perustuvat tietoihin 330 potilaasta, joilla oli metastasoitunut ei-pienisoluinen keuhkosyöpä. Yleisimpiä (> 10 %) haittavaikutuksia olivat anemia (49,7 %), pahoinvointi (41,5 %), neutropenia (41,2 %), väsymys (36,1 %), pienentynyt ruokahalu (28,2 %), ihottuma (25,8 %), trombosytopenia (24,5 %), ripuli (21,5 %), leukopenia (19,4 %), ummetus (19,1 %), oksentelu (18,2 %), kohonnut aspartaattiaminotransferaasiarvo tai kohonnut alaniiniaminotransferaasiarvo (17,6 %), kuume (16,1 %), ylähengitystieinfektiot (15,5 %), keuhkokuume (14,8 %), hypotyreoosi (13,3 %), nivelkipu (12,4 %), yskä / limaa tuottava yskä (12,1 %) ja kutina (10,9 %).
Yleisimpiä (> 3 %) vaikeita (NCI:n CTCAE-luokituksen mukainen vaikeusaste ≥ 3) haittavaikutuksia olivat neutropenia (23,9 %), anemia (20,6 %), keuhkokuume (9,4 %), trombosytopenia (8,2 %), leukopenia (5,5 %), väsymys (5,2 %), suurentunut lipaasipitoisuus (3,9 %) ja suurentunut amylaasipitoisuus (3,6 %).
Yleisimpiä (> 2 %) vakavia haittavaikutuksia olivat keuhkokuume (11,5 %), anemia (5,5 %), trombosytopenia (3 %), paksusuolitulehdus (2,4 %), ripuli (2,4 %), kuume (2,4 %) ja kuumeinen neutropenia (2,1 %).
Tremelimumabihoito lopetettiin haittavaikutusten vuoksi 4,5 %:lla potilaista. Yleisimpiä hoidon lopettamiseen johtaneita haittavaikutuksia olivat keuhkokuume (1,2 %) ja paksusuolitulehdus (0,9 %).
Tremelimumabihoito keskeytettiin haittavaikutusten vuoksi 40,6 %:lla potilaista. Yleisimpiä hoidon keskeyttämiseen johtaneita haittavaikutuksia olivat neutropenia (13,6 %), trombosytopenia (5,8 %), leukopenia (4,5 %), ripuli (3,0 %), keuhkokuume (2,7 %), kohonnut aspartaattiaminotransferaasiarvo tai kohonnut alaniiniaminotransferaasiarvo (2,4 %), väsymys (2,4 %), suurentunut lipaasipitoisuus (2,4 %), paksusuolitulehdus (2,1 %), maksatulehdus (2,1 %) ja ihottuma (2,1 %).
Haittavaikutustaulukko
Ellei toisin mainita, taulukossa 3 on esitetty haittavaikutusten ilmaantuvuus potilailla, jotka saivat tremelimumabia 300 mg:n annoksella yhdistelmänä durvalumabin kanssa, maksasolusyöpää koskevassa yhdistetyssä tietoaineistossa, joka käsittää 462 potilasta, sekä potilailla, jotka saivat IMJUDO-valmistetta yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa POSEIDON-tutkimuksessa, jossa 330 potilasta sai tremelimumabia. Potilaiden tremelimumabialtistuksen keston mediaani POSEIDON-tutkimuksessa oli 20 viikkoa.
Haittavaikutukset on lueteltu MedDRA:n elinjärjestelmäluokituksen mukaan. Haittavaikutukset on esitetty kussakin elinjärjestelmäluokassa haittavaikutuksen yleisyyden mukaan alenevassa järjestyksessä. Kunkin haittavaikutuksen yleisyysluokka on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1 / 1 000, < 1/100), harvinainen (≥ 1 / 10 000, < 1 / 1000), hyvin harvinainen (< 1 / 10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Lääkkeen haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3. Haittavaikutukset potilailla, jotka saivat tremelimumabia yhdistelmänä durvalumabin kanssa
| Tremelimumabi 75 mg yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa | Tremelimumabi 300 mg yhdistelmänä durvalumabin kanssa
| |||||
|---|---|---|---|---|---|---|
| Mikä tahansa vaikeusaste (%) | Vaikeusaste 3–4 (%) | Mikä tahansa vaikeusaste (%) | Vaikeusaste 3–4 (%) | |||
| Infektiot | ||||||
| Ylähengitystieinfektiota | Hyvin yleinen | 15,5 | 0,6 | Yleinen | 8,4 | 0 |
| Keuhkokuumeb | Hyvin yleinen | 14,8 | 7,3 | Yleinen | 4,3 | 1,3 |
| Influenssa | Yleinen | 3,3 | 0 | Yleinen | 2,2 | 0 |
| Suun kandidiaasi | Yleinen | 2,4 | 0,3 | Melko harvinainen | 0,6 | 0 |
| Hampaisiin ja suun pehmytkudoksiin liittyvät infektiotc | Melko harvinainen | 0,6 | 0,3 | Yleinen | 1,3 | 0 |
| Veri ja imukudos | ||||||
| Anemiad | Hyvin yleinen | 49,7 | 20,6 | |||
| Neutropeniad,e | Hyvin yleinen | 41,2 | 23,9 | |||
| Trombosytopeniad,f | Hyvin yleinen | 24,5 | 8,2 | |||
| Leukopeniad,g | Hyvin yleinen | 19,4 | 5,5 | |||
| Kuumeinen neutropeniad | Yleinen | 3,0 | 2,1 | |||
| Pansytopeniad | Yleinen | 1,8 | 0,6 | |||
| Immuunitrombosytopenia | Melko harvinainen | 0,3 | 0 | Melko harvinainenh | 0,3 | 0 |
| Umpieritys | ||||||
| Hypotyreoosii | Hyvin yleinen | 13,3 | 0 | Hyvin yleinen | 13,0 | 0 |
| Hypertyreoosij | Yleinen | 6,7 | 0 | Yleinen | 9,5 | 0,2 |
| Lisämunuaisten vajaatoiminta | Yleinen | 2,1 | 0,6 | Yleinen | 1,3 | 0,2 |
| Hypopituitarismi/ hypofysiitti | Yleinen | 1,5 | 0,3 | Melko harvinainen | 0,9 | 0 |
| Tyreoidiittik | Yleinen | 1,2 | 0 | Yleinen | 1,7 | 0 |
| Diabetes insipidus | Melko harvinainen | 0,3 | 0,3 | Harvinainenl | < 0,1 | 0 |
| Tyypin 1 diabetes | Melko harvinainen | 0,3 | 0,3 | Melko harvinainenl | 0,3 | < 0,1 |
| Silmät | ||||||
| Uveiitti | Melko harvinainen | 0,3 | 0 | Harvinainen1 | <0,1 | 0 |
| Aineenvaihdunta ja ravitsemus | ||||||
| Pienentynyt ruokahalud | Hyvin yleinen | 28,2 | 1,5 | |||
| Hermosto | ||||||
| Perifeerinen neuropatiad,m | Yleinen | 6,4 | 0 | |||
| Enkefaliittin | Melko harvinainen | 0,6 | 0,6 | Harvinainenl | < 0,1 | 0 |
| Myasthenia gravis | Harvinaineno | < 0,1 | < 0,1 | Melko harvinainen | 0,4 | 0 |
| Guillain–Barrén oireyhtymä | Harvinainenp | < 0,1 | 0 | Harvinainenp | < 0,1 | 0 |
| Meningiitti | Harvinaineno | 0,1 | 0 | Melko harvinainen | 0,2 | 0,2 |
| Transversaalimyeliittiq | Tuntematon | - | - | Tuntematon | - | - |
| Sydän | ||||||
| Sydänlihastulehdusr | Melko harvinainen | 0,3 | 0 | Melko harvinainen | 0,4 | 0 |
| Hengityselimet, rintakehä ja välikarsina | ||||||
| Yskä / limaa tuottava yskä | Hyvin yleinen | 12,1 | 0 | Hyvin yleinen | 10,8 | 0,2 |
| Pneumoniittis | Yleinen | 4,2 | 1,2 | Yleinen | 2,4 | 0,2 |
| Dysfonia | Yleinen | 2,4 | 0 | Melko harvinainen | 0,9 | 0 |
| Interstitiaalinen keuhkosairaus | Melko harvinainen | 0,6 | 0 | Melko harvinainen | 0,2 | 0 |
| Ruoansulatuselimistö | ||||||
| Pahoinvointid | Hyvin yleinen | 41,5 | 1,8 | |||
| Ripuli | Hyvin yleinen | 21,5 | 1,5 | Hyvin yleinen | 25,3 | 3,9 |
| Ummetusd | Hyvin yleinen | 19,1 | 0 | |||
| Oksentelud | Hyvin yleinen | 18,2 | 1,2 | |||
| Stomatiittid,t | Yleinen | 9,7 | 0 | |||
| Suurentunut amylaasipitoisuus | Yleineno | 8,5 | 3,6 | Yleinen | 8,9 | 4,3 |
| Vatsakipuu | Yleinen | 7,3 | 0 | Hyvin yleinen | 19,7 | 2,2 |
| Suurentunut lipaasipitoisuus | Yleineno | 6,4 | 3,9 | Yleinen | 10,0 | 7,1 |
| Paksusuolitulehdusv | Yleinen | 5,5 | 2,1 | Yleinen | 3,5 | 2,6 |
| Haimatulehdusw | Yleinen | 2,1 | 0,3 | Yleinen | 1,3 | 0,6 |
| Suolen puhkeama | Harvinainenp | < 0,1 | < 0,1 | Harvinainenp | < 0,1 | < 0,1 |
| Paksusuolen puhkeama | Melko harvinainenp | 0,1 | < 0,1 | Melko harvinainenp | 0,1 | < 0,1 |
| Keliakia | Harvinainenp | 0,03 | 0,03 | Harvinainenp | 0,03 | 0,03 |
| Maksa ja sappi | ||||||
| Kohonnut aspartaattiaminotransferaasiarvo tai kohonnut alaniiniaminotransferaasiarvox | Hyvin yleinen | 17,6 | 2,1 | Hyvin yleinen | 18,0 | 8,9 |
| Maksatulehdusy | Yleinen | 3,9 | 0,9 | Yleinen | 5,0 | 1,7 |
| Iho ja ihonalainen kudos | ||||||
| Karvojen lähtöd | Hyvin yleinen | 10,0 | 0 | |||
| Ihottumaz | Hyvin yleinen | 25,8 | 1,5 | Hyvin yleinen | 32,5 | 3,0 |
| Kutina | Hyvin yleinen | 10,9 | 0 | Hyvin yleinen | 25,5 | 0 |
| Dermatiittiaa | Melko harvinainen | 0,6 | 0 | Yleinen | 1,3 | 0 |
| Yöhikoilu | Melko harvinainen | 0,6 | 0 | Yleinen | 1,3 | 0 |
| Pemfigoidi | Melko harvinainen | 0,3 | 0,3 | Melko harvinainen | 0,2 | 0 |
| Luusto, lihakset ja sidekudos | ||||||
| Nivelkipu | Hyvin yleinen | 12,4 | 0,3 | |||
| Lihaskipu | Yleinen | 4,2 | 0 | Yleinen | 3,5 | 0,2 |
| Myosiittibb | Melko harvinainen | 0,3 | 0,3 | Melko harvinainen | 0,6 | 0,2 |
| Polymyosiittibb | Melko harvinainen | 0,3 | 0,3 | Melko harvinainen | 0,2 | 0,2 |
| Immuunivälitteinen niveltulehdus | Melko harvinaineno | 0,2 | 0 | Melko harvinainen | 0,6 | 0 |
| Polymyalgia rheumatica | Tuntematoncc | - | - | Melko harvinainen | 0,6 | 0,2 |
| Munuaiset ja virtsatiet | ||||||
| Kohonnut veren kreatiniiniarvo | Yleinen | 6,4 | 0,3 | Yleinen | 4,5 | 0,4 |
| Dysuria | Yleinen | 1,5 | 0 | Yleinen | 1,5 | 0 |
| Munuaistulehdusdd | Melko harvinainen | 0,6 | 0 | Melko harvinainen | 0,6 | 0,4 |
| Ei-infektiivinen virtsarakkotulehdus | Melko harvinainen | 0,3 | 0 | Harvinainenl | < 0,1 | 0 |
| Yleisoireet ja antopaikassa todettavat haitat | ||||||
| Väsymysd | Hyvin yleinen | 36,1 | 5,2 | |||
| Kuume | Hyvin yleinen | 16,1 | 0 | Hyvin yleinen | 13,9 | 0,2 |
| Perifeerinen turvotusee | Yleinen | 8,5 | 0 | Hyvin yleinen | 10,4 | 0,4 |
| Vammat, myrkytykset ja hoitokomplikaatiot | ||||||
| Infuusioon liittyvä reaktioff | Yleinen | 3,9 | 0,3 | Yleinen | 1,3 | 0 |
a Sisältää seuraavat: kurkunpäätulehdus, nasofaryngiitti, nielutulehdus, riniitti, sinuiitti, tonsilliitti, trakeobronkiitti ja ylähengitystieinfektio.
b Sisältää seuraavat: Pneumocystis jirovecii -keuhkokuume, keuhkokuume ja bakteerikeuhkokuume.
c Sisältää seuraavat: parodontiitti, pulpiitti, hammasabsessi ja hampaan infektio.
d Tällä haittavaikutuksella tarkoitetaan ainoastaan solunsalpaajahoidon haittavaikutuksia POSEIDON-tutkimuksessa.
e Sisältää seuraavat: neutropenia ja neutrofiilien niukkuus.
f Sisältää seuraavat: verihiutaleniukkuus ja trombosytopenia.
g Sisältää seuraavat: leukopenia ja valkosolujen niukkuus.
h Raportoitiin tutkimuksissa maksasolusyöpää koskevan yhdistetyn tietoaineiston ulkopuolella. Esiintymistiheys perustuu POSEIDON-tutkimukseen.
i Sisältää seuraavat: veren suurentunut tyreotropiiniarvo (TSH-arvo), hypotyreoosi ja immuunivälitteinen hypotyreoosi.
j Sisältää seuraavat: veren pienentynyt tyreotropiiniarvo (TSH-arvo) ja hypertyreoosi.
k Sisältää seuraavat: autoimmuunityreoidiitti, immuunivälitteinen tyreoidiitti, tyreoidiitti ja subakuutti tyreoidiitti.
l Raportoitiin tutkimuksissa maksasolusyöpää koskevan yhdistetyn tietoaineiston ulkopuolella. Esiintymistiheys perustuu yhdistettyyn tietoaineistoon potilaista, jotka olivat saaneet tremelimumabia yhdistelmänä durvalumabin kanssa.
m Sisältää seuraavat: perifeerinen neuropatia, parestesia ja perifeerinen sensorinen neuropatia.
n Sisältää seuraavat: enkefaliitti ja autoimmuunienkefaliitti.
o Raportoitiin tutkimuksissa POSEIDON-tutkimuksen ulkopuolella. Esiintymistiheys perustuu yhdistettyyn tietoaineistoon potilaista, jotka olivat saaneet tremelimumabia yhdistelmänä durvalumabin kanssa.
p Raportoitiin tutkimuksissa POSEIDON-tutkimuksen ja maksasolusyöpää koskevan yhdistetyn tietoaineiston ulkopuolella. Esiintymistiheys perustuu yhdistettyyn tietoaineistoon potilaista, jotka olivat saaneet tremelimumabia yhdistelmänä durvalumabin kanssa.
q Raportoitiin tutkimuksissa POSEIDON-tutkimuksen ja maksasolusyöpää koskevan yhdistetyn tietoaineiston ulkopuolella.
r Sisältää autoimmuunimyokardiitin.
s Sisältää seuraavat: immuunivälitteinen pneumoniitti ja pneumoniitti.
t Sisältää seuraavat: limakalvotulehdus ja stomatiitti.
u Sisältää seuraavat: vatsakipu, alavatsakipu, ylävatsakipu ja kipu kyljessä.
v Sisältää seuraavat: koliitti, enteriitti ja enterokoliitti.
w Sisältää seuraavat: autoimmuunihaimatulehdus, haimatulehdus ja akuutti haimatulehdus.
x Sisältää seuraavat: kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonneet maksaentsyymiarvot ja kohonneet transaminaasiarvot.
y Sisältää seuraavat: autoimmuunimaksatulehdus, maksatulehdus, maksasoluvaurio, maksatoksisuus, äkillinen maksatulehdus ja immuunivälitteinen hepatiitti.
z Sisältää seuraavat: ekseema, punoitus, ihottuma, makulaarinen ihottuma, makulopapulaarinen ihottuma, papulaarinen ihottuma, kutiava ihottuma ja märkärakkulainen ihottuma.
aa Sisältää seuraavat: dermatiitti ja immuunivälitteinen dermatiitti.
bb Sisältää seuraavat: rabdomyolyysi, myosiitti ja polymyosiitti.
cc Haittavaikutusta ei havaittu POSEIDON-tutkimuksessa, mutta sitä ilmoitettiin kliinisissä tutkimuksissa POSEIDON-tietoaineiston ulkopuolella potilailla, jotka olivat saaneet tremelimumabia yhdistelmänä durvalumabin kanssa.
dd Sisältää seuraavat: autoimmuunimunuaistulehdus ja immuunivälitteinen munuaistulehdus.
ee Sisältää seuraavat: perifeerinen edeema ja perifeerinen turvotus.
ff Sisältää seuraavat: infuusioon liittyvä reaktio ja nokkosihottuma.
Valikoitujen haittavaikutusten kuvaus
Tremelimumabihoitoon liittyy immuunivälitteisiä haittavaikutuksia. Useimmat niistä, vaikeat reaktiot mukaan lukien, hävisivät asianmukaisen hoidon aloittamisen tai tremelimumabihoidon lopettamisen jälkeen. Seuraavia immuunivälitteisiä haittavaikutuksia koskevat tiedot perustuvat 2 280 potilaaseen yhdeksässä tutkimuksessa, joissa potilailla oli erityyppisiä kasvaimia. Nämä potilaat saivat tremelimumabia 75 mg 4 viikon välein tai 1 mg/kg 4 viikon välein yhdistelmänä durvalumabin kanssa, jota annettiin 1 500 mg 4 viikon välein, 20 mg/kg 4 viikon välein tai 10 mg/kg 2 viikon välein. Tämä yhdistetty turvallisuustietoaineisto ei sisällä POSEIDON-tutkimusta (eikä potilaita, jotka olivat saaneet tremelimumabia yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa). Durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa yhdistelmänä annetun tremelimumabin merkittävien haittavaikutusten tiedot on esitetty tapauksissa, joissa havaittiin kliinisesti oleellisia eroja verrattuna tremelimumabin käyttöön yhdistelmänä durvalumabin kanssa.
Seuraavat tiedot viittaavat myös maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) havaittujen tremelimumabi 300 mg:n ja durvalumabin yhdistelmän merkittävien haittavaikutusten tietoihin.
Näitä haittavaikutuksia koskevat hoitosuositukset on kuvattu kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Immuunivälitteinen pneumoniitti
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä pneumoniittia oli todettu 86 potilaalla (3,8 %). Näistä vaikeusasteen 3 tapahtumia oli 30 potilaalla (1,3 %), vaikeusasteen 4 tapahtuma 1 potilaalla (< 0,1 %) ja vaikeusasteen 5 (eli kuolemaan johtaneita) tapahtumia 7 potilaalla (0,3 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 57 päivää (vaihteluväli: 8–912 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja näistä 86 potilaasta 79 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Seitsemän potilasta sai myös muita immuunisalpaajia. Hoito lopetettiin 39 potilaalla. Immuunivälitteinen pneumoniitti parani 51 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä pneumoniittia oli todettu 6 potilaalla (1,3 %). Näistä vaikeusasteen 3 tapahtumia oli 1 potilaalla (0,2 %) ja vaikeusasteen 5 (eli kuolemaan johtaneita) tapahtumia 1 potilaalla (0,2 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 29 päivää (vaihteluväli: 5–774 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja kuudesta potilaasta viisi sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Yksi potilas sai myös muita immuunisalpaajia. Hoito lopetettiin 2 potilaalla. Immuunivälitteinen pneumoniitti parani 3 potilaalla.
Immuunivälitteinen maksatulehdus
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä maksatulehdusta oli todettu 80 potilaalla (3,5 %). Näistä vaikeusasteen 3 tapahtumia oli 48 potilaalla (2,1 %), vaikeusasteen 4 tapahtumia 8 potilaalla (0,4 %) ja vaikeusasteen 5 (eli kuolemaan johtaneita) tapahtumia 2 potilaalla (< 0,1 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 36 päivää (vaihteluväli: 1–533 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja näistä 80 potilaasta 68 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Kahdeksan potilasta sai myös muita immuunisalpaajia. Hoito lopetettiin 27 potilaalla. Immuunivälitteinen maksatulehdus parani 47 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä maksatulehdusta oli todettu 34 potilaalla (7,4 %). Näistä vaikeusasteen 3 tapahtumia oli 20 potilaalla (4,3 %), vaikeusasteen 4 tapahtumia 1 potilaalla (0,2 %) ja vaikeusasteen 5 (eli kuolemaan johtaneita) tapahtumia 3 potilaalla (0,6 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 29 päivää (vaihteluväli: 13–313 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 34 potilaasta 32 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Yhdeksän potilasta sai myös muita immuunisalpaajia. Hoito lopetettiin 10 potilaalla. Immuunivälitteinen maksatulehdus parani 13 potilaalla.
Immuunivälitteinen paksusuolitulehdus
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä paksusuolitulehdusta tai ripulia oli todettu 167 potilaalla (7,3 %). Näistä vaikeusasteen 3 tapahtumia oli 76 potilaalla (3,3 %) ja vaikeusasteen 4 tapahtumia 3 potilaalla (0,1 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 57 päivää (vaihteluväli: 3–906 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja näistä 167 potilaasta 151 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). 22 potilasta sai myös muita immuunisalpaajia. Hoito lopetettiin 54 potilaalla. Immuunivälitteinen paksusuolitulehdus parani 141 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä paksusuolitulehdusta tai ripulia oli todettu 31 potilaalla (6,7 %). Näistä vaikeusasteen 3 tapahtumia oli 17 potilaalla (3,7 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 23 päivää (vaihteluväli: 2–479 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 31 potilaasta 28 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Neljä potilasta sai myös muita immuunisalpaajia. Hoito lopetettiin 5 potilaalla. Immuunivälitteinen paksusuolitulehdus parani 29 potilaalla.
Tremelimumabia yhdistelmänä durvalumabin kanssa saaneilla potilailla on havaittu (harvinaisena haittavaikutuksena) suolen puhkeamia tutkimuksissa, jotka eivät sisältyneet maksasolusyöpää koskevaan tietoaineistoon.
Immuunivälitteiset umpierityssairaudet
Immuunivälitteinen hypotyreoosi
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä hypotyreoosia oli todettu 209 potilaalla (9,2 %). Näistä vaikeusasteen 3 tapahtumia oli 6 potilaalla (0,3 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 85 päivää (vaihteluväli: 1–624 päivää). 13 potilasta sai systeemistä kortikosteroidihoitoa, ja 13 potilaasta 8 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Hoito lopetettiin 3 potilaalla. Immuunivälitteinen hypotyreoosi parani 52 potilaalla. Immuunivälitteistä hypotyreoosia edelsi immuunivälitteinen hypertyreoosi 25 potilaalla ja immuunivälitteinen tyreoidiitti 2 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä hypotyreoosia oli todettu 46 (10,0 %) potilaalla. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 85 päivää (vaihteluväli: 26–763 päivää). Yksi potilas sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Kaikki potilaat tarvitsivat muuta hoitoa, kuten hormonikorvaushoitoa. Immuunivälitteinen hypotyreoosi parani 6 potilaalla. Immuunivälitteistä hypotyreoosia edelsi immuunivälitteinen hypertyreoosi 4 potilaalla.
Immuunivälitteinen hypertyreoosi
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä hypertyreoosia oli todettu 62 potilaalla (2,7 %). Näistä vaikeusasteen 3 tapahtumia oli 5 potilaalla (0,2 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 33 päivää (vaihteluväli: 4–176 päivää). 18 potilasta sai systeemistä kortikosteroidihoitoa, ja näistä 18 potilaasta 11 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). 53 potilasta tarvitsi muuta hoitoa (tiamatsolia, karbimatsolia, propyylitiourasiilia, perkloraattia, kalsiuminestäjää tai beetasalpaajaa). Yksi potilas lopetti hoidon hypertyreoosin vuoksi. Immuunivälitteinen hypertyreoosi parani 47 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä hypertyreoosia oli todettu 21 potilaalla (4,5 %). Näistä 1 potilaalla (0,2 %) oli todettu vaikeusasteen 3 tapahtuma. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 30 päivää (vaihteluväli: 13–60 päivää). 4 potilasta sai systeemistä kortikosteroidihoitoa, ja kaikki 4 potilasta saivat suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). 20 potilasta tarvitsi muuta hoitoa (tiamatsolia, karbimatsolia, propyylitiourasiilia, perkloraattia, kalsiumkanavan salpaajaa tai beetasalpaajaa). Yksi potilas lopetti hoidon hypertyreoosin vuoksi. Immuunivälitteinen hypertyreoosi parani 17 potilaalla.
Immuunivälitteinen tyreoidiitti
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä tyreoidiittia oli todettu 15 potilaalla (0,7 %). Näistä 1 potilaalla (< 0,1 %) oli todettu vaikeusasteen 3 tapahtuma. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 57 päivää (vaihteluväli: 22–141 päivää). 5 potilasta sai systeemistä kortikosteroidihoitoa, ja näistä 5 potilaasta 2 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). 13 potilasta tarvitsi muuta hoitoa, kuten hormonikorvaushoitoa, tiamatsolia, karbimatsolia, propyylitiourasiilia, perkloraattia, kalsiuminestäjää tai beetasalpaajaa. Yksikään potilas ei lopettanut hoitoa immuunivälitteisen tyreoidiitin vuoksi. Immuunivälitteinen tyreoidiitti parani 5 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä tyreoidiittia oli todettu 6 potilaalla (1,3 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 56 päivää (vaihteluväli: 7–84 päivää). 2 potilasta sai systeemistä kortikosteroidihoitoa, ja näistä kahdesta potilaasta toinen sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Kaikki potilaat tarvitsivat muuta hoitoa, kuten hormonikorvaushoitoa. Immuunivälitteinen tyreoidiitti parani 2 potilaalla.
Immuunivälitteinen lisämunuaisten vajaatoiminta
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä lisämunuaisten vajaatoimintaa oli todettu 33 potilaalla (1,4 %). Näistä vaikeusasteen 3 tapahtumia oli 16 potilaalla (0,7 %) ja vaikeusasteen 4 tapahtuma 1 potilaalla (< 0,1 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 105 päivää (vaihteluväli: 20–428 päivää). 32 potilasta sai systeemistä kortikosteroidihoitoa, ja näistä 32 potilaasta 10 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Hoito lopetettiin 1 potilaalla. Immuunivälitteinen lisämunuaisten vajaatoiminta parani 11 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä lisämunuaisten vajaatoimintaa oli todettu 6 potilaalla (1,3 %). Näistä 1 potilaalla (0,2 %) oli todettu vaikeusasteen 3 tapahtuma. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 64 päivää (vaihteluväli: 43–504 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 6 potilaasta yksi sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Immuunivälitteinen lisämunuaisten vajaatoiminta parani 2 potilaalla.
Immuunivälitteinen tyypin 1 diabetes
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteinen tyypin 1 diabetes oli todettu 6 potilaalla (0,3 %). Näistä 1 potilaalla (< 0,1 %) oli todettu vaikeusasteen 3 tapahtuma ja 2 potilaalla (< 0,1 %) vaikeusasteen 4 tapahtuma. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 58 päivää (vaihteluväli: 7–220 päivää). Kaikki potilaat tarvitsivat insuliinia. Hoito lopetettiin 1 potilaalla. Tyypin 1 diabetes parani 1 potilaalla.
Tremelimumabia yhdistelmänä durvalumabin kanssa saaneilla potilailla on havaittu (melko harvinaisena haittavaikutuksena) tyypin 1 diabetesta tutkimuksissa, jotka eivät sisältyneet maksasolusyöpää koskevaan tietoaineistoon.
Immuunivälitteinen hypofysiitti tai hypopituitarismi
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä hypofysiittia tai hypopituitarismia oli todettu 16 potilaalla (0,7 %). Näistä vaikeusasteen 3 tapahtumia oli 8 potilaalla (0,4 %). Mediaaniaika tapahtuman ilmaantumiseen oli 123 päivää (vaihteluväli: 63–388 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 16 potilaasta 8 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Neljä potilasta tarvitsi myös hormonihoitoa. Hoito lopetettiin 2 potilaalla. Immuunivälitteinen hypofysiitti tai hypopituitarismi parani 7 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä hypofysiittia tai hypopituitarismia oli todettu 5 potilaalla (1,1 %). Mediaaniaika tapahtuman ilmaantumiseen oli 149 päivää (vaihteluväli: 27–242 päivää). Neljä potilasta sai systeemistä kortikosteroidihoitoa, ja näistä 4 potilaasta yksi sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Kolme potilasta tarvitsi myös hormonihoitoa. Immuunivälitteinen hypofysiitti tai hypopituitarismi parani 2 potilaalla.
Immuunivälitteinen munuaistulehdus
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä munuaistulehdusta oli todettu 9 potilaalla (0,4 %). Näistä 1 potilaalla (< 0,1 %) oli todettu vaikeusasteen 3 tapahtuma. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 79 päivää (vaihteluväli: 39–183 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 7 potilasta sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Hoito lopetettiin 3 potilaalla. Immuunivälitteinen munuaistulehdus parani 5 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä munuaistulehdusta oli todettu 4 potilaalla (0,9 %). Näistä vaikeusasteen 3 tapahtumia oli 2 potilaalla (0,4 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 53 päivää (vaihteluväli: 26–242 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 4 potilaasta 3 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Hoito lopetettiin 2 potilaalla. Immuunivälitteinen munuaistulehdus parani 3 potilaalla.
Immuunivälitteinen ihottuma
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) immuunivälitteistä ihottumaa tai dermatiittia (pemfigoidi mukaan lukien) oli todettu 112 potilaalla (4,9 %). Näistä vaikeusasteen 3 tapahtumia oli 17 potilaalla (0,7 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 35 päivää (vaihteluväli: 1–778 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 112 potilaasta 57 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Hoito lopetettiin 10 potilaalla. Immuunivälitteinen ihottuma parani 65 potilaalla.
Maksasolusyöpää koskeneessa yhdistetyssä tietoaineistossa (n = 462) immuunivälitteistä ihottumaa tai dermatiittia (pemfigoidi mukaan lukien) oli todettu 26 potilaalla (5,6 %). Näistä vaikeusasteen 3 tapahtumia oli 9 potilaalla (1,9 %) ja vaikeusasteen 4 tapahtumia 1 potilaalla (0,2 %). Mediaaniaika haittavaikutuksen ilmaantumiseen oli 25 päivää (vaihteluväli: 2–933 päivää). Kaikki potilaat saivat systeemistä kortikosteroidihoitoa, ja 26 potilaasta 14 sai suuriannoksista kortikosteroidihoitoa (prednisonia vähintään 40 mg vuorokaudessa tai vastaavaa hoitoa). Yksi potilas sai muita immuunisalpaajia. Hoito lopetettiin 3 potilaalla. Immuunivälitteinen ihottuma parani 19 potilaalla.
Infuusioon liittyvät reaktiot
Durvalumabin kanssa yhdistelmänä käytettyä tremelimumabia koskeneessa yhdistetyssä turvallisuustietokannassa (n = 2 280) infuusioon liittyviä reaktioita oli todettu 45 potilaalla (2,0 %). Näistä vaikeusasteen 3 tapahtumia oli 2 potilaalla (< 0,1 %). Vaikeusasteen 4 tai 5 tapahtumia ei ilmennyt.
Laboratorioarvojen poikkeavuudet
POSEIDON-tutkimuksessa tremelimumabia yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa saaneilla potilailla (n = 330) niiden potilaiden osuudet, joiden laboratorioarvot muuttuivat lähtötilanteesta vaikeusasteen 3 tai 4 poikkeavuuksiksi, olivat seuraavat: kohonneet alaniiniaminotransferaasiarvot, 6,2 %; kohonneet aspartaattiaminotransferaasiarvot, 5,2 %; kohonnut veren kreatiniiniarvo, 4,0 %; suurentunut amylaasipitoisuus, 9,4 %; ja suurentunut lipaasipitoisuus, 13,6 %. Niiden potilaiden osuus, joiden TSH-arvo oli lähtötilanteessa korkeintaan viitealueen ylärajalla (≤ ULN) ja kohosi ylärajan yläpuolelle, oli 24,8 %. Niiden potilaiden osuus, joiden TSH-arvo oli lähtötilanteessa vähintään viitealueen alarajalla (≥ LLN) ja laski alarajan alapuolelle, oli 32,9 %.
Immuunijärjestelmän tarkistuspisteen estäjien luokkavaikutukset
Muilla immuunijärjestelmän tarkistuspisteen estäjillä annetun hoidon aikana on havaittu seuraavia haittavaikutuksia, joita voi ilmaantua myös tremelimumabihoidon aikana: haiman eksokriininen vajaatoiminta.
Immunogeenisuus
Kaikkien proteiinilääkkeiden tavoin myös tremelimumabiin liittyy immunogeenisuuden mahdollisuus. Tiedot tremelimumabin immunogeenisuudesta perustuvat yhdistettyihin tietoihin 2 075 potilaasta, jotka saivat tremelimumabia annoksella 75 mg tai 1 mg/kg ja joilta voitiin määrittää lääkevasta-aineet (ADA). Hoidon aikana kehittyneitä lääkevasta-aineita todettiin 252 potilaalla (12,1 %). Tremelimumabia neutraloivia vasta-aineita todettiin 10,0 %:lla (208 / 2 075) potilaista. Lääkevasta-aineiden kehittyminen ei vaikuttanut tremelimumabin farmakokinetiikkaan, eikä sillä ollut havaittavia vaikutuksia turvallisuuteen.
HIMALAYA-tutkimuksessa hoidon aikana ilmenevien lääkevasta-aineiden testitulos oli positiivinen 20 potilaalla (11,0 %) niistä 182 potilaasta, jotka saivat tremelimumabia 300 mg:n kerta-annoksena yhdistelmänä durvalumabin kanssa ja joilta voitiin määrittää tremelimumabia vastaan kehittyneet vasta-aineet. Tremelimumabia neutraloivia vasta-aineita todettiin 4,4 %:lla (8 / 182) potilaista. Lääkevasta-aineiden kehittymisellä ei ollut havaittavia vaikutuksia farmakokinetiikkaan tai turvallisuuteen.
POSEIDON-tutkimuksessa hoidon aikana kehittyneiden lääkevasta-aineiden testitulos oli positiivinen 38 potilaalla (13,7 %) niistä 278 potilaasta, jotka saivat tremelimumabia annoksella 75 mg yhdistelmänä durvalumabin (1 500 mg 3 viikon välein) sekä platinapohjaisen solunsalpaajahoidon kanssa ja joilta voitiin määrittää lääkevasta-aineet. Tremelimumabia neutraloivia vasta-aineita todettiin 11,2 %:lla (31 / 278) potilaista. Lääkevasta-aineiden kehittymisellä ei ollut havaittavia vaikutuksia farmakokinetiikkaan tai turvallisuuteen.
Iäkkäät
Vähintään 75‑vuotiaista maksasolusyöpää sairastavista potilaista on vain vähän tietoja.
POSEIDON-tutkimuksessa iäkkäiden (vähintään 65-vuotiaiden) ja nuorempien potilaiden välillä ilmoitettiin olevan joitakin turvallisuuteen liittyviä eroja potilailla, jotka saivat tremelimumabia yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa. Turvallisuustiedot vähintään 75-vuotiaista potilaista rajoittuvat yhteensä 74 potilaaseen. Niillä 35 potilaalla, jotka olivat vähintään 75-vuotiaita ja jotka saivat tremelimumabia yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa, ilmeni enemmän vakavia haittavaikutuksia (45,7 %) ja jonkin tutkimushoidon keskeyttämistä haittavaikutusten vuoksi (28,6 %) kuin niillä 39 potilaalla, jotka olivat vähintään 75-vuotiaita ja jotka saivat vain platinapohjaista solunsalpaajahoitoa (näistä potilaista 35,9 %:lla ilmeni vakavia haittavaikutuksia ja 20,5 %:lla tutkimushoito keskeytettiin haittavaikutusten vuoksi).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Tremelimumabin yliannostuksesta ei ole tietoja. Yliannostustapauksissa potilaan tilaa on seurattava tarkoin haittavaikutuksiin viittaavien oireiden tai löydösten havaitsemiseksi, ja oireenmukainen hoito on aloitettava välittömästi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut monoklonaaliset vasta-aineet ja vasta-ainekonjugoidut lääkkeet. ATC-koodi: L01FX20
Vaikutusmekanismi
Sytotoksisiin T‑lymfosyytteihin liittyvää antigeenia (CTLA‑4) ilmentyy pääasiassa T‑lymfosyyttien pinnalla. CTLA‑4:n ja sen ligandien CD80 ja CD86 välinen vuorovaikutus rajoittaa efektori-T‑solujen aktivaatiota useiden mahdollisten mekanismien kautta, mutta pääasiassa vähentämällä CD28:n kautta tapahtuvaa kostimulatorista signaalinvälitystä.
Tremelimumabi on selektiivinen, täysin humaani IgG2-vasta-aine, joka salpaa CTLA‑4:n vuorovaikutusta CD80:n ja CD86:n kanssa tehostaen siten T‑solujen aktivaatiota ja proliferaatiota, mikä lisää T‑solujen monimuotoisuutta ja tehostaa vaikutusta kasvaimia vastaan.
Antamalla yhdistelmänä tremelimumabia, joka on CTLA-4:n estäjä, ja durvalumabia, joka on PD-L1:n estäjä, saavutetaan parempi vaste kasvaimia vastaan metastasoituneen ei-pienisoluisen keuhkosyövän ja maksasolusyövän hoidossa.
Kliininen teho
Maksasolusyöpä – HIMALAYA-tutkimus
IMJUDO-valmisteen tehoa, kun sitä annetaan 300 mg:n kerta-annoksena yhdistelmänä durvalumabin kanssa, arvioitiin HIMALAYA-tutkimuksessa, joka oli satunnaistettu, avoin monikeskustutkimus potilailla, joilla oli vahvistetusti leikkaushoitoon soveltumaton maksasolusyöpä ja jotka eivät olleet aiemmin saaneet maksasolusyöpään systeemihoitoa. Tutkimukseen osallistui potilaita, joilla taudin BCLC (Barcelona Clinic Liver Cancer) -levinneisyysaste oli C tai B (lokoregionaalinen hoito ei soveltunut potilaalle) ja Child–Pugh-luokka A.
Tutkimuksesta suljettiin pois potilaat, joilla oli aivometastaaseja sillä hetkellä tai anamneesissa; samanaikaisesti sekä hepatiitti B- että hepatiitti C ‑virusinfektio; aktiivinen tai aiemmin dokumentoitu maha-suolikanavan verenvuoto 12 kuukauden sisällä; ei-lääkkeellistä hoitointerventiota edellyttänyt askites 6 kuukauden sisällä; maksaenkefalopatia 12 kuukauden sisällä ennen hoidon aloittamista; tai aktiivinen tai aiemmin dokumentoitu autoimmuuni- tai tulehdussairaus.
Potilaat, joilla oli ruokatorven suonikohjuja, otettiin mukaan tutkimukseen, jos heillä ei ollut aktiivista tai edeltävien 12 kuukauden sisällä dokumentoitua aiempaa maha-suolikanavan verenvuotoa ennen tutkimuksessa aloittamista.
Satunnaistamisessa ositustekijöinä olivat makrovaskulaarinen invaasio (kyllä vs. ei), maksasairauden etiologia (vahvistettu hepatiitti B ‑virusinfektio vs. vahvistettu hepatiitti C ‑virusinfektio vs. muut) ja ECOG-suorituskykyluokka (0 vs. 1). HIMALAYA-tutkimuksessa satunnaistettiin 1 171 potilasta suhteessa 1:1:1 saamaan
- durvalumabia 1 500 mg 4 viikon välein
- IMJUDO-valmistetta 300 mg kerta-annoksena sekä durvalumabia 1 500 mg; sen jälkeen durvalumabia 1 500 mg 4 viikon välein
- sorafenibia 400 mg kaksi kertaa vuorokaudessa.
Kasvaimet arvioitiin ensimmäisten 12 kuukauden aikana 8 viikon välein ja sen jälkeen 12 viikon välein. Elossaoloarvioinnit tehtiin kuukauden välein ensimmäisten 3 kuukauden aikana hoidon lopettamisen jälkeen ja sen jälkeen 2 kuukauden välein.
Ensisijainen päätetapahtuma oli kokonaiselossaoloaika (OS), kun IMJUDO-valmisteen 300 mg:n kerta-annosta yhdistelmänä durvalumabin kanssa verrattiin sorafenibiin. Toissijaisia päätetapahtumia olivat etenemättömyysaika (PFS), tutkijalääkärin arvioimien objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DoR) RECIST v1.1 ‑kriteerien mukaan.
Demografiset tiedot ja sairauden ominaispiirteet lähtötilanteessa olivat hyvin samankaltaiset eri tutkimushaaroissa. Koko tutkimuspopulaation demografiset tiedot lähtötilanteessa olivat: miehiä (83,7 %), ikä alle 65 vuotta (50,4 %), valkoihoisia (44,6 %), aasialaisia (50,7 %), mustaihoisia tai afrikkalaisamerikkalaisia (1,7 %), muun etnisen taustan omaavia (2,3 %), ECOG-suorituskykyluokka 0 (62,6 %); Child–Pugh-luokka A (99,5 %), makrovaskulaarinen invaasio (25,2 %), leviäminen maksan ulkopuolelle (53,4 %), lähtötilanteen AFP-arvo (alfafetoproteiinipitoisuus) < 400 ng/ml (63,7 %), lähtötilanteen AFP-arvo ≥ 400 ng/ml (34,5 %), virusetiologia: hepatiitti B (30,6 %), hepatiitti C (27,2 %), ei infektiota (42,2 %), arvioitavissa olevia PD-L1-tietoja (86,3 %), PD‑L1 TAP (Tumor Area Positivity eli PD‑L1-positiivisten solujen osuus kasvaimen pinta-alasta) ≥ 1 % (38,9 %), PD‑L1 TAP < 1 % (48,3 %) [Ventana PD‑L1 (SP263) ‑analyysi].
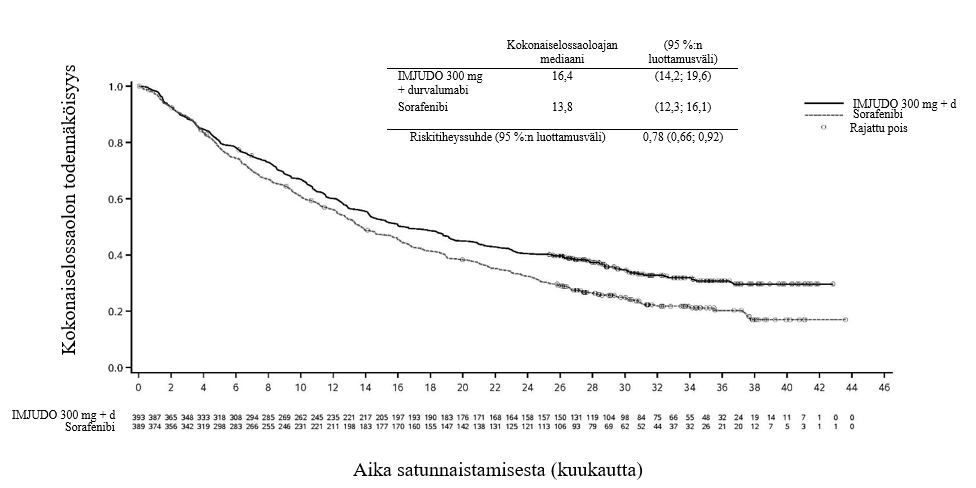
Tulokset on esitetty taulukossa 4 ja kuvassa 1.
Taulukko 4. HIMALAYA-tutkimuksen tehoa koskevat tulokset IMJUDO 300 mg + durvalumabi ‑hoidolle verrattuna sorafenibiin
IMJUDO 300 mg + durvalumabi (n = 393) | Sorafenibi (n = 389) | |
| Seurannan kesto | ||
| Seurannan keston mediaani (kuukausina)a | 33,2 | 32,2 |
| Kokonaiselossaolo | ||
| Kuolemantapausten määrä (%) | 262 (66,7) | 293 (75,3) |
Kokonaiselossaoloajan mediaani (kuukausina) (95 %:n luottamusväli) | 16,4 (14,2; 19,6) | 13,8 (12,3; 16,1) |
| Riskitiheyssuhde (95 %:n luottamusväli) | 0,78 (0,66; 0,92) | |
| p‑arvob | 0,0035 | |
| Etenemättömyys | ||
| Tapahtumien lukumäärä (%) | 335 (85,2) | 327 (84,1) |
Etenemättömyysajan mediaani (kuukausina) (95 %:n luottamusväli) | 3,78 (3,68; 5,32) | 4,07 (3,75; 5,49) |
| Riskitiheyssuhde (95 %:n luottamusväli) | 0,90 (0,77; 1,05) | |
| Objektiiviset vasteet | ||
| Objektiiviset vasteet, n (%)c | 79 (20,1) | 20 (5,1) |
| Täydellinen vaste, n (%) | 12 (3,1) | 0 |
| Osittainen vaste, n (%) | 67 (17,0) | 20 (5,1) |
| Vasteen kesto | ||
| Vasteen keston mediaani (kuukausina) | 22,3 | 18,4 |
a Laskettu käänteisellä Kaplan–Meier-tekniikalla (käyttäen käänteistä sensurointiosoitinta).
b Tilastollisen merkitsevyyden raja IMJUDO 300 mg + durvalumabi -hoidolle verrattuna sorafenibiin oli 0,0398, kun käytössä oli Lan–DeMetsin alfavirheen korjausfunktio, O’Brien–Flemingin tyyppinen raja ja havaittujen tapahtumien todellinen lukumäärä (Lan◦ja◦DeMets 1983).
c Vahvistettu täydellinen vaste.
Kuva 1. Kokonaiselossaolon Kaplan–Meier-käyrä
Ei-pienisoluinen keuhkosyöpä – POSEIDON-tutkimus
POSEIDON-tutkimus oli suunniteltu durvalumabin tehon arviointiin, kun durvalumabia annettiin IMJUDO‑valmisteen kanssa tai ilman sitä, yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa. POSEIDON oli satunnaistettu, avoin monikeskustutkimus, johon osallistuneet 1 013 potilasta sairastivat metastasoitunutta ei-pienisoluista keuhkosyöpää eikä heillä ollut herkistävää epidermaalisen kasvutekijän reseptorin (EGFR) mutaatiota eikä anaplastisen lymfoomakinaasin (ALK) poikkeavuuksia kasvaimen genomissa. Tutkimukseen otettiin potilaita, joilla oli histologisesti tai sytologisesti dokumentoitu metastasoitunut ei-pienisoluinen keuhkosyöpä. Potilaat eivät olleet aiemmin saaneet solunsalpaajahoitoa tai muuta systeemistä hoitoa metastasoituneen ei-pienisoluisen keuhkosyövän vuoksi. Ennen satunnaistamista kasvainten PD‑L1-status varmistettiin Ventana PD‑L1 (SP263) -analyysillä. Potilaiden WHO/ECOG (World Health Organization/Eastern Cooperative Oncology Group) ‑suorituskykypistemäärä oli 0 tai 1 heidän aloittaessaan tutkimuksessa.
Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen tai aiemmin dokumentoitu autoimmuunisairaus; aktiivisia ja/tai hoitamattomia aivometastaaseja; anamneesissa immuunipuutos; systeemisten immuunisalpaajien käyttöä 14 päivän kuluessa ennen IMJUDO‑ tai durvalumabihoidon aloittamista, lukuun ottamatta systeemistä kortikosteroidihoitoa fysiologisella annoksella; tai aktiivinen tuberkuloosi tai hepatiitti B- tai hepatiitti C ‑infektio tai HIV-infektio, sekä potilaat, jotka saivat eläviä heikennettyjä taudinaiheuttajia sisältävän rokotteen 30 päivän kuluessa ennen IMJUDO‑ tai durvalumabihoidon aloittamista tai sen aloittamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Satunnaistamisessa ositustekijöinä olivat kasvainsolujen PD-L1:n ilmentyminen (≥ 50 % kasvainsoluista vs. < 50 % kasvainsoluista), taudin levinneisyysaste (levinneisyysaste IVA vs. levinneisyysaste IVB American Joint Committee on Cancer -organisaation julkaiseman luokituskäsikirjan 8. painoksen mukaan) ja histologia (ei-levyepiteeliperäinen vs. levyepiteeliperäinen).
Potilaat satunnaistettiin suhteessa 1:1:1 seuraavasti:
- Hoitohaara 1: IMJUDO 75 mg sekä durvalumabi 1 500 mg ja platinapohjainen solunsalpaajahoito 3 viikon välein 4 hoitosyklin ajan ja sen jälkeen durvalumabi 1 500 mg 4 viikon välein monoterapiana. IMJUDO‑valmistetta annettiin viides 75 mg:n annos viikolla 16 durvalumabiannoksen 6 kanssa.
- Hoitohaara 2: Durvalumabi 1 500 mg ja platinapohjainen solunsalpaajahoito 3 viikon välein 4 hoitosyklin ajan ja sen jälkeen durvalumabi 1 500 mg 4 viikon välein monoterapiana.
- Hoitohaara 3: Platinapohjainen solunsalpaajahoito 3 viikon välein 4 hoitosyklin ajan. Tutkijalääkärin harkinnan ja kliinisen tarpeen mukaan hoitoon saatettiin lisätä vielä kaksi hoitosykliä (yhteensä 6 hoitosykliä satunnaistamisen jälkeen).
Potilaat saivat jotakin seuraavista platinapohjaisista solunsalpaajahoidoista:
-
Ei-levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä
- Pemetreksedi 500 mg/m2 sekä karboplatiini AUC 5–6 tai sisplatiini 75 mg/m2 kolmen viikon välein. Pemetreksedi-ylläpitohoitoa voitiin antaa, ellei tutkijalääkäri katsonut sen olevan vasta-aiheista.
-
Levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä
- Gemsitabiini 1 000 tai 1 250 mg/m2 päivinä 1 ja 8 sekä sisplatiini 75 mg/m2 tai karboplatiini AUC 5–6 päivänä 1 kolmen viikon välein.
-
Ei-levyepiteeliperäinen tai levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä
- Nab-paklitakseli 100 mg/m2 päivinä 1, 8 ja 15 sekä karboplatiini AUC 5–6 päivänä 1 kolmen viikon välein.
Jos tauti ei edennyt eikä ilmennyt toksisia vaikutuksia, joita ei voitu hyväksyä, IMJUDO‑valmistetta voitiin antaa enintään 5 annosta. Durvalumabihoitoa ja histologisiin tietoihin perustuvaa pemetreksedi-ylläpitohoitoa (jos sen käyttö katsottiin aiheelliseksi) jatkettiin, kunnes tauti eteni tai ilmeni toksisia vaikutuksia, joita ei voitu hyväksyä.
Kasvaimet arvioitiin viikon 6 ja viikon 12 kohdalla satunnaistamispäivästä lukien ja sen jälkeen 8 viikon välein, kunnes taudin vahvistettiin objektiivisesti edenneen. Elossaoloarvioinnit tehtiin 2 kuukauden välein hoidon lopettamisen jälkeen.
Tutkimuksen kaksi ensisijaista päätetapahtumaa olivat etenemättömyysaika (PFS) ja kokonaiselossaoloaika (OS), kun verrattiin durvalumabin ja platinapohjaisen solunsalpaajahoidon yhdistelmää (hoitohaara 2) pelkkään platinapohjaiseen solunsalpaajahoitoon (hoitohaara 3). Tutkimuksen keskeiset toissijaiset päätetapahtumat olivat etenemättömyysaika ja kokonaiselossaoloaika IMJUDO‑valmisteen, durvalumabin ja platinapohjaisen solunsalpaajahoidon yhdistelmällä (hoitohaara 1) sekä pelkällä platinapohjaisella solunsalpaajahoidolla (hoitohaara 3). Toissijaisia päätetapahtumia olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DoR). Sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) arvioi etenemättömyysajan, objektiivisten vasteiden osuuden ja vasteen keston RECIST v1.1 ‑kriteerien mukaisesti.
Demografiset tiedot ja sairauden ominaispiirteet lähtötilanteessa olivat hyvin samankaltaiset eri tutkimushaaroissa. Koko tutkimuspopulaation demografiset tiedot lähtötilanteessa olivat: miehiä (76,0 %), ikä vähintään 65 vuotta (47,1 %), ikä vähintään 75 vuotta (11,3 %), iän mediaani 64 vuotta (vaihteluväli: 27–87 vuotta), valkoihoisia (55,9 %), aasialaisia (34,6 %), mustaihoisia tai afrikkalaisamerikkalaisia (2,0 %), muita (7,6 %), muita kuin taustaltaan espanjankielisistä maista olevia tai latinalaisamerikkalaisia (84,2 %), edelleen tupakoivia tai aiemmin tupakoineita (78,0 %), WHO/ECOG-suorituskykypistemäärä 0 (33,4 %), WHO/ECOG-suorituskykypistemäärä 1 (66,5 %). Sairauden ominaispiirteet olivat: levinneisyysaste IVA (50,0 %), levinneisyysaste IVB (49,6 %), histologinen alatyyppi levyepiteeliperäinen (36,9 %), ei-levyepiteeliperäinen (62,9 %), aivometastaaseja (10,5 %), PD‑L1:n ilmentyminen kasvainsoluissa ≥ 50 % (28,8 %), PD‑L1:n ilmentyminen kasvainsoluissa < 50 % (71,1 %).
Tutkimuksessa osoitettiin kokonaiselossaoloajan olevan tilastollisesti merkitsevästi pidempi IMJUDO‑valmisteen, durvalumabin ja platinapohjaisen solunsalpaajahoidon yhdistelmää saaneilla (hoitohaara 1) verrattuna pelkkää platinapohjaista solunsalpaajahoitoa saaneisiin (hoitohaara 3). IMJUDO‑valmisteen, durvalumabin ja platinapohjaisen solunsalpaajahoidon yhdistelmää saaneilla potilailla havaittiin etenemättömyysajan olevan tilastollisesti merkitsevästi pidempi verrattuna pelkkää platinapohjaista solunsalpaajahoitoa saaneisiin. Tulokset on esitetty yhteenvetona alla.
Taulukko 5. POSEIDON-tutkimuksen tehoa koskevat tulokset
| Hoitohaara 1: IMJUDO + durvalumabi + platinapohjainen solunsalpaajahoito (n = 338) | Hoitohaara 3: Platinapohjainen solunsalpaajahoito (n = 337) | |
| Kokonaiselossaoloa | ||
| Kuolemantapausten määrä (%) | 251 (74,3) | 285 (84,6) |
Kokonaiselossaoloajan mediaani (kuukausina) (95 %:n luottamusväli) | 14,0 (11,7; 16,1) | 11,7 (10,5; 13,1) |
| Riskitiheyssuhde (95 %:n luottamusväli)b | 0,77 (0,650; 0,916) | |
| p‑arvoc | 0,00304 | |
| Etenemättömyysa | ||
| Tapahtumien lukumäärä (%) | 238 (70,4) | 258 (76,6) |
Etenemättömyysajan mediaani (kuukausina) (95 %:n luottamusväli) | 6,2 (5,0; 6,5) | 4,8 (4,6; 5,8) |
| Riskitiheyssuhde (95 %:n luottamusväli)b | 0,72 (0,600; 0,860) | |
| p-arvoc | 0,00031 | |
| Objektiiviset vasteet, n (%)d,e | 130 (38,8) | 81 (24,4) |
| Täydellinen vaste, n (%) | 2 (0,6) | 0 |
| Osittainen vaste, n (%) | 128 (38,2) | 81 (24,4) |
Vasteen keston mediaani (kuukausina) (95 %:n luottamusväli)d,e | 9,5 (7,2; ei saavutettu) | 5,1 (4,4; 6,0) |
a Etenemättömyysajan analyysi tiedonkeruun katkaisupisteen 24.7.2019 kohdalla (seuranta-ajan mediaani 10,15 kuukautta). Kokonaiselossaoloajan analyysi tiedonkeruun katkaisupisteen 12.3.2021 kohdalla (seuranta-ajan mediaani 34,86 kuukautta). Tehon toteamiseen vaadittavat raja-arvot (hoitohaara 1 verrattuna hoitohaaraan 3: etenemättömyys 0,00735, kokonaiselossaolo 0,00797; kaksitahoinen) määritettiin Lan–DeMetsin alfavirheen korjausfunktiolla, joka approksimoi O’Brien–Flemingin lähestymistapaa. Sokkoutettu riippumaton keskitetty arvioijataho (BICR) arvioi etenemättömyysajan RECIST v1.1 ‑kriteerien mukaisesti.
b Riskitiheyssuhteet saadaan käyttämällä PD‑L1-statuksen, histologian ja taudin levinneisyysasteen mukaan stratifioitua Coxin pH‑mallia.
c Kaksitahoinen p-arvo, joka perustuu PD‑L1-statuksen, histologian ja taudin levinneisyysasteen mukaan stratifioituun log rank ‑testiin.
d Vahvistettu objektiivinen vaste.
e Post hoc ‑analyysi.
Kuva 2. Kokonaiselossaoloajan Kaplan–Meier-käyrä
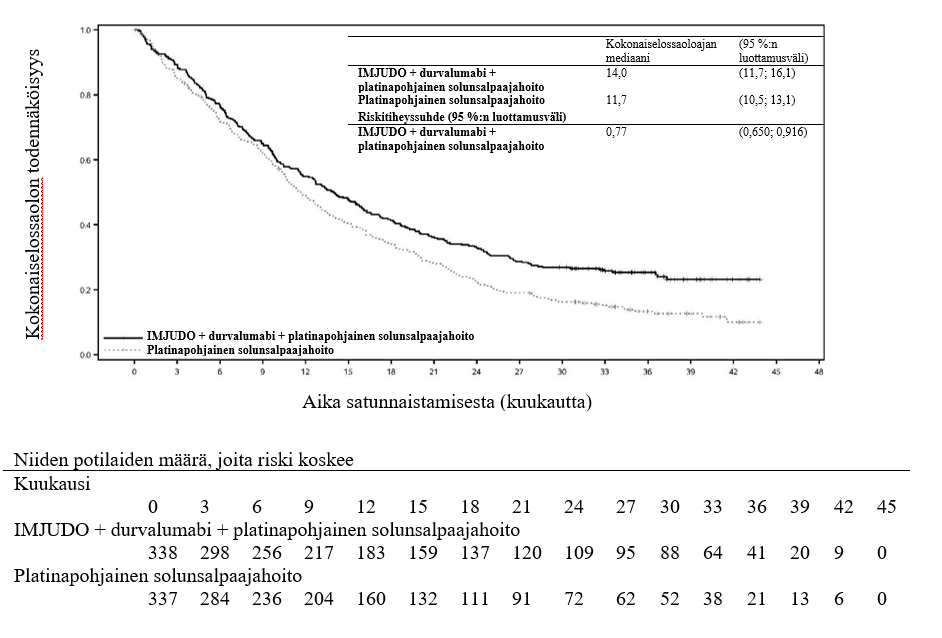
Kuva 3. Etenemättömyysaikaa koskeva Kaplan–Meier-käyrä
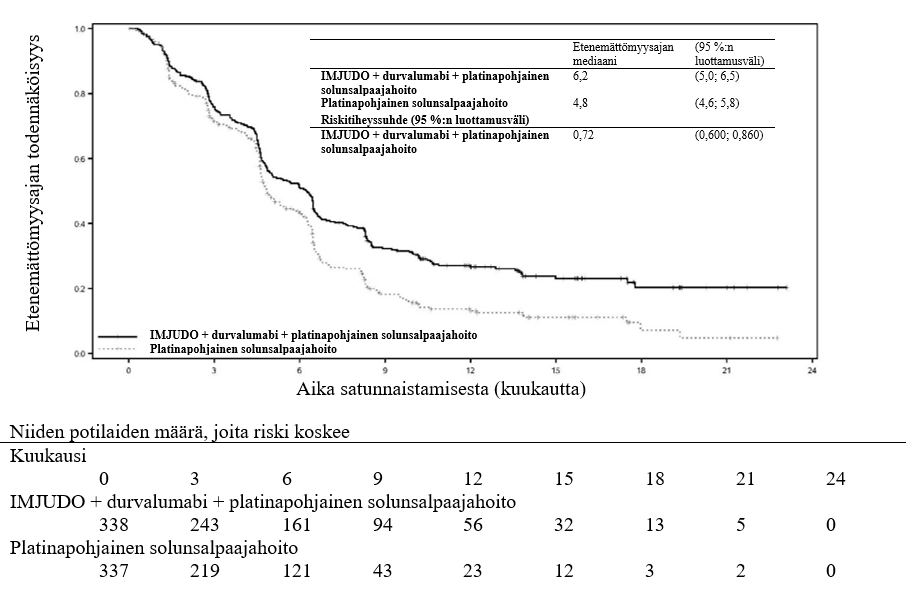
Kuvassa 4 on esitetty yhteenvedot tuloksista, jotka koskevat tehoa kokonaiselossaoloajan suhteen kasvaimen PD-L1:n ilmentymisen mukaan ennalta määritellyissä alaryhmäanalyyseissä.
Kuva 4. Kokonaiselinajan Forest plot ‑kuvaaja PD-L1:n ilmentymisen mukaan IMJUDO‑valmisteen, durvalumabin ja platinapohjaisen solunsalpaajahoidon yhdistelmää saaneilla verrattuna platinapohjaista solunsalpaajahoitoa saaneisiin
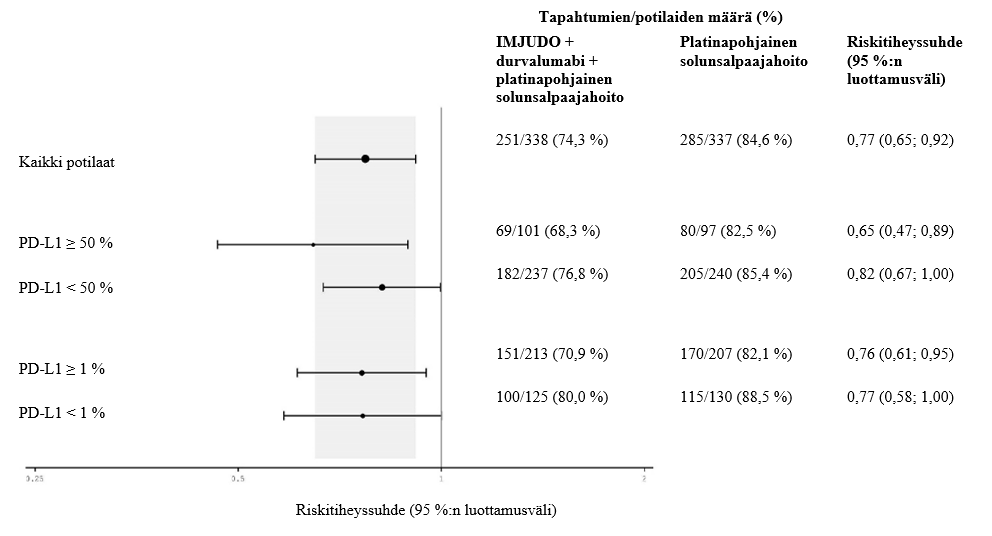
Iäkkäät potilaat
Yhteensä 75 potilasta, jotka olivat vähintään 75-vuotiaita, otettiin POSEIDON-tutkimuksen hoitohaaroihin, joissa tutkittavat saivat IMJUDOvalmistetta yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa (n = 35) tai pelkkää platinapohjaista solunsalpaajahoitoa (n = 40). Kokonaiselossaololle havaittu riskitiheyssuhde oli 1,05 (95 %:n luottamusväli: 0,64, 1,71) IMJUDOvalmistetta yhdistelmänä durvalumabin ja platinapohjaisen solunsalpaajahoidon kanssa saaneilla verrattuna platinapohjaiseen solunsalpaajahoitoon tässä tutkimuksen alaryhmässä. Koska tämä alaryhmäanalyysi oli luonteeltaan eksploratiivinen, lopullisia johtopäätöksiä ei voida tehdä. Varovaisuutta kuitenkin suositellaan noudatettavan, kun tätä hoito-ohjelmaa harkitaan iäkkäille potilaille.
Pediatriset potilaat
IMJUDO-valmisteen turvallisuutta ja tehoa yhdistelmänä durvalumabin kanssa lasten ja alle 18 vuoden ikäisten nuorten hoidossa ei ole varmistettu. D419EC00001-tutkimus oli avoin monikeskustutkimus, johon sisältyi annosmääritysvaihe ja tutkimuksen laajentamisvaihe. Tutkimuksessa arvioitiin IMJUDO-valmisteen turvallisuutta, alustavaa tehoa ja farmakokinetiikkaa, kun pediatrisille potilaille annettiin ensin IMJUDO-valmistetta yhdistelmänä durvalumabin kanssa ja sen jälkeen durvalumabia monoterapiana. Potilailla oli pitkälle edenneitä pahanlaatuisia kiinteitä kasvaimia (ei kuitenkaan primaarisia keskushermostokasvaimia), heidän tautinsa oli edennyt, eikä heille ollut olemassa tavanomaista hoitoa. Tutkimukseen otettiin mukaan 50 pediatrista potilasta, jotka olivat iältään 1–17-vuotiaita ja joiden primaarikasvain oli jokin seuraavista: neuroblastooma, kiinteä kasvain tai sarkooma. Potilaat saivat IMJUDO-valmistetta annoksella 1 mg/kg yhdistelmänä durvalumabin (joko 20 mg/kg tai 30 mg/kg) kanssa 4 viikon välein 4 hoitosyklin ajan ja sen jälkeen durvalumabia monoterapiana 4 viikon välein. Annosmääritysvaiheessa annettiin yksi hoitosykli durvalumabia ennen IMJUDO-valmisteella ja durvalumabilla toteutettua yhdistelmähoitoa; tämän vaiheen aikana 8 potilasta kuitenkin lopetti hoidon ennen kuin he saivat IMJUDO-valmistetta. Näin ollen tutkimukseen otetuista 50 potilaasta 42 sai IMJUDO-hoitoa yhdistelmänä durvalumabin kanssa ja 8 sai pelkkää durvalumabia. Vasteen suhteen arvioitavissa olevassa analyysipopulaatiossa tutkimuksen laajentamisvaiheen aikana ilmoitettu objektiivinen vasteprosentti oli 5,0 % (1 potilas 20:stä). Uusia turvallisuussignaaleja verrattuna IMJUDO-valmisteen ja durvalumabin tunnettuihin turvallisuusprofiileihin aikuisilla ei havaittu. Ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa.
Farmakokinetiikka
Tremelimumabin farmakokinetiikkaa arvioitiin monoterapiana, yhdistelmänä durvalumabin kanssa ja yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa.
Tremelimumabin farmakokinetiikkaa tutkittiin potilailla joko annoksilla, jotka olivat 75–750 mg tai 10 mg/kg ja jotka annettiin laskimoon 4 tai 12 viikon välein monoterapiana, tai 300 mg:n kerta-annoksella. Farmakokineettinen altistus suureni suhteessa annokseen (lineaarinen farmakokinetiikka) ≥ 75 mg:n annoksilla. Vakaa tila saavutettiin noin 12 viikon kohdalla. Populaatiofarmakokineettisessä analyysissä oli mukana potilaita (n = 1 605), jotka saivat tremelimumabia monoterapiana tai yhdistelmänä muiden lääkevalmisteiden kanssa ja joilla annostus oli ≥ 75 mg (tai 1 mg/kg) 3 tai 4 viikon välein. Tremelimumabin arvioitu puhdistuma (CL) oli 0,309 l/vrk ja jakautumistilavuus (Vd) 6,33 l. Terminaalinen puoliintumisaika oli noin 14,2 vuorokautta. Tremelimumabin pääasialliset eliminaatioreitit ovat proteiinin hajotus retikuloendoteliaalijärjestelmän kautta ja kohdevälitteinen jakautuminen.
Erityisryhmät
Ikä (18–87 vuotta), kehon paino (34–149 kg), sukupuoli, positiivinen lääkevasta-ainestatus (ADA-status), albumiiniarvot, LD‑arvot, kreatiniiniarvot, kasvaintyyppi, etninen tausta tai ECOG/WHO-suorituskykyluokka eivät vaikuttaneet kliinisesti merkittävästi tremelimumabin farmakokinetiikkaan.
Munuaisten vajaatoiminta
Lievällä munuaisten vajaatoiminnalla (kreatiniinipuhdistuma 60–89 ml/min) tai kohtalaisella munuaisten vajaatoiminnalla (kreatiniinipuhdistuma 30–59 ml/min) ei ollut kliinisesti merkittäviä vaikutuksia tremelimumabin farmakokinetiikkaan. Vaikean munuaisten vajaatoiminnan (kreatiniinipuhdistuma 15–29 ml/min) vaikutuksia tremelimumabin farmakokinetiikkaan ei tiedetä. Mahdollista annoksen muuttamisen tarvetta ei voida määrittää. Monoklonaaliset IgG-vasta-aineet eivät kuitenkaan ensisijaisesti poistu munuaisten kautta, joten munuaisten toiminnan muutosten ei odoteta vaikuttavan tremelimumabialtistukseen.
Maksan vajaatoiminta
Lievällä maksan vajaatoiminnalla (bilirubiini enintään viitealueen ylärajalla ja ASAT viitealueen ylärajan yläpuolella tai bilirubiini > 1,0 – 1,5 kertaa viitealueen yläraja ja ASAT-arvo mikä tahansa) ja kohtalaisella maksan vajaatoiminnalla (bilirubiini > 1,5 – 3 kertaa viitealueen yläraja ja ASAT-arvo mikä tahansa) ei ollut kliinisesti merkittäviä vaikutuksia tremelimumabin farmakokinetiikkaan. Vaikean maksan vajaatoiminnan (bilirubiini > 3,0 kertaa viitealueen yläraja ja ASAT-arvo mikä tahansa) vaikutuksia tremelimumabin farmakokinetiikkaan ei tiedetä. Mahdollista annoksen muuttamisen tarvetta ei voida määrittää. Monoklonaaliset IgG-vasta-aineet eivät kuitenkaan poistu ensisijaisesti maksan kautta, joten maksan toiminnan muutosten ei odoteta vaikuttavan tremelimumabialtistukseen.
Pediatriset potilaat
Tremelimumabin farmakokinetiikkaa yhdistelmänä durvalumabin kanssa arvioitiin D419EC00001-tutkimuksessa 50 pediatrisella potilaalla, jotka olivat 1–17-vuotiaita. Potilaat saivat tremelimumabia 1 mg/kg:n annoksella yhdistelmänä durvalumabin (joko 20 mg/kg tai 30 mg/kg) kanssa 4 viikon välein 4 hoitosyklin ajan ja sen jälkeen durvalumabia monoterapiana 4 viikon välein. Populaatiofarmakokineettisen analyysin perusteella systeeminen altistus tremelimumabille ≥ 35 kg painavilla pediatrisilla potilailla, jotka saivat tremelimumabia 1 mg/kg 4 viikon välein, oli samanlainen kuin altistus aikuisilla, jotka saivat 1 mg/kg 4 viikon välein, kun taas < 35 kg painavilla pediatrisilla potilailla altistus oli pienempi kuin aikuisilla.
Prekliiniset tiedot turvallisuudesta
Toksikologia koe-eläimillä
Jaavanmakakeilla tehdyssä pitkäkestoisessa 6 kuukauden pituisessa tutkimuksessa tremelimumabin käytön yhteydessä ilmeni pitkittynyttä ripulia ja ihottumaa, rupia ja avoimia haavaumia, joiden ilmaantuvuus oli yhteydessä annokseen ja jotka olivat annosta rajoittavia. Näihin kliinisiin merkkeihin liittyi myös ruokahalun heikkenemistä, painonlaskua ja perifeeristen imusolmukkeiden turvotusta. Näiden kliinisten merkkien kanssa korreloivia histopatologisia löydöksiä olivat umpisuolen ja paksusuolen korjaantuva krooninen tulehdus, mononukleaaristen solujen infiltraatio ihokudoksessa sekä imukudoksen hyperplasia.
Mononukleaaristen solujen infiltraation ilmaantuvuuden ja vaikeusasteen annosriippuvaista suurenemista todettiin sylkirauhasessa, haimassa (rauhasrakkulasoluissa), kilpirauhasessa, lisäkilpirauhasessa, lisämunuaisissa, sydämessä, ruokatorvessa, kielessä, maksan periportaalialueella, luustolihaksissa, eturauhasessa, kohdussa, aivolisäkkeessä, silmissä (sidekalvolla, silmänulkoisissa lihaksissa) sekä aivokammioiden suonipunoksessa. Infiltraatioon liittyi joissakin tapauksissa mononukleaarinen tulehdus. Tässä tutkimuksessa ei löydetty NOAEL-arvoa (suurin annos, joka ei aiheuta haittavaikutuksia), kun pienin eläimille annettu annos oli 5 mg/kg/viikko. Suurimman annoksen, joka ei aiheuttanut vaikeaa toksisuutta (highest non-severely toxic dose, HNSTD), katsottiin olevan 15 mg/kg/viikko (keskisuuri annos). Tästä annoksesta laskettu altistukseen perustuva turvallisuusmarginaali on 1,77–5,33 kertaa kliinisesti merkittävä altistus, kun kliininen annostus on joko 300 mg kerta-annoksena tai 75 mg kolmen viikon välein.
Karsinogeenisuus ja mutageenisuus
Tremelimumabin karsinogeenisuutta ja genotoksisuutta ei ole arvioitu.
Lisääntymistoksisuus
Toistuvan altistuksen aiheuttamaa toksisuutta arvioineissa tutkimuksissa todettiin mononukleaaristen solujen infiltraatiota eturauhasessa ja kohdussa. Koska tremelimumabilla ei ole tehty hedelmällisyyttä koskevia eläinkokeita, näiden löydösten merkitystä hedelmällisyyden kannalta ei tiedetä. Lisääntymistutkimuksissa tremelimumabin antamiseen tiineille jaavanmakakeille organogeneesivaiheen aikana ei liittynyt emoon kohdistuvaa toksisuutta eikä se vaikuttanut alkio- ja sikiökuolemiin, sikiöiden painoihin, ulkoisiin, viskeraalisiin tai luuston poikkeavuuksiin eikä tiettyjen sikiön elinten painoihin.
Farmaseuttiset tiedot
Apuaineet
Histidiini
Histidiinihydrokloridimonohydraatti
Trehaloosidihydraatti
Dinatriumedetaattidihydraatti
Polysorbaatti 80
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
4 vuotta 2–8 °C:ssa.
Laimennettu liuos
Valmisteen kemiallinen ja fysikaalinen säilyvyys käytön aikana on osoitettu 28 päivään asti 2–8 °C:ssa ja 48 tuntiin asti huoneenlämmössä (korkeintaan 25 °C:ssa) valmistusajankohdasta laskien.
Valmistettu infuusioliuos on mikrobiologisista syistä käytettävä välittömästi. Jos sitä ei käytetä välittömästi, käytönaikaiset säilytysajat ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä ne yleensä saa ylittää 24:ää tuntia 2–8 °C:ssa tai 12:ta tuntia huoneenlämmössä (korkeintaan 25 °C:ssa), ellei laimennusta ole tehty valvotuissa, validoiduissa aseptisissa olosuhteissa.
Valmistetun infuusioliuoksen säilyvyys ilman mikrobikasvua on osoitettu 28 päivään asti 2–8 °C:ssa ja 48 tuntiin asti huoneenlämmössä (korkeintaan 25 °C:ssa) valmistusajankohdasta laskien.
Säilytys
Säilytä jääkaapissa (2–8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
IMJUDO infuusiokonsentraatti, liuosta varten
20 mg/ml (L:ei) 1,25 ml (25 mg) (1423,43 €), 15 ml (300 mg) (15503,10 €)
PF-selosteen tieto
IMJUDO-valmisteesta on saatavilla kaksi pakkauskokoa:
-
1,25 ml (yhteensä 25 mg tremelimumabia) konsentraattia tyypin I lasista valmistetussa injektiopullossa, jossa on elastomeeritulppa ja violetti irtinapsautettava alumiinisinetti. Pakkaus sisältää yhden kerta-antoon tarkoitetun injektiopullon.
- 15 ml (yhteensä 300 mg tremelimumabia) konsentraattia tyypin I lasista valmistetussa injektiopullossa, jossa on elastomeeritulppa ja tummansininen irtinapsautettava alumiinisinetti. Pakkaus sisältää yhden kerta-antoon tarkoitetun injektiopullon.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas tai hieman opaalinhohtoinen, väritön tai kellertävä liuos, jossa ei ole lainkaan tai käytännössä lainkaan näkyviä hiukkasia. Liuoksen pH on noin 5,5 ja osmolaliteetti noin 285 mOsm/kg.
Käyttö- ja käsittelyohjeet
Liuoksen valmistus
IMJUDO toimitetaan kerta-annosinjektiopullossa, joka ei sisällä säilöntäaineita. Aseptista tekniikkaa on noudatettava.
- Tarkista silmämääräisesti, ettei lääkevalmisteessa näy hiukkasia eikä värimuutoksia. IMJUDO on kirkas tai hieman opaalinhohtoinen, väritön tai kellertävä liuos. Hävitä injektiopullo, jos liuos on sameaa tai siinä näkyy värimuutoksia tai hiukkasia. Älä ravista injektiopulloa.
- Vedä IMJUDO-injektiopullo(i)sta tarvittava tilavuus ruiskuun ja siirrä se infuusiopussiin, jossa on natriumkloridi-injektioliuosta (9 mg/ml, 0,9 %) tai glukoosi-injektioliuosta (50 mg/ml, 5 %). Sekoita laimennettu liuos kääntelemällä varovasti. Laimennetun liuoksen lopullinen pitoisuus on 0,1–10 mg/ml. Älä anna liuoksen jäätyä äläkä ravista liuosta.
- Valmistetun liuoksen steriiliys on varmistettava huolellisesti.
- Injektiopullosta saa ottaa lääkevalmistetta vain kerran.
- Hävitä injektiopulloon jäänyt käyttämätön lääke.
Antaminen
- Anna infuusioliuos laskimoon 60 minuutin aikana käyttäen laskimolinjaa, jossa on steriili, niukasti proteiineja sitova 0,2 tai 0,22 mikronin kiinteä (in-line) suodatin.
- Älä anna muita lääkevalmisteita saman infuusiolinjan kautta.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
IMJUDO infuusiokonsentraatti, liuosta varten
20 mg/ml 1,25 ml, 15 ml
- Ei korvausta.
ATC-koodi
L01FX20
Valmisteyhteenvedon muuttamispäivämäärä
04.08.2025
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
