LOCAMETZ beredningssats för radioaktiva läkemedel 25 mikrog
Observera
▼Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Kvalitativ och kvantitativ sammansättning
Injektionsflaskan innehåller 25 mikrogram gozetotid.
Radionukliden ingår inte i beredningssatsen.
Hjälpämne med känd effekt
Injektionsflaskan innehåller 28,97 mg natrium.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Beredningssats för radioaktivt läkemedel.
Kliniska uppgifter
Terapeutiska indikationer
Endast avsett för diagnostik.
Efter radiomärkning med gallium-68 är Locametz avsett för detektion av prostataspecifika membranantigen (PSMA)- positiva lesioner med positronemissionstomografi (PET) hos vuxna med prostatacancer (PCa) i följande kliniska situationer:
- Stadieindelning av patienter med högrisk-PCa, före primär kurativ behandling.
- Misstänkt recidiv av PCa hos patienter med förhöjda nivåer av prostataspecifikt antigen (PSA) i serum efter primär kurativ behandling.
- Identifiering av patienter med PSMA-positiv progressiv metastaserad kastrationsresistent prostatacancer (mCRPC), för vilka PSMA-riktad behandling är indicerad (se avsnitt Varningar och försiktighet).
Villkor
Lääkevalmiste on tarkoitettu käytettäväksi vain sairaaloissa tai isotooppidiagnostiikkaan erikoistuneissa yksiköissä, jolloin sitä käsittelevät vain radiofarmaseuttisilla tuotteilla kuvantamiseen perehtyneet henkilöt.
Dosering och administreringssätt
Detta läkemedel får endast administreras av utbildad hälso- och sjukvårdspersonal med teknisk kunskap om användning och hantering av medel för nukleärmedicinsk avbildning och endast i lämpliga lokaler för detta.
Dosering
Rekommenderad dos av gallium(68Ga)gozetotid är 1,8‑2,2 MBq/kg kroppsvikt, med en minimidos på 111 MBq upp till en maximal dos på 259 MBq.
Särskilda populationer
Äldre
Dosen behöver inte justeras för patienter över 65 år,
Nedsatt njurfunktion
Det finns inga data med gallium(68Ga)gozetotid hos patienter med måttligt till gravt nedsatt njurfunktion eller njursvikt. Ingen dosjustering anses nödvändig för patienter med nedsatt njurfunktion (se avsnitt Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Ingen dosjustering krävs för patienter med nedsatt leverfunktion (se avsnitt Farmakokinetiska egenskaper).
Pediatrisk population
Det finns ingen relevant användning av Locametz för en pediatrisk population för identifiering av PSMA-positiva lesioner vid prostatacancer.
Administreringssätt
Detta läkemedel är avsett för intravenös användning och flerdosbruk. Det ska beredas och radiomärkas innan det administreras till patienten.
Efter beredning och radiomärkning ska lösningen med gallium(68Ga)gozetotid administreras genom långsam intravenös injektion. Lokal extravasering, som resulterar i oavsiktlig strålningsexponering för patienten och avbildningsartefakter bör undvikas. Injektionen ska följas av en intravenös spolning med steril natriumklorid 9 mg/ml (0,9%) injektionslösning för att säkerställa full tillförsel av dosen.
Den totala radioaktiviteten i sprutan ska verifieras med en doskalibrator omedelbart före och efter administrering till patienten. Doskalibratorn måste kalibreras och uppfylla kraven i internationella standarder. Instruktioner angående spädning av gallium(68Ga)gozetotidlösning bör följas (se avsnitt 12).
För förberedelser av patient, se avsnitt Varningar och försiktighet.
Anvisningar om beredning och radiomärkning av läkemedlet före administrering finns i avsnitt 12.
Avbildning
PET-avbildning med gallium(68Ga)gozetotid ska utföras genom skanning av hela kroppen med början vid mitten av låret och vidare till skallbasen. PET-bilder ska tas 50‑100 minuter efter intravenös administrering av lösningen med gallium(68Ga)gozetotid.
Avbildningens starttid och varaktighet ska anpassas till den utrustning som används, patienten och tumörens egenskaper för att uppnå bästa möjliga bildkvalitet.
Användning av datortomografi (DT) eller magnetisk resonanstomografi (MRT) för säkrare bedömning rekommenderas.
Kontraindikationer
Överkänslighet mot den aktiva substansen, mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller mot någon av komponenterna i det märkta radioaktiva läkemedlet.
Varningar och försiktighet
Individuell nytta-riskbedömning
För varje patient måste strålexponeringen kunna motiveras av den förväntade nyttan. Den tillförda radioaktiviteten ska i varje enskilt fall vara så låg som möjligt för att uppnå önskad diagnostisk information.
Hittills finns inga data som stöd för hur efterföljande behandling av patienter med högrisksjukdom där PSMA PET/CT använts för primär stadieindelning ska ges.
Erfarenhet av användning av gallium(68Ga)gozetotid PET-diagnostik för identifiering av patienter att få PSMA-baserad terapi är begränsad till patienter med progressiv metastaserad kastrationsresistent prostatacancer (mCRPC) som har behandlats med androgenreceptorhämmare (AR-hämmare) och taxanbaserad kemoterapi, samt för identifiering av patienter för behandling med lutetium(177Lu)vipivotidtetraxetan. Nytta-riskförhållandet kan inte överföras till andra typer av PSMA-baserad terapi och patienter med mCRPC som tidigare fått olika behandlingar.
Strålningsrisk
Gallium(68Ga)gozetotid bidrar till patientens totala långsiktiga kumulativa strålningsexponering, som är förenad med en ökad risk för cancer. Procedurer för säker hantering, beredning och radiomärkning ska upprättas för att skydda patienter och sjukvårdspersonal från oavsiktlig strålningsexponering (se avsnitt Särskilda anvisningar för destruktion och övrig hantering och 12)
Tolkning av bilder med gallium(68Ga)gozetotid
PET-bilder med gallium(68Ga)gozetotid bör tolkas genom visuell bedömning. Misstanke om maligna lesioner baseras på gallium (68Ga)gozetotidupptag i jämförelse med vävnadsbakgrund.
Upptag av gallium(68Ga)gozetotid är inte specifikt för prostatacancer och kan förekomma i normal vävnad (se avsnitt Farmakokinetiska egenskaper), vid andra typer av cancer och icke-maligna processer, vilket potentiellt kan leda till falskt positiva fynd. Måttligt till högt fysiologiskt PSMA-upptag noteras i njurarna, tårkörtlarna, levern, spottkörtlarna och urinblåsans vägg. Falskt positiva fynd inkluderar, men är inte begränsade till, njurcellscancer, hepatocellulärt karcinom, bröstcancer, lungcancer, benigna skelettsjukdomar (t.ex. Pagets sjukdom), pulmonell sarkoidos/granulomatos, gliom, meningiom, paragangliom och neurofibromer. Ganglier kan efterlikna lymfkörtlar.
Den diagnostiska prestandan hos gallium(68Ga)gozetotid kan påverkas av PSA-nivåerna i serum, androgenreceptorriktade behandlingar, sjukdomsstadium och storleken på maligna lymfkörtlar (se avsnitt Farmakodynamiska egenskaper).
Gallium(68Ga)gozetotid PET bilder bör granskas endast av radiologer som är utbildade i tolkning av PET-bilder med gallium(68Ga)gozetotid. Fynd från PET-avbildning med gallium(68Ga)gozetotid bör alltid tolkas tillsammans med och bekräftas med hjälp av andra diagnostiska metoder (inklusive histopatologi) innan någon efterföljande förändring i behandlingen av patienten påbörjas.
Förberedelse av patienten
Patienterna ska vara väl hydrerade före administrering av gallium(68Ga)gozetotid och ska uppmanas att tömma blåsan omedelbart före och ofta under de första timmarna efter avbildningen för att minska strålningsexponeringen.
Särskilda varningar
Natriuminnehåll
Detta läkemedel innehåller 28,97 mg natrium per injektion, motsvarande 1,5 % av WHOs högsta rekommenderat dagligt intag (2 g natrium för vuxna).
Lågt pH och extravasering
Lågt pH av gallium(68Ga)gozetotid kan leda till reaktioner på injektionsstället efter administrering. Oavsiktlig extravasering kan orsaka lokal irritation på grund av lösningens låga pH. Fall av extravasering bör hanteras i enlighet med klinikens riktlinjer.
Interaktioner
Baserat på interaktionsstudier in vitro förväntas inte gallium(68Ga)gozetotid interagera kliniskt signifikant med andra läkemedel (se avsnitt Farmakokinetiska egenskaper). Inga läkemedelsinteraktionsstudier har utförts.
Fertilitet, graviditet och amning
Graviditet
Locametz är inte avsett för kvinnor. Det finns inga data om användning av gallium(68Ga)gozetotid hos kvinnor. Inga reproduktionstoxikologiska djurstudier har utförts med gallium(68Ga)gozetotid. Alla radioaktiva läkemedel, inklusive gallium(68Ga)gozetotid, kan dock orsaka fosterskador.
Amning
Locametz är inte avsett för kvinnor. Det finns inga data om effekterna av gallium(68Ga)gozetotid på nyfödda barn/spädbarn som ammas eller på mjölkproduktionen. Inga laktationsstudier på djur har utförts med gallium(68Ga)gozetotid.
Fertilitet
Det finns inga data om effekterna av gallium(68Ga)gozetotid på fertiliteten hos människa.
Effekter på förmågan att framföra fordon och använda maskiner
Gallium(68Ga)gozetotid har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Exponering för joniserande strålning förknippas med framkallande av cancer och en potential för utveckling av ärftliga defekter. Eftersom den effektiva dosen är 0,0166 mSv/MBq, med en maximal rekommenderad dos på 259 MBq (4,3 mSv), förväntas sannolikheten för dessa biverkningar vara låg.
Lindriga till måttliga biverkningar förekom hos patienter som fick gallium(68Ga)gozetotid, med undantag av ett fall av fatigue av grad 3 (0,1 %).
De vanligaste biverkningarna är fatigue (1,2 %), illamående (0,8 %), förstoppning (0,5 %) och kräkningar (0,5 %).
Tabell över biverkningar
Säkerhetsprofilen för gallium(68Ga)gozetotid vid en mediandos per kroppsvikt på 1,9 MBq/kg (intervall: 0,9‑3,7 MBq/kg) utvärderades hos 1 003 patienter med metastaserande kastrationsresistent prostatacancer som fick bästa standardbehandling (Best Standard of Care) enligt läkarens bedömning (VISION-studien).
Biverkningarna (tabell 1) anges enligt MedDRAs organsystemklass. Inom varje organsystem rangordnas biverkningarna efter frekvens, med den oftast förekommande biverkningen först. Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad. Motsvarande frekvenskategori för varje biverkning baseras dessutom på följande princip (CIOMS III): mycket vanliga (≥ 1/10); vanliga (≥ 1/100, < 1/10); mindre vanliga (≥ 1/1 000, < 1/100); sällsynta (≥ 1/10 000, < 1/1 000); mycket sällsynta (< 1/10 000).
Tabell 1 Biverkningar observerade med gallium(68Ga)gozetotid
Organsystemklass | Frekvenskategori | Biverkning |
Magtarmkanalen | Mindre vanliga | Illamående |
Mindre vanliga | Förstoppning | |
Mindre vanliga | Kräkning | |
Mindre vanliga | Diarré | |
Mindre vanliga | Muntorrhet | |
Allmänna symtom och/eller symtom vid administreringsstället | Vanliga | Fatigue |
Mindre vanliga | Reaktioner vid injektionsstället1 | |
Mindre vanliga | Frossa | |
1 Reaktioner vid injektionsstället omfattar: hematom vid injektionsstället, värmekänsla vid injektionsstället, klåda vid injektionsstället | ||
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-/riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
I händelse av överdosering av strålning med gallium(68Ga)gozetotid ska den absorberade stråldosen till patienten om möjligt reduceras genom att elimineringen av radionukliden från kroppen ökas med hydrering och frekvent tömning av urinblåsan. Det kan vara till hjälp att uppskatta den effektiva stråldos som tillfördes.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Diagnostiska radiofarmaka, övriga radiofarmaceutiska diagnostika för tumördetektion, ATC-kod: V09IX14
Verkningsmekanism
Gallium(68Ga)gozetotid binder till celler som uttrycker PSMA, inklusive maligna prostatacancerceller, som överuttrycker PSMA. Gallium-68 är en radionuklid med en emission som möjliggör PET-avbildning. Baserat på signalernas intensitet påvisar PET-bilder som erhållits med gallium(68Ga)gozetotid förekomst av PSMA-protein i vävnader.
Farmakodynamisk effekt
Vid de kemiska koncentrationer som används för diagnostiska undersökningar har gallium(68Ga)gozetotid ingen farmakodynamisk aktivitet.
Klinisk effekt och säkerhet
Sensitiviteten och specificiteten av gallium(68Ga)gozetotid utvärderades i de två följande prospektiva studierna:
I van Kalmthout et al, 2020, genomgick 103 vuxna manliga patienter med biopsibekräftad mellan- och högrisk-prostatacancer med indikation att genomgå utökad bäckenlymfkörteldissektion (ePLND), PET/CT-undersökning med gallium (68Ga) gozetotid. PET/CT-avbildningarna tolkades av två oberoende blindade granskare och ePLND var histopatologisk referensstandard för 96 av 103 (93 %) patienter. Patientbaserad sensitivitet, specificitet, positivt och negativt prediktivt värde (PPV respektive NPV) för gallium (68Ga) gozetotid PET/CT-avbildningar för att detektera lymfkörtelmetastaser (LNM) sammanfattas i tabell 2.
Tabell 2 Effektresultat i primära stadiet för patienter med biopsibekräftad prostatacancer
Patientbaserad N=961 | |
Sensitivitet (95% KI) | 42% (27, 58) |
Specificitet (95 % KI) | 91% (79, 97) |
PPV | 77% (54, 91) |
NPV | 68% (56, 78) |
1 Bedömningsbar population | |
Överensstämmelsen mellan de 2 oberoende blindade granskarna var κ = 0,67. Av de 67 analyserade LNM detekterades 26 av gallium(68Ga)gozetotid PET/CT, vilket resulterade i 38,8 % nodbaserad känslighet. Metastasernas mediandiameter i dessa detekterade LNM var 7 mm (intervall: 0,3-35). PET-granskningen missade 41 LMN med en metastasmediandiameter på 3 mm (intervall: 0,5‑35).
I Fendler et al, 2019 genomgick 635 vuxna manliga patienter med histopatologiskt bevisad och biokemiskt recidiverande (BCR) prostatacancer efter prostatektomi (N=262), strålbehandling (N=169) eller båda (N=204) PET/DT-undersökning med gallium(68Ga)gozetotid eller PET/MR-undersökning. BCR definierades med PSA i serum på ≥ 0,2 ng/ml mer än 6 veckor efter prostatektomi eller med en ökning av PSA i serum på minst 2 ng/ml över nadir efter definitiv strålbehandling. Patienterna hade en median-PSA-nivå på 2,1 ng/ml över nadir efter strålbehandling (intervall: 0,1‑1 154 ng/ml). En sammansatt referensstandard, inklusive histopatologi, seriella PSA-nivåer i serum och avbildningsresultat (DT, MR och/eller skelettskintigrafi) fanns tillgänglig för 223 av 635 (35,1 %) patienter, medan enbart en histopatologireferensstandard fanns tillgänglig för 93 (14,6 %) patienter. PET/DT-undersökningarna avlästes av 3 oberoende granskare som var blindade för annan klinisk information än typen av primärbehandling och den senaste PSA-nivån i serum.
PSMA-positiva lesioner detekterades hos 475 av 635 (75 %) patienter som fick gallium(68Ga)gozetotid och detektionsfrekvensen var signifikant högre med PSA-nivåer. Detektionsfrekvensen för PET-positiva lesioner med gallium(68Ga)gozetotid ökade med stigande PSA-nivåer i serum (se avsnitt Varningar och försiktighet). Sensitivitet och positivt prediktivt värde (PPV) för PET/DT-avbildning med gallium(68Ga)gozetotid sammanfattas i tabell 3. Fleiss kappa (κ) för interindividuell variabilitet mellan granskare vad gäller PET/DT-avbildning med gallium(68Ga) gozetotid varierade från 0,65 (95 % KI: 0,61; 0,70) till 0,78 (95 % KI: 0,73; 0,82) för de bedömda områdena (prostatabädd, bäckenkörtlar, mjukvävnad och skelett utanför bäckenet).
Tabell 3 Effektresultat för patienter med histopatologiskt bevisad och BCR-prostatacancer
Sammansattreferensstandard N=2231 | Histopatologi-referensstandard N=931 | |
Sensitivitet per patient (95 % KI) | Ej relevant | 92 % (84; 96) |
Sensitivitet per region (95 % KI) | Ej relevant | 90 % (82; 95) |
PPV per patient (95 % KI) | 92 % (88; 95) | 84 % (75; 90) |
PPV per region (95 % KI) | 92 % (88; 95) | 84 % (76; 91) |
1 Bedömningsbar population | ||
PET/DT-avbildning med gallium(68Ga)gozetotid användes för att identifiera vuxna patienter med progressiv, PSMA-positiv mCRPC-cancer i den randomiserade, multicenter, öppna fas III-studien VISION, som testade effekten av Pluvicto plus standardbehandling mot standardbehandling ensamt. Totalt 1 003 manliga patienter, som hade behandlats med minst en androgenreceptor (AR)-hämmare och 1 eller 2 tidigare taxanbaserade kemoterapiregimer, valdes ut baserat på PSMA-uttrycket av deras prostatacancerlesioner. Patienterna genomgick en gallium(68Ga)gozetotid PET/CT-skanning för att utvärdera PSMA-uttryck i lesioner definierade av centrala avläsningskriterier. Förbättrad total överlevnad och radiografisk progressionsfri överlevnad rapporterades i den PSMA-riktade terapiarmen.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Locametz för alla grupper av den pediatriska populationen för visualisering av PSMA vid prostatacancer (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Distribution
Gallium(68Ga)gozetotid uppvisar ett biexponentiellt beteende i blodet, med en biologisk halveringstid på 6,5 minuter för den snabba komponenten och en terminal halveringstid på 4,4 timmar för den långsammare komponenten. Baserat på in vitro-data distribueras gozetotid huvudsakligen till plasma, med en genomsnittlig blod‑plasmakvot på 0,71. Gozetotid binds till 33 % till humana plasmaproteiner.
Organupptag
Den högsta absorberade stråldosen av gallium(68Ga)gozetotid påvisades i njurarna, tårkörtlarna, spottkörtlarna, urinblåseväggen och levern.
De beräknade absorberade stråldoserna till dessa organ med en administrerad aktivitet på 259 MBq är 62.1 mGy (njurar), 28,5 mGy (tårkörtlar), 23,1 mGy (spottkörtlar), 14,8 mGy (urinblåsevägg) och 13,7 mGy (lever).
Metabolism
Baserat på in vitro-data genomgår gallium(68Ga)gozetotid försumbar metabolism i lever och njurar.
Eliminering
Gallium(68Ga)gozetotid elimineras huvudsakligen via njurarna. Ungefär 14 % av den administrerade dosen av gallium(68Ga)gozetotid utsöndras i urinen 2 timmar efter injektionen.
Halveringstid
Baserat på gallium(68Ga)gozetotids biologiska och terminala halveringstid på 4,4 timmar och den fysiska halveringstiden på 68 minuter för gallium-68, är den resulterande effektiva halveringstiden för gallium(68Ga)gozetotid 54 minuter.
Risk för läkemedelsinteraktion in vitro
CYP450-enzymer
Gozetotid är inte substrat för eller hämmare eller inducerare av cytokrom P450-enzymer (CYP450). Gallium(68Ga)gozetotid förväntas inte ha några läkemedelsinteraktioner med CYP450-substrat, ‑hämmare eller ‑inducerare.
Transportörer
Gozetotid är inte ett substrat för BCRP, P-gp, MATE1, MATE2-K, OAT1, OAT3 eller OCT2. Gozetotid är inte en hämmare av BCRP, BSEP, P-gp, MATE1, MATE2-K, OAT1, OAT3, OATP1B1, OATP1B3, OCT1 eller OCT2. Gallium(68Ga)gozetotid förväntas inte ha några läkemedelsinteraktioner med substraten för dessa transportörer.
Särskilda populationer
Äldre
I den kliniska studien VISION var 752 av 1 003 (75 %) patienter 65 år eller äldre. Inga generella skillnader i säkerhet och effekt noterades mellan dessa patienter och yngre patienter.
Nedsatt njur-/leverfunktion
Farmakokinetiken och biodistributionen för gallium(68Ga)gozetotid förväntas inte påverkas i någon kliniskt relevant utsträckning av nedsatt njur-/leverfunktion.
Prekliniska säkerhetsuppgifter
Gozetotid utvärderades i studier av säkerhetsfarmakologi och endostoxicitet. Gängse studier avseende säkerhetsfarmakologi och endostoxicitet visade inte några särskilda risker för människa.
Karcinogenitet och mutagenitet
Inga studier av mutagenitet och karcinogenitet har utförts med gallium(68Ga)gozetotid.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Gentisinsyra
Natriumacetattrihydrat
Natriumklorid
Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt Särskilda anvisningar för destruktion och övrig hantering och 12.
Hållbarhet
Oöppnad injektionsflaska: 1 år.
Efter beredning och radiomärkning har kemisk och fysikalisk stabilitet visats under 6 timmar vid 30°C (se avsnitt Särskilda förvaringsanvisningar). Förvaras upprättstående.
Om man inte kan utesluta risk för mikrobiell kontaminering vid öppning av flaska, beredning, radiomärkning eller spädning, bör produkten ur mikrobiologisk synvinkel användas omedelbart.
Om den inte används omedelbart är förvaringstider och förvaringsförhållanden användarens ansvar.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C före beredning.
Förvaringsanvisningar för läkemedlet efter beredning och radiomärkning finns i avsnitt Hållbarhet.
Radioaktiva läkemedel ska förvaras i enlighet med nationella bestämmelser för radioaktivt material.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
LOCAMETZ valmisteyhdistelmä radioaktiivista lääkettä varten
25 mikrog (L:ei) 1 kpl (-)
PF-selosteen tieto
Locametz levereras som en flerdossats för beredning av radioaktivt gallium(68Ga)gozetotid injektionsvätska, lösning (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING och 3). Locametz innehåller en 10 ml injektionsflaska av typ I Plus-glas med gummipropp och snäpplock.
Läkemedlets utseende:
En injektionsflaska med vitt frystorkat pulver (pulver till injektionsvätska, lösning).
Särskilda anvisningar för destruktion och övrig hantering
Allmän varning
Radioaktiva läkemedel ska endast tas emot, användas och administreras av behöriga personer i en för ändamålet avsedd klinisk miljö. Mottagande, förvaring, användning, överföring och destruktion av dessa läkemedel omfattas av regler och/eller tillstånd utfärdade av lokala behöriga myndigheter.
Radioaktiva läkemedel ska beredas på ett sätt som uppfyller såväl strålskyddskrav som farmaceutiska kvalitetskrav. Lämpliga aseptiska försiktighetsåtgärder ska vidtas.
Innehållet i injektionsflaskan är endast avsett att användas för beredning av gallium(68Ga)gozetotid injektionsvätska, lösning, och ska inte administreras direkt till patienten utan att först ha genomgått den förberedande proceduren (se avsnitt Dosering och administreringssätt och 12).
Försiktighetsåtgärder före hantering eller administrering av läkemedlet
Före beredning är innehållet i Locametz inte radioaktivt. Efter beredning och radiomärkning måste effektivt strålningsskydd upprätthållas av gallium(68Ga)gozetotid injektionsvätska, lösning, upprätthållas (se avsnitt 3).
Efter beredning och radiomärkning innehåller Locametz en steril injektionsvätska, lösning, av gallium(68Ga)gozetotid med en aktivitet på upp till 1 369 MBq. Gallium(68Ga)gozetotid injektionsvätska, lösning, innehåller även saltsyra från gallium-68-kloridlösningen.
Gallium(68Ga)gozetotid injektionsvätska, lösning, är en steril, klar och färglös lösning för intravenös administrering, utan oupplöst material och med ett pH-värde på mellan 3,2 och 6,5.
Lämpliga aseptiska försiktighetsåtgärder ska vidtas när gallium(68Ga)gozetotid injektionsvätska, lösning, dras upp och administreras.
Administrering ska utföras på ett sätt som minimerar risken för kontaminering av läkemedlet och strålningsexponering för användarna. Effektivt strålningsskydd är obligatorisk.
Läkemedlet ska inte användas om injektionsflaskan vid något tillfälle under beredning kan ha skadats.
Anvisningar om beredning och radiomärkning av läkemedlet före administrering finns i avsnitt 12.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
LOCAMETZ valmisteyhdistelmä radioaktiivista lääkettä varten
25 mikrog 1 kpl
- Ei korvausta.
Atc-kod
V09IX14
Datum för översyn av produktresumén
31.03.2025
Absorberad dos och effektiv dos
Gallium-68 framställs med hjälp av en germanium-68/gallium-68(68Ge/68Ga)-generator och sönderfaller med en halveringstid på 68 minuter till stabilt zink-68. Gallium-68 sönderfaller enligt följande:
- 89 % genom positronemission med en genomsnittlig energi på 836 keV, följt av fotonisk annihilationsstrålning på 511 keV (178 %)
- 10 % genom elektroninfångning (röntgen eller Augeremission) och
- 3 % genom 13 gammaövergångar från 5 exciterade nivåer.
Den effektiva stråldosen av gallium(68Ga)gozetotid är 0,022 mSv/MBq, vilket ger en ungefärlig effektiv stråldos på 5,70 mSv vid en administrerad maximal aktivitet på 259 MBq.
Genomsnittliga absorberade stråldoser för organ och vävnader hos vuxna patienter (N=6) efter intravenös injektion av gallium(68Ga)gozetotid inklusive observerade intervall beräknades av Sandgren et al, 2019, med hjälp av ICRP/ICRU voxel phantom med mjukvaran IDAC-Dose 2.1. Genomsnittliga absorberade stråldoser av gallium(68Ga) gozetotid visas i tabell 4.
Tabell 4 Beräknade genomsnittliga absorberade stråldoser av gallium(68Ga)gozetotid
Absorberad stråldos (mGy/MBq)1 N=6 | ||
Organ | Median (mGy/MBq) | Intervall (mGy/MBq) |
Binjurarna | 0.048 | 0.0405 – 0.0548 |
Hjärna | 0.008 | 0.0065 – 0.0079 |
Bröst | 0.008 | 0.0077 – 0.0087 |
Endosteum (benyta)* | 0.011 | 0.0095 – 0.0110 |
Ögonslinser* | 0.0051 | 0.0047 – 0.0054 |
Gallblåsans vägg | 0.027 | 0.0212 – 0.0343 |
Hjärtväggen | 0.026 | 0.0236 – 0.0317 |
Njurar* | 0.240 | 0.2000 – 0.2800 |
Tårkörtlar* | 0.110 | 0.0430 – 0.2000 |
Tjocktarmsvägg, vänster** | 0.014 | 0.0120 – 0.0140 |
Lever* | 0.053 | 0.0380 – 0.0710 |
Lungor* | 0.016 | 0.0130 – 0.0170 |
Muskler | 0.0083 | 0.0073 – 0.0086 |
Esofagus* | 0.014 | 0.0110 – 0.0150 |
Pankreas | 0.019 | 0.0173 – 0.0209 |
Tjocktarmsvägg, sigmoideum-rektum | 0.013 | 0.0108 – 0.0149 |
Röda (aktiva) benmärgen* | 0.015 | 0.0140 – 0.0150 |
Tjocktarmsvägg, höger** | 0.014 | 0.0120 – 0.0140 |
Spottkörtlar* | 0.089 | 0.0740 – 0.1500 |
Hud* | 0.007 | 0.0059 – 0.0069 |
Tunntarmsvägg | 0.014 | 0.0129 – 0.0149 |
Mjälte* | 0.046 | 0.0300 – 0.1000 |
Magsäcksvägg* | 0.015 | 0.0150 – 0.0170 |
Testiklar* | 0.009 | 0.0074 – 0.0089 |
Tymus | 0.0081 | 0.0072 – 0.0085 |
Sköldkörtel* | 0.010 | 0.0090 – 0.0100 |
Urinblåsans vägg* | 0.057 | 0.0280 – 0.0840 |
Effektiv dos (mSv/MBq)*2 | 0.022 | 0.0204 – 0.0242 |
* enligt Sandgren et al, 2019; alla andra organ uppskattas utifrån de tidsintegrerade aktivitetskoefficienterna för källorganen som publiceras i artikeln. ** rapporterad i Sandgren som ett enda värde märkt ”Tjocktarm”. 1 doserna var beräknande med hjälp av mjukvaran IDAC‑dose 2.1. 2 beräknad enligtICRP:s publikation 103. | ||
Instruktion ör beredning av radiofarmaka
Beredningsmetod
Steg 1: Beredning och radiomärkning
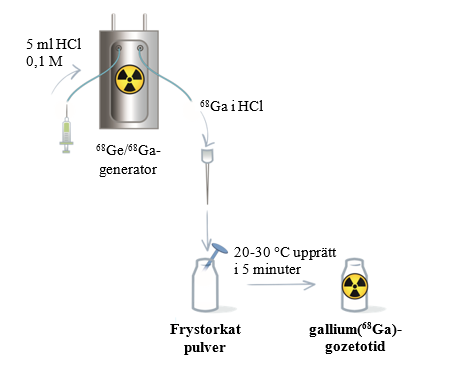
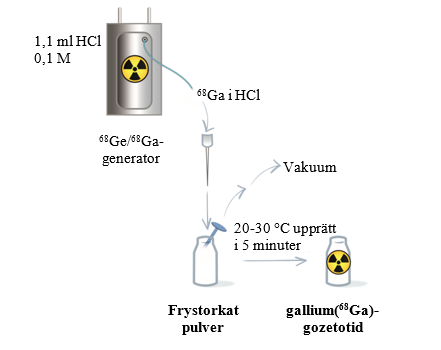
Med Locametz kan gallium(68Ga)gozetotid injektionsvätska, lösning, beredas direkt med eluatet från en av följande generatorer (se nedan för specifika anvisningar för varje generator):
- Generatorn Eckert & Ziegler GalliaPharm germanium-68/gallium-68 (68Ge/68Ga)
- Generatorn IRE ELiT Galli Ad germanium‑68/gallium‑68 (68Ge/68Ga)
Bruksanvisningen från tillverkaren av germanium-68/gallium-68-generatorn ska också följas.
Gallium(68Ga)gozetotid injektionsvätska, lösning, ska beredas enligt följande aseptiska procedur:
- Snäpp av locket från injektionsflaskan med Locametz och torka membranet med lämpligt antiseptiskt medel. Låt sedan membranet torka.
- Stick hål på membranet på injektionsflaskan med Locametz med en steril nål ansluten till ett 0,2 mikron sterilt luftfilter för att upprätthålla atmosfäriskt tryck inuti injektionsflaskan under beredningsprocessen. Placera injektionsflaskan med Locametz i en blyskyddsbehållare.
Följ de generatorspecifika anvisningarna för beredning och radiomärkning som visas i tabell 5 och i figur 1 och 2. Fortsätt sedan med steg 2.
Tabell 5 Beredning och radiomärkning med generatorerna Eckert & Ziegler GalliaPharm och IRE ELiT Galli Ad
Om generatorn Eckert & Ziegler GalliaPharm används | Om generatorn IRE ELiT Galli Ad används |
| |
Utför elueringen manuellt eller med hjälp av en pump enligt generatorns bruksanvisning. | Anslut injektionsflaskan med Locametz via luftningsnålen med 0,2 mikron sterilt luftfilter till en vakuumflaska (minsta volym 25 ml) med hjälp av en steril nål (storlek 21G‑23G) eller till en pump för att starta elueringen. |
Bered det frystorkade pulvret med 5 ml eluat. | Bered det frystorkade pulvret med 1,1 ml eluat. |
Koppla bort injektionsflaskan med Locametz från generatorn när elueringen har slutförts genom att ta bort elueringsnålen och luftningsnålen med sterilt 0,2 mikron luftfilter från gummimembranet. Vänd sedan injektionsflaskan med Locametz en gång och placera den upprätt. | När elueringen har slutförts ska du först dra ut den sterila nålen från vakuumflaskan eller koppla bort vakuumpumpen för att skapa atmosfäriskt tryck i injektionsflaskan med Locametz. Koppla sedan bort injektionsflaskan från generatorn genom att ta bort både elueringsnålen och luftningsnålen med sterilt 0,2 mikron luftfilter från gummimembranet. |
Figur 1 Procedur för beredning och radiomärkning för generatorn Eckert & Ziegler GalliaPharm
Figur 2 Procedur för beredning och radiomärkning för generatorn IRE ELiT Galli Ad
Steg 2: Inkubation
- Inkubera injektionsflaskan med Locametz upprättstående i rumstemperatur (20‑30 °C) i minst 5 minuter utan skakning eller omrörning.
- Analysera injektionsflaskan med gallium(68Ga)gozetotid injektionsvätska, lösning, med en doskalibrator efter 5 minuter för att fastställa den totala koncentrationen av radioaktivitet och notera resultatet.
- Utför kvalitetskontroller enligt de rekommenderade metoderna för att kontrollera att specifikationerna uppfylls (se steg 3).
- Förvara injektionsflaskan med Locametz innehållande gallium(68Ga)gozetotid injektionsvätska, lösning, upprättstående i en blyskyddsbehållare vid högst 30 °C tills den ska användas.
- Efter att gallium-68-klorid har tillsatts till injektionsflaskan med Locametz ska gallium(68Ga)gozetotid injektionsvätska, lösning, användas inom 6 timmar.
Steg 3: Specifikationer och kvalitetskontroll
Utför kvalitetskontrollerna i tabell 6 bakom ett blyglasskydd för att skydda mot radioaktivitet.
Tabell 6 Specifikationer för gallium(68Ga)gozetotid injektionsvätska, lösning
Test | Acceptanskriterier | Metod |
Utseende | Klar, färglös och utan oupplöst material | Visuell kontroll |
pH | 3,2‑6,5 | pH-indikatorremsor |
Märkningseffektivitet | Icke-komplexa typer av gallium-68 ≤ 3 % | Omedelbar tunnskiktskromatografi (ITLC, se ytterligare information nedan) |
Fastställ märkningseffektiviteten för gallium(68Ga)gozetotid injektionsvätska, lösning, genom att utföra omedelbar tunnskiktskromatografi (ITLC).
Utför ITLC med ITLC SG-remsor och ammoniumacetat 1M: Metanol (1:1 v/v) som mobil fas.
ITLC-metod
a. Låt ITLC SG-remsan framkallas för ett avstånd på 6 cm från appliceringspunkten (dvs. 7 cm från nederdelen av ITLC-remsan).
b. Skanna ITLC SG-remsan med en radiometrisk ITLC-skanner.
c. Beräkna märkningseffektiviteten genom att integrera toppvärdena på kromatogrammet. Använd inte den beredda och radiomärkta produkten om procentandelen (%) icke-komplexa typer av gallium-68 är högre än 3 %.
Specifikationerna för retentionsfaktorn (Rf) är följande:
- Icke-komplexa typer av gallium-68, Rf = 0 till 0,2;
- Gallium(68Ga)gozetotid, Rf = 0,8 till 1
Steg 4: Administrering
a. Aseptisk teknik och strålningsskydd ska användas när gallium(68Ga)gozetotid injektionsvätska, lösning, dras upp och administreras (se avsnitt Dosering och administreringssätt och Särskilda anvisningar för destruktion och övrig hantering).
b. Före användning ska beredd gallium(68Ga)gozetotid injektionsvätska, lösning, inspekteras visuellt bakom ett blyglasskydd för att skydda mot radioaktivitet. Endast lösningar som är klara, färglösa och utan oupplöst material ska användas (se avsnitt Dosering och administreringssätt och Särskilda anvisningar för destruktion och övrig hantering).
c. Efter beredning och radiomärkning kan gallium(68Ga)gozetotid injektionsvätska, lösning, spädas med vatten för injektionsvätskor eller natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning, upp till en slutlig volym på 10 ml. För IRE ELiT Galli Ad-generatorn krävs utspädning till en minsta volym på 4 ml för att reducera osmolaliteten.
d. Använd en endosspruta med en steril nål (storlek 21G‑23G) och skyddshölje och dra aseptiskt upp beredd gallium(68Ga)gozetotid injektionsvätska, lösning, före administrering (se avsnitt Dosering och administreringssätt och Särskilda anvisningar för destruktion och övrig hantering).
e. Den totala radioaktiviteten i sprutan ska verifieras med en doskalibrator omedelbart före och efter administrering av gallium(68Ga)gozetotid till patienten. Doskalibratorn måste kalibreras och uppfylla kraven i internationella standarder (se avsnitt Dosering och administreringssätt).
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
