ORNIBEL depotlääkevalmiste, emättimeen 0,120/0,015 mg/24 h
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteista
Terveydenhuollon ammattilainen
Tärkeää tietoa yhdistelmäehkäisyvalmisteesta ja veritulppariskistä
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Vaikuttavat aineet ja niiden määrät
Ornibel sisältää 8,25 mg etonogestreelia ja 2,60 mg etinyyliestradiolia. Rengas vapauttaa etonogestreelia ja etinyyliestradiolia keskimäärin 0,120 mg ja 0,015 mg 24 tunnissa 3 viikon ajan.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Depotlääkevalmiste, emättimeen.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Ornibel on tarkoitettu hedelmällisessä iässä oleville naisille. Valmisteen turvallisuus ja tehokkuus on todettu naisilla ikäryhmässä 18–40 vuotta.
Ornibel-renkaan määräämistä koskevassa päätöksessä on otettava huomioon renkaan käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja se, millainen Ornibel-renkaan käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Annostus
Ehkäisytehon saavuttamiseksi Ornibel-valmistetta on käytettävä ohjeiden mukaan (lue kohdat "Kuinka Ornibel-valmistetta käytetään" ja "Kuinka Ornibel-renkaan käyttö aloitetaan").
Pediatriset potilaat
Ornibel-renkaan turvallisuutta ja tehokkuutta alle 18-vuotiailla ei ole tutkittu.
Antotapa
KUINKA ORNIBEL-VALMISTETTA KÄYTETÄÄN
Käyttäjä asettaa itse Ornibel-renkaan emättimeen. Lääkärin tulee neuvoa, miten Ornibel-rengas asetetaan ja poistetaan. Käyttäjän on valittava itselleen mukavin asento esim. nostamalla toinen jalka ylös, kyykistymällä tai asettumalla selälleen. Ornibel-rengasta puristetaan ja asetetaan emättimeen niin, ettei se tunnu. Ornibel-renkaan tarkka paikka emättimessä ei ole oleellista ehkäisytehon kannalta (katso kuvat 1–4).
Kun Ornibel on paikallaan (katso kohta "Kuinka Ornibel-renkaan käyttö aloitetaan"), se jätetään emättimeen yhtäjaksoisesti 3 viikon ajaksi. Naisia on neuvottava tarkistamaan säännöllisesti, että Ornibel-rengas on edelleen paikallaan emättimessä (esim.ennen yhdyntää ja sen jälkeen). Jos Ornibel tulee vahingossa ulos, noudata kohdassa Annostus ja antotapa "Mitä tehdä, jos rengas tulee vahingossa ulos emättimestä" annettuja ohjeita (lisätietoja saa myös kohdasta Varoitukset ja käyttöön liittyvät varotoimet, "Ulostyöntyminen"). Ornibel on poistettava 3 viikon käytön jälkeen samana viikonpäivänä kuin se asetettiin paikalleen. Uusi rengas asetetaan viikon renkaattoman jakson jälkeen (esim. jos Ornibel asetettiin keskiviikkona noin klo 22.00, se pitää poistaa 3 viikon kuluttua keskiviikkona noin klo 22.00. Uusi rengas asetetaan sitä seuraavana keskiviikkona). Ornibel voidaan poistaa koukistamalla etusormi renkaan ympärille tai tarttumalla renkaan reunaan etu- ja keskisormella ja vetämällä sen ulos (kuva 5). Käytetty rengas laitetaan takaisin pussiin (pidettävä poissa lasten ja lemmikkien ulottuvilta) ja hävitetään kohdassa Käyttö- ja käsittelyohjeet annettujen ohjeiden mukaan. Tyhjennysvuoto kestää yleensä 2–3 päivää Ornibel-renkaan poistamisen jälkeen, eikä se ehkä ole loppunut täysin ennen uuden renkaan asettamisaikaa.
Käyttö muiden emättimeen asetettavien mekaanisten ehkäisyvälineiden kanssa
Ornibel voi vaikeuttaa tiettyjen emättimeen asetettavien mekaanisten ehkäisyvälineiden (esim. pessaari, ehkäisykuppi tai naisten kondomi) oikeaa paikoilleenasettamista ja oikeassa kohdassa pysymistä. Näitä ehkäisyvälineitä ei tule käyttää Ornibel-valmisteen lisäksi.
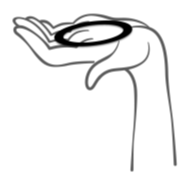
Kuva 1: Ota Ornibel pois pussista
Kuva 2: Purista rengasta
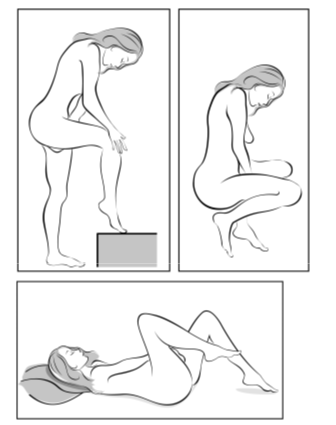
Kuva 3: Valitse käyttäjälle mukavin asento
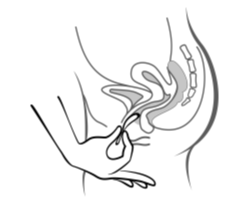 | 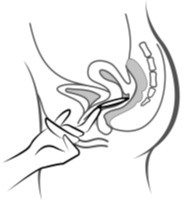 | 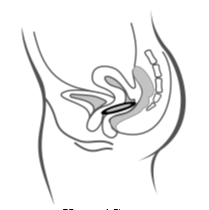 |
| Kuva 4A | Kuva 4B | Kuva 4C |
Työnnä rengas emättimeen toisella kädellä (kuva 4A) ja levitä tarvittaessa häpyhuulia toisella kädellä. Työnnä rengasta emättimeen, kunnes rengas ei tunnu (kuva 4B). Jätä rengas paikalleen 3 viikoksi (kuva 4C).
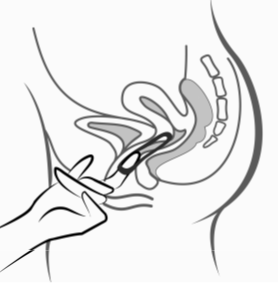
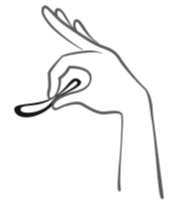
Kuva 5:
Ornibel voidaan poistaa koukistamalla etusormi renkaan ympärille tai tarttumalla renkaan reunaan etu- ja keskisormella ja vetämällä sen ulos.
KUINKA ORNIBEL-RENKAAN KÄYTTÖ ALOITETAAN
Ei aiempaa hormonaalista ehkäisyä edeltäneen kierron aikana:
Ornibel asetetaan luonnollisen kuukautiskierron ensimmäisenä päivänä (eli ensimmäisenä vuotopäivänä). Aloittaminen on mahdollista päivinä 2–5, mutta ensimmäisen kierron aikana lisäehkäisyksi suositellaan estemenetelmää Ornibel-valmisteen seitsemän ensimmäisen käyttöpäivän ajaksi.
Siirtyminen yhdistelmäehkäisyvalmisteesta:
Käyttäjän tulee asettaa Ornibel-rengas viimeistään (aiemman ehkäisyn) viimeisen tabletittoman, laastarittoman tai lumetablettijakson jälkeisenä päivänä.
Jos aiempaa menetelmää on käytetty jatkuvasti ja oikein ja on epätodennäköistä, että nainen on raskaana, aiemmasta yhdistelmähormonivalmisteesta voidaan siirtyä suoraan renkaaseen missä tahansa kierron vaiheessa.
Aiemman menetelmän hormoniton jakso ei saa koskaan ylittää suositeltua pituutta.
Vaihto pelkkää progestiinia sisältävistä ehkäisyvalmisteesta (minipilleri, implantaatti tai injektio) tai progestiinia vapauttavasta kohdunsisäisestä ehkäisimestä:
Minipilleristä voidaan siirtyä käyttämään Ornibel-valmistetta koska tahansa (implantaatista ja kohdunsisäisestä ehkäisimestä niiden poistopäivänä, injektiosta seuraavana suunniteltuna injektiopäivänä). Kaikissa näissä tapauksissa tulee kuitenkin käyttää lisäehkäisynä jotain estemenetelmää Ornibel-valmisteen seitsemän ensimmäisen käyttöpäivän ajan.
Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen:
Tablettien käyttö voidaan aloittaa heti. Muita ehkäisymenetelmiä ei tällöin tarvita. Jos välitöntä vaihtamista ei haluta, tulee noudattaa kohdassa "Ei aiempaa hormonaalista ehkäisyä edeltäneen kierron aikana" annettuja ohjeita. Tällä välin on neuvottava käyttämään vaihtoehtoista ehkäisymenetelmää.
Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen:
Imetys, katso kohta Raskaus ja imetys.
Käyttö aloitetaan neljännen viikon aikana synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen. Jos käyttö aloitetaan myöhemmin, tulee seitsemän ensimmäisen päivän aikana käyttää lisäksi estemenetelmää. Jos käyttäjä on jo ollut yhdynnässä, raskaus on suljettava pois ennen Ornibel-renkaan käytön varsinaista aloittamista tai on odotettava seuraavien kuukautisten alkamista.
POIKKEAMINEN SUOSITUKSISTA
Ehkäisyteho ja kierto saattavat vaarantua, jos suosituksista poiketaan. Jotta ehkäisytehoa ei menetettäisi poikkeamien aikana, on käyttäjälle annettava seuraavat neuvot:
-
Mitä tehdä, jos renkaaton jakso kestää yli viikon?
Uusi rengas on asetettava heti, kun mahdollista. Lisäksi seuraavien seitsemän päivän ajan tulee käyttää jotain estemenetelmää, kuten miesten kondomia. Jos nainen on ollut yhdynnässä renkaattoman jakson aikana, raskauden mahdollisuus on otettava huomioon. Mitä pidempi renkaaton jakso on, sitä suurempi on raskauden mahdollisuus. -
Mitä tehdä, jos rengas tulee vahingossa ulos emättimestä?
Ornibel pitää jättää emättimeen 3 viikon ajaksi. Jos rengas tulee vahingossa ulos, se voidaan huuhdella sen kylmässä tai haaleassa vedessä (ei kuumassa) ja asettaa se takaisin.
Jos Ornibel on ollut ulkona emättimestä alle 3 tuntia, ehkäisyteho ei ole heikentynyt. Rengas tulee asettaa takaisin mahdollisimman pian, kuitenkin 3 tunnin kuluessa.
Jos Ornibel-rengas on ollut ulkona emättimestä tai epäilet sen olleen ulkona emättimestä yli 3 tuntia 1. ja 2. käyttöviikon aikana, sen ehkäisyteho on saattanut heikentyä. Uusi rengas on asetettava heti, kun mahdollista. Lisäksi tulee käyttää jotain estemenetelmää, kuten kondomia, kunnes Ornibel-rengas on ollut paikallaan 7 päivää. Mitä pidempään Ornibel on ollut ulkona emättimestä ja mitä lähempänä renkaaton viikko on, sitä suurempi on raskauden mahdollisuus.
Jos Ornibel-rengas on ollut ulkona emättimestä tai epäilet sen olleen ulkona emättimestä yli 3 tuntia 3. käyttöviikon aikana, sen ehkäisyteho on saattanut heikentyä. Käyttäjän pitää heittää rengas pois ja valita seuraavista kahdesta vaihtoehdosta.
-
Aseta uusi rengas välittömästi paikalleen
Huomaa: Uuden renkaan asettaminen käynnistää uuden kolmen viikon jakson. Tyhjennysvuotoa ei ehkä ole ollut edellisen kierron aikana. Sen sijaan välivuotoja ja tiputtelua saattaa esiintyä. -
Odota tyhjennysvuotoa ja aseta uusi rengas viimeistään 7 päivän kuluttua (7 x 24 tuntia) siitä, kun edellinen rengas on poistettu tai tullut ulos.
Huomaa: Tämä vaihtoehto tulee valita vain, jos rengasta on käytetty yhtäjaksoisesti edeltävät 7 päivää.
Jos Ornibel on ollut poissa emättimestä tuntemattoman ajan, on raskauden mahdollisuus otettava huomioon. Enne uuden renkaan asettamista on tehtävä raskaustesti.
- Mitä tehdä, jos rengasta on käytetty liian pitkään?
Vaikka emme suosittele toimimaan näin, ehkäisyteho säilyy, jos Ornibel-rengasta on käytetty enintään 4 viikkoa. Käyttäjä voi pitää tavallisen renkaattoman viikon ja asettaa sen jälkeen uuden renkaan. Jos Ornibel-rengas on ollut paikallaan yli 4 viikkoa, ehkäisyteho on saattanut heikentyä, ja raskauden mahdollisuus pitää sulkea pois ennen uuden Ornibel-renkaan asettamista.
Jos käyttäjä ei ole noudattanut suositeltuja jaksoja eikä tyhjennysvuotoa ole tullut renkaattoman viikon aikana, raskauden mahdollisuus pitää sulkea pois ennen uuden Ornibel-renkaan asettamista.
KUINKA KUUKAUTISIA SIIRRETÄÄN AIKAISEMMAKSI TAI MYÖHEMMÄKSI?
Jos kuukautisia pitää poikkeustapauksessa lykätä, käyttäjä voi asettaa uuden renkaan heti edellisen perään ilman renkaatonta viikkoa. Seuraavaa rengasta voidaan käyttää taas enintään 3 viikkoa. Tänä aikana voi esiintyä välivuotoja tai tiputtelua. Ornibel-renkaan säännöllistä käyttöä jatketaan taas yhden normaalin renkaattoman viikon jälkeen.
Kuukautisten siirtäminen alkamaan toisena viikonpäivänä tapahtuu lyhentämällä tulevaa renkaatonta jaksoa halutun verran. Mitä lyhyempi renkaaton väli on, sitä suurempi on riski, että tyhjennysvuotoa ei lyhennetyn jakson aikana tule ja että seuraavan renkaan käytön aikana esiintyy välivuotoja ja tiputtelua.
Vasta-aiheet
Yhdistelmäehkäisyvalmisteita ei pidä käyttää seuraavien tilojen yhteydessä: Jos jokin näistä tiloista ilmenee ensimmäistä kertaa Ornibel-rengasta käytettäessä, rengas on poistettava välittömästi.
-
laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC-resistenssi (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
valtimotromboembolia tai sen riski
- valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus – tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA).
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupus-antikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vaikea-asteisen riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea-asteinen hypertensio
- vaikea-asteinen dyslipoproteinemia
- Haimatulehdus nyt tai aiemmin, jos siihen on liittynyt vaikea hypertriglyseridemia.
- vaikea-asteinen maksasairaus, tämänhetkinen tai aiemmin ilmennyt, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi
- tämänhetkinen tai aiemmin ilmennyt hyvän- tai pahanlaatuinen maksakasvain
- Sukupuolielinten tai rintojen maligniteetit, joihin sukupuolihormonit vaikuttavat, tai niiden epäily.
- emätinverenvuoto, jonka syy on selvittämättä
- yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille Ornibelin apuaineille.
Ornibel on vasta-aiheinen käytettäessä samanaikaisesti ombitasviiri/paritabreviiri/ritonaviiri-yhdistelmää ja dasabuviiria sisältäviä lääkkeitä tai glekapreviiri/pibrentasviiri‑yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmääsisältäviä lääkkeitä (ks. kohta Yhteisvaikutukset)
Varoitukset ja käyttöön liittyvät varotoimet
VAROITUKSET
Ornibel-renkaan soveltuvuudesta on keskusteltava potilaan kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Ornibel-renkaan käyttö keskeyttää.
1. Verenkiertohäiriöt
Laskimotromboembolian (VTE) riski
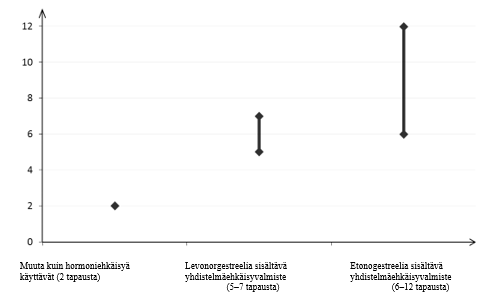
- Minkä tahansa yhdistelmäehkäisyrenkaan käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Ornibel-renkaan kohdalla. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Ornibel-renkaan käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään neljän viikon tauon jälkeen.
- Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistään (ks. jäljempänä).
- Arvioiden mukaan noin kuudelle1 10 000:sta levonorgestreelia sisältävää pieniannoksista yhdistelmäehkäisyvalmistetta käyttävästä naisesta kehittyy veritulppa vuoden aikana. Etonogestreelia/etinyyliestradiolia sisältävän renkaan käyttöön liittyvästä VTE:n riskistä on saatu ristiriitaisia tuloksia verrattuna levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käyttöön (suhteellisen riskin arviot vaihtelevat siitä, ettei kasvua ole, RR=0,96, lähes 2-kertaiseen kasvuun, RR=1,90). Tämä vastaa noin 6–12 VTE-tapausta vuodessa 10 000 etonogestreelia/etinyyliestradiolia sisältävää-rengasta käyttävää naista kohti.
- Molemmissa tapauksissa VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
- VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista
1 Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6
VTE-tapausten määrä 10 000 naista kohti yhden vuoden aikana
TEV-tapausten määrä
- Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on hyvin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Ornibel on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian riskitekijät
| Riskitekijä | Kommentti |
| Ylipaino (painoindeksi yli 30 kg/m²) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma. Huomaa: Väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä. | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei renkaan käyttöä ole lopetettu etukäteen. |
| Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
| Muut laskimotromboemboliaan liitetyt sairaudet. | Syöpä, systeeminen lupus erythematosus, hemolyyttisureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia. |
| ikääntyminen | Erityisesti yli 35 vuoden ikä |
- Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
- Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin kuuden viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys "Hedelmällisyys, raskaus ja imetys”).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea-asteinen pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkin näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vakaviksi tapauksiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näönmenetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko).
Ornibel-rengas on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin. Tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
| Riskitekijä | Kommentti |
| ikääntyminen | Erityisesti yli 35 vuoden ikä |
| Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
| Korkea verenpaine | |
| Ylipaino (painoindeksi yli 30 kg/m²) | Riski suurenee huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
| Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
| Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
| Muut verisuoniston haittatapahtumiin liitetyt sairaudet. | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
Yhdistelmäehkäisyvalmisteiden käyttö tulee keskeyttää tromboosilöydöksen tai sen epäilyn yhteydessä. Potilasta tulee neuvoa käyttämään asianmukaista vaihtoehtoista ehkäisymenetelmää ko. hoidon aikana antikoagulanttihoidon (kumariinit) teratogeenisyyden vuoksi.
2. Kasvaimet
- Epidemiologiset tutkimukset osoittavat, että ehkäisytablettien pitkäaikainen käyttö on kohdunkaulan syövän riskitekijä naisilla, joilla on ihmisen papilloomaviruksen (HPV) aiheuttama tartunta. On kuitenkin vielä epävarmaa, missä määrin tähän havaintoon vaikuttavat sekoittavat vaikutukset (esim. erot seksikumppaneiden määrässä tai estemenetelmien käytössä). Kohdunkaulasyövän riskistä Ornibel-renkaan käyttäjillä ei ole epidemiologisia tietoja (katso kohta "lääkärintarkastus/vastaanottokäynti").
- Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytablettien käyttäjien suhteellinen rintasyöpäriski on hieman suurentunut (suhteellinen riskikerroin 1,24). Tämä riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön lopettamisesta. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, yhdistelmäehkäisytabletteja käyttävillä tai hiljattain niitä käyttäneillä todettu rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyöpäriskiin koko elinaikana. Lisäksi käyttäjiltä diagnosoidut rintasyöpätapaukset ovat yleensä kliinisesti varhaisemmassa vaiheessa kuin ehkäisytabletteja käyttämättömiltä diagnosoidut rintasyöpätapaukset. Havaittu suurentunut riski voi johtua rintasyövän varhaisemmasta diagnoosista suun kautta otettavien yhdistelmäehkäisytablettien käyttäjillä, suun kautta otettavien yhdistelmäehkäisytablettien biologisista vaikutuksista tai molemmista.
- Harvinaisissa tapauksissa yhdistelmäehkäisytablettien käyttäjillä on todettu hyvänlaatuisia ja vielä harvemmin pahanlaatuisia maksakasvaimia. Yksittäistapauksissa nämä kasvaimet ovat johtaneet hengenvaarallisiin sisäisiin vatsaonteloverenvuotoihin. Tästä syystä erotusdiagnostisesti maksakasvaimen mahdollisuutta tulisi harkita, kun Ornibel-rengasta käyttävillä naisilla on voimakasta ylävatsakipua, suurentunut maksa tai merkkejä vatsaontelonsisäisestä verenvuodosta.
3. Muut sairaudet
- Naisilla, joilla on hypertriglyseridemia tai joilla sitä esiintyy suvussa, saattaa olla suurentunut haimatulehduksen riski yhdistelmäehkäisyvalmisteiden käytön aikana.
- Vähäistä verenpaineen kohoamista on raportoitu yhdistelmäehkäisyvalmisteiden käyttäjillä, mutta kliinisesti merkitsevä verenpaineen kohoaminen on harvinaista. Määriteltyä suhdetta hormoniehkäisyn käytön ja kliinisen verenpaineen välillä ei ole osoitettu. Jos kuitenkin kliinisesti merkittävää verenpaineen kohoamista tapahtuu Ornibel-renkaan käytön aikana, lääkärin tulisi kehottaa lopettamaan renkaan käyttö ja hoitaa hypertensiota. Ornibel-renkaan käyttöä voidaan jatkaa, jos verenpainelääkityksellä saadaan aikaan normotensio.
- Seuraavia sairaustiloja tai niiden pahenemista on raportoitu esiintyneen sekä raskauden että yhdistelmäehkäisyn käytön yhteydessä, mutta niiden yhteydestä yhdistelmäehkäisyn käyttöön ei ole pitävää näyttöä: kolestaasiin liittyvä keltaisuus ja/tai kutina, sappikivien muodostuminen porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroosiin liittyvä kuulonalenema.
- Eksogeeniset estrogeenit saattavat indusoida tai pahentaa perinnöllisen tai hankinnaisen angioedeeman oireita.
- Ornibel-renkaan käytön keskeyttäminen saattaa olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksafunktioarvot ovat normalisoituneet. Renkaan käyttö on lopetettava, jos ensin raskausaikana tai aiemman sukupuolihormonien käytön aikana ilmennyt kolestaasiin liittyvä keltaisuus ja/tai kutina uusiutuu.
- Vaikka estrogeeneilla ja progestageeneilla voi olla vaikutusta perifeeriseen insuliiniresistenssiin tai glukoosinsietoon, hormonaalista ehkäisyä käyttävien naisten diabeteshoidon muuttamistarpeesta ei ole näyttöä. Ornibel-rengasta käyttäviä diabetespotilaita on kuitenkin seurattava etenkin ensimmäisten käyttökuukausien aikana.
- Crohnin taudin ja haavaisen paksusuolen tulehduksen ilmaantumista tai vaikeutumista on raportoitu tapahtuneen hormonaalisten ehkäisyvalmisteiden käytön yhteydessä, mutta näyttöä näiden yhteydestä toisiinsa ei ole osoitettu sitovasti
- Maksaläiskiä voi joskus esiintyä, erityisesti jos niitä on esiintynyt raskausaikana. Maksaläiskien saamiseen taipuvaisten naisten tulisi välttää aurinkoa ja ultraviolettisäteilyaltistusta Ornibel-renkaan käytön aikana.
- Jos käyttäjällä on jokin seuraavista, hän ei ehkä pysty asettamaan Ornibel-rengasta tai se saattaa pudota: kohdunkaulan prolapsi, kystoseele ja/tai rektoseele, vakava tai krooninen ummetus.
- Erittäin harvoin on raportoitu Ornibel-renkaan virheellisestä asettamisesta virtsaputkeen ja mahdollisuudesta joutua virtsarakkoon. Siksi virheellisen asetuksen mahdollisuus on otettava huomioon erotusdiagnosoinnissa kystiitin oireiden ilmetessä.
- Ornibel-renkaan käytön aikana saattaa joskus esiintyä emätintulehdusta. Ei ole olemassa indikaatioita siitä, että emätintulehduksen hoito vaikuttaisi Ornibel-renkaan tehokkuuteen tai että Ornibel-renkaan käyttö vaikuttaisi emätintulehduksen hoitoon (katso kohta Yhteisvaikutukset).
- Hyvin harvoin on raportoitu, että rengas jää kiinni emättimen kudoksiin niin, että se edellyttää poistamista terveydenhuollon ammattihenkilön luona. Joissain tapauksissa, kun renkaan päälle on kasvanut kudosta, rengas on voitu poistaa katkaisemalla se; tällöin emätinkudosta ei ole tarvinnut leikata.
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
LÄÄKÄRIN TUTKIMUS/VASTAANOTTO
Ennen Ornibel-renkaan käytön aloittamista tai uudelleen aloittamista, potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Potilaan verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (katso kohta Vasta-aiheet) ja varoitukset (katso kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten renkaan käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
HEIKENTYNYT TEHO
Käyttöohjeiden noudattamatta jättäminen (kohta Annostus ja antotapa) tai plasman etinyyliestradioli- tai
etonogestreelipitoisuutta laskeva samanaikainen lääkitys (kohta Yhteisvaikutukset) voivat heikentää Ornibel-renkaan ehkäisytehoa.
VAIKUTUKSET KIERTOON
Epäsäännöllistä verenvuotoa emättimestä (tiputtelu- tai välivuotoa) voi esiintyä etenkin ensimmäisten Ornibel-renkaan käyttökuukausien aikana. Jos vuotohäiriöitä ilmaantuu, vaikka Ornibel-rengasta olisi aiemmin käytetty syklien mukaan, ei-hormonaaliset syyt on syytä ottaa huomioon. Asianmukaiset diagnostiset toimenpiteet ovat perusteltuja maligniteetin tai raskauden poissulkemiseksi. Näihin voi sisältyä myös kaavinta.
Joissakin tapauksissa renkaattoman jakson aikana ei tule tyhjennysvuotoa. Jos Ornibel-rengasta on käytetty kohdassa Annostus ja antotapa annettujen ohjeiden mukaan, käyttäjä ei todennäköisesti ole raskaana. Jos Ornibel -rengasta ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon ensimmäistä poisjääntiä tai jos jo kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen Ornibel-renkaan käytön jatkamista.
MIEHEN ALTISTUMINEN ETINYYLIESTRADIOLILLE JA ETONOGESTEREELILLE
Miespuolisten seksikumppaneiden etinyyliestradiolille ja etonogestreelille altistumisen laajuutta ja mahdollista farmakologista roolia peniksen kautta imeytymisessä ei ole tutkittu.
RIKKOUTUNEET RENKAAT
Ornibel-renkaan on raportoitu rikkoutuneen käytön aikana (katso kohta Yhteisvaikutukset). Renkaan rikkoutumiseen liittyviä emättimen vaurioita on raportoitu. Käyttäjää neuvotaan poistamaan rikkoutunut rengas sekä asettamaan uusi rengas mahdollisimman pian ja käyttämään lisäehkäisyä, kuten miesten kondomia, seuraavien 7 päivän ajan. Raskauden mahdollisuus on otettava huomioon, ja käyttäjän on oltava yhteydessä lääkäriin.
ULOSTYÖNTYMINEN
Ornibel-renkaan on raportoitu tulleen ulos emättimestä, jos se on esimerkiksi asetettu väärin, tamponia poistettaessa, yhdynnän aikana tai vaikeassa tai kroonisessa ummetuksessa. Jos rengas on poissa emättimestä pitkään, ehkäisyteho heikkenee ja/tai voi esiintyä välivuotoja. Siksi on suositeltavaa tarkistaa säännöllisesti, että Ornibel-rengas on edelleen paikallaan (esim. ennen yhdyntää ja sen jälkeen).
Jos Ornibel on vahingossa tullut ulos emättimestä ja ollut ulkona alle 3 tuntia, ehkäisyteho ei ole heikentynyt. Renkaan voi huuhdella kylmässä tai haaleassa vedessä (älä käytä kuumaa vettä) ja asettaa takaisin, kuitenkin viimeistään 3 tunnin kuluessa.
Jos Ornibel-rengas on ollut ulkona emättimestä tai epäilet sen olleen ulkona emättimestä yli 3 tuntia, sen ehkäisyteho on saattanut heikentyä. Kohdassa Annostus ja antotapa on annettu ohjeet, kuinka toimia, jos rengas tulee vahingossa ulos emättimestä.
Yhteisvaikutukset
YHTEISVAIKUTUKSET MUIDEN LÄÄKEVALMISTEIDEN KANSSA
Huom. Mahdollisten yhteisvaikutusten selvittämiseksi on tutustuttava samanaikaisesti käytettävien
lääkevalmisteiden valmisteyhteenvetoihin.
Muiden lääkkeiden vaikutukset Ornibeliin
Yhteisvaikutuksia saattaa ilmetä maksan mikrosomaalisia entsyymejä indusoivien lääkkeiden tai
kasvirohdosvalmisteiden kanssa, jotka voivat lisätä sukupuolihormonien puhdistumaa, mikä voi johtaa läpäisyvuotoihin ja/tai ehkäisytehon pettämiseen
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymiinduktio ilmenee yleensä muutaman viikon kuluessa. Lääkehoidon lopettamisen jälkeen entsyymiinduktion vaikutus voi kestää noin neljän viikon ajan.
Lyhytaikainen hoito
Käytettäessä entsyymejä indusoivia lääkkeitä tai kasvirohdosvalmisteita naisen tulee väliaikaisesti
käyttää Ornibel-renkaan lisäksi jotakin estemenetelmää tai valita jokin muu ehkäisykeino. Huom.
Ornibeliä ei pidä käyttää pessaarin, ehkäisykupin eikä naisten kondomin kanssa. Estemenetelmää on käytettävä samanaikaisesti käytettävän lääkityksen ajan sekä lisäksi 28 päivää lääkityksen lopettamisen jälkeen. Jos samanaikainen lääkitys kestää kauemmin kuin Ornibelin 3 viikon käyttösykli, seuraavan renkaan käyttö on aloitettava heti ilman tavanomaista taukoa.
Pitkäaikainen hoito
Käytettäessä pitkäkestoisesti maksan entsyymejä indusoivaa lääkitystä, suositellaan muun luotettavan ei-hormonaalisen ehkäisymenetelmän käyttöä.
Kirjallisuudessa on raportoitu seuraavia yhteisvaikutuksia.
Hormonaalisten yhdistelmäehkäisyvalmisteiden puhdistumaa lisäävät aineet
Yhteisvaikutuksia saattaa ilmetä maksan mikrosomaalisia entsyymejä indusoivien lääkkeiden tai
kasvirohdosvalmisteiden, erityisesti sytokromi P450 (CYP) -entsyymien kanssa, jotka saattavat lisätä
sukupuolihormonien puhdistumaa ja vähentää niiden pitoisuutta plasmassa ja heikentää hormonaalisten yhdistelmäehkäisyvalmisteiden, mukaan lukien Ornibelin, tehoa. Näitä valmisteita ovat fenytoiini, fenobarbitaali, primidoni, bosentaani, karbamatsepiini, rifampisiini sekä mahdollisesti myös okskarbatsepiini, topiramaatti, felbamaatti, griseofulviini, jotkut HIV-proteaasin estäjät (esim. ritonaviiri) ja ei-nukleosidirakenteiset käänteiskopioijaentsyymin estäjät (esim. efavirentsi) ja mäkikuismarohdosta sisältävät valmisteet.
Aineet, joilla on vaihtelevia vaikutuksia hormonaalisten yhdistelmäehkäisyvalmisteiden puhdistumaan
Yhtäaikaisesti hormonaalisten yhdistelmäehkäisyvalmisteiden kanssa käytettynä monet HIV-proteaasin estäjiä (esim. nelfinaviiria) ja ei-nukleosidirakenteisia käänteiskopioijaentsyymin estäjiä (esim. nevirapiinia) sisältävät lääkeyhdistelmät ja/tai HCV:n hoitoon tarkoitetut yhdistelmät (esim. bosepreviiri, telapreviiri) voivat suurentaa tai pienentää progestiinien, mukaan lukien etonogestreelin, tai estrogeenin pitoisuutta plasmassa. Näiden muutosten kokonaisvaikutus voi joissakin tapauksissa olla kliinisesti merkittävä.
Aineet, jotka vähentävät hormonaalisten yhdistelmäehkäisyvalmisteiden puhdistumaa
Entsyymi-inhibiittoreihin liittyvien mahdollisten interaktioiden kliininen merkitys on tuntematon.
Voimakkaiden CYP 3A4-entsyymi-inhibiittoreiden (esim. ketokonatsoli, itrakonatsoli, klaritromysiini) tai kohtalaisten CYP 3A4-entsyymi-inhibiittoreiden (esim. flukonatsoli, diltiatseemi, erytromysiini) yhtäaikainen käyttö voi nostaa estrogeenien tai progestiinien, mukaan lukien etonogestreelin, pitoisuutta plasmassa.
Renkaan rikkoutumista on raportoitu käytettäessä samanaikaisesti emättimeen annosteltavia valmisteita, kuten sienilääkkeitä, antibiootteja ja liukastusaineita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ”Rikkoutuneet renkaat”). Farmakokineettisten tietojen perusteella emättimeen annettuna antimykootit ja spermisidit eivät todennäköisesti vaikuta Ornibel-renkaan ehkäisytehoon ja turvallisuuteen.
Hormonaaliset ehkäisyvalmisteet saattavat häiritä muiden lääkkeiden toimintaa. Tällöin niiden pitoisuus plasmassa ja kudoksessa voi joko nousta (esim. siklosporiini) tai laskea (esim. lamotrigiini).
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet).
Tästä syystä Ornibelin-käyttäjien on vaihdettava muuhun ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään ehkäisyyn tai ei-hormonaalisiin menetelmiin) ennen näiden yhdistelmähoitojen aloittamista.
Ornibel-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen lopettamisesta.
LABORATORIOKOKEET
Steroidiehkäisyn käyttö voi vaikuttaa eräisiin laboratorioarvoihin, kuten maksan, kilpirauhasen,
lisämunuaisen ja munuaisten toimintakokeiden biokemiallisiin parametreihin, kantajaproteiinien
(esim. kortikosteroideja sitovan globuliinin ja sukupuolihormone ja sitovan globuliinin) ja
lipidi/lipoproteiinifraktioiden pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä normaalialueella
KÄYTTÖ TAMPONIEN KANSSA
Farmakokineettiset tiedot osoittavat, että käyttö tamponien kanssa ei vaikuta Ornibel-renkaan vapauttamien hormonien systeemisen imeytymisen. Harvoissa tapauksissa Ornibel voi tulla ulos tamponia poistettaessa (katso kohta "Mitä tehdä, jos rengas tulee vahingossa pois emättimestä").
Raskaus ja imetys
Raskaus
Ornibel-renkaita ei saa käyttää raskauden aikana. Jos käyttäjä tulee raskaaksi Ornibel-renkaan käytön aikana, rengas on poistettava. Laajojen epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski lapsella ei ole suurentunut raskautta edeltäneen yhdistelmäehkäisytablettien käytön yhteydessä eikä teratogeenisten vaikutusten riski silloin, kun yhdistelmäehkäisytabletteja on käytetty tahattomasti raskauden varhaisvaiheessa.
Pientä joukkoa naisia koskevassa kliinisessä tutkimuksessa osoitettiin, että emättimeen asetuksesta huolimatta etonogestreelia/etinyyliestradiolia sisältävän renkaan käytön aiheuttama kohdunsisäinen steroidipitoisuus on samanlainen kuin yhdistelmäehkäisyä käyttävillä (katso kohta Farmakokinetiikka). Etonogestreelia/etinyyliestradiolia sisältävälle renkaalle altistuneiden raskauksien tuloksista ei ole raportoitu kliinisiä kokemuksia.
Kun Ornibel-renkaan käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Yhdistelmäehkäisy saattaa vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi Ornibel-rengasta suositellaan yleensä käytettäviksi vasta, kun lapsi on vieroitettu rintamaidosta. Pieniä määriä kontraseptiivisia steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon yhdistelmäehkäisyn käytön aikana, mutta ei ole todisteita tämän haitallisesta vaikutuksesta lapsen terveyteen.
Hedelmällisyys
Ornibel on tarkoitettu raskauden ehkäisyyn. Jos nainen haluaa lopettaa Ornibelin käytön tullakseen
raskaaksi, on häntä neuvottava odottamaan ensimmäisten luonnollisten kuukautisten tuloa ennen kuin yrittää tulla raskaaksi. Tämä helpottaa synnytyksen ajankohdan määrittämistä
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ornibel-renkaalla ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Useimmin raportoidut haittavaikutukset etonogestreelia/etinyyliestradiolia sisältävän valmisteenkäyttöä koskevissa kliinisissä tutkimuksissa olivat päänsärky ja emättimen infektiot ja valkovuoto, joita jokaista raportoitu 5–6 %:lla naisista.
Valittujen haittavaikutusten kuvaus
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Yhdistelmäehkäisyvalmisteilla ei ole ilmoitettu olevan vaikutusta ajokykyyn ja koneiden käyttökykyyn. Tätä käsitellään tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutukset, joista on raportoitu kliinisissä tutkimuksissa, havainnointitutkimuksissa tai etonogestreelia/etinyyliestradiolia sisältävän renkaan markkinoille tulon jälkeen, on lueteltu alla olevassa taulukossa. Sopivin MedDRA-termi kuvaamaan tiettyä haittavaikutusta on valittu luetteloon.
Kaikki haittavaikutukset on lueteltu elinluokan ja esiintymistiheyden mukaan.
yleinen (≥ 1/100 - < 1/10), melko harvinainen (≥ 1/1 000 - < 1/100), harvinainen (≥ 1/10 000 - < 1/1 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Elinjärjestelmä- luokka | Yleinen | Melko harvinainen | Harvinainen | Tuntematon1 |
| Infektiot | emätintulehdus | Kohdunkaulan tulehdus, kystiitti, virtsatie- infektio | ||
| Immuunijärjestelmä | yliherkkyysreaktiot, mukaan lukien angioedeema ja anafylaksia, perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | |||
Aineenvaihdunta ja ravitsemus | lisääntynyt ruokahalu | |||
Psyykkiset häiriöt | masennus, seksuaalivietin heikentyminen | mielialan epävakaisuus, mielialamuutokset, mielialan vaihtelut | ||
| Hermosto | päänsärky, migreeni | huimaus, heikentynyt tunto | ||
| Silmät | näköhäiriöt | |||
| Verisuonisto | kuumat aallot | laskimo- tromboembolia valtimo- tromboembolia | ||
Ruoansulatus- elimistö | vatsakipu, pahoinvointi | vatsan pullistuma, ripuli, oksentelu, ummetus | ||
Iho ja ihonalainen kudos | akne | hiustenlähtö, ekseema, kutina, ihottuma, nokkosihottuma | kloasma | |
Luusto, lihakset ja side- kudos | selkäkipu, lihas- krampit, kipua raajassa | |||
Munuaiset ja virtsatiet | dysuria, virtsaamishäiriöt tihentynyt virtsaamisen tarve | |||
Sukupuolielimet ja rinnat | rintojen arkuus, genitaalialueiden kutina naisilla, kuukautiskivut, lantiokipu, emätineritteen muutokset | amenorrea, epämukava tunne rinnoissa, rintojen suureneminen, rintojen massa, kohdunkaulan polyyppi, verenvuoto yhdynnässä, dyspareunia, kohdunkaulan uloskääntymä fibrokystiset rinnat, menorragia, metrorragia, lantion epämukavuus, pms-oireet virtsarakon kouristelut, emättimen kuumotus, hajua emättimestä, emätinkipu, ulkosynnyttimiin ja emättimeen liittyvä epämukavuus, ulkosynnyttimiin ja emättimeen liittyvä kuivuus | galaktorrea, | peniksen häiriöt |
Yleisoireet ja antopaikassa todettavat haitat | väsymys, ärtyneisyys, huonovointisuus, turvotus, vierasesine- tuntemus | emätinkudoksen kasvaminen renkaan päälle | ||
| Tutkimukset | painonnousu | verenpaineen kohoaminen | ||
| Vammat, myrkytykset ja hoitokomplikaatiot | emätinrenkaan aiheuttama epämukavuus, emätinrenkaan ekspulsio | emätinrenkaaseen liittyvä komplikaatio | renkaan rikkoutumiseen liittyvä emättimen vaurio |
1) Vapaaehtoiseen raportointiin perustuva haittavaikutusten luettelo
Hormonikasvaimia, kuten rintasyöpää ja maksakasvaimia, on raportoitu yhdistelmähormonivalmisteiden käyttäjillä. Lisätietoja on kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Ornibel-renkaan on raportoitu auenneen liitoskohdasta käytön aikana (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Yhteisvaikutukset
Läpäisyvuoto ja/tai ehkäisyn pettäminen saattavat johtua muiden lääkkeiden (entsyymi-indusorit)
yhteisvaikutuksista hormonaalisten ehkäisyvalmisteiden kanssa (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haitta‐tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Hormonaalisten ehkäisyvalmisteiden yliannostuksen ei ole raportoitu aiheuttavan vakavia haittavaikutuksia. Mahdollisia yliannostusoireita ovat: pahoinvointi, oksentelu ja erityisesti nuorilla tytöillä vähäinen verenvuoto emättimestä. Antidoottia ei ole ja hoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut gynekologiset, intravaginaaliset ehkäisyvälineet, emätinrengas (progestiini ja estrogeeni), ATC-koodi: G02BB01
Vaikutusmekanismi
Ornibel sisältää etonogestreelia ja etinyyliestradiolia. Etonogestreeli on 19-nortestosteroni-johdettu progestiini, joka sitoutuu suurella affiniteetilla progesteronin reseptoreihin kohde-elimissä. Etinyyliestradioli on estrogeeni, jota käytetään laajalti ehkäisyvalmisteissa. Etonogestreelia/etinyyliestradiolia sisältävän renkaan ehkäisyteho perustuu monen eri tekijän yhteisvaikutukseen. Näistä tärkein on ovulaation estyminen.
Kliininen teho ja turvallisuus
Valmistetta koskeviin maailmanlaajuisiin (USA, EU ja Brasilia) kliinisiin tutkimuksiin osallistuneet naiset olivat 18–40-vuotiaita. Ehkäisyteho osoittautui vähintään yhtä hyväksi kuin oraalisten ehkäisyvalmisteiden teho. Seuraavassa taulukossa esitetään Pearl-indeksit (raskauksien määrä 100:a naista kohden käyttövuoden aikana), jotka saatiin etonogestreelia/etinyyliestradiolia sisältävän renkaan kliinisissä tutkimuksissa.
Analyysi Menetelmä | Pearl-indeksi | 95 % CI | Jaksojen määrä |
ITT (käyttäjä + menetelmän pettäminen) | 0,96 | 0,64 – 1,39 | 37 977 |
PP (menetelmän pettäminen) | 0,64 | 0,35 – 1,07 | 28 723 |
Korkeampiannoksisia yhdistelmäehkäisytabletteja (0,05 mg etinyyliestradiolia) käytettäessä sekä kohdun limakalvon- että munasarjasyövän esiintymisen riski pienenee. Se, koskeeko tämä myös matala-annoksisia ehkäisyvälineitä, kuten etonogestreelia/etinyyliestradiolia sisältäviä renkaita, on vielä vahvistamatta.
VUODOT
Suuri vertaileva tutkimus, jossa 150/30 μg levonorgestreelia/etinyyliestradiolia OC (n = 512 vs n = 518), jossa vertailtiin emätinverenvuodon ominaisuuksia yli 13 kierrossa, osoitti pientä ilmaantuvuutta välivuotoihin, tiputteluvuotoon tai verenvuotoon etonogestreelia/ethinyyliestradiolia sisältävän -renkaan käytössä (2,0–6,4 %). Lisäksi emättimen verenvuoto oli rajoittunut yksinomaan renkaattomaan jaksoon useimmissa tapauksissa (58,8–72,8 %).
VAIKUTUKSET LUUN MINERAALITIHEYTEEN
Etonogestreelia/etinyyliestradiolia sisältävän -renkaan vaikutuksia (n = 76) luun mineraalitiheyteen (BMD) tutkittiin verrattuna ei-hormonaalista kierukkaa (IUD) (n = 31) käyttäviin naisiin yli kahden vuoden ajan. Mitään haitallisia vaikutuksia luun tiheyteen ei havaittu.
Pediatriset potilaat
Etonogestreelia/etinyyliestradiolia sisältävän renkaan turvallisuutta ja tehokkuutta alle 18-vuotiailla ei ole tutkittu.
Farmakokinetiikka
Etonogestreeli
Imeytyminen
Etonogestreelia/etinyyliestradiolia sisältävästä -renkaasta vapautuva etonogestreeli imeytyy nopeasti emättimen limakalvolta. Etonogestreelin huippupitoisuus seerumissa noin 1 700 pg/ml saavutettiin noin 1 viikon kuluttua asetuksesta. Seerumipitoisuudet osoittavat pieniä heilahteluja ja laskevat hitaasti suunnilleen tasolle 1 600 pg/ml yhden viikon kuluttua, 1 500 pg/ml kahden viikon kuluttua ja 1 400 pg/ml kolmen viikon käytön jälkeen. Absoluuttinen hyötyosuus on noin 100 %, mikä on korkeampi kuin suun kautta otettuna. Pieneltä joukolta naisia, jotka käyttivät joko etonogestreelia/etinyyliestradiolia sisältävää rengasta tai oraalista ehkäisyä, joka sisälsi 0,150 mg desogestreelia ja 0,020 mg etinyyliestradiolia, mitattiin kohdunkaulan ja kohdunsisäiset etonogestreeli pitoisuudet. Havaitut pitoisuudet olivat verrannolliset toisiinsa nähden.
Jakautuminen
Etonogestreeli sitoutuu seerumin albumiiniin ja sukupuolihormonia sitovaan globuliiniin (SHBG). Etonogestreelin jakautumistilavuus on 2,3 l/kg.
Biotransformaatio
Etonogestreeli metaboloituu elimistössä täysin steroidimetabolismin tyypillisiä reittejä. Näennäinen puhdistuma seerumista on noin 3,5 l/h. Suoraa vuorovaikutusta ei havaittu samanaikaisesti annetun etinyyliestradiolin kanssa.
Eliminaatio
Etonogestreelin pitoisuus seerumissa vähenee kahdessa vaiheessa. Ensimmäisen vaiheen eliminaation puoliintumisaika on noin 29 tuntia. Metaboliitit erittyvät virtsaan ja sappeen suhteessa 1,7:1. Niiden eliminaation puoliintumisaika on noin 6 päivää.
Etinyyliestradioli
Imeytyminen
Etonogestreelia/etinyyliestradiolia sisältävästä -renkaasta vapautuva etinyyliestradioli imeytyy nopeasti emättimen limakalvolta. Seerumin maksimipitoisuudet noin 35 pg/ml saavutetaan 3 päivää asettamisen jälkeen, ja ne alkavat laskea arvoon 19 pg/ml yhden viikon jälkeen, 18 pg/ml kahden viikon jälkeen ja 18 pg/ml 3 viikon käytön jälkeen. Kuukausittainen systeeminen etinyyliestradiolialtistus (AUC0-ω) etonogestreelia/etinyyliestradiolia sisältävää -rengasta käytettäessä on 10,9 ng. h/ml.
Absoluuttinen hyötyosuus on noin 56 %, mikä on verrattavissa etinyyliestradioliin suun kautta otettuna. Pieneltä joukolta naisia, jotka käyttivät joko etonogestreelia/etinyyliestradiolia sisältävää -rengasta tai oraalista ehkäisyä, joka sisälsi 0,150 mg desogestreelia ja 0,020 mg etinyyliestradiolia, mitattiin kohdunkaulan ja kohdunsisäiset etonogestreeli pitoisuudet. Havaitut pitoisuudet olivat verrannolliset toisiinsa nähden.
Jakautuminen
Etinyyliestradioli on hyvin, mutta ei-spesifisesti sitoutunut seerumin albumiiniin. Jakautumistilavuus on noin 15 l/kg.
Biotransformaatio
Etinyyliestradioli metaboloituu pääasiassa aromaattisen hydroksylaation kautta, mutta reaktiossa muodostuu laajasti erilaisia hydroksyloituja ja metyloituja metaboliitteja. Ne esiintyvät vapaina metaboliitteina ja konjugoituneina glukuronidien ja sulfaattien kanssa. Näennäinen puhdistuma on noin 35 l/h.
Eliminaatio
Etinyyliestradiolipitoisuus seerumissa vähenee kahdessa vaiheessa. Loppuvaiheen eliminaatiolle on tyypillistä suuret yksilöiden väliset erot puoliintumisajassa, joka keskimäärin on noin 34 tuntia. Muuttumaton etinyyliestradioli ei erity, etinyyliestradiolin metaboliitit erittyvät virtsaan ja sappeen suhteessa 1,3:1. Metaboliittien erittymisen puoliintumisaika on noin 1,5 vuorokautta.
Erityisryhmät
Pediatriset potilaat
Etonogestreelia/etinyyliestradiolia sisältävän -renkaan farmakokinetiikkaa ei ole tutkittu terveillä alle 18-vuotiailla naisilla, joilla on ollut ensimmäiset kuukautiset.
Vaikutukset munuaisten vajaatoimintaan
Ei ole tehty tutkimuksia, joissa arvioidaan etonogestreelia/etinyyliestradiolia sisältävän -renkaan farmakokinetiikkaa munuaissairauksissa.
Maksan vajaatoiminta
Ei ole tehty tutkimuksia, joissa arvioidaan etonogestreelia/etinyyliestradiolia sisältävän -renkaan farmakokinetiikkaa maksasairauksissa. Steroidihormonit saattavat kuitenkin metaboloitua huonosti naisilla, joilla on maksan vajaatoimintaa.
Etniset ryhmät
Ei ole tehty muodollisia tutkimuksia, joissa arvioidaan etnisten ryhmien farmakokinetiikkaa.
Prekliiniset tiedot turvallisuudesta
Etinyyliestradiolia ja etonogestreelia koskeva prekliininen aineisto (perinteiset farmakologiset turvallisuus-, toistoannoksen toksisuus -, genotoksisuus-, karsinogeenisyys- ja lisääntymistoksikologiset tutkimukset) ei anna aihetta epäilyille aiemmin tuntemattomista vaaroista ihmisille.
Ympäristöön kohdistuvien riskien arviointi
Tutkimukset ympäristöön kohdistuvien riskien arvioinnista ovat osoittaneet, että 17α-etinyyliestradiolista ja etonogestreelistä saattaa olla vaaraa pintavesien eliöille (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Etyleenivinyyliasetaattikopolymeeri (28 % vinyyliasetaattia)
Polyuretaani
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ORNIBEL depotlääkevalmiste, emättimeen
0,120/0,015 mg/24 h (L:ei) 3 kpl (34,56 €)
PF-selosteen tieto
Pussi, jossa on yksi Ornibel-rengas. Pussi on valmistettu PET/Alumiiini/LDPE:stä. Pussi suojaa valolta ja kosteudelta. Pussi on pakattu painettuun pahvikoteloon yhdessä pakkausselosteen ja naisten kalenteriin liitettävien tarrojen kanssa. Tarrat laitetaan kalenteriin muistuttamaan päivistä milloin rengas tulee asettaa ja milloin poistaa.
Yksi pahvipakkaus sisältää 1, 3 tai 6 rengasta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Ornibel on joustava, läpinäkyvä ja väritön tai lähes väritön rengas, jonka ulkohalkaisija on 54 mm ja poikkileikkauksen halkaisija 4 mm.
Käyttö- ja käsittelyohjeet
Ks. kohta Annostus ja antotapa.
Ornibel on asetettava viimeistään kuukautta ennen viimeistä käyttöpäivää, joka on merkitty pahvikoteloon ”EXP”. Viimeinen käyttöpäivä tarkoittaa kyseisen kuukauden viimeistä päivää.
Tämä lääkevalmiste voi olla haitallinen ympäristölle (ks. kohta Prekliiniset tiedot turvallisuudesta). Käytetty Ornibel-rengas laitetaan pussiinsa, joka suljetaan kunnolla. Suljettu pussi on hävitettävä normaalin kotitalousjätteen mukana tai se viedään takaisin apteekkiin hävitettäväksi paikallisten vaatimusten mukaisesti. Käyttämätön (tai vanhentunut) Ornibel-rengas on hävitettävä paikallisten vaatimusten mukaisesti. Ornibel-rengasta ei saa huuhtoa alas WC:stä eikä hävittää jäteveden mukana.
Korvattavuus
ORNIBEL depotlääkevalmiste, emättimeen
0,120/0,015 mg/24 h 3 kpl
- Ei korvausta.
ATC-koodi
G02BB01
Valmisteyhteenvedon muuttamispäivämäärä
11.12.2024
Yhteystiedot
Strandvägen 7 A
114 56 Stockholm
Sweden
