TALZENNA kapsel, hård 0,25 mg, 1 mg
Kvalitativ och kvantitativ sammansättning
Talzenna 0,1 mg hårda kapslar
Varje hård kapsel innehåller talazoparibtosylat motsvarande 0,1 mg talazoparib.
Talzenna 0,25 mg hårda kapslar
Varje hård kapsel innehåller talazoparibtosylat motsvarande 0,25 mg talazoparib.
Talzenna 0,35 mg hårda kapslar
Varje hård kapsel innehåller talazoparibtosylat motsvarande 0,35 mg talazoparib.
Talzenna 0,5 mg hårda kapslar
Varje hård kapsel innehåller talazoparibtosylat motsvarande 0,5 mg talazoparib.
Talzenna 1 mg hårda kapslar
Varje hård kapsel innehåller talazoparibtosylat motsvarande 1 mg talazoparib.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Hård kapsel (kapsel).
Kliniska uppgifter
Terapeutiska indikationer
Bröstcancer
Talzenna är indicerat som monoterapi för behandling av vuxna patienter med medfödd BRCA1/2- mutation som har HER2-negativ lokalt avancerad eller metastaserad bröstcancer. Patienter ska tidigare ha behandlats med en antracyklin och/eller en taxan som (neo)adjuvant behandling, för lokalt avancerad eller metastaserande cancer, såvida inte patienterna var olämpliga för dessa behandlingar (se avsnitt Farmakodynamiska egenskaper). Patienter med hormonreceptorpositiv (HR-positiv) bröstcancer ska ha fått tidigare endokrinbaserad behandling, eller ha bedömts som olämpliga för endokrinbaserad behandling.
Prostatacancer
Talzenna är indicerat i kombination med enzalutamid för behandling av vuxna patienter med metastaserad kastrationsresistent prostatacancer (mCRPC) för vilka kemoterapi inte är kliniskt indicerat.
Villkor
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Dosering och administreringssätt
Behandling med Talzenna ska sättas in och övervakas av läkare med erfarenhet av användning av cancerläkemedel.
Patienturval
Bröstcancer
Beslut om behandling med Talzenna för patienter med bröstcancer, ska baseras på förekomsten av skadliga eller misstänkt skadliga medfödda BRCA-mutationer, fastställt med en validerad testmetod av ett rutinerat laboratorium.
I tillämpliga fall ska patienter med BRCA-mutationer erhålla genetisk rådgivning enligt lokala rutiner.
Prostatacancer
Det finns inga krav på mutationstestning av tumörer för urval av patienter med mCRPC vid behandling med Talzenna.
Dosering
Talzenna som monoterapi (bröstcancer)
Rekommenderad dos är 1 mg talazoparib en gång dagligen. Patienterna ska behandlas fram till sjukdomsprogression eller oacceptabel toxicitet.
Talzenna i kombination med enzalutamid (prostatacancer)
Rekommenderad dos är 0,5 mg talazoparib i kombination med 160 mg enzalutamid en gång dagligen. Patienterna ska behandlas fram till sjukdomsprogression eller oacceptabel toxicitet.
Medicinsk kastration med LHRH-analog (hormon som frisätter luteiniserande hormon) ska fortsätta under behandling av patienter som inte har genomgått kirurgisk kastration.
Se den fullständiga produktinformationen för enzalutamid för rekommenderad dosering.
Missad dos
Om patienten kräks eller missar en dos Talzenna ska ingen extra dos tas. Nästa ordinerade dos ska tas vid vanlig tid.
Dosjustering
Biverkningar hanteras genom avbruten behandling eller dosminskning, baserat på allvarlighetsgrad och klinisk bild (se tabell 1). Rekommenderade dosminskningsnivåer för talazoparib som monoterapi (bröstcancer) och för talazoparib i kombination med enzalutamid (prostatacancer) redovisas i tabell 2 respektive tabell 3.
Komplett blodstatus ska tas innan behandling med talazoparib inleds och därefter kontrolleras varje månad samt på kliniska indikationer (se tabell 1 och avsnitt Varningar och försiktighet).
Tabell 1.Dosjusteringar på grund av biverkningar
| Gör uppehåll med Talzenna tills värdena återgått till | Återuppta Talzenna | |
| Hemoglobin < 80 g/L | ≥ 90 g/l | Återuppta Talzenna med nästa lägre dos |
| Trombocyter < 50 x 109/L | ≥ 75 109/L | |
| Neutrofiler < 1,0 x 109/L | ≥ 1,5 109/L | |
| Icke-hematologisk biverkning grad 3 eller grad 4 | ≤ Grad 1 | Överväg att återuppta Talzenna med nästa lägre dos eller utsättning |
Tabell 2. Dosminskningsnivåer för talazoparib som monoterapi (bröstcancer)
| Dosnivå talazoparib (bröstcancer) | |
| Rekommenderad startdos | 1 mg en gång dagligen |
| Första dosminskningen | 0,75 mg en gång dagligen |
| Andra dosminskningen | 0,5 mg en gång dagligen |
| Tredje dosminskningen | 0,25 mg en gång dagligen |
Tabell 3. Dosminskningsnivåer för talazoparib i kombination med enzalutamid (prostatacancer)
| Dosnivå talazoparib (prostatacancer) | |
| Rekommenderad startdos | 0,5 mg en gång dagligen |
| Första dosminskningen | 0,35 mg en gång dagligen |
| Andra dosminskningen | 0,25 mg en gång dagligen |
| Tredje dosminskningen | 0,1 mg en gång dagligen |
Se den fullständiga produktinformationen för enzalutamid för dosjustering på grund av biverkningar kopplade till enzalutamid.
Kapseln med 0,1 mg är avsedd att användas som stöd vid dosjusteringar och är inte utbytbar mot andra styrkor.
Samtidig behandling med hämmare av P-glykoprotein (P‑gp)
Talzenna som monoterapi (bröstcancer)
Starka hämmare av P‑gp kan öka exponeringen för talazoparib. Samtidig användning av starka P‑gp-hämmare under behandling med talazoparib ska undvikas. Samtidig användning ska endast övervägas efter noggrann nytta-risk-bedömning. Om samtidig administrering av en stark P‑gp-hämmare inte kan undvikas ska dosen av Talzenna reduceras till närmaste lägre dos. När den starka P‑gp-hämmaren sätts ut ska dosen av Talzenna ökas (efter 3–5 halveringstider för P‑gp-hämmaren) till den dos som användes innan den starka P‑gp-hämmaren sattes in (se avsnitt Interaktioner).
Talzenna i kombination med enzalutamid (prostatacancer)
Effekten av samtidig administrering av P‑gp-hämmare på exponeringen för talazoparib när talazoparib ges i kombination med enzalutamid har inte studerats. Samtidig användning av P‑gp-hämmare under behandling med talazoparib ska därför undvikas (se avsnitt Interaktioner).
Särskilda populationer
Nedsatt leverfunktion
Ingen dosjustering krävs för patienter med lätt nedsatt leverfunktion (totalt bilirubin ≤ 1 x övre normalgränsen [ULN] och aspartataminotransferas [ASAT] > ULN, eller totalt bilirubin > 1,0 till 1,5 x ULN oavsett ASAT), måttlig leverfunktionsnedsättning (totalt bilirubin > 1,5 till 3,0 x ULN oavsett ASAT) eller grav leverfunktionsnedsättning (totalt bilirubin > 3,0 x ULN oavsett ASAT) (se avsnitt Farmakokinetiska egenskaper). Talzenna i kombination med enzalutamid är inte rekommenderat för användning hos patienter med grav leverfunktionsnedsättning (Child-Pugh-klass C), eftersom farmakokinetik och säkerhet inte har fastställts för dessa patienter (se avsnitt Farmakokinetiska egenskaper).
Nedsatt njurfunktion
Bröstcancer
Ingen dosjustering krävs för patienter med lätt nedsättning av njurfunktionen (kreatininclearance [CrCL] ≥ 60 ml/min till < 90 ml/min). Till patienter med måttligt nedsatt njurfunktion (CrCL ≥ 30 ml/min till < 60 ml/min) är den rekommenderade startdosen för Talzenna 0,75 mg en gång dagligen. För patienter med gravt nedsatt njurfunktion (CrCL ≥ 15 ml/min till < 30 ml/min) är den rekommenderade startdosen för Talzenna 0,5 mg en gång dagligen. Talzenna har inte studerats hos patienter med CrCL < 15 ml/min eller patienter som kräver hemodialys (se avsnitt Farmakokinetiska egenskaper).
Prostatacancer
Ingen dosjustering krävs för patienter med lätt nedsättning av njurfunktionen (kreatininclearance [CrCL] ≥ 60 ml/min till < 90 ml/min). Till patienter med måttligt nedsatt njurfunktion (CrCL ≥ 30 ml/min till < 60 ml/min) är den rekommenderade startdosen för Talzenna 0,35 mg en gång dagligen i kombination med enzalutamid oralt en gång dagligen. För patienter med gravt nedsatt njurfunktion (CrCL ≥ 15 ml/min till < 30 ml/min) är den rekommenderade dosen för Talzenna 0,25 mg en gång dagligen i kombination med enzalutamid en gång dagligen. Talzenna har inte studerats hos patienter med CrCL < 15 ml/min eller patienter som kräver hemodialys (se avsnitt Farmakokinetiska egenskaper).
Äldre
Ingen dosjustering krävs för äldre patienter (≥ 65 år) (se avsnitt Farmakokinetiska egenskaper).
Pediatrisk population
Säkerhet och effekt för Talzenna för barn och ungdomar < 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Talzenna är avsett för oral användning. För att inte komma i kontakt med kapselinnehållet ska kapslarna sväljas hela. De får inte öppnas eller lösas upp. Kapslarna kan tas med eller utan mat (se avsnitt Farmakokinetiska egenskaper)
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Amning (se avsnitt Fertilitet, graviditet och amning).
Varningar och försiktighet
Myelosuppression
Myelosuppression med anemi, leukopeni/neutropeni och/eller trombocytopeni, har rapporterats hos patienter som behandlas med talazoparib (se avsnitt Biverkningar). Behandling med talazoparib ska inte inledas förrän patienterna återhämtat sig från hematologiska biverkningar av tidigare behandling (≤ grad 1).
Försiktighetsåtgärder ska vidtas för rutinmässig övervakning av hematologiska parametrar och tecken och symtom på anemi, leukopeni/neutropeni och/eller trombocytopeni hos patienter som får talazoparib. Vid sådana händelser rekommenderas dosändring (minskning eller avbrott) (se avsnitt Dosering och administreringssätt). Understödjande vård med eller utan blod- och/eller trombocyttransfusion och/eller administrering av kolonistimulerande faktorer kan användas om så bedöms lämpligt.
Myelodysplastiskt syndrom/akut myeloisk leukemi
Myelodysplastiskt syndrom/akut myeloisk leukemi (MDS/AML) har rapporterats hos patienter som får poly(adenosindifosfatribos)polymeras (PARP)-hämmare, såsom talazoparib. Totalt har MDS/AML rapporterats hos < 1 % av patienter med solida tumörer som behandlades med talazoparib i kliniska studier (se avsnitt Biverkningar). Möjliga bidragande faktorer för utveckling av MDS/AML är tidigare platinainnehållande kemoterapi, andra substanser som skadar DNA, eller strålbehandling. Komplett blodstatus ska tas vid baslinjen och kontrolleras varje månad avseende tecken på hematologisk toxicitet under behandlingen. Vid bekräftad MDS/AML ska talazoparib sättas ut.
Venösa tromboemboliska händelser
Hos patienter med mCRPC observerades en högre incidens av venösa tromboemboliska händelser med Talzenna i kombination med enzalutamid jämfört med endast enzalutamid. Patienter ska övervakas avseende kliniska tecken och symtom på djup ventrombos och lungembolism och behandlas på medicinskt lämpligt sätt (se avsnitt Biverkningar).
Preventivmedel för fertila kvinnor
Talazoparib var klastogent i en invitro-analys av kromosomavvikelser i lymfocyter i perifert blod hos människa och i en in vivo-analys av mikronuklei i benmärg hos råtta, dock var det inte mutagent i Ames test (se avsnitt Prekliniska säkerhetsuppgifter). Talazoparib kan orsaka fosterskador om det ges till en gravid kvinna. Gravida kvinnor ska informeras om den potentiella risken för fostret (se avsnitt Fertilitet, graviditet och amning). Fertila kvinnor ska inte bli gravida medan de tar Talzenna och ska inte vara gravida när behandlingen inleds. Alla fertila kvinnor ska graviditetstestas före behandlingen.
En mycket effektiv preventivmetod måste användas av kvinnliga patienter under behandlingen med Talzenna och i minst 7 månader efter avslutad behandling. Eftersom användning av hormonella preventivmedel inte rekommenderas hos patienter med bröstcancer bör två icke-hormonella och kompletterande preventivmedel användas (se avsnitt Fertilitet, graviditet och amning).
Manliga patienter som har en fertil kvinnlig partner ska uppmanas att använda en effektiv preventivmetod (även efter vasektomi) under behandlingen med Talzenna och i minst 4 månader efter den sista dosen.
Interaktioner
Talazoparib är substrat för läkemedelstransportproteinerna P-gp och bröstcancerresistensprotein (BCRP) och elimineras främst i oförändrad form genom renal clearance.
Substanser som kan påverka plasmakoncentrationen av talazoparib
P-gp-hämmare
Effekt av enzalutamid
Samtidig administrering av 160 mg enzalutamid ökar exponeringen för talazoparib ungefär 2-faldigt. Vid administrering av talazoparib 0,5 mg dagligen i kombination med enzalutamid uppnås ungefär samma dalvärde för koncentrationen vid steady state (Ctrough) som den som har rapporterats för talazoparib 1 mg dagligen (se avsnitt Farmakokinetiska egenskaper). När Talzenna administreras samtidigt som enzalutamid är startdosen för Talzenna 0,5 mg (se avsnitt Dosering och administreringssätt). Interaktionseffekten av andra doser än 160 mg enzalutamid på talazoparib har inte kvantifierats.
Effekten av samtidig administrering av andra P‑gp-hämmare på exponeringen för talazoparib när talazoparib ges i kombination med enzalutamid har inte studerats. Om samtidig administrering av P‑gp-hämmare inte kan undvikas när Talzenna ges med enzalutamid ska patienten övervakas avseende eventuella ökade biverkningar.
Effekt av andra P‑gp-hämmare
Data från en läkemedelsinteraktionsstudie på patienter med avancerade solida tumörer visade att samtidig administrering av multipla dagliga doser av itrakonazol, en P-gp-hämmare, i dosen 100 mg två gånger dagligen, och en engångsdos talazoparib 0,5 mg, ökade exponeringen för talazoparib (AUCinf) med ca 56 % och max-koncentrationen (Cmax) med ca 40 %, jämfört med när enbart en engångsdos talazoparib 0,5 mg administreras. Populationsfarmakokinetisk (PK) analys har också visat att samtidig användning av starka P-gp-hämmare ökade exponeringen för talazoparib med 45 % jämfört med när enbart talazoparib administrerades.
Samtidig användning av starka P-gp-hämmare (bland andra amiodaron, karvedilol, klaritromycin, kobicistat, darunavir, dronedaron, erytromycin, indinavir, itrakonazol, ketokonazol, lapatinib, lopinavir, propafenon, kinidin, ranolazin, ritonavir, sakvinavir, telaprevir, tipranavir och verapamil) ska undvikas. Om samtidig administrering av en stark P-gp-hämmare inte kan undvikas ska Talzenna-dosen reduceras (se avsnitt Dosering och administreringssätt).
P-gp-inducerare
Data från en läkemedelsinteraktionsstudie på patienter med avancerade solida tumörer visade att samtidig administrering av en engångsdos talazoparib 1 mg och multipla dagliga doser av 600 mg rifampin, en P-gp-inducerare, där rifampin administrerades samma dag som talazoparib men 30 minuter före talazoparibdosen, ökade Cmax för talazoparib med cirka 37 % medan AUCinf inte förändrades jämfört med när enbart en engångsdos talazoparib 1 mg administrerades. Detta är förmodligen nettoeffekten av både P-gp-induktion och -inhibition av rifampin under de testade tillstånden i läkemedelsinteraktionsstudien. Dosen av talazoparib behöver inte justeras vid administrering samtidigt med rifampin. Dock har effekten av andra P-gp-inducerare på exponeringen av talazoparib inte studerats. Andra P-gp-inducerare (bland andra karbamazepin, fenytoin och johannesört) kan minska exponeringen för talazoparib.
BCRP-hämmare
Effekten av BCRP-hämmare på talazoparibs farmakokinetik har inte studerats in vivo. Samtidig administrering av talazoparib och BCRP-hämmare kan öka exponeringen för talazoparib. Samtidig användning av starka BCRP-hämmare (bland andra kurkumin och cyklosporin) ska undvikas. Om samtidig administrering av starka BCRP-hämmare inte kan undvikas ska patienten övervakas avseende eventuella ökade biverkningar.
Effekt av syrareducerande preparat
Populationsfarmakokinetisk analys visar att samtidig administrering av syrareducerande preparat såsom protonpumphämmare och histamin-2-receptor-antagonister (H2RA), samt andra syrareducerande preparat, inte har någon signifikant inverkan på absorptionen av talazoparib.
Systemiska hormonella preventivmedel
Läkemedelsinteraktionsstudier mellan talazoparib och orala preventivmedel har inte genomförts.
Fertilitet, graviditet och amning
Fertila kvinnor/preventivmedel till män och kvinnor
Fertila kvinnor ska inte bli gravida medan de tar Talzenna och ska inte vara gravida när behandlingen inleds. Alla fertila kvinnor ska graviditetstestas före behandlingen (se avsnitt Varningar och försiktighet).
Fertila kvinnor måste använda en mycket effektiv preventivmetod (se avsnitt Varningar och försiktighet) innan behandlingen med talazoparib startar, under behandlingen och i minst 7 månader efter avslutad behandling med talazoparib. Eftersom användning av hormonella preventivmedel inte rekommenderas hos patienter med bröstcancer ska två icke-hormonella och kompletterande preventivmedel användas. Manliga patienter som har en fertil kvinnlig partner ska uppmanas att använda ett effektivt preventivmedel (även efter vasektomi) under behandlingen med Talzenna och i minst 4 månader efter den sista dosen (se avsnitt Varningar och försiktighet).
Graviditet
Det finns inga data från användningen av Talzenna hos gravida kvinnor. Data från djurstudier har visat embryofetal toxicitet (se avsnitt Prekliniska säkerhetsuppgifter). Talzenna kan orsaka fosterskador när det ges till en gravid kvinna. Talzenna rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel (se avsnitt Varningar och försiktighet).
Amning
Det är okänt om talazoparib utsöndras i bröstmjölk. En risk för barn som ammas kan inte uteslutas och amning är därför kontraindicerat (se avsnitt Kontraindikationer) under behandling med Talzenna och i minst 1 månad efter den sista dosen.
Fertilitet
Det finns ingen information om fertiliteten hos patienter. Baserat på icke kliniska fynd i testiklar (partiellt reversibla) och äggstockar (reversibla) kan Talzenna försämra fertiliteten hos fertila män (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Talzenna har en mindre effekt på förmågan att framföra fordon och använda maskiner. Trötthet/asteni eller yrsel kan uppträda efter administrering av talazoparib.
När Talzenna ges i kombination med enzalutamid, se även den fullständiga produktinformationen för enzalutamid för effekterna av enzalutamid på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Den övergripande säkerhetsprofilen för Talzenna baseras på sammanslagna data för 1 088 patienter, varav 690 patienter som fick talazoparib 1 mg dagligen som monoterapi i kliniska studier för behandling av solida tumörer och 398 patienter med mCRPC som fick talazoparib 0,5 mg i kombination med enzalutamid 160 mg i studien TALAPRO-2.
De vanligaste biverkningarna (≥ 20 %) hos patienter som fick talazoparib i dessa kliniska studier var anemi (55,6 %), trötthet (52,5 %), illamående (35,8 %), neutropeni (30,3 %), trombocytopeni (25,2 %) och nedsatt aptit (21,1 %). De vanligaste biverkningarna av grad ≥ 3 (≥ 10 %) som orsakades av talazoparib var anemi (39,2 %), neutropeni (16,5 %) och trombocytopeni (11,1 %).
Dosjustering (dosminskning eller behandlingsavbrott) på grund av en biverkning krävdes för 58,7 % av patienterna som fick Talzenna 1 mg som monoterapi. De vanligaste biverkningarna som ledde till dosjustering var anemi (33,5 %), neutropeni (11,7 %) och trombocytopeni (9,9 %). Permanent utsättning på grund av biverkningar krävdes för 2,9 % av patienterna som fick Talzenna; den vanligaste var anemi (0,6 %). Mediantiden för exponering var 5,6 månader (intervall 0,0–70,2).
Behandlingsavbrott med Talzenna på grund av biverkningar förekom hos 62,1 % av patienterna med mCRPC som fick Talzenna i kombination med enzalutamid; den vanligaste var anemi (44 %). Dosminskningar med Talzenna på grund av biverkningar förekom hos 52,8 % av patienterna; den vanligaste var anemi (43,2 %). Permanent utsättning av Talzenna på grund av biverkningar förekom hos 18,8 % av patienterna; den vanligaste var anemi (8,3 %). Mediantiden för exponering för talazoparib var 86 veckor (intervall 0,29–186,14).
Tabell över biverkningar
Biverkningarna sammanfattas i tabell 4 baserat på sammanslagna data, indelade efter organsystem och frekvens. Frekvenskategorierna definieras som följer: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10) och mindre vanliga (≥ 1/1 000, < 1/100). Inom varje frekvensgrupp presenteras biverkningarna efter fallande allvarlighetsgrad.
Tabell 4.Biverkningar baserade på sammanslagna data från åtta studier (N=1 088)
Organsystem Frekvens Rekommenderad term | Alla grader n (%) | Grad 3 n (%) | Grad 4 n (%) |
| Neoplasier; benigna, maligna och ospecificerade tumörer (inkl. cystor och polyper) | |||
Mindre vanliga Myelodysplastiskt syndrom/akut myeloisk leukemia | 2 (0,2) | 1 (< 0,1) | 1 (< 0,1) |
| Blodet och lymfsystemet | |||
| Mycket vanliga | |||
Trombocytopenib Anemic Neutropenid Leukopenie | 274 (25,2) 605 (55,6) 330 (30,3) 195 (17,9) | 88 (8,1) 411 (37,8) 163 (15,0) 52 (4,8) | 33 (3,0) 16 (1,5) 17 (1,6) 2 (0,2) |
Vanliga Lymfopenif | 88 (8,1) | 37 (3,4) | 4 (0,4) |
| Metabolism och nutrition | |||
Mycket vanliga Nedsatt aptit | 230 (21,1) | 11 (1,0) | 0 (0,0) |
| Centrala och perifera nervsystemet | |||
Mycket vanliga Yrsel Huvudvärk | 157 (14,4) 207 (19,0) | 4 (0,4) 8 (0,7) | 1 (< 0,1) Ej tillämpl. |
Vanliga Dysgeusi | 68 (6,3) | 0 (0,0) | 0 (0,0) |
Blodkärl Vanliga Venös tromboembolism*g | 36 (3,3 %) | 23 (2,1 %) | 2 (0,2 %) |
| Magtarmkanalen | |||
Mycket vanliga Kräkningar Diarré Illamående Buksmärtorh | 167 (15,3) 205 (18,8) 389 (35,8) 162 (14,9) | 9 (0,8) 4 (0,4) 10 (0,9) 12 (1,1) | 0 (0,0) 0 (0,0) Ej tillämpl. Ej tillämpl. |
Vanliga Stomatit Dyspepsi | 54 (5,0) 69 (6,3) | 0 (0,0) 0 (0,0) | 0 (0,0) Ej tillämpl. |
Hud och subkutan vävnad Mycket vanliga Alopeci | 189 (17,4) | Ej tillämpl. | Ej tillämpl. |
Allmänna symtom och/eller symtom vid administreringsstället Mycket vanliga Tröttheti | 571 (52,5) | 58 (5,3) | Ej tillämpl. |
Förkortningar: n = antal patienter
* Biverkningar av grad 5 har rapporterats.
a. Se även avsnitt Varningar och försiktighet.
b. Omfattar de rekommenderade termerna trombocytopeni och sänkt antal trombocyter.
c. Omfattar de rekommenderade termerna anemi, sänkt hematokrit, sänkt hemoglobin och minskat antal röda blodkroppar.
d. Omfattar de rekommenderade termerna neutropeni och sänkt antal neutrofiler.
e. Omfattar de rekommenderade termerna leukopeni och sänkt antal vita blodkroppar.
f. Omfattar de rekommenderade termerna sänkt antal lymfocyter samt lymfopeni.
g. Omfattar de rekommenderade termerna lungembolism, djup ventrombos, venös embolism och venös trombos. Se även avsnitt Varningar och försiktighet.
h. Omfattar de rekommenderade termerna buksmärta, övre buksmärta, besvär från buken och nedre buksmärta.
i. Omfattar de rekommenderade termerna trötthet och asteni.
Beskrivning av utvalda biverkningar
Myelosuppression
Biverkningar relaterade till myelosuppression, såsom anemi, neutropeni och trombocytopeni, rapporterades som mycket vanliga hos patienter som behandlades med talazoparib. Biverkningar av grad 3 och grad 4 relaterade till myelosuppression rapporterades enligt följande: anemi hos 37,8 % resp. 1,5 % av patienterna, neutropeni hos 15,0 % resp. 1,6 % och trombocytopeni hos 8,1 % resp. 3,0 %. Inga dödsfall på grund av biverkningar relaterade till myelosuppression rapporterades.
I monoterapistudier (population som fick 1 mg/dag) var de vanligaste myelosuppressionsrelaterade biverkningarna associerade med dosjustering, anemi (33,5 %), neutropeni (11,7 %) och trombocytopeni (9,9 %) som rapporterades hos upp till 30 % av patienterna i populationen som fick talazoparib 1 mg/dag. Den biverkning som var associerad med permanent utsättning av studieläkemedlet var anemi som rapporterades hos 0,6 % av patienterna.
Hos patienter med mCRPC som behandlades med talazoparib i kombination med enzalutamid ledde anemi till behandlingsavbrott med talazoparib hos 44,0 % av patienterna, sänkt antal neutrofiler hos 13,6 % och sänkt antal trombocyter hos 7,8 %. Totalt behövde 42,5 % av patienterna blodtransfusioner. Den vanligaste typen av blodtransfusion var med erytrocytkoncentrat, 39,2 %. Utsättning på grund av anemi, neutropeni och trombocytopeni förekom hos 8,3 %, 3,3 % respektive 0,5 % av patienterna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Erfarenheterna av överdosering av talazoparib är begränsade. Inga biverkningar rapporterades hos en patient som oavsiktligt tog trettio kapslar à 1 mg talazoparib dag 1 och omedelbart behandlades med gastrisk dekontaminering (till exempel genom kräkningar eller ventrikelsköljning). Symtomen på överdosering har inte fastställts. Vid överdosering ska behandlingen med talazoparib avbrytas. Läkaren ska överväga gastrisk dekontaminering, sätta in allmänna understödjande åtgärder och ge symtomatisk behandling.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: antineoplastiska medel, övriga antineoplastiska medel, ATC-kod: L01XK04
Verkningsmekanism
Talazoparib är en hämmare av PARP-enzymer, PARP1 (IC50 = 0,7 nM) och PARP2 (IC50 = 0,3 nM). PARP-enzymerna är involverade i signalvägarna för respons på cellulära DNA-skador, såsom DNA-reparation, gentranskription och celldöd. PARP-hämmare (PARPi) utövar cytotoxiska effekter på cancerceller genom två mekanismer: hämning av PARP-enzymernas katalytiska aktivitet samt ”PARP-trapping”, varvid PARP-protein bundet till en PARP-hämmare hindras från att snabbt dissociera från en DNA-skada. På det sättet förhindras DNA-reparation, replikation och transkription, vilket resulterar i apoptos och/eller celldöd. Behandling av cancercellinjer som har defekter i de gener som reparerar DNA, när talazoparib används som enda substans, leder till ökade nivåer av gamma-H2AX, en markör för DNA med dubbelsträngsbrott, och resulterar i minskad cellproliferation och ökad apoptos. Talazoparibs aktivitet mot tumörer observerades även i en modell med ett patientderiverat xenograft (PDX) av BRCA-muterad bröstcancer där patienten tidigare fått en platinabaserad behandling samt en modell med ett xenograft av androgenreceptorpositiv (AR-positiv) prostatacancer. I dessa PDX-modeller minskade talazoparib tumörtillväxten och ökade halten γH2AX samt apoptos i tumörerna.
Effekten mot tumörer vid kombinerad hämning av PARP- och AR-aktiviteten baseras på följande mekanismer: Hämningen av AR-signaleringen supprimerar uttrycket av homologa rekombinationsreparationsgener (HRR-gener), inklusive BRCA1, vilket leder till känslighet för PARP-hämning. PARP1-aktivitet har visats vara nödvändig för maximal AR-funktion; hämning av PARP kan därmed minska AR-signaleringen och öka känsligheten för hämmare av AR-signaleringen. Klinisk resistens mot AR-blockad är ibland förknippad med deletion av både RB1 och BRCA2, vilket i sin tur är förknippat med känslighet för PARP-hämning.
Hjärtats elektrofysiologi
Effekten av talazoparib på hjärtats repolarisation undersöktes med tidsmatchade elektrokardiogram (EKG) genom analys av sambandet mellan förändringen av QT-intervallet korrigerat för hjärtfrekvens (QTc) från baslinjen och motsvarande talazoparibkoncentration i plasma hos 37 patienter med avancerade solida tumörer. Talazoparib hade inte någon kliniskt relevant QTc-förlängande effekt vid den högsta rekommenderade monoterapidosen på 1 mg dagligen.
Klinisk effekt och säkerhet
Medfödd BRCA-muterad (gBRCAm) HER2-negativ lokalt avancerad eller metastaserande bröstcancer
EMBRACA-studien
EMBRACA var en öppen, randomiserad, multicenterstudie med två parallella armar där man jämförde Talzenna med kemoterapi (kapecitabin, eribulin, gemcitabin, vinorelbin) hos patienter med medfödd BRCA‑muterad HER2‑negativ lokalt avancerad eller metastaserande bröstcancer som fått högst tre tidigare cytotoxiska kemoterapiregimer för sin metastaserande eller lokalt avancerade sjukdom. Patienterna måste tidigare ha behandlats med en antracyklin och/eller en taxan (såvida dessa inte var kontraindicerade) som neoadjuvant eller adjuvant behandling och/eller vid metastaser. Patienter som tidigare behandlats med platina för framskriden sjukdom fick inte ha några tecken på sjukdomsprogression under platinabehandlingen. Patienterna fick inte tidigare ha behandlats med PARPi.
Av de 431 patienterna som randomiserades i EMBRACA-studien hade 408 (95 %) en skadlig eller misstänkt skadlig medfödd BRCA-mutation, centralt bekräftad med en analys i den kliniska studien. Av dessa bekräftades 354 (82 %) med användning av BRACAnalysis CDx. BRCA-mutationsstatus (positivt resultat för bröstcancergen 1 [BRCA1] eller bröstcancergen 2 [BRCA2]) var densamma i båda behandlingsarmarna.
Totalt randomiserades 431 patienter i förhållandet 2:1 till att få Talzenna kapslar à 1 mg en gång dagligen eller kemoterapi med standarddoser fram till sjukdomsprogression eller oacceptabel toxicitet. Av de 431 patienterna som randomiserades i EMBRACA fick 287 Talzenna och 144 fick kemoterapi. Randomiseringen stratifierades efter tidigare kemoterapi för metastaserande sjukdom (0 respektive 1, 2 eller 3), trippelnegativ sjukdomsstatus (trippelnegativ bröstcancer [TNBC] resp. icke-TNBC), och anamnes på metastaser i centrala nervsystemet (ja eller nej).
Patientdemografi, baslinjevärde och sjukdomskaraktäristika var generellt lika mellan studiearmarna (se tabell 5).
| Tabell 5. Demografi, baslinjevärden och sjukdomskaraktäristika – EMBRACA-studien | ||
Talazoparib (N = 287) | Kemoterapi (N = 144) | |
| Medianålder (år [intervall]) | 45,0 (27,0; 84,0) | 50,0 (24,0; 88,0) |
| Åldersgrupp (år), n (%) | ||
| < 50 | 182 (63,4 %) | 67 (46,5 %) |
| 50 till < 65 | 78 (27,2 %) | 67 (46,5 %) |
| ≥ 65 | 27 (9,4 %) | 10 (6,9 %) |
| Kön, n (%) | ||
| Kvinnor | 283 (98,6 %) | 141 (97,9 %) |
| Män | 4 (1,4 %) | 3 (2,1 %) |
| Etnicitet, n (%) | ||
| Asiatisk | 31 (10,8 %) | 16 (11,1 %) |
| Mörkhyade eller afroamerikaner | 12 (4,2 %) | 1 (0,7 %) |
| Vita | 192 (66,9 %) | 108 (75,0 %) |
| Övriga | 5 (1,7 %) | 1 (0,7 %) |
| Ej angivet | 47 (16,4 %) | 18 (12,5 %) |
| ECOG-funktionsstatus, n (%) | ||
| 0 | 153 (53,3 %) | 84 (58,3 %) |
| 1 | 127 (44,3 %) | 57 (39,6 %) |
| 2 | 6 (2,1 %) | 2 (1,4 %) |
| Saknas | 1 (0,3 %) | 1 (0,7 %) |
| Hormonreceptorstatus, n (%) | ||
| HER2-positiva | 0 (0,0 %) | 0 (0,0 %) |
| Trippelnegativa | 130 (45,3 %) | 60 (41,7 %) |
| Hormonreceptorpositiva (ER-positiva eller PgR-positiva) | 157 (54,7 %) | 84 (58,3 %) |
| BRCA-status enl. bedömning av lokalt eller centralt laboratorium, n (%) | 287 (100,0 %) | 144 (100,0 %) |
| BRCA1‑mutationspositiva | 133 (46,3 %) | 63 (43,8 %) |
| BRCA2‑mutationspositiva | 154 (53,7 %) | 81 (56,3 %) |
| Tid från första bröstcancerdiagnos till diagnos av avancerad bröstcancer (år) | ||
| n | 286 | 144 |
| Median | 1,9 | 2,7 |
| Minimum, maximum | 0; 22 | 0; 24 |
| Kategorier för tid från första bröstcancerdiagnos till diagnos av avancerad bröstcancer | ||
| < 12 månader | 108 (37,6 %) | 42 (29,2 %) |
| ≥ 12 månader | 178 (62,0 %) | 102 (70,8 %) |
| Antal tidigare cytostatikabehandlingar för lokalt avancerad eller metastaserande sjukdom | ||
| Medelvärde (standardavv.) | 0,9 (1,01) | 0,9 (0,89) |
| Median | 1 | 1 |
| Minimum, maximum | 0; 4 | 0; 3 |
| Antal patienter som tidigare behandlats med cytostatika för lokalt avancerad eller metastaserande sjukdom, n (%) | ||
| 0 | 111 (38,7 %) | 54 (37,5 %) |
| 1 | 107 (37,3 %) | 54 (37,5 %) |
| 2 | 57 (19,9 %) | 28 (19,4 %) |
| 3 | 11 (3,8 %) | 8 (5,6 %) |
| ≥ 4 | 1 (0,3 %) | 0 (0,0 %) |
| Antal patienter som tidigare behandlats med följande, n (%) | ||
| Taxan | 262 (91,3 %) | 130 (90,3 %) |
| Antracyklin | 243 (84,7 %) | 115 (79,9 %) |
| Platina | 46 (16,0 %) | 30 (20,8 %) |
Förkortningar: BRCA = bröstcancergen; ER = östrogenreceptor; HER2 = human epidermal tillväxtfaktor-receptor 2; N = antal patienter; n = antal patienter i kategorin; PgR = progesteronreceptor.
Primärt effektmått i studien var progressionsfri överlevnad (PFS), utvärderad med användning av Response Evaluation Criteria in Solid Tumors (RECIST) version 1.1, bedömt vid blindad oberoende central granskning (BICR). Sekundära effektmått var objektiv responsfrekvens (ORR), total överlevnad (OS), säkerhet och farmakokinetik.
I studien påvisades en statistiskt signifikant förbättring av PFS, det primära effektmåttet, för Talzenna i jämförelse med kemoterapi. Det fanns ingen statistiskt signifikant effekt på total överlevnad vid tidpunkten för den slutliga analysen av total överlevnad. Effektdata i EMBRACA sammanfattas i tabell 6. Kaplan‑Meier‑kurvor för PFS och total överlevnad visas i figur 1 respektive figur 3.
| Tabell 6. Sammanfattning av effektresultat – EMBRACA-studien* | ||
| Talazoparib | Kemoterapi | |
| PFS enligt BICR | N=287 | N=144 |
| Händelser, antal (%) | 186 (65 %) | 83 (58 %) |
| Median (95 % KI), månader | 8,6 (7,2; 9,3) | 5,6 (4,2; 6,7) |
| Riskkvota (95 % KI) | 0,54 (0,41; 0,71) | |
| 2-sidigt p-värdeb | p <0,0001 | |
| OS (slutlig analys)c | N=287 | N=144 |
| Händelser, antal (%) | 216 (75,3 %) | 108 (75 %) |
| Median (95 % KI), månader | 19,3 (16,6; 22,5) | 19,5 (17,4; 22,4) |
| Riskkvota (95 % KI) | 0,85 (0,67; 1,07)c | |
| 2-sidigt p-värdeb | p=0,1693 | |
| Objektiv respons enl. prövarend.e | N=219 | N=114 |
| ORR, % (95 % KI) | 62,6 (55,8; 69,0) | 27,2 (19,3; 36,3) |
| Oddskvot (95 % KI) | 4,99 (2,93; 8,83) | |
| 2-sidigt p-värdef | p < 0,0001 | |
| Responsens varaktighet enl. prövarend | N=137 | N=31 |
| Median (IQR), månader | 5,4 (2,8; 11,2) | 3,1 (2,4; 6,7) |
Förkortningar: BICR = blindad oberoende central granskning, KI = konfidensintervall, CMH = Cochran-Mantel-Haenszel, CR = komplett respons, IQR = interkvartil-intervall, ITT = intent-to-treat, N = antal patienter, ORR = objektiv responsfrekvens, OS = total överlevnad, PARP = poly(adenosindifosfatribos)polymeras, PFS = progressionsfri överlevnad, PR = partiell respons, RECIST 1.1 = Response Evaluation Criteria in Solid Tumors version 1.1. * PFS, ORR och responsens varaktighet baseras på data fram till brytdatumet 15 september 2017 och en medianuppföljning för PFS på 13,0 månader (95 % KI: 11,1; 18,4) i talazoparibarmen och 7,2 månader (95 % KI: 4,6; 11,1) i kemoterapiarmen. OS baseras på data fram till brytdatumet 30 september 2019 och en medianuppföljning på 44,9 månader (95 % KI: 37,9; 47,0) i talazoparibarmen och 36,8 månader (95 % KI: 34,3; 43,0) i kemoterapiarmen. a. Riskkvoten baserades på stratifierad Cox-regressionsmodell med behandling som enda kovariat (stratifieringsfaktorer: antal tidigare cytostatikabehandlingar, trippelnegativ sjukdom, anamnes på metastaser i centrala nervsystemet) och jämfördes med total kemoterapi, där < 1 var till fördel för talazoparib. b. Stratifierat logrank-test. c. Vid tidpunkten för den slutliga OS-analysen fick 46,3 % respektive 41,7 % av patienterna som randomiserats till talazoparibarmen respektive kemoterapiarmen en efterföljande platinabehandling och 4,5 % respektive 32,6 % fick en efterföljande behandling med PARP-hämmare. d. Utfört på ITT-populationen med mätbar sjukdom som fick en objektiv respons. Frekvensen för komplett respons var 5,5 % för talazoparib och 0 % för kemoterapiarmen. e. Enligt RECIST 1.1, bekräftelse på CR/PR var inte nödvändigt. f. Stratifierat CHM-test. | ||
Figur 1. Kaplan-Meier-kurvor över PFS – EMBRACA-studien
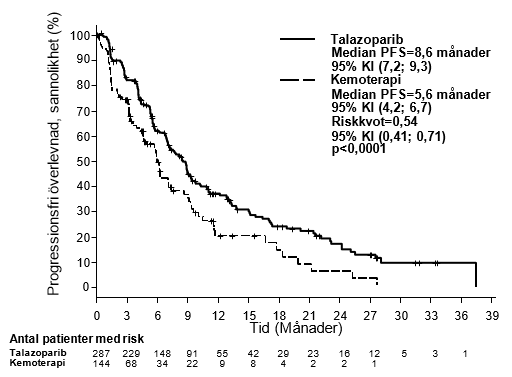
Förkortningar: KI = konfidensintervall, PFS = progressionsfri överlevnad
En serie förbestämda PFS-analyser utfördes baserat på prognostiska faktorer och egenskaper vid baslinjen, med syfte att undersöka behandlingseffektens konsekvens inom grupperna. I samtliga enskilda patientundergrupper sågs en lägre risk för sjukdomsprogression eller död i talazoparibarmen, vilket överensstämde med det totala resultatet (figur 2).
Figur 2. Träddiagram över PFS-analyser i viktiga undergrupper – EMBRACA-studien
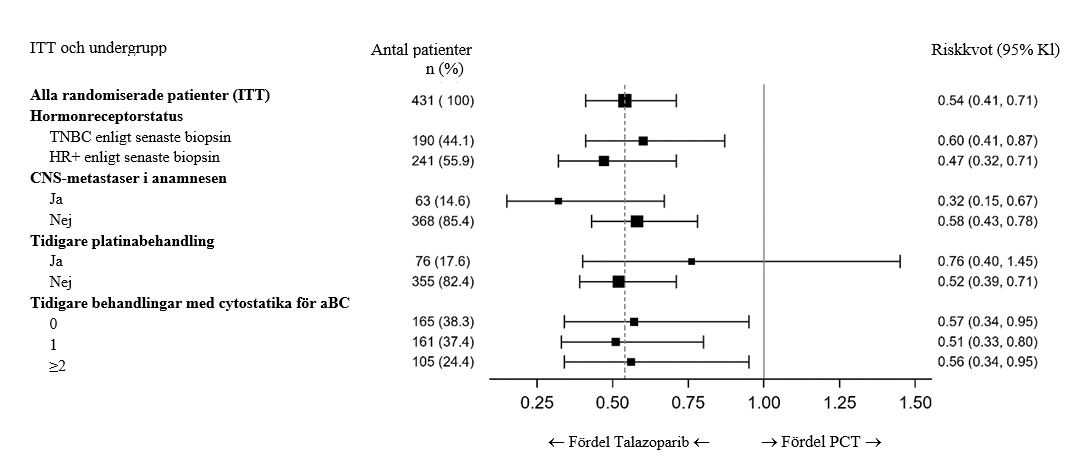
Förkortningar: aBC = avancerad bröstcancer; KI = konfidensintervall; CNS = centrala nervsystemet; HR+ = hormonreceptorpositiv; ITT = intent-to-treat; PCT = läkarens val av behandling (kemoterapi); PFS = progressionsfri överlevnad; TNBC = trippelnegativ bröstcancer
Figur 3. Kaplan-Meier-kurvor för total överlevnad – EMBRACA-studien
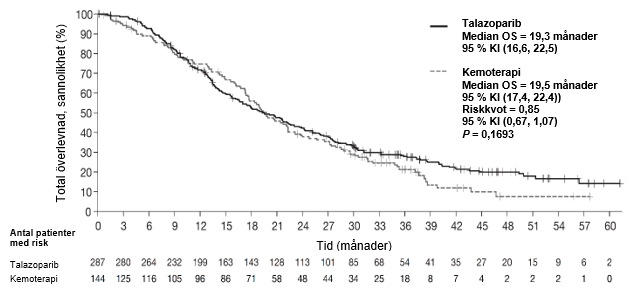
Förkortningar: KI = konfidensintervall, OS = total överlevnad.
Primäranalysens p-värde baseras på ett stratifierat logrank-test.
Metastaserad kastrationsresistent prostatacancer (mCRPC)
TALAPRO-2-studien
TALAPRO-2 var en randomiserad, dubbelblindad, placebokontrollerad studie där patienter (N = 805) med mCRPC randomiserades i förhållandet 1:1 till att få Talzenna 0,5 mg en gång dagligen i kombination med enzalutamid 160 mg en gång dagligen jämfört med en jämförelsearm som fick placebo i kombination med enzalutamid 160 mg en gång dagligen. Alla patienter fick en GnRH-analog (gonadotropinfrisättande hormon) eller hade tidigare genomgått bilateral orkiektomi och behövde ha progredierat på tidigare androgen deprivationsterapi. Tidigare behandling med abirateron eller taxanbaserad kemoterapi för metastaserad kastrationskänslig prostatacancer (mCSPC) tilläts.
Randomiseringen stratifierades efter (1) tidigare behandling med abirateron eller taxanbaserad kemoterapi jämfört med ingen sådan tidigare behandling och efter (2) HRR-genmutationsstatus, prospektivt testad med nästa generations sekvensering av tumörvävnad med FoundationOne CDx eller cirkulerande tumör-DNA (ctDNA) med FoundationOne Liquid CDx; patienter med tumörer med HRR-genmutationer (ATM, ATR, BRCA1, BRCA2, CDK12, CHEK2, FANCA, MLH1, MRE11A, NBN, PALB2 eller RAD51C) jämfört med patienter utan tumörer med HRR-genmutationer eller med okänd status.
Medianåldern var 71 år (intervall 36-91) i båda armarna; 62 % var vita, 31 % var asiater och 2 % var svarta. De flesta patienter (66 %) i båda armarna hade en ECOG-funktionsstatus på 0. Hos patienter som behandlades med Talzenna var andelen patienter med sjukdom som vid baslinjen var mätbar enligt RECIST 1.1, 30 % enligt BICR. Tjugoåtta procent (28 %) av patienterna hade tidigare fått abirateron eller taxanbaserad kemoterapi. Tjugo procent (20 %) hade tumörer med HRR‑genmutationer och 80 % hade tumörer utan HRR-genmutationer eller med okänd status.
Det primära effektmåttet var radiografisk progressionsfri överlevnad (rPFS) bedömd utifrån RECIST version 1.1 och PCWG3-kriterier (Prostate Cancer Clinical Trials Working Group) (ben) bedömd enligt BICR. OS var ett alfakontrollerat sekundärt effektmått.
En statistiskt signifikant förbättring av BICR-bedömd rPFS och OS påvisades för Talzenna i kombination med enzalutamid jämfört med placebo i kombination med enzalutamid. En känslighetsanalys av prövarbedömd rPFS överensstämde med resultaten för BICR-bedömd rPFS.
Effektresultat för TALAPRO-2 presenteras i tabell 7 och 8 och figur 4, 5, 6 och 7.
| Tabell 7.Sammanfattning av effektresultat – TALAPRO-2 (mCRPC)* | ||
Talazoparib + enzalutamid N = 402 | Placebo + enzalutamid N = 403 | |
| rPFS enligt BICR | ||
| Händelser, antal (%) | 151 (37,6) | 191 (47,4) |
| Median, månader (95 % KI) | NR (27,5; NR) | 21,9 (16,6; 25,1) |
Riskkvot (95 % KI)a p-värdeb | 0,627 (0,506; 0,777) p < 0,0001 | |
| OS | ||
| Händelser, antal (%) | 211 (52,5) | 243 (60,3) |
| Median, månader (95 % KI) | 45,8 (39,4; 50,8) | 37 (34,1; 40,4) |
Riskkvot (95 % KI)a p-värdeb | 0,796 (0,661; 0,958) p = 0,0155 | |
Förkortningar: BICR = blindad oberoende central granskning, KI = konfidensintervall, CSPC = kastrationskänslig prostatacancer, HRR = homolog rekombinationsreparation, mCRPC = metastaserad kastrationsresistent prostatacancer, N = antal patienter, NHT = ny hormonbehandling, NR = ej uppnått, OS = total överlevnad, rPFS = radiografisk progressionsfri överlevnad. * rPFS baseras på data fram till brytdatumet 16 augusti 2022 och en medianuppföljning för rPFS på 24,9 månader (95 % KI: 24,7; 25,3) i armen som fick talazoparib plus enzalutamid och 24,6 månader (95 % KI: 22,1; 24,9) i armen som fick placebo plus enzalutamid. Total överlevnad baseras på data fram till brytdatumet den 3 september 2024 och en medianuppföljning av OS på 52,5 månader (95 % KI: 49,9; 53,4) i armen som fick talazoparib plus enzalutamid och 53,0 månader (95 % KI: 50,6; 54,0) i armen som fick placebo plus enzalutamid. a Riskkvot baserad på Cox proportionella riskmodell stratifierad efter tidigare NHT-behandling (abirateron) eller taxanbaserad kemoterapi för CSPC (ja jämfört med nej) och efter HRR-mutationsstatus (defekt jämfört med icke‑defekt/okänd) med < 1 fördel för talazoparib. b. P-värden (2-sidiga) från logrank-test stratifierat efter tidigare NHT-behandling (abirateron) eller taxanbaserad kemoterapi för CSPC och efter HRR-mutationsstatus. Vid tidpunkten för den slutliga OS-analysen var medianvärdet för rPFS 33,1 månader (95 % KI: 27,4; 39,0) för patienter som fick Talzenna i kombination med enzalutamid och 19,5 månader (95 % KI: 16,6; 24,7) för patienter som fick placebo i kombination med enzalutamid (riskkvot = 0,667, 95 % KI: 0,551; 0,807). | ||
| Tabell 8.Sammanfattning av effektresultat för analys av undergrupper – TALAPRO-2 (mCRPC)* | ||
| Talazoparib + enzalutamid | Placebo + enzalutamid | |
| Analyser av HRRm-undergruppera | ||
| HRRm | N = 85 | N = 82 |
| rPFS enligt BICR | ||
| Händelser, antal (%) | 37 (43,5) | 49 (59,7) |
| Median, månader (95 % KI) | 27,9 (16,8; NR) | 13,8 (10,9; 19,5) |
| Riskkvot (95 % KI)b | 0,424 (0,275; 0,653) | |
| OS | ||
| Händelser, antal (%) | 41 (48,2) | 55 (67,1) |
| Median, månader (95 % KI) | 45,8 (36,4; NR) | 30,1 (25,6; 38,2) |
| Riskkvot (95 % KI)b | 0,524 (0,348; 0,787) | |
| Icke-HRRm | N = 207 | N = 219 |
| rPFS enligt BICR | ||
| Händelser, antal (%) | 73 (35,3) | 95 (43,4) |
| Median, månader (95 % KI) | NR (25,8; NR) | 22,4 (16,6; NR) |
| Riskkvot (95 % KI)b | 0,695 (0,511; 0,944) | |
| OS | ||
| Händelser, antal (%) | 112 (54,1) | 133 (60,7) |
| Median, månader (95 % KI) | 45 (34,7; 53,3) | 37,4 (31,8; 41,4) |
| Riskkvot (95 % KI)b | 0,817 (0,635; 1,053) | |
| Analyser av BRCAm-undergruppera | ||
| BRCAm | N = 27 | N = 32 |
| rPFS enligt BICR | ||
| Händelser, antal (%) | 8 (29,6) | 22 (68,7) |
| Median, månader (95 % KI) | NR (16,8; NR) | 11 (7,4; 24,6) |
| Riskkvot (95 % KI)b | 0,232 (0,101; 0,529) | |
| OS | ||
| Händelser, antal (%) | 14 (51,9) | 23 (71,9) |
| Median, månader (95 % KI) | 36,9 (24,9; NR) | 26,1 (15,2; 35,4) |
| Riskkvot (95 % KI)b | 0,556 (0,285; 1,085) | |
Förkortningar: BICR = blindad oberoende central granskning, BRCAm = muterad bröstcancergen, KI = konfidensintervall, CSPS = kastrationskänslig prostatacancer, ctDNA = cirkulerande tumör-DNA, HRRm = muterad homolog rekombinationsreparationsgen, mCRPC = metastaserad kastrationsresistent prostatacancer, N = antal patienter, NHT = ny hormonbehandling, NR = ej uppnått, OS = total överlevnad, rPFS = radiografisk progressionsfri överlevnad. * Baserat på data fram till brytdatumet 16 augusti 2022 och en medianuppföljning för rPFS på 24,9 månader (95 % KI: 24,7; 25,3) i armen som fick talazoparib plus enzalutamid och 24,6 månader (95 % KI: 22,1; 24,9) i armen som fick placebo plus enzalutamid. Total överlevnad baseras på data fram till brytdatumet den 3 september 2024 och en medianuppföljning av OS på 52,5 månader (95 % KI: 49,9; 53,4) i armen som fick talazoparib plus enzalutamid och 53,0 månader (95 % KI: 50,6; 54,0) i armen som fick placebo plus enzalutamid. a. Baserade på prospektiva tumörvävnadsbaserade resultat (resultat som var kända före randomiseringen) och prospektiva resultat för blodbaserat ctDNA (resultat som var kända före randomiseringen). b Riskkvot baserad på Cox proportionella riskmodell stratifierad efter tidigare NHT-behandling (abirateron) eller taxanbaserad kemoterapi för CSPC (ja jämfört med nej) med < 1 fördel för talazoparib. | ||
Vid tidpunkten för den slutliga OS-analysen var medianvärdet för rPFS i HRRm-undergruppen 27,7 månader (95 % KI: 19,3; 38,4) för patienter som fick Talzenna i kombination med enzalutamid och 13,8 månader (95 % KI: 10,8; 19,3) för patienter som fick placebo i kombination med enzalutamid (riskkvot = 0,454, 95 % KI: 0,305; 0,674). I icke-HRRm-undergruppen var medianvärdet för rPFS 33,2 månader (95 % KI: 25,9; 44,2) för patienter som fick Talzenna i kombination med enzalutamid och 22,1 månader (95 % KI: 16,6; 30,4) för patienter som fick placebo i kombination med enzalutamid (riskkvot = 0,740, 95 % KI: 0,565; 0,969). I BRCAm-undergruppen var medianvärdet för rPFS ej uppnått (95 % KI: 16,8; ej uppnått) för patienter som fick Talzenna i kombination med enzalutamid och 11 månader (95 % KI: 5,9; 13,8) för patienter som fick placebo i kombination med enzalutamid (riskkvot = 0,259, 95 % KI: 0,120; 0,558).
Figur 4.Kaplan‑Meier-kurvor över rPFS enligt BICR – TALAPRO-2 (mCRPC)
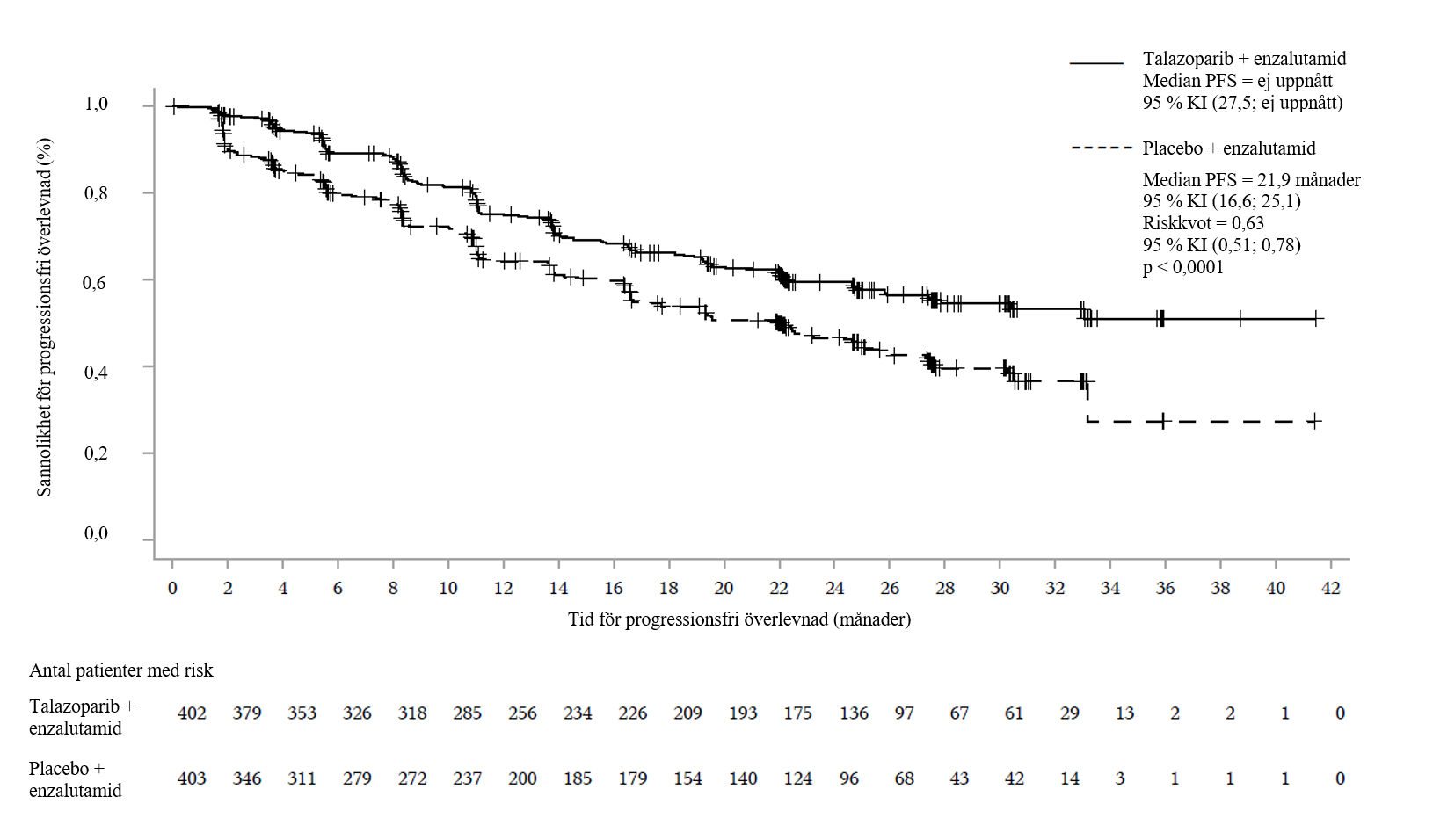
Förkortningar: BICR = blindad oberoende central granskning, KI = konfidensintervall, mCRPC = metastaserad kastrationsresistent prostatacancer, PFS = progressionsfri överlevnad, rPFS = radiografisk progressionsfri överlevnad.
Figur 5.Träddiagram över rPFS-analyser i viktiga undergrupper – TALAPRO‑2 (mCRPC)
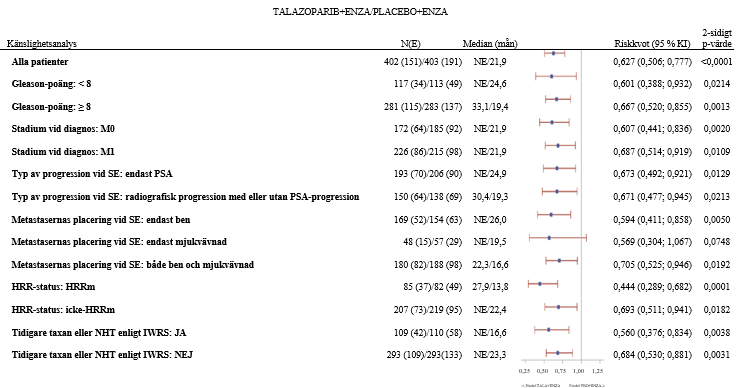
Förkortningar: KI = konfidensintervall, ctDNA = cirkulerande tumör-DNA, ENZA = enzalutamid, E = antal händelser, HRR = homolog rekombinationsreparation, HRRm = muterad homolog rekombinationsreparationsgen, IWRS = interaktivt webbsvarssystem, mCRPC = metastaserad kastrationsresistent prostatacancer, N = antal patienter, NE = ej bedömningsbart/ej uppnått, NHT = ny hormonbehandling, PBO = placebo, PSA = prostataspecifikt antigen; rPFS = radiografisk progressionsfri överlevnad, SE = inskrivning i studien, TALA = talazoparib.
Riskkvoten för alla patienter baserades på en Coxmodell stratifierat enligt randomiseringens stratifieringsfaktorer. För alla undergrupper baserades riskkvoten på en icke-stratifierad Coxmodell med behandling som enda kovariat. En riskkvot <1 betyder en fördel för talazoparib.
HRR-status baseras på prospektiva vävnadsbaserade resultat på tumören samt prospektiva blodbaserade ctDNA‑resultat.
Figur 6.Kaplan-Meier-kurvor över OS – TALAPRO-2 (mCRPC)
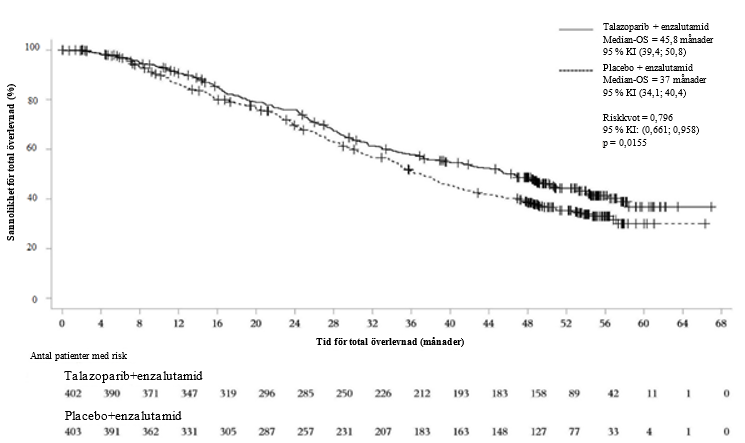
Förkortningar: KI = konfidensintervall, mCRPC = metastaserad kastrationsresistent prostatacancer, OS = total överlevnad.
Figur 7.Träddiagram över OS-analyser i viktiga undergrupper – TALAPRO-2 (mCRPC)
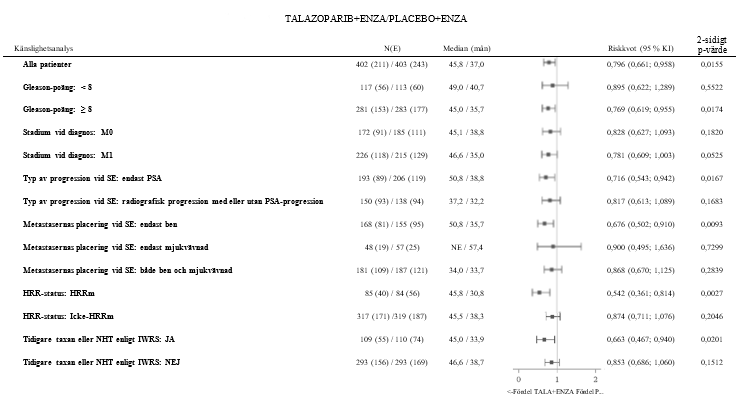
Förkortningar: KI = konfidensintervall, E = antal händelser, ENZA = enzalutamid, HRR= homolog rekombinationsreparation, HRRm = muterad homolog rekombinationsreparationsgen, IWRS = interaktivt webbsvarssystem, mCRPC = metastaserad kastrationsresistent prostatacancer, N = antal patienter, NHT = ny hormonbehandling, OS = total överlevnad, PSA = prostataspecifikt antigen, SE = inskrivning i studien, TALA = talazoparib.
Riskkvoten för alla patienter baserades på en Coxmodell stratifierad enligt randomiseringens stratifieringsfaktorer. För alla undergrupper baserades riskkvoten på en icke-stratifierad Coxmodell med behandling som enda kovariat.
Procentandelar beräknade baserat på N, antalet patienter i den fullständiga analysuppsättningen i varje behandlingsgrupp.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för talazoparib för alla grupper av den pediatriska populationen för bröstcancer och prostatacancer (se avsnitt Dosering och administreringssätt för information om pediatrisk användning).
Farmakokinetiska egenskaper
Efter daglig administrering av multipla doser ökade exponeringen för talazoparib generellt i proportion med dosen i intervallet 0,025 mg till 2 mg. Efter upprepad daglig dosering av 1 mg talazoparib som monoterapi till bröstcancerpatienter låg det geometriska medelvärdet (% variationskoefficient [CV%]) för arean under kurvan plasmakoncentration-tid (AUC) och maximal observerad plasmakoncentration (Cmax) för talazoparib vid steady state i intervallet 126 (107) ng•hr/ml till 208 (37) ng•hr/m respektive 11 (90) ng/ml till 19 (27) ng/ml. Efter peroral administrering av 0,5 mg talazoparib en gång dagligen i kombination med enzalutamid till patienter med mCRPC, låg det geometriska medelvärdet (CV%) för Ctrough vid steady state för alla besök inom intervallet 3,29 till 3,68 ng/ml (45-48 %), vilket liknar de observerade värdena på 3,53 ng/ml (61 %) när talazoparib administrerades som monoterapi med 1 mg en gång dagligen till bröstcancerpatienter. Efter upprepad daglig dosering nådde plasmakoncentrationen av talazoparib steady state inom 2 till 3 veckor när det administrerades ensamt och inom ungefär 9 veckor när det administrerades tillsammans med ezalutamid . Medianvärdet för ackumuleringskvoten för talazoparib efter upprepad peroral administrering av 1 mg som monoterapi en gång dagligen låg i intervallet 2,3 till 5,2. Talazoparib är substrat till P-gp- och BCRP‑transportproteiner.
Absorption
Efter peroral administrering av talazoparib var mediantiden till Cmax (Tmax) vanligen 1 till 2 timmar efter dosen. Inga studier av absolut biotillgänglighet har utförts på människa. Baserat på data om urinutsöndringen är den absoluta biotillgängligheten minst 41 % vid en absorberad fraktion på minst 69 % (se ”Eliminering”). Ingen signifikant effekt av syrareducerande medel på talazoparibexponeringen förväntas eftersom talazoparib har tillräcklig löslighet vid alla pH-värden mellan 1 och 6,8. Tjugoåtta procent (28 %) av patienterna i den pivotala studien tog syrareducerande medel, huvudsakligen protonpumphämmare.
Effekten av föda
Födointag minskade absorptionshastigheten för talazoparib men påverkade inte absorptionsgraden. Efter en peroral engångsdos talazoparib tillsammans med en fett- och kaloririk måltid (cirka 827 kalorier, 57 % fett), minskade genomsnittlig Cmax för talazoparib med cirka 46 %, median Tmax förlängdes med 1 till 4 timmar, medan AUCinf inte förändrades. Baserat på dessa resultat kan Talzenna tas med eller utan föda (se avsnitt Dosering och administreringssätt).
Distribution
Genomsnittlig skenbar distributionsvolym i populationen (Vss/F) för talazoparib var 420 l. In vitro är talazoparib till cirka 74 % bundet till plasmaproteiner, ej koncentrationsberoende i koncentrationsintervallet från 0,01 µM till 1 µM. Nedsatt njur- eller leverfunktion verkar inte påverka talazoparibs proteinbindning eftersom det inte fanns någon uppenbar trend i den genomsnittliga fraktionen av obundet läkemedel (fu) för talazoparib i human plasma in vivo med försämrad njur- eller leverfunktion.
Metabolism
Talazoparib metaboliseras i minimal omfattning i levern hos människa. Efter peroral administrering av en engångsdos om 1 mg [14C] talazoparib till människa kunde inga större cirkulerande metaboliter detekteras i plasma. Talazoparib var den enda cirkulerande läkemedelsderiverade substans som identifierades. Inga metaboliter som var och en för sig stod för mer än 10 % av den administrerade dosen återfanns i urin eller feces.
In vitro hämmade talazoparib inte cytokrom (CYP)1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 eller CYP3A4/5 och inducerade inte CYP1A2, CYP2B6 eller CYP3A4 vid kliniskt relevanta koncentrationer.
In vitro hämmade talazoparib inte någon av de viktigare intestinala, hepatiska eller renala membrantransportproteinerna (P-gp, BCRP, organisk anjontransporterande polypeptid [OATP]1B1, OATP1B3, organisk katjontransportör [OCT]1, OCT2, organisk anjontransportör [OAT]1, OAT3, bile salt export pump [BSEP], multidrug and toxin extrusion [MATE]1 eller MATE2-K) vid kliniskt relevanta koncentrationer.
In vitro hämmade inte talazoparib någon av de viktigare isoformerna av urindifosfat-glukuronosyl-transferas (UGT) (1A1, 1A4, 1A6, 1A9, 2B7 eller 2B15) vid kliniskt relevanta koncentrationer.
Eliminering
Renal eliminering av oförändrat läkemedel (passiv filtrering och aktiv utsöndring) är den viktigaste elimineringsvägen för talazoparib. P-gp är sannolikt involverat vid aktiv renal utsöndring av talazoparib. Genomsnittlig (±standardavvikelse) terminal halveringstid för talazoparib i plasma var 90 (± 58) timmar, och genomsnittlig skenbar oral clearance (CL/F) i populationen (variabilitet mellan deltagarna) var 6,5 l/h (31 %) hos cancerpatienter. Hos 6 kvinnliga patienter som fått en peroral engångsdos av [14C] talazoparib återfanns 69 % (± 8,6 %) av den totala administrerade radioaktiva dosen i urinen och 20 % (± 5,5 %) i feces. Utsöndring av oförändrat talazoparib via urinen var den viktigaste elimineringsvägen och stod för 55 % av den administrerade dosen, medan oförändrat talazoparib i feces stod för 14 %.
Särskilda populationer
Ålder, kön och kroppsvikt
En populationsfarmakokinetisk analys utfördes med data från 490 cancerpatienter som fick talazoparib 1 mg en gång dagligen som monoterapi för att undersöka hur ålder (från 18 till 88 år), kön (53 män och 437 kvinnor) och kroppsvikt (från 35,7 kg till 162 kg) inverkade på talazoparibs farmakokinetik. Resultaten visade att ålder, kön och kroppsvikt inte hade någon kliniskt relevant effekt på talazoparibs farmakokinetik.
Etnicitet
Baserat på en populationsfarmakokinetisk analys som inkluderade 490 patienter som fick talazoparib 1 mg en gång dagligen som monoterapi, varav 41 patienter var asiatiska och 449 icke-asiatiska (361 vita, 16 mörkhyade, 9 övriga, och 63 ej angivet), var CL/F för talazoparib högre hos asiatiska patienter än hos icke-asiatiska, vilket leder till en 19 % lägre exponering (AUC) i asiatiska patienter.
Pediatrisk population
Talazoparibs farmakokinetik har inte undersökts hos patienter < 18 år.
Nedsatt njurfunktion
Talazoparib som monoterapi
Data från en farmakokinetisk studie med patienter med framskriden cancer och varierande grad av njurfunktionsnedsättning tydde på att den totala exponeringen för talazoparib (AUC0-24) efter flera doser talazoparib en gång dagligen ökade med 92 % respektive 169 % hos patienter med måttlig (eGFR 30 – < 60 ml/min) och grav (eGFR < 30 ml/min) njurfunktionsnedsättning jämfört med patienter med normal njurfunktion (eGFR ≥ 90 ml/min). Cmax för talazoparib ökade med 90 % respektive 107 % hos patienter med måttlig och grav njurfunktionsnedsättning jämfört med patienter med normal njurfunktion. Talazoparibexponeringen var liknande för patienter med lätt njurfunktionsnedsättning (eGFR 60 – < 90 ml/min) och patienter med normal njurfunktion. Därutöver, baserat på en populationsfarmakokinetisk analys som omfattade 490 patienter, varav 132 hade en lätt njurfunktionsnedsättning (CrCL ≥ 60 ml/min till < 90 ml/min), 33 patienter hade en måttlig njurfunktionsnedsättning (CrCL ≥ 30 ml/min till < 60 ml/min), och 1 patient hade grav njurfunktionsnedsättning (CrCL < 30 ml/min), sjönk dessutom CL/F för talazoparib med 14 % respektive 37 % hos patienter med lätt och måttlig njurfunktionsnedsättning, motsvarande en ökning på 17 % respektive 59 % av AUC, i jämförelse med hos patienter med normal njurfunktion (CrCL ≥ 90 ml/min). Farmakokinetiken för talazoparib har inte studerats hos patienter som behöver hemodialys (se avsnitt Dosering och administreringssätt).
Talazoparib administrerat tillsammans med enzalutamid
Baserat på en populationsfarmakokinetisk analys som inkluderade 412 patienter med mCRPC och som fick talazoparib administrerat tillsammans med enzalutamid, varav 152 patienter hade lätt njurfunktionsnedsättning (CrCL ≥ 60 ml/min till < 90 ml/min), 72 patienter hade en måttlig njurfunktionsnedsättning (CrCL ≥ 30 ml/min till < 60 ml/min) och 2 patienter hade en grav njurfunktionsnedsättning (CrCL < 30 ml/min), sjönk förväntat CL/F för talazoparib med 8 % och 27 % hos patienter med lätt och måttlig njurfunktionsnedsättning, motsvarande en ökning på 9 % respektive 37 % av AUC, jämfört med patienter med normal njurfunktion. Farmakokinetiken för talazoparib har inte studerats hos patienter som behöver hemodialys (se avsnitt Dosering och administreringssätt).
Nedsatt leverfunktion
Talazoparib som monoterapi
Baserat på en populationsfarmakokinetisk analys som inkluderade 490 patienter som fick talazoparib 1 mg en gång dagligen som monoterapi, varav 118 patienter hade lätt nedsatt leverfunktion (totalt bilirubin ≤ 1,0 × ULN och ASAT > ULN, eller totalt bilirubin > 1,0 till 1,5 × ULN oavsett ASAT), hade lätt nedsatt leverfunktion inte någon inverkan på talazoparibs farmakokinetik. Talazoparibs farmakokinetik hos patienter med normal leverfunktion, lätt nedsatt leverfunktion, måttligt nedsatt leverfunktion (totalt bilirubin > 1,5 till 3,0 x ULN oavsett ASAT) eller gravt nedsatt leverfunktion (totalt bilirubin > 3,0 x ULN oavsett ASAT) undersöktes i en farmakokinetikstudie. En populationsfarmakokinetisk analys med data från denna farmakokinetikstudie tydde på att lätt, måttligt eller gravt nedsatt leverfunktion inte hade någon signifikant inverkan på talazoparibs farmakokinetik (se avsnitt Dosering och administreringssätt).
Talazoparib administrerat tillsammans med enzalutamid
Talazoparibs farmakokinetik i kombination med enzalutamid har inte studerats hos patienter med nedsatt leverfunktion (se avsnitt Dosering och administreringssätt).
Prekliniska säkerhetsuppgifter
Karcinogenicitet
Inga karcinogenicitetsstudier av talazoparib har utförts.
Gentoxicitet
Talazoparib var inte mutagent i test av bakteriell omvänd mutation (Ames test). Talazoparib var klastogent i en in vitro-analys av kromosomavvikelser i humana lymfocyter i perifert blod, och i en in vivo-analys av mikronuklei hos råtta vid exponeringar motsvarande kliniskt relevanta doser. Denna klastogenicitet står i överensstämmelse med genominstabilitet på grund av talazoparibs primära farmakologi, och tyder på en risk för gentoxicitet hos människa.
Allmäntoxicitet
I studier av allmäntoxicitet vid upprepad dosering till råtta och hund var de viktigaste resultaten vid subterapeutisk exponering hypocellularitet i benmärgen med dosberoende minskning av hematopoetiska celler, minskad lymfoid vävnad i flera organ samt atrofi och/eller degenerativa förändringar i testiklar, bitestiklar och sädeskanaler. Ytterligare fynd vid högre exponering var en dosberoende ökning av apoptos/nekros i magtarmkanalen, levern och äggstockarna. De flesta av de histopatologiska fynden var reversibla, medan testikelfynden partiellt hade gått tillbaka efter 4 veckor utan behandling. Dessa toxicitetsfynd står i överensstämmelse med talazoparibs farmakologi och distribution i vävnaderna.
Utvecklingstoxicitet
I en studie av embryofetal utveckling hos råtta resulterade talazoparib i embryofatal död, fostermissbildningar (plattare ögonglob, små ögon, kluvna sternebrae, sammanväxt cervikal kotbåge) och strukturella förändringar i skelettet när moderdjurets systemiska exponering, AUC24, var ungefär 0,09 gånger relevant exponering hos människa vid den rekommenderade dosen.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Kapselns innehåll
Mikrokristallin cellulosa med kiseldioxid
Kapselskal 0,1 mg kapsel
Hypromellos
Titandioxid (E171)
Kapselskal 0,25 mg kapsel
Hypromellos
Gul järnoxid (E172)
Titandioxid (E171)
Kapselskal 0,35 mg kapsel
Hypromellos
Gul järnoxid (E172)
Titandioxid (E171)
Kapselskal 0,5 mg kapsel
Hypromellos
Röd järnoxid (E172)
Titandioxid (E171)
Kapselskal 1 mg kapsel
Hypromellos
Röd järnoxid (E172)
Gul järnoxid (E172)
Titandioxid (E171)
Tryckfärg
Shellack (E904)
Propylenglykol (E1520)
Ammoniumhydroxid (E527)
Svart järnoxid (E172)
Kaliumhydroxid (E525)
Inkompatibiliteter
Ej relevant.
Hållbarhet
4 år.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
TALZENNA kapseli, kova
0,25 mg (L:ei) 30 kpl (1774,42 €)
1 mg (L:ei) 30 kpl (4986,21 €)
PF-selosteen tieto
Talzenna 0,1 mg hårda kapslar
Burk av högdensitetspolyeten (HDPE) och värmeförseglat lock av polypropen (PP). Förpackningsstorlek: kartong med 30 kapslar i en HDPE-burk.
Talzenna 0,25 mg hårda kapslar
Burk av högdensitetspolyeten (HDPE) och värmeförseglat lock av polypropen (PP). Förpackningsstorlek: kartong med 30 kapslar i en HDPE-burk.
Perforerat endosblister av polyvinylklorid/polyvinylidenklorid (PVC/PVDC) med avrivbar aluminiumfolie. Förpackningsstorlek: kartong med 30 × 1 kapslar, 60 × 1 kapslar eller 90 × 1 kapslar i endosblister.
Talzenna 0,35 mg hårda kapslar
Burk av högdensitetspolyeten (HDPE) och värmeförseglat lock av polypropen (PP). Förpackningsstorlek: kartong med 30 kapslar i en HDPE-burk.
Talzenna 0,5 mg hårda kapslar
Burk av högdensitetspolyeten (HDPE) och värmeförseglat lock av polypropen (PP). Förpackningsstorlek: kartong med 30 kapslar i en HDPE-burk.
Talzenna 1 mg hårda kapslar
Burk av högdensitetspolyeten (HDPE) och värmeförseglat lock av polypropen (PP). Förpackningsstorlek: kartong med 30 kapslar i en HDPE-burk.
Perforerat endosblister av polyvinylklorid/polyvinylidenklorid (PVC/PVDC) med avrivbar aluminiumfolie. Förpackningsstorlek: kartong med 30 × 1 kapslar i endosblister.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Talzenna 0,1 mg hårda kapslar
Opak, cirka 14 mm × 5 mm hård kapsel med vit överdel (med ”Pfizer” tryckt i svart) och vit underdel (med ”TLZ 0.1” tryckt i svart).
Talzenna 0,25 mg hårda kapslar
Opak, cirka 14 mm × 5 mm hård kapsel med benvit överdel (med ”Pfizer” tryckt i svart) och vit underdel (med ”TLZ 0.25” tryckt i svart).
Talzenna 0,35 mg hårda kapslar
Opak, cirka 14 mm × 5 mm hård kapsel med benvit överdel (med ”Pfizer” tryckt i svart) och benvit underdel (med ”TLZ 0.35” tryckt i svart).
Talzenna 0,5 mg hårda kapslar
Opak, cirka 14 mm × 5 mm hård kapsel med ljusrosa överdel (med ”Pfizer” tryckt i svart) och vit underdel (med ”TLZ 0.5” tryckt i svart).
Talzenna 1 mg hårda kapslar
Opak, cirka 14 mm × 5 mm hård kapsel, med ljusröd överdel (med ”Pfizer” tryckt i svart) och vit underdel (med ”TLZ 1” tryckt i svart).
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
TALZENNA kapseli, kova
0,25 mg 30 kpl
1 mg 30 kpl
- Ylempi erityiskorvaus (100 %). Talatsoparibi: Aikuispotilaiden hoito, kun ituradan BRCA-mutaatio ja HER2-negatiivinen paikallisesti edennyt tai etäpesäkkeinen rintasyöpä erityisin edellytyksin (1540).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Talatsoparibi: Aikuispotilaiden hoito, kun ituradan BRCA-mutaatio ja HER2-negatiivinen paikallisesti edennyt tai etäpesäkkeinen rintasyöpä erityisin edellytyksin (3070).
Atc-kod
L01XK04
Datum för översyn av produktresumén
19.06.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
