APEXXNAR (uusi kauppanimi Prevenar 20) injektioneste, suspensio, esitäytetty ruisku
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Uusi kauppanimi Prevenar 20
Vaikuttavat aineet ja niiden määrät
Yksi annos (0,5 ml) sisältää:
Pneumokokkipolysakkaridi serotyyppi 11,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 31,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 41,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 51,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 6A1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 6B1,2 4,4 µg
Pneumokokkipolysakkaridi serotyyppi 7F1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 81,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 9V1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 10A1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 11A1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 12F1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 141,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 15B1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 18C1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 19A1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 19F1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 22F1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 23F1,2 2,2 µg
Pneumokokkipolysakkaridi serotyyppi 33F1,2 2,2 µg
1Konjugoitu CRM197-kantajaproteiiniin (noin 51 mikrogrammaa per annos)
2Adsorboitu alumiinifosfaattiin (0,125 mg alumiinia per annos)
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
Aktiivinen immunisaatio Streptococcus pneumoniaen aiheuttamia invasiivisia tauteja, keuhkokuumetta ja akuuttia välikorvatulehdusta vastaan imeväisillä, lapsilla ja nuorilla 6 viikon iästä 17 vuoden ikään.
Aktiivinen immunisaatio Streptococcus pneumoniaen aiheuttamia invasiivisia tauteja ja keuhkokuumetta vastaan 18 vuotta täyttäneillä henkilöillä.
Katso tiedot serotyyppikohtaisesta suojasta kohdista Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka.
Prevenar 20 ‑rokotetta on käytettävä virallisten suositusten mukaisesti.
Annostus ja antotapa
Annostus
Jos imeväisikäisen pneumokokkikonjugaattirokotesarja on aloitettu Prevenar 20 -rokotteella, suositellaan antamaan sarja loppuun Prevenar 20 -rokotteella.
| Imeväisten ja lasten (ikä 6 viikosta 15 kuukauteen) rokotusohjelma | |
| 4 annoksen sarja (kolmesta annoksesta koostuva perusrokotussarja, jonka jälkeen tehosteannos) | Imeväisten perusrokotussarja koostuu kolmesta 0,5 ml:n annoksesta. Ensimmäinen annos annetaan tavallisesti 2 kuukauden iässä, ja annosväli on vähintään 4 viikkoa. Ensimmäinen annos voidaan antaa jo 6 viikon iässä. Neljäs annos (tehosteannos) suositellaan antamaan 11–15 kuukauden iässä (ks. kohta Farmakodynamiikka). |
| 18 vuotta täyttäneiden henkilöiden rokotusohjelma | |
| 18 vuotta täyttäneet henkilöt | 18 vuotta täyttäneille henkilöille Prevenar 20 -rokote annetaan kerta-annoksena. Uusintarokotuksen tarvetta toisella Prevenar 20 -annoksella ei ole varmistettu. Prevenar 20 -rokotteesta ei ole saatavissa tietoja peräkkäisestä rokotuksesta muilla pneumokokkirokotteilla tai tehosteannoksesta. Jos 23‑valenttisen pneumokokkipolysakkaridirokotteen (Pneumovax 23 [PPSV23]) käyttö katsotaan asianmukaiseksi, Prevenar 20 -rokote pitää antaa ensin, mikä perustuu Prevenar 13 ‑rokotteesta (pneumokokkikonjugaattirokote, joka sisältää kolmetoista samaa konjugoitua polysakkaridia kuin Prevenar 20) saatavissa olevaan kliiniseen kokemukseen (ks. kohta Farmakodynamiikka). |
Pediatriset potilaat
Tietoja Prevenar 20 -rokotteen käytöstä alle 6 viikon ikäisille, ennenaikaisesti syntyneille, vanhemmille rokottamattomille tai osittain rokotetuille imeväisille ja lapsille ei ole tai tietoja on vain vähän (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka). Seuraavat annossuositukset perustuvat pääosin Prevenar 13 ‑rokotteesta saatuihin kokemuksiin.
Alle 6 viikon ikäiset imeväiset
Prevenar 20 -valmisteen turvallisuutta ja tehoa alle 6 viikon ikäisillä imeväisillä ei ole varmistettu. Tietoja ei ole saatavilla.
Ennenaikaisesti syntyneet imeväiset (ennen raskausviikkoa 37 syntyneet)
Suositeltu Prevenar 20 -rokotesarja koostuu neljästä annoksesta, joista kukin on 0,5 ml. Imeväisten perusrokotussarja koostuu kolmesta annoksesta, joista ensimmäinen annetaan 2 kuukauden iässä, ja annosväli on vähintään 4 viikkoa. Ensimmäinen annos voidaan antaa jo 6 viikon iässä. Neljäs annos (tehosteannos) suositellaan antamaan 11–15 kuukauden iässä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Vähintään 7 kuukauden ikäiset ja alle 12 kuukauden ikäiset rokottamattomat imeväiset
Kaksi annosta, kumpikin 0,5 ml, joiden annosväli on vähintään 4 viikkoa. Kolmas annos suositellaan antamaan toisena ikävuonna.
Vähintään 12 kuukauden ikäiset ja alle 24 kuukauden ikäiset rokottamattomat lapset
Kaksi annosta, kumpikin 0,5 ml, joiden annosväli on vähintään 8 viikkoa.
Vähintään 2-vuotiaat ja alle 5-vuotiaat rokottamattomat lapset
Yksi 0,5 ml:n kerta-annos.
15 kuukauden ikäiset ja alle 5-vuotiaat lapset, jotka ovat aiemmin saaneet täyden rokotesarjan Prevenar 13 ‑rokotteella
Yksi kerta-annos (0,5 ml) annetaan yksilöllisen tarpeen mukaan virallisten suositusten mukaisesti, jotta saadaan immuunivaste uusille serotyypeille.
Jos on annettu Prevenar 13 ‑rokote, on odotettava vähintään 8 viikkoa ennen Prevenar 20 -rokotteen antoa (ks. kohta Farmakodynamiikka).
5–17-vuotiaat lapset ja nuoret aiemmasta Prevenar 13 ‑rokotuksesta riippumatta
Yksi kerta-annos (0,5 ml) annetaan yksilöllisen tarpeen mukaan virallisten suositusten mukaisesti.
Jos on annettu Prevenar 13 ‑rokote, on odotettava vähintään 8 viikkoa ennen Prevenar 20 -rokotteen antoa (ks. kohta Farmakodynamiikka).
Erityisryhmät
Prevenar 20 -valmisteen käytöstä erityisryhmillä ei ole tietoja.
Kliinisistä tutkimuksista saatua kokemusta on Prevenar 13 ‑rokotteen (pneumokokkikonjugaattirokote, joka sisältää kolmetoista samaa konjugoitua polysakkaridia kuin Prevenar 20) käytöstä lapsilla ja aikuisilla, joilla on tavanomaista suurempi pneumokokki-infektion riski, mukaan lukien immuunipuutteiset lapset ja aikuiset, joilla on HIV-infektio tai jotka ovat saaneet hematopoieettisen kantasolusiirron, sekä lapsilla, joilla on sirppisolutauti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Näiden tietojen perusteella suositeltiin seuraavaa annostusta Prevenar 13 -rokotteelle:
- Henkilöille, joilla on tavanomaista suurempi pneumokokki-infektion riski (kuten ne, joilla on sirppisolutauti tai HIV-infektio), sekä henkilöille, jotka on aiemmin rokotettu yhdellä tai useammalla annoksella 23-valenttista pneumokokkipolysakkaridirokotetta, suositeltiin annettavaksi ainakin yksi Prevenar 13 ‑annos.
- Henkilöille, joille on tehty hematopoieettinen kantasolusiirto, suositeltava Prevenar 13 -rokotussarja koostui neljästä 0,5 ml:n annoksesta. Perusrokotussarja koostui kolmesta annoksesta, joista ensimmäinen annetaan 3–6 kuukauden kuluttua hematopoieettisesta kantasolusiirrosta. Perusrokotussarjassa annosväli on vähintään 4 viikkoa. Neljäs (tehoste)annos suositeltiin annettavaksi 6 kuukauden kuluttua perussarjan kolmannesta annoksesta (ks. kohta Farmakodynamiikka).
Suositeltua Prevenar 13 ‑annostusta voidaan harkita ohjeelliseksi suuren riskin henkilöiden Prevenar 20 -rokotuksissa. Tiedot immuunipuutteisten henkilöiden vasteista pneumokokkirokotteisiin, ks. myös kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka.
Antotapa
Vain lihakseen.
Rokote (0,5 ml) annetaan injektiona lihakseen. Suositeltuja antokohtia ovat imeväisillä reiden etusivu (ulompi reisilihas) tai lapsilla ja aikuisilla olkavarren hartialihas. Prevenar 20 -rokote pitää antaa välttäen huolellisesti injisoimasta hermoihin ja verisuoniin tai niiden läheisyyteen.
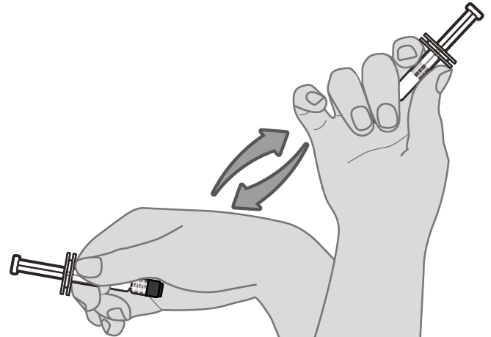
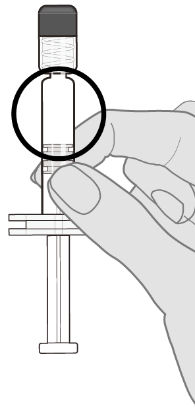
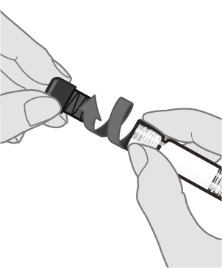
Ks. kohdasta Käyttö- ja käsittelyohjeet. ohjeet rokotteen käsittelyyn ennen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille, kohdassa Apuaineet mainituille apuaineille tai difteriatoksoidille.
Varoitukset ja käyttöön liittyvät varotoimet
Prevenar 20 -rokotetta ei saa antaa laskimoon.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyys
Kuten kaikkien pistettävien rokotteiden antamisen yhteydessä, rokotettaessa on oltava saatavissa asianmukainen hoito ja valvonta rokotuksen jälkeen ilmenevän harvinaisen anafylaktisen reaktion varalta.
Samanaikainen sairaus
Rokotuksen antoa pitää siirtää myöhemmäksi, jos henkilöllä on akuutti vaikea kuumesairaus. Rokotusta ei kuitenkaan pidä siirtää lievän infektion, kuten nuhakuumeen, vuoksi.
Trombosytopenia ja hyytymishäiriöt
Rokotteen antamisessa on oltava varovainen, jos henkilöllä on trombosytopenia tai hyytymishäiriö, sillä lihakseen annon jälkeen voi esiintyä verenvuotoa.
Hyytymishäiriötä sairastavan potilaan verenvuotoriski on arvioitava huolellisesti ennen minkään rokotteen antamista lihakseen; antoa ihon alle pitää harkita, jos odotettavissa oleva hyöty on selvästi suurempi kuin riskit.
Suoja pneumokokkitautia vastaan
Prevenar 20 voi suojata vain niitä Streptococcus pneumoniaen serotyyppejä vastaan, joita rokote sisältää. Se ei anna suojaa muita invasiivisia sairauksia, keuhkokuumetta tai välikorvatulehdusta aiheuttavia mikrobeja vastaan. Prevenar 20 ei muiden rokotteiden tavoin välttämättä suojaa kaikkia rokotettuja invasiiviselta pneumokokkitaudilta, keuhkokuumeelta tai välikorvatulehdukselta. Kysy oman maasi viimeisimmät epidemiologiset tiedot asianomaiselta kansalliselta organisaatiolta.
Immuunipuutteiset henkilöt
Turvallisuus- ja immunogeenisuustietoa Prevenar 20 -rokotteesta immuunipuutteisilla henkilöillä ei ole käytettävissä. Rokotusta pitää harkita potilaskohtaisesti.
Pneumokokkirokotteista saadun kokemuksen perusteella joillakin henkilöillä, joiden immuniteetti on muuttunut, immuunivaste Prevenar 20 -rokotteelle voi olla tavanomaista heikompi.
Vasta-ainevaste aktiivisessa immunisaatiossa saattaa olla heikentynyt henkilöillä, joilla immuunivaste on alentunut joko immunosuppressiivisen hoidon, synnynnäisen immuunivajeen, HIV-infektion tai muiden syiden takia. Tämän kliinistä merkitystä ei tiedetä.
Turvallisuus- ja immunogeenisuustietoja Prevenar 13 ‑rokotteen (pneumokokkikonjugaattirokote, joka sisältää kolmetoista samaa konjugoitua polysakkaridia kuin Prevenar 20) käytöstä on saatavissa henkilöistä, joilla on HIV-infektio tai sirppisolutauti tai joille on tehty hematopoieettinen kantasolusiirto (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). Prevenar 20 -rokotetta pitää käyttää virallisten suositusten mukaisesti.
Varsinaiset vertailukelpoisuuden (non-inferiority) kriteerit täyttyivät kaikissa tutkituissa aikuisten ikäryhmissä, vaikka lähes kaikkien serotyyppien titterien geometristen keskiarvojen (GMT) havaittiin olevan Prevenar 20 -rokotteella numeerisesti pienemmät kuin Prevenar 13 ‑rokotteella (ks. kohta Farmakodynamiikka). Lapsilla havaittiin numeerisesti pienempiä immunoglobuliini G:n (IgG) pitoisuuksien titterien geometrisiä keskiarvojaa (GMC) kaikilla yhteisillä serotyypeillä Prevenar 13 -rokotteeseen verrattuna (ks. kohta Farmakodynamiikka). Näiden havaintojen kliinistä merkitystä immuunipuutteisilla henkilöillä ei tiedetä.
Pediatriset potilaat
Annettaessa perusimmunisaatiosarjaa hyvin pienille keskosille (syntyneet 28. raskausviikolla tai ennen sitä) on huomioitava hengityspysähdyksen mahdollinen riski ja hengityksen seurannan tarve 48–72 tunnin ajan etenkin, jos keskosella on anamneesissa keuhkojen kypsymättömyyttä. Rokotuksesta on tälle imeväisten ryhmälle huomattavaa hyötyä, joten rokotuksia ei pidä jättää antamatta eikä niitä pidä siirtää myöhemmäksi.
Apuaine
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Injektoitavat rokotteet tulee aina antaa eri pistoskohtiin.
Prevenar 20 -rokotetta ei saa sekoittaa samaan ruiskuun muiden rokotteiden tai lääkevalmisteiden kanssa.
Pediatriset potilaat
Prevenar 20 -rokote voidaan antaa imeväisikäisille ja lapsille (iältään 6 viikosta alle 5 vuoteen) samanaikaisesti seuraavien rokoteantigeenien kanssa joko monovalentteina tai yhdistelmärokotteina: kurkkumätä, jäykkäkouristus, soluton hinkuyskä, hepatiitti B, Haemophilus influenzae tyyppi b, inaktivoitu poliorokote, tuhkarokko-, sikotauti-, vihurirokko- ja vesirokkorokotteet. Kliinisissä tutkimuksissa on sallittu rotavirusrokotteiden samanaikainen anto Prevenar 20 -rokotteen kanssa, eikä turvallisuutta koskevia huolenaiheita havaittu.
18 vuotta täyttäneet henkilöt
Prevenar 20 -rokote voidaan antaa samanaikaisesti kausi-influenssarokotteen (nelivalenttinen influenssarokote [QIV]; pinta-antigeeni, inaktivoitu, sisältää adjuvanttia) kanssa. Henkilöille, joilla on perussairauksia, joihin liittyy suuri hengenvaarallisen pneumokokkitaudin kehittymisen riski, voidaan harkita QIV-rokotteen ja Prevenar 20 -rokotteen antamista erikseen (esim. noin 4 viikon välein). Satunnaistetussa kaksoissokkotutkimuksessa 65-vuotiailla ja sitä vanhemmilla aikuisilla (B7471004) immuunivaste oli muodollisesti vertailukelpoinen (non-inferior), mutta annettaessa Prevenar 20 -rokote samanaikaisesti kausi-influenssarokotteen (nelivalenttinen influenssarokote [QIV]; pinta-antigeeni, inaktivoitu, sisältää adjuvanttia) kanssa kaikkien Prevenar 20-rokotteeseen sisältyvien pneumokokkiserotyyppien titterien havaittiin olevan numeerisesti matalammat verrattuna siihen, kun Prevenar 20 -rokote annettiin yksinään. Tämän havainnon kliinistä merkitystä ei tunneta.
Prevenar 20 -rokote voidaan antaa samanaikaisesti COVID-19-mRNA-rokotteen (nukleosidimuokattu) kanssa.
Prevenar 20 -rokotteen käytöstä samanaikaisesti muiden rokotteiden kanssa ei ole tietoja.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja Prevenar 20 -rokotteen käytöstä raskaana olevilla naisilla.
Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia.
Prevenar 20 -rokotteen antamista raskauden aikana tulee harkita vain, jos mahdolliset hyödyt ovat äidille ja sikiölle aiheutuvia mahdollisia riskejä suuremmat.
Imetys
Ei tiedetä, erittyykö Prevenar 20 ihmisen rintamaitoon.
Hedelmällisyys
Tietoja Prevenar 20 -rokotteen vaikutuksesta ihmisen hedelmällisyyteen ei ole saatavissa. Eläinkokeissa ei ole havaittu suoria tai epäsuoria haitallisia vaikutuksia naaraiden hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Prevenar 20 -valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Jotkut kohdassa Haittavaikutukset mainitut vaikutukset voivat kuitenkin vaikuttaa tilapäisesti ajokykyyn tai koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Pediatriset potilaat
Prevenar 20 -rokotteen turvallisuutta on arvioitu 5 987 osallistujalla, jotka olivat iältään 6 viikosta 17 vuoteen ja jotka olivat mukana viidessä kliinisessä tutkimuksessa: neljässä satunnaistetussa, kaksoissokkoutetussa, vaikuttavalla aineella kontrolloidussa kliinisessä tutkimuksessa ja yhdessä yhden haaran kliinisessä tutkimuksessa (neljä faasin 3 tutkimusta ja yksi faasin 2 tutkimus). 3 664 osallistujaa sai vähintään yhden Prevenar 20 -annoksen ja 2 323 osallistujaa sai Prevenar 13 ‑rokotetta (vertailurokote).
Osallistujat iältään6 viikosta 14 kuukauteen
Kliiniset tutkimukset tehtiin terveillä imeväisillä, jotka olivat iältään 6 viikosta 14 kuukauteen ja jotka saivat kolmesta annoksesta koostuvan rokotusohjelman tai neljästä annoksesta koostuvan rokotusohjelman (ks. kohta Farmakodynamiikka). Näissä imeväisillä tehdyissä tutkimuksissa 5 156 osallistujaa sai vähintään yhden rokoteannoksen: 2 833 sai Prevenar 20 -rokotetta ja 2 323 sai Prevenar 13 ‑rokotetta. Kaikkiaan noin 90 % kummankin ryhmän osallistujista sai kaikki annokset tutkimuksessa määriteltyinä taaperoille tarkoitettuina annoksina. Kaikissa tutkimuksissa kerättiin kunkin annoksen jälkeen tiedot paikallisista reaktioista ja systeemisistä tapahtumista sekä tiedot haittatapahtumista kuukauden ajan ensimmäisestä annoksesta alkaen viimeisen imeväiselle annetun rokotuksen jälkeen ja kuukauden ajan taaperoille tarkoitetun annoksen jälkeen. Vakavia haittatapahtumia arvioitiin faasin 3 tutkimuksessa B7471012 (tutkimus 1012) yhden kuukauden ajan viimeisen annoksen jälkeen ja faasin 3 tutkimuksissa 1011 ja 1013 ja faasin 2 tutkimuksessa 1003 kuusi kuukautta viimeisen annoksen jälkeen.
Imeväisikäisille kolmen annoksen ja neljän annoksen sarjoina annettu Prevenar 20 -rokote oli hyvin siedetty, sillä vaikea-asteisia paikallisia reaktioita ja systeemisiä tapahtumia ilmaantui vähän ja valtaosa reaktioista hävisi 1–3 päivän kuluessa. Niiden osallistujien prosentuaalinen osuus, joilla oli paikallisia reaktioita ja systeemisiä tapahtumia Prevenar 20 -rokotuksen jälkeen, oli yleisesti samankaltainen kuin Prevenar 13 ‑rokotuksen jälkeen. Yleisimmin raportoituja paikallisia reaktioita ja systeemisiä tapahtumia minkä tahansa Prevenar 20 -annoksen jälkeen olivat ärtyisyys, uneliaisuus ja kipu pistoskohdassa. Prevenar 20 -rokote annettiin näissä tutkimuksissa yhdessä tavanomaisesti lapsille annettavien rokotteiden kanssa tai sen anto näiden kanssa oli sallittua (ks. kohta Yhteisvaikutukset).
Tutkimus 1012 oli kaksoissokkoutettu, satunnaistettu, vaikuttavalla aineella kontrolloitu faasin 3 keskeinen tutkimus, jossa 601 tervettä imeväistä sai kolmen annoksen sarjan Prevenar 20 -rokotetta. Yleisimmin raportoituja (> 10 %) haittavaikutuksia minkä tahansa Prevenar 20 -annoksen jälkeen olivat ärtyisyys (71,0–71,9 %), uneliaisuus / lisääntynyt nukkuminen (50,9–61,2 %), pistoskohdan kipu (22,8–42,4 %), heikentynyt ruokahalu (24,7–39,3 %), pistoskohdan punoitus (25,3–36,9 %), pistoskohdan turpoaminen (21,4–29,8 %) ja ≥ 38,0 ℃:n kuume (8,9–24,3 %). Valtaosa haittavaikutuksista ilmaantui 1–2 päivää rokotuksen jälkeen, ja ne olivat vaikeusasteeltaan lieviä tai keskivaikeita ja lyhytkestoisia (1–2 päivää).
Tutkimukset 1011, 1013 ja 1003 olivat kaksoissokkoutettuja, satunnaistettuja, vaikuttavalla aineella kontrolloituja tutkimuksia, joissa oli mukana 2 232 tervettä imeväistä, jotka saivat neljän annoksen sarjan Prevenar 20 -rokotetta. Yleisimmin raportoituja (> 10 %) haittavaikutuksia, joita havaittiin imeväisillä minkä tahansa Prevenar 20 -annoksen jälkeen, olivat ärtyisyys (58,5–70,6 %), uneliaisuus / lisääntynyt nukkuminen (37,7–66,2 %), pistoskohdan kipu (32,8–45,5 %), heikentynyt ruokahalu (23,0–26,4 %), pistoskohdan punoitus (22,6–24,5 %) ja pistoskohdan turpoaminen (15,1–17,6 %). Valtaosa rokotuksen jälkeisistä haittavaikutuksista oli lieviä tai kohtalaisia ja valtaosa reaktioista meni ohi 1–3 päivässä. Vaikeita reaktioita raportoitiin harvoin.
Tutkimuksessa 1013 paikallisia reaktioita ja systeemisiä tapahtumia ilmeni keskosten alaryhmässä (111 imeväistä, jotka olivat syntyneet raskausviikoilla 34 – < 37) vastaavasti tai vähemmän kuin tutkimuksen täysiaikaisena syntyneillä imeväisillä. Keskosten alaryhmässä minkä tahansa raportoidun paikallisen reaktion yleisyys oli 31,7–55,3 % Prevenar 20 -ryhmässä ja minkä tahansa raportoidun systeemisen tapahtuman yleisyys oli 65,0–85,5 % Prevenar 20 -ryhmässä.
Osallistujat iältään15 kuukaudesta17 vuoteen
Faasin 3 tutkimuksessa B7471014 (tutkimus 1014) 831 osallistujaa, jotka olivat iältään 15 kuukaudesta 17 vuoteen, sai Prevenar 20 -kerta-annoksen neljässä ikäryhmässä (209 osallistujaa ikäryhmässä 15 kuukautta – 23 kuukautta, 216 osallistujaa ikäryhmässä 2 vuotta – 4 vuotta, 201 osallistujaa ikäryhmässä 5–9 vuotta ja 205 osallistujaa ikäryhmässä 10 – 17 vuotta). Alle 5 vuoden ikäiset osallistujat olivat saaneet aiemmin vähintään kolme Prevenar 13 ‑annosta.
Yleisimmin raportoituja (> 10 %) havaittuja haittavaikutuksia minkä tahansa Prevenar 20 -annoksen jälkeen alle 2 vuoden ikäisillä osallistujilla olivat ärtyisyys (61,8 %), pistoskohdan kipu (52,5 %), uneliaisuus / lisääntynyt nukkuminen (41,7 %), pistoskohdan punoitus (37,7 %), heikentynyt ruokahalu (25,0 %), pistoskohdan turpoaminen (22,1 %) ja ≥ 38,0 °C:n kuume (11,8 %). 2 vuoden ikäisillä ja sitä vanhemmilla osallistujilla yleisimmin raportoituja haittavaikutuksia olivat pistos kohdan kipu(66,0–82,9 %), lihaskipu (26,5–48,3 %), pistoskohdan punoitus (15,1–39,1 %), väsymys (27,8–37,2 %), päänsärky (5,6–29,3 %) ja pistoskohdan turpoaminen (15,6–27,1 %).
18 vuotta täyttäneet osallistujat
Prevenar 20 -rokotteen turvallisuutta arvioitiin kuudessa kliinisessä tutkimuksessa (kaksi faasin 1, yksi faasin 2 ja kolme faasin 3 tutkimusta) 4 552:lla 18 vuotta täyttäneellä osallistujalla ja 2 496:lla vertailuryhmien osallistujalla.
Faasin 3 tutkimuksissa 4 263 osallistujaa sai Prevenar 20 -rokotetta. Näistä 1 798 oli 18–49-vuotiaita osallistujia, 334 oli 50–59-vuotiaita ja 2 131 oli 60-vuotiaita ja vanhempia osallistujia (1 138 oli 65-vuotiaita ja vanhempia). Faasin 3 tutkimuksissa Prevenar 20 -rokotetta saaneista 3 639 osallistujaa ei ollut aiemmin saanut pneumokokkirokotteita, 253 oli saanut Pneumovax 23 ‑rokotetta (pneumokokkipolysakkaridirokote [23‑valenttinen]; PPSV23) (≥ 1 – ≤ 5 vuotta ennen tutkimukseen mukaan tuloa), 246 oli saanut aiemmin vain Prevenar 13 ‑rokotetta (≥ 6 kuukautta ennen tutkimukseen mukaan tuloa) ja 125 oli saanut aiemmin Prevenar 13 -rokotetta ja sen jälkeen PPSV23-rokotetta (PPSV23-annos ≥ 1 vuosi ennen tutkimukseen mukaan tuloa).
Faasin 3 tutkimuksen B7471007 (pivotaalitutkimus 1007) osallistujien haittatapahtumat arvioitiin 1 kuukauden ajan rokotuksen jälkeen sekä vakavat haittatapahtumat 6 kuukauden ajan rokotuksen jälkeen. Tässä tutkimuksessa 447 osallistujaa oli iältään 18–49-vuotiaita, 445 osallistujaa oli 50–59-vuotiaita, 1 985 oli 60–64-vuotiaita, 624 oli 65–69-vuotiaita, 319 oli 70–79-vuotiaita ja 69 osallistujaa oli ≥ 80-vuotiaita.
Tutkimusten 1007 ja B7471008 (Faasi 3, erien yhdenmukaisuustutkimus 1008) iältään 18–49-vuotiailla osallistujilla yleisimmin raportoituja haittavaikutuksia olivat injektiokohdan kipu (79,2 %), lihaskipu (62,9 %), väsymys (46,7 %), päänsärky (36,7 %) ja nivelkipu (16,2 %). Tutkimuksen 1007 iältään 50–59-vuotiailla osallistujilla yleisimmin raportoituja haittavaikutuksia olivat injektiokohdan kipu (72,5 %), lihaskipu (49,8 %), väsymys (39,3 %), päänsärky (32,3 %) ja nivelkipu (15,4 %). Tutkimuksen 1007 iältään ≥ 60-vuotiailla osallistujilla yleisimmin raportoituja haittavaikutuksia olivat injektiokohdan kipu (55,4 %), lihaskipu (39,1 %), väsymys (30,2 %), päänsärky (21,5 %) ja nivelkipu (12,6 %). Nämä olivat vaikeusasteeltaan tavallisesti lieviä tai keskivaikeita ja hävisivät muutaman päivän kuluttua rokotuksesta.
Faasin 3 tutkimuksessa B7471006 (tutkimus 1006) arvioitiin Prevenar 20 -rokotetta ≥ 65-vuotiailla osallistujilla, joiden edeltävä pneumokokkirokotusstatus vaihteli (rokotettu aiemmin PPSV23-rokotteella, Prevenar 13 -rokotteella tai Prevenar 13 -rokotteella ja sen jälkeen PPSV23-rokotteella). Tässä tutkimuksessa yleisimmin raportoidut haittavaikutukset olivat esiintyvyydeltään samankaltaisia kuin haittavaikutukset, joita havaittiin ≥ 60-vuotiailla osallistujilla tutkimuksessa 1007. Injektiokohdan kipu (61,2 %) oli hieman yleisempää osallistujilla, jotka oli aiemmin rokotettu Prevenar 13 -rokotteella, ja nivelkipu (16,8 %) oli hieman yleisempää osallistujilla, jotka oli aiemmin rokotettu Prevenar 13 -rokotteella ja sen jälkeen PPSV23-rokotteella.
Haittavaikutustaulukko
Imeväisillä tehdyssä faasin 2, lapsilla ja aikuisilla tutkittavilla tehdyissä faasin 3 kliinisissä tutkimuksissa havaitut ja valmisteen markkinoille tulon jälkeen havaitut haittavaikutukset esitetään jäljempänä taulukkona.
Kliinisissä tutkimuksissa esiintyneet haittavaikutukset
Prevenar 20 sisältää 13 samaa serotyyppispesifistä kapselipolysakkaridikonjugaattia ja samat rokotteen apuaineet kuin Prevenar 13, joten Prevenar 13 ‑rokotteella jo tunnistetut haittavaikutukset koskevat myös Prevenar 20 -rokotetta. Taulukossa 1 esitetään imeväisille tehdyssä faasin 2 tutkimuksessa sekä lapsilla ja aikuisilla tutkittavilla tehdyissä faasin 3 tutkimuksissa rokotuksen jälkeen Prevenar 20 -ryhmässä tai integroiduissa tietoaineistoissa raportoidut haittavaikutukset, paikallisreaktiot ja systeemiset tapahtumat niiden suurimman esiintyvyyden mukaan. Kliinisistä tutkimuksista imeväisistä saadut tiedot kuvastavat rokotteen antoa samanaikaisesti muiden tavanomaisten lapsuusiässä annettavien rokotteiden kanssa.
Haittavaikutukset on lueteltu elinjärjestelmittäin esiintyvyyden ja vakavuuden mukaan alenevassa järjestyksessä. Esiintyvyydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
| Taulukko 1. Kliinisiin Prevenar 20 -tutkimuksiin perustuva haittavaikutustaulukko | ||||
| Elinjärjestelmä | Haittavaikutukset | Esiintyvyys | ||
| Imeväiset/lapset/nuoret | Aikuiset | |||
| ikä 6 viikkoa - < 5 vuotta | ikä 5 - < 18 vuotta | |||
| Immuunijärjestelmä | Yliherkkyysreaktiot, mukaan lukien kasvojen turvotus, hengenahdistus, bronkospasmi | Harvinainena | - | Melko harvinainen |
| Aineenvaihdunta ja ravitsemus | Heikentynyt ruokahalu | Hyvin yleinen | Hyvin yleinena | Hyvin yleinena |
| Psyykkiset häiriöt | Ärtyisyys | Hyvin yleinen | Hyvin yleinena | - |
| Itkuisuus | Melko harvinainena | - | - | |
| Hermosto | Uneliaisuus / lisääntynyt nukkuminen | Hyvin yleinen | Hyvin yleinena | - |
| Kouristuskohtaukset (mukaan lukien kuumekouristukset) | Melko harvinainen | - | - | |
| Hypotonis-hyporesponsiivinen episodi | Harvinainena | - | - | |
| Levoton uni / vähentynyt nukkuminen | Hyvin yleinena | Hyvin yleinena | - | |
| Päänsärky | - | Hyvin yleinen | Hyvin yleinen | |
| Ruoansulatuselimistö | Ripuli | Yleinen | Yleinena | Melko harvinainenb |
| Pahoinvointi | - | - | Melko harvinainen | |
| Oksentelu | Yleinen | Yleinena | Melko harvinainenb | |
| Iho ja ihonalainen kudos | Ihottuma | Yleinen | Yleinena | Melko harvinainenb |
| Angioedeema | - | - | Melko harvinainen | |
| Nokkosihottuma tai nokkosihottuman kaltainen ihottuma | Melko harvinainen | Melko harvinainen | - | |
| Luusto, lihakset ja sidekudos | Lihaskipu | - | Hyvin yleinen | Hyvin yleinen |
| Nivelkipu | - | Yleinen | Hyvin yleinen | |
| Yleisoireet ja antopaikassa todettavat haitat | Kuume | Hyvin yleinen | Melko harvinainen | Yleinen |
| Yli 38,9 °C:n kuume | Yleinen | - | - | |
| Väsymys | - | Hyvin yleinen | Hyvin yleinen | |
| Pistoskohdan punoitus | Hyvin yleinen | Hyvin yleinen | Yleinenb | |
| Pistoskohdan kovettuma/turpoaminen | Hyvin yleinen | Hyvin yleinen | Yleinenb | |
| Pistoskohdan punoitus tai kovettuma/turpoaminen (> 2,0–7,0 cm) | Hyvin yleinen (taaperoille tarkoitetun annoksen jälkeen sekä isommilla lapsilla [ikä 2 – < 5 vuotta]) | - | - | |
| Yleinen (imeväisille tarkoitetun rokotussarjan jälkeen) | - | - | ||
| Pistoskohdan punoitus tai kovettuma/turpoaminen (> 7,0 cm) | Melko harvinainen | - | - | |
| Pistoskohdan kipu/aristus | Hyvin yleinen | Hyvin yleinen | Hyvin yleinen | |
| Pistoskohdan kipu/aristus, josta aiheutuu raajan liikerajoitus | Yleinen | Yleinen | Hyvin yleinena | |
| Pistoskohdan kutina | - | - | Melko harvinainen | |
| Lymfadenopatia | - | - | Melko harvinainen | |
| Pistoskohdan nokkosihottuma | - | - | Melko harvinainen | |
| Vilunväreet | - | - | Melko harvinainenb | |
| Pistoskohdan yliherkkyys | Harvinainenc | - | - | |
a. Nämä esiintyvyydet perustuvat Prevenar 13 ‑rokotteella tehdyissä kliinisissä tutkimuksissa raportoituihin haittavaikutuksiin, koska näitä haittavaikutuksia ei raportoitu imeväisillä (faasit 2 ja 3), alle 18-vuotiailla lapsilla ja nuorilla ja 18 vuotta täyttäneillä aikuisilla (faasi 3) tehdyissä Prevenar 20-tutkimuksissa, minkä vuoksi esiintyvyys on tuntematon. b. Tapahtumaa raportoitiin aikuisilla tehdyissä kliinisissä Prevenar 13 ‑tutkimuksissa hyvin yleisesti (≥ 1/10). c. Haittavaikutusta ei raportoitu Prevenar 13 ‑rokotteella, mutta pistoskohdan nokkosihottumaa, pistoskohdan kutinaa ja pistoskohdan dermatiittia raportoitiin Prevenar 13 ‑rokotteen käytössä myyntiluvan saamisen jälkeen. | ||||
Turvallisuus aikuisille samanaikaisesti annettavien rokotteiden kanssa
Kun Prevenar 20 -rokotetta annettiin iältään ≥ 65-vuotiaille aikuisille yhdessä kolmannen (tehoste) COVID-19-mRNA-rokoteannoksen (nukleosidimuokattu) kanssa, siedettävyysprofiili muistutti yleisesti yksinään annetun COVID-19-mRNA-rokotteen (nukleosidimuokattu) siedettävyysprofiilia. Turvallisuusprofiilissa oli joitakin eroja Prevenar 20 -rokotteen yksinään antoon verrattuna. Faasin 3 tutkimuksessa B7471026 (tutkimus 1026) kuumetta (13,0 %) ja vilunväristyksiä (26,5 %) raportoitiin samanaikaisessa annossa hyvin yleisesti. Rokotteet samanaikaisesti saaneiden ryhmässä raportoitiin myös yksi huimausta (0,5 %) koskenut tapaus.
Valmisteen markkinoille tulon jälkeiseen kokemukseen perustuvat haittavaikutukset
Taulukossa 2 esitetään Prevenar 13 ‑rokotteen käytössä markkinoille tulon jälkeen lapsilla ja aikuisilla rokotetuilla spontaanisti raportoidut haittavaikutukset, joita voi esiintyä myös Prevenar 20 -rokotetta käytettäessä. Prevenar 13 ‑rokotteen markkinoille tulon jälkeinen turvallisuutta koskeva kokemus on oleellinen myös Prevenar 20 -rokotteen kannalta, koska Prevenar 20 sisältää kaikkia Prevenar 13 ‑rokotteen komponentteja (polysakkaridikonjugaatit ja apuaineet). Nämä tapahtumat raportoitiin vapaaehtoisesti potilasjoukosta, jonka kokoa ei tiedetä. Sen vuoksi niiden esiintyvyyttä ei voida arvioida luotettavasti eikä kaikkien tapahtumien osalta voida varmistaa syy-yhteyttä rokotteelle altistumiseen.
| Taulukko 2. Prevenar 13 ‑rokotteella todetut haittavaikutukset markkinoille tulon jälkeen | |
| Elinjärjestelmä | Esiintyvyys tuntematon |
| Veri ja imukudos | Pistoskohdan seudulle paikallistunut lymfadenopatia |
| Immuunijärjestelmä | Anafylaktinen/anafylaktoidinen reaktio, mukaan lukien sokki |
| Iho ja ihonalainen kudos | Angioedeema, Erythema multiforme |
| Yleisoireet ja antopaikassa todettavat haitat | Pistoskohdan dermatiitti, pistoskohdan nokkosihottuma, pistoskohdan kutina |
Tapahtumat raportoitu spontaanisti Prevenar 13 ‑rokotteen markkinoille tulon jälkeisessä käytössä, joten esiintyvyyttä ei voitu saatavissa olevan Prevenar 20 -rokotetta koskevan tiedon perusteella arvioida ja esiintyvyys on tuntematon.
Lisätietoja Prevenar 13 ‑tutkimusten erityisryhmistä
HIV-infektoituneilla 6 – < 18-vuotiailla osallistujilla haittavaikutusten esiintyvyydet olivat samankaltaisia kuin taulukossa 1, lukuun ottamatta kuumetta (11–19 %), nivelkipua (24–42 %) ja oksentelua (8–18 %), jotka olivat hyvin yleisiä. HIV-infektoituneilla ≥ 18-vuotiailla osallistujilla haittavaikutusten esiintyvyydet olivat samankaltaisia kuin taulukossa 1, lukuun ottamatta kuumetta (5–18 %) ja oksentelua (8–12 %), jotka olivat hyvin yleisiä, ja pahoinvointia (< 1–3 %), joka oli yleistä.
Hematopoieettisen kantasolusiirron saaneilla 2 – < 18-vuotiailla osallistujilla haittavaikutusten esiintyvyydet olivat samankaltaisia kuin taulukossa 1, lukuun ottamatta raajan liikerajoituksen aiheuttanutta pistoskohdan kipua (5–15 %), oksentelua (6–21 %), ripulia (15–32 %) ja nivelkipua (25–32 %), jotka olivat hyvin yleisiä. Osallistujilla (≥ 18-vuotiailla), joille on tehty hematopoieettinen kantasolusiirto, haittavaikutusten esiintyvyydet olivat samankaltaisia kuin taulukossa 1, lukuun ottamatta kuumetta (4–15 %), oksentelua (6–21 %) ja ripulia (25–36 %), jotka olivat hyvin yleisiä.
Sirppisolutautia sairastavilla 6 – < 18-vuotiailla osallistujilla haittavaikutusten esiintyvyydet olivat samankaltaisia kuin taulukossa 1, lukuun ottamatta raajan liikerajoituksen aiheuttanutta pistoskohdan kipua (11–16 %), kuumetta (21–22 %), oksentelua (13–15 %), ripulia (13–25 %) ja nivelkipua (40–45 %), jotka olivat hyvin yleisiä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Prevenar 20 -yliannostus on epätodennäköistä, koska rokote saatavissa esitäytetyssä ruiskussa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: pneumokokkirokotteet; ATC-koodi: J07AL02
Vaikutusmekanismi
Prevenar 20 sisältää 20:n pneumokokkiserotyypin kapselin polysakkaridia, jotka kaikki on konjugoitu CRM197-kantajaproteiiniin. CRM197-kantajaproteiini muuttaa immuunivasteen polysakkarideille T-soluriippumattomasta vasteesta T-soluriippuvaiseksi vasteeksi. T-soluriippuvainen vaste johtaa tehostuneeseen vasta-ainevasteeseen ja indusoi toiminnallisia (opsonisaatiota, fagosytoosia ja pneumokokkien tuhoamista tehostavia) vasta-aineita pneumokokkitaudilta suojaamiseksi, ja se johtaa lisäksi B-muistisolujen muodostumiseen ja siten anamnestiseen (tehoste)vasteeseen altistuttaessa bakteerille.
Streptococcus pneumoniae ‑bakteerille altistumisen tai pneumokokkirokotuksen jälkeiset immuunivasteet lapsilla ja aikuisilla voidaan määrittää mittaamalla immunoglobuliini G (IgG)- ja opsonofagosyyttinen aktiivisuus (OPA) ‑vasteet. Opsonofagosyyttinen aktiivisuus mittaa vasta-aineiden toiminnallista aktiivisuutta ja se katsotaan aikuisilla pneumokokkitautia estävän suojan tärkeäksi immunologiseksi mittariksi. Lapsilla pneumokokkikonjugaattirokotteiden kliiniseen arviointiin käytetään useita immunogeenisuuskriteereitä, mukaan lukien niiden rokotettujen lasten osuutta, jotka saavuttavat serotyyppispesifisen IgG-vasta-ainepitoisuuden ≥ 0,35 mikrog/ml käytettäessä WHO:n ELISA-määritystä (entsyymivälitteinen immunosorbenttimääritys) tai vastaavan määritysspesifisen arvon. Serotyyppispesifisiä immuunivasteita, jotka korreloivat yksilöllisen pneumokokkitautia estävän suojan kanssa, ei ole tarkoin määritelty.
Kliininen teho
Prevenar 20 -rokotteella ei ole tehty tehotutkimuksia.
Immunogeenisuustiedot
Kliiniset Prevenar 20 -tutkimukset imeväisillä, lapsilla ja nuorilla
Immunogeenisuutta on arvioitu serotyyppispesifisten IgG-vastelukujen (niiden osallistujien lukumäärä, joilla todettiin serotyyppispesifinen IgG-pitoisuus ≥ 0,35 mikrog/ml tai vastaava määritysspesifinen arvo) ja IgG-pitoisuuksien geometrisen keskiarvon (geometric mean concentrations, GMCs) perusteella 1 kuukausi perusrokotussarjan jälkeen ja 1 kuukausi taaperoille annetun annoksen jälkeen. Myös opsonofagosyyttisen aktiivisuuden geometriset keskiarvotitterit mitattiin 1 kuukausi perusrokotussarjan jälkeen ja taaperoille annetun annoksen jälkeen. Ennalta määritelty IgG-pitoisuus, joka vastaa 0,35 mikrog/ml:aa WHO:n ELISA-määritystä käytettäessä (tai vastaavaa määritysspesifistä arvoa) soveltuu vain populaatiotasolla eikä sitä voi käyttää ennustamaan yksilöllistä tai serotyyppispesifistä suojaa invasiivista pneumokokkitautia vastaan. Keuhkokuumeelle ja akuutille välikorvatulehdukselle ei ole olemassa vastaavaa suojasta kertovaa arvoa.
Kahdessa faasin 3 kliinisessä tutkimuksessa (tutkimus 1011, tutkimus 1012) ja yhdessä faasin 2 kliinisessä tutkimuksessa (tutkimus 1003) arvioitiin Prevenar 20 -rokotteen 3 annoksen ja 4 annoksen sarjan immunogeenisuutta imeväisillä. Yhdessä faasin 3 tutkimuksessa (tutkimus 1014) arvioitiin Prevenar 20 -kerta-annosta lapsilla, jotka olivat iältään 15 kuukaudesta 17 vuoteen.
Immuunivasteet imeväisten neljästä annoksesta koostuvan rokotussarjan 3 ja 4 annoksen jälkeen
Tutkimus 1011 tehtiin Yhdysvalloissa ja Puerto Ricossa 1 991 terveellä imeväisellä, jotka olivat suostumuksen ajankohtana 2 kuukauden (≥ 42 – ≤ 98 päivän) ikäisiä ja syntyneet raskausviikolla > 36. Imeväiset satunnaistettiin (suhteessa 1:1), ja he saivat joko Prevenar 20- tai Prevenar 13 ‑rokotuksen noin 2, 4, 6 ja 12–15 kuukauden iässä. Osallistujat saivat myös muita lapsilla käytettäviä rokotteita, mukaan lukien kurkkumätä, jäykkäkouristus, hinkuyskä (soluton), hepatiitti B (rDNA), polio (inaktivoitu) ja Haemophilus influenzae tyyppi b ‑konjugaatti (adsorboitu) ‑yhdistelmärokotteen, jota annettiin 3 annosta, MPR-rokotetta (tuhkarokko, sikotauti, vihurirokko) ja taaperoille tarkoitetun annoksen vesirokkorokotetta. Rotavirus- ja influenssarokotteiden samanaikainen antaminen oli tutkimuksessa sallittua.
Yksi kuukausi kolmannen imeväisille annetun annoksen jälkeen serotyyppispesifisten IgG-pitoisuuksien geometrinen keskiarvo oli vertailukelpoinen (non-inferior, kriteeri 10 %) 9:llä 13:sta yhteisestä serotyypistä ja ei-vertailukelpoinen 4 serotyypillä (serotyypit 3, 4, 9V ja 23F). (Taulukko 3). Myös kuusi 7:stä lisäserotyypistä täytti vertailukelpoisuuden kriteerin Prevenar 13 ‑ryhmän pienimpään tulokseen verrattuna (pois lukien serotyyppi 3); serotyyppi 12F ei täyttänyt tilastollista vertailukelpoisuuden kriteeriä. IgG:n geometriset keskiarvotitterit (GMC) olivat vertailukelpoisia 1 kuukauden kuluttua Prevenar 20 -rokotteen kolmannesta annoksesta (geometristen keskiarvojen suhteen [GMR] vertailukelpoisuuden kriteeri 0,5) Prevenar 13 -ryhmän kaikkien 13 yhteisten serotyypien suhteen. Prevenar 13 ‑ryhmässä kaikki 7 lisäserotyyppiä täyttivät myös pienimmän vertailukelpoisuuden (non-inferiority) kriteerin (serotyyppi 3 poislukien) IgG-pitoisuuden geometriselle keskiarvolle rokotteen serotyyppien osalta (taulukko 3).
7 lisäserotyypin vasta-ainepitoisuudet olivat merkitsevästi suuremmat kuin vastaavien serotyyppien pitoisuudet Prevenar 13 ‑ryhmässä (taulukot 3 ja 4).
Yksi kuukausi taaperoille annetun Prevenar 20 -annoksen jälkeen IgG-pitoisuuksien geometrinen keskiarvo (IgG:n GMR:n vertailukelpoisuuden kriteeri 0,5) oli kaikilla 13 yhteisellä serotyypillä vertailukelpoinen (non-inferior). Prevenar 13 ‑ryhmässä kaikki 7 lisäserotyyppiä täyttivät myös pienimmän IgG-pitoisuuden geometrisen keskiarvon (serotyyppi 3 poislukien) vertailukelpoisuuden (non-inferiority) kriteerin rokotteen serotyyppien osalta (taulukko 4). Vaikka vertailukelpoisuutta ei testattu virallisesti tälle päätetapahtumalle, havaitut erot (Prevenar 20- ja Prevenar 13 -ryhmien välillä) niiden osallistujien prosenttiosuuksissa, joilla oli ennalta määritellyt serotyyppispesifiset IgG-vasta-ainepitoisuudet 1 kuukauden kuluttua neljännestä annoksesta, olivat suurempia kuin -10 % kaikkien 13 yhteisten serotyyppien osalta, lukuun ottamatta serotyyppiä 3 (‑16,4 %, CI -21,0 %, -11,8 %). 7:llä lisäserotyypillä havaitut erot niiden osallistujien prosenttiosuuksissa, joilla oli ennalta määritellyt serotyyppispesifiset IgG-vasta-ainepitoisuudet 1 kuukauden kuluttua neljännestä annoksesta, vaihtelivat -11,5 %:sta (serotyyppi 12F) 1,8 %:iin (serotyypit 15B, 22F ja 33F) (taulukko 4).
| Taulukko 3. Prosenttiosuudet osallistujista, joilla oli ennalta määritellyt IgG-pitoisuudet ja IgG-pitoisuuksien geometrinen keskiarvo (mikrog/ml) yksi kuukausi 4 annoksen sarjan kolmannen annoksen jälkeen, tutkimus 1011a | ||||||
| Niiden osallistujien prosenttiosuudet, joilla oli ennalta määritellyt IgG-pitoisuudetb | IgG-pitoisuuksien geometrinen keskiarvo | |||||
Prevenar 20 Nc = 831–833 | Prevenar 13 Nc = 801–802 | Ero (Prevenar 20 – Prevenar 13) | Prevenar 20 Nc = 831–833 | Prevenar 13 Nc = 801–802 | Prevenar 20/ Prevenar 13 | |
| % | % | % (95 %:n luottamusvälid) | Pitoisuuksien geometrinen keskiarvoe | Pitoisuuksien geometrinen keskiarvoe | Geometristen keskiarvojen suhde, (95 %:n luottamusvälie) | |
| Serotyypit | ||||||
| 1 | 84,9 | 91,1 | -6,3 (-9,4–3,1) | 0,74 | 1,14 | 0,65 (0,59–0,72) |
| 3 | 40,5 | 55,2 | -14,8 (-19,5 – -10,0) | 0,36 | 0,51 | 0,70 (0,64–0,76) |
| 4 | 78,2 | 87,5 | 9,4 (-13,0–5,8) | 0,75 | 1,08 | 0,70 (0,63–0,78) |
| 5 | 86,2 | 90,5 | -4,3 (-7,5 – -1,2) | 0,66 | 0,96 | 0,69 (0,61–0,77) |
| 6A | 94,2 | 96,1 | -1,9 (-4,0–0,2) | 1.95 | 2.69 | 0.72 (0.65–0.81) |
| 6B | 88,3 | 92,4 | -4.1 (-7,0 – -1,2) | 0,61 | 1,02 | 0,60 (0,51–0,70) |
| 7F | 96,4 | 97,3 | -0.9 (-2,6–0,9) | 1,71 | 2,29 | 0.75 (0,69–0,81) |
| 9V | 80,3 | 88,8 | -8.5 (-12,0 – -5,0) | 0,87 | 1,21 | 0,72 (0,65–0,80) |
| 14 | 94,2 | 95,4 | -1.2 (-3,4–1,0) | 2,16 | 2,72 | 0,79 (0,71–0,89) |
| 18C | 87,3 | 89,4 | -2,1 (-5,3, 1,0) | 1,31 | 1,71 | 0,77 (0,70–0,84) |
| 19A | 96,3 | 98,0 | -1,7 (-3,4 – -0,1) | 0,72 | 0,91 | 0,79 (0,72–0,86) |
| 19F | 96,0 | 95,9 | 0,2 (-1,8–2,1) | 1,59 | 2,00 | 0,79 (0,73–0,86) |
| 23F | 74,3 | 83,2 | -8,9 (-12,8 – -4,9) | 0,82 | 1,25 | 0,66 (0,58–0,75) |
| Lisäserotyypitf | ||||||
| 8 | 95,8 | 83,2f | 12,6 (9,8–15,6) | 1,80 | 0,91g | 1,98 (1,81–2,16) |
| 10A | 88,0 | 83,2f | 4,8 (1,4–8,3) | 1,21 | 0,91g | 1,32 (1,18–1,49) |
| 11A | 90,0 | 83,2f | 6,9 (3,6–10,2) | 1,39 | 0,91g | 1,52 (1,39–1,67) |
| 12F | 48,0 | 83,2f | -35,1 (-39,4 – -30,8) | 0,55 | 0,91g | 0.60 (0,54–0,67) |
| 15B | 97,0 | 83,2f | 13.8 (11,1–16,8) | 4,40 | 0,91g | 4,82 (4,39–5,30) |
| 22F | 98,7 | 83,2f | 15,5 (12,9–18,3) | 3,71 | 0,91g | 4,06 (3,68–4,48) |
| 33F | 89,3 | 83,2f | 6,1 (2,8–9,5) | 1,49 | 0,91g | 1,64 (1,46–1,83) |
Lyhenteet: dLIA = Luminex-pohjainen suora immuunimääritys; IgG = immunoglobuliini G Huom.: Serotyyppi todettiin vertailukelpoiseksi, jos kaksisuuntaisen 95 %:n luottamusvälin alaraja prosenttiosuuksien erolle (Prevenar 20 vs. Prevenar 13) oli > -10 % tai jos kaksisuuntaisen 95 %:n luottamusvälin alaraja (Prevenar 20 vs. Prevenar 13) geometriselle keskiarvolle oli > 0,5 kyseiselle serotyypille. Huom.: alle määritysrajan (LLOQ) olevina määritystuloksina analyysissa käytettiin 0,5 × LLOQ. a. Tutkimus 1011 tehtiin Yhdysvalloissa ja Puerto Ricon territoriossa (NCT04382326). b. Prevenar 13 -serotyyppien ennalta määritellyt pitoisuudet on saatu julkaisusta siltatutkimuksesta (Tan CY et al. 2018) käyttämällä tuloksia, jotka on saatu imeväisten perussarjan annosten jälkeen, ennen taaperoille annettua annosta ja taaperoille annetun annoksen jälkeen (rokotusaikataulu koostuu 3 imeväisten annoksesta ja sen jälkeen yhdestä taaperoiden annoksesta) lukuun ottamatta serotyyppiä 19A, jolle käytettiin pelkästään imeväisten annosten jälkeisiä tuloksia. 7 lisäserotyypin ennalta määritellyt pitoisuudet ovat peräisin faasin 2 tutkimuksesta B7471003 saatujen tietojen yhdenmukaisuusarvioinnista (kliininen dLIA uudelle ELISA-määritykselle), jossa myös käytetään rokotusaikataulua, joka koostuu 3 imeväisten annoksesta ja sen jälkeen yhdestä taaperoiden annoksesta. c. N = niiden osallistujien lukumäärä, joista oli luotettava IgG-pitoisuus. d. Kaksisuuntainen luottamusväli Miettisen ja Nurmisen menetelmällä. e. Pitoisuuksien geometrinen keskiarvo, geometrisen keskiarvon suhteet ja niihin liittyvät kaksisuuntaiset luottamusvälit laskettiin eksponoimalla pitoisuuksien logaritmien ja vastaavien luottamusvälien keskiarvot ja keskiarvojen erot (Prevenar 20 – Prevenar 13) (Studentin t-jakauman perusteella). f. 7.n lisäserotyypin prosenttiosuuksien erojen vertailukelpoisuuden arviointia varten käytettiin serotyypin 23F (Prevenar 13 -serotyyppi, jolla oli pienin prosenttiosuus, lukuun ottamatta serotyyppiä 3) IgG-tuloksia Prevenar 13 -ryhmästä. Niiden osallistujien prosenttiosuudet, joilla oli ennalta määritellyt IgG-pitoisuudet serotyypeille 8, 10A, 11A, 12F, 15B, 22F ja 33F Prevenar 13 -ryhmässä, olivat 1,4 %, 1,9 %, 1,4 %, 0,1 %, 1,2 %, 1,4 % ja 1,5 %. g. 7 lisäserotyypin geometristen keskiarvojen vertailukelpoisuuden arviointiin käytettiin serotyyppi 19A:n IgG-tuloksia (Prevenar 13 -serotyyppi, jolla oli pienin prosenttiosuus, lukuun ottamatta serotyyppiä 3) Prevenar 13 -ryhmästä. IgG-pitoisuuksien geometriset keskiarvotitterit serotyypeille 8, 10A, 11A, 12F, 15B, 22F ja 33F Prevenar 13 -ryhmässä olivat 0,02 µg/ml, 0,01 µg/ml, 0,02 µg/ml, 0,01 µg/ml, 0,03 µg/ml, 0,01 µg/ml ja 0,02 µg/ml. | ||||||
| Taulukko 4. Prosenttiosuudet osallistujista, joilla oli ennalta määritellyt IgG-pitoisuudet ja IgG-pitoisuuksien geometriset keskiarvot (mikrog/ml) kuukausi neljästä annoksesta koostuvan sarjan neljännen annoksen jälkeen, tutkimus 1011a | ||||||
| Niiden osallistujien prosenttiosuudet, joilla oli ennalta määritellyt IgG-pitoisuudetb | IgG-pitoisuuksien geometrinen keskiarvo | |||||
Prevenar 20 Nc = 753–755 | Prevenar 13 Nc = 744–745 | Ero (Prevenar 20 – Prevenar 13) | Prevenar 20 Nc = 753–755 | Prevenar 13 Nc = 744–745 | Prevenar 20/ Prevenar 13 | |
| % | % | % (95 %:n luottamusvälid) | Pitoisuuden geometrinen keskiarvoe | Pitoisuuden geometrinen keskiarvoe | Geometrisen keskiarvon suhde (95 %:n luottamusvälie) | |
| Serotyypit | ||||||
| 1 | 95,5 | 98,1 | -2,6 (-4,5 – -0,9) | 1,47 | 2,12 | 0,69 (0,63–0,76) |
| 3 | 60,8 | 77,2 | -16,4 (-21,0, -11,8) | 0,56 | 0,85 | 0,66 (0,61–0,73) |
| 4 | 98,8 | 98,9 | -0,1 (-1,3 – 1,1) | 3,77 | 4,84 | 0,78 (0,70–0,86) |
| 5 | 98,8 | 98,7 | 0,2 (-1,1 – 1,4) | 1,87 | 2,51 | 0,74 (0,67–0,82) |
| 6A | 99,5 | 99,9 | -0,4 (-1,2 – 0,3) | 9,01 | 11,69 | 0,77 (0,70–0,85) |
| 6B | 99,1 | 99,5 | -0,4 (-1,4 – 0,6) | 4,01 | 5,74 | 0,70 (0,62–0,79) |
| 7F | 99,5 | 99,9 | -0,4 (-1,2 – 0,3) | 3,91 | 5,18 | 0,76 (0,70–0,82) |
| 9V | 98,3 | 98,9 | -0,6 (-2,0 – 0,6) | 3,44 | 4,30 | 0,80 (0,73–0,88) |
| 14 | 99,2 | 99,6 | -0,4 (-1,4 – 0,5) | 5,68 | 6,34 | 0,90 (0,81–1,00) |
| 18C | 97,6 | 97,9 | -0,2 (-1,8 – 1,3) | 3,46 | 4,69 | 0,74 (0,67–0,82) |
| 19A | 99,9 | 99,7 | 0,1 (-0,5 – 0,9) | 3,53 | 4,13 | 0,85 (0,77–0,94) |
| 19F | 98,8 | 98,7 | 0,2 (-1,1 – 1,4) | 5,01 | 5,79 | 0,86 (0,78–0,96) |
| 23F | 96,6 | 97,9 | -1,3 (-3,1 – 0,4) | 3,95 | 6,18 | 0,64 (0,57–0,72) |
| Lisäserotyypit | ||||||
| 8 | 99,2 | 97,9f | 1,4 (0,1–2,8) | 3,97 | 2,12g | 1,87 (1,71–2,06) |
| 10A | 98,7 | 97,9f | 0,8 (-0,5 – 2,3) | 6,22 | 2,12g | 2,94 (2,64–3,26) |
| 11A | 98,7 | 97,9f | 0,8 (-0,5 – 2,3) | 3,53 | 2,12g | 1,67 (1,51–1,84) |
| 12F | 86,4 | 97,9f | -11,5 (-14,3 – -8,9) | 1,85 | 2,12g | 0,88 (0,79–0,97) |
| 15B | 99,6 | 97,9f | 1,8 (0,7–3,1) | 12,59 | 2,12g | 5,95 (5,39–6,55) |
| 22F | 99,6 | 97,9f | 1,8 (0,7–3,1) | 10,60 | 2,12g | 5,01 (4,54–5,52) |
| 33F | 99,6 | 97,9f | 1,8 (0,7–3,1) | 9,31 | 2,12g | 4,40 (3,99–4,85) |
Lyhenteet: dLIA = Luminex-pohjainen suora immuunimääritys; IgG = immunoglobuliini G Huom.: Kaltaistetun serotyypin pääteltiin olevan vertailukelpoinen (non-inferiority), jos kyseisen serotyypin prosentuaalisen eron (Prevenar 20 – Prevenar 13) kaksisuuntaisen 95 %:n luottamusvälin alaraja oli > ‑10 % tai geometrisen keskiarvon suhteen (Prevenar 20 – Prevenar 13) kaksisuuntaisen 95 %:n luottamusvälin alaraja oli > 0,5. Huom.: alle määritysrajan (LLOQ) olevina määritystuloksina analyysissa käytettiin 0,5 × LLOQ. a. Tutkimus 1011 tehtiin Yhdysvalloissa ja Puerto Ricon territoriossa (NCT04382326). b. Prevenar 13 -serotyyppien ennalta määritellyt pitoisuudet on saatu julkaisusta siltatutkimuksesta (Tan CY et al. 2018) käyttämällä tuloksia, jotka on saatu imeväisten perussarjan annosten jälkeen, ennen taaperoille annettua annosta ja taaperoille annetun annoksen jälkeen (rokotusaikataulu koostuu 3 imeväisten annoksesta ja sen jälkeen yhdestä taaperoiden annoksesta) lukuun ottamatta serotyyppiä 19A, jolle käytettiin pelkästään imeväisten annosten jälkeisiä tuloksia. 7 muun serotyypin ennalta määritellyt pitoisuudet ovat peräisin faasin 2 tutkimuksesta B7471003 saatujen tietojen yhdenmukaisuusarvioinnista (kliininen dLIA uudelle ELISA-määritykselle), jossa myös käytetään rokotusaikataulua, joka koostuu 3 imeväisten annoksesta ja sen jälkeen yhdestä taaperoiden annoksesta. c. N = niiden osallistujien lukumäärä, joista oli luotettava IgG-pitoisuus. d. Kaksisuuntainen luottamusväli Miettisen ja Nurmisen menetelmällä. e. Pitoisuuksien geometrinen keskiarvo, geometrisen keskiarvon suhteet ja niihin liittyvät kaksisuuntaiset luottamusvälit laskettiin eksponoimalla pitoisuuksien logaritmien ja vastaavien luottamusvälien keskiarvot ja keskiarvojen erot (Prevenar 20 – Prevenar 13) (Studentin t-jakauman perusteella). f. 7:n lisäserotyypin prosenttiosuuksien erojen vertailukelpoisuuden arviointia varten käytettiin serotyyppien 18C tai 23F (Prevenar 13 -serotyyppi, jolla oli pienin prosenttiosuus, lukuun ottamatta serotyyppiä 3) IgG-tuloksia Prevenar 13 ‑ryhmästä. Niiden osallistujien prosenttiosuudet, joilla oli ennalta määritellyt IgG-pitoisuudet serotyypeille 8, 10A, 11A, 12F, 15B, 22F ja 33F Prevenar 13 -ryhmässä, olivat 4,2 %, 2,2 %, 3,8 %, 0,1 %, 3,1 %, 1,7 % ja 2,3 %. g. 7 lisäserotyypin geometristen keskiarvojen vertailukelpoisuuden arviointiin käytettiin serotyypin 1 (Prevenar 13 -serotyyppi, jolla oli pienin prosenttiosuus, lukuun ottamatta serotyyppiä 3) IgG-tuloksia Prevenar 13 -ryhmästä. IgG-pitoisuuksien geometriset keskiarvotitterit serotyypeille 8, 10A, 11A, 12F, 15B, 22F ja 33F Prevenar 13 -ryhmässä olivat 0,03 µg/ml, 0,01 µg/ml, 0,02 µg/ml, 0,01 µg/ml, 0,02 µg/ml, 0,00 µg/ml ja 0,01 µg/ml. | ||||||
13 yhteisen serotyypin opsonofagosyyttisen aktiivisuuden geometriset keskiarvotitterit olivat Prevenar 20 -ryhmässä yleisesti samankaltaiset kuin opsonofagosyyttisen aktiivisuuden geometriset keskiarvotitterit Prevenar 13 ‑ryhmässä 1 kuukausi kolmannen imeväisille annetun annoksen jälkeen ja useimmilla serotyypeillä hiukan pienemmät taaperoille annetun annoksen jälkeen. Opsonofagosyyttisen aktiivisuuden aineistossa on vaihtelua pienten otoskokojen vuoksi, ja taaperoille annetun annoksen jälkeen havaittujen hiukan pienempien keskiarvotitterien kliininen merkitys on tuntematon. Havaitut opsonofagosyyttisen aktiivisuuden geometristen keskiarvotitterit 7 lisäserotyypille olivat huomattavasti suuremmat Prevenar 20 -ryhmässä kuin Prevenar 13 -ryhmässä. Prevenar 20 -ryhmässä immuunivasteissa todetaan myös tehostumista IgG-pitoisuuksien ja opsonofagosyyttisen aktiivisuuden geometristen keskiarvotitterien perusteella taaperoille annetun annoksen jälkeen. Tämä osoittaa, että 3 imeväisille annettua annosta sai aikaan muistivasteen.
IgG-immuunivasteet 3 annoksesta koostuvan rokotussarjan 2 ja 3 annoksen jälkeen
Tutkimus 1012 tehtiin 1 204 imeväisellä, jotka olivat suostumuksen ajankohtana 2 kuukauden (≥ 42 – ≤ 112 päivän) ikäisiä ja syntyneet raskausviikolla > 36. Imeväiset satunnaistettiin (suhteessa 1:1), ja he saivat joko Prevenar 20- tai Prevenar 13 ‑rokotuksen. Ensimmäinen annos annettiin tutkimukseen mukaan tullessa, toinen annos annettiin noin 2 kuukauden kuluttua ja kolmas annos annettiin noin 11–12 kuukauden iässä.
Yksi kuukausi kahden imeväisille annetun annoksen jälkeen havaitut IgG-pitoisuuksien geometriset keskiarvot 9 yhteisen serotyypin osalta 13:sta olivat vertailukelpoisia (non-inferior) Prevenar 13 ‑ryhmän vastaavien keskiarvojen kanssa, ja 4 yhteistä serotyyppiä 13:sta (6A, 6B, 9V ja 23F) eivät täyttäneet kaksinkertaista tilastollisen vertailukelpoisuuden kriteeriä. Niiden osallistujien prosenttiosuudet, joilla oli 1 kuukauden kuluttua toisesta Prevenar 20 -annoksesta tietyt serotyyppispesifiset IgG-pitoisuudet 4 yhteiselle serotyypille 13:sta, olivat vertailukelpoisia (non-inferior, kriteeri 10 %) vastaavien Prevenar 13 ‑ryhmän prosenttiosuuksien kanssa, ja 9 yhteistä serotyyppiä 13:sta (1, 3, 4, 5, 6A, 6B, 9V, 18C ja 23F) eivät olleet vertailukelpoisia.
Immuunivasteet 7 lisäserotyypille Prevenar 20 -rokotteen antamisen jälkeen olivat vertailukelpoisia Prevenar 13 -rokotteen 13 serotyypin pienimmälle (serotyyppi 6B) IgG-pitoisuuksien geometriselle keskiarvolle. 7 lisäserotyypin osalta niiden osallistujien prosenttiosuudet, joilla oli 1 kuukauden kuluttua toisesta Prevenar 20 -annoksesta tietyt serotyyppispesifiset IgG-pitoisuudet viidelle seitsemästä lisäserotyypistä, olivat vertailukelpoisia Prevenar 13 ‑ryhmän 13 serotyypistä pienimmän prosenttiosuuden omaavan serotyypin (serotyyppi 6B) kanssa, ja serotyypit 10A ja 12F eivät täyttäneet tilastollisen vertailukelpoisuuden kriteeriä. Näiden löydösten kliinistä merkitystä ei tunneta. Lisäksi 7 lisäserotyypin osalta IgG-pitoisuuksien geometriset keskiarvot olivat suurempia kuin vastaavien serotyyppien IgG-pitoisuuksien geometriset keskiarvot Prevenar 13 ‑ryhmässä kahden imeväisille annetun annoksen jälkeen. Yksi kuukausi kolmannen (taaperoille annetun) annoksen jälkeen Prevenar 20 -ryhmässä havaittujen IgG-pitoisuuksien geometriset keskiarvot olivat vertailukelpoisia Prevenar 13 ‑ryhmän kanssa 12 yhteisen serotyypin osalta 13:sta lukuun ottamatta serotyyppiä 6B, ja kaikkien 7 lisäserotyypin IgG-pitoisuuksien geometriset keskiarvot olivat vertailukelpoisia Prevenar 13 ‑ryhmän pienimmän IgG-pitoisuuden geometrisen keskiarvon kanssa. Lisäksi 7 lisäserotyypin osalta IgG-pitoisuuksien geometriset keskiarvot olivat suuremmat kuin IgG-pitoisuuksien geometriset keskiarvot vastaavien serotyyppien osalta Prevenar 13 ‑ryhmässä taaperoille annetun annoksen jälkeen.
Toiminnalliset vasteet, joiden määritelmänä olivat 13 yhteisen serotyypin opsonofagosyyttisen aktiivisuuden (opsonophagocytic activity, OPA) geometriset keskiarvotitterit 1 kuukausi toisen imeväisille annetun annoksen jälkeen ja 1 kuukausi taaperoille annetun annoksen jälkeen, olivat Prevenar 20 -ryhmässä yleisesti samankaltaiset kuin useimpien serotyyppien opsonofagosyyttisen aktiivisuuden geometriset keskiarvotitterit Prevenar 13 ‑ryhmässä, ja havaitut opsonofagosyyttisen aktiivisuuden geometriset keskiarvotitterit olivat 7 lisäserotyypin osalta molempina ajankohtina huomattavasti suuremmat Prevenar 20 -ryhmässä kuin Prevenar 13 ‑ryhmässä. Tarkasteltaessa tilannetta ensin toisen Prevenar 20 -annoksen jälkeen ja sitten kolmannen Prevenar 20 -annoksen jälkeen IgG-pitoisuuksien havaittiin nousseen ja OPA-vasta-ainevasteiden voimistuneen kaikkien 20 serotyypin osalta, mukaan lukien ne, jotka eivät täyttäneet vertailukelpoisuuden (non-inferiority) kriteeriä. Tämä on osoitus immunologisesta muistista.
Lapset ja nuoret, ikä 15 kuukautta –< 18 vuotta (tutkimus 1014)
Osallistujat otettiin mukaan yhden hoitohaaran monikeskustutkimukseen (tutkimus 1014) ikäryhmittäin (kussakin ryhmässä noin 200 osallistujaa), ja he saivat Prevenar 20 -kerta-annoksen jäljempänä kuvatusti.
Prevenar 13 ‑rokotteella aiemmin rokotetut lapset (ikä 15 kuukautta – < 24 kuukautta)
Ikäryhmän 15 kuukaudesta – < 24 kuukautta osallistujat olivat aiemmin saaneet 3 tai 4 Prevenar 13 ‑rokoteannosta. IgG-pitoisuuksien havaittiin nousseen Prevenar 20-rokotusta edeltäneestä tilanteesta 1 kuukauteen rokotuksen jälkeen rokotteen sisältämien kaikkien 20 serotyypin osalta. 7 lisäserotyypin havaitut IgG-pitoisuuden geometrisen keskiarvon nousut olivat 27,9–1847,7.
Prevenar 13 ‑rokotteella aiemminrokotetut lapset (ikä24 kuukautta –< 5 vuotta)
Ikäryhmän 24 kuukautta – < 5 vuotta osallistujat oli aiemmin rokotettu kolmella tai neljällä Prevenar 13 ‑annoksella. IgG-pitoisuuksien havaittiin nousseen Prevenar 20 -rokotusta edeltäneestä tilanteesta 1 kuukauteen rokotuksen jälkeen rokotteen sisältämien kaikkien 20 serotyypin osalta. 7 lisäserotyypin osalta havaitut IgG-pitoisuuden geometrisen keskiarvon nousut (GMFR) olivat 36,6–796,2. 7 lisäserotyypin OPA-titterit nousivat ≥ 4-kertaisiksi 71,2–94,6 %:lla tutkittavista.
Prevenar 13 ‑rokotteella aiemmin rokotetut tai rokottamattomat lapset ja nuoret (ikä 5 vuotta – < 18 vuotta)
Ikäryhmien 5 vuotta – < 10 vuotta ja 10 vuotta – < 18 vuottta osallistujat olivat Prevenar 13 ‑rokotteella aiemmin rokotettuja tai rokottamattomia. Prevenar 20 -rokote sai iältään 5 vuotta – < 18-vuotiaille tutkittaville annetulla kerta-annoksella aikaan selkeän IgG- ja OPA-immuunivasteen rokotteen 20 serotyypille. 7 lisäserotyypin opsonofagosyyttisen aktiivisuuden geometristen keskiarvotitterien nousut (GMFR) olivat 11,5–499,0, ja rokotteen sisältämien kaikkien 20 serotyypin opsonofagosyyttisen aktiivisuuden geometristen keskiarvotitterien havaittiin suurentuneen.
Keskoset
Keskosia koskevia tietoja Prevenar 20 -rokotteen immunogeenisuudesta ei ole saatavissa. Prevenar- ja Prevenar 13 ‑rokotteista saadun kokemuksen perusteella keskosilla saadaan aikaan immuunivasteet, mutta ne voivat olla heikommat kuin täysiaikaisena syntyneillä imeväisillä. Prevenar 20 -rokotteen turvallisuutta ja siedettävyyttä arvioitiin faasin 3 tutkimuksessa (tutkimus 1013), jossa oli mukana kokonaistutkimuspopulaatioon kuuluneet 111 hieman ennenaikaisesti syntynyttä imeväistä (raskausviikoilla 34 – alle 37 syntyneet imeväiset). Osallistujat satunnaistettiin saamaan neljän annoksen sarja joko Prevenar 20 -rokotetta (N = 77) tai Prevenar 13 ‑rokotetta (N = 34).
Kliiniset Prevenar 20 -tutkimukset aikuisilla
Yhdysvalloissa ja Ruotsissa tehtiin kolme faasin 3 kliinistä tutkimusta, B7471006 (tutkimus 1006), B7471007 (tutkimus 1007) ja B7471008 (tutkimus 1008), joissa arvioitiin Prevenar 20 -rokotteen immunogeenisuutta aikuisilla eri ikäryhmissä ja osallistujilla, jotka joko eivät olleet aiemmin saaneet pneumokokkirokotetta tai oli aiemmin rokotettu Prevenar 13:lla tai PPSV23-rokotteella tai molemmilla.
Jokaisessa tutkimuksessa oli mukana terveitä osallistujia tai immunokompetentteja osallistujia, joilla oli hyvässä hoitotasapainossa oleva perussairaus, mukaan lukien krooninen sydän- ja verisuonisairaus, krooninen keuhkosairaus, munuaissairaus, diabetes, krooninen maksasairaus ja joilla oli terveydellisiä riskejä ja elintapoja (esim. tupakointi), joiden tiedetään lisäävän vakavan pneumokokkikeuhkokuumeen ja invasiivisen pneumokokkitaudin riskiä. Pivotaalitutkimuksessa (tutkimus 1007) tällaisia riskitekijöitä tunnistettiin 34 %:lla 60 vuotta täyttäneistä, 32 %:lla 50–59-vuotiaista ja 26 %:lla 18–49-vuotiaista. Stabiiliksi sairaudeksi määriteltiin tila, joka ei edeltäneiden 6 viikon aikana ollut vaatinut merkittäviä muutoksia hoitoon (eli siirtymistä toiseen lääkeryhmään kuuluvan lääkkeen käyttöön sairauden pahenemisen vuoksi) eikä sairaalahoitoa sairauden pahenemisen vuoksi tutkimusrokotteen saamista edeltäneiden 12 viikon aikana.
Prevenar 20 -rokotteen ja vertailtavien pneumokokkirokotteiden tuottamat immuunivasteet mitattiin jokaisessa tutkimuksessa määrittämällä opsonofagosyyttinen aktiivisuus (OPA). OPA-määritys mittaa vasta-aineiden toiminnallisuutta S. pneumoniaeta vastaan.
Prevenar 20 -rokotteen immuunivasteen vertailu Prevenar 13- ja PPSV23-rokotteiden immuunivasteisiin
Prevenar 20 -rokotteella Yhdysvalloissa ja Ruotsissa tehdyssä satunnaistetussa, vaikuttavalla aineella kontrolloidussa, kaksoissokkoutetussa kliinisessä non‑inferioriteettitutkimuksessa (pivotaalitutkimus 1007) 18 vuotta täyttäneet osallistujat, jotka eivät olleet aiemmin saaneet pneumokokkirokotetta, otettiin mukaan yhteen kolmesta kohortista tutkimukseen tuloajankohdan iän perusteella (18–49 vuotta, 50–59 vuotta ja ≥ 60 vuotta) ja satunnaistettiin saamaan Prevenar 20 -rokotetta tai vertailuvalmistetta. 60 vuotta täyttäneet osallistujat satunnaistettiin suhteessa 1:1 saamaan Prevenar 20 -rokotetta (n = 1 507) ja kuukausi sen jälkeen keittosuolaliuosta lumevalmisteena tai Prevenar 13 ‑rokotetta (n = 1 490) sekä kuukausi sen jälkeen PPSV23-rokotetta. 18–49-vuotiaat ja 50–59-vuotiaat osallistujat satunnaistettiin (suhteessa 3:1) saamaan Prevenar 20 -annos (18–49-vuotiaat: n = 335; 50–59-vuotiaat: n = 334) tai Prevenar 13 ‑annos (18–49-vuotiaat: n = 112; 50–59-vuotiaat: n = 111).
Serotyyppispesifiset opsonofagosyyttisen aktiivisuuden (OPA) geometriset keskiarvotitterit (GMT) mitattiin ennen ensimmäistä rokotusta ja kuukausi kunkin rokotuksen jälkeen. Prevenar 20 -rokotteen aikaansaama serotyyppikohtainen immuunivaste määritettynä opsonofagosyyttisen aktiivisuuden geometrisina keskiarvotittereinä (OPA GMT) oli vertailukelpoinen (non‑inferior) vertailuvalmisteeseen nähden, jos geometristen keskiarvotittereiden suhteen (Prevenar 20/Prevenar 13, Prevenar 20/PPV23) kaksisuuntaisen 95 %:n luottamusvälin alaraja oli yli 0,5.
60 vuotta täyttäneiden osallistujien Prevenar 20 -rokotteen tuottamat immuunivasteet kaikille 13:lle yhteiselle serotyypille olivat vertailukelpoiset (non‑inferior) Prevenar 13 ‑rokotteen tuottamien vasteiden kanssa vastaaville serotyypeille kuukausi rokotuksen jälkeen. Prevenar 20 -rokotteella havaitut yhteisten serotyyppien titterien geometriset keskiarvot olivat yleensä numeerisesti pienemmät kuin Prevenar 13 ‑rokotteella (taulukko 5), mutta näiden havaintojen kliinistä merkitystä ei tiedetä.
Prevenar 20 -rokotteen indusoimat immuunivasteet kuudelle lisäserotyypille seitsemästä olivat vertailukelpoiset (non‑inferior) PPSV23‑rokotteella aikaansaatujen vasteiden kanssa samoille serotyypeille kuukausi rokotuksen jälkeen. Vaste serotyypille 8 ei täyttänyt ennalta määriteltyä vertailukelpoisuuden (non‑inferiority) tilastollista kriteeriä (sillä geometristen keskiarvotittereiden kaksisuuntaisen 95 %:n luottamusvälin alaraja oli 0,49 eikä > 0,50) (taulukko 5). Tämän havainnon kliinistä merkitystä ei tiedetä. Prevenar 20 -ryhmän muista serotyypin 8 päätetapahtumista tueksi tehdyt analyysit olivat suotuisat. Tällaisia olivat geometrisen keskiarvon nousu rokotusta edeltävästä tilanteesta 22,1-kertaiseksi kuukausi rokotuksen jälkeen, OPA-titterien nousu ≥ 4-kertaiseksi 77,8 %:lla osallistujista rokotusta edeltävästä tilanteesta kuukausi rokotuksen jälkeen ja 92,9 %:lla osallistujista OPA-titterit ≥ alempi määritysraja (LLOQ) kuukausi rokotuksen jälkeen.
| Taulukko 5. 60 vuotta täyttäneiden osallistujien OPA-titterien geometriset keskiarvot (GMT) kuukausi Prevenar 20 -rokotuksen jälkeen Prevenar 13 ‑rokotukseen verrattuna 13 yhteisen serotyypin ja PPSV23-rokotteen muiden 7 serotyypin osalta (tutkimus 1007)a,b,c,d | |||||
Prevenar 20 (N = 1157–1430) | Prevenar 13 (N = 1390–1419) | PPSV23 (N = 1201–1319) | Rokotteiden vertailu | ||
| GMTe | GMTe | GMTe | GMT suhdee | 95 %:n luottamusvälie | |
| Serotyyppi | |||||
| 1 | 123 | 154 | 0,80 | 0,71–0,90 | |
| 3 | 41 | 48 | 0,85 | 0,78–0,93 | |
| 4 | 509 | 627 | 0,81 | 0,71–0,93 | |
| 5 | 92 | 110 | 0,83 | 0,74–0,94 | |
| 6A | 889 | 1165 | 0,76 | 0,66–0,88 | |
| 6B | 1115 | 1341 | 0,83 | 0,73–0,95 | |
| 7F | 969 | 1129 | 0,86 | 0,77–0,96 | |
| 9V | 1456 | 1568 | 0,93 | 0,82–1,05 | |
| 14 | 747 | 747 | 1,00 | 0,89–1,13 | |
| 18C | 1253 | 1482 | 0,85 | 0,74–0,97 | |
| 19A | 518 | 645 | 0,80 | 0,71–0,90 | |
| 19F | 266 | 333 | 0,80 | 0,70–0,91 | |
| 23F | 277 | 335 | 0,83 | 0,70–0,97 | |
| Muut serotyypit | |||||
| 8 | 466 | 848 | 0,55 | 0,49–0,62 | |
| 10A | 2008 | 1080 | 1,86 | 1,63–2,12 | |
| 11A | 4427 | 2535 | 1,75 | 1,52–2,01 | |
| 12F | 2539 | 1717 | 1,48 | 1,27–1,72 | |
| 15B | 2398 | 769 | 3,12 | 2,62–3,71 | |
| 22F | 3666 | 1846 | 1,99 | 1,70–2,32 | |
| 33F | 5126 | 3721 | 1,38 | 1,21–1,57 | |
Lyhenteet: LLOQ = alempi määritysraja; N = osallistujien lukumäärä; OPA = opsonofagosyyttinen aktiivisuus; PPSV23 = pneumokokkipolysakkaridirokote (23-valenttinen). a. Tutkimus 1007 tehtiin Yhdysvalloissa ja Ruotsissa. b. Serotyypin vertailukelpoisuus (non‑inferiority) tavoitettiin, jos geometristen keskiarvotitterien (Prevenar 20 -rokotteen ja vertailurokotteen välinen suhde) kaksisuuntaisen 95 %:n luottamusvälin alaraja oli yli 0,5 (vertailukelpoisuuden kaksinkertainen kriteeri). c. Analyysissa määrityksen alarajaksi (LLOQ) asetettiin 0,5 × LLOQ. d. Arvioitavissa oleva immunogeenisuutta koskeva potilasjoukko. e. Geometriset keskititterit ja geometristen keskititterien suhteet sekä niihin liittyvät kaksisuuntaiset luottamusvälit perustuivat OPA-titterien log-muunnokseen regressiomallilla; regressiomalli huomioi rokoteryhmät, sukupuolen, tupakoinnin, iän vuosina rokotusajankohtana sekä lähtötilanteen OPA-titterien log-muunnoksen. | |||||
Immunogeenisuus 18–59-vuotiailla
Tutkimuksessa 1007 iältään 50–59-vuotiaat osallistujat ja 18–49-vuotiaat osallistujat satunnaistettiin (suhteessa 3:1) saamaan yhden Prevenar 20 - tai Prevenar 13 ‑rokotuksen. Serotyyppispesifiset opsonofagosyyttisen aktiivisuuden (OPA) geometriset keskiarvotitterit mitattiin ennen rokotusta ja kuukausi rokotuksen jälkeen. Nuoremmilla osallistujilla havaittiin kummallekin rokotteelle suuremmat immuunivasteet kuin iäkkäämmillä osallistujilla. Käyttöaiheen tueksi vertailukelpoisuusanalyysi (non-inferiority) tehtiin serotyypeittäin siten, että Prevenar 20 -rokotetta verrattiin nuoremman ikäryhmän ja 60–64-vuotiaiden osallistujien välillä iältään 18–49-vuotiaille ja 50–59-vuotiaille aikuisille. Vertailukelpoisuus todettiin, jos kunkin 20 serotyypin titterien geometristen keskiarvojen kaksisuuntaisen 95 %:n luottamusvälin alaraja (Prevenar 20 18–49-vuotiailla / 60–64-vuotiailla ja 50–59-vuotiailla / 60–64-vuotiailla) oli > 0,5. Prevenar 20 sai aikaan immuunivasteet kaikkia rokotteen 20 serotyyppiä vastaan kummassakin nuoremmassa ikäryhmässä, ja nämä vasteet olivat vertailukelpoiset (non-inferior) 60–64-vuotiailla kuukausi rokotuksen jälkeen todettuihin vasteisiin nähden (taulukko 6).
Huolimatta siitä, että deskriptiivistä post hoc ‑analyysiä ei ollut suunniteltu immunogeenisuutta koskevien arvioiden aktiiviseksi vertailukohdaksi, se osoitti opsonofagosyyttisen aktiivisuuden geometristen keskiarvotitterien olevan 18–59-vuotiailla osallistujilla yleisesti numeerisesti pienemmät kuin Prevenar 13 ‑rokotteella 1 kuukausi Prevenar 20 -rokotteen annon jälkeen (yhteiset serotyypit). Näiden havaintojen kliinistä merkitystä ei kuitenkaan tiedetä.
Kuten edellä on mainittu, tähän tutkimukseen otettiin mukaan henkilöitä, joilla oli riskitekijöitä. Kaikissa tutkituissa ikäryhmissä osallistujilla, joilla oli riskitekijöitä, havaittiin yleensä numeerisesti heikompi immuunivaste verrattuna osallistujiin, joilla ei ollut riskitekijöitä. Tämän havainnon kliinistä merkitystä ei tiedetä.
| Taulukko 6.18–49-vuotiaiden tai 50–59-vuotiaiden osallistujien OPA-titterien geometristen keskiarvojen (GMT) vertailu kuukausi Prevenar 20 -rokotuksen jälkeen 60–64-vuotiaisiin nähden (tutkimus 1007)a,b,c,d | ||||||
18–49-vuotiaat (N = 251–317) | 60–64-vuotiaat (N = 765–941) | 18–49-vuotiaat verrattuna 60–64-vuotiaisiin | 50–59-vuotiaat (N = 266–320) | 60–64-vuotiaat (N = 765–941) | 50–59-vuotiaat verrattuna 60–64-vuotiaisiin | |
| GMTe | GMTe | GMT suhdee (95 %:n luottamusväli)e | GMTe | GMTe | GMT suhdee (95 %:n luottamusväli)e | |
| Serotyyppi | ||||||
| 1 | 163 | 132 | 1,23 (1,01–1,50) | 136 | 132 | 1,03 (0,84–1,26) |
| 3 | 42 | 42 | 1,00 (0,87–1,16) | 43 | 41 | 1,06 (0,92–1,22) |
| 4 | 1967 | 594 | 3,31 (2,65–4,13) | 633 | 578 | 1,10 (0,87–1,38) |
| 5 | 108 | 97 | 1,11 (0,91–1,36) | 85 | 97 | 0,88 (0,72–1,07) |
| 6A | 3931 | 1023 | 3,84 (3,06–4,83) | 1204 | 997 | 1,21 (0,95–1,53) |
| 6B | 4260 | 1250 | 3,41 (2,73–4,26) | 1503 | 1199 | 1,25 (1,00–1,56) |
| 7F | 1873 | 1187 | 1,58 (1,30–1,91) | 1047 | 1173 | 0,89 (0,74–1,07) |
| 9V | 6041 | 1727 | 3,50 (2,83–4,33) | 1726 | 1688 | 1,02 (0,83–1,26) |
| 14 | 1848 | 773 | 2,39 (1,93–2,96) | 926 | 742 | 1,25 (1,01–1,54) |
| 18C | 4460 | 1395 | 3,20 (2,53–4,04) | 1805 | 1355 | 1,33 (1,06–1,68) |
| 19A | 1415 | 611 | 2,31 (1,91–2,81) | 618 | 600 | 1,03 (0,85–1,25) |
| 19F | 655 | 301 | 2,17 (1,76–2,68) | 287 | 290 | 0,99 (0,80–1,22) |
| 23F | 1559 | 325 | 4,80 (3,65–6,32) | 549 | 328 | 1,68 (1,27–2,22) |
| Lisäserotyypit | ||||||
| 8 | 867 | 508 | 1,71 (1,38–2,12) | 487 | 502 | 0,97 (0,78–1,20) |
| 10A | 4157 | 2570 | 1,62 (1,31–2,00) | 2520 | 2437 | 1,03 (0,84–1,28) |
| 11A | 7169 | 5420 | 1,32 (1,04–1,68) | 6417 | 5249 | 1,22 (0,96–1,56) |
| 12F | 5875 | 3075 | 1,91 (1,51–2,41) | 3445 | 3105 | 1,11 (0,88–1,39) |
| 15B | 4601 | 3019 | 1,52 (1,13–2,05) | 3356 | 2874 | 1,17 (0,88–1,56) |
| 22F | 7568 | 4482 | 1,69 (1,30–2,20) | 3808 | 4228 | 0,90 (0,69–1,17) |
| 33F | 7977 | 5693 | 1,40 (1,10–1,79) | 5571 | 5445 | 1,02 (0,81–1,30) |
Lyhenteet: LLOQ = alempi määritysraja; N = osallistujien lukumäärä; OPA = opsonofagosyyttinen aktiivisuus; PPSV23 = pneumokokkipolysakkaridirokote (23-valenttinen). a. Tutkimus 1007 tehtiin Yhdysvalloissa ja Ruotsissa. b. Serotyypin vertailukelpoisuus (non‑inferiority) tavoitettiin, jos geometristen keskititterien suhteen (nuoremman ikäryhmän ja 60–64-vuotiaiden ikäryhmän suhde) kaksisuuntaisen 95 %:n luottamusvälin alaraja oli yli 0,5 (vertailukelpoisuuden kaksinkertainen kriteeri). c. Analyysissa määrityksen alarajaksi (LLOQ) asetettiin 0,5 × LLOQ. d. Arvioitavissa oleva immunogeenisuutta koskeva potilasjoukko. e. Geometriset keskiarvotitterit, geometristen keskiarvotitterien suhteet sekä niiden kaksisuuntaiset luottamusvälit perustuivat OPA-titterien log-muunnokseen regressiomallilla; regressiomalli huomioi ikäryhmät, sukupuolen, tupakoinnin sekä lähtötilanteen OPA-titterien log-muunnoksen. Vertailut 18–49-vuotiaiden ja 60–64-vuotiaiden osallistujien välillä sekä 50–59-vuotiaiden ja 60–64-vuotiaiden osallistujien välillä perustuivat erillisiin regressiomalleihin. | ||||||
Prevenar 20 -rokotteen immunogeenisuus pneumokokkirokotteen aiemmin saaneilla aikuisilla
Faasin 3 satunnaistettu, avoin kliininen tutkimus (tutkimus 1006) kuvasi Prevenar 20 -rokotteella aikaansaatuja immuunivasteita 65 vuotta täyttäneillä osallistujilla, jotka oli rokotettu aiemmin PPSV23-rokotteella, Prevenar 13 ‑rokotteella tai Prevenar 13 ‑rokotteella ja sen jälkeen PPSV23-rokotteella. Tutkimukseen osallistujat, jotka olivat aiemmin saaneet Prevenar 13 ‑rokotteen (rokotettu vain Prevenar 13:lla tai sen jälkeen PPSV23-rokotteella) otettiin tutkimukseen mukaan yhdysvaltalaisissa tutkimuskeskuksissa, kun taas pelkästään PPSV23-rokotteella aiemmin rokotettuja osallistujia otettiin tutkimuksen mukaan myös ruotsalaisissa tutkimuskeskuksissa (35,5 % tässä kategoriassa).
Prevenar 20 sai pneumokokkirokotuksen aiemmin saaneilla 65 vuotta täyttäneillä osallistujilla aikaan immuunivasteet kaikkia rokotteen 20 serotyyppiä vastaan (taulukko 7). Immuunivasteet olivat kummassakin ryhmässä heikommat osallistujilla, jotka olivat aiemmin saaneet PPSV23-rokotuksia.
| Taulukko 7.Pneumokokkien OPA-titterien geometriset keskiarvot (GMT) ennen Prevenar 20 -rokotusta ja kuukausi Prevenar 20 -rokotuksen jälkeen 65 vuotta täyttäneillä osallistujilla, jotka olivat aiemmin saaneet pneumokokkirokotuksen (tutkimus 1006)a,b,c,d | ||||||
| Vain aiempi PPSV23 | Vain aiempi Prevenar 13 | Aiempi Prevenar 13 ja PPSV23 | ||||
Ennen rokotusta (N = 208–247) | Rokotuksen jälkeen (N = 216–246) | Ennen rokotusta (N = 210–243) | Rokotuksen jälkeen (N = 201–243) | Ennen rokotusta (N = 106–121) | Rokotuksen jälkeen (N = 102–121) | |
GMT (95 %:n luottamusväli)e | GMT (95 %:n luottamusväli)e | GMT (95 %:n luottamusväli)e | GMT (95 %:n luottamusväli)e | GMT (95 %:n luottamusväli)e | GMT (95 %:n luottamusväli)e | |
| Serotyyppi | ||||||
| 1 | 24 (20–28) | 51 (42–62) | 34 (28–41) | 115 (96–138) | 42 (32–56) | 82 (61–110) |
| 3 | 13 (11–15) | 31 (27–36) | 15 (13–18) | 54 (47–63) | 20 (17–25) | 39 (32–48) |
| 4 | 29 (23–35) | 150 (118–190) | 67 (53–84) | 335 (274–410) | 73 (53–101) | 194 (143–262) |
| 5 | 27 (24–31) | 63 (53–75) | 38 (32–44) | 87 (73–104) | 47 (37–59) | 83 (65–108) |
| 6A | 57 (46–70) | 749 (577–972) | 125 (99–158) | 1081 (880–1327) | 161 (116–224) | 1085 (797–1478) |
| 6B | 107 (86–133) | 727 (574–922) | 174 (138–219) | 1159 (951–1414) | 259 (191–352) | 1033 (755–1415) |
| 7F | 156 (132–184) | 378 (316–452) | 210 (175–251) | 555 (467–661) | 206 (164–258) | 346 (277–432) |
| 9V | 203 (171–241) | 550 (454–667) | 339 (282–408) | 1085 (893–1318) | 352 (270–459) | 723 (558–938) |
| 14 | 212 (166–270) | 391 (315–486) | 282 (224–356) | 665 (554–798) | 336 (238–473) | 581 (434–777) |
| 18C | 173 (137–218) | 552 (445–684) | 219 (177–272) | 846 (693–1033) | 278 (209–369) | 621 (470–821) |
| 19A | 82 (66–100) | 239 (197–288) | 124 (100–153) | 365 (303–440) | 182 (141–235) | 341 (264–439) |
| 19F | 61 (52–71) | 159 (131–192) | 89 (74–107) | 242 (199–294) | 120 (94–154) | 218 (168–282) |
| 23F | 23 (18–28) | 152 (115–199) | 48 (37–62) | 450 (358–566) | 66 (46–94) | 293 (204–420) |
| Lisäserotyypit | ||||||
| 8 | 55 (45–67) | 212 (172–261) | 28 (24–33) | 603 (483–753) | 139 (99–195) | 294 (220–392) |
| 10A | 212 (166–269) | 1012 (807–1270) | 141 (113–177) | 2005 (1586–2536) | 400 (281–568) | 1580 (1176–2124) |
| 11A | 510 (396–656) | 1473 (1192–1820) | 269 (211–343) | 1908 (1541–2362) | 550 (386–785) | 1567 (1141–2151) |
| 12F | 147 (112–193) | 1054 (822–1353) | 53 (43–65) | 1763 (1372–2267) | 368 (236–573) | 1401 (1002–1960) |
| 15B | 140 (104–189) | 647 (491–853) | 74 (56–98) | 1480 (1093–2003) | 190 (124–291) | 1067 (721–1578) |
| 22F | 167 (122–230) | 1773 (1355–2320) | 60 (45–82) | 4157 (3244–5326) | 286 (180–456) | 2718 (1978–3733) |
| 33F | 1129 (936–1362) | 2026 (1684–2437) | 606 (507–723) | 3175 (2579–3908) | 1353 (1037–1765) | 2183 (1639–2908) |
Lyhenteet: LLOQ = alempi määritysraja; N = osallistujien lukumäärä; OPA = opsonofagosyyttinen aktiivisuus; PPSV23 = pneumokokkipolysakkaridirokote (23-valenttinen). a. Tutkimus 1006 tehtiin Yhdysvalloissa ja Ruotsissa. c. Analyysissa määrityksen alarajaksi (LLOQ) asetettiin 0,5 × LLOQ. C. Arvioitavissa oleva immunogeenisuutta koskeva potilasjoukko. d. Avoin Prevenar 20 -rokotus. e. Kaksisuuntaiset luottamusvälit perustuvat Studentin t-jakaumaan. | ||||||
Erityisryhmien immuunivasteet
Seuraavassa kuvattuja sairauksia sairastavilla henkilöillä on suurentunut riski sairastua pneumokokkitautiin.
Prevenar 20 -rokotteella ei ole tehty tutkimuksia sirppisoluanemiaa, HIV-infektiota sairastavilla ja hematopoieettisen kantasolusiirron saaneilla.
On olemassa kliinisistä tutkimuksista saatua kokemusta Prevenar 13 ‑rokotteen (pneumokokkikonjugaattirokote, joka sisältää kolmetoista samaa konjugoitua polysakkaridia kuin Prevenar 20) käytöstä lapsilla ja aikuisilla, joilla on tavanomaista suurempi pneumokokki-infektion riski, mukaan lukien immuunipuutteiset lapset ja aikuiset, joilla on HIV-infektio tai jotka ovat saaneet hematopoieettisen kantasolusiirron, sekä sirppisolutautia sairastavat lapset.
Kaikkien analysoitujen ikäryhmien osallistujilla, jotka olivat terveitä tai joilla oli stabiili krooninen sairaus, joka ei vaikuta immuniteettiin, immuunivasteet Prevenar 20 -rokotteelle olivat heikommat kuin Prevenar 13 ‑rokotteelle, vaikka ne olivatkin ennalta määritetyissä vertailukelpoisuuden (non-inferiority) marginaaleissa. Tämän havainnon kliinistä merkitystä ei tiedetä.
Sirppisolutauti
Avoimessa yhden hoitohaaran tutkimuksessa annettiin kaksi Prevenar 13 ‑annosta 6 kuukauden välein 158 lapselle ja nuorelle, jotka olivat iältään 6 – < 18-vuotiaita, joilla oli sirppisolutauti ja jotka olivat aiemmin saaneet rokotuksen yhdellä tai useammalla annoksella 23-valenttista pneumokokkipolysakkaridirokotetta vähintään 6 kuukautta ennen tutkimukseen mukaan tuloa. Prevenar 13 ‑rokote sai ensimmäisen rokotuksen jälkeen aikaan sekä IgG-pitoisuuden geometrisenä keskiarvona että opsonofagosyyttisen aktiivisuuden geometrisinä keskiarvotittereinä mitatut vasta-ainepitoisuudet, jotka olivat tilastollisesti merkitsevästi suuremmat kuin rokotusta edeltävät pitoisuudet. Toisen annoksen jälkeen immuunivasteet olivat verrannolliset ensimmäisen annoksen jälkeisten immuunivasteiden kanssa. Vuosi toisen annoksen jälkeen sekä IgG-pitoisuuksien geometrisenä keskiarvona että opsonofagosyyttisen aktiivisuuden geometrisinä keskiarvotittereinä mitatut vasta-ainepitoisuudet olivat suuremmat kuin ennen ensimmäistä Prevenar 13 ‑annosta, lukuun ottamatta serotyyppien 3 ja 5 IgG-pitoisuuksien geometrisiä keskiarvoja, jotka olivat numeerisesti samankaltaiset.
HIV-infektio
Lapset ja aikuiset, joita ei ollut aiemmin rokotettu pneumokokkirokotteella
Tutkimuksessa 6115A1-3002 (B1851021) 151 iältään 6 – < 18-vuotiasta ja 152 18 vuotta täyttänyttä osallistujaa, joilla oli HIV-infektio (CD4-määrät ≥ 200 solua/µl, virustaakka < 50 000 kopiota/ml eikä aktiivisia AIDSiin liittyviä sairauksia), joita ei ollut aiemmin rokotettu pneumokokkirokotteella, otettiin tutkimukseen mukaan. He saivat 3 annosta Prevenar 13 ‑rokotetta. Yleisten suositusten mukaisesti heille annettiin sen jälkeen yksi annos PPSV23-rokotetta. Rokotteet annettiin kuukauden välein. Immuunivasteet määriteltiin 128–133 iältään 6 – < 18-vuotiaalta arviointiin sopivalta koehenkilöltä ja 131–137 18 vuotta täyttäneeltä arviointiin sopivalta koehenkilöltä noin kuukausi jokaisen rokoteannoksen jälkeen. Ensimmäinen annos Prevenar 13 ‑rokotetta sai aikaan tilastollisesti merkitsevästi suuremmat immunoglobuliini G (IgG) ‑luokan vasta-ainevasteet rokotusta edeltäviin pitoisuuksiin verrattuina sekä pitoisuuksina (pitoisuuden geometrinen keskiarvo, GMC) että OPA GMT ‑arvoina mitattuna. Toisen ja kolmannen Prevenar 13 ‑annoksen jälkeen immuunivasteet olivat samanlaisia tai suurempia ensimmäisen annoksen jälkeiseen vasteeseen verrattuina.
Aikuiset, jotka oli aiemmin rokotettu PPSV23-rokotteella
Tutkimuksessa 6115A1-3017 (B1851028) immuunivasteen arviointi tehtiin 329 osallistujalle, joilla oli HIV-infektio, jotka olivat 18 vuotta täyttäneitä (CD4+-T‑solumäärä ≥ 200 solua/µl ja virustaakka < 50 000 kopiota/ml) ja jotka olivat aiemmin saaneet PPSV23-rokotteen vähintään 6 kuukautta ennen tutkimukseen osallistumista. Osallistujat saivat 3 annosta Prevenar 13 ‑rokotetta: ensimmäinen annos annettiin tutkimuksen alussa, toinen 6 kk:n ja kolmas 12 kk:n kuluttua ensimmäisestä Prevenar 13 ‑annoksesta. Ensimmäinen annos Prevenar 13 ‑rokotetta sai aikaan tilastollisesti merkitsevästi suuremmat IgG‑luokan vasta-ainevasteet rokotusta edeltäviin pitoisuuksiin verrattuina pitoisuuksina (GMC) ja OPA GMT ‑arvoina mitattuna. Toisen ja kolmannen Prevenar 13 ‑annoksen jälkeen immuunivasteet olivat verrattavissa ensimmäisen annoksen jälkeiseen vasteeseen tai ne olivat sitä suurempia. Kaksi tai useampia PPSV23-annoksia aiemmin saaneiden osallistujien immuunivasteet olivat samankaltaiset kuin osallistujilla, jotka olivat aiemmin saaneet kerta-annoksen.
Hematopoieettinen kantasolusiirto
Tutkimuksessa 6115A1-3003 (B1851022) oli 61 iältään 2 – < 18-vuotiasta osallistujaa ja 190 iältään ≥ 18 vuotta täyttänyttä osallistujaa, joille oli tehty allogeeninen hematopoieettinen kantasolusiirto, ja he saivat 3 annosta Prevenar 13 ‑rokotetta annosvälin ollessa vähintään 1 kuukausi. Ensimmäinen annos annettiin 3–6 kuukauden kuluttua hematopoieettisesta kantasolusiirrosta. Neljäs Prevenar 13 ‑(tehoste)annos annettiin 6 kuukauden kuluttua kolmannesta annoksesta. Yleisten suositusten mukaisesti heille annettiin kuukauden kuluttua neljännestä Prevenar 13 ‑annoksesta yksi annos PPSV23-rokotetta. Immuunivasteet mitattuina IgG GMC ‑pitoisuuksina määriteltiin 41–52 iältään 2 – < 18-vuotiaalta arviointiin sopivalta osallistujalta ja 127–159 arviointiin sopivalta ≥ 18 vuotta täyttäneeltä osallistujalta noin kuukausi rokoteannoksen jälkeen. Jokainen Prevenar 13 ‑annos sai aikaan suurentuneen vasta-ainevasteen. Neljännen Prevenar 13 ‑annoksen jälkeen immuunivasteet olivat tilastollisesti merkitsevästi suuremmat kaikkien serotyyppien kohdalla kolmannen annoksen jälkeiseen vasteeseen verrattuina, lukuun ottamatta serotyyppiä 3 iältään 2 – < 18-vuotiaiden ikäryhmässä. Iältään 2 – < 18-vuotiailla osallistujilla oli yleensä kaikkiaan suuremmat serotyyppispesifiset immuunivasteet verrattuna ≥ 18 vuotta täyttäneisiin.
Tämä tutkimus osoitti, että neljä Prevenar 13 ‑annosta indusoi samankaltaiset IgG-pitoisuudet kuin kerta-annos samaan ikäryhmään kuuluvien terveiden osallistujien seerumissa.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Prevenar 20 -valmisteen käytöstä Streptococcus pneumoniaen aiheuttaman taudin ehkäisyssä yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Invasiivinen pneumokokkitauti
Prevenar 13 ‑rokotteen tehoa rokotteen sisältämien serotyyppien aiheuttamaa invasiivista pneumokokkitautia vastaan arvioitiin SpIDnet-tutkimuksessa, joka oli useassa maassa toteutettu invasiivisen pneumokokkitaudin tehostettua seurantaa koskenut hanke Euroopassa. Prevenar 13 ‑rokotteen käytöstä yli 6 vuoden ajan (2012–2018) kymmenessä tutkimuskeskuksessa seitsemässä Euroopan maassa saatujen tietojen perusteella < 5-vuotiailla lapsilla todettu teho rokotteen sisältämien serotyyppien aiheuttamaa invasiivista pneumokokkitautia vastaan oli ≥ 1 Prevenar 13 ‑annoksen saaneilla 84,2 % (95 %:n luottamusväli 79,0–88,1) ja täyden rokotusohjelman saaneilla 88,7 % (95 %:n luottamusväli 81,7–92,7).
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Meripihkahappo
Polysorbaatti 80
Injektionesteisiin käytettävä vesi
Ks. adjuvantit kohdasta Vaikuttavat aineet ja niiden määrät.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä rokotetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C). Esitäytetyt ruiskut pitää säilyttää jääkaapissa vaakatasossa suspension uudelleensekoittamiseen kuluvan ajan minimoimiseksi.
Ei saa jäätyä. Hävitä rokote, jos se on jäätynyt.
Mikrobiologiselta kannalta katsottuna rokote tulee käyttää heti jääkaapista ottamisen jälkeen.
Säilyvyystiedot osoittavat rokotteen säilyvyydeksi 96 tuntia 8–25 °C:n lämpötilassa säilytettynä tai 72 tuntia 0–2 °C:n lämpötilassa säilytettynä. Prevenar 20 on näiden ajanjaksojen päättyessä käytettävä tai hävitettävä. Nämä tiedot on tarkoitettu terveydenhuollon ammattilaisille ohjeellisiksi vain tilapäisten lämpötilapoikkeamien yhteydessä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
APEXXNAR injektioneste, suspensio, esitäytetty ruisku
1 kpl (0,5 ml) (96,50 €)
PF-selosteen tieto
0,5 ml injektionestettä, suspensiota, esitäytetyssä ruiskussa (tyypin I lasia), jonka kärjessä on korkki (synteettistä isopreeni-bromobutyylikumiseosta) ja männän tulppa (klooributyylikumia).
Pakkauskoot 1, 10 ja 50 esitäytettyä ruiskua, joissa on neula tai ei ole neulaa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Rokote on homogeeninen valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Suspension sisältävässä esitäytetyssä ruiskussa voidaan säilytyksen aikana havaita valkoista sakkaa ja pinnalla kirkas liuos. Esitäytetyt ruiskut pitää säilyttää vaakatasossa suspension uudelleensekoittamiseen kuluvan ajan minimoimiseksi.
Käyttöön valmistelu
Vaihe 1. Rokotteen uudelleensekoittaminen suspensioksi Pidä esitäytettyä ruiskua peukalon ja etusormen välissä vaakatasossa ja ravista voimakkaasti, kunnes ruiskun sisältö on homogeeninen valkoinen suspensio. Älä käytä rokotetta, jos se ei sekoitu suspensioksi. |
|
Vaihe 2. Silmämääräinen tarkistus Tarkista rokote silmämääräisesti ennen antoa, ettei siinä ole suuria hiukkasia eikä värimuutosta. Älä käytä, jos havaitset suuria hiukkasia tai värimuutoksen. Jos rokote ei ole homogeeninen valkoinen suspensio, toista vaiheet 1 ja 2. |
|
Vaihe 3. Irrota ruiskun korkki Irrota ruiskun korkki Luer lock ‑liittimestä kiertämällä korkkia hitaasti vastapäivään. Pidä samalla kiinni Luer lock ‑liittimestä. Huom.: Ruiskun korkkia irrotettaessa on varottava tarkoin painamasta ulos vedettynä olevaa männän vartta. |
|
Vaihe 4. Kiinnitä steriili neula Kiinnitä esitäytettyyn ruiskuun lihakseen antoon soveltuva neula pitämällä kiinni Luer lock ‑liittimestä ja kiertämällä neulaa myötäpäivään. | |
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
APEXXNAR injektioneste, suspensio, esitäytetty ruisku
1 kpl
- Ei korvausta.
ATC-koodi
J07AL02
Valmisteyhteenvedon muuttamispäivämäärä
11.03.2024
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com